基因表达系统的制作方法
本发明涉及用于昆虫的条件致死性表达系统、它们的用途、以及采用以其转化的昆虫进行种群控制的方法。
背景技术:
在野外控制昆虫种群的重要方法涉及辐射不育昆虫技术(sit),其用作环境友好的昆虫控制方法,包括大量饲养蝇并通过辐射让雄性不育。但是,与其它的控制方法相比时,sit并非在所有区域都是有效或者经济上可行的,并且该辐射sit计划的成功依赖于经辐射的蝇与雄性的野外种群具有类似的行为模式。这种sit方法的更多限制为在蛹期分离雄性和雌性。所希望的是仅释放雄性昆虫,因为释放雌性昆虫可能在释放区域导致更大的作物损失。尤其是,该分离涉及劳动密集的和耗时的昆虫手工分选。
备选的方法曾是引入温度敏感致死(tsl)定性品系,借此地中海实蝇中自发突变的染色体易位使得能进行温度敏感的分离(caceres2002);这种经转化的种系在除去雌性方面是99%有效(mumford2012)。但是,已证实tsl品系高度不稳定,并由此在大量饲养的设施中需要费力的和昂贵的滤器聚居地设置(expensivefiltercolonyset-up)(caceres2002)。
另外的控制方法是使用引入昆虫基因组中的可阻遏、显性、致死基因系统。对这种方法的进一步改进曾是使用雌性特异的可阻遏、显性、致死基因系统。这些系统提供了不存在阻遏物时致死基因产物的雌性特异性表达。开发了两组分系统,其中反式激活因子基因产物通过激活致死基因的启动子用作致死基因的反式激活因子。通过提供阻止反式激活因子基因产物对致死基因的启动子的作用的阻遏物,该系统是可阻遏的。
在这种雌性特异的、可阻遏、显性、致死基因系统的后来发展中,提供待表达的单个基因,该基因产物既为该基因的反式激活因子,也为致死基因产物,由此产生了导致转基因昆虫死亡的正反馈回路。
gong等公开了带有四环素反式激活因子(tta)的地中海实蝇品系,其在杂合后代的早期发育阶段导致致死性,但对亲本转基因昆虫的存活几乎无影响。在该系统中,tta即是反式激活因子,也是致死的,由于高水平的tta被认为是对细胞有害的。实际上,tta经修饰以优化在昆虫中的表达,这种变体称为ttav。但是,该文献公开了一些昆虫逃脱了ttav的致死效应,并且对该致死效应分子的生化抗性的可能性可能为该系统的缺点。其还公开了发育中的更早致死性是优选的。
fu等公开了采用tta和cctra的地中海实蝇(c.capitata)中雌性特异的自杀基因系统。插入tta的cctra导致tta转录本在雄性剪接变体中的中断,但在雌性剪接变体中不中断(图1)。此前,曾缺乏对能够在早期发育阶段赋予雌性特异表达的基因表达系统的表征。fu等的该系统提供了这种在早期发育阶段的雌性特异表达。在gong等的正反馈回路中该cctra雌性特异内含子插入该ttav编码区,这提供了雌性特异的致死性。
但是,fu等获得的数据表明,致死性发生在发育的晚幼虫期/早蛹期,并且大部分的昆虫种系不是100%外显的。fu等还公开了该系统的潜在困难为响应容量的饱和。调节可变剪接的因子被认为是相对短缺的,所以如果产生了太多的前体mrna,则可变剪接途径可能饱和。为了雌性特异的正反馈系统为致死性的,必须产生大量的ttav,所以需要高水平的f1型(雌性类型的)剪接。另一问题是低效率,由于相当比例的前体mrna在雌性中以雄性形式(m1和m2)加工;这些不产生功能性蛋白,所以相对于非性别特异构建体趋于减弱致死性。
因此,希望提供改进的雌性特异的、可阻遏、显性、致死基因系统,比之前看到的更早的发育中致死效应发作,优选具有改进的外显率,并优选具有减弱的生化抗性。另外期望的改进为一旦该系统插入宿主基因组后增加的稳定性。
技术实现要素:
令人惊讶的是,现已发现通过提供具有两个雌性特异的、可阻遏、显性、致死表达系统,改进了这种转基因系统的外显率。提供两个这样的表达系统令人惊讶地除了降低出现对致死产物的生化抗性的风险,还具有诱导更早致死性发作的更多优点。
因此,在第一方面,提供了包括第一和第二基因表达系统的多核苷酸序列,其中:
i)所述第一基因表达系统包括组分:可操作地连接至第一启动子的第一显性致死基因、编码第一转录激活因子的基因、以及第一剪接控制序列,
ii)所述第二基因表达系统包括组分:可操作地连接至第二启动子的第二显性致死基因、编码第二转录激活因子的基因、以及第二剪接控制序列,
其中
所述转录激活因子中的每一个能够激活至少一个所述启动子,条件是当两个所述转录因子表达时两个所述启动子都被激活,
所述第一和第二剪接控制序列中的每一个通过可变剪接分别介导所述第一和第二显性致死基因的雌性特异表达,
所述第一和第二转录激活因子中每一个的反式激活活性分别被第一和第二外源控制因子阻遏,其中所述第一外源控制因子与所述第二外源控制因子相同或不同,以及
所述第一基因表达系统中的所述组分的每一个与所述第二基因表达系统的所述组分相同或不同。
本发明的表达系统能够在昆虫中表达,优选至少在双翅类、鞘翅类和/或鳞翅类中表达。
本发明的表达系统优选每个包括经选择的用于在昆虫中表达的启动子,优选至少在双翅类、鞘翅类和/或鳞翅类中表达。该启动子可以为昆虫启动子,或者在目标昆虫的至少一个组织中可运转的启动子。
两个或更多个条件性、显性、致死基因表达系统已显示出在昆虫中提供高水平的外显率。与单个昆虫条件性、显性、致死基因表达系统相比,通常在发育的较早期诱导致死性,并且降低了生化抗性风险。本发明可用于控制昆虫种群。
两个系统中的每个包括待表达的显性致死基因和激活该致死基因的表达的转录激活因子。该转录激活因子的作用可被阻遏,并且当以足够量表达时该显性致死基因的产物对昆虫具有致死效应。每个表达系统也包括剪接控制序列,其提供该致死效应的雌性特异性。两个雌性特异的、可阻遏、显性、致死表达系统的存在通过增加所表达的致死产物的量改进了系统的外显率,由此增加了有效致死性的概率。由于致死产物的积累,两个表达系统的存在也在发育期间诱导了更早的致死性发作,并且因为出现对两个表达系统的抗性的概率低,降低了抗性机制风险。
用在本文时,术语“外显率”指带有特定基因变体的个体也表达与该变体相关的表型特征的比例。因此,与本发明相关的“外显率”指经转化的生物体表达该致死表型的比例。
用在本文时,术语“构建体”指用于插入宿主生物体的人工构建的dna节段,用于在遗传上修饰该宿主生物体。构建体的至少一部分插入宿主生物体的基因组,并改变该宿主生物体的基因型。该构建体可以形成为载体的一部分,或者为载体。
用在本文时,术语“转基因”指待插入宿主生物体基因组以改变宿主生物体表型的包括第一和第二基因表达系统的多核苷酸序列。
用在本文时,术语“基因表达系统”指待表达基因连同所述待表达基因的表达所需的任何基因和dna序列。
用在本文时,术语“剪接控制序列”指与基因关联的dna序列,其中该dna序列和剪接体一起介导所述基因的rna产物的可变剪接。优选地,该剪接控制序列和剪接体一起介导该关联基因的rna转录本的剪接,以产生编码功能性蛋白的mrna,并介导所述rna转录本的可变剪接,以产生至少一种编码非功能性蛋白的可变mrna。
用在本文时,术语“反式激活活性”指转录激活因子的活性,其导致增加的基因表达速率。该转录激活因子可以结合可操作地连接至所述基因的启动子,由此激活该启动子,于是增强所述基因的表达。作为选择,该转录激活因子可以结合与所述启动子关联的增强子,由此通过所述增强子提升所述启动子的活性。
用在本文时,术语“致死基因”指其表达产物在足够量时对在其中表达该致死基因的生物体具有致死效应的基因。
用在本文时,术语“致死效应”指有害或致不育效应,例如能够杀死该生物体自身或其后代、或者能够减弱或破坏其某些组织的效应,其中生殖组织是特别优选地,以使得该生物体或其后代是不育的。因此,诸如毒性的一些致死效应将在相对于它们寿命的短时间框架内杀死生物体或组织,而其它的可以简单地减弱该生物体发挥功能的能力,例如生殖。
用在本文时,术语“ttav基因变体”指编码功能性tta蛋白但是其在核苷酸序列方面有差异的多核苷酸。
用在本文时,术语“启动子”指通常直接在编码序列上游的dna序列,为基因的基础和/或受调节转录所需。具体地,启动子具有让转录起始的足够信息,通常具有转录开始的起始位点和用于聚合酶复合物的结合位点。
用在本文时,术语“最小启动子”指上文定义的启动子,通常具有转录开始的起始位点和用于聚合酶复合物的结合位点,还通常具有足够的额外序列以允许这二者有效。例如,诸如决定组织特异性的其它序列信息一般是缺乏的。
用在本文时,术语“外源控制因子”指不在宿主生物体内自然存在并且不存在于宿主生物体的自然栖息地的物质,或者不存在于宿主生物体自然栖息地的环境条件。该外源控制因子的存在由经转化的宿主生物体的操作者来控制,以便控制基因表达系统的表达。
用在本文时,术语“teto元件”指串联排列的一个或多个teto操作单元。
用在本文时,术语例如“tetox7”指由所指出数量的teto操作单元组成的teto元件。因此,提到“tetox7”表示由7个teto操作单元组成的teto元件。类似地,提到“tetox14”表示由14个teto操作单元组成的teto元件,依此类推。
用在本文时,术语“tra内含子”指剪接控制序列,其中rna转录本的可变剪接由例如单独或联合tra2(即当复合时)与其结合的tra蛋白调节。
用在本文时,术语“最小重复序列”指观察到的为给定转座酶的活性所需的高度保守的重复序列。
当提及具体的核苷酸或蛋白序列,应理解这包括提及具有与其基本上等同的生物学活性的其任何突变体或变体。优选地,该突变体或变体与参照序列具有至少85%、优选至少90%、优选至少95%、优选至少99%、优选至少99.9%以及最优选至少99.99%的序列一致性。
附图简要说明
图1(a)和(b)为雌性特异的致死性特征的示意图。在四环素可阻遏的基因系统的tta组分中插入cctra雌性特异内含子,使得仅雌性产生编码功能性tta的mrna。(a)方框表示存在于雄性转录本中的含有终止密码子的外显子,产生截短的tra。(b)示意图下面的箭头表示用于rt-pcr分析的引物退火位置。(c)为凝胶照片,显示对用于性别特异表达的tra剪接的pcr分析结果。cctra内含子仅在雌性中正确剪接以产生ttav的f1转录本。
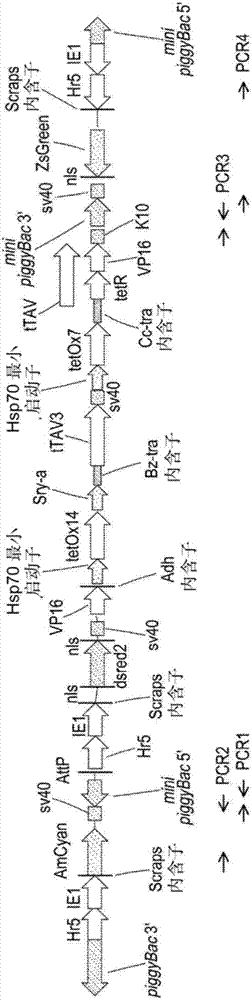
图2为本发明的基因构建体的一个实施方案的示意图。
图3(a)、(b)、(c)和(d)为来自4个pcr反应的凝胶运行图片,这些反应横跨构建体区域,其中在ox3864a/ox3647q品系与品系ox3133(转座酶来源,如dafa’alla等(2006)所描述的)杂交后应通过盒式交换而已除去了piggybac序列。
图4(a)为显示经转化的地中海实蝇在“压力试验”即羽化后无食物或水条件下的存活率的图。成体雄性和雌性存活率数据是合并的(n=180)。(b)为显示充足食物和水的非压力条件下的存活率的图(n=180)。(c)为显示单个的雌性终生产卵力的图。(d)为显示雌性终生卵产量的图,显示30只雌性的3个笼子在3周期间的平均产量。(e)为显示插图(c)中的雌性所产的卵的孵化率的图。(f)为显示经转化的品系ox3864a(右)和ox3647q(中)中的雄性的dsred2荧光与野生型雄性对比的照片。(g)为与(f)中相同的成体雄性在白光下的照片。
图5为来自特异鉴定ox3864a的基于pcr分析的凝胶的照片。该凝胶显示用经ox3864特异的引物tg1和tg2以及adh引物扩增的x3864纯合的、ox3864杂合的、野生型个体以及水阴性对照。标记物(m)=smart梯度(eurogentec)。
图6为来自用于检测ox3864a蝇样品中质粒骨架的基于pcr分析的凝胶的照片。泳道1至4:ox3864a纯合蝇样品;泳道5:阳性对照—其中插入了质粒骨架的经转化的昆虫;泳道6:wt-地中海实蝇野生型gdna。
图7为来自用于检测ox3864a蝇中沉默插入的基于pcr分析的凝胶的照片。阳性对照:9只野生型蛹掺杂有1只杂合蛹;阴性对照:水。(a)显示了采用引物td539)diag3k10(caactcttctcgttttgaagtcagc;seqidno:22)和852)ttavdiagf(cgtcaggcaatcgagctgttc;seqidno:23)对转基因序列的检测(772bp)。(b)显示了采用引物1351)med3864altf(ggataccgaattcatagcggcg;seqidno:24)和1366)med3864fldiagr2(ggtgagaagcatccattccaggc;seqidno:25)对野生型序列的检测(852/952bp,基于之前观察到的wt多态性)。标记物(m):smart梯度(eurogentec)。
图8为通过引入ox3864a雄性改变地中海实蝇种群动态的图。(a)为显示处理和对照笼子中每个给定周的平均日产卵率的图。最下面的线表示平均每周日间温度(摄氏度),取自每天中午温度读数。(b)显示了来自处理和对照笼子的所计算的雌性数量。(c)显示了从产卵陷阱返回每个处理笼子的后代显示dsred2荧光表型的比例。
序列表简要说明
seqidno:1显示了昆虫基因表达系统的核苷酸序列。
seqidno:2显示了旁侧有地中海实蝇基因组dna的基因表达系统的核苷酸序列。
seqidno:3显示了旁侧有地中海实蝇基因组dna的基因表达系统的核苷酸序列。
seqidno:4显示了引物tg1-3864attpflr的核苷酸序列。
seqidno:5显示了引物tg1-attpf2的核苷酸序列。
seqidno:6显示了引物tg2-3864frtflf的核苷酸序列。
seqidno:7显示了引物tg2-frtnhef的核苷酸序列。
seqidno:8显示了引物ccadh2rtf的核苷酸序列。
seqidno:9显示了引物ccadh2rtf的核苷酸序列。
seqidno:10显示了引物cc3864frttaqf的核苷酸序列。
seqidno:11显示了引物cc3864frttaqr的核苷酸序列。
seqidno:12显示了cc3864frt探针的核苷酸序列。
seqidno:13显示了引物pb5out的核苷酸序列。
seqidno:14显示了引物pb3out的核苷酸序列。
seqidno:15显示了引物diag-5pbmin的核苷酸序列。
seqidno:15显示了引物diag-pb5的核苷酸序列。
seqidno:17显示了引物amcydiagf的核苷酸序列。
seqidno:18显示了引物dlag6-pb3的核苷酸序列。
seqidno:19显示了引物dlag-k10-1的核苷酸序列。
seqidno:20显示了引物diag7-pb3的核苷酸序列。
seqidno:21显示了引物diag2-hr5的核苷酸序列。
seqidno:22显示了引物diag3k10的核苷酸序列。
seqidno:23显示了引物ttavdiagf的核苷酸序列。
seqidno:24显示了引物med3864altf的核苷酸序列。
seqidno:25显示了引物med3864fldiagr2的核苷酸序列。
seqidno:26显示了ttav基因的核苷酸序列。
seqidno:27显示了ttav2基因的核苷酸序列。
seqidno:28显示了ttav3基因的核苷酸序列。
seqidno:29显示了ttav蛋白的多肽序列。
seqidno:30显示了包括5’itr的5’piggybac末端的核苷酸序列。
seqidno:31显示了包括3’itr的3’piggybac末端的核苷酸序列。
seqidno:32显示了包括3’itr的3’piggybac末端的核苷酸序列。
发明详细说明
本发明使得能选择性控制第一和/或第二显性致死基因的表达,从而提供对致死表型的表达的控制。因此应当理解,每个致死基因编码功能性蛋白。优选的是,每个基因表达系统如wo2005/012534中所描述的。
每个致死基因都具有有条件的致死效应。适合的条件的实例包括温度,以使得致死在一个温度下表达,而在另一温度下不表达或表达程度较低。适合的条件的另一实例为一物质的存在或不存在,由此致死在存在或不存在该物质时表达,但不是都表达。优选致死基因的效应是有条件的,并且在需要一物质(该物质不存在于生物体的天然环境中)存在的许可条件下不表达,以使得该致死系统的致死效应在生物体的天然环境中发生。
每个致死基因系统都可以对特定的细胞或组织起作用,或者对整个生物体施加影响。也考虑非严格致死但施加实质性适合度代价的系统,例如导致失明、不能飞行(对于可正常飞行的生物体)、或者不育。也考虑干扰性别决定的系统,例如将生物体的全部或一部分从一种性别类型转变或趋于转变为另一性别类型。但是,优选的是每个致死基因的产物导致绝育,因为这使得该生物体能够在天然环境(“野外”)中与野生型生物体竞争,但不育生物体接着不能产生能存活的后代。以此方式,本发明在昆虫中获得了与诸如昆虫不育技术(sit)的技术类似的结果,而没有与sit相关的问题,例如成本、危害使用者、以及经辐射生物体的减弱的竞争力。
在一些实施方案中,至少一个致死基因的产物优选为凋亡诱导因子,例如在例如candéetal(journalofcellscience115,4727-4734(2002))中描述的aif蛋白或其同源物。aif同源物在哺乳动物和甚至无脊椎动物中有发现,包括昆虫、线虫、真菌和植物,表明aif基因在整个真核生物界是保守的。在其它实施方案中,至少一个致死基因的产物为hid(黑腹果蝇的头部退化缺陷基因的蛋白产物)、或reaper(rpr,果蝇的reaper基因的产物)、或它们的突变体。heinrich和scott(proc.natlacad.sciusa97,8229-8232(2000))描述了hid的用途。horn和wimmer(naturebiotechnology21,64-70(2003))描述了突变体衍生物hidala5的用途。本文描述了rpr的突变体衍生物rprkr的用途(还参见whiteetal1996,wingetal.,2001,以及olsonetal.,2003)。rpr和hid都是促凋亡蛋白,被认为结合iap1。iap1为充分保守的抗凋亡蛋白。因此预期hid和rpr横跨广泛的系统发生范围起作用(huangetal.,2002,vernooyetal.,2000),尽管它们自己的序列不是充分保守的。
在其它实施方案中,至少一个致死基因为nipp1dm,即哺乳动物nipp1的果蝇同源物(parkeretalbiochemicaljournal368,789-797(2002);bennettetal.,genetics164,235-245(2003))。nipp1dm为若以适合水平表达时具有致死效应的蛋白的另一实例,这为技术人员所理解。事实上,具有致死效应的蛋白的很多其它实例为本领域技术人员所知。
优选地,至少一个致死基因为tta或ttav基因变体。ttav为tta的类似物,其中tta的序列经修饰以增强与期望的昆虫种类的相容性。ttav的变体可能编码tta蛋白,由此ttav变体基因产物与tta基因产物具有相同的功能。因此,与tta核苷酸序列相比以及相互比较,ttav基因的变体包括经修饰的核苷酸序列,但编码具有相同功能的蛋白。因此,ttav基因变体可用于替换tta。实际上,在本发明的转基因中优选采用ttav基因变体。
可以使用致死基因的任何组合,并且在一些实施方案中,致死基因是相同,而在其它实施方案中,致死基因是不同的。致死基因的改善的外显率以及致死性的更早发作通过致死产物的积累来实现。
在优选的实施方案中,第一和第二致死基因中的每个独立地为tta或ttav基因变体。在一些实施方案中,第一和第二致死基因中的每个独立地为ttav(seqidno:26)、ttav2(seqidno:27)和ttav3(seqidno:28)之一。在其它实施方案中,第一和第二致死基因是相同的。在另外实施方案中,第一和第二致死基因的一个为ttav(seqidno:26),另一个基因为ttav3(seqidno:28)。但是,可以使用ttav变体的任何组合;因此,在一些实施方案中,第一和第二基因中的一个为ttav(seqidno:26),另一个为ttav2(seqidno:27),而在另外的实施方案中,第一和第二基因中的一个为ttav2(seqidno:27),另一个为ttav3(seqidno:28)。在其它实施方案中,第一致死基因为ttav(seqidno:26),第二致死基因为ttav3(seqidno:28)。
每个致死基因可操作地连接至启动子,其中所述启动子能够由也包括在至少一个基因表达系统中的基因所编码的转录激活因子所激活。
该启动子可以为大型或复杂启动子,但在导入非宿主昆虫中时这些启动子经常具有被很少利用或零散利用的缺点。因此,在一些实施方案中,优选采用最小启动子。应当理解,最小启动子可以直接从已知的启动子来源获得,或者源自较大的天然出现的或以其它方式了解的启动子。适合的最小启动子以及如何获得它们对本领域技术人员是显而易见的。例如,适合的最小启动子包括源自hsp70的最小启动子、p最小启动子、cmv最小启动子、基于act5c的最小启动子、bma3启动子片段、以及adh核心启动子(bieschke,e.,wheeler,j.,andtower,j.(1998)。“doxycycline-inducedtransgeneexpressionduringdrosophiladevelopmentandaging”.molgengenet,258,571-579)。并非所有最小启动子都必定在所有的物种中起作用,但是对本领域技术人员而言显而易见的是如何保证该启动子是有活性的。
优选地,至少一个存在于本发明中的可操作地连接的启动子在宿主生物体的早期发育期间是有活性的,特别优选在胚胎阶段,以便保证在生物体的早期发育期间该致死基因被表达。
在一些实施方案中,至少一个启动子为最小启动子为热休克启动子,例如hsp70。在其它实施方案中,至少一个启动子为来自黑腹果蝇的sryα胚胎特异启动子(horn&wimmer(2003))、或其同源物,或者来自其它胚胎特异或胚胎活性基因的启动子,例如果蝇基因slowasmolasses(slam)的的启动子,或者其来自其它物种的同源物。
在一些实施方案中,至少一个启动子为最小启动子。在一些实施方案中,每个启动子独立地为hsp70、hsp73或sryα。在优选的实施方案中,第一和第二启动子之一为hsp70,另一个为sryα。在一个实施方案中,第一启动子为hsp70,第二启动子为sryα。
每个基因表达系统还包括编码转录激活因子的基因,其中每个转录激活因子激活转基因的致死基因的表达。因此,每个编码转录激活因子的基因能够被宿主生物体表达,产生功能性蛋白。具体地,每个转录激活因子能够激活至少一个启动子,其中该启动子可操作地连接至致死基因。结果,当转录激活因子激活启动子时,上调了可操作地连接至该启动子的致死基因的表达。每个转录激活因子都可以作用于第一或第二启动子,或者每个转录激活因子可以作用于第一和第二启动子二者。优选地,当不止一个转录激活因子表达时,不止一个启动子被激活。因此,当第一和第二转录激活因子都表达时,第一和第二启动子都被激活。
起转录激活因子作用的基因产物可以以任何适合的方式工作。例如,转录激活因子可以结合位于至少一个启动子附近的增强子,由此增强聚合酶在启动子处的结合。可以采用其它的机制,例如阻遏抗衡机制,例如阻断转录或翻译抑制剂。可以例如通过使用阻断编码抑制剂的mrna的翻译的发夹rna's或核酶来阻断转录抑制剂,或者产物可直接结合抑制剂,从而防止对转录或翻译的抑制。
在优选的实施方案中,转录激活因子对致死基因的表达的影响可由技术人员控制,优选通过使用外源控制因子。特别优选的是,转录激活因子的反式激活活性可被外源控制因子所遏制。因此,有可能通过控制转录激活因子的反式激活活性来控制致死基因的表达。由技术人员施用的外源控制因子的存在减弱了转录激活因子对相关启动子的活性。结果,对启动子的激活被阻遏,使得可操作地连接的致死基因的表达减弱。
在每个或任一个基因表达系统中都可以使用其反式激活活性可被控制的任何转录激活因子。例如,转录激活因子可以为四环素可阻遏的转录激活子(tta)蛋白,在表达时,其结合teto操纵序列,并驱动从附近的最小启动子表达。可控转录激活因子的其它实例包括gal4。
编码转录激活因子的基因可以相同或不同。在优选的实施方案中,编码转录激活因子的每个基因独立地为tta或ttav基因变体。在特别优选的实施方案中,编码转录激活因子的每个基因独立地为ttav基因变体,并且可以为相同的或不同的ttav基因变体。可以使用tta和ttav基因变体的任何组合。在一些实施方案中,每个编码转录激活因子的基因独立地为ttav(seqidno:26)、ttav2(seqidno:27)和ttav3(seqidno:28),并且这些基因可以相同或不同。在一些实施方案中,每个编码转录激活因子的基因独立地为ttav(seqidno:26)、ttav2(seqidno:27)和ttav3(seqidno:28)之一。在另外实施方案中,编码转录激活因子的第一和第二基因中的一个为ttav(seqidno:26),另一个基因为ttav3(seqidno:28)。可以使用ttav变体的任何组合;因此,在一些实施方案中,编码转录激活因子的第一和第二基因中的一个为ttav(seqidno:26),另一个为ttav2(seqidno:27);而在另外的实施方案中,编码转录激活因子的第一和第二基因中的一个为ttav2(seqidno:27),另一个为ttav3(seqidno:28)。在其它实施方案中,编码第一转录激活因子的基因为ttav(seqidno:26),编码第二转录激活因子的基因为ttav3(seqidno:28)。
如上所述,转录激活因子是可控的,优选可通过外源控制因子阻遏。可以通过任何适合的手段控制转录激活因子,以及可以在任何水平上有效。例如,该控制可以有效的,或者是阻断编码该转录激活因子的基因的转录,或者是阻断其rna产物的翻译,或者防止或抑制该基因的翻译产物的作用。
应当理解,所用的外源控制因子将取决于转基因中所编码的转录激活因子的。例如,在至少一个编码转录激活因子的基因编码gal4的实施方案中,控制因子可以为温度(由于gal4有些冷敏感)和/或gal80或其变体。在至少一个编码转录激活因子的基因为tta或ttav变体的实施方案中,外源控制因子为四环素。四环素结合tta或ttav基因变体产物(i.e.tta),因此防止tta具有反式激活活性。当使用tta或其类似物时,如tav,可将四环素的存在或不存在,或者浓度的调整,用于控制该系统。
转基因的显性致死基因的表达可以是性别特异的,或者是性别特异与阶段特异、生殖系特异或组织特异的组合,由于在每个基因表达系统中存在至少一个剪接控制序列。在优选的实施方案中,该性别特异的表达为雌性特异的。每个基因表达序列中的剪接控制序列使得能够在除启动子之外有额外水平的蛋白表达控制。例如,仅在胚胎中组织或性别特异的表达对于传统方法而言是极其困难的。
第一和第二致死基因包含蛋白或多肽的编码序列,即至少一个能够编码多肽(例如蛋白或其片段)的外显子,优选两个或多个外显子。优选地,不同的外显子有差异的剪接在一起以提供可变mrna。优选地,所述可变剪接mrna具有不同的编码潜能,即编码不同的蛋白或多肽序列。因此,该编码序列的表达是通过可变剪接调节的。
系统中的每个剪接控制序列包含至少一个剪接受体位点和至少一个剪接供体位点。供体和受体位点的数量可以随准备剪接在一起的序列的节段的数量而变化。
在一些实施方案中,一个或两个剪接控制序列通过内含子和外显子核苷酸来调节可变剪接。在其它实施方案中,一个或两个剪接控制序列为内含子剪接控制序列。换言之,优选所述剪接控制序列基本上源自形成一部分内含子的多核苷酸,因此通过剪接被从初级转录本切除,使得这些核苷酸不保留在成熟的mrna序列中。
应当理解,在可变剪接中,在一些情况下(即在一些可变剪接变体中),序列可以为内含子,但在其它情况下为外显子(即在其它变体中)。因此,在至少一个剪接变体中,本发明的至少一个剪接控制序列优选基本上源自形成内含子的一部分的多核苷酸,即无论是在第一剪接mrna产物中,还是在至少一个可变剪接mrna产物中。因此,可在至少一个转录本或转录类型中观察到内含子或内含子序列被剪接掉。
在“正常的”(非可变的)剪接和可变剪接中,内含子一般是从前rna去除以形成剪接的mrna,其接着可翻译为具有氨基酸序列的多肽,例如蛋白或蛋白片段。因此,对技术人员显而易见的是如何确定本系统的这些序列被认为是内含子,而不是外显子。
如上所述,外显子序列可以参与介导可变剪接的控制,但优选的是至少一些内含子控制序列参与介导可变剪接。换言之,每个基因表达系统还可以包括存在于外显子中的剪接控制序列,只要存在一些内含子参与控制。在一些实施方案中,一个或两个剪接控制序列源自或者含有dsx基因的元件,其中,无需被理论束缚,可认为外显子序列有助于可变剪接机制。
因此,在一些实施方案中,该至少一个剪接控制序列包括外显子序列,并且,应当理解,这由用于描述本发明的定义所预想。因此,显而易见地,有可能一些核苷酸被涵盖在该至少一个剪接控制序列的定义内,并且还处于编码功能性蛋白的多核苷酸序列的定义内。换言之,这些元件的定义可以交叠,使得某些核苷酸可被不止一个元件的定义所覆盖。但是,技术人员会意识到,这在分子生物学中并非罕见的,因为核苷酸通常可执行不止一个角色。在其它实施方案中,至少一个剪接控制序列为纯内含子的,即没有外显子影响。
优选至少一个剪接控制序列能够通过剪接从前rna去除。优选地,所述至少一个剪接控制序列在至少一个所产生的剪接变体中不导致移码。优选地,这为编码全长功能性蛋白的剪接变体。换言之,至少一个剪接控制序列优选不介导形成或打算形成编码功能性蛋白的多核苷酸序列(定义在起始密码子和终止密码子之间,准备在生物体中表达)的一部分的核苷酸的去除。为此,这意味着在至少一个剪接变体中通过剪接切除的核苷酸不为编码野生型形式的蛋白的核苷酸或基因。一个或多个剪接变体可以将所述核苷酸切除,但是至少一个变体必须保留这些核苷酸,以使得在该至少一个变体中没有诱导移码。这些移除的核苷酸为在正常剪接出的序列(如内含子)之外被移除的核苷酸。
该至少一个剪接控制序列与细胞剪接机构如剪接体的相互作用导致或介导了一系列优选至少50个连续核苷酸从初级转录本的移除以及在初级转录本中不连续的核苷酸的连接(剪接)一起(因为它们,或如果考虑反义序列的话则是它们的互补序列,在初始转录本从其转录而来的原始模板序列中是不连续的)。所述至少50个连续核苷酸的系列包括内含子。这种介导优选以性别特异的、更优选雌性特异的方式起作用,以使得等量的初级转录本在不同的性别、以及任选地还在不同的阶段、组织类型等中趋于去除不同大小或序列的内含子,或者在某些情况下可以在一种情况下去除内含子,而另一种情况则不去除。这种在不同情形下去除不同大小或序列的内含子、或者在不同情形下指定大小或序列的内含子的差异化去除的现象,称为可变剪接。可变剪接在自然界是公知的现象,并且很多实例是已知的,见上文。
在可变剪接的介导是性别特异时,优选编码准备在有机体中表达的功能性蛋白的剪接变体为f1剪接变体,即仅在或主要在雌性中发现的剪接变体,并优选为雌性中发现的最丰富的变体,尽管这不是必要的。
如上所述,在一些实施方案中,可变剪接的方式或机制为性别特异的,优选雌性特异的,并且任何适合的剪接控制序列都是可以使用的。在优选的实施方案中,至少一个剪接控制序列源自tra内含子。来自transformer基因的地中海实蝇tra内含子最初由上文pane等(2002)表征。在昆虫中,例如tra蛋白在不同性别中是差异表达的。具体地,已知tra蛋白主要存在于雌性中,并因此如此介导可变剪接,以使得编码序列以性别特异的方式表达,即在一些情况下蛋白仅在雌性中表达或者以比在雄性中高得多的水平在雌性中表达,或者,在其它情况下,蛋白仅在雄性中表达或者以比在雌性中高得多的水平在雄性中表达。实现这种tra蛋白或tra/tra-2复合体介导的性别特异的可变剪接的机制是已知的,并且例如在paneetal(development129,3715-3725(2002))中有讨论。
应当理解,来自transformer基因的地中海实蝇tra内含子的同源物存在于其它物种中,并且可容易地在所述物种以及也在它们的各属中鉴定这些同源物。因此,当提及tra时,应当理解这也涉及其它物种中的tra同源物。因此,在一些实施方案中,可变剪接机制的每一个独立的源自地中海实蝇tra内含子、或源自另一直系同源物或同源物。在一些实施方案中,该直系同源物或同源物来自节肢动物,优选实蝇科。在其它实施方案中,该直系同源物或同源物来自蜡实蝇属(ceratitis)、果实蝇属(bactrocera)、实蝇属(anastrepha)或绕实蝇属(rhagoletis)。在其它实施方案中,该直系同源物或同源物来自纳塔尔实蝇(c.rosa)或桃实蝇(b.zonata)。在另外的实施方案中,该直系同源物或同源物来自桃实蝇,并且这种直系同源物或同源物在本文中称为bztra(genbank登记号bztrakj397268)。
基因表达系统的剪接控制序列可以相同或不同。在一些实施方案中,优选该剪接控制序列源自不同的物种,以便减少重组风险。因此,在优选的实施方案中,第一和第二剪接控制系列之一为cctra,另一个源自不同的物种。在特别优选的实施方案中,第一和第二剪接控制系列之一为cctra,另一个为bztra(genbank登记号bztrakj397268)。在另一实施方案中,该第一剪接控制序列为cctra,该第二剪接控制系列为bztra(genbank登记号bztrakj397268)。
源自tra内含子的剪接控制序列的精确长度不是关键的,只要能够介导可变剪接。就此而言,对于经修饰的tra内含子认为约55至60个核苷酸为最小长度,尽管来自地中海实蝇(c.capitata)的野生型tra内含子(f1剪接变体)在1345核苷酸长的区域内。
在其它实施方案中,至少一个剪接控制序列源自源于节肢动物(优选实蝇科)的actin-4基因的可变剪接机制。在不止一个剪接序列源自actin-4的实施方案中,它们可以源自相同或不同的实蝇科物种。在一些实施方案中,每个actin-4基因独立地源自蜡实蝇属、果实蝇属、实蝇属或绕实蝇属的物种。在其它实施方案中,该第一和第二actin-4基因独立地源自地中海实蝇、橄榄果蝇(troceraoleae)、纳塔尔实蝇(ceratitisrosa)或桃实蝇(bactrocerazonata)。在一些实施方案中,第一和第二actin-4基因的至少一个源自地中海实蝇。在不止一个剪接控制序列源自actin-4的实施方案中,剪接控制序列可以源自相同的物种。但是,优选该剪接控制序列源自不同的物种,以便减少重组风险。
在一些实施方案中,至少一个剪接控制序列包括源自节肢动物(优选实蝇科)的doublesex(dsx)基因的至少一片段。在一些实施方案中,不止一个剪接控制序列(例如,第一和第二剪接控制序列二者)源自dsx,并且该dsx基因源自相同或不同的实蝇科物种。在一些实施方案中,每个dsx基因独立地源自蜡实蝇属、果实蝇属、实蝇属或绕实蝇属的物种。在一些实施方案中,该dsx基因独立地源自地中海实蝇、橄榄果蝇、纳塔尔实蝇或桃实蝇。在一些实施方案中,第一和第二dsx基因的至少一个源自地中海实蝇。在不止一个剪接控制序列源自dsx的实施方案中,剪接控制序列可以源自相同的物种。但是,优选该剪接控制序列源自不同的物种,以便减少重组风险。
尽管在一些实施方案中设想剪接控制序列源自相同的基因或内含子起源,但在其它实施方案中该剪接控制序列源自不同的基因或内含子起源。例如,在一些实施方案中,剪接控制序列之一源自tra内含子,其它的剪接控制序列源自actin-4基因或dsx基因。
在一些实施方案中,该第一和第二基因表达系统的至少一个还包括与所述基因表达系统关联的增强子。在第一和/或第二基因表达系统中编码的至少一个转录激活因子结合该增强子,使得转录激活因子的结合用于增强所述关联的启动子的活性,例如通过促进聚合酶在启动子处的结合。
在基因表达系统的启动子与增强子关联的实施方案中,在缺乏活性增强子时该启动子基本上无活性。这些启动子优选最小启动子,例如上文描述的那些。
本领域技术人员会意识到哪些增强子适合用在本发明中。具体地,该增强子必须适合于被转录激活因子结合,如上所述(即其可由外源控制因子控制)。
因此,在一个或多个显性、致死基因为tta或ttav基因变体的实施方案中,增强子为teto元件,包括一个或多个teto操纵单元。在启动子上游,当被tta基因或ttav基因变体的产物结合时,任一方向的teto能够增强与其临近的启动子的转录水平。在一些实施方案中,每个增强子独立地为tetox1、tetox2、tetox3、tetox4、tetox5、tetox6、tetox7、tetox8、tetox9、tetox10、tetox11、tetox12、tetox13、tetox14、tetox15、tetox16、tetox17、tetox18、tetox19、tetox20和tetox21之一。在一些实施方案中,每个增强子独立地为tetox7、tetox14和tetox21之一。在包括不止一个增强子的实施方案中,第一增强子与第二增强子相同或不同。
在优选的实施方案中,第一和第二基因表达系统二者还分别包括增强子,即第一和第二增强子。在一些实施方案中,第一和第二增强子之一为tetox7,另一个增强子为tetox14。在另一实施方案中,第一增强子为tetox7,第二增强子为tetox14。
在一些实施方案中,在给定的基因表达系统中,优选将所述基因表达系统的显性、致死基因与该相同基因表达系统的编码转录激活因子的基因连接。这可以通过将两个基因串联设置来实现,包括将二者提供为融合产物的可能性,或者例如通过将每个基因连同其自己的启动子提供在相反方向,但是与该增强子位点毗邻。
在一些实施方案中,至少一个基因表达系统形成线性表达系统。因此,当编码转录激活因子的基因被表达时,所述转录激活因子激活可操作地连接至致死基因的启动子,由此上调该致死基因的表达。在一些实施方案中,该转录激活因子仅激活表达了所述转录激活因子的基因表达系统的启动子。在其它实施方案中,该转录激活因子还可以激活其它基因表达系统的启动子。
在更优选的实施方案中,特定基因表达系统的显性、致死基因与也是所述基因表达系统的一部分的编码转录激活因子的基因就是同一个。因此,致死产物对于至少该基因表达系统也起转录激活因子的作用。结果,该致死基因产物激活所述基因表达系统的启动子,由此上调所述致死基因的表达,产生正反馈回路。换言之,所述显性、致死基因也为编码所述基因表达系统的转录激活因子的基因。因此,启动子的增强不仅有助于增加转录激活因子的转录,还导致该基因表达系统的致死产物的积累,对宿主生物体产生致死效应。就此而言,在一个实施方案中,尤其优选第一和/或第二基因表达系统的正反馈回路如wo2005/012534中所公开的。
优选地,该第一和/或第二致死基因为tta或ttav基因变体,如上所述。在这些实施方案中,相关的基因表达系统还包括如上文所述的作为增强子的teto元件。编码转录激活因子的基因与所述致死基因就是同一个。该外源控制因子为四环素。因此,由四环素是否存在来对该正反馈机制加以控制,而四环素的存在阻遏tta或ttav基因变体产物对启动子的反式激活活性。
在至少一个基因表达系统为正反馈回路时,所述正反馈回路的转录激活因子激活所述基因表达系统的启动子,但在一些实施方案中,该转录激活因子还同时激活其它基因表达系统的启动子。
在一些实施方案中,基因表达系统之一为如上所述的线性基因表达系统,另一个为如上所述的正反馈回路。
在一些实施方案中,第一和第二基因表达系统二者都起正反馈回路的作用。第一和第二基因表达系统的每一个表达不同的致死基因产物,以使得第一基因表达系统的致死基因产物仅对第一基因表达系统起转录激活因子的作用,反之亦然。
在优选的实施方案中,第一和第二基因表达系统二者都起正反馈回路的作用,并表达相同或类似的致死产物。因此,由第一基因表达系统表达的致死基因产物对第一和第二基因表达系统都起转录激活因子的作用,反之亦然。相应地,在一些实施方案中,第一和第二基因表达系统都包括作为致死基因和编码转录激活因子的基因的tta或ttav基因变体。相应地,两个基因表达系统包括如上所述的增强子teto元件,其驱动从关联启动子的表达。第一转录激活因子(即第一致死基因产物)可结合第一和第二增强子,并且第二转录激活因子可结合第一和第二增强子。
在一些实施方案中,基因表达系统之一还包括可操作地连接第三启动子的第三显性、致死基因。能够激活相关基因表达系统的启动子的转录激活因子也能够激活该第三启动子,由此增强该第三致死基因的表达。因此,该第三致死基因的表达也可以被作用于所述转录激活因子的外源控制因子所控制,优选所阻遏。
在一些实施方案中,该相关基因表达系统还包括如上所述的增强子,以及任选地第三致死基因和第三启动子。在一些这样的实施方案中,所述基因表达系统的启动子和该第三启动子都与所述增强子关联。优选地,所述基因表达系统的启动子与增强子的一端相关联,而第三启动子与增强子的另一端相关联。具体地,如上所述,一些增强子能够增强任一方向的转录水平。
第三致死基因表达致死产物,并由于总致死产物的积累而由此增加转基因的致死效应。但是,甚至在转基因中没有该第三致死基因时,观察到上文描述的由转基因提供的改进。
该第三致死基因可以为本领域技术人员已知的任何致死基因。在一些实施方案中,该第三致死基因为上文涉及第一和第二致死基因时提到的那些中的任一个。在一些实施方案中,该第三致死基因为tta、ttav基因变体或vp16。在优选的实施方案中,该第三致死基因为vp16。
第三启动子可以为涉及转基因的第一和第二启动子时先前描述的那些中的任一个。在一些实施方案中,该第三启动子为最小启动子。在优选的实施方案中,该第三启动子在生物体的早期发育中表达,优选至少在胚胎期期间表达。优选地,该第三启动子为hsp70或sryα。在优其它实施方案中,该第三启动子为hsp70。
在一些实施方案中,转基因还包括基因标记物。在一些实施方案中,这种标记物为荧光标记物,即编码荧光蛋白的基因。适合的基因标记物对于本领域技术人员是显而易见的。在优选的实施方案中,该荧光标记物为dsred2,其编码dsred2荧光蛋白。在其它实施方案中,该基因标记物为绿色荧光蛋白,或其变体。这些基因标记物可用在对成功转化的生物体的筛选中。此外,这些标记物可用于将例如转基因蝇类与野外野生型蝇类或在野外捕捉的那些区分开。
本领域技术人员应当理解,在包括这些基因标记物的实施方案中,表达该标记物所需的组件也包括在所述实施方案中。例如,因此可设想荧光标记物将可操作地连接至启动子。可以使用任何适合的启动子,例如hr5/ie1。
在优选的实施方案中,ttav(seqidno:26)为第一显性致死基因,hsp70为第一启动子,以及cctra为第一剪接控制序列。如上所述,该第一基因表达系统为正反馈回路,使得该第一致死基因也为编码第一转录激活因子的基因。该第一基因表达系统还包括第一增强子,其中该第一增强子为tetox7。第二基因表达系统包括作为第二显性、致死基因的ttav3(seqidno:28),作为第二启动子的sryα以及作为第二剪接控制序列的bztra(genbank登记号bztrakj397268)。该第二基因表达系统也形成正反馈回路,使得该第二致死基因为编码第二转录激活因子的基因。该第二基因表达系统还包括第二增强子,其中该第二增强子为tetox14。该第二基因表达系统还包括与第三启动子可操作地连接的第三致死基因,其中该第三致死基因为vp16,第三启动子为hsp70。该第三启动子与第二增强子相关联,第二启动子与该增强子的一端相关联,而第三启动子与该第二增强子的另一端相关联。该转基因还包括基因标记物和为其所用的启动子,其中该基因标记物为dsred2,启动子因此为hr5/ie1。在另一实施方案中,该转基因为具有seqidno:1表示的序列的多核苷酸序列。
该第一和第二基因表达系统串联排列,形成转基因,并且该转基因可以在每个基因表达系统之间包含或不包含接头核苷酸序列。在基因表达系统之间不包含接头序列的实施方案中,第一和第二基因表达系统为连续的。在第一和第二基因表达系统之间包含接头序列的实施方案中,该接头序列为1bp至10kbp长。
还应当理解,在转基因还包括基因标记物和其关联启动子的实施方案中,在基因标记物(或其启动子)和临近的基因表达系统之间可以有或没有接头核苷酸序列。如上所述,在不存在接头序列的实施方案中,基因标记物或其启动子与该转基因的基因表达系统之一连续。在转基因在基因标记物和相关基因表达系统之间包括接头序列的实施方案中,该接头序列为1bp至10kbp长。
但是,本领域技术人员也应当理解,优选转基因中不存在接头序列,以使得转基因的元件是连续的。这是为了减小随机突变引入该转基因的风险以及减小重组的风险。
包括基因表达系统的多核苷酸序列即转基因可以形成基因构建体的一部分。因此,在本发明的另一方面,提供了包括如上所述的第一和第二基因表达系统的基因构建体。该基因构建体还可以包括不形成该转基因的一部分的其它组件。这些组件可以存在或不存在于以其转化的生物体内。
在一些实施方案中,该基因构建体还包括至少4个反向重复序列,形成至少两对相对的反向重复序列。该转基因位于两对反向重复序列之间。这意味着,成对的反向重复序列的原位切除有效地让基因表达系统插入宿主基因组中,而没有旁侧转座子来源的重复序列存在于宿主基因组中。该至少4个反向重复序列如wo2005/003364中所描述的,并提供对可转座末端的消除,如dafa’alla等(2006)中所描述。
在一些实施方案中,该基因构建体包括4个反向重复序列,形成至少两对相对的反向重复序列。在一些这样的实施方案中,优选该4个反向重复序列为piggybac反向末端重复序列(itr)。两个反向重复序列远离该转基因,即它们为外部反向重复序列,而剩余的反向重复序列为内部反向重复序列。具体地,这意味着一个内部反向重复序列在一个外部反向重复序列和该转基因之间。这4个反向重复序列因此形成4个不同的可转座元件,其中两个可转座元件不包含该转基因。不包括该基因表达系统的可转座元件比另两个可转座元件短得多。通常,转座酶对切出较短的序列更有效,使得例如在转座子具有一个5’重复序列和两个3’重复序列时,将观察到的转移至另一基因座的最常见转座子为较短的,由5’重复序列和两个3’重复序列中更临近的一起形成。因此,由于不含有该转基因的转座子比含有该转基因的转座子更短,因此对不包括转基因的转座子的切除以比对含有转基因的转座子的切除更高的频率发生。
在一些实施方案中,两个内部iggybacitrs经修饰以包括约160碱基对的额外亚末端piggybac序列。可以添加这种额外的序列以便确保在随后的多轮暴露于转座酶期间较短的转座子(即不包含该转基因的那些)被切除。
在优选的实施方案中,该构建体包括4个piggybac反向重复序列,形成至少两对相对的反向重复序列。这4个piggybac反向重复序列由seqidno:30-32表示的核苷酸序列组成,其中seqidno:30表示的序列用于两个piggybac反向重复序列。具体地,一个外部反向重复序列由seqidno:30表示的核苷酸序列组成,另外的外部反向重复序列由seqidno:31表示的核苷酸序列组成。一个内部piggybac重复序列由seqidno:30表示的核苷酸序列组成,另外的内部piggybac反向重复序列由seqidno:32表示的核苷酸序列组成。更具体地,5'外部piggybac重复序列由seqidno:30表示的核苷酸序列组成,由seqidno:32表示的核苷酸序列组成3'内部piggybac反向重复序列位于该5'外部piggybac反向重复序列和该转基因之间。3'外部piggybac重复序列由seqidno:31表示的核苷酸序列组成,由seqidno:30表示的核苷酸序列组成5'内部piggybac反向重复序列位于该3'外部piggybac反向重复序列和该转基因之间。
因此,在这种实施方案中可能的4个转座子位于:
i)5’外部和3’外部piggybac反向重复序列之间,
ii)5’外部和3’内部piggybac反向重复序列之间,
iii)3’外部和5’内部piggybac反向重复序列之间,以及
iv)5’内部和3’内部piggybac反向重复序列之间。
如上所述,转座子ii)和iii)不含有该转基因,并短于转座子i)和iv)。
在一些具有四个反向重复序列的实施方案中,该构建体还包括至少一个与至少一个可能的转座子关联的基因标记物,以便让使用者能够跟踪转座和切除的各个步骤的进展,并确定哪些个体中所述步骤是成功的。在一些实施方案中,至少一个基因标记物与转座子/切除过程中的可鉴定步骤相关联,更优选地,该标记物与转基因相关联。这些与转基因关联的标记物可以为如上文所述的。
优选地,至少一个基因标记物与每一个可能的转座子相关联。因此,至少一个基因标记物置于每对反向重复序列之间。应当理解,任何适合的基因标记物都可以使用,这些标记物的实例包括dsred2、amcyan和zsgreen。在一些实施方案中,构建体包括三个基因标记物,其中一个标记物置于每对反向重复序列之间。应当理解,为了在转座子之间进行区分,每个标记物必须是不同的。
本领域技术人员应理解,包括至少一个基因标记物的实施方案还可以包括驱动该基因标记物表达的启动子。在一些实施方案中,该启动子为hr5/ie1(choi&guarino,1995),而在其它实施方案中,该启动子为polyubiquitin(handler&harrel,2001)。但是,与这些基因标记物一起使用的启动子不限于这两个实例,可以使用其它的。本领域技术人员会认识到哪些启动子是适合的。
在优选的实施方案中,该构建体包括seqidno:1表示的转基因,还包括4个如上文所述的piggybac反向重复序列。该构建体还在5'外部piggybac重复序列和3'内部piggybac重复序列之间包括基因标记物,以及在3'外部piggybac重复序列和5'内部piggybac重复序列之间包括基因标记物,其中基因标记物之一为amcyan,另外的为zsgreen。在特别优选的实施方案中,该构建体如图2所示,其中5'外部piggybac重复序列和3'内部piggybac重复序列之间的标记物为zsgreen,3'外部piggybac重复序列和5'内部piggybac重复序列之间的标记物为amcyan。
如上文提到的,本发明的转基因和基因构建体可用在野外生物体种群的控制中。确切地,经该转基因转化的节肢动物显示出性别特异的致死性,与之前公开的转移昆虫相比具有改善的转基因外显率和更早的致死性发作。如果发生生化抗性,以上述任何转基因或构建体转化节肢动物还提供了安全机制。如上文所述的还包括至少4个反向重复序列的构建体提供了进一步的优点:所有的转座子序列整合后消除是可能的,导致大量饲养和野外条件下的稳定性。
因此,在本发明的另一方面,提供了以上述转基因或构建体转化的生物体。在一些实施方案中,该生物体为节肢动物。在一些实施方案中,该生物体为昆虫。在一些实施方案中,该生物体属于鳞翅目(lepidoptera)、蚤目(siphonaptera)、双翅目(diptera)、膜翅目(hymenoptera)、鞘翅目(coleoptera)、缨翅目(thysanoptera)、半翅目(hemiptera)、直翅目(orthoptera)或中气门目(mesostigmata)。在其它实施方案中,该生物体属于实蝇科(tephritidae)、果蝇科(drosophilidae)、尖尾蝇科(lonchaeidae)、草蝇科(pallopteridae)、扁口蝇科(platystomatidae)、蜣蝇科(pyrogotidae)、粗股蝇科(richardiidae)或小金蝇科(ulidiidae)。在优选的实施方案中,该生物体属于实蝇科或果蝇科。在优选的实施方案中,该生物体属于蜡实蝇属(ceratitis)、果蝇属(drosophila)、果实蝇属(bactrocera)、实蝇属(anastrepha)或绕实蝇属(rhagoletis)。更优选地,该生物体属于蜡实蝇属。在特别优选的实施方案中,该生物体为地中海实蝇(ceratitiscapitata)。
应当理解,可以通过本领域技术人员已知的任何手段施用该转基因或构建体,但通常在整合进基因组后测试。可通过本领域已知的方法施用,例如胃肠外、静脉内、肌肉内、口服、透皮、经粘膜等等。注射进胚胎是特别优选的。在一些实施方案中,该转基因或构建体作为质粒施用。
在优选的实施方案中,经转化的生物体为地中海实蝇,并且该经转化的昆虫包括seqidno:2或3表示的序列。在特别优选的实施方案中,经转化的地中海实蝇包括seqidno:2表示的序列,并且包括该序列的地中海实蝇在本文称作ox3864a。在其它实施方案中,经转化的地中海实蝇包括seqidno:3表示的序列,并且包括该序列的经转化的地中海实蝇在本文称作ox3647q。
在一些实施方案中,包括seqidno:2表示的序列的经转化的地中海实蝇(即ox3864a)是特别优选的,原因如下:
i)在一个拷贝时该转基因外显率为100%;即如实施例中看到的,甚至在杂合状态下,所有的雌性在幼虫培养基中无四环素时死亡;
ii)在幼虫饮食中掺有四环素时,雄性:雌性比例为50:50,表明了对雌性中转基因表达的良好阻遏(这对于饲养机构中该品系有成本效益的繁殖是重要的);
iii)不存在四环素时ox3864a显示了完全的蛹前雌性致死性;
v)红色标记物(dsred2)的表达是强劲并可持续的。该标记物在所有的发育期都是明显的,使得能在大量饲养的机构中进行质量控制(qc)规程以及在野外可靠监测;
vi)生活史参数与用于转化的野生型的那些具有可比性,如实施例中所显示的,表明在四环素上饲养时o3864a具有近似野生型适合度;
vii)所插入的构建体通过除去载体piggybac末端已在插入后稳定化,这样该转基因是固定的并且在昆虫基因组中可遗传。
鉴定经上述转基因或构建体成功转化的生物体也是有用的。因此,在本发明的另一方面,提供了检测经上文所述的转基因或构建体转化的生物体的方法,以及用于所述方法的引物。该方法包括用于检测经转化的生物体的基于pcr的测定法,通过扩增覆盖所插入的转基因的旁侧生物体基因组dna以及该转基因自身的dna序列来进行。该方法包括让从生物体获得的样品dna与特异于插入昆虫基因组的如上文所述的转基因的引物对接触,其中引物对中的一个引物特异于该转基因的核苷酸序列,引物对中的另一引物特异于所插入的转基因旁侧的基因组核苷酸序列,以及扩增该样品dna。因此,引物对中的一个引物与旁侧基因组dna退火,引物对中另外的引物与该转基因退火。然后可观察扩增产物,并且通常可以采用本领域技术人员已知的标准技术检测。
对dna样品的扩增采用本领域技术人员已知的pcr技术进行。如上所述,引物对中的引物特异于所转化的生物体,使得当转基因整合进相关的基因组位置时才会扩增出合适的带。
本领域技术人员应当理解,各种引物可以用在本发明的方法中,并且这些引物可以采用本领域技术人员已知的技术制备。所用的引物将定义待观察的或者更经常地是检测的pcr扩增产物的大小。
在一些实施方案中,该方法用于检测经转基因或基因构建体转化的生物体。在一些实施方案中,该生物体为节肢动物。在一些实施方案中,该生物体为昆虫。在一些实施方案中,该生物体属于鳞翅目、蚤目、双翅目、膜翅目、鞘翅目、缨翅目、半翅目、直翅目或中气门目。在另外的实施方案中,该生物体属于实蝇科、果蝇科、尖尾蝇科、草蝇科、扁口蝇科、蜣蝇科、粗股蝇科或小金蝇科。在优选的实施方案中,该生物体属于实蝇科或果蝇科。在其它实施方案中,该生物体属于蜡实蝇属、果蝇属、果实蝇属、实蝇属或绕实蝇属。在优选的实施方案中,该生物体属于蜡实蝇属。在特别优选的实施方案中,该生物体为地中海实蝇。
在优选的实施方案中,该方法采用特异于转化的地中海实蝇。在一些实施方案中,特异于地中海实蝇的引物包括seqidno:2表示的核苷酸序列。在本实施方案中,提供了第一引物对(tg1)、第二引物对(tg2)或第三引物对。tg1由引物tg1-3864attpflr(seqidno:4)和tg1-attpf2,(seqidno:5)组成。在这对引物中,tg1-3864attpflr特异于转基因旁侧基因组dna,tg1-attpf2特异于转基因本身。tg2由seqidno:6和7表示的引物组成。tg2由引物tg2-3864frtflf(seqidno:6)和tg2-frtnhef(seqidno:7)组成。在tg2中,tg2-3864frtflf特异于所插入转基因旁侧的基因组dna,tg2-frtnhef特异于转基因本身。第三引物对由cc3864frttaqf(seqidno:10)和cc3864frttaqr(seqidno:11)组成。在第三引物对中,cc3864frttaqf特异于转基因,cc3864frttaqr特异于旁侧基因组dna。
在其它实施方案中,以上公开的特异于转基因的引物的任何一个可以与特异于旁侧基因组dna的引物的任何一个配对,本领域技术人员应当理解,pcr扩增产物的大小将取决于所用的引物对。
在其它实施方案中,用于检测经上述转基因或构建体转化的生物体的方法还包括在扩增步骤期间使用双标记探针。
所整合的转基因和生物体基因组dna接合处的序列代表了唯一指纹。因此,采用三种特异的寡核苷酸检测唯一接合处是可能的。用在该方法中的两种寡核苷酸为使得能扩增所插入的转基因和旁侧基因组dna的预定片段的引物,而第三、双标记寡核苷酸即探针与该预定片段退火,在一些实施方案中,该探针包括淬灭分子和5'报告分子。
在一些实施方案中,该方法包括以下步骤:让从生物体获得的样品dna与特异于插入生物体基因组的上述转基因的引物对接触,其中引物对的一个引物特异于该转基因,引物对的另一个引物特异于所插入的转基因旁侧的基因组核苷酸序列,以及扩增该样品dna。该方法的步骤大致如上所述。探针与引物一起添加至扩增混合物。该探针特异地横跨所扩增的pcr产物中的转基因与旁侧dna的接合处,需要这种边界用于阳性输出。在pcr扩增的每个步骤中,taq聚合酶的5'-3'外切酶活性从退火的探针释放5'报告分子(fam),导致在含有整合的转基因的样品中积累性发射,这在实时pcr仪器中可检测。因此,该方法还包括让dna样品在该dna样品的pcr扩增期间与探针接触的步骤。
在一些实施方案中,该生物体为节肢动物,优选上文已讨论的节肢动物。在优选的实施方案中,该生物体为昆虫,优选实蝇科,更优选属于蜡实蝇属。在特别优选的实施方案中,该昆虫属于物种地中海实蝇。因此,在这些实施方案中,引物特异于所转化的地中海实蝇。优选地,该引物特异于包括seqidno:2表示的序列的地中海实蝇(即ox3864a)。在本实施方案中,使得能扩增预定片段的引物为分别由seqidno:10和11表示的cc3864frttaqf和cc3864frttaqr。cc3864frttaqf特异于旁侧基因组dna,cc3864frttaqr特异于转基因。在这些实施方案中,探针为cc3864frt探针,如seqidno:12所表示的。
在本发明的另外方面,提供了生物体的种群控制的方法。在优选的实施方案中,该方法包括以上文描述的转基因或构建体转化一个或多个生物体的步骤。在一些实施方案中,该方法还包括将所述转化的生物体释放进待控制的种群中。在另外实施方案中,该方法还包括监测待控制种群的步骤。所释放的生物体与待控制种群一起繁育,由该基因表达系统赋予的雌性特异的致死性意味着通过这种杂交繁育产生的雌性后代将在发育的早期阶段死亡。继承了该基因表达系统的雄性后代存活,以将致死表型传至后续各代。
在一些实施方案中,该待控制种群为节肢动物种群。在一些实施方案中,该种群为昆虫种群。在一些实施方案中,该种群属于鳞翅目、蚤目、双翅目、膜翅目、鞘翅目、缨翅目、半翅目、直翅目或中气门目。在其它实施方案中,该种群属于实蝇科、果蝇科、尖尾蝇科、草蝇科、扁口蝇科、蜣蝇科、粗股蝇科或小金蝇科。在优选的实施方案中,该种群属于实蝇科或果蝇科。在其它实施方案中,该种群属于蜡实蝇属、果蝇属、果实蝇属、实蝇属或绕实蝇属。在优选的实施方案中,该种群属于蜡实蝇属。在一些实施方案中,该种群为地中海实蝇种群。
生物体的释放可以通过本领域技术人员已知的任何方法,例如通过笼子释放或纸袋释放,例如simmons等(2011)或harris等(2011)中所描述的那些。
监测生物体种群的步骤可以是本领域技术人员已知的任何方法。在一些实施方案中,插进所转化的生物体内的转基因包括基因标记物,例如dsred2。因此,对待控制种群的监测可以通过在释放所转化的生物体后捕获来自该种群的昆虫,并观察或更通常是检测所捕获种群中的基因标记物来进行。
现在将参照以下的非限定性实例来阐述本发明。
实施例
实施例1:主导产品地中海实蝇品系的选择
采用图2所示的构建体通过piggybac介导的对定居toliman(起源:危地马拉)的地中海实蝇品系的转化来产生转化的品系。回交野生型蝇产生多个转基因种系(表1)。对于ox3864获得49个g0成体(存活率21%),对于ox3647是950个(35%存活率)。
将这两种饮食条件下的性别比例用于在两个关键参数中评估构建体的功能:1)饲喂四环素时对雌性致死性的总抑制,和2)不存在四环素时的完全致死性。对种系进行筛选,以便基于它们满足这些参数的能力和荧光强度进一步试验。
11个种系在单拷贝的该转基因时未能提供完全的外显率,被舍弃。一个种系证实为不完全的四环素阻遏,也被舍弃。两个种系不产生足够的后代,可能是由于该转基因插入所施加的适合度惩罚,并由此而终止。在产生的所有种系中荧光都是良好的;但是,构建体ox3864通常提供更强和更清晰的荧光表型。可在图4f和4g中看到ox3864a和ox3647q成体雄蝇的照片。尽管这两个品系与wt雄性相比都显示出可识别的表型,但明显的是ox3864a荧光表型(+++)强于ox3647q的(++)。
表1.对来自不同ox种系的雄性和雌性的g2存活分析。在与tolimanwt杂交之前合并了四环素开和四环素关的微注射存活者(g0)(或者10个雄性,或者20个雌性)。根据编号和字母后缀对种系命名(例如ox3647q),以表示从其收集g1子代的合并池。因为极大数量的ox3647存活者,所以再次使用了字母系统,并通过该字母后缀之前的括号内的编号标注,例如ox3647(2)b。将额外的编号给予了来自相同合并池的多个g1子代(例如,ox3647l1、l2),这些在最初是作为可能的分开的插入事件来处理。单个的转基因g1雄性每个与几个野生型处女雌性杂交。在含四环素(t,100μg/ml)或不含四环素(nt)培养基上,对g2后代按性别进行荧光(f)或无荧光(nf)评分。
对所产生的品系的进一步分析包括:
·在g2中最初测量为标记等位基因分离的单一转基因插入,
·当相同种系的雄性和雌性一起杂交时测量为标记等位基因分离的纯合潜能,
·通过杂交至提供了转座酶来源的品系ox3133对piggybac末端的去除,按照dafa’alla等(2006)描述的方法进行。
5个种系显示出多个插入,3个种系该转基因插入发现是性别连锁的。因此,舍弃了全部8个种系。品系ox3864e含有沉默插入(通过旁侧序列分析证实),被舍弃。所有剩余的品系对于纯合潜能而言都是阳性的,因此杂交至地中海实蝇(medfly)品系ox3133,用于piggybac切除(dafa’alla等,2006)。仅品系ox3864a和ox3647q证实完全去除所有的piggybac序列,因而选为可能的产品品系。
然后,通过同系交配衍生ox3864a和ox3647q每一个的纯合种系,以产生推测的纯合子,通过pcr证实。通过pcr提供piggybac序列的完全去除的进一步的证据(图3)。如图3中可看到,没有piggybac序列存在于品系ox3864a和ox3647q中,如所显示的,当采用4种设计的用来在piggybac存在于构建体中时产生产物的pcr时,所解析的泳道缺乏凝胶产物。为了产生该凝胶,采用purelink基因组dna试剂盒(invitrogen),按制造商的说明书从单个成体提取基因组dna。采用biotaq(pcrbiosystems),按制造商的说明书进行pcr。pcr条件为:在94℃预变性2min,接着是10个循环的4℃15s、60℃30s(每个循环降低0.5℃)、以及72℃15s,然后25个循环的94℃15s、55℃30s、72℃15s,最后72℃延伸7min。
采用引物916)attpf2(gtcatgtcggcgaccctacgc;seqidno:5)和td935)diag-5pbmin(gccaccgagtatgaccggtag;seqidno:15)的pcr反应产生了图3插图a中显示的凝胶。piggybac基序的存在生成了512bp的dna片段。采用引物td222)diag-pb5(ctgattttgaactataacgaccgcgtg;seqidno:16)和432)amcydiagf(tcacctacgaggacggcgg;seqidno:17)的pcr反应产生了图3插图b中显示的凝胶。piggybac基序的存在生成了820bp的dna片段。采用引物td1445)diag6-pb3(gtgccaaagttgtttctgactgac;seqidno:18)和td154)diag-k10-1(cacttaagcgacaagtttggccaac;seqidno:19)的pcr反应产生了图3插图c中显示的凝胶。piggybac基序的存在生成了972bp的dna片段。采用引物td1312)diag7-pb3(ccctagaaagataatcatattgtgacg;seqidno:20)和td677)diag2-hr5(catacttgattgtgttttacgcgtag;seqidno:21)的pcr反应产生了图3插图d中显示的凝胶,piggybac基序的存在生成了470bp的dna片段。来自ox3864a、ox3647q、未解析的阳性对照ox3647以及两个阴性对照(wttoliman和水)的pcr产物在带有smart梯度(eurogentec,从上往下的带尺寸:10kb、8kb、6kb、5kb、4kb、3kb、2.5kb、2kb、1.5kb、1kb、800bp、600bp、400bp、200bp)的1%凝胶上跑胶。
在插入和切除分析后,进一步试验了品系ox3864a和ox3647q的生活史参数,与它们的来源toliman野生型品系以及温度敏感的致死性(tsl)vienna8品系(参照)比较。tsl为遗传定性品系(geneticsexingstrain)t(y;5)101,也称为vienna-8(无臂间倒位d53)(caceres,2002),基因渗入目前在全世界用在很多昆虫不育技术(sit)计划中的tolimanwt。所进行的试验的细节在下文给出。图4中显示了曲线图。表2中给出了适合度指数(fitnessindice)。
寿命
在21℃和相对湿度(r.h.)50%下在6个重复塑料笼子(9cmx9cmx9cm)中进行寿命试验,每个笼子含有相同基因型的30个雄性和30个雌性(1只昆虫/8.1cm2)。三只笼子随机分配给无食物和无水的“压力”试验。这用来评估对羽化时可获得的营养物储量的相对测量,一个在释放条件下重要的潜在寿命指示者。剩余的笼子具有充分供应的食物和水。每天监测笼子,移除死亡成体并辨识性别,直至所有的蝇都死亡,符合fao/iaea/usda指南。
与提供食物和水的那些相比,保持在压力条件下的蝇具有显著缩短的生命期(logrank检验χ21=1307,p<0.001);所有的压力蝇在6天内死亡(图4d)。在给予食物和水的非压力笼子中,基因型对存活有显著影响(即ridl对比野生型和tsl;χ23=15.6,p<0.001;图4b)。性别对寿命没有显著影响(χ21=0.17,p=0.68),因此组合两种性别的存活数据。在压力条件下,与wt相比,两性别中ox3647q都显示了显著更高的存活率(均值±标准差:wt=4.1天±0.054;ox3647q=4.38天±0.066;cox比例风险:z=-2.1,p=0.035)。但是,充足食物、非压力条件下该模式是反转的(wt=18.9天±0.52;ox3647q=13.7天±0.53;z=5.92,p<0.01)。与wt相比,ox3864a和tsl蝇平均生命期无显著差异,无论是压力还是非压力处理(压力处理:ox3864a=4.13天±0.055;z=0.59,p=0.55,tsl=4.13天±0.064;z=0.53,p=0.33;充足食物,非压力处理:ox3864a=17.2天±0.53;z=1.13,p=0.26,tsl=17.0天±0.52;z=0.7,p=0.49)。
雌性终身产卵力
从上述的非压力笼子中,在24小时期间收集卵并在解剖显微镜下计数。然后将卵样品在湿润的whatman滤纸(fisherscientific)上孵育,并用封口膜封在培养皿中(每个培养皿200个卵,每个种系一共600个卵)。在收集卵72小时后,打开培养皿并在解剖显微镜下检查,以便对空卵壳和未孵化卵壳计数并比较。
来自“非压力”笼子的每个笼子每天的卵产量随时间显著下降(重复测量anova:f1.6,12.9=253.04,p<0.001)并且基因型有显著影响(f4.8,12.9=5.19,p=0.008)。用bonferroni校正的成对比较揭示,与wt比较,ridl和tsl种系二者终身产生了显著更少的卵(wt平均终身卵产量=4315±48.51;ox3864a=3470±226,p<0.014;ox3647q=2593±147,p<0.001;tsl=2465±93.29,p<0.001)。与ox3864a相比,ox3647q和tsl品系也产生了显著更少的卵(ox3647q对比wt,p<0.001;tsl对比wt,p=0.005,图4d)。
通过记录每天死亡率,也可能估计每只雌性年龄特异的卵产量。与上文一致,也显示产卵力随时间显著下降(重复测量anova:f1.9,15.2=131.85,p<0.001)。但是,基因型对这种下降无显著影响(f5.7,15.2=2.19,p=0.104,图4c)。在峰值产卵力(第10天)时产下的卵的数量的单因素anova也揭示任何种系之间在每只雌性产卵方面无显著差异(f3,8=0.029,p=0.97),支持了这一点。
卵孵化率
年龄对孵化率有显著影响(重复测量anovaf5,40=207.3,p<0.001),基因型也有显著影响(f15,40=4.52,p<0.001,图4e)。用bonferroni校正的成对比较显示,ox3647q和tsl,而不是ox3864a,具有显著低于wt的平均卵孵化率百分比(wt=89.56%±0.84;ox3647q=79.11%±0.84,p<0.001;tsl=78.33%±0.84,p<0.001;ox3864a=87.11%±0.84,p=0.247)。
成体羽化率
来自每个种系的300个蛹保持单个,并监测羽化。在记录前检测成体性别和可见的畸形。对未羽化或部分羽化的蛹壳计数,并舍弃。
种系间在成体羽化率方面也有显著差异(anova::f3,10=9.89,p<0.001)。tukeyhsd事后检验揭示,这可主要归因于与wt相比ox3647q中显著较低的成体羽化率(wt=86.1%±0.69;ox3647q=75.7%±2.43,p<0.01;ox3864a=84.7%±0.91,p=0.9;tsl=81.2%±1.04,p=0.25)。基因型对成体性别比例有显著影响(f3,10=5.06,p=0.036),可归因于ox3647q中而不是其它种系中雄性与雌性性别比例的差异(tukeyhsd事后检验:wt=47%±1.8;ox3647q=54%±1,p=0.035;ox3864a=55%±2.3,p=0.055;tsl=50%±1.5,p=0.83)。
适合度指数
从各个生活史部分,计算了每只雌性(r0)的净繁殖率和平均时代时间(g)(从一代到下一代跨雌性繁殖力峰值)(表2)。然后从这些评估衍生每只雌性的适合度指数(r)。wt的r值为0.195,这等于每只雌性每天平均贡献0.195只雌性到下一代。其它的种系具有较低的适合度指数(ox3864a:r=0.187,ox3647q:r=0.176,tsl:r=0.165)。
表2.从生活史数据计算的品系ox3864a、ox3647q、野生型和tsl的适合度指数。
ox3864a和ox3647与野生型toliman蝇的交配竞争力
成体ox3864a、ox3647q、tolimanwt从无tet、低密度(1个幼虫/0.5g培养基)饲养的幼虫获得。在牛津大学动物学系(oxford,uk)的温室内构建了野外笼子(1.25m高,底部0.5m2),内部放置有小橘子树(~1m高),实验在8月进行(日出06.00),采用自然光和稳定的温度和湿度(25℃,50%r.h.)。来自ox3864a或ox3647q的30个雄性与30个wt雄性在06:30放置在一起,30分钟后引入30个雌性。
在地中海实蝇中求偶和交尾的基本顺序是被充分表征的,遵循独特的雄性行为模式顺序(cayol等,2002),由“信息素呼叫”和翅膀快速震动组成。在求爱之后,雄性将跳至雌性上,如果发生了成功的插入,则该对将通常保持静止。交尾通常持续90至195分钟。在插入后从笼子中移除交配对,并小心地引入水平放置的1.5mleppendorf管中。记录交尾起始时间,并且仅在转移至eppendorf管后该对交配>30分钟时才将交尾评分为成功的。从数据中除去短交尾(<15分钟),因为它们经常未产生精子转移。该交配实验在起始后9小时结束(16:00)或者所有的雌性都已交尾时结束,以较早者为准。对交配雄性的鉴别是通过在荧光显微镜下是否存在dsred2荧光标记物而对雄性评分来确定的。每个种系进行10次重复试验。分别对ox3864a和ox3647q评估了167和237对配偶。
将相对不育指数(rsi)用作对雄性性竞争力的衡量(mcinnis等,2002;fao/iaea/usda,2003)。rsi的范围在0到1之间,rsi为1表示100%的转基因雄性交配,值为0表示100%的wt,0.5表示相等数量的交配。结果显示,相对于wt雄性,转基因品系在都没有显示出显著的竞争力降低(t检验:ox3864a:rsi0.46±0.08,t18=-2.09,ox3864a交配的雄性n=77,wt交配的雄性n=90,p=0.05;ox3647q:rsi0.47±0.09,t18=-1.72,ox3647q交配的雄性n=112,wt交配的雄性n=125,p=0.1)。
起初与wt或fsridl雄性交配的雌性之间在雌性再交配频率方面未看到显著差异(fisher精确检验:ox3864a:χ21=0.82,n=40,p=0.775;7只先与ox3864a雄性交配的雌性再交配,8只先与wt雄性交配的雌性再交配;ox3647q:χ21=0,n=40,p=1,12只先与ox3647q雄性交配的雌性再交配,12只先与wt雄性交配的雌性再交配)。对于那些先与ridl雄性交配而再交配的雌性而言,第二雄性的基因型对再交配频率无影响(ox3864a:χ21=0.58,p=0.4(先与ox3864a交配接着与wt再交配的雌性n=3,与ox3864a再交配的雌性n=4;先与wt交配接着与wt再交配的雌性n=5,与ox3864a再交配的雌性n=3);ox3647q:χ21=0.17,p=0.5(先与ox3647q交配接着与wt再交配的雌性n=6,与ox3647q再交配的雌性n=6,先与wt交配接着与wt再交配的雌性n=7,与ox3647q再交配的雌性n=5))。
尽管两种地中海实蝇品系与tslvienna8品系和wttoliman品系相比都显示出良好的饲养和交配特征,但品系ox3864a表现超过品系ox3647q,因此选为主导地中海实蝇产品品系。
实施例2:品系ox3864a的分子表征
用于特异鉴定品系ox3864a的基于pcr分析
为了对ox3864a品系进行质量控制并监测野外使用,开发了事件特异的、基于pcr的核苷酸检测测定。这种测定的规程显示在以下实施例4中,所用的引物描述在表3中。
表3.
每个转基因检测引物对包括一个在转基因内退火的引物和一个在ox3864的旁侧基因组dna内退火的引物。因此,只有当转基因整合进为ox3864描述的基因组位置,才会扩增适当大小的带。引物对tg1和tg2靶向转基因相反末端处的旁侧dna。将扩增内源adh基因的片段的引物对用作阳性对照,以确保用在测定中的基因组dna的质量。
来自基于pcr测定的结果显示在图5中。ox3864样品显示了对tg1和tg2所预期的591bp和523bp带,而wt和水样品为阴性的。所有的基因组样品都显示了使用adh引物所预期的的491bp产物,显示基因组dna对于pcr扩增有足够的质量。
特异检测所整合的转基因和旁侧序列的接合处的taqman测定
这种测定被开发来检测所整合的转基因与地中海实蝇gdna的接合处的序列,其代表了用于ox3864的独特指纹。这种测定被开发为采用3种特异寡核苷酸来检测一个接合处(表4)。引物中的两个使得能扩增98bp(52bp的旁侧gdna+46bp的转基因)的片段,第三、双标记的[5’报告物(fam)-3’淬灭物(bhq1)]寡核苷酸即探针与该片段退火。该探针特异地横跨所扩增的pcr产物中的整合序列与旁侧dna的接合处,需要这种边界用于阳性输出。在pcr扩增的每个步骤中,taq聚合酶的5'-3'外切酶活性从退火的探针释放5'荧光报告物(fam),导致在带有ox3864dna的样品中积累性发射,这在实时pcr仪器中可检测到。用在该测定中的引物和探针显示在表4中。
表4.
品系ox3864a上的质粒骨架分析
质粒骨架在本品系基因组中的存在通过采用退火至piggybac元件的引物的pcr来核实:
pb5out(ctctggacgtcatcttcacttacgtg)(seqidno:13)和
pb3out(ctcgatatacagaccgataaaacacatgc)(seqidno:14),如果质粒骨架存在,这产生4045bp的片段。结果显示在图6中。在所有试验的蝇样品中都证实完全不存在任何质粒骨架序列。
品系ox3864a中沉默转基因插入
通过pcr分析研究本品系中沉默插入的可能性。将野生型雄性与ox3864a杂合雌性杂交,反之亦然,比例为1:3(雄性:雌性)。将下一代饲养成蛹,并筛选荧光。将1000个非荧光个体保持在-20并通过pcr分析。
结果显示在图7中。使用用于扩增野生型序列的引物以确保所分析的dna样品的质量。包括掺杂有1只杂合蛹的9只野生型蛹阳性对照,连同阴性对照水。将pcr产物在带有smart梯度(eurogentec,从上往下的带尺寸:10kb、8kb、6kb、5kb、4kb、3kb、2.5kb、2kb、1.5kb、1kb、800bp、600bp、400bp、200bp)的1%琼脂糖凝胶上跑胶。
实施例3:品系ox3864a的野外试验
与来自地中海地区的野生地中海实蝇的交配竞争
根据fao/iaea/usda指南(fao/iaea/usda,2003),进行了各品系和wt雄性竞争性交配wt雌性试验。为了试验雄性在雌性中诱导再交配不应性的能力,基于它们的最初交配选择(wt或oxitec雄性)将交配过的雌性分开成40只的两组,然后在第二天将它们再暴露于相等数量的wt和oxitec雄性。该过程进行3天,针对笼子每天9小时对交配评分。如上文所述,在交配期间将交配对移出,再次通过筛选荧光对雄性进行基因分型。为了与野外来源的蝇的交配竞争试验,从克里特伊拉克利翁省(heraklionprovince,crete)的无杀虫剂橘子树收集的受侵袭橘子回收蛹。在羽化后立即将野外来源的成体按性别分开。野外来源的蝇保持在25℃,50%相对湿度(r.h.)10至13天,以达到性成熟。开始试验前,让所有的蝇都适应温室的自然光和温度条件至少24小时。每个实验在日出后1小时开始,持续至少9小时。在克里特大学(universityofcrete)温室设施中进行交配试验。ox3864a交配竞争试验重复进行7次,评估了89对。
当与来自克里特的野外来源地中海实蝇交配时,ox3864a蝇的平均rsi值为0.45±0.13(t检验:t12=-0.9,n=89,p=0.38),在ox3864a和野外来源雄性之间的交配竞争没有给出显著差异的证据。
稳定野生型种群的笼内抑制
在4个大的野外笼子中建立了稳定的wt地中海实蝇种群,随机选择两个笼子作为“处理”笼子,除了向笼子添加正常数量的蛹之外,还每周释放大约1500只ridl雄性。该规程是基于wisedevaldez等人的。该基于温室的野外笼子每个为8m3,每个含有1.5m高的柠檬树,被设置在伊拉克利翁的克里特大学,利用自然光和稳定的温度和湿度(c.25℃,50%r.h.,)。笼子含有3种食物和水源,以及两个装有去离子水的产卵盆(每天清空),每个带有两个40cm2的产卵表面。
在8周期间,通过每周将固定数量的蛹引入每个笼子建立wt种群(第一周200个,第二周300个,第三周180个,之后的第4至8周230个)。前4周的蛹添加源自wt储备群,之后所有的蛹添加来自在产卵盆中获得的卵并在作为蛹再引入野外笼子之前在实验室以低密度饲养(1只幼虫/0.5g培养基)。每天从产卵盆对卵数量计数,而成体数量每周计算一次。
在第7周时,笼子随机的分为处理或对照。从第8周往后,ridl处理笼子每周接收1700个无tet饲养ox3864a蛹(导致每周添加大约1,500只成体雄性)。基于对笼子种群的估计(1500只雄性释放进具有大约220只wt雄性的种群的笼子)以及每周补充比例大概15:1(ox3864a对wt雄性),这产生了在第8周~7ox3864a雄性对1只wt雄性的最初比例。一旦开始引入ox3864a,让返回至处理笼子的蛹与其蛹产生速率成比例,而对照笼子为此计算提供稳定的每周蛹返回系数。例如,在第16周从对照笼子回收的蛹的平均数量为300。因为返回至对照笼子设置为恒定的每周230个,所以返回至所有笼子的蛹的数量占所发育的所有蛹的比例通过(230/300=0.76)的系数设置。例如,在相同周,处理笼子之一产生了一共126个蛹。返回至该笼子的蛹的数量(采用该系数)因此为96个(126×0.76)。这种方法使得能依赖于产卵量和蛹存活率进行动态蛹返回,并反映了所产卵的数量和ridl对雌性幼虫存活率的作用。结果显示在图8中。
与对照笼子中卵产量的持续稳定的速率相比,在处理笼子中到ridl释放后(pr)7周前观察到每周卵产量的突然下降,并持续至22周前最终两个处理笼子中野生型种群的最终消失(如通过两周无卵产量来评估的)(图8a)。这是由于返回的带有ox3864a转基因的后代的比例在处理笼子中增加,导致雌性种群的快速下降(图8b)。通过对返回蛹筛选存在dsred2荧光标记物(从所有产生的蛹中随机选择)来监测处理笼子种群中的转基因频率。在pr8周前处理笼子的返回后代中转基因的频率为100%(图8c),在pr14周前认为两个笼子是灭绝的(灭绝定义为两个连续周0卵产量)。
实施例4:ox3864转基因的检测规程
该测定用于检测各种ox3864昆虫样品(野外的、大量饲养的以及实验室的)中是否存在ox3864转基因。该相同规程也可用于提供ox3864转基因随时间而稳定的证据。随时间成功扩增ox3864转基因提供了其稳定性的证据,因为一个引物退火至该转基因,另外的退火至旁侧基因组序列,所以该转基因的变动会导致阴性pcr。
a.材料
purelink基因组提取试剂盒(invitrogen提供)
biotaqdna聚合酶(pcrbiosystems)
c部分描述的引物(由lifetechnologies合成)
10x牛血清白蛋白(bsa,newenglandbiolabs)
smart梯度200bp-10kb(eurogentec)
milli-q去离子纯化水
琼脂糖(webscientific)
tris-乙酸-edta溶液(10xtae)
溴化乙锭
6xgel上样溶液(包含30%甘油,0.25%溴酚蓝)
b.设备
biometra热循环仪(t3000)
gilson移液抢,
枪头,
96孔微量滴定板或0.2mlpcr管,adhesive盖板或8孔条状盖,
2ml微量离心管,
凝胶电泳槽,电源组,灌胶架和梳子。
紫外线(uv)观察系统。
c.方法
i.基因组dna的提取
采用以下的规程(在td/sop/00142中也可找到),使用invitrogenpurelink基因组提取试剂盒从单个的昆虫分离基因组dna。
1.根据每个标签上的说明,向purelinktm基因组洗涤缓冲液1和purelinktm基因组洗涤缓冲液2添加96-100%乙醇。充分混合。在标签上标记所添加的乙醇。将两种含有乙醇的洗涤缓冲液保存在室温。
2.将水浴或恒温仪设为55℃。
3.将180μlpurelinktm基因组消化缓冲液和20μl蛋白酶k添加至腹部池。用无菌研磨棒破碎昆虫样品。使用后,在洗涤和高压灭菌之前将研磨棒置于卫康(irkon)杯中至少24小时。确保组织完全浸没在缓冲液混合物中。
4.在55℃温浴,不时涡旋振荡,直至完全裂解(1至4小时)。你可以进行消化过夜。
5.为了除去任何颗粒物质,室温下以最大速度离心裂解液3分钟。将上清液转移至新微粒离心管。
6.向裂解液添加20μlrna酶,通过短暂涡旋振荡充分混合,并在室温下温浴2分钟。
7.添加200μlpurelinktm基因组裂解/结合缓冲液,并通过涡旋振荡充分混合以得到均一溶液。
8.向裂解液添加200μl的96-100%乙醇。通过涡旋振荡充分混合以得到均一溶液。裂解/结合缓冲液和100%乙醇可在添加前混合。
9.取出来自试剂盒的收集管(collectiontube)中的purelinktm离心柱。向该离心柱添加以purelinktm基因组裂解/结合缓冲液和乙醇制备的裂解液(~640μl)。
10.室温下将该柱以10,000×g离心1分钟。弃去收集管,将离心柱放进试剂盒内提供的清洁purelinktm收集管内。
11.向该柱添加用乙醇制备的500μl洗涤缓冲液1。室温下将该柱以10,000×g离心1分钟。弃去收集管,将离心柱放进试剂盒内提供的清洁purelinktm收集管内。
12.向该柱添加用乙醇制备的500μl洗涤缓冲液2。室温下以最大速度离心该柱3分钟。弃去流出液并再以10,000xg再旋转1分钟。
13.将该离心柱置于无菌1.5-ml微量离心管中。向该柱添加100μlpurelinktm基因组洗脱缓冲液。
14.室温下温浴1分钟。室温下以最大速度离心该柱1分钟。
16.取出并弃去该柱。将dna用于希望的下游应用或者在4℃(短期)或-20℃(长期)保存该纯化的dna。
17.在实验室记录本中记下所有细节。
ii.pcr规程
引物来自oxitec目录;编号指oxitec内部引物目录,由lifetechnologies非现场合成
采用pcrbio聚合酶通过pcr如下扩增转基因特异的和actin4内源基因序列:
ox3864转基因引物:
1087)frtnhef(ggtgtggctagctcgaagaagttcctattccgaagttcc;seqidno:7)和1272)3864frtflf(caacgagtgacagcaatgatattccttac;seqidno:6)产生532bp的产物。frtnhef退火至该转基因,而3864frtflf退火至该转基因的旁侧基因组序列。这种引物对仅扩增含有ox3864转基因的样品。
adh对照引物:
包括进引物对以检查对地中海实蝇基因组dna的扩增,作为内部对照。引物为1131)ccadh2rtf(gaaagctgttcgggcttcaggc;seqidno:8)和1132)ccadh2rtr(cttggaggtgatgtcgaatttggtg;seqidno:9),产生491bp的产物。
按它们在下面出现的顺序添加以下成分至微量离心管,制备pcr主混合物(mastermix)(对于样品数加额外的1至5个是足够的,以便允许有移液错误):
将18μl主混合物移液进每个pcr管或86孔板的孔中。
添加2μlgdna模板。
模板包括已知的ox3864纯合gdna样品阳性对照(来自大量饲养的储备,或之前已知为阳性的)、野生型gdna样品阴性对照和milli-q水阴性对照。
采用以下程序在biometrat3000热循环仪上运行pcr:
1.94℃2min
2.94℃15s
3.60℃30s(每个循环降温0.5℃)
4.72℃15s转至步骤2x10个循环
5.94℃15s
6.55℃30s
7.72℃15s转至步骤5x25个循环
8.72℃7mins
9.4℃保持
将8μl的pcr产物与1.5μl凝胶上样缓冲液(30%甘油,含0.25%溴酚蓝)混合,在1%琼脂糖凝胶上(见下文)以120v跑胶25分钟,用于观察。在凝胶的每一端加样eurogentecsmart梯度。采用uvitec凝胶观察系统观察凝胶并拍照。
iii.琼脂糖凝胶制备
将1g琼脂糖与100ml1xtae缓冲液混合,微波溶解约2分钟,在冷流动水下冷却30秒,添加1.5μl1%溴化乙锭,然后倒入灌胶架,让其凝固。
参考文献
caceres,c.(2002)."massrearingoftemperaturesensitivegeneticsexingstrainsinthemediterraneanfruitfly(ceratitiscapitata)”.genetica,116:107-116.
candéc,cecconif,dessenp,kroemerg.(2002)."apoptosis-inducingfactor(aif):keytotheconservedcaspase-independentpathwaysofcelldeath?”.jcellsci.,115(24):4727-34.
cayolj.p.,etal.2002."recentfindingsonmedflysexualbehaviour:implicationsforsit”.floridaentomologist,85(1):171-181.
choij.andguarinoa.(1995).“thebaculovirustransactivatorie1bindstoviralenhancerelementsintheabsenceofinsectcellfactors”.journalofvirology,69(7):4548-4551.
dafa'allat.h.,condong.c.,condonk.c.,phillipsc.e.,morrisonn.i.,jinl.,eptonm.j.,fug.l.,alpheyl.(2006).“transposon-freeinsertionsforinsectgeneticengineering”.natbiotechnol,24(7),820-821.(doi:10.1038/nbt1221).
fao/iaea/usda.2003productqualitycontrolandshippingproceduresforsterilemass-rearedtephritidfruitflies.vienna,austria:internationalatomicenergyagencyiaea.
fug.l.,condonk.c.,eptonm.j.,gongp.,jinl.,condong.c.,morrisonn.i.,dafa'allat.h.,alpheyl.(2007).“female-specificinsectlethalityengineeredusingalternativesplicing.natbiotechnol,25(3),353-357.(doi:10.1038/nbt1283).
gongp.,eptonm.j.,fug.l.,scaifes.,hiscoxa.,condonk.c.,condong.c.,morrisonn.i.,kellyd.w.,dafa'allat.,etal.(2005).“adominantlethalgeneticsystemforautocidalcontrolofthemediterraneanfruitfly”.natbiotechnol,23(4),453-456.
handlera.m.andharrelr.a.(2001)“polyubiquitin-regulateddsredmarkerfortransgenicinsects”.biotechniques31,820-828
harrisa.f.,nimmod.,mckemeya.r.,kellyn.,scaifes.,donnellyc.a.,beechc.,petriew.d.&alpheyl.(2011).“fieldperformanceofengineeredmalemosquitoes”.naturebiotechnology29(11):1034-1037
hornc,wimmerea.(2003).“atransgene-based,embryo-specificlethalitysystemforinsectpestmanagement”.natbiotechnol.,21(1):64-70.
huang,q.,deveraux,q.l.,maeda,s.,salvesen,g.s.,stennicke,h.r.,hammock,b.d.andreed,j.c.(2002).“evolutionaryconservationofapoptosismechanisms:
lepidopteranandbaculoviralinhibitorofapoptosisproteinsareinhibitorofmammaliancaspase-9”.agriculturalsciences97(4):1427-1432.
mcinnis,d.o.,rendonp.,komatsuj.(2002)matingandrematingofmedflies(diptera:tephritidae)inguatemala:individualflymarkinginfieldcages”.floridaentomologist85(1):126-137
mumford,j.(2012)."science,regulation,andprecedentforgeneticallymodifiedinsects”.plosnegltropdis,6(1).
olson,m.r.,holley,c.l.,gan,e.c.,colon-ramos,d.a.,kaplan,b.andkornbluth,s.(2003).“agh3-likedomaininreaperisrequiredformitochondriallocalizationandinductionofiapdegradation”.j.biol.chem.,278(45):44758-44768.
pane,a.,salvemini,m.,dellibovi,p.,polito,c.,andsaccone,g.(2002).“thetransformergeneinceratitiscapitataprovidesageneticbasisforselectingandrememberingthesexualfate”.development,129,3715-3725.
simmonsg.s.,mckemeya.r.,morrisonn.i.,o’connells.,tabashnikb.t.,clausj.,fug.,tangg.,sledgem.,walkera.s.,phillipsc.e.,d.miller,roser.i.,statenr.t.,donnellyc.a.,alpheyl.(2011)fieldperformanceofageneticallyengineeredstrainofpinkbollwormplosone6(9):e24110
valdezdem.r.w.,nimmod.,betzj.,gongh.f.,jamesa.a.,alpheyl.,blackw.c.(2011).“geneticeliminationofdenguevectormosquitoes”.procnatlacadsciusa108(12),4772-4775.
vernooy,s.y.,copeland,j.,ghaboosi,n.,griffin,e.e.,yoo,s.j.andhay,b.a.(2000).j.cellbiol.150(2):f69-f75.
white,k.,tahoaglu,e.andsteller,h.(1996).“cellkillingbythedrosophilagenereaper”.science,271(5250):805-807.
wing,j.p.,zhou,l.,schwartz,l.m.andnambu,j.r.(2001).“distinctcellkillingpropertiesofthedrosophilareaper,headinvolutiondefective,andgrimgenes”.celldeathdiffn5(11):930—939.
- 还没有人留言评论。精彩留言会获得点赞!