核酸导入方法、核酸检测方法、生物体成分解析方法、生物体成分定量用阵列器件及生物体成分解析试剂盒与流程
本发明涉及核酸导入方法、核酸检测方法、生物体成分解析方法、生物体成分定量用阵列器件及生物体成分解析试剂盒。
本申请基于2014年11月4日在日本提出申请的日本特愿2014-224639号和2015年2月6日在日本提出申请的日本特愿2015-022624号主张优先权,在此援引其内容。
背景技术:
以往已知通过对生物体分子进行解析来进行疾病或体质的诊断。例如已知利用单核苷酸多态性(singlenucleotidepolymorphism:snp)解析进行的体质诊断、使用体细胞突变解析进行的抗癌剂的给药判断、利用病毒的蛋白质或dna解析进行的感染症对策等。
例如教示了:在癌症的治疗药中,通过在egfr-tki(酪氨酸激酶抑制剂)的给药前后对突变型egfr(表皮生长因子受体)的拷贝数进行定量,可以成为治疗效果的指标。一直以来进行使用实时pcr的定量,但已知检查中使用的核酸总量变化会对定量性造成影响,现在开发了核酸的总量不会影响定量性的数字pcr技术。
数字pcr技术是指如下的技术:将pcr反应试剂和核酸的混合物分成多个微小液滴,对这些微小液滴进行以混合物中的核酸中成为检测对象的核酸为模板的pcr扩增,从而由含模板核酸的微小液滴检测由pcr扩增产生的荧光等信号,求出微小液滴总数中检测到信号的微小液滴的比例,由此对试样中的核酸进行定量。
例如在专利文献1及非专利文献1中示出了:通过在具有微少量容积的微小空间内进行酶反应,利用数字pcr可以进行生物体物质检查。
作为数字pcr中使用的微小液滴的制作方法,已知通过用密封液将试剂和核酸的混合物分割来制作微小液滴的方法;在基板上开的孔中放入试剂和核酸的混合物之后用密封液将孔密封,从而制作微小液滴的方法等。另外,专利文献2中公开了为了用少量的试剂在短时间内获取大量的实验数据而在微腔室内制造乳液的方法。
数字pcr中,按照1个微小液滴中存在的模板核酸达到1个或0个的方式,对pcr反应试剂和核酸的混合物进行稀释。数字pcr中,为了提高核酸扩增的感度、并且为了对多个微小液滴同时进行核酸扩增,优选各微小液滴的体积小。例如在非专利文献1中公开了按照各孔的容积达到6nl的方式形成的微阵列状反应容器。另外,专利文献2中公开了如下方法:对在流路内形成有多个深度为3μm、直径为5μm的孔的微阵列向流路内流过试样而将试样导入各孔中之后,利用密封液将流路内的剩余试剂挤出,从而将试样导入到各孔内。
现有技术文献
专利文献
专利文献1:日本特表2003-511009号公报
专利文献2:日本专利第4911592号公报
非专利文献
非专利文献1:plosone,3(8),e2876,(2008)
非专利文献2:labonachip,doi:10.1039/c21c40632b,(2012)
技术实现要素:
发明要解决的技术问题
但是,上述非专利文献1、2所公开的技术中,当在孔内进入气泡时,需要将气泡从各孔中除去,为了进行精度良好的定量分析,需要繁琐的操作。
本发明鉴于上述事实而完成,本发明的目的在于提供在孔内难以进入气泡的核酸导入方法(生物体成分导入方法)、以及利用简便的操作即可进行精度良好的定量分析的核酸检测方法、生物体成分解析方法、生物体成分核酸定量用阵列器件及生物体成分解析试剂盒。
用于解决技术问题的方法
本发明第一方式的生物体成分定量用阵列器件具备:具有多个孔的基材部;与所述基材部之间具有空隙且按照将所述多个孔的开口部分覆盖的方式置于所述基材部上的盖部;连通于所述基材部与所述盖部之间的所述空隙的注入口部;以及形成在远离所述注入口部的位置上且连通于所述基材部与所述盖部之间的所述空隙的排出口部,通过在所述基材部与所述盖部之间填充水性溶液之后,将含有生物体成分的液体从所述注入口部导入到所述基材部与所述盖部之间的所述空隙内,从而将所述水性溶液中位于所述多个孔外的剩余溶液从所述排出口部排出,所述生物体成分通过扩散移动至所述水性溶液中位于所述多个孔内的孔填充水性溶液中。
还可具备填充在所述基材部与所述盖部之间的所述水性溶液。
所述多个孔和所述盖部的至少任一个还可具有透光性。
还可以所述多个孔具有电极,所述基材部具有连接于所述电极的布线和用于将所述布线连接于检测电路的连接器。
还可以在从所述基材部的厚度方向进行观察时不与所述注入口部及所述排出口部重叠的区域内设定有具有所述多个孔、进行信号放大反应的区域。
还可以进一步具备与所述排出口部相连通、液体从所述基材部与所述盖部之间的所述空隙通过所述排出口部流入并储存的废液容器部。
还可以在从所述基材部的厚度方向进行观察时不与所述注入口部、所述废液容器部及所述排出口部重叠的区域内设定有具有所述多个孔、进行信号放大反应的区域。
本发明第二方式的生物体成分解析试剂盒具备上述方式的生物体成分定量用阵列器件、针对所述生物体成分的检测反应试剂、以及能够从所述注入口部送液至所述基材部与所述盖部之间的油性密封液,所述水性溶液是不含核酸的缓冲液。
本发明第三方式的核酸导入方法为向在流路内形成多个孔且在所述流路内及所述多个孔内填充有水性溶液的核酸定量用阵列器件中的所述流路内送液含有模板核酸的混合液,使送液至所述流路内的混合液扩散至所述多个孔内的所述水性溶液中。
还可以通过将油性密封液送液至所述流路内、利用所述油性密封液将所述多个孔内的所述混合液及所述水性溶液密封,从而将所述多个孔制成多个独立的核酸检测反应容器。
还可以所述混合液含有信号放大反应试剂,在所述核酸检测反应容器内进行信号放大反应,对所述核酸检测反应容器内进行信号检测。
所述信号放大反应还可以是酶反应。
所述酶反应还可以是等温反应。
所述酶反应还可以是侵入(invader)反应。
所述信号检测还可以通过与所述核酸检测反应容器内的所述模板核酸的有无相对应的荧光、发光、ph变化、吸光度变化及电位变化中的至少1个的检测来进行。
本发明第四方式的生物体成分解析方法是使用了上述第三方式的核酸检测方法的生物体成分解析方法,其中,所述混合液含有成为解析对象物质的dna、rna、mirna、mrna或蛋白质中的任一者,具有针对所述解析对象物质的特异性标记能力的标记物质以所述模板核酸含有在该标记物质中或者所述模板核酸能够结合于该标记物质的状态、含有在所述混合液和所述水性溶液中的至少任一者中。
所述标记物质还可以含有与所述模板核酸不同的dna链、酶、粒子、抗体及脂质体中的至少1个。
发明效果
根据本发明的上述方式,可以提供在孔内难以进入气泡的核酸导入方法(生物体成分导入方法)以及利用简单的操作即可进行精度良好的定量分析的核酸检测方法、生物体成分解析方法、核酸定量用阵列器件及生物体成分解析试剂盒。
附图说明
图1为本发明第1实施方式的生物体成分解析试剂盒的立体图。
图2为图1的a-a线的截面图。
图3为用于说明该生物体成分解析试剂盒的作用的图。
图4为用于说明该生物体成分解析试剂盒的作用的图。
图5为表示本发明第2实施方式的生物体成分解析试剂盒中的核酸定量用阵列器件的基材部的示意图。
图6为本发明第3实施方式的生物体成分解析试剂盒中的核酸定量用阵列器件的俯视图。
图7为图6的b-b线的截面图。
图8为表示该实施方式(第3实施方式)的变形例(变形例1)的构成的截面图。
图9为表示该实施方式的其它变形例(变形例2)的构成的截面图。
图10为表示该实施方式的另一个其它变形例(变形例3)的构成的截面图。
图11为表示该实施方式的另一个其它变形例(变形例4)的构成的截面图。
图12为表示该实施方式的另一个其它变形例(变形例5)的构成的俯视图。
图13为图12的c-c线的截面图。
图14为表示该实施方式的另一个其它变形例(变形例6)的构成的俯视图。
图15为图14的d-d线的截面图。
图16为表示图14的d-d线的截面的立体图。
图17为表示该变形例(变形例6)的间隔构件的俯视图。
图18a为表示间隔构件的其他构成的俯视图。
图18b为表示间隔构件的其他构成的俯视图。
图18c为表示间隔构件的其他构成的俯视图。
图19为具备该实施方式的其他变形例(变形例6)的微小孔阵列层的基材部的俯视图。
图20为表示该变形例(变形例6)的其他变形例的构成例的截面图。
图21为表示该构成例的立体图。
图22为表示该构成例的间隔构件的俯视图。
图23为表示该变形例的另一个其他构成例的截面图。
图24为表示该构成例的立体图。
图25为表示该实施方式的另一个其他变形例(变形例7)的构成的截面图。
图26为表示该实施方式的另一个其他变形例(变形例8)的构成的俯视图。
图27为图26的e-e线的截面图。
图28为表示该实施方式的另一个其他变形例(变形例9)的构成的截面图。
图29为表示该实施方式的另一个其他变形例(变形例10)的构成的截面图。
图30为表示该实施方式的另一个其他变形例(变形例11)的构成的截面图。
图31为表示该实施方式的另一个其他变形例(变形例12)的构成的截面图。
图32a为表示该实施方式的另一个其他变形例(变形例13)的构成的立体图。
图32b为表示该实施方式的另一个其他变形例(变形例13)的构成的6面图。
图33a为表示该实施方式的另一个其他变形例(变形例14)的构成的立体图。
图33b为表示该实施方式的另一个其他变形例(变形例14)的构成的6面图。
图34为用于说明该实施方式的另一个其他变形例(变形例15)的作用的图。
图35为表示本发明实施例的生物体成分解析结果的照片。
具体实施方式
(第1实施方式)
对本发明第1实施方式的核酸导入方法、核酸检测方法、生物体成分解析方法、生物体成分定量用阵列器件及生物体成分解析试剂盒进行说明。图1为本实施方式的生物体成分解析试剂盒的立体图。图2为图1的a-a线的截面图。图3及图4为用于说明本实施方式的生物体成分解析试剂盒的作用的图。
本实施方式的生物体成分解析试剂盒1是作为用于对生物体成分进行定量的阵列器件(生物体成分定量用阵列器件)的一例、具备可对核酸进行定量的阵列器件(核酸定量用阵列器件2)的试剂盒。
首先对具备本实施方式的核酸定量用阵列器件2的生物体成分解析试剂盒1的构成进行说明。图1所示的本实施方式的生物体成分解析试剂盒1是以可选择dna、rna、mirna、mrna、蛋白质、外来体、脂质体及细胞中的任一者的物质为解析对象物质的试剂盒。具体地说,本实施方式的生物体成分解析试剂盒1是定量地对生物体成分所含的解析对象物质的浓度进行测定的试剂盒。
本实施方式的生物体成分解析试剂盒1具备图1及图2所示的核酸定量用阵列器件2、检测反应试剂11(参照图3)、以及与核酸定量用阵列器件2一起使用的油性密封液12(参照图4)。
如图1及图2所示,核酸定量用阵列器件2具备具有多个孔6的基材部3、盖部7、注入口部8、排出口部9和水性溶液10。
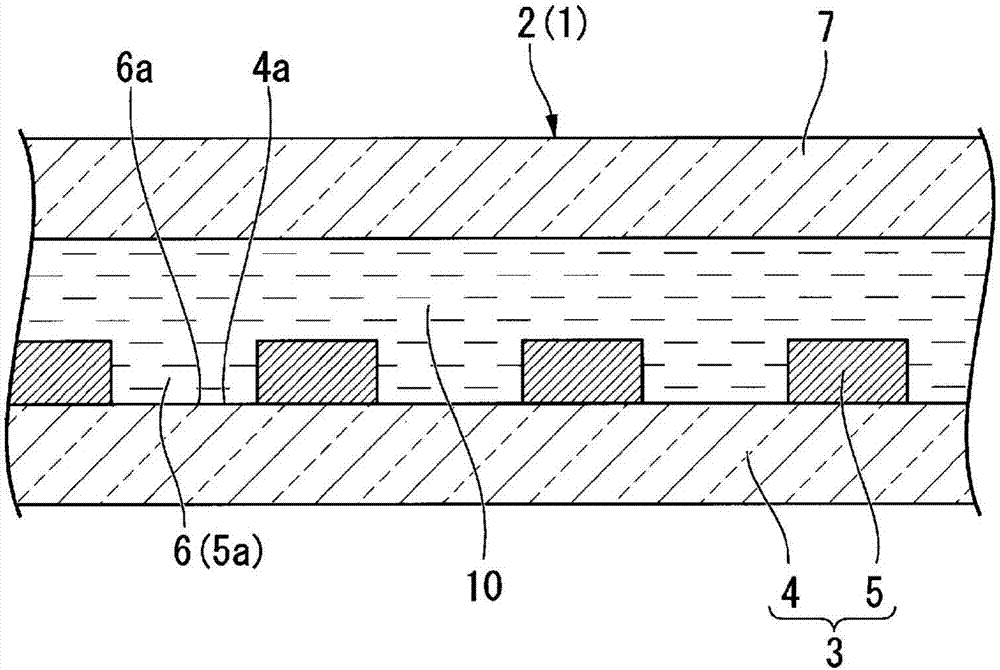
如图2所示,基材部3具备基板4和微小孔阵列层5。
基板4是由实质上透明的材料形成的板状构件。基板4的材质例如为树脂或玻璃。具体地说,基板4还可以由聚苯乙烯或聚丙烯形成。基板4只要是具有利用搬送核酸定量用阵列器件2的装置或者操作者的手工作业进行处理时不会破损的程度的刚性即可。
微小孔阵列层5是并列形成有多个贯通孔5a的层。微小孔阵列层5的层厚为3μm,在微小孔阵列层5与盖部7之间空有100μm的空隙。形成于微小孔阵列层5的各贯通孔5a是直径为5μm、中心线方向的长度为3μm的圆柱形状(贯通孔5a的直径为5μm、中心线方向的长度为3μm时,由1个贯通孔5a形成的微小空间的容量约为100毫微微升(fl))。
各贯通孔5a的容积可以适当地设定,作为一例,各贯通孔5a的容积为10微微升以下。各贯通孔5a之间的中心线间的距离只要是比各贯通孔5a的直径大即可。各贯通孔5a按照在微小孔阵列层5上形成三角格子状的方式而排列。另外,各贯通孔5a的排列方法并无特别限定。
通过微小孔阵列层5上形成的贯通孔5a和基板4的表面4a,在基材部3上构成以基板4为底面部6a的有底筒状的孔6。
微小孔阵列层5的材质可以是树脂或玻璃等。微小孔阵列层5的材质可以与基板4的材质相同,也可以与基板4的材质不同。另外,微小孔阵列层5还可以与基板4以相同材料一体化。另外,微小孔阵列层5还可以与基板4以相同材料一体成型。作为由树脂构成的微小孔阵列层5的材质的例子,可举出环烯烃聚合物、硅、聚丙烯、聚碳酸酯、聚苯乙烯、聚乙烯、聚醋酸乙烯酯、氟树脂、无定形氟树脂等。
其中,作为微小孔阵列层5的例子示出的这些材质不过是个例子,微小孔阵列层5的材质并非限定于这些材质。
例如,可以在玻璃的基板4上使用作为疏水性树脂的环烯烃聚合物形成微小孔阵列层5。这种构成中,由于玻璃基板4的表面为亲水性的,因此在利用侵入反应进行加热、对试样进行分析时,易于在孔6内保持亲水性的试样。
另外,微小孔阵列层5如果由疏水性树脂等疏水性材料形成,由于作为检测对象的生物体分子的疏水性部位易于吸附及保持在疏水性的微小孔阵列层5上,因此生物体分子可效率良好地被微小孔阵列层5捕获、孔6中的生物体分子的检测变得容易。
此外,本实施方式中的疏水性定义为接触角试验中与水的接触角处于70°以上的范围。
另外,作为实施方式中使用的材料的与水的接触角之一例,环烯烃聚合物(cop)与水的接触角为85°、作为疏水性树脂的cytop与水的接触角为110°左右。
其中,接触角试验使用液滴法。
另外,微小孔阵列层5还可以被着色。当微小孔阵列层5被着色时,在孔6内进行使用荧光、发光、吸光度等光的测定时,可减轻来自于接近成为测定对象的孔6的其他孔6的光的影响。
微小孔阵列层5通过对层叠于基板4上的整面图案实施刻蚀、压花形成或切削等加工而成型贯通孔5a。另外,当将微小孔阵列层5与基板4一体成型时,相当于微小孔阵列层5的贯通孔5a的部分通过对基板4实施刻蚀、压花形成或切削等加工来形成。
盖部7按照在基材部3与盖部7之间具有空隙、将多个孔6的开口部分覆盖的方式置于基材部3上。基材部3与盖部7之间成为各种液体流过的流路。本实施方式中,各种液体从注入口部8朝向排出口部9流过基材部3与盖部7之间。
图1所示的注入口部8具有连通于基材部3与盖部7之间的空隙的管路形状。本实施方式中,在盖部7上形成注入口部8。此外,注入口部8也可以形成在基材部3上。
排出口部9在远离注入口部8的位置处连通于基材部3与盖部7之间的空隙。本实施方式中,在基材部3及盖部7中,按照液体从沿着液体的流路方向进行测定时最远离注入口部8的部分中的基材部3与盖部7的空隙漏出的方式构成排出口部9。
此外,排出口部9可以按照在远离注入口部8的位置处具有连接于基材部3与盖部7之间的空隙的管路形状的方式、形成在基材部3或盖部7上并被密封。此时,可以防止存在于基材部3与盖部7之间的液体通过排出口部9蒸发。排出口部9的密封可以利用堵住排出口部9的密封件或塞子来进行。
如图2所示,水性溶液10填充在基材部3与盖部7之间。
水性溶液10是具有能够与含有解析对象物质的试样混合的组成的液体。本实施方式中,水性溶液10是不含核酸的缓冲液。其中,水性溶液10填满在各孔6内即可。即,基材部3与盖部7之间的流路部分的一部分或全部还可以被气体填满。
检测反应试剂11(参照图3、4)是用于针对与解析对象物质有关的模板核酸进行生物化学反应的试剂。针对模板核酸的生物化学反应例如是在模板核酸存在的条件下引起信号放大的反应。本实施方式的检测反应试剂11是使针对模板核酸的酶反应发生的试剂。检测反应试剂11例如可根据能够检测核酸的方法进行选择。例如,invader(注册商标)法、taqman(注册商标)法或荧光探针法或其他方法中使用的试剂可作为本实施方式的检测反应试剂11含有在生物体成分解析试剂盒1中。
油性密封液12(参照图4)是能够从注入口部(参照图1)送液至基材部3与盖部7之间的溶液。油性密封液12可以从不与含解析对象物质的试样混合的材料中选择。本实施方式的油性密封液12为矿物油。
接着,作为本发明第1实施方式的核酸导入方法、核酸检测方法及生物体成分解析方法,示出使用了本实施方式的生物体成分解析试剂盒1的核酸导入方法、核酸检测方法及生物体成分解析方法,同时示出本实施方式的生物体成分解析试剂盒1的作用。
本实施方式中,在生物体成分解析试剂盒1的使用前的状态下,在如图2所示预先在基材部3与盖部7之间填充有水性溶液10的状态下,将注入口部8(参照图1)和排出口部9(参照图1)这两者水密地密封。因此,处于基材部3与盖部7之间的水性溶液10在注入口部8或排出口部9开放之前被封入在基材部3与盖部7之间。
本实施方式中,由于各孔6的容积非常小,因此若在制造核酸定量用阵列器件2时在各孔6内填满水性溶液10,则在使用生物体成分解析试剂盒1之前,即便是多少的振动等传递至核酸定量用阵列器件2,各孔6内的水性溶液10(孔填充水性溶液)也难以被替换成空气。
另外,本实施方式中,若在制造生物体成分解析试剂盒1(核酸定量用阵列器件2)时预先在各孔6内填充水性溶液10,则使用者在使用生物体成分解析试剂盒1时,不需要自生物体成分解析试剂盒1进行脱气的工序,因此使用者可以简单地使用生物体成分解析试剂盒1。
使用生物体成分解析试剂盒1时,作为前处理,利用公知的溶剂适当地将含有解析对象物质的试样稀释。试样的稀释率可以以公知的数字pcr中的稀释率作为参照。另外,对含有解析对象物质的试样进行稀释的溶剂优选是能够与各孔6内所填满的水性溶液10(孔填充水性溶液)混合的组成。另外,在对含有解析对象物质的试样进行稀释的工序中,以规定的浓度混合检测反应试剂11。
以下示出解析对象物质为核酸、以成为解析对象物质的核酸为模板核酸、利用侵入法进行信号放大反应的例子。其中,模板核酸可以是生物体产生的核酸,也可以是pcr(聚合酶链反应)产物等人工物。另外,模板核酸还可以是能够捕获生物体物质的抗体或者标记有抗体的珠粒中的标记核酸。此外,当水性溶液10中含有检测反应试剂11的一部分或全部时,上述前处理中的检测反应试剂11的混合的一部分或全部是不需要的。
首先,开放图1所示的注入口部8及排出口部9,利用例如分配移液管等将含模板核酸的试样和侵入反应用的检测反应试剂11的混合液x通过注入口部8送液至基材部3与盖部7之间的空隙。试样和检测反应试剂11的混合液x按照将多个孔6全部覆盖的方式、在基材部3与盖部7之间的空隙内扩散(参照图3)。另外,通过将试样和检测反应试剂11的混合液x送液至基材部3与盖部7之间的空隙,水性溶液10从排出口部9被排出。此外,此时,当试样和检测反应试剂11的混合液x为与水性溶液10不同的颜色时,可以容易地把握将试样和检测反应试剂11的混合液x送液至基材部3与盖部7之间的哪个部分。
如图3所示,在由基材部3和盖部7构成的流路上,配置有由基板4和微小孔阵列层5形成的多个孔6。填满在多个孔6内的水性溶液10(孔填充水性溶液)维持在保持于各孔6的内表面的状态。因此,试样和检测反应试剂11的混合液x不是与填满于多个孔6内的水性溶液10相调换、而是成为混合液x层叠在水性溶液10上的状态。但是,由于水性溶液10与混合液x能够相互间容易地混合,因此在成为混合液x层叠在水性溶液10上的状态之后,混合液x中的溶质向水性溶液10(孔填充水性溶液)中扩散。
接着,如图4所示,将油性密封液12从注入口部8(参照图1)送液至由基材部3和盖部7构成的流路内。油性密封液12通过在混合液x扩散至水性溶液10的状态下将多个孔6内的液体(孔填充水性溶液)密封,将多个孔6制成多个独立的核酸检测反应容器6a。另外,油性密封液12将在基材部3与盖部7之间的空隙内位于多个孔6外部的液体从排出口部9挤出。
通过上述前处理中的试样稀释,存在于每一个核酸检测反应容器6a中的模板核酸变为1个或0个。试样的浓度过高时,还有每一个核酸检测反应容器6a中有多个模板核酸进入的可能性。
本实施方式中,将侵入反应用的检测反应试剂11和模板核酸根据模板核酸的浓度密封在孔6内(核酸检测反应容器6a内)。在此状态下,利用62℃的烘箱对核酸定量用阵列器件2孵育规定时间。通过用62℃的烘箱对核酸定量用阵列器件2孵育规定时间,在核酸检测反应容器6a内,侵入反应中等温(等温反应)地进行的信号放大优选地进行。
接着,在预先规定的时间之后,将孔6内(核酸检测反应容器6a内)密封有侵入反应用检测反应试剂11及模板核酸的核酸定量用阵列器件2从烘箱中取出,测量具有荧光的核酸检测反应容器6a数及具有该荧光的核酸的荧光量。另外,本实施方式中,核酸检测反应容器6a的荧光的有无可以将相对于自发荧光、超过规定s/n比的荧光量作为阈值。另外,本实施方式中,若利用侵入法进行的信号放大优选地进行、在各核酸检测反应容器6a内信号达到饱和,则具有荧光的核酸检测反应容器6a中的荧光量难以产生大的不均。
如以上所说明,本实施方式的核酸导入方法、核酸检测方法、生物体成分解析方法、核酸定量用阵列器件2及生物体成分解析试剂盒1中,通过将含模板核酸的液体从注入口部8导入到基材部3与盖部7之间的空隙中,将水性溶液10中处于多个孔6外的多余溶液从排出口部9排出,模板核酸通过扩散移动至水性溶液10中处于多个孔6内的水性溶液10(孔填充水性溶液10)中。因此,根据本实施方式的核酸导入方法、核酸检测方法、生物体成分解析方法、核酸定量用阵列器件2及生物体成分解析试剂盒1,模板核酸向各孔6移动时,各孔6内难以进入气泡。
另外,本实施方式中由于各孔6内进入气泡的可能性极低,因此根据本实施方式的核酸检测方法、生物体成分解析方法、核酸定量用阵列器件2及生物体成分解析试剂盒1,可以将能够检测核酸的核酸检测反应容器6a的数量因气泡的存在而产生不均的可能性抑制在较低。进而,当各孔6的容积极小时,可以在无视孔6内的气泡的体积下考虑核酸检测反应的进行在各孔6中不均的可能性,但本实施方式中,由于不需要考虑孔6内存在气泡的可能性,因而不需要将气泡从孔6中除去的操作,利用简单的操作即可进行精度良好的定量分析。
此外,本实施方式中,除了荧光的检测以外,还可以应用将可见光的发光、显色等作为信号进行检测的检测系统。
另外,为了解析蛋白质,也可以适用本实施方式的构成。解析蛋白质时,预先利用dna链等核酸对特异地结合于目标蛋白质的分子进行修饰。此时,通过进行以修饰中使用的dna链等核酸为模板核酸的侵入法的寡核苷酸设计,可以按照本实施方式的信号检测顺序来解析目标蛋白质的有无。成为解析对象物质的物质例如可以是dna、rna、mirna、mrna或蛋白质中的任一者。此时,利用本实施方式的核酸定量用阵列器件2及生物体成分解析试剂盒1定量的物质是修饰中使用的dna链等核酸,从而被该核酸修饰的物质被间接地定量。另外,对特异地结合于目标蛋白质的分子进行修饰的物质并非限定于dna链,只要是产生用于检测的信号的物质即可。例如,可举出荧光珠粒或hpr(辣根过氧化物酶)等。
进而,还可以利用本实施方式的核酸检测方法、生物体成分解析方法、核酸定量用阵列器件2及生物体成分解析试剂盒1对被上述模板核酸修饰了的物质成为标记物质而特异性地结合的物质(成为结合对象的物质)进行解析。此时,被上述模板核酸修饰了的物质可以含有与模板核酸不同的dna链、酶、粒子、抗体及脂质体中的至少一个。
此外,通过代替上述模板核酸,在孔6内将含有发生荧光、可见光或显色反应的生物体来源物质的液体从注入口部8导入至基材部3与盖部7之间的空隙中,从而可以对该生物体来源物质进行定量。
例如,作为解析对象物质被定量的生物体来源物质的例子可举出脂质体、外来体、细胞。通过对特异性存在于这些生物体来源物质中的物质进行荧光标记等标记,可以对这些生物体来源物质进行定量。作为进行这种标记的标记物质,可举出构成要素中含有特异性结合于成为解析对象物质的生物体来源物质的低分子配体或抗体等的物质。
另外,还可以代替通过模板核酸对解析对象物质进行定量、而是使用本实施方式的生物体成分定量用阵列器件对成为解析对象的生物体来源物质本身产生的信号进行检测,由此进行生物体来源物质的定量。
作为这种生物体来源物质的一例,可举出将含有用于表达荧光蛋白的启动子及目标基因等的荧光蛋白表达盒通过转基因组装到染色体及其他基因区域等中而得到的细胞;或者保持包含上述荧光蛋白表达盒的质粒等的细胞。
例如,通过使促进对荧光蛋白表达盒的转录的规定试剂和上述细胞在孔6内成为混合状态来表达荧光蛋白,可以对发出荧光的细胞进行定量。荧光蛋白表达盒还可构建成对应于荧光蛋白以外的基因的表达来进行表达的报告基因的表达盒。此时,可以利用来自报告基因来源的荧光蛋白的荧光,使用本实施方式的生物体成分定量用阵列器件,对在孔6内发生了对应于细胞外配位基的存在等信号传达而表达规定基因的细胞内信号传达的细胞进行定量。
如此,被油性密封液12密封的孔6成为用于对来自生物体来源物质的信号进行检测的独立的信号检测容器,可以进行生物体来源物质的定量。
通过利用上述的定量方法,作为生物体来源物质,也可对生物体内存在的病毒或细胞进行定量。另外,还可以定性地对存在的有无进行确认。
此外,本实施方式的生物体成分定量用阵列器件还可以对并不是生物体成分的物质进行定量。例如,本实施方式的生物体成分定量用器件还可以作为病毒粒子定量用器件来使用。
另外,还可以代替本实施方式公开的侵入法,采用与侵入法不同的、利用使用了信号放大反应试剂的酶反应进行的信号放大。该信号放大反应试剂可以与上述实施方式同样地混合在含有解析对象物质的试样中。
此外,本实施方式中公开了多个孔6的底面部6a和盖部7这两者由实质上透明的材料形成的例子,但只要多个孔6的底面部6a和盖部7中的至少1个具有透光性即可进行多个孔6内的荧光、发光、吸光度等光学检测。
另外,本实施方式中公开了在含有模板核酸的试样为水性(极性)时优选的构成,但当含有模板核酸的试样为油性(非极性)时,优选代替水性溶液10而采用含有有机溶剂等的非极性密封液。进而,当含有模板核酸的试样为油性(非极性)时,为了将孔6密封,优选代替本实施方式所示的油性密封液12而采用极性的置换液。这些溶液的选择要考虑含有模板核酸的试样在溶剂中的溶解容易性以及根据模板核酸及解析对象物的稳定性所选择的溶剂的种类。例如,含有模板核酸的试样为水溶液时,作为密封液可以选择矿物油,在含有模板核酸的试样以矿物油作为溶剂时,密封液可以选择水或水性缓冲液等。
核酸由于是极性分子,因此对非极性溶剂是难溶性的,但例如以蛋白质或脂质作为解析对象物质时,在使得用于解析对象物质定量的标记核酸结合于解析对象物质的状态下,优选除了考虑标记核酸对溶剂的溶解性之外还要考虑解析对象物质对溶剂的溶解性。此时,含有模板核酸(标记核酸)的试样有时用非极性溶剂进行稀释。
(第2实施方式)
接着,对本发明的第2实施方式进行说明。图5为表示本实施方式的生物体成分解析试剂盒中的核酸定量用阵列器件的基材部的示意图。此外,在以下各实施方式中,与上述第1实施方式所公开的构成要素相同的构成要素带有与第1实施方式相同的符号,将重复的说明省略。
图5所示的本实施方式的生物体成分解析试剂盒1a与上述第1实施方式的构成不同之处在于:在孔6内,代替上述第1实施方式的核酸定量用阵列器件2而具备能够进行电化学测定的核酸定量用阵列器件2a。
本实施方式的核酸定量用阵列器件2a具有第1实施方式所公开的基材部3、孔6、盖部7、水性溶液10、注入口部8及排出口部9。
进而,本实施方式的多个孔6在底面部6a上具有电极20。进而,本实施方式的基材部3具有连接于孔6内的电极20的布线21和用于将布线21连接于检测电路的连接器22。
电极20例如可以对孔6内的溶液的电位变化或电阻的变动进行检测。
布线21及连接器22通过在基材部3上例如印刷等来形成。若举出一例,布线21及连接器22按照被夹持在基板4与微小孔阵列层5之间的方式在基板4的外表面上进行图案形成。
电极20、布线21及连接器22的材质并无特别限定。
本实施方式中,使用孔6的底面部6a的电极20,以对应于有无模板核酸存在的ph变化或电位变化作为信号,可以进行核酸的定量。
(第3实施方式)
接着,对本发明的第3实施方式进行说明。图6为本实施方式的生物体成分解析试剂盒中的核酸定量用阵列器件的俯视图。图7为图6的b-b线的截面图。
图6所示的本实施方式的生物体成分解析试剂盒1b具有第1实施方式所公开的基材部3、具有孔的微小孔阵列层5、盖部7、水性溶液10、注入口部8及排出口部9。进而,本实施方式的生物体成分解析试剂盒1b进一步具备与排出口部9相连通的废液容器部31。
废液容器部31具有液体从基材部3与盖部7之间的空隙通过排出口部9流入并储存的空间,配设在盖部7的外部。本实施方式中,代替第1实施方式所公开的盖部7而具有形成有注入口部8、排出口部9及废液容器部31的盖部7a。
另外,本实施方式中,代替第1实施方式所公开的核酸定量用阵列器件2而具有多个(本实施方式中为96个)的独立的核酸定量用阵列器件2b1、2b2、……b96。核酸定量用阵列器件2b1、2b2、……b96排列成正方格子状地相互间连接。多个独立的核酸定量用阵列器件2b1、b2、……b96通过连接基材部3和盖部7a的间隔构件32而水密性地隔开。本实施方式的间隔构件32按照基材部3的微小孔阵列层5与盖部7a之间的空隙大小达到100μm的方式来保持微小孔阵列层5和盖部7a。本实施方式的间隔构件32具有将注入口部8和排出口部9连接、将微小孔阵列层5的各贯通孔5a包围的贯通孔32a。
本实施方式中,由于自排出口部9排出的各种液体储存在废液容器部31中,因此废液处理容易。
此外,本实施方式的生物体成分解析试剂盒1b也可没有水性溶液10。
此外,也可以由排出口部9注入各种液体,将剩余的液体从注入口部8排出。
(变形例1)
接着,对本实施方式的变形例1进行说明。图8是表示本变形例的构成6的截面图。
如图8所示,本变形例中,当在基材部3的厚度方向上将基材部3定义为下侧、盖部7a定义为上侧时,注入口部8的注入口开口端8a的位置位于较排出口部9的废液容器部侧开口端9a更靠下的位置。进而,排出口部9的废液容器部侧开口端9a位于较废液容器部31的底面更靠上的位置。
本变形例中,将各种液体从注入口开口端8a送液直至液体从排出口部9的废液容器部侧开口端9a进入到废液容器部31内之后,若开放注入口开口端8a,则在注入口部8和排出口部9的各自液面的高度因重力而达到一致的过程中,以位于排出口部9内的液量为上限,液体从注入口开口端8a发生逆流。因此,即便是注入口开口端8a附近具有气泡,该气泡也会因液体的逆流而流动,从注入口开口端8a被挤出至外面。本变形例中,在注入口部8的附近,在基材部3与盖部7a之间难以滞留气泡。
进而,本变形例中,由于排出口部9的废液容器部侧开口端9a位于较废液容器部31的底面更靠上的位置,因此进入到废液容器部31内的液体难以通过排出口部9逆流至基材部3与盖部7a之间的空隙中。
(变形例2)
接着,对本实施方式的变形例2进行说明。图9为表示本变形例的构成的截面图。
如图9所示,本变形例中,当在基材部3的厚度方向上将基材部3定义为下侧、盖部7a定义为上侧时,注入口部8的注入口开口端8a的位置处于较排出口部9的废液容器部侧开口端9a更靠上的位置。本变形例中,将各种液体从注入口开口端8a送液直至液体从排出口部9的废液容器部侧开口端9a进入到废液容器部31内之后,若开放注入口开口端8a,则在注入口部8和排出口部9的各自液面的高度因重力而达到一致的过程中,处于注入口部8的液体进一步进入到基材部3与盖部7a之间的空隙。另外,通过注入口部8将试样和检测反应试剂11的混合液x及油性密封液12送液至基材部3与盖部7a之间的空隙中时,自排出口部9挤出至废液容器部31的液体的一部分因为重力而会从排出口部9返回至基材部3与盖部7a之间的空隙,但由于与位于注入口部8内的液体的质量相对抗,由此可抑制液体自废液容器部31的逆流。
(变形例3)
接着,对本实施方式的变形例3进行说明。图10为表示本变形例的构成的截面图。
如图10所示,本变形例中,排出口部9的开口面积小于注入口部8的开口面积。
将排出口部9的开口面积设定为能够获得若不施加来自注入口部8的送液压力则液体无法通过排出口部9的程度的管路阻力的面积。排出口部9的具体的开口面积可以根据假设自排出口部9排出的液体的组成来决定。
本变形例中,在自注入口部8送液时,液体能够从基材部3与盖部7a之间的空隙通过排出口部9移动至废液容器部31,在从注入口部8向该空隙的送液结束之后,不会发生通过了排出口部9的液体的流动。因此,本变形例中,可抑制液体从废液容器部31向基材部3与盖部7a之间的空隙的逆流。
此外,也可以将各种液体从排出口部9注入、将剩余的液体从注入口部8排出。
(变形例4)
接着,对本实施方式的变形例4进行说明。图11为表示本变形例的构成的截面图。
如图11所示,本变形例中,与上述第3实施方式的生物体成分解析试剂盒1b相比,构成废液容器部31的底面31a的部位更厚。进而,本变形例中,与上述变形例1同样,当在基材部3的厚度方向上将基材部3定义为下侧、盖部7a定义为上侧时,注入口部8的注入口开口端8a的位置位于较排出口部9的废液容器部侧开口端9a更靠下的位置。本变形例中,通过注入口部8的注入口开口端8a的位置位于较排出口部9的废液容器部侧开口端9a更靠下的位置,发挥与上述变形例1相同的效果。另外,注入口部8的注入口开口端8a的位置也可位于较排出口部9的废液容器部侧开口端9a更靠上的位置。此时,本变形例发挥与上述变形例2相同的效果。
本变形例中,从基材部3厚度方向上的下侧(下面)(图11中符号d1所示的方向)进行荧光、发光或显色等检测时,由于构成废液容器部31的底面31a的部位厚,因此可以缓和来自积存在废液容器部31内的废液的荧光或废液自身颜色等的影响。
此外,还可以将各种液体从排出口部9注入、将剩余的液体从注入口部8排出。
(变形例5)
接着,对本实施方式的变形例5进行说明。图12为表示本变形例的构成的俯视图。图13为图12的c-c线的截面图。
本变形例的生物体成分解析试剂盒1c中,在设置于注入口部8与排出口部9之间、在基材部3的厚度方向上不与废液容器部31重叠的区域a1中,可以进行反应及检测。该区域a1中设置有能够从基材部3的厚度方向的下侧(下面)(图13中符号d1所示的方向)或从基材部3的厚度方向的上侧(上面)(图13中符号d2所示的方向)进行荧光、发光或显色等的检测的区域。
本变形例中,可以在不受到废液的有无或废液量的影响的情况下进行微小孔阵列层5中的荧光、发光或显色等的检测。
另外,还可以将各种液体从排出口部9注入、将剩余的液体从注入口部8排出。
(变形例6)
接着,对本实施方式的变形例6进行说明。图14为表示本变形例的构成的俯视图。图15为图14的d-d线的截面图。图16为表示图14的d-d线的截面的立体图。图17为表示本变形例的间隔构件32的俯视图。图18a、图18b及图18c为表示间隔构件32的其他构成的俯视图。图19为具备本变形例的微小孔阵列层5的基材部3的俯视图。
从图14~图16所示可知,本变形例的生物体成分解析试剂盒1d中,与上述变形例5同样,按照可以在不受到废液的有无或废液量的影响的情形下进行微小孔阵列层5中的荧光、发光或显色等检测的方式,在注入口部8与排出口部9之间具有按照在基材部3的厚度方向上不与废液容器部31重叠的方式配置有微小孔阵列层5的区域a1。
另外,本变形例中,注入口部8形成为漏斗状,可以顺畅地引导用于向注入口部8注入液体的移液管吸头等。注入口部8的位置也可对应于现有96孔板中的各孔的中央位置。即,本变形例中,还可以在96孔板的各孔中央位置(96处)中的48处配置有注入口部8。由此,可以容易地使其对应现有elisa装置的分配动作。
另外,连接于废液容器部31的排出口部9与上述变形例1同样,按照排出口部9的废液容器部侧开口端9a位于较废液容器部31的底面更靠上的位置的方式进行成型。
如图17所示,间隔构件32将图15所示的注入口部8与排出口部9连接,产生能够将试剂等液体储存在注入口部8与排出口部9之间的空隙。
另外,如图18a及图18b所示,间隔构件32只要具有对应于注入口部8的位置的入口部32x、对应于排出口部9的位置的出口部32z、及将入口部32x与出口部32z连接的流路部32y即可,并非限定于图17所示的构造。
例如,作为间隔构件32的其他构成例示于图18a中的构成中,按照将不与废液容器部31重叠的区域a1(参照图19)中的2个连接的方式设置流路部32y。
另外,例如作为间隔构件32的其他构成例示于图18b的构成中,在中间夹着不与废液容器部31重叠的区域a1(参照图19)的情况下设置入口部32x,在与入口部32x相反的位置上设置流路部32y的一端,将流路部32y的另一端拉回至入口部32x侧,出口部32z位于入口部32x的附近。
另外,如图18c所示,在间隔构件32中注入口部8的附近还可形成有用于保持固体状试剂的凹处32a。在该凹处中可以保持有待在检测马上开始之前进行混合的各种试剂。试剂等液体通过注入口部8流过,从而配置于凹处的试剂溶解到该液体中,由此可以发生反应。
本变形例中,在位于注入口部8与排出口部9之间的大致长方形状的区域a1(参照图15)内可以检测荧光、显色或发光的反应。
如图14及图19所示,本变形例中,可以在微小孔阵列层5中最多48处发生互不相同的反应。另外,在微小孔阵列层5中能够发生互不相同的反应的上限并非限定于48处。
另外,盖部7a及间隔构件32的形状并非限定于上述形状。
例如,如图20~图22所示,注入口部8及排出口部9可以均为漏斗状。
另外,如图23及图24所示,可以注入口部8的内表面由多个平面构成,注入口部8形成为锥状,按照向基材部3侧逐渐变小、变窄的方式(按照注入口部8的直径减小的方式)来构成。
此外,还可以将各种液体从排出口部9注入,将剩余的液体从注入口部8排出。
(变形例7)
接着,对本实施方式的变形例7进行说明。图25为表示本变形例的构成的截面图。
如图25所示,本变形例中,注入口部8具有漏斗状。注入口部8的内部形状按照液体不会因毛细管现象而贮存在注入口部8的方式较大地构成。本变形例中,通过将试剂等液体滴加到注入口部8中,利用试剂等液体的自重对试剂等液体进行送液。
例如,将含有检测对象物或试剂等的液体通过注入口部8利用该液体的自重进行送液之后,如果将比重高于该液体的油层叠在注入口部8上,则在油因自重从注入口部8流至排出口部9的过程中,可以将微小孔阵列层5的各孔6(参照第1实施方式)分别地密封。
本变形例中,当含有检测对象物或试剂等的液体的比重大致为1时,油的比重可以例如为1.8左右。
(变形例8)
接着,对本实施方式的变形例8进行说明。图26为表示本变形例的构成的俯视图。图27为图26的e-e线的截面图。
如图26及图27所示,在本变形例的生物体成分解析试剂盒1e中,在注入口部8侧也构成有废液容器部31。构成在注入口部8侧的废液容器部31可以在将液体从排出口部9送液至注入口部8侧时、对从注入口部8溢出的液体进行储存。
本变形例中,可以实施将含有检测对象物或试剂等的液体从注入口部8送液、之后将油从排出口部9送液的使用方法。将油从排出口部9送液时,从注入口部8溢出的试剂及油储存在设置于注入口部8侧的废液容器部31中。储存于设置在注入口部8侧的废液容器部31中的液体不会与储存在设置于排出口部9侧的废液容器部31中的液体发生混合。
此外,还可以将各种液体从排出口部9注入,将剩余的液体从注入口部8排出。
(变形例9)
接着,对本实施方式的变形例9进行说明。图28为表示本变形例的构成的截面图。
如图28所示,本变形例的不同之处在于:在上述第3实施方式的生物体成分解析试剂盒1b中,盖部7a是由不透光的材料构成的。此时,在基材部3的厚度方向上自下侧对荧光、发光或显色进行检测时,不容易受到积存在废液容器部31中的废液的影响。
另外,本变形例中,盖部7a还可以由选择性地不透过特定波长的光的材料构成。本变形例中的不透过可以是对特定波长的光进行吸收,也可以是对特定波长的光进行反射。例如,盖部7a可以具有虽透过可见光但紫外线不透过等的构成。此时,盖部7a为用于检测荧光的激发光会透过、但由该激发光产生的荧光则不透过。其结果是,在基材部3的厚度方向上从下侧(下面)照射激发光且从下侧(下面)观察荧光时,难以受到废液容器部31内的液体的影响,还可进行以透过盖部7a的可见光为照明光的明视野的观察。
(变形例10)
接着,对本实施方式的变形例10进行说明。图29为表示本变形例的构成的截面图。
如图29所示,本变形例中,盖部7a具有用于使进入微小孔阵列层5与盖部7a之间的气泡移动至盖部7a外的过滤器33。过滤器33具有能够使气体透过但无法使液体透过的构造。
另外,本变形例中与上述第3实施方式同样地设置注入口部8及排出口部9。
本变形例中,将设置在盖部7a的过滤器33配置在注入口部8的下游且注入口部8的附近。由此,混入到试剂或油等中的气泡在到达微小孔阵列层5中用于检测的区域之前即被过滤器33捕获。
(变形例11)
接着,对本实施方式的变形例11进行说明。图30为表示本变形例的构成的截面图。
本变形例中,代替上述变形例10所公开的过滤器33而在盖部7a上形成有用于储存气泡的凹处33a。
形成于盖部7a的凹处33a的位置与上述变形例10同样,优选为注入口部8的下游且注入口部8的附近。即便是这种构成,也可发挥与上述变形例10相同的效果。
另外,本变形例中,相比较于具备上述变形例10所公开的过滤器33的情况,还可以效率良好地将较大的气泡捕获。
(变形例12)
接着,对本实施方式的变形例12进行说明。图31为表示本变形例的构成的截面图。
本变形例中具有抵接于注入口部8的注入口开口端8a且形成有能够将移液管吸头40插入到注入口部8的贯通孔34a的转接头34。
转接头34在与对试剂或油进行送液时所使用的移液管吸头40相组合的状态下进行使用。转接头34的外形形状并无特别限定。本实施方式的转接头34的外形形状是在转接头34上安装了移液管吸头40时、朝向移液管吸头40的前端直径逐渐减小的圆锥台状。
本变形例中,例如当在移液管吸头40上安装转接头34、将移液管吸头40的前端插入到注入口部8中时,转接头34抵接于注入口开口端8a。由此,将盖部7a向基材部3侧挤压。其结果是,通过盖部7a与基材部3之间的空隙的容积减少,位于盖部7a与基材部3之间的液体从注入口部8及排出口部9稍有漏出。此时,当注入口部8的注入口开口端8a附近具有气泡时,通过将气泡从注入口开口端8a挤出,在移液管吸头40内的试剂或油的送液时,难以将位于注入口开口端8a附近的气泡卷入。
(变形例13)
接着,对本发明实施方式的变形例13进行说明。图32a为表示本变形例的生物体成分解析试剂盒1f的构成的立体图。另外,图32b中示出了生物体成分解析试剂盒1f的俯视图1f1(相当于盖部7a的俯视图7aa)、a-a截面的截面图1f2、b-b截面的截面图1f3和侧视图1f4以及密封构件101的俯视图及盖部7a的底面图7ab。
如图32a和32b所示,本变形例的生物体成分解析试剂盒1f与上述变形例6同样,按照可以在不受废液的有无或废液量的影响的情况下进行微小孔阵列层5的荧光、发光或显色等的检测的方式,在注入口部8与排出口部9之间具有按照在基材部3的厚度方向上不与废液容器部31重叠的方式配置有微小孔阵列层5的区域a1。
另外,本变形例中,注入口部8形成为漏斗状,可以顺畅地引导用于向注入口部8注入液体的移液管吸头等。
另外,连接于本变形例的废液容器部31的排出口部9如图32a和图32b所示,与注入口部8同样地排出口部9为漏斗状,排出口部9具有能够顺畅地引导移液管吸头等的形状。
本变形例中,与变形例8同样,可以实施将含检测对象物或试剂等的液体从注入口部8送液之后、将油从排出口部9送液的使用方法。
将含有检测对象物或试剂等的液体从注入口部8注入之后,液体通过排出口部9从盖部7a与基材部3之间的空隙流入至废液容器部31。由于废液容器部31和排出口部9周边存在液体,因此在使用移液管等将油从排出口部9注入时,空气难以混入到盖部7a与基材部3之间的空隙的液体中。
即,根据本变形例,在将油注入到盖部7a与基材部3之间的空隙的液体时,易于防止空气的混入。
因此,根据本变形例,在液体的注液时即将气泡进入到填充于盖部7a与基材部3之间的空隙的液体中的可能性降低,因而能够以简单的操作进行精度良好的定量分析。
如图32b所示,密封构件101与其他变形例中的间隔构件32同样,将图32b所示的注入口部8与排出口部9连接,产生能够在注入口部8与排出口部9之间储存试剂等液体的空隙。
另外,与图18a及图18b所示的间隔构件32同样,密封构件101只要具有对应于注入口部8的位置的入口部、对应于排出口部9的位置的出口部及连接入口部和出口部的流路部即可,并非限于图32b所示的构造。
本变形例中,可以在位于注入口部8与排出口部9之间的大致长方形状的区域a1(参照图32b)内对荧光、显色或发光的反应进行检测。
此外,还可以将图32a和图32b所示的一列式的试剂盒中的“1个注入口部8、1个区域a1、1个排出口部9和1个废液容器部31”作为1个单元进行使用。即,本变形例的生物体成分解析试剂盒1f可以作为一列式的试剂盒进行使用,也可以从该一列式的试剂盒中切割出各个单元、作为单独的分析试剂盒进行使用。
另外,图32a中示出了一列式的试剂盒,但如其他的变形例所示,本变形例的生物体成分解析试剂盒1f也可具有96孔式的形状。此时,注入口部8的位置也可对应于现有的96孔板的各孔的中央位置。即,本变形例中,还可以在96孔板的各孔的中央位置(96处)中的48处配置注入口部8。由此,可以使其容易地对应现有elisa装置的分配动作。
另外,图32b中示出了密封构件101与基板4和微小孔阵列层5所形成的基材部3单独设置的构成,但也可以具有密封构件101和基材部3一体形成的构成。
(变形例14)
接着,对本发明实施方式的变形例14进行说明。图33a为表示本变形例的生物体成分解析试剂盒1g的构成的立体图。另外,图33b中示出了生物体成分解析试剂盒1g的俯视图1g1(相当于盖部7a的俯视图7aa)、a-a截面的截面图1g2、左侧视图1g3和右侧视图1g4、密封构件101的俯视图及盖部7a的底面图7ab。
如图33a和33b所示,本变形例的生物体成分解析试剂盒1g与上述变形例6同样,按照可以在不受到废液的有无或废液量的影响的情况下进行微小孔阵列层5的荧光、发光或显色等检测的方式,在注入口部8与排出口部9之间具有按照在基材部3的厚度方向上不与废液容器部31重叠的方式配置有微小孔阵列层5的区域a1。
另外,本变形例中,注入口部8形成为漏斗状,可以顺畅地导引用于向注入口部8注入液体的移液管吸头等。
如图33b所示,本变形例中,当在基材部3的厚度方向上将基材部3定义为下侧、盖部7a定义为上侧时,注入口部8的注入口开口端8a的位置位于较排出口部9的废液容器部侧开口端9a更靠下的位置。进而,排出口部9的废液容器部侧开口端9a位于较废液容器部31的底面更靠上的位置。
本变形例中,将各种液体从注入口开口端8a进行送液直至液体从排出口部9的废液容器部侧开口端9a进入至废液容器部31内之后,如果开放注入口开口端8a,则在注入口部8与排出口部9的各自液面的高度因重力而达到一致的过程中,以位于排出口部9内的液量为上限,液体从入口开口端8a发生逆流。因此,即便在注入口开口端8a附近有气泡,该气泡因液体的逆流而流动,从注入口开口端8a被挤出到外部。本变形例中,在注入口部8的附近,在基材部3与盖部7a之间难以滞留气泡。
进而,本变形例中,由于排出口部9的废液容器部侧开口端9a位于较废液容器部31的底面更靠上的位置,因此进入废液容器部31内的液体难以通过排出口部9逆流至基材部3与盖部7a之间的空隙。
此外,本变形例的生物体成分解析试剂盒1g中,按照废液容器部31的容积比试剂和油的注入量的总量还大的方式来形成废液容器部31。因而,当注入试剂和油时,没有液体从废液容器部31漏出至生物体成分解析试剂盒1g外部的顾虑。
如图33b所示,密封构件101与上述第13变形例同样,将图33b所示注入口部8与排出口部9连接,在注入口部8与排出口部9之间产生能够储存试剂等液体的空隙。
另外,与第13变形例同样,密封构件101只要具有对应于注入口部8的位置的入口部、对应于排出口部9的位置的出口部及连接入口部和出口部的流路部即可,并非限定于图33b所示的构造。
本变形例中,可以在位于注入口部8与排出口部9之间的大致长方形状的区域a1(参照图33b)内对荧光、显色或发光的反应进行检测。
此外,还可以将图33a和图33b所示一列式的试剂盒中的“1个注入口部8、1个区域a1、1个排出口部9和1个废液容器部31”作为1个单元进行使用。即,本变形例的生物体成分解析试剂盒1g可以作为一列式的试剂盒进行使用,也可以从该一列式的试剂盒中切割出各个单元、作为单独的分析试剂盒进行使用。
另外,图33a中示出了一列式的试剂盒,但如其他的变形例所示,试剂盒也可具有96孔式的形状。此时,注入口部8的位置也可对应于现有的96孔板的各孔的中央位置。即,本变形例中,还可以在96孔板的各孔的中央位置(96处)中的48处配置注入口部8。由此,可以使其容易地对应现有elisa装置的分配动作。
另外,图33b中示出了密封构件101与基板4和微小孔阵列层5所形成的基材部3单独设置的构成,但也可以具有密封构件101和基材部3一体形成的构成。
(变形例15)
接着,对本发明实施方式的变形例15进行说明。图34为用于说明本变形例的作用的图。
上述变形例13和14中示出了也可将一列式的试剂盒切割成各个单元进行使用,但如图34所示,也可使用将基材部3和密封构件101一体形成、具有杯状、管状的容器103。
此时,可以不形成流路、而是在分批式容器103中填满液体的状态下进行将核酸等生物体成分102导入至孔6的操作和检测操作。
另外,还可在容器103中设置多个孔6。
在使用图34所示的分批式容器103时,如果在制造工序时预先将水性溶液10填充在孔6中,则试剂盒的使用者在现场进行分析试验时,作为检测对象的核酸等生物体成分102扩散到孔6内,将生物体成分102导入到孔6内,能够进行检测。
另一方面,在制造工序中未预先将水性溶液10填充到孔6中时,试剂盒的使用者在现场进行分析试验时,难以对进入孔6内的气泡进行脱气。
因此,本变形例中,优选在制造工序时将水性溶液10预先填充到孔6中。
此外,本变形例的核酸等生物体成分的导入操作、检测及观察等分析操作可以与上述实施方式同样地实施。
此外,上述实施方式的生物体成分的导入方法中作为一例示出了核酸的导入方法,但也可以是含有dna、rna、mirna、mrna、蛋白质、外来体、脂质体及细胞等的生物体成分的导入方法。
本实施方式的生物体成分的导入方法可以与上述核酸导入方法同样地进行,生物体成分并非仅限定于核酸。
另外,同样地,上述实施方式的核酸检测方法、生物体成分解析方法、生物体成分定量用阵列器件及生物体成分解析试剂盒中也可以以含有dna、rna、mirna、mrna、蛋白质、外来体、脂质体及细胞等的生物体成分等为对象,分析对象并非限定于上述实施方式。
实施例
接着,示出实施例详细地说明本发明的上述实施方式的核酸导入方法(生物体成分导入方法)、生物体成分解析方法、核酸定量用阵列器件2及生物体成分解析试剂盒1。此外,下述实施例为适用本发明的具体的一例,对本发明并没有任何限定。
<核酸定量用阵列器件的制作>
在0.5mm厚的玻璃制基板4上旋涂疏水性树脂cytop(注册商标)(旭硝子制),在180℃下使其热固化3小时,使用光刻技术制作具有100万个直径为5μm的孔的基材部3。通过对cytop(注册商标)进行旋涂而形成在基板4上的层通过光刻法而成型,由此形成上述实施方式所公开的微小孔阵列层5。通过对cytop(注册商标)进行旋涂而形成在基板4上的层的厚度为3μm。
接着,按照与基材部3的空隙达到100μm的方式,将作为盖部7的盖玻璃设置在基材部3上。基材部3与盖部7之间配设有由胶带构成的间隔物。进而,向基材部3与盖部7之间送液作为置换液的不含核酸的水性液体,在直径为5μm的孔和基材部3与盖部7之间的空隙的全部中都填满水性液体。本实施例中,水性液体的组成是20μmmopsph7.5、15mmnacl、6.25mmmgcl2。
<试样与检测反应试剂的混合液的送液>
将侵入反应试剂(2μm等位基因探针、1μm侵入寡核苷酸、1μmfam标记臂、20μmmopsph7.5、15mmnacl、6.25mmmgcl2、50u/μlcleavase(注册商标))和人工合成dna混合,将该混合液x送液至基材部3与盖部7之间的空隙。这里,关于人工合成dna的浓度,按照1分子进入形成于基材部3上的直径5μm的1个孔的方式、按照人工合成dna的浓度达到30pm的方式,将人工合成dna添加到混合液x中。
直径为5μm、高度为3μm的圆柱的微小孔为59fl的体积,依据泊松分布假设的话,推测在30pm的人工合成dna浓度下,进入到100万个微小孔中65%的微小孔。对侵入反应试剂和人工合成dna的混合物进行送液后,作为油性密封液12,将fc-40(sigma)送液至基材部3与盖部7之间的空隙中,将直径为5μm的孔密封,从而构成100万个独立的核酸检测反应容器6a。
<荧光强度的测定>
接着,使用62℃的烘箱对具有100万个独立的核酸检测反应容器6a的本实施例的核酸定量用阵列器件2进行孵育,15分钟后取出,利用荧光显微镜进行拍摄,对各孔的荧光强度进行观察。这里,反应后的核酸检测反应容器6a使用荧光显微镜(zeiss公司、ax10)、光源(lej公司、fluoarc001.26ausablewithhbo10)、传感器(hamamatsuphotonics公司、em-ccdc9100)、滤光器(奥林巴斯公司、u-mniba2)、解析软件(hamamatsuphotonics公司、aquacosmos2.6:曝光时间488ms、em增益120、补偿0、binning×1)进行拍摄,计算相对于自发荧光具有充分的s/n比地发出荧光的核酸检测反应容器6a的数量。
图35为表示本实施例的生物体成分解析结果的照片。本实施例中,如图35所示,从核酸检测反应容器6a的总数中约65%的核酸检测反应容器6a观察到因侵入反应产生的荧光发光。这与基于上述泊松分布的推测是一致的,显示了:对核酸检测反应容器6a优选地放入侵入反应试剂和人工合成dna,进行侵入反应,获得了对应于人工合成dna浓度的测量结果。
以上,参照附图及实施例详述了本发明的实施方式,但具体的构成并非限定于该实施方式,还包含不脱离本发明主旨的范围的设计变更等。
符号说明
1、1a、1b、1c、1d、1e、1f、1g生物体成分解析试剂盒
2、2a、2b1~2b96核酸定量用阵列器件
3基材部
4基板
4a基板的表面
5微小孔阵列层
5a贯通孔
6孔
6a底面部
6a核酸检测反应容器
7、7a盖部
8注入口部
8a注入口开口端
9排出口部
9a废液容器部侧开口端
10水性溶液
11检测反应试剂
12油性密封液
20电极
21布线
22连接器
31废液容器部
32间隔构件
32a贯通孔
33过滤器
34转接头
40移液管吸头
101密封构件
102生物体成分
103容器
- 还没有人留言评论。精彩留言会获得点赞!