用于识别、富集和/或扩增抗原特异性T细胞的试剂和方法与流程
本申请的主题涉及免疫治疗,并且涉及公开于2014年3月13日提交的pct/us2014/25889中的主题,其中的内容以引入方式并入。
背景技术:
抗原特异性t细胞的扩增因抗原特异性天然前体的稀有性而复杂,其可仅为百万分之一。为了产生过继治疗所需要的大量的肿瘤特异性t细胞(例如),淋巴细胞通常用抗原刺激多周,常常接着在劳动密集过程中的t细胞选择和亚克隆。
出于治疗和诊断目的两者,存在对可从天然前体快速产生大量和高频率抗原特异性t细胞,或快速识别t细胞应答以候选肽抗原的技术的需要。
技术实现要素:
在各种方面,本发明提供在培养液中,包括从天然t细胞并且包括从稀少前驱细胞快速富集和扩增抗原特异性t细胞。本发明由此提供用于更有效免疫治疗(例如通过过继转移)的平台。本发明通过确定对候选肽抗原库的t细胞反应性,进一步提供用于快速识别来自患者淋巴细胞的抗原特异性t细胞应答的平台和用于个性化免疫治疗的平台。
在各种实施例中本发明采用纳米级人工抗原呈递细胞(aapc),其捕获刺激信号并且将其传递到免疫细胞,如抗原特异性t淋巴细胞,如ctl。存在于aapc上的信号可包括信号1,在主要组织相容性复合体(mhc)的情形下呈递的抗原肽(i类或ii类);以及信号2,调节t细胞应答的一种或多种共刺激配体。在一些实施例中信号2为通过cd28结合并且活化的配体。在各种实施例中,粒子材料为顺磁性的并且优选地为生物兼容性的,如聚葡萄糖涂布的氧化铁粒子。顺磁性的粒子允许磁性捕获或通过施加磁场“富集”,以及在富集的细胞部分内活化和后续扩增抗原特异性淋巴细胞,其另外通过施加磁场增强。
在一些方面,本发明提供用于制备抗原特异性t细胞群的方法。所述方法包含提供包含来自患者的t细胞的样品。在一些实施例中,患者需要抗原特异性t细胞的过继转移。样品可为pbmc样品,或通过白细胞去除术获得的样品。样品可富集所关注的t细胞,如cd8+t细胞和/或天然t细胞。含有t细胞的样品与呈递所关注的疾病(例如肿瘤型)常见的抗原和/或呈递基于个人化选择的一种或多种抗原的顺磁性aapc的群接触。在某些实施例中,每个aapc珠粒呈递单个抗原,并且各自呈递不同抗原的aapc珠粒的混合液用于富集/扩增。顺磁性特性用于通过邻近放置磁体针对特异性t细胞捕获或“富集”抗原样品以由此分离aapc-缔合细胞与非缔合细胞。回收的t细胞可通过具有aapc的培养液体外扩增,并且抗原特异性细胞的扩增通过磁场的存在进一步增强。富集和扩增过程可重复一次或多次,用于抗原特异性细胞的理想扩增(以及进一步纯化)。
在某些实施例中,所述方法提供抗原特异性t细胞的约1000至10,000倍扩增(或更多),其中大于约108抗原特异性t细胞在例如1至3周里产生。所得细胞可向患者给药以治疗疾病。抗原特异性频率为在转移之后对于理想扩增的独特重要的参数,因为竞争来自无关的共同转移的细胞的生长信号可显著减弱所关注的抗肿瘤t细胞的动态平衡扩增。
在另外其它方面,本发明提供用于基于个人化选择t细胞抗原的方法。举例来说,各自呈递候选抗原肽的aapc的阵列或库用来自受试者或患者的t细胞筛选,并且确定或定量t细胞对每个aapc-肽的应答。t细胞应答可例如通过细胞因子表达或t细胞活化的其它替代标记的表达定量。示例性的测定平台包括免疫化学,如elisa,或已表达基因的扩增,例如通过rt-pcr。在其它实施例中,t细胞活化通过测量指示t细胞活化(如钙信号传递)的胞内信号传递事件定量。此类测定可采用本领域中已知的任何多种比色测定。
对于免疫治疗选择示出最鲁棒应答的肽抗原,所述免疫治疗在一些实施例中包括过继免疫治疗,其可通过抗原特异性t细胞的富集和扩增实现。在一些实施例中,并且具体来说对于癌免疫治疗,基因分析患者的肿瘤,并且根据患者的独特肿瘤突变特征预测肿瘤抗原。合成这些预测的抗原(“新抗原”)并且使用aapc平台针对患者的t细胞进行筛选。当识别/确认反应性抗原时,可制备aapc用于本文所述的富集和扩增方案,或在一些实施例中aapc可直接向患者给药。
在一些实施例中,针对各自呈递不同候选肽抗原的顺磁性aapc的阵列或库筛选患者或受试者的t细胞。此筛选可提供大量关于受试者或患者的t细胞抗体库的信息,并且结果可用于诊断或预测目的。举例来说,针对突变蛋白、过表达蛋白和/或其它肿瘤相关的抗原的t细胞抗肿瘤应答的数量和标识可用作分层风险的生物标记,以监测免疫治疗的功效,或预测免疫治疗治疗的结果。另外,此类t细胞应答的数量或强度可与疾病进展的风险成反比或可预测化学疗法的抗性或非应答性。在其它实施例中,针对各自呈递候选肽抗原的纳米apc的阵列或库筛选受试者的或患者的t细胞,并且t细胞应答的存在或这些t细胞应答的数量或强度,例如通过识别自体免疫疾病或识别患者患有亚临床肿瘤,提供关于患者健康的信息。在这些实施例中,所述方法不仅识别可能疾病病况,而且提供疾病生物学的初始理解。
由此本发明提供多个t细胞相关的疾病或病况的诊断和治疗发展,所述疾病或病况包括癌症、自体免疫疾病和其中离体抗原特异性免疫细胞的检测、富集、活化和/或扩增为治疗或诊断上期望的其它疾病。
基于以下详细描述,本发明的另外的方面和实施例对于本领域技术人员将是显而易见的。
附图说明
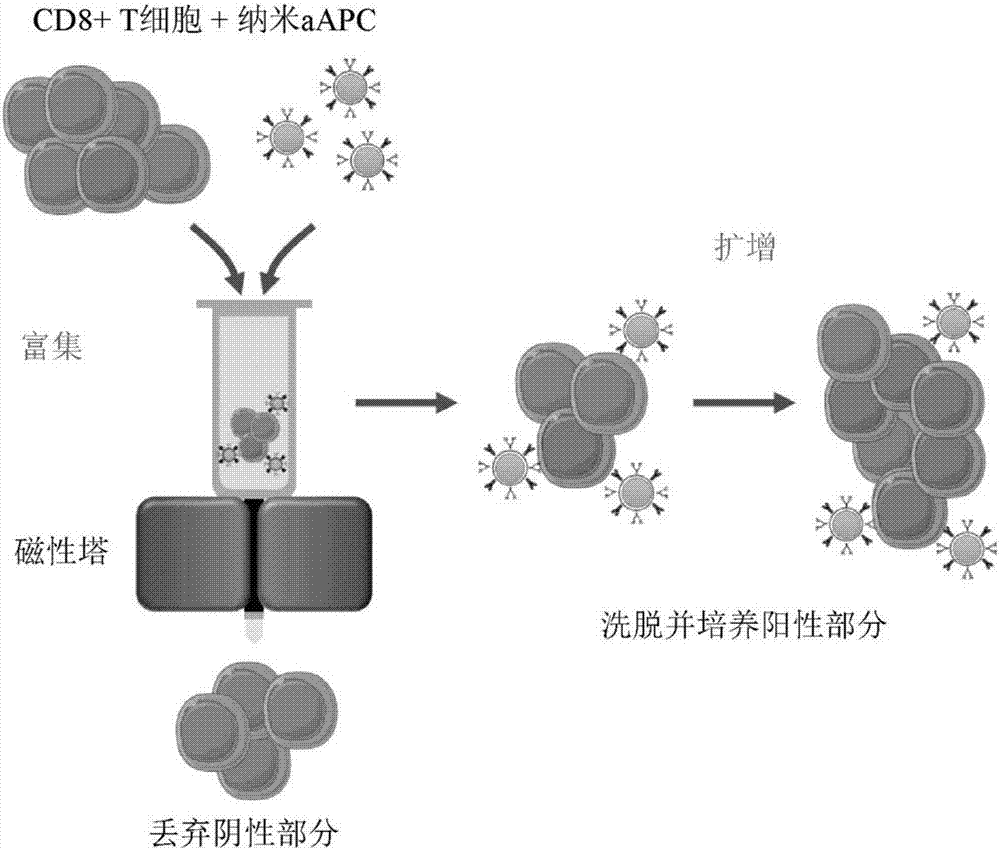
图1a至图1b呈现抗原特异性t细胞的富集和扩增的实施例的示意图。(图1a)纳米级人工抗原呈递细胞(纳米aapc)的实施例通过将mhc-ig二聚体(信号1)和共刺激抗cd28抗体(信号2)偶联到50nm至100nm铁-聚葡萄糖纳米粒子合成。(图1b)磁性富集的示意图。在“富集”步骤中,结合到纳米aapc的抗原特异性cd8+t细胞保留在磁性塔中,而非同源细胞不大可能结合。然后富集的t细胞通过纳米aapc活化并且在“扩增”步骤中增殖。
图2a至图2c.纳米aapc介导的抗原特异性t细胞的富集。(图2a)纳米aapc介导来自千倍多的多克隆thy1.2+b6脾细胞的集合的同源thy1.1+pmel细胞的抗原特异性富集。(图2b)在如在(图2a)中用增加量的纳米aapc进行pmel富集之后,抗原特异性细胞频率和%回收的细胞的汇总。(图2c)通过纳米aapc的内源性db-gp100脾细胞的富集(顶部)。在富集之后,非同源kb-trp2细胞的频率不增加(底部)。
图3a至图3g.在富集之后抗原特异性t细胞的扩增。(图3a)用于评估富集对扩增的影响的细胞部分的示意图。粒子结合的抗原特异性t细胞在磁性塔中捕获(阳性部分),而未结合细胞通过(阴性部分)。阴性部分可加回到阳性部分以消除富集(阳性+阴性)的影响。(图3b)在通过用kb-trp2纳米aapc富集培养七天之后产生的抗原特异性细胞的增加频率。阴性(左)、阳性(中间)和阴性+阳性(右)部分培养七天,然后用同源kb-trp2(顶部)和对照kb-siinf(底部)二聚体染色。(图3c)当细胞富集时kb-trp2细胞的频率的10至15倍增加(*,通过t检验,p<0.001)。(图3d)在用同源纳米aapc富集之后db-gp100、kb-siinf和ld-a5纳米aapc扩增七天的代表性facs曲线。(图3e)在用指定纳米aapc富集和活化之后%抗原特异性细胞(左)和总抗原特异性细胞(右)的汇总。(图3f)三种抗原(db-gp100、kb-siinf、kb-trp2)同时富集和扩增。对于来自相同t细胞培养的每种抗原的抗原特定性的代表性facs曲线。(图3g)当单独或一起富集和扩增时对于三种指定抗原产生的抗原特定性(左)和总抗原特异性细胞(右)的比较。
图4a至图4d:富集和扩增的t细胞介导肿瘤排斥反应的过继转移。(图4a)在过继转移之后淋巴细胞耗尽和降低的旁观者竞争对扩增的影响。b6小鼠在106或107无关的b6细胞任一者存在下在105pmelt细胞的过继转移之前一天未用500cgyγ辐射治疗或淋巴细胞耗尽。淋巴细胞耗尽和较少旁观者细胞的施用两者增加从脾和淋巴结回收的pmelt细胞的频率(通过双向方差分析p<0.01)。(图4b)在(图4a)中回收的thy1.1+pmel细胞的总数。(图4c)在抑制黑素瘤生长的过继转移之前培养7天的kb-trp2和db-gp100富集+扩增的淋巴细胞(通过双向方差分析p<0.01,8个小鼠/组)。小鼠八天前用皮下黑素瘤注射并且一天前用500cgyγ辐射来辐射。非同源富集和扩增的淋巴细胞(siinf)不抑制肿瘤生长(与未经治疗的相比),而同源富集和扩增(trp2+gp100)抑制肿瘤生长。(图4d)来自(图4c)的动物的存活期。在kb-trp2和db-gp100治疗的组中,2/8小鼠示出肿瘤的完全排斥反应,与非同源和未经治疗的组相比,其具有显著较长的存活期(通过mantel-cox,p<0.01)。
图5a至图5b:人类抗肿瘤应答的扩增。cd8+pbmc从健康供体中分离并且使用富集和扩增方案扩增一周。(图5a)紧接在cd8分离之后(第0天,左)和在富集和扩增一周之后(第7天,右)a2-ny-eso1(顶部)和a2-mart1(底部)特异性细胞的代表性染色和频率。(图5b)在用指定的纳米aapc富集/扩增之后%抗原特异性细胞频率(顶部)和总抗原特异性细胞(底部)的汇总。结果来源于具有不同供体的三个实验。
图6a至图6c:新表位扩增。(图6a)用于产生用于b16和ct26mutomes的候选肽的方法的示意图。通过mhcnet预测算法针对mhc结合评估围绕单个碱基对替换(sbs)的17-mer序列。(图6b)针对新表位用纳米aapce+e扩增七天的细胞到同源(顶部)和非同源(底部)mhc的代表性结合。图(6c)在e+e之后一周获得的总新表位特异性细胞。
图7a至图7c:微aapcare对抗原特异性富集无效。(图7a)微aapc(顶部)和纳米aapc(底部)到同源pmel(红色)或非同源2c(蓝色)cd8+t细胞的结合,其特征在于结合珠粒的萤光标记。无珠粒(灰色)背景作为对照示出。(图7b)微aapc不富集同源细胞。在thy1.1+pmel细胞用多克隆thy1.2+b6脾细胞以1:1000比率培育,并且富集使用db-gp100微米粒子尝试。在富集之后thy1.1+细胞的频率不显著增加。(图7c)抗原特异性细胞频率和回收的细胞的百分比,如在具有增加量的微aapc的(图7c)中进行。
具体实施方式
过继免疫治疗涉及离体免疫细胞的活化和扩增,其中所得细胞转移到患者以治疗疾病,如癌症。如果足够数量和频率的活化和抗原特异性ctl可在相对较短时间产生,包括从稀少前驱细胞,那么例如通过过继转移,抗原特异性细胞毒素(cd8+)淋巴细胞(ctl)应答的诱导可为有吸引力的治疗。在一些实施例中此方法可甚至产生预防疾病复发的长期的记忆。除了癌症免疫治疗和涉及ctl的免疫治疗之外,本发明发现与其它免疫细胞(包括cd4+t细胞和调节t细胞)一起使用,并且因此大体上适用于用于传染病和自体免疫疾病的免疫治疗。
在一方面,本发明提供人工抗原呈递细胞(aapc),其捕获刺激信号并且将其传递到免疫效应细胞,如抗原特异性t淋巴细胞,如ctl。在一些实施例中,这些aapc提供用于过继免疫治疗的有力工具。存在于支持t细胞活化的aapc上的信号包括信号1,在主要组织相容性复合体(mhc)(i类或ii类)的情形下呈递的抗原肽,其结合抗原特异性t细胞受体(tcr);以及信号2,调节t细胞应答的一种或多种共刺激配体。在此系统的一些实施例中,信号1通过单体、二聚或多聚mhc构建体带来。二聚构建体在一些实施例中通过融合到免疫球蛋白重链序列的可变区或ch1区产生。mhc复合物负载有一种或多种抗原肽,并且信号2为b7.1(用于t细胞受体cd28的天然配体)或抗cd28的活化抗体任一者。两种配体可直接化学偶联到微米级(4.5μm)或纳米级珠粒的表面以产生人工抗原呈递细胞(aapc)。在一些实施例中,粒子材料为顺磁性的,其允许通过施加磁场磁性捕获或“富集”,以及在富集的细胞部分内抗原特异性淋巴细胞的后续扩增,这还通过施加磁场增强。在其它实施例中,顺磁性特性支持快速t细胞应答(例如活化),即使来自天然细胞,其可在数分钟到数小时内体外检测到。
在一些方面,本发明提供用于制备用于过继转移的抗原特异性t细胞群的方法。所述方法包含提供包含来自患者的t细胞的样品,其中患者需要抗原特异性t细胞的过继转移。如本文详细描述,使t细胞或含有t细胞的样品与顺磁性aapc的群接触,其中的每个在mhc(i类或ii类)的情形下呈递所关注的肽抗原,并且由此结合样品中的抗原特异性t细胞(包括不频繁表示的天然抗原特异性细胞)。aapc可呈递常用于所关注的疾病(例如肿瘤型)的抗原,或可呈递基于个人化选择的一种或多种抗原。顺磁性特性可用于例如通过使用磁体针对抗原特异性t细胞捕获或“富集”样品以分离aapc-缔合细胞与非缔合细胞。回收的t细胞,例如保持与顺磁性aapc粒子缔合的那些,可在aapc存在下体外扩增,并且抗原特异性细胞的扩增另外通过磁场的存在增强。不希望受理论所束缚,据相信,结合到抗原特异性t细胞的顺磁性aapc在磁场存在下将促进t细胞受体集群。在一些实施例中,扩增步骤可进行约3天到约2周,或约5天到约10天(例如约1周)。富集和扩增方法然后可重复一次或多次,用于抗原特异性细胞的理想扩增(以及进一步纯化)。对于后续轮的富集和扩增,附加aapc可添加到t细胞以支持在样品中较大抗原特异性t细胞群的扩增。在某些实施例中,最终轮(例如第2、3、4或5轮)的扩增在体内发生,其中生物兼容性纳米apc添加到扩增的t细胞群,并且然后输注入患者。
在某些实施例中,所述方法提供抗原特异性t细胞的约1000至10,000倍扩增(或更多),其中大于约108抗原特异性t细胞在例如小于约一个月,或小于约三周,或小于约两周,或在约一周里产生。所得细胞可向患者给药以治疗疾病。aapc可与在一些实施例中制备的所得抗原特异性t细胞一起向患者给药。
在另外其它方面,本发明提供用于基于个人化选择t细胞抗原的方法。举例来说,在某些实施例中,各自呈递候选抗原肽的aapc的阵列或库从受试者或患者筛选t细胞(并且在一些实施例中在磁场存在下),并且确定或定量t细胞对每种aapc肽的应答。在一些实施例中,t细胞应答可以分子形式定量,例如通过定量细胞因子表达或t细胞活化的其它替代标记的表达(例如通过免疫化学或已表达基因的扩增如通过rt-pcr)。在一些实施例中,在培养液中定量步骤在约15小时和48小时之间进行。在其它实施例中,t细胞应答通过检测胞内信号传递(例如ca2+信号传递,或在t细胞活化期间早期出现的其它信号传递)确定,并且因此可在用纳米aapc培养的约15分钟到约5小时内(例如在约15分钟到约2小时内)定量。对于免疫治疗选择示出最鲁棒应答的肽,所述免疫治疗在一些实施例中包括本文所述的过继免疫治疗方法。在一些实施例中,并且具体来说对于癌症免疫治疗,基因分析(例如使用下一代测序)患者的肿瘤,并且根据患者的独特肿瘤突变特征预测肿瘤抗原。针对患者的t细胞使用本文所述的aapc平台合成并且筛选这些预测的抗原(“新抗原”)当识别/确认反应性抗原时,可制备aapc用于本文所述的富集和扩增方案,或在一些实施例中aapc可直接向患者给药。
在一些方面,针对顺磁性纳米aapc(如本文所述)的阵列或库筛选受试者或患者的t细胞,其中每种顺磁性纳米aapc呈递肽抗原。如本文所述确定或定量对每个的t细胞应答,提供关于患者的t细胞抗体库的有用的信息,并且从而提供受试者或患者的条件。
举例来说,对抗突变蛋白、过表达蛋白和/或其它肿瘤相关的抗原的t细胞抗肿瘤应答的数量和标识可用作分层风险的生物标记,并且在一些实施例中可包括计算机实施的分类器算法以对用于抗药性或药物敏感性的应答分布进行分类,或将应答分布分层作为用于免疫治疗的候选(例如检查点抑制剂治疗或过继t细胞传递治疗)。举例来说,此类t细胞应答的数量或强度可与疾病进展的高风险成反比,和/或可直接涉及患者的对免疫治疗的可能应答,这可包括用于癌症的检查点抑制剂治疗、过继t细胞转移或其它免疫治疗中的一种或多种。
在另外其它方面和实施例中,针对各自呈递候选肽抗原的顺磁性纳米apc的阵列或库筛选患者的t细胞。举例来说,阵列或库可呈递肿瘤相关的抗原,或可呈递自体抗原,或可呈递与各种传染病相关的t细胞抗原。通过与患者的t细胞一起培育阵列或库,并且在促进t细胞受体集群的磁场存在下,可快速确定t细胞应答的存在和/或这些t细胞应答的数量或强度。此信息可用于诊断,例如亚临床肿瘤、自体免疫或免疫疾病,或传染病,并且可提供疾病生物学(包括可能病原或治疗t细胞、t细胞抗原)的初始理解,和所关注的t细胞受体的理解,其表示药物或免疫治疗目标。
本发明的各种方面的各种替代实施例在下文详细描述。
本发明提供用于癌症和其中离体抗原特异性免疫细胞的检测、富集、活化和/或扩增为治疗或诊断上期望的其它疾病的免疫治疗。本发明通常可适用于抗原特异性t细胞(包括细胞毒素t淋巴细胞(ctl)、辅助t细胞和调节t细胞)的检测、富集和/或扩增。
在一些实施例中,患者为癌症患者。用于过继转移到患者的离体抗原特异性ctl的富集和扩增提供鲁棒抗肿瘤免疫应答。可根据所述方法治疗或评定的癌症包括历史上违禁差免疫应答或具有高复发比率的癌症。示例性癌症包括各种类型的实体肿瘤,包括癌瘤、肉瘤和淋巴瘤。在各种实施例中,所述癌症为黑素瘤(包括转移性黑素瘤)、结肠癌、十二指肠癌、前列腺癌、乳癌、卵巢癌、导管癌、肝癌、胰腺癌、肾癌、子宫内膜癌、睾丸癌、胃癌、发育异常的口腔黏膜、息肉病、头颈癌、侵袭性口腔癌、非小细胞肺癌瘤、小细胞肺癌、间皮瘤、过渡和鳞状细胞泌尿癌瘤、大脑癌、神经母细胞瘤和神经胶质瘤。在一些实施例中,癌症为血液恶性病,如慢性骨髓性白血病、儿童急性白血病、非霍奇金氏淋巴瘤、慢性淋巴细胞性白血病、恶性皮肤t细胞、毒蕈样霉菌病、非mf皮肤t细胞淋巴瘤、淋巴瘤样的丘疹病、富含t细胞的皮肤淋巴增生和盘状红斑狼疮。
在各种实施例中,癌症为阶段i、阶段ii、阶段iii或阶段iv。在一些实施例中,癌症为转移性的和/或复发性的。在一些实施例中,癌症为临床前,并且在本文所述的筛选系统中检测(例如结肠癌、胰腺癌,或难以早期检测的其它癌症)。
在一些实施例中,患者患有传染病。传染病可为其中用于过继转移到患者的离体抗原特异性免疫细胞(如cd8+或cd4+t细胞)的富集和扩增可增强或提供产生性的免疫应答的一种传染病。可治疗的传染病包括由细菌、病毒、朊病毒、真菌、寄生虫、蠕虫等引起的那些传染病。此类疾病包括aids、肝炎、cmv感染和后移植淋巴增生失调症(ptld)。举例来说,cmv为在器官移植患者中发现的最常见病毒病原体,并且为进行骨髓或周边血液干细胞移植的患者的发病和死亡的主要原因。这是由于这些患者的免疫功能不全状态,其允许在血清反应阳性的患者中的潜伏病毒的再活化或在血清反应阴性的个体中的机会性感染。这些治疗的有用替代方案为涉及在移植程序开始之前来源于患者或来源于适当供体的病毒特异性ctl的产生的防治性免疫治疗剂疗程。ptld出现在大部分移植患者中并且由艾伯斯坦-巴尔病毒(ebv)感染产生。在美国,ebv感染被认为存在于大约90%的成年群体中。活性病毒复制和感染通过免疫系统检查保持,但如在cmv的情况下,通过移植治疗免疫功能不全的个体失去控制t细胞群,其允许病毒再活化。这表示移植方案的严重障碍。ebv还可与多种血液和非血液癌症的肿瘤促进有关。
在一些实施例中,患者患有自体免疫疾病,其中用于过继转移到患者的离体调节t细胞(例如cd4+、cd25+、foxp3+)的富集和扩增可减弱有害免疫应答。可治疗的自体免疫疾病包括全身性红斑狼疮、类风湿性关节炎、i型糖尿病、多发性硬化、克罗恩病、溃疡性结肠炎、牛皮癣、重症肌无力、古巴士德氏综合症、格雷夫氏疾病、寻常天疱疮、艾迪森氏疾病、疱疹样皮炎、乳糜泻和桥本氏病甲状腺炎。在一些实施例中,患者怀疑患有自体免疫疾病或免疫病症(如在前述语句中描述的那些),并且针对如本文所述的顺磁性纳米aapc的库的t细胞应答的评定可用于识别或确定免疫病症。
因此,在各种实施例中,本发明涉及抗原特异性t细胞(如细胞毒素t淋巴细胞(ctl)、辅助t细胞和调节t细胞)的富集和/或扩增。在一些实施例中,本发明涉及抗原特异性ctl的富集和扩增。前体t细胞可从患者或从合适的hla匹配供体获得。前体t细胞可从多个来源获得,包括外周血单个核细胞(pbmc)、骨髓、淋巴结组织、脾脏组织和肿瘤。在一些实施例中,样品为来自患者的pbmc样品。在一些实施例中,pbmc样品用于分离所关注的t细胞群,如cd8+、cd4+或调节t细胞。在一些实施例中,前体t细胞使用本领域技术人员已知的任何数目的技术(如ficoll分离)从受试者收集的血液的单元获得。举例来说,来自个体的循环血液的前体t细胞可通过单采血液成分术或白细胞去除术获得。单采血液成分术产物通常含有淋巴细胞,包括t细胞和前体t细胞、单核细胞、粒细胞、b细胞、其它有核的白细胞、红血细胞和血小板。白细胞去除术为其中白血细胞与血液样品分离的实验室程序。
可洗涤通过单采血液成分术收集的细胞以去除血浆部分并且将细胞放置在用于后续处理步骤的适当缓冲液或培养基中。洗涤步骤可根据制造商的说明书通过本领域的普通技术人员已知的方法实现,如通过使用半自动化“流通式”离心机(例如cobe2991细胞处理器)。在洗涤之后,细胞可在多种生物兼容性缓冲液(如例如无ca无mg的pbs)中再悬浮。可替代地,可去除单采血液成分术样品的不希望的组分并且细胞在培养基中直接再悬浮。
如果需要,前体t细胞可通过溶解红血细胞和消耗单核细胞(例如通过经percolltm梯度的离心)从外周血淋巴细胞中分离。
如果需要,t细胞的亚群可与可存在的其它细胞分离。举例来说,t细胞的特异性亚群,如cd28+、cd4+、cd8+、cd45ra+和cd45ro+t细胞可进一步通过阳性或阴性选择技术分离。其它富集技术包括经由负磁性免疫粘附或流式细胞测量术,例如使用针对存在于不利地选择的细胞上的细胞表面标记的单克隆抗体的混合液的细胞分拣和/或选择。
在某些实施例中,白细胞通过白细胞去除术收集,并且随后使用已知方法(如可商购的磁性富集塔)富集cd8+t细胞。富集cd8的细胞然后使用借助aapc试剂的磁性富集来富集抗原特异性t细胞。在各种实施例中,对于抗原特异性t细胞富集,分离至少约105,或至少约106,或至少约107富集cd8的细胞。
在各种实施例中,包含免疫细胞(例如cd8+t细胞)的样品与具有磁特性的人工抗原呈递细胞(aapc)接触。顺磁性的材料对磁场具有小正敏感性。这些材料通过磁场吸引并且当去除外部场时材料不保留磁特性。示例性顺磁性材料包括(但不限于)镁、钼、锂、钽和氧化铁。适合于磁性富集的顺磁性珠粒为可商购的(dynabeadstm、macsmicrobeadstm、美天旎生物技术公司(miltenyibiotec))。在一些实施例中,aapc粒子为右旋糖酐铁珠粒(例如聚葡萄糖涂布的铁氧化物珠粒)。
在某些实施例中,aapc含有至少两种配体,抗原呈递复合物(肽-mhc)和淋巴细胞活化配体。
抗原呈递复合物包含抗原结合裂隙,其具有用于呈递到t细胞或t细胞前体的抗原。抗原呈递复合物可为例如mhci类或ii类分子,并且可连接或系栓以提供二聚或多聚mhc。在一些实施例中,mhc为单体,但其与纳米粒子的紧密关联对于亲合力和活化为足够的。在一些实施例中,mhc为二聚的。二聚mhci类构建体可通过融合到免疫球蛋白重链序列构建,其然后经一个或多个二硫键缔合(并且具有缔合轻链)。在一些实施例中,信号1复合物为非经典的mhc类分子,如cd1家族的成员(例如cd1a、cd1b、cd1c、cd1d和cd1e)。mhc多聚体可通过经肽或化学连接体直接系栓产生,或可为经由经生物素部分与抗生蛋白链菌素缔合的多聚的。在一些实施例中,抗原呈递复合物为涉及用免疫球蛋白序列融合的mhci类或mhcii类分子复合物,其极其稳定并且易于产生,基于通过免疫球蛋白主结构提供的稳定性和分泌效率。
具有免疫球蛋白序列的mhci类分子复合物描述于美国专利6,268,411中,其以全文引用的方式并入本文。这些mhci类分子复合物可在免疫球蛋白重链的末端以构象完整形式形成。结合抗原肽的mhci类分子复合物可稳定结合到抗原特异性淋巴细胞受体(例如t细胞受体)。在各种实施例中,免疫球蛋白重链序列不是全长,但包含ig铰链区以及ch1、ch2和/或ch3域中的一个或多个。ig序列可或可不包含可变区,但其中存在可变区序列,可变区可为完全或部分的。复合物可进一步包含免疫球蛋白轻链。
示例性mhci类分子复合物包含至少两种融合蛋白。第一融合蛋白包含第一mhci类α链和第一免疫球蛋白重链(或其包含铰链区的部分),并且第二融合蛋白包含第二mhci类α链和第二免疫球蛋白重链(或其中包含铰链区的部分)。第一免疫球蛋白重链和第二免疫球蛋白重链缔合以形成mhci类分子复合物,其包含两种mhci类肽结合裂隙。免疫球蛋白重链可为igm、igd、igg1、igg3、igg2β、igg2α、igg4、ige或iga的重链。在一些实施例中,igg重链用于形成mhci类分子复合物。如果期望多价mhci类分子复合物,那么igm或iga重链可用于分别提供五价或四价分子。
示例性i类分子包括hla-a、hla-b、hla-c、hla-e,并且这些可单独地或以任何组合采用。在一些实施例中,抗原呈递复合物为hla-a2配体。
示例性mhcii类分子复合物描述于美国专利6,458,354、美国专利6,015,884、美国专利6,140,113和美国专利6,448,071,其以全文引用的方式并入本文。mhcii类分子复合物包含至少四种融合蛋白。两种第一融合蛋白包含(i)免疫球蛋白重链(或其中包含铰链区的部分)和(ii)mhcii类β链的胞外域。两种第二融合蛋白包含(i)免疫球蛋白κ或λ轻链(或其部分)和(ii)mhcii类α链的胞外域。两种第一融合蛋白和两种第二融合蛋白缔合以形成mhcii类分子复合物。每个第一融合蛋白的mhcii类β链的胞外域和每个第二融合蛋白的mhcii类α链的胞外域形成mhcii类肽结合裂隙。
免疫球蛋白重链可为igm、igd、igg3、igg1、igg2β、igg2α、igg4、ige或iga的重链。在一些实施例中,igg1重链用于形成包含两种抗原结合裂隙的二价分子复合物。任选地,可包括重链的可变区。igm或iga重链可用于分别提供五价或四价分子复合物。
mhcii类分子复合物的融合蛋白可包含插入免疫球蛋白链和mhcii类多肽的胞外域之间的肽连接体。连接体序列的长度可根据调节抗原结合和受体交联的程度所需要的灵活性而变化。
在一些实施例中免疫球蛋白序列为人类化单克隆抗体序列。
信号2通常为t细胞影响分子,即,对前体t细胞或对抗原特异性t细胞具有生物效应的分子。此类生物效应包括例如前体t细胞分化成ctl、辅助t细胞(例如th1、th2),或调节t细胞;和/或t细胞的增殖。因此,t细胞影响分子包括t细胞共刺激分子、粘附分子、t细胞生长因子和调节t细胞诱导剂分子。在一些实施例中,aapc包含至少一种此类配体;任选地aapc包含至少两种、三种或四种此类配体。
在某些实施例中,信号2为t细胞共刺激分子。t细胞共刺激分子有助于抗原特异性t细胞的活化。此类分子包括(但不限于)特异性结合到cd28(包括抗体)、cd80(b7-1)、cd86(b7-2)、b7-h3、4-1bb、4-1bbl、cd27、cd30、cd134(ox-40l)、b7h(b7rp-1)、cd40、light的分子,特异性结合到hvem的抗体、特异性结合到cd40l的抗体、特异性结合到ox40的抗体以及特异性结合到4-1bb的抗体。在一些实施例中,共刺激分子(信号2)为抗体(例如单克隆抗体)或其部分,如f(ab')2、fab、scfv,或单链抗体,或其它抗原结合片段。在一些实施例中,抗体为人类化单克隆抗体或其中具有抗原结合活性的部分,或为全人类抗体或其中具有抗原结合活性的部分。
可用于纳米aapc的粘附分子可用于介导纳米aapc到t细胞或到t细胞前体的粘附性。有用的粘附分子包括例如icam-1和lfa-3。
在一些实施例中,信号1通过肽-hla-a2复合物提供,并且信号2通过b7.1-ig或抗cd28提供。示例性抗cd28单克隆抗体为9.3mab(tan等人,《实验医学杂志(j.exp.med.)》1993177:165),在某些实施例中其可为人类化和/或作为完全完整抗体或其抗原结合片段结合到珠粒。
一些实施例采用t细胞生长因子,其影响t细胞的增殖和/或分化。t细胞生长因子的实例包括细胞因子(例如白介素、干扰素)和超抗原。如果需要,细胞因子可存在于包含融合蛋白的分子复合物中,或可由aapc封装。尤其有用的细胞因子包括il-2、il-4、il-7、il-10、il-12、il-15、il-21γ干扰素和cxcl10。任选地,细胞因子在扩增步骤期间通过培养基组分单独提供。
纳米粒子可由任何材料制成,并且针对期望的磁性材料可经适当地选择,并且可包含例如金属,如铁、镍、钴或稀土金属的合金。顺磁性材料还包括镁、钼、锂、钽和氧化铁。适合于材料(包括细胞)的富集的顺磁性珠粒为可商购的,并且包括右旋糖酐铁珠粒,如聚葡萄糖涂布的氧化铁珠粒。在其中不需要磁特性的本发明的方面中,纳米粒子还可由非金属或有机(例如聚合物)材料,如纤维素、陶瓷、玻璃、尼龙、聚苯乙烯、橡胶、塑料或胶乳制成。用于制备纳米粒子的示例性材料为聚(乳酸-共-乙醇酸)(plga)和其共聚物,其可与这些实施例结合使用。包括可采用的聚合物和共聚物的其它材料包括在pct/us2014/25889中描述的那些材料,该文献以全文引用的方式并入本文。
在一些实施例中,磁性粒子为生物兼容性的。这在其中aapc将递送到与富集和扩增的细胞相关联的患者的实施例中尤其重要。举例来说,在一些实施例中,磁性粒子为生物兼容性右旋糖酐铁顺磁性珠粒。
在各种实施例中,粒子具有在约10nm到约500nm内,或在约20nm到约200nm内的尺寸(例如平均直径)。尤其在其中aapc将递送到患者的实施例中,微米级aapc太大难以通过淋巴管运送,并且当皮下注射时保持在注射部位。当静脉内注射时,它们倒伏在毛细管床中。实际上,微米级珠粒的不良运输已阻止其中对于理想免疫治疗aapc应运输的研究。纳米aapc的运输和生物分布可能将比微米级aapc更有效。举例来说,其中aapc可最有效的两个可能部位为其中天然和记忆t细胞驻留的淋巴结以及肿瘤自身。约50nm到约200nm直径的纳米粒子可被淋巴管吸收并且运输到淋巴结,因此获得进入t细胞的较大集合。如描述于pct/us2014/25889(其以引入方式并入本文)中,纳米aapcs的皮下注射比对照或静脉内注射的珠粒产生较少肿瘤生长。
在一些实施例中,仅在将t细胞输注入患者之前,使用纳米尺寸aapc再富集抗原特异性t细胞将避免静脉和动脉的堵塞,例如这可为如果微米尺寸的aapc与细胞一起输注入患者的效应。
在细胞-纳米粒子界面处受体-配体相互作用不好理解。然而,纳米粒子结合和细胞活化对膜空间组构敏感,这在t细胞活化期间尤其重要,并且磁场可用于操控集群结合纳米粒子以增强活化。参见wo/2014/150132。举例来说,t细胞活化诱导持久增强的纳米级tcr集群的状态,并且纳米粒子以较大粒子不敏感的方式对此集群敏感。参见wo/2014/150132。
此外,可利用纳米粒子与tcr集群相互作用以增强受体触发。t细胞活化通过信号传递蛋白的集合介导,其中“信号传递集群”横跨数百纳米,首先在t细胞-apc接触部位的外周形成并且向内迁移。如本文所述,外部磁场可用于富集抗原特异性t细胞(包括稀少天然细胞)并且驱动磁性纳米aapc的集合结合到tcr,产生tcr集群的集合和天然t细胞的增强的活化。磁场可对顺磁性粒子施加适当强的力,但否则的话为生物性惰性,使它们成为控制粒子行为的有力工具。结合到顺磁性纳米aapc的t细胞在外部施加的磁场存在下活化。纳米aapc自身磁化,并且附着到磁场源极和在磁场中的附近纳米粒子,感应珠粒以及因此tcr集合提高aapc介导的活化。参见wo/2014/150132。
与天然t细胞相比,纳米aapc结合更多tcr并且诱导先前活化的更大活化。此外,外部磁场的施加诱导纳米aapc在天然细胞上集合,增强体外和后续过继转移体内两者t细胞增殖。重要的是,在黑素瘤过继免疫治疗模型中,通过纳米aapc活化t细胞在磁场中介导肿瘤排斥反应。因此,施加的磁场的使用允许天然t细胞群的活化,否则的话其不佳地响应于刺激。这是免疫治疗的重要特征,因为天然t细胞已经示出比用于癌症免疫治疗的更分化的次型更有效,具有较高的增殖能力和更大能力以产生强的、长期的t细胞应答。因此,纳米aapc可用于t细胞的磁场增强活化以增加从天然前体扩增的抗原特异性t细胞的产量和活性,改善细胞治疗,例如患有传染病、癌症或自体免疫疾病的患者,或为免疫抑制患者提供防治性保护。
分子可通过吸附或通过直接化学结合(包括共价结合)直接附接至纳米粒子。参见,hermanson《生物结合物技术(bioconjugatetechniques)》,学术出版社(academicpress),纽约(newyork),1996。分子自身可直接用多种化学官能团(包括亲核基团、离去基团或亲电子基团)活化。活化的官能团包括烷基和酰基卤、胺、硫氢基、醛、不饱和键、酰肼、异氰酸酯、异硫氰酸酯、酮和已知用于化学结合活化的其它基团。可替代地,分子可通过使用小分子偶联剂结合到纳米粒子。偶联剂的非限制性实例包括碳二酰亚胺、马来酰亚胺、n-羟基丁二酰亚胺酯、双氯乙胺、双官能醛如戊二醛、酸酐等。在其它实施例中,分子可通过亲和力结合(如生物素抗生蛋白链菌素键或偶联)偶联到纳米粒子,如在本领域中所熟知的。举例来说,抗生蛋白链菌素可通过共价或非共价附接结合到纳米粒子,并且生物素化分子可使用本领域中熟知的方法合成。
如果设想共价结合到纳米粒子,那么负载物可涂覆有聚合物,所述聚合物含有可用于共价附接到合适的反应物(通常通过连接体)的一种或多种化学部分或官能团。举例来说,氨基酸聚合物可具有基团,如赖氨酸的ε-氨基,其可用于共价地经由适当连接体偶联分子。本公开还设想将第二涂层放置在纳米粒子上以提供这些官能团。
活化化学反应可用于允许分子到纳米粒子的表面的特异性稳定附接。存在可用于将蛋白附接到官能团的许多方法。举例来说,常见交联剂戊二醛可用于以两步法将蛋白氨基附接到胺化纳米粒子表面。所得键为水解稳定的。其它方法包括使用含有与在蛋白上的胺反应的n-氢丁二酰亚氨基(nhs)酯的交联剂、含有与含胺、含硫氢基或含组氨酸的蛋白反应的活性卤素的交联剂,含有与胺或硫氢基反应的环氧化物的交联剂、在顺丁烯二酰亚胺基和硫氢基之间的共轭,以及在还原氨基化后通过侧链糖部分的高碘酸盐氧化形成蛋白醛基团。
在相同纳米粒子上的特定配体的比率可变化以增加在抗原或共刺激配体呈递中的纳米粒子的效力。举例来说,纳米粒子可与以多种比率的hla-a2-ig和抗cd28偶联,如约30:1、约25:1、约20:1、约15:1、约10:1、约5:1、约3:1、约2:1、约1:1、约0.5:1、约0.3:1;约0.2:1、约0.1:1或约0.03:1。偶联到负载物的蛋白的总量可为例如约250mg/ml、约200mg/ml、约150mg/ml、约100mg/ml或约50mg/ml的粒子。因为效应功能(如细胞因子剥离和生长)可对于信号1对信号2具有与t细胞活化和分化不同的需要,所以这些功能可分别确定。
纳米粒子的配置可在形状的不规则到球形和/或具有不均匀或不规则表面到具有平滑表面范围内变化。非球形aapc描述于wo2013/086500中,其以全文引用的方式并入本文。
aapc将抗原呈递到t细胞并且因此可用于富集和扩增抗原特异性t细胞两者,包括从天然t细胞。将基于期望的治疗(例如癌症、癌症的类型、传染病等)选择肽抗原。在一些实施例中,进行所述方法以治疗癌症患者,并识别患者专有的新抗原,且用于负载apac而合成。在一些实施例中,通过肿瘤的基因分析(例如核酸测序)识别在三个和十个之间的新抗原,接着预测生物信息学。如本文所示,若干抗原可一起使用(在分离aapc方面),而无在所述方法中功能性的损失。在一些实施例中,抗原为天然非突变的癌症抗原,其中许多为已知的。用于基于个人化识别抗原的这种方法在下文更详细地描述。
多种抗原可结合到抗原呈递复合物。抗原的性质取决于使用的抗原呈递复合物的类型。举例来说,肽抗原可结合到mhci类和ii类肽结合裂隙。非经典的mhc类分子可用于呈递非肽抗原,如磷脂、复合碳水化合物等(例如细菌膜组分如分枝菌酸和脂阿拉伯甘露聚糖)。能够诱导免疫应答的任何肽可结合到抗原呈递复合物。抗原肽包括肿瘤相关的抗原、自身抗原、同种异体抗原和传染剂的抗原。
“肿瘤相关的抗原”包括通过它们从其衍生的肿瘤专门表达的独特肿瘤抗原,在许多肿瘤中但不在正常成年组织中表达的共享肿瘤抗原(癌胚的抗原),和也通过出现肿瘤的正常组织表达的组织特定抗原。肿瘤相关的抗原可为例如胚胎抗原、具有异常翻译后修饰的抗原、分化抗原、突变致癌基因或肿瘤抑制因子的产物、融合蛋白或致癌病毒蛋白。
多种肿瘤相关的抗原为本领域中已知的,并且这些中的许多可商购。癌胚的和胚胎抗原包括癌胚抗原和α-胎蛋白(通常仅在发育胚胎中高度表达但经常分别通过肝和结肠的肿瘤高度表达)、mage-1和mage-3(在黑素瘤、乳癌和神经胶质瘤中表达)、胎盘碱性磷酸酶唾液酸-lewisx(在腺癌中表达)、ca-125和ca-19(在肠胃、肝和妇科肿瘤中表达)、tag-72(在结肠直肠肿瘤中表达)、上皮醣蛋白2(在许多癌瘤中表达)、胰腺癌胚抗原、5t4(在胃癌中表达)、甲胎蛋白受体(在多个肿瘤类型中,尤其乳房肿瘤中表达)和m2a(在生殖细胞瘤形成中表达)。
肿瘤相关的分化抗原包括酪氨酸酶(在黑素瘤中表达)和特定表面免疫球蛋白(在淋巴瘤中表达)。
突变的致癌基因或肿瘤抑制基因产物包括ras和p53,其中两者在多肿瘤类型中表达,her-2/neu(在乳癌和妇科癌症中表达)、egf-r、雌激素受体、孕酮受体、成视网膜细胞瘤基因产物、myc(与肺癌相关)、ras、p53、与乳房肿瘤相关的未突变体、mage-1和mage-3(与黑素瘤、肺和其它癌症相关)。融合蛋白包括bcr-abl,其在铬骨髓白血病中表达。致癌病毒蛋白包括hpv型16、e6和e7,其在宫颈癌中发现。
组织特定抗原包括黑色素转铁蛋白和muc1(在胰腺和乳癌中表达);cd10(先前被称为常见急性淋巴母细胞白血病抗原,或calla)或表面免疫球蛋白(在b细胞白血病和淋巴瘤中表达);il-2受体、t细胞受体、cd45r、cd4+/cd8+的α链(在t细胞白血病和淋巴瘤中表达);前列腺特异性抗原和前列腺酸-磷酸酶(在前列腺癌中表达);gp100、melana/mart-1、酪氨酸酶、gp75/brown、bage和s-100(在黑素瘤中表达);细胞角蛋白(在各种癌瘤中表达);以及cd19、cd20和cd37(在淋巴瘤中表达)。
肿瘤相关的抗原还包括变化的糖脂和醣蛋白抗原,如含神经氨酸的鞘醣脂(例如gm2和gd2,在黑色素瘤和一些大脑肿瘤中表达);血型抗原,尤其t和唾液酸化tn抗原,其可在癌瘤中异常表达);以及粘蛋白,如ca-125和ca-19-9(在卵巢癌瘤上表达)或低糖基化muc-1(在乳房和胰腺癌瘤上表达)。
“传染物的抗原”包括原虫、细菌、真菌(单细胞和多细胞两者)、病毒、朊病毒、胞内寄生虫、蠕虫和可诱导免疫应答的其它传染物的组分。细菌抗原包括革兰氏阳性球菌、革兰氏阳性杆菌、革兰氏阴性细菌、厌氧细菌(如放线菌科、芽胞杆菌科、巴尔通氏体科、博代氏杆菌科、captophagaceae科、棒状杆菌科、肠杆菌科、军团秆菌科、细球菌科、分枝杆菌科、诺卡菌科、巴斯德氏菌科、假单胞菌科、螺旋体科、弧菌科的生物体以及不动杆菌属、布氏杆菌属、弯曲杆菌属、红斑丹毒丝菌属、爱文氏菌属、弗朗西斯氏菌属、加德纳菌属、螺旋杆菌属、列文菌属、李斯特氏菌属、链杆菌属和tropheryma的生物体)的抗原。原虫传染物的抗原包括疟疾疟原虫、利什曼原虫种、锥虫种和裂体吸虫种的抗原。
真菌抗原包括曲霉、芽生菌、假丝酵母、粗球菌、隐球菌属、组织浆菌、paracoccicioides、孢子丝菌、毛霉目的生物体、诱导着色真菌病和足菌病的生物体和发癣菌属、小芽孢菌属、表皮癣菌属和马拉色氏霉菌属的生物体的抗原。
病毒肽抗原包括(但不限于)腺病毒、单纯疱疹病毒、乳头瘤病毒、呼吸合胞体病毒、痘病毒、hiv、流感病毒和cmv的那些抗原。尤其有用的病毒肽抗原包括hiv蛋白,如hivgag蛋白(包括(但不限于)膜锚定(ma)蛋白、核心壳体(ca)蛋白和核壳体(nc)蛋白)、hiv聚合酶、流感病毒基质(m)蛋白和流感病毒核壳体(np)蛋白、b型肝炎表面抗原(hbsag)、b型肝炎核心蛋白(hbcag)、肝炎e蛋白(hbeag)、b型肝炎dna聚合酶、c型肝炎抗原等。
包括抗原肽的抗原可主动地或被动地结合到抗原呈递复合物的抗原结合裂隙,如描述于美国专利6,268,411中,其以全文引用的方式并入本文。任选地,抗原肽可共价结合到肽结合裂隙。
如果需要,肽系栓可用于将抗原肽连接到肽结合裂隙。举例来说,多个i类mhc分子的结晶分析指示β2m的氨基末端非常接近,大约距驻留在mhc肽结合裂隙中的抗原肽的羧基端20.5埃。因此,使用相对较短连接体序列,大约13个氨基酸长度,可将肽系栓到β2m的氨基末端。如果序列为适当的,那么肽将结合到mhc结合槽(参见美国专利6,268,411)。
结合到aapc的抗原特异性t细胞可与不使用磁性富集或其它细胞分拣或捕获技术结合的细胞分离。可用于此目的的其它方法包括流式细胞测量术和其它色谱方法(例如涉及本文所述的抗原呈递复合物或其它配体的固定)。在一个实施例中,抗原特异性t细胞通过与珠粒例如抗原呈递复合物/抗cd28共轭顺磁性珠粒(如
在一些实施例中,t细胞的群可使用例如对cd44的抗体基本上耗尽先前活性t细胞,留下天然t细胞富集的群。将纳米aapc结合到此群将基本上不活化天然t细胞,但将准许其纯化。
在另外其它实施例中,靶向nk细胞、nkt细胞或b细胞(或免疫效应细胞)的配体可并入到顺磁性纳米粒子中,并且用于磁性富集这些细胞群,任选地伴随如下所述的在培养液中扩增。附加免疫效应细胞配体描述于pct/us2014/25889中,其以全文引用的方式并入本文。
不希望受理论所束缚,去除不需要的细胞可降低细胞因子和生长信号的竞争,去除抑制细胞,或可简单地提供用于所关注的细胞的扩增的更多物理空间。
富集的t细胞然后在邻近产生磁场的磁体的培养液中扩增,这增强aapc结合细胞的t细胞受体集群。培养液可用纳米aapc刺激可变量的时间(例如约0.5、2、6、12、36、48或72小时以及连续刺激)。可评估在高度富集的抗原特异性t细胞培养液中的刺激时间的效应。抗原特异性t细胞可放置回培养液中并且分析细胞生长、增殖速率、各种效应功能等,如本领域中已知。此类条件可根据期望的抗原特异性t细胞应答变化。在一些实施例中,t细胞在培养液中扩增约2天到约3周,或在一些实施例中,约5天到约2周,或约5天到约10天。在一些实施例中,t细胞在培养液中扩增约1周,之后任选地进行第二富集和扩增步骤。在一些实施例中,进行2、3、4或5个富集和扩增轮。
在一轮或多轮的富集和扩增之后,样品的抗原特异性t细胞组分将为细胞的至少约1%,或在一些实施例中,样品中的细胞的至少约5%、至少约10%、至少约15%或至少约20%或至少约25%。另外,这些t细胞通常显示活化状态。根据从患者分离的原始样品,在各种实施例中抗原特异性t细胞扩增约100倍到约10,000倍,如在各种实施例中至少约1000倍、至少约2000倍、至少约3,000倍、至少约4,000倍或至少约5,000倍。在一轮或多轮的富集和扩增之后,获得至少约106,或至少约107,或至少约108,或至少约109抗原特异性t细胞。
纳米aapc对t细胞前体的扩增、活化和分化的的效应可以本领域的普通技术人员已知的任何数目的方式测定。功能的快速测定可使用增殖测定通过检测每种类型的t细胞专有的标记确定在培养液中ctl、辅助t细胞或调节t细胞的增加而实现。此类标记是本领域中已知的。ctl可通过使用铬剥离测定来测定细胞因子生产或溶细胞活性检测。
除了产生具有适当效应功能的抗原特异性t细胞之外,抗原特异性t细胞功效的另一参数为使t细胞运输到病理学部位的归巢受体的表达(sallusto等人,《自然(nature)》401,708-12,1999;lanzavecchia&sallusto,《科学(science)》290,92-97,2000)。
举例来说,效应ctl功效已与归巢受体、cd62l+、cd45ro+和ccr7-的后续表现型有关。因此,纳米aapc诱导和/或扩增的ctl群可表征这些归巢受体的表达。归巢受体表达为与初始刺激条件有关的复杂特点。可能,这通过共刺激复合物以及细胞因子环境两者控制。已暗示的一个重要细胞因子为il-12(salio等人,2001)。如下文所论述,纳米aapc提供将单独的组分(例如t细胞效应分子和抗原呈递复合物)单独地变化以优化生物结果参数的可能。任选地,细胞因子(如il-12)可包括在初始诱导培养液中以影响在抗原特异性t细胞群中的归巢受体分布。
任选地,包含抗原特异性t细胞的细胞群可继续与相同纳米aapc或第二纳米aapc任一者一起培育足以形成包含相对于在第一细胞群中的抗原特异性t细胞的数量增加数量的抗原特异性t细胞的第二细胞群的时间段。通常,此类培育进行3至21天,优选地7至10天。
合适的培育条件(培养基、温度等)包括用于培养t细胞或t细胞前体的那些条件,以及本领域中已知用于使用dc或人工抗原呈递细胞诱导抗原特异性t细胞形成的那些条件。参见例如latouche&sadelain《自然生物技术(naturebiotechnol.)》18,405-09,2000年4月;levine等人《免疫学杂志(j.immunol.)》159,5921-30,1997;maus等人,《自然生物技术(naturebiotechnol.)》20,143-48,2002年2月。还参见下文具体实例。
为了评估增殖信号的量级,抗原特异性t细胞群可用cfse标记并且分析细胞分裂的速率和数量。t细胞可在用结合抗原的纳米aapc刺激一至两轮之后用cfse标记。在那时,抗原特异性t细胞应表示总细胞群的2%至10%。抗原特异性t细胞可使用抗原特异性染色检测,使得抗原特异性t细胞的分裂速率和数量可后跟着cfse损失。在刺激之后,在变化的时间(例如12、24、36、48和72小时),可针对抗原呈递复合物染色和cfse两者分析细胞。用尚未结合抗原的纳米aapc刺激可用于确定增殖的基线水平。任选地,增殖可通过监测3h-胸苷的并入来检测,如本领域中已知。
使用纳米aapc获得的抗原特异性t细胞可通过任何适当的途径向患者给药,包括静脉内给药、动脉内给药、皮下给药、皮内给药、淋巴管内给药和瘤内给药。患者包括人类和家畜患者两者。
抗原特异性调节t细胞可用于实现免疫抑制效应,例如治疗或预防在移植患者中的移植物抗宿主疾病,或治疗或预防自体免疫疾病,如上文所列的那些,或过敏。调节t细胞的使用公开于例如us2003/0049696、us2002/0090724、us2002/0090357、us2002/0034500和us2003/0064067,其以全文引用的方式并入本文。
根据这些方法制备的抗原特异性t细胞可以在约5至10×106ctl/kg的体重(~7×108ctl/治疗)到约3.3×109ctl/kg的体重(~6×109ctl/治疗)范围内的剂量向患者给药(walter等人,《新英格兰医学杂志(newenglandjournalofmedicine)》333,1038-44,1995;yee等人,《实验医学杂志(jexpmed)》192,1637-44,2000)。在其它实施例中,患者可接受约103、约5×103、约104、约5×104、约105、约5×105、约106、约5×106、约107、约5×107、约108、约5×108、约109、约5×109或约1010个细胞每静脉内给药剂量。在另外其它实施例中,患者可接受在200μl大丸剂中的例如约8×106或约12×106细胞的结节内注射。用细胞给药的纳米apc的剂量包括约103、约5×103、约104、约5×104、约105、约5×105、约106、约5×106、约107、约5×107、约108、约5×108、约109、约5×109或约1010纳米aapc每剂量。
在示例性实施例中,对来源于患者的相同样品反复地进行富集和扩增过程。t细胞的群在第0天富集和活化,接着在培养液中合适的时间段(例如约3至20天)。随后,纳米aapc可用于针对所关注的抗原再次富集和扩增,进一步增加群纯度并且为进一步t细胞扩增提供附加刺激。纳米aapc和富集的t细胞的混合物可随后再次体外培养适当的时间段,或紧接着再输注入患者用于进一步体内扩增和治疗效果。富集和扩增可重复任何数目的次数直至实现期望的扩增。
在一些实施例中,每种针对不同抗原的纳米aapc的混合液可使用一次以同时针对多个抗原富集和扩增抗原t细胞。在此实施例中,每批带有不同mhc肽的多个不同纳米aapc批将组合并用于针对所关注的抗原中的每种同时富集t细胞。所得t细胞集合将针对这些抗原中的每种富集和活化,并且针对多个抗原的应答可因此同时培养。这些抗原可与单个治疗性干预有关;例如存在于单个肿瘤上的多个抗原。
在一些实施例中,患者在通过过继转移接受抗原特异性t细胞之前,或在直接给药带有通过患者的肿瘤的基因分析体外识别的新抗原的aapc之前,接受具有一种或多种检查点抑制剂的免疫治疗。在各种实施例中,(一种或多种)检查点抑制剂靶向ctla-4或pd-1/pd-l1中的一个或多个,其可包括针对此类目标的抗体,如单克隆抗体,或其部分,或其人类化或完全人类形式。在一些实施例中,检查点抑制剂治疗包含伊派利单抗或克珠达(派立珠单抗)。
在一些实施例中,患者接受约1轮到5轮的过继免疫治疗(例如一轮、两轮、三轮、四轮或五轮)。在一些实施例中,与一轮检查点抑制剂治疗同时或在其之后(例如约1天到约1周之后)进行过继免疫治疗的每种给药。在一些实施例中,在检查点抑制剂治疗之后约1天、约2天或约3天提供过继免疫治疗。
在另外其它实施例中,纳米aapc过继转移或直接输注到患者包含如在珠粒上的配体、靶向ctla-4或pd-1/pd-l1中的一个或多个的配体。在这些实施例中,所述方法可避免给药可溶检查点抑制剂治疗的某些副作用。
用于个人化治疗的方法
在一些方面,本发明提供用于个人化癌症免疫治疗的方法。所述方法使用aapc识别患者将对其应答的抗原,接着将适当的负载肽的aapc向患者给药,或接着离体抗原特异性t细胞的富集和扩增来实现。
全基因组定序已大大改变我们对癌症生物学的理解。癌症的测序已产生关于与许多人类癌症的发展有关的分子方法的重要数据。驱动突变已经在与调整三种主要细胞方法(1)细胞归宿,(2)细胞存活期和(3)基因组维护的路径有关的关键基因中识别。vogelstein等人,《科学(science)》339,1546-58(2013)。
全基因组测序还具有变革我们的癌症免疫治疗的方法的可能。测序数据可提供关于对于癌症免疫治疗的两者共享以及个人化目标的信息。大体上,突变蛋白为免疫系统外来的并且为假定的肿瘤特异性抗原。实际上,测序成果已限定如果不是数千也有数百的可能相关免疫目标。有限的研究已示出针对这些新表位的t细胞应答可在癌症患者中发现或通过癌症疫苗诱导。然而,针对特定癌症的此类应答的频率和在患者之间共享的此类应答的程度不熟知。对于我们对肿瘤特异性免疫应答的有限理解的一个主要原因为用于验证可能免疫相关目标的当前方法繁琐且费时。
因此,在一些方面,本发明提供用于检测针对在癌症中的新抗原的t细胞应答的高通量平台类方法。此方法使用用于检测针对癌症抗原的甚至低频t细胞应答的本文所述的aapc平台。理解此类应答的频率和个人之间的变化将对于癌症疫苗的设计和个人化癌症免疫治疗具有重要暗示。
虽然中枢耐受消除针对自蛋白的t细胞应答,但致癌突变诱导针对可形成t细胞应答的新表位。来源于整个外显子组测序的突变目录提供用于识别此类新表位的开始点。使用hla结合预测算法(srivastava,《科学公共图书馆综合卷(plosone)》4,e6094(2009),它已预测每种癌症可具有最多7至10个新表位。类似方法估计数百的肿瘤新表位。然而,此类算法在预测t细胞应答方面可具有低精确性,并且在hla的情形下仅10%的预测的结合表位期望结合(lundegaardc,《免疫学(immunology)》130,309-18(2010))。因此,预测的表位必须证实针对那些可能的新表位的t细胞应答的存在。
在某些实施例中,纳米aapc系统用于筛选在多种癌症中或在特定患者的癌症中诱导t细胞应答的新表位。癌症可例如通过整个外显子组测序基因分析。举例来说,在一组24种晚期腺癌中,识别平均约50种突变每种肿瘤。在大约分析的20,000种基因中,1327种具有至少一种突变,并且148种具有两种或更多种突变。识别974种错义突变,其中少附加数量的删除和插入。
候选肽的列表可在突变的蛋白中重叠九个氨基酸窗口产生。将从每种蛋白选择含有突变氨基酸的所有九个aa窗口和2个非突变“对照”。将使用mhc结合预测算法的共识(包括netmhc和稳定矩阵方法(smm))针对mhc结合在计算上评估这些候选肽。纳米aapc和mhc结合算法已经开发主要用于hla-a2等位基因。可调节共识预测的敏感性截断直至识别易控制数量的含有突变肽(~500)和非突变的对照肽(~50)。
然后合成肽库。带有aapc的mhc(例如a2)在多孔板中沉积并且被动地负载肽。cd8t细胞可从a2阳性健康供体和a2阳性胰腺癌症患者(或本文所述的其它癌症或疾病)两者的pbmc中分离。随后,分离的t细胞与负载的aapc一起在盘中培育用于富集步骤。在培育之后,将盘放置在磁场上并且去除含有未结合到aapc的无关t细胞的上清液。将培养结合到aapc的剩余t细胞并且使其扩增7到21天。通过用aapc和胞内ifnγ萤光染色再刺激评估抗原特异性扩增。
在一些实施例中,针对纳米aapc的阵列或库筛选患者的t细胞,并且结果用于诊断或预测目的。举例来说,针对突变的蛋白、过表达蛋白和/或其它肿瘤相关的抗原的t细胞抗肿瘤应答的数量和标识可用作分层风险的生物标记。举例来说,此类t细胞应答的数量可与疾病进展的风险或化学疗法的抗性或非应答性的风险成反比。在其它实施例中,针对纳米apc的阵列或库筛选患者的t细胞,并且t细胞应答存在或这些t细胞应答的数量或强度识别患者患有亚临床肿瘤,和/或提供肿瘤生物学的初始理解。
在一些实施例中,针对各自呈递不同候选肽抗原的顺磁性aapc的阵列或库筛选患者或受试者的t细胞。此筛选可提供大量关于受试者或患者的t细胞抗体库的信息,并且结果可用于诊断或预测目的。举例来说,针对突变蛋白、过表达蛋白和/或其它肿瘤相关的抗原的t细胞抗肿瘤应答的数量和标识可用作分层风险的生物标记,以监测免疫治疗的功效,或预测免疫治疗治疗的结果。另外,此类t细胞应答的数量或强度可与疾病进展的风险成反比或可预测化学疗法的抗性或非应答性。在其它实施例中,针对各自呈递候选肽抗原的纳米apc的阵列或库筛选受试者的或患者的t细胞,并且t细胞应答的存在或这些t细胞应答的数量或强度,例如通过识别自体免疫疾病或识别患者患有亚临床肿瘤,提供关于患者健康的信息。在这些实施例中,所述方法不仅识别可能疾病病况,而且提供疾病生物学的初始理解。
试剂/试剂盒
在本发明的另一个方面,在试剂盒中提供纳米aapc连同用于进行富集和扩增过程的组分。用于纳米aapc的合适的容器包括例如瓶子、小瓶、针筒和试管。容器可由多种材料(包括玻璃或塑料)形成。容器可具有无菌进入孔(例如容器可为静脉内溶液袋或具有可由皮下注射针刺穿的塞子的小瓶)。任选地,一种或多种不同抗原可结合到纳米aapc或可分别供应。可替代地或此外,试剂盒可包含用于t细胞的一种或多种多壁盘或培养盘。在一些实施例中,试剂盒包含密封的容器,其包含aapcs、磁体和(任选地)试管和/或用于进行磁性富集的溶液或缓冲液。
试剂盒可进一步包含第二容器,其包含医药学上可接受的缓冲液,如磷酸盐缓冲盐水、林格氏溶液和右旋糖溶液。它还可含有适用于最终用户的其它材料,包括其它缓冲液、稀释液、过滤器、针和针筒。
试剂盒还可含有用于评估抗原特异性t细胞活化或扩增的程度和功效的试剂,如针对特异性标记蛋白的抗体、mhci类或ii类分子复合物、tcr分子复合物、抗克隆型抗体等。
试剂盒还可包含含有用于诱导抗原特异性t细胞、扩增抗原特异性t细胞、以各种方案使用在试剂盒中的纳米aapc的方法的书面说明书的包装说明书。包装说明书可为未经批准的草案包装说明书或可为由食品和药物管理局(fda)或其它监管机构审批通过的包装说明书。
实例
实例1
过继t细胞治疗可介导癌症的持久消退。为了从天然t细胞快速产生大量的功能肿瘤特异性t细胞,我们开发使用顺磁性纳米级人工抗原呈递细胞的富集+扩增策略,其能够在磁性塔中富集稀少肿瘤特异性t细胞而同时活化它们。富集+扩增产生小鼠和人类肿瘤特异性t细胞的大于1000倍扩增,并且用通过富集+扩增产生的肿瘤特异性ctl治疗的小鼠具有显著较少肿瘤生长。通过富集+扩增以经济的可再生的形式精简大量肿瘤特异性t细胞的产生可为自体肿瘤免疫治疗方案的有力补充。
肿瘤特异性t细胞的过继转移可介导癌症1的持久消退。虽然预先存在的抗肿瘤应答仅可从少数的癌症患者2培养,但对广泛多种肿瘤抗原具有特异性的t细胞可通过具有肿瘤抗原3的天然前驱细胞的刺激来产生。此培养过程依赖于自体抗原呈递细胞和喂养细胞,其为对于每个个体患者4必须产生的复合物生物制剂,显著增加过继免疫治疗的成本和复杂度。
肿瘤特异性t细胞的扩增进一步因肿瘤特异性天然前体的稀有性而复杂,其可仅为百万分之一5-7。为了产生有效治疗8-10所需要的大量的肿瘤特异性t细胞,在许多周内淋巴细胞用抗原反复刺激,常常接着t细胞选择和亚克隆11。此劳动密集过程增加在最终细胞产物中的肿瘤特异性t细胞的总数和抗原特异性频率(或“纯度”)两者。抗原特异性频率为在转移之后对于理想扩增的独特重要的参数,因为竞争来自无关的共同转移的细胞的生长信号可显著减弱所关注的抗肿瘤t细胞的动态平衡扩增12-14。
因此,存在对可从天然前体快速产生大量和高频率的肿瘤特异性t细胞的技术的需要,而不添加细胞apc或喂养细胞的费用和复杂度。本发明因此提供使用纳米级人工抗原呈递细胞(纳米aapc)的t细胞富集和扩增策略。这里例示的纳米aapc为顺磁性的铁-聚葡萄糖纳米粒子,直径为50nm至100nm,用通过内源性apc递送的两种活化信号官能化:信号1,在结合tcr的mhc的情形下呈递同源抗原肽;以及信号2,调节t细胞应答并且促进有效活化的多个共刺激受体中的一个(图1,顶部)。顺磁性纳米aapc因此能够在磁性富集塔中捕获同源t细胞和诱导抗原特异性t细胞扩增(图1,底部)。
通过与纳米aapc一起培育天然、多克隆小鼠cd8+t淋巴细胞,使细胞-粒子混合物通过磁性塔,洗脱并且然后培养磁体结合部分进行用纳米aapc富集(图1)。为了评估富集的功效,对db-gp100黑素瘤抗原具有特异性的已知数量的thy1.1+pmeltcr转殖基因t细胞以1:1000比率与来自b6小鼠的thy1.2+cd8t细胞混合。在用pmelgp100特异性aapc富集之后,抗原特异性pmelt细胞的频率从在富集之前的0.07%增加大于10倍到在以剂量依赖性方式富集之后的1.17%(图2a)。优化与t细胞一起培育的纳米aapc的量增加富集效率并且产生最多95%的添加的pmelt细胞的回收率(图2b)。
通过用可溶mhc五聚体染色评估来自内源性b6cd8+脾细胞的野生型db-gp100细胞的富集。在富集之前db-gp100特异性频率低于可检测水平,但之后增加到0.30%。与db-gp100粒子一起培育的非特异性kb-trp2细胞的频率不增加(图2c)。
在富集之后,体外洗脱和培养富集细胞的磁体结合部分(阳性部分)和纳米aapc。为研究富集对后续增殖的影响,通过收集阴性部分(未结合到纳米aapc的cd8+t细胞)并将其添加回阳性部分,在对照样品中“未进行”富集程序(图3a)。
在扩增之后富集显著增强抗原特异性频率和总t细胞数量。在用kb-trp2纳米-aapc富集七天之后,与来自阴性+阳性未富集组的1.46%的细胞相比,17.6%的来自阳性部分的扩增的细胞为kb-trp2特异性(图3b)。富集程序产生全部抗原特异性细胞的2至3倍增加,不管阴性+阳性部分的总细胞的更大数量如何。我们假设全部t细胞扩增的增加可通过对淋巴细胞因子降低的竞争介导。
富集+扩增方法大体上适用于多种肿瘤和模型t细胞抗原,包括黑素瘤抗原gp100(db-gp100)、kb-限制的卵白蛋白抗原siin(kb-siin)以及结肠癌瘤抗原ld-ah1/a5(ld-a5)(图3d、图3e)。绝对数量的抗原特异性细胞和频率为抗原依赖性的。在一周之后kb-siin应答不断地产生20%抗原特异性细胞,而db-gp100特异性为总t细胞的大约5%并且ld-a5为总t细胞的大约7.5%。
根据所关注的抗原的已知前体频率估计t细胞增殖(表1)。对外来抗原的cd8应答的前体频率在10s/107至100s/107的范围内,7并且对于自身抗原如trp2期望在此范围的下端。db-gp100的前体频率已经在107中的10处测量,5并且对于kb-siinf在107中40至350处。在一周之后,由107多克隆cd8t细胞产生150,000trp2特异性细胞;因此,我们估计trp2特异性增殖在100至1000倍之间。相比之下,由107t细胞产生大约35,000db-gp100和150,000kb-siinf特异性t细胞,这表明对于每种抗原最多5,000倍扩增。这与在体内病毒感染之后观察的鲁棒扩增相当18。
为了验证这些估计,我们用增殖标记染料cfse标记天然t细胞群,其用每轮的t细胞分裂稀释一半。在e+e四天之后,kb-trp2四聚体结合t细胞已稀释其cfse低于可检测极限。用中等剂量的纳米aapc刺激的转殖基因pmelt细胞用于比较;这些细胞示出cfse荧光的多个峰,这表明在2至7轮的分裂之间。这允许我们确定富集+扩增trp2特异性t细胞已完成大于7轮的分裂,仅在四天之后与大于256倍扩增一致。扩增的t细胞示出cd62l低cd44高效应记忆表型,与鲁棒活化和增殖一致。
通过e+e的t细胞扩增与使用经trp2肽脉冲的成熟、骨髓衍生的树突状细胞扩增相比。一千万天然淋巴细胞的刺激产生2±0.5×104trp2-特异性t细胞,其中抗原特异性频率在0.5%至2.85%之间,比用e+e实现的数量和频率低大约10倍。这与在人类中通过apc和人工apc扩增一致,其中在一周的刺激之后抗原特异性应答经常不可检测19。
对多种肿瘤抗原的t细胞应答的同时产生将增加由单个天然t细胞群产生的抗肿瘤t细胞的数量,并且降低由于单个抗原下调的肿瘤免疫逃逸的可能性20-22。我们因此开发用于同时产生多个抗肿瘤群的单步e+e方案。
天然淋巴细胞与带有db-gp100、kb-siinf和kb-trp2mhc二聚体的纳米aapc一起培育,每种以标准单个抗原剂量。在“三”e+e一周之后,通过针对所关注的每种抗原的五聚体染色检测抗原特异性t细胞(图3f)。虽然每个群的频率低于在仅用一种抗原刺激的对照样品中发现的频率(图3g),但无论分开单独地或同时,总抗原特异性细胞相同(通过双向方差分析p>0.4)(图3g)。因此,对于每种肿瘤特异性t细胞群体,三e+e方案与单个抗原对照中的任一个一样有效。
过继性转移的肿瘤特异性t细胞与共转移的非肿瘤特异性旁观者细胞竞争生长信号12-14。然而,此效应尚未证实t细胞的抗原特异性扩增先前已经体外活化,如在富集+扩增期间出现。
我们因此以粗略估计具有和无e+e(分别10%和1%)的情况下实现的抗原特异性频率的比率组合肿瘤特异性pmelt细胞和多克隆、野生型b6细胞。在每组中,给药的pmelt细胞的总数相同(105);仅旁观者t细胞的量不同(106或107)。在接受较少(106)旁观者细胞的小鼠中观察最大数量和最高频率的pmelt细胞(图4a至图4b)。从这些动物的脾和淋巴结回收大约5.5±1.5×105pmelt细胞(图4b)。从接受107旁观者细胞的动物回收仅1.4±0.7×105pmelt细胞(通过用tukey后测试双向方差分析,p<0.05)。因此,在转移之后去除来自共转移细胞的竞争增强移植和扩增。
此外,肿瘤特异性t细胞与宿主细胞竞争生长信号24,其在过继转移之前已推动宿主放射和化疗类淋巴细胞耗尽的使用25,26。因此,接受106或107旁观者细胞的动物为在转移之前用500cgyγ辐射来辐射24小时或保持未经治疗任一者,产生四个实验组。未辐射的动物示出不良移植,其中在106或107旁观者组任一者中回收少于0.3×105pmelt细胞(图4a至图4b)。因此,去除转移的旁观者淋巴细胞和/或宿主淋巴细胞两者显著增加在宿主中的过继性转移肿瘤特异性t细胞的产量。
我们接下来确定通过富集+扩增用纳米aapc产生的肿瘤特异性淋巴细胞介导形成的黑素瘤的排斥反应。b16-f10细胞(侵略性、差免疫原性黑素瘤模型)皮下植入到b6宿主小鼠中并且使其生长八天直至肿瘤可触知。同时,cd8淋巴细胞从天然b6供体小鼠中分离并且针对db-gp100和kb-trp2抗原富集+扩增,然后在淋巴细胞耗尽一天之后转移到宿主。
接受肿瘤特异性e+e供体淋巴细胞的动物具有比未经治疗小鼠或接受针对不相关的kb-siinf抗原产生的等效数量的淋巴细胞的小鼠显著少的肿瘤生长(图4c)。在肿瘤注射十八天之后,对于未经治疗小鼠的平均肿瘤面积为130±12mm2,相比于对于kb-siinf治疗的小鼠为144±11mm2和对于db-gp100/kb-trp2治疗的小鼠为22±9mm2(通过用tukey后测试方差分析,p<0.05)。
由于过度的肿瘤负荷在第22天处死在未经治疗和kb-siinf治疗组中的所有小鼠。相比而言,在db-gp100/kb-trp2组中的小鼠直至第24天才被处死,并且2/8小鼠在移植2个月之后不具有可检测的肿瘤(通过mantel-cox,p<0.01)。在e+e治疗组(28天)中的中值存活期比未经治疗(20天)或非同源治疗(20天)组显著更大。因此,从天然细胞培养仅一周的的e+e淋巴细胞能够延迟并且在一些情况下,完全排斥形成的b16黑素瘤。
通过用hla-a2官能化的纳米aapc富集+扩增还在从天然淋巴细胞扩增人类抗肿瘤应答下有效。人类cd8+淋巴细胞从健康供体的外周血单个核细胞中分离,并且e+e用带有ny-eso1或mart1肿瘤抗原任一者的纳米aapc进行。在一周之后,产生44,000±21,000ny-eso1特异性细胞,表示大约1000倍前体扩增(表1,图5)。对于mart1应答,在一周中产生83,000±37,000;这表示大约100倍数扩增,反映甚至在健康供体27中发现的mart1应答的高前体频率(表1,图5)。因此,富集+扩增不限于鼠类t细胞,但还为用于天然、低频、抗肿瘤人类ctl的扩增的鲁棒方法。
用于癌症的广泛应用的过继免疫治疗受肿瘤特异性细胞的有成本效益和方便的来源的可用性限制。这里,我们开发用于从天然细胞快速扩增大量高频肿瘤特异性淋巴细胞的简化技术,其中在一周中大于1000倍扩增。我们进一步证实通过富集去除不相关的旁观者细胞在体外培养期间和在体内过继转移之后均将显著存活期和增殖优点赋予肿瘤特异性t细胞。
虽然抗原特异性t细胞可在t细胞扩增之后使用mhc四聚合物富集28-30,但我们的平台通过允许富集和扩增用单个试剂进行来简化此过程。此外,在不存在共刺激的情况下通过多聚mhc的tcr的交联可诱导t细胞细胞凋亡或失能31-33,其中在四聚体接合之后最多二分之一的抗原特异性细胞缺失。因此,用于t细胞富集和扩增两者的单个平台的使用简化并且改善现有方案。
肿瘤特异性t细胞现在可通过淋巴细胞的基因工程来产生以表达抗癌tcr或嵌合抗原受体(car)1并且为提高可用性的有前景的方法;然而,尚未通过内源性耐受机构调节的外来受体的使用理论上增加交叉反应性和毒性的可能性,在实验中观察具有显著毒性34。自体黑素瘤浸润淋巴细胞已证明在临床试验中高度有效,但不可从所有黑素瘤患者或对于大部分其它癌症2培养。
用于从内源性天然细胞产生应答的可靠方法可因此增加可用性和安全两者3。现有方案已用来源于天然细胞的应答展示令人鼓舞结果35,36,但依赖于在多周到数月内重复的刺激和克隆以产生在108和1010之间的给药的肿瘤反应性t细胞36-38每输注,这导致高成本和复杂度。就总数和纯度两者而言e+e为有前景的新颖方法,相比于现有尝试在较短时间段中产生鲁棒扩增。举例来说,在培养液中一周之后,ny-eso1用树突状细胞类方法的扩增为不可检测的或未报告任一者,使实现在4%至27%之间的抗原特异性纯度,其中1000倍扩增均更显著。相比之下,若干组已报告高前体频率mart1应答的有效扩增。举例来说,由
假设大约1至10每百万的肿瘤特异性t细胞前体频率,大约0.5×1010cd8t细胞从单个白细胞采集物收获,并且e+e观察具有1000至5000倍扩增,大于108抗原特异性t细胞可在一周中产生。同时扩增多个抗原将增加此数量,另外产生用于输注的足够的细胞。因此,通过排除培养细胞apc的需要和简化大量的高频肿瘤特异性t细胞的产生,富集+扩增可为自体肿瘤免疫治疗方案的有力补充。
方法
小鼠和试剂。pmeltcr/thy1arag-/-转基因小鼠维持为纯合体。c57bl/6j和balb/c小鼠购自杰克逊实验室(jacksonlaboratories)(缅因州巴港(barharbor,me))。所有小鼠根据约翰霍普金斯大学的机构审查委员会(johnshopkinsuniversity'sinstitutionalreviewboard)维持。荧光标记的单克隆抗体购自博莱德(biolegend)(加利福尼亚州圣地亚哥)。
mhc-ig二聚体和纳米aapc的制备。如所描述制备可溶的mhc-ig二聚体、kb-ig、db-ig和a2-ig并且用肽负载。19如所描述通过mhc-ig二聚体和抗cd28抗体(37.51;博莱德)直接共轭到macs微珠(美天旎生物技术公司(miltenyibiotec))制造纳米aapc。15
淋巴细胞分离。小鼠淋巴细胞从均匀化的小鼠脾和淋巴结获得,接着rbc的低渗裂解。细胞毒素淋巴细胞按照制造商的方案使用来自美天旎生物技术公司(德国科隆)的cd8无接触分离试剂盒和磁性富集塔分离。在适用的情况下,细胞在37℃下用羧基荧光素丁二酰亚胺基酯(cfse)标记15分钟,然后充分洗涤。对于人类研究,约翰霍普金斯大学的道德委员会审批通过本研究并且所有健康志愿者给出书面知情同意书。hla-a2+供体的pbmc通过密度梯度离心(通用电气医疗集团,淋巴细胞分离培养基ficoll-paque(lymphocyteseparationmediumficoll-paque,gehealthcare))获得。随后,cd8+t细胞按照制造商的方案使用来自美天旎生物技术公司(德国科隆)的cd8无接触分离试剂盒和磁性富集塔分离。经纯化的cd8+t细胞在4℃下用纳米aapc染色1h,并且利用ms塔(美天旎生物技术公司)磁性富集。
富集和扩增。1千万富集cd8的淋巴细胞在4℃下与10μl的纳米aapc一起培育1小时。细胞-粒子混合物随后穿过磁性富集塔,收集阴性部分并且洗脱阳性部分。混合分离的部分并且在96孔圆底盘中在完全rpmi-1640培养基中培养7天,在提供5%co2和37℃的含湿气培育箱中的96孔圆底盘(法尔康(falcon))中用10%人类自体血清和3%t细胞成长因子(tcgf)补充1周。培养基和tcgf一周补充一次。利用facs分析通过四聚体和mhc-ig染剂在第0天和第7天监测ctl的特定性。
旁观者体内实验。pmel和野生型b6cd8+t淋巴细胞的混合物以指定比率混合。在过继转移之前,细胞混合物用20μl的db-gp100纳米aapc培养一周。在指定组中在用msdnordiongammacell双cs137源极(约翰霍普金斯分子成像中心)过继转移之前一天,在宿主小鼠中通过半致命的辐射(500cgy)诱导暂时淋巴球減少症。小鼠在过继转移的当天和之后的当天两者用30,000单位腹膜内il-2治疗。在过继转移之后七天和二十天,每组三个小鼠被处死并且淋巴细胞从外周血、脾和腹股沟、颈和腋下淋巴结中分离,并且然后用抗thy1.1抗体染色。
肿瘤排斥反应实验。肿瘤排斥反应实验如上进行,例外为在过继t细胞转移之前十天皮下注射3×105b16黑素瘤细胞。在如上文所描述在过继转移之前一天诱导暂时淋巴球減少症。对于每个肿瘤宿主(最多每个供体3个宿主)来自每个供体的1千万天然淋巴细胞用于产生抗原特异性细胞,这表示在培养一周之后产生和转移大约2×105肿瘤特异性t细胞。小鼠在过继转移的当天和之后的当天两者用30,000单位腹膜内il-2治疗。使用数字卡尺以2天时间间隔监测肿瘤生长。当肿瘤达到150mm2时处死小鼠。
表1:抗原特异性t细胞扩增。估计每1千万淋巴细胞的t细胞前体频率。由1千万淋巴细胞产生的抗原特异性细胞(参考)。
实例2
新抗原的扩增
迄今描述的肿瘤抗原为来源于在肿瘤中过度表达的蛋白的先前已知的“共享抗原”,并且存在于来自多个患者的肿瘤上或在其之间共享。借助全基因组测序的出现,已经证明大部分癌症含有可结合到患者的mhc的克隆非同义单个碱基对取代基,由此打开免疫治疗的新途径。29后续分析已增强此想法。38-45这些“新抗原”具有优于作为肿瘤目标的共享抗原的理论优点,如对于肿瘤组织更大特定性并且可能较高亲和力tcr-mhc相互作用。然而,在每种癌症中突变的模式是独特的,并且方法必须开发用于快速个人化识别和这些新抗原的靶向。
为了使用富集+扩增针对新抗原产生t细胞应答,我们采用公布的对于小鼠黑素瘤系b16和结肠癌瘤系ct26描述的“mutomes”。46,47简单来说,组合基因组和转录组数据集以识别表达的单个碱基对取代基(图6a)。经由计算机提取每个sbs的上游和下游的八个或九个侧接氨基酸。这些~17个氨基酸序列然后通过netmhc处理,所述netmhc为使用人工神经网络48预测肽到人类hla以及小鼠mhc等位基因的结合的算法。此算法预测在对于ct26和b16的长度中的氨基酸新表位8到10个氨基酸(表2)。合成表示大范围预测亲和力的七个候选肽(2个来自ct26和5个来自b16)并且用于产生新表位特异性纳米aapc。然后用带有这些新表位的纳米aapc进行e+e并且在第7天评估mhc多聚体。
对于测试的两种ct26衍生的候选肽的两者(fps和saf),识别来自第7天培养液的抗原特异性群。图6b示出了ld-fps和ld-saf活化的样品的代表性第7天同源mhc染色。来源于b16mutome的肽示出响应性(db-ytg)和非响应性(kb-lay)染色图案(图6b);研究的总体2/5肽(db-ytg和kb-vdw)示出强应答,2/5示出中等应答(db-iam和db-rtf),和1/5为非响应性(kb-lay)。如通过netmhc(表2)预测的对于mhc的肽亲和力不精确预测e+e应答;分别在991nm和9066nm处强应答者ytg和vdw具有低预测亲和力,而分别在69nm和5nm处无应答者lay和模棱两可的应答者iam具有高预测亲和力。总体上,在第7天产生的细胞的总数近似于用共享的抗原db-gp100和ld-a5观察的那些数量,在15,000至40,000范围内(图6c),但少于共享的抗原kb-trp2和kb-siin。
表2.候选新表位
含有来源于b16肿瘤的新表位候选肽序列的列表,包括如通过netmhc预测的mhc亲和力。
仅用于实例2的参考文献:
(1)restifo,n.p.;dudley,m.e.;rosenberg,s.a.用于癌症的过继免疫治疗:利用t细胞应答(adoptiveimmunotherapyforcancer:harnessingthetcellresponse)《自然评论免疫学(nat.rev.immunol.)》2012,12,269-281。
(2)barrett,d.m.;singh,n.;porter,d.l.;grupp,s.a;june,c.h.用于癌症的嵌合抗原受体治疗(chimericantigenreceptortherapyforcancer)《医学评论年鉴(annu.rev.med.》2014,65,333-347。
(3)kershaw,m.h.;westwood,j.a;darcy,p.k.用于癌症治疗的基因工程化的t细胞(gene-engineeredtcellsforcancertherapy)《自然评论癌症(nat.rev.cancer)》2013,13,525-541。
(4)yee,c.用于过继转移的内源性t细胞的使用(theuseofendogenoustcellsforadoptivetransfer)《免疫学评论(immunol.rev.)》2014,257,250-263。
(5)morgan,r.a.;chinnasamy,n.;abate-daga,d.;gros,a.;robbins,p.f.;zheng,z.;dudley,m.e.;feldman,s.a.;yang,j.c.;sherry,r.m.;等人,在抗mage-a3tcr基因治疗之后的癌症消退和神经毒性(cancerregressionandneurologicaltoxicityfollowinganti-mage-a3tcrgenetherapy.)《免疫疗法杂志(jimmunother.)》2013,36,133-151.
(6)zhong,s.;malecek,k.在t细胞免疫治疗中t细胞受体亲和力和亲合力限定抗肿瘤应答和自体免疫性(t-cellreceptoraffinityandaviditydefinesantitumorresponseandautoimmunityint-cellimmunotherapy.)《会刊(proc.)》2013,110。
(7)wherry,e.j.t细胞耗尽(tcellexhaustion)《自然免疫学(nat.immunol.)》2011,131,492-499。
(8)rabinovich,g.a;gabrilovich,d.;sotomayor,e.m.通过肿瘤细胞介导的免疫抑制策略(immunosuppressivestrategiesthataremediatedbytumorcells)《免疫学年鉴(annu.rev.immunol.)》2007,25,267-296。
(9)dudley,m.e.;rosenberg,s.a.用于患有癌症的患者的治疗的过继细胞转移治疗(adoptive-cell-transfertherapyforthetreatmentofpatientswithcancer)《自然评论癌症(nat.rev.cancer)》2003,3,666-675。
(10)itzhaki,o.;hovav,e.;ziporen,y.;levy,d.;kubi,a.;zikich,d.;hershkovitz,l.;treves,a.j.;shalmon,b.;zippel,d.;等人,最低限度地过继转移治疗的建立和大规模扩增(establishmentandlarge-scaleexpansionofminimallyadoptivetransfertherapy)《免疫疗法杂志(jimmunother.)》2011,34,212-220。
(11)satthaporn,s.;robins,a.;vassanasiri,w.;el-sheemy,m.;jibril,j.a;clark,d.;valerio,d.;eremin,o.在患有可操作乳癌患者中树突状细胞功能异常(dendriticcellsaredysfunctionalinpatientswithoperablebreastcancer)《癌症免疫与免疫疗法(cancerimmunol.immunother.)》2004,53,510-518。
(12)hurwitz,a.a;watkins,s.k.在肿瘤微环境中的免疫抑制:树突状细胞介导的t细胞的耐受的作用(immunesuppressioninthetumormicroenvironment:arolefordendriticcell-mediatedtolerizationoftcells)《癌症免疫与免疫疗法(cancerimmunol.immunother.)》2012,61,289-293。
(13)ma,y.;shurin,g.v;gutkin,d.w.;shurin,m.r.肿瘤相关联的调节树突状细胞(tumorassociatedregulatorydendriticcells)《癌症生物学研讨会(semin.cancerbiol.)》2012,22,298-306。
(14)perica,k.;deleónmedero,a.;durai,m.;chiu,y.l.;bieler,j.g.;sibener,l.;
(15)zhang,n.;bevan,m.j.cd8(+)t细胞:免疫系统的步兵(cd8(+)tcells:footsoldiersoftheimmunesystem)《免疫(immunity)》2011,35,161-168。
(16)fahmy,t.m.;bieler,j.g.;edidin,m.;schneck,j.p.在t细胞活化之后提高的tcr亲合力:用于感测低密度抗原的机制(increasedtcravidityaftertcellactivation:amechanismforsensinglow-densityantigen)《免疫(immunity)》2001,14,135-143。
(17)perica,k.;tu,a.;richter,a.;bieler,j.g.;edidin,m.;schneck,j.p.通过纳米粒子集群的磁场诱导t细胞受体增强t细胞活化并刺激抗肿瘤活性(magneticfield-inducedtcellreceptorclusteringbynanoparticlesenhancestcellactivationandstimulatesantitumoractivity)《美国化学学会·纳米(acsnano)》2014,8,2252-2260。
(18)he,c.;hu,y.;yin,l.;tang,c.;yin,c.粒度和表面电荷对聚合纳米粒子的细胞吸收和生物分布的影响(effectsofparticlesizeandsurfacechargeoncellularuptakeandbiodistributionofpolymericnanoparticles)《生物材料(biomaterials)》2010,31,3657-3666。
(19)decuzzi,p.;godin,b.;tanaka,t.;lee,s.-y.;chiappini,c.;liu,x.;ferrari,m.尺寸和形状在血管内注射粒子的生物分布中的影响(sizeandshapeeffectsinthebiodistributionofintravascularlyinjectedparticles)《控制释放杂志(j.control.release)》2010,141,320-327。
(20)semete,b.;booysen,l.;lemmer,y.;kalombo,l.;katata,l.;verschoor,j.;swai,h.s.作为药物递送系统的plga纳米粒子的生物分布和安全的体内评价(invivoevaluationofthebiodistributionandsafetyofplgananoparticlesasdrugdeliverysystems)《纳米医学(nanomedicine)》2010,6,662-671。
(21)schamel,w.w.a;alarcón,b.在纳米级低聚物中静息tcr的组构(organizationoftherestingtcrinnanoscaleoligomers)《免疫学评论(immunol.rev.)》2013,251,13-20。
(22)rizzuto,g.a;merghoub,t.;hirschhorn-cymerman,d.;liu,c.;lesokhin,a.m.;sahawneh,d.;zhong,h.;panageas,k.s.;perales,m.-a.;altan-bonnet,g.;等人,自抗原特异性cd8+t细胞前体频率确定抗肿瘤免疫应答的质量(self-antigen-specificcd8+tcellprecursorfrequencydeterminesthequalityoftheantitumorimmuneresponse)《实验医学杂志(j.exp.med.)》2009,206,849-866。
(23)jenkins,m.k.;chu,h.h.;mclachlan,j.b.;moon,j.j.关于对肽主要组织相容性复合体配体具有特异性的t细胞的免疫前抗体库的组合物(onthecompositionofthepreimmunerepertoireoftcellsspecificforpeptide-majorhistocompatibilitycomplexligands)《免疫学年鉴(annu.rev.immunol.)》2010,28,275-294。
(24)jenkins,m.k.;moon,j.j.天然t细胞前体频率和补充在决定免疫应答量级中的作用(theroleofnaivetcellprecursorfrequencyandrecruitmentindictatingimmuneresponsemagnitude)《免疫学杂志(j.immunol.)》2012,188,4135-4140。
(25)chapuis,a.;ragnarsson,g.转移wt1反应性cd8+t细胞可介导抗白血病活性并且保持在移植后患者中(transferredwt1-reactivecd8+tcellscanmediateantileukemicactivityandpersistinpost-transplantpatients),《科学转化医学(sci.transl.med.)》2013,5,174ra27。
(26)klebanoff,c.a;gattinoni,l.;palmer,d.c.;muranski,p.;ji,y.;hinrichs,c.s.;borman,z.a;kerkar,s.p.;scott,c.d.;finkelstein,s.e.;等人,用于在小鼠中大量形成的肿瘤的成功cd8+t细胞过继免疫治疗的决定因素(determinantsofsuccessfulcd8+t-celladoptiveimmunotherapyforlargeestablishedtumorsinmice)《临床癌症研究(clin.cancerres.)》2011,17,5343-5352。
(27)wen,f.;thisted,r.对不同尺寸和生长的持续时间的肿瘤的实验免疫治疗的系统分析(asystematicanalysisofexperimentalimmunotherapiesontumorsdifferinginsizeanddurationofgrowth.…)2012,172-178。
(28)besser,m.j.;shapira-frommer,r.;treves,a.j.;zippel,d.;itzhaki,o.;hershkovitz,l.;levy,d.;kubi,a.;hovav,e.;chermoshniuk,n.;等人,在使用在转移性黑素瘤患者中的短期培养的肿瘤穿透淋巴细胞的过继转移的ii期研究中的临床应答(clinicalresponsesinaphaseiistudyusingadoptivetransferofshort-termculturedtumorinfiltrationlymphocytesinmetastaticmelanomapatients)《临床癌症研究(clin.cancerres.)》2010,16,2646-2655。
(29)segal,n.h.;parsons,d.w.;peggs,k.s.;velculescu,v.;kinzler,k.w.;vogelstein,b.;allison,j.p.在乳房和结肠直肠癌中的表位概貌(epitopelandscapeinbreastandcolorectalcancer)《癌症研究(cancerres.)》2008,68,889-892。
(30)smith-garvin,j.e.;koretzky,g.a;jordan,m.s.t细胞活化(tcellactivation)《免疫学年鉴(annu.rev.immunol.)》2009,27,591-619。
(31)durai,m.;krueger,c.;ye,z.;cheng,l.;mackensen,a.;oelke,m.;schneck,j.p.使用hla-ig类人工抗原呈递细胞(aapc)扩增的肿瘤特异性t细胞的体内功能功效(invivofunctionalefficacyoftumor-specifictcellsexpandedusinghla-igbasedartificialantigenpresentingcells(aapc))(《癌症免疫与免疫疗法cancerimmunol.immunother.)》2009,58,209-220。
(32)sarkar,s.;
(33)oelke,m.;kurokawa,t.;hentrich,i.;behringer,d.;cerundolo,v.;lindemann,a.基于细胞因子分泌作用在富集之后cd81抗原特异性细胞毒素t淋巴细胞的功能表征:与mhc四聚体技术比较(functionalcharacterizationofcd81antigen-specificcytotoxictlymphocytesafterenrichmentbasedoncytokinesecretion:comparisonwiththemhc-tetramertechnology)2000,544-549。
(34)oelke,m.;maus,m.v;didiano,d.;june,c.h.;mackensen,a.;schneck,j.p.通过hla-ig-涂布的人工抗原呈递细胞的抗原特异性细胞毒素t细胞的离体诱导和扩增(exvivoinductionandexpansionofantigen-specificcytotoxictcellsbyhla-ig-coatedartificialantigen-presentingcells)《自然医学》(nat.med.)2003,9,619-624。
(35)seliger,b.在人类肿瘤中mhci类异常和apm组分的分子机制(molecularmechanismsofmhcclassiabnormalitiesandapmcomponentsinhumantumors)《癌症免疫与免疫疗法(cancerimmunol.immunother.)》2008,57,1719-1726。
(36)kaluza,k.m.;thompson,j.m.;kottke,t.j.;flynngilmer,h.c.;knutson,d.l.;vile,r.g.过继t细胞治疗促进基因改变的肿瘤逃逸变体的出现(adoptivetcelltherapypromotestheemergenceofgenomicallyalteredtumorescapevariants)《国际癌症杂志(int.j.cancer)》2012,131,844-854。
(37)jensen,s.m.;twitty,c.g.;maston,l.d.;antony,p.a;lim,m.;hu,h.-m.;petrausch,u.;restifo,n.p.;fox,b.a.抑制调节t细胞的增加的频率和t细胞介导的抗原损失产生鼠类黑素瘤复发(increasedfrequencyofsuppressiveregulatorytcellsandtcell-mediatedantigenlossresultsinmurinemelanomarecurrence)《免疫学杂志(j.immunol.)》2012,189,767-776。
(38)duan,f.;duitama,j.;alseesi,s.;ayres,c.m.;corcelli,s.a.;pawashe,a.p.;blanchard,t.;mcmahon,d.;sidney,j.;sette,a.;等人,突变新表位的基因组和生物信息学分布显示预测抗癌免疫原性的新规则(genomicandbioinformaticprofilingofmutationalneoepitopesrevealsnewrulestopredictanticancerimmunogenicity)《实验医学杂志(j.exp.med.)》2014。
(39)rajasagi,m.;shukla,s.a;fritsch,e.f.;keskin,d.b.;deluca,d.;carmona,e.;zhang,w.;sougnez,c.;cibulskis,k.;sidney,j.;等人,在慢性淋巴细胞性白血病中的个人肿瘤特异性新抗原的系统识别(systematicidentificationofpersonaltumor-specificneoantigensinchroniclymphocyticleukemia)《血液(blood)》2014,124,453-462。
(40)fritsch,e.f.;rajasagi,m.;ott,p.a;brusic,v.;hacohen,n.;wu,c.j.人类的肿瘤新表位的hla结合特性(hla-bindingpropertiesoftumorneoepitopesinhumans)《癌症免疫学研究(cancerimmunol.res.)》2014,2,522-529。
(41)srivastava,p.k.;duan,f.利用用于人类癌症的免疫治疗的每个个体癌症的抗原指纹:基因组学示出了新方式及其挑战(harnessingtheantigenicfingerprintofeachindividualcancerforimmunotherapyofhumancancer:genomicsshowsanewwayanditschallenges)《癌症免疫与免疫疗法(cancerimmunol.immunother)》2013,62,967-974。
(42)tran,e.;turcotte,s.;gros,a.;robbins,p.f.;lu,y.;dudley,m.e.;parkhurst,m.r.;yang,j.c.;rosenberg,s.a.基于在患有上皮癌的患者中的突变特异性cd4+t细胞的癌症免疫治疗(cancerimmunotherapybasedonmutation-specificcd4+tcellsinapatientwithepithelialcancer)《科学转化医学(sci.transl.med.)》2014,9,641-645。
(43)matsushita,h.;vesely,m.;koboldt,d.癌症外显子组分析显示癌症免疫编辑的t细胞依赖性机制(cancerexomeanalysisrevealsat-cell-dependentmechanismofcancerimmunoediting)《自然(nature)》2012,482,400-404。
(44)yadav,m.;jhunjhunwala,s.;phung,q.t.;lupardus,p.;tanguay,j.;bumbaca,s.;franci,c.;cheung,t.k.;fritsche,j.;weinschenk,t.;等人,通过组合质谱和外显子组测序预测免疫原性肿瘤突变(predictingimmunogenictumourmutationsbycombiningmassspectrometryandexomesequencing)《自然(nature)》2014,515,572-576。
(45)gubin,m.m.;zhang,x.;schuster,h.;caron,e.;ward,j.p.;noguchi,t.;ivanova,y.;hundal,j.;arthur,c.d.;krebber,w.-j.;等人,检查点阻断癌症免疫治疗靶向肿瘤特异性突变抗原(checkpointblockadecancerimmunotherapytargetstumour-specificmutantantigens)《自然(nature)》2014,515,577-581。
(46)castle,j.c.;kreiter,s.;diekmann,j.;
(47)kim,k.;skora,a.d.;li,z.;liu,q.;tam,a.j.;blosser,r.l.;diaz,l.a;papadopoulos,n.;kinzler,k.w.;vogelstein,b.;等人,通过骨髓衍生的细胞的抑制抵抗免疫检查点阻断的转移性小鼠癌症的根除(eradicationofmetastaticmousecancersresistanttoimmunecheckpointblockadebysuppressionofmyeloid-derivedcells)《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》2014,111,11774-11779。
(48)gulukota,k.;sidney,j.;sette,a;delisi,c.用于预测肽结合主要组织相容性复合体分子的两种互补方法(twocomplementarymethodsforpredictingpeptidesbindingmajorhistocompatibilitycomplexmolecules)《分子生物学杂志(j.mol.biol.)》1997,267,1258-1267。
(49)ernst,b.;lee,d.;chang,j.m.;sprent,j.;surh,c.d.;cd,i.在胸腺中介导阳性选择肽配体控制在外周中的t细胞存活期和动态平衡增殖(thepeptideligandsmediatingpositiveselectioninthethymuscontroltcellsurvivalandhomeostaticproliferationintheperiphery)1999,11,173-181。
(50)dummer,w.;ernst,b.;leroy,e.;surh,c.d.;lee,d.在t细胞区室内的天然t细胞动态静止的自体调节(autologousregulationofnaivetcellhomeostasiswithinthetcellcompartment)《免疫学杂志(j.immunol.)》2001,166,2460-2468。
(51)wu,z.;bensinger,s.j.;zhang,j.;chen,c.;yuan,x.;huang,x.;markmann,j.f.;kassaee,a.;rosengard,b.r.;hancock,w.w.;等人,动态平衡增殖是移植耐受的障碍(homeostaticproliferationisabarriertotransplantationtolerance)《自然医学(nat.med.)》2004,10,87-92。
(52)klebanoff,c.a;khong,h.t.;antony,p.a;palmer,d.c.;restifo,n.p.储集、抑制因子和抗原呈递者:淋巴细胞耗尽如何增强t细胞介导的肿瘤免疫治疗(sinks,suppressorsandantigenpresenters:howlymphodepletionenhancestcell-mediatedtumorimmunotherapy)《免疫学趋势(trendsimmunol.)》2005,26,111-117。
(53)wrzesinski,c.;paulos,c.m.;kaiser,a.;muranski,p.;palmer,d.c.;gattinoni,l.;yu,z.;rosenberg,s.a;restifo,n.p.增加强度淋巴细胞耗尽增强过继性转移肿瘤特异性t细胞的肿瘤治疗功效(increasedintensitylymphodepletionenhancestumortreatmentefficacyofadoptivelytransferredtumor-specifictcells)《免疫疗法杂志(j.immunother.)》2010,33,1-7。
(54)gattinoni,l.;finkelstein,s.e.;klebanoff,c.a;antony,p.a;palmer,d.c.;spiess,p.j.;hwang,l.n.;yu,z.;wrzesinski,c.;heimann,d.m.;等人,通过淋巴细胞耗尽的去除动态平衡细胞因子储集增强过继性转移肿瘤特异性cd8+t细胞的功效(removalofhomeostaticcytokinesinksbylymphodepletionenhancestheefficacyofadoptivelytransferredtumor-specificcd8+tcells)《实验医学杂志(j.exp.med.)》2005202,907-912.
(55)alanio,c.;lemaitre,f.;law,h.k.w.;hasan,m.;albert,m.l.人类抗原特异性天然cd8+t细胞的枚举显示保守前体频率(enumerationofhumanantigen-specificnaivecd8+tcellsrevealsconservedprecursorfrequencies)《血液(blood)》2010;115,3718-3725。
(56)lu,x.;jiang,x.;liu,r.;zhao,h.;liang,z.通过珠粒类人工抗原呈递细胞扩增ptrp2特异性ctl的过继转移介导抗黑素瘤应答(adoptivetransferofptrp2-specificctlsexpandingbybead-basedartificialantigen-presentingcellsmediatesanti-melanomaresponse)《癌症快报(cancerlett.)》2008,271,129-139。
(57)cobbold,m.;khan,n.;pourgheysari,b.;tauro,s.;mcdonald,d.;osman,h.;assenmacher,m.;billingham,l.;steward,c.;crawley,c.;等人,在通过hla-肽四聚合物选择之后巨细胞病毒特异性ctl过继转移到干细胞移植患者(adoptivetransferofcytomegalovirus-specificctltostemcelltransplantpatientsafterselectionbyhla-peptidetetramers)《实验医学杂志(j.exp.med.)》2005,202,379-386。
(58)yee,c.;savage,p.a;lee,p.p.;davis,m.m.;greenberg,p.d.使用肽-mhc四聚合物从非均匀群中分离高亲合力黑素瘤反应性ctl(isolationofhighaviditymelanoma-reactivectlfromheterogeneouspopulationsusingpeptide-mhctetramers)《免疫学杂志(j.immunol.)》1999,162,2227-2234。
(59)bouquié,r.;bonnin,a.;bernardeau,k.;khammari,a.;dréno,b.;jotereau,f.;labarrière,n.;lang,f.诱导极少细胞凋亡以分离临床等级人类肿瘤特异性t淋巴细胞的快速且有效的hla多聚体类分拣程序(afastandefficienthlamultimer-basedsortingprocedurethatinduceslittleapoptosistoisolateclinicalgradehumantumorspecifictlymphocytes)《癌症免疫与免疫疗法(cancerimmunol.immunother.)》2009,58,553-566。
(60)cebecauer,m.;guillaume,p.;hozák,p.;mark,s.;everett,h.;schneider,p.;luescher,i.f.可溶mhc肽复合物诱导cd8+ctl的快速死亡(solublemhc-peptidecomplexesinducerapiddeathofcd8+ctl)《免疫学杂志(j.immunol.)》2005,174,6809-6819。
(61)guillaume,p.;legler,d.f.;boucheron,n.;doucey,m.-a.;cerottini,j.-c.;luescher,i.f.具有减弱的cd8结合选择性地诱导fas依赖性细胞凋亡的可溶主要组织相容性复合体肽八聚物(solublemajorhistocompatibilitycomplex-peptideoctamerswithimpairedcd8bindingselectivelyinducefas-dependentapoptosis),《生物化学杂志(j.biol.chem.)》2003,278,4500-4509。
(62)
(63)mackensen,a.;meidenbauer,n.;vogl,s.;laumer,m.;berger,j.;andreesen,r.使用用于治疗患有转移性黑素瘤的患者的抗原特异性cd8+t细胞过继t细胞治疗的i期研究(phaseistudyofadoptivet-celltherapyusingantigen-specificcd8+tcellsforthetreatmentofpatientswithmetastaticmelanoma),《临床肿瘤学杂志(j.clin.oncol.)》2006,24,5060-5069。
(64)chapuis,a.;ragnarsson,g.转移wt1反应性cd8+t细胞可介导抗白血病活性并且保持在移植后患者中(transferredwt1-reactivecd8+tcellscanmediateantileukemicactivityandpersistinpost-transplantpatients),《科学转化医学(sci.transl.med.)》2013,27。
(65)dudley,m.e.;wunderlich,j.;nishimura,m.i.;yu,d.;yang,j.c.;topalian,s.l.;schwartzentruber,d.j.;hwu,p.;marincola,f.m.;sherry,r.;等人,用于治疗患有转移性黑素瘤的患者的克隆的黑素瘤反应性t淋巴细胞的过继转移(adoptivetransferofclonedmelanoma-reactivetlymphocytesforthetreatmentofpatientswithmetastaticmelanoma)《免疫疗法杂志(j.immunother.)》2001,24,363-373。
(66)oelke,m.;moehrle,u.;chen,j.;behringer,d.;cerundolo,v.;lindemann,a.;mackensen,a.用于在肿瘤免疫治疗中过继转移的cd8+melan-a特异性细胞毒素t淋巴细胞的产生和纯化,用于在肿瘤免疫治疗1中过继转移的cd8
用于除实例2之外的整个申请的参考文献
(1)restifo,n.p;dudley,m.e.;rosenberg,s.《自然评论免疫学(nat.rev.immunol.)》2012,12,269-281。
(2)dudley,m.e.;rosenberg,s.《自然评论癌症(nat.rev.cancer)》2003,3,666-675。
(3)yee,c.《免疫学评论(immunol.rev.)》2014,257,250-263。
(4)itzhaki,o.;hovav,e.;ziporen,y.;levy,d.;kubi,a.;zikich,d.;hershkovitz,l.;treves,a.j.;shalmon,b.;zippel,d.;markel,g.;shapira-frommer,r.;schachter,j.;j,m.j.b.《免疫疗法杂志(jimmunother.)》2011,34,212-220。
(5)rizzuto,g.a;merghoub,t.;hirschhorn-cymerman,d.;liu,c.;lesokhin,a.m.;sahawneh,d.;zhong,h.;panageas,k.s.;perales,m.-a.;altan-bonnet,g.;wolchok,j.d.;houghton,a.n.j.《实验医学(exp.med.)》2009,206,849-866。
(6)jenkins,m.k.;chu,h.h.;mclachlan,j.b.;moon,j.《免疫学杂志年鉴(j.annu.rev.immunol.)》2010,28,275-294。
(7)jenkins,m.k.;moon,j.j.《免疫学杂志(j.immunol.)》2012,188,4135-4140。
(8)klebanoff,c.a;gattinoni,l.;palmer,d.c.;muranski,p;ji,y.;hinrichs,c.s.;borman,z.a;kerkar,s.p.;scott,c.d.;finkelstein,s.e.;rosenberg,s.a;restifo,n.p.《临床癌症研究(clin.cancerres.)》2011,17,5343-5352。
(9)wen,f.;thisted,r.2012,172-178。
(10)besser,m.j.;shapira-frommer,r.;treves,a.j.;zippel,d.;itzhaki,o.;hershkovitz,l.;levy,d.;kubi,a.;hovav,e.;chermoshniuk,n.;shalmon,b.;hardan,i.;catane,r.;markel,g.;apter,s.;ben-nun,a.;kuchuk,i.;shimoni,a.;nagler,a.;schachter,j.《临床癌症研究(clin.cancerres.)》2010,16,2646-2655。
(11)chapuis,a.;ragnarsson,g.《科学转化(sci.transl.)》,2013,27。
(12)ernst,b.;lee,d.;chang,j.m.;sprent,j.;surh,c.d.;cd,i.1999,11,173-181。
(13)dummer,w.;ernst,b.;leroy,e.;surh,c.d.;lee,d.《免疫学杂志(j.immunol.)》2001,166,2460-2468。
(14)wu,z.;bensinger,s.j.;zhang,j.;chen,c.;yuan,x.;huang,x.;markmann,j.f.;kassaee,a.;rosengard,b.r.;hancock,w.w.;sayegh,m.h.;turka,l.a.《自然医学(nat.med.)》2004,10,87-92。
(15)perica,k.;deleónmedero,a.;durai,m.;chiu,y.l.;bieler,j.g.;sibener,l.;
(16)perica,k.;tu,a.;richter,a.;bieler,j.g.;edidin,m.;schneck,j.p.《美国化学学会·纳米(acsnano)》2014。
(17)smith-garvin,j.e.;koretzky,g.a;jordan,m.s.《免疫学年鉴(annu.rev.immunol.)》2009,27,591-619。
(18)sarkar,s.;
(19)oelke,m.;maus,m.v;didiano,d.;june,c.h.;mackensen,a.;schneck,j.p.《自然医学(nat.med.)》2003,9,619-624。
(20)seliger,b.《癌症免疫与免疫疗法(cancerimmunol.immunother.)》2008,57,1719-1726。
(21)kaluza,k.m.;thompson,j.m.;kottke,t.j.;flynngilmer,h.c.;knutson,d.l.;vile,r.g.《国际癌症杂志(int.j.cancer)》2012,131,844-854。
(22)jensen,s.m.;twitty,c.g.;maston,l.d.;antony,p.a;lim,m.;hu,h.-m.;petrausch,u.;restifo,n.p.;fox,b.a.《免疫学杂志(j.immunol.)》2012,189,767-776。
(23)kaluza,k.m.;kottke,t.;diaz,r.m.;rommelfanger,d.;thompson,j.;vile,r.《人类基因治疗(hum.genether.)》2012,23,1054-1064。
(24)klebanoff,c.a;khong,h.t.;antony,p.a;palmer,d.c.;restifo,n.p.《免疫学趋势(trendsimmunol.)》2005,26,111-117。
(25)wrzesinski,c.;paulos,c.m.;kaiser,a.;muranski,p.;palmer,d.c.;gattinoni,l.;yu,z.;rosenberg,s.a;restifo,n.p.《免疫疗法杂志(j.immunother.)》2010,33,1-7。
(26)gattinoni,l.;finkelstein,s.e.;klebanoff,c.a;antony,p.a;palmer,d.c.;spiess,p.j.;hwang,l.n.;yu,z.;wrzesinski,c.;heimann,d.m.;surh,c.d.;rosenberg,s.a;restifo,n.p.《实验医学杂志(j.exp.med.)》2005,202,907-912。
(27)alanio,c.;lemaitre,f.;law,h.k.w.;hasan,m.;albert,m.l.《血液(blood)》2010,115,3718-3725。
(28)lu,x.;jiang,x.;liu,r.;zhao,h.;liang,z.《癌症快报(cancerlett.)》2008,271,129-139。
(29)cobbold,m.;khan,n.;pourgheysari,b.;tauro,s.;mcdonald,d.;osman,h.;assenmacher,m.;billingham,l.;steward,c.;crawley,c.;olavarria,e.;goldman,j.;chakraverty,r.;mahendra,p.;craddock,c.;moss,p.ah.《实验医学杂志(j.exp.med.)》2005,202,379-386。
(30)yee,c.;savage,p.a;lee,p.p.;davis,m.m.;greenberg,p.d.《免疫学杂志(j.immunol.)》1999,162,2227-2234。
(31)bouquié,r.;bonnin,a.;bernardeau,k.;khammari,a.;dréno,b.;jotereau,f.;labarrière,n.;lang,f.《癌症免疫与免疫疗法(cancerimmunol.immunother.)》2009,58,553-566。
(32)cebecauer,m.;guillaume,p.;hozák,p.;mark,s.;everett,h.;schneider,p.;luescher,i.f.《免疫学杂志(j.immunol.)》2005,174,6809-6819。
(33)guillaume,p.;legler,d.f.;boucheron,n.;doucey,m.-a.;cerottini,j.-c.;luescher,i.f.《生物化学杂志(j.biol.chem.)》2003,278,4500-4509。
(34)morgan,r.a.;chinnasamy,n.;abate-daga,d.;gros,a.;robbins,p.f.;zheng,z.;dudley,m.e.;feldman,s.a.;yang,j.c.;sherry,r.m.;phan,g.q.;hughes,m.s.;kammula,u.s.;miller,a.d.;hessman,c.j.;stewart,a.a.;restifo,n.p.;quezado,m.m.;alimchandani,m.;rosenberg,a.z.;nath,a.;wang,t.;bielekova,b.;wuest,s.c.;akula,n.;mcmahon,f.j.;wilde,s.;mosetter,b.;schendel,d.j.;laurencot,c.m.;rosenberg,s.a.《免疫疗法杂志(j.immunother.)》2013,36,133-151。
(35)hunder,n.n.;wallen,h.;cao,j.;hendricks,d.w.;reilly,j.z.;rodmyre,r.;jungbluth,a.;gnjatic,s.;thompson,j.a;yee,c.n.engl.《医疗杂志(j.med.)》2008,358,2698-2703。
(36)chapuis,a.;ragnarsson,g.《科学转化(sci.transl.)》2013,27。
(37)mackensen,a.;meidenbauer,n.;vogl,s.;laumer,m.;berger,j.;andreesen,r.《临床肿瘤学杂志(j.clin.oncol.)》2006,24,5060-5069。
(38)dudley,m.e.;wunderlich,j.;nishimura,m.i.;yu,d.;yang,j.c.;topalian,s.l.;schwartzentruber,d.j.;hwu,p.;marincola,f.m.;sherry,r.;leitman,s.f.;rosenberg,s.a.《免疫疗法杂志(j.immunother.)》2001,24,363-373。
(39)
- 还没有人留言评论。精彩留言会获得点赞!