使用T细胞用于培养自然杀伤细胞的方法与流程
本发明涉及使用t细胞用于产生自然杀伤细胞的方法,且更具体地,涉及用于产生自然杀伤细胞的方法,其包括使用cd4(+)t细胞作为饲养细胞培养种子细胞。
背景技术:
作为用于预防癌症的转移和复发并延长末期癌症患者生存时间的疗法,基于患者免疫功能的免疫疗法受到关注。近年来,使用表达抗原特异性嵌合抗原受体(car)的基因工程化的t细胞的免疫疗法已作为有前景的癌症治疗方式受到认可。然而,当使用其他人的t细胞时,由于主要组织相容性复合体(mhc)限制,其可引起系列的移植物抗宿主疾病(gvhd)。由于该原因,对于细胞疗法的商业化,自然杀伤(nk)细胞有效的多,其可用于同种异体移植且可大量产生并冷冻。
自然杀伤细胞被认为是占外周血淋巴细胞约10-15%且在天然免疫响应中起关键作用的淋巴样细胞。与t细胞不同的是,自然杀伤细胞以mhc非限制性方式识别其靶标,且自然杀伤细胞中活化的受体(如nkg2d、ncr(nkp30、nkp44或nkp46))与抑制性受体如kir或cd94/nkg2a竞争以展示活性并消除肿瘤靶t细胞。自然杀伤细胞可呈现抗病毒作用、抗gvh作用和抗癌作用。具体地,自然杀伤细胞直接杀伤恶性肿瘤,包括肉瘤、骨髓瘤、癌、淋巴瘤和白血病,或有助于通过诱导树突状细胞(dc)活性或肿瘤特异性细胞毒性t淋巴细胞(ctl)的适应性免疫活化,由此消除异常细胞,所述异常细胞为肿瘤细胞或正发展成为肿瘤细胞的细胞。
自然杀伤细胞的抗癌作用通过同种异体造血干细胞移植证实,且发现供体自然杀伤细胞抑制t细胞耗尽(depleted)的造血干细胞移植后的微肿瘤残留。此外,由于当在供体和接受者间存在kir(杀伤细胞免疫球蛋白样受体)-mhc错配时,供体自然杀伤细胞的移植物抗肿瘤(gvt)作用显著增加,同种异体自然杀伤细胞比使用患者自身具有减少功能的自体自然杀伤细胞有效的多。尽管该自然杀伤细胞具有作为对抗癌症或感染性疾病的治疗剂的潜力,正常人体内大多的自然杀伤细胞以休眠状态存在,且癌症患者体内的自然杀伤细胞由于癌细胞的免疫逃逸机制缺少其功能。为将自然杀伤细胞实际应用为治疗剂,需要能够识别并破坏肿瘤细胞的活化的自然杀伤细胞,且由于该原因,通过离体扩大培养自正常培养物或患者血液活化自然杀伤细胞是非常重要的。此外,由于体内的自然杀伤细胞数目有限,需要建立能够大量产生并冷冻有效呈现抗癌作用的自然杀伤细胞的技术。
在自然杀伤细胞的离体扩大培养中,将pbmc、cd3-细胞、cd3-cd56+细胞、cd56+细胞等用作种子细胞,并将刺激lps(goodier等人,j.immunol.165(1):139-147,2000)和cd3的细胞因子如il-2、il-12、il-15或il-21和okt-3抗体(condiotti等人,experimentalhematol.29(1):104-113,2001)用作用于自然杀伤细胞的生长因子。然而,单独使用上述生长因子允许自然杀伤细胞增加约3-10倍且不能实现足够的增殖。由于该原因,在数项研究中,存在使用多种类型的饲养细胞增殖自然杀伤细胞的尝试。已报道使用白血病细胞系ctv-1显示了较少增殖上的改进或无改进(north等人,j.immunol.178(1):85-94,2007),且使用ebv-lcl培养21天导致细胞数平均增加约490倍(berg等人,cytotherapy,11(3):341-355,2009)。已报道当使用通过在k562细胞系中表达4-1bbl和膜结合的il-15获得的人工apc(抗原递呈细胞)实施培养7天至3周时,细胞数平均增加90-209倍(fujisaki等人,cancerres.69(9):4010-4017,2009)。此外,已报道当培养具有在其中表达的mica、4-1bbl和il-15的k562细胞系3周时,细胞数平均增加350倍(gong等人,tissueantigens,76(6):467-475,2010),且当培养具有在其中表达的膜结合的il-15的k562细胞系3周同时以7天的时间间隔再次刺激细胞时,细胞数平均增加21,000倍(denman等人,plosone,7(1):e30264,2012)。此外,已报道当使用kl-1(人t淋巴母细胞)和ebv-转化的b细胞作为饲养细胞培养pbmc14天时,经诱导的自然杀伤细胞数平均增加约740倍(lim等人,cancerres.,73(8):2598-6607,2013)。
在韩国专利号10-1133185中,本发明的发明人公开了使用okt-3刺激的pbmc可用作饲养细胞,且还公开了当培养pbmc14天时,可诱导细胞数增加691倍(lim等人,plosone,7(1):e53611,2012)。此外,本发明的发明人还公开了当使用饲养细胞再次刺激pbmc两次或更多次时,可诱导细胞数增加数千至数万倍(wo2013/094988)。然而,在大量培养的情况中,用作饲养细胞所需的pbmc的量增加且自然杀伤细胞的培养结果依赖于每种供体的特征而变化,且出于这些原因,实际上难以实现用于商业化的原始材料的平稳供应和大量培养及供体的管理。
因此,本发明的发明人已作出大量努力开发能够替换pbmc的种子细胞,结果是,已经发现了在pbmc中,t淋巴细胞特别是辅助t细胞(th细胞)在自然杀伤细胞的增殖中非常重要,且可增殖同时具有th细胞的特性的t细胞白血病-淋巴瘤细胞系可选择性地诱导自然杀伤细胞的培养并允许自然杀伤细胞稳定增殖,由此完成本发明。
技术实现要素:
技术问题
本发明的目的是提供以有效和稳定的方式通过培养和增殖细胞产生自然杀伤细胞的方法。
本发明的另一目的是提供通过上述方法产生的自然杀伤细胞、用于预防或治疗癌症或感染性疾病的组合物,其包含自然杀伤细胞作为活性成分,还提供用于预防或治疗癌症或感染性疾病的方法,其包括向有此需要的受试者施用治疗有效量的上述组合物。
技术方案
为实现上述目的,本发明提供用于产生自然杀伤细胞的方法,其中将所述t细胞特别是cd4(+)t细胞用作刺激自然杀伤细胞的饲养细胞。
本发明还提供由上述方法产生的自然杀伤细胞。
本发明还提供用于预防或治疗癌症或感染性疾病的组合物,其包含上述自然杀伤细胞作为活性成分。
本发明还提供用于预防或治疗癌症或感染性疾病的方法,其包括向由此需要的受试者施用治疗有效量的上述组合物。
附图简述
图1a显示测量有核细胞总数目和自然杀伤细胞数目的增加的结果,其通过使用多种t细胞作为饲养细胞培养pbmc种子细胞14天获得(下表1中的条件1)。
图1b显示测量有核细胞总数目和自然杀伤细胞数目的增加的结果,其通过使用多种t细胞作为饲养细胞培养pbmc种子细胞,且随后使用作为饲养细胞发挥作用的多种t细胞再次刺激细胞并培养细胞直至第21天获得(下表1中的条件2)。
图1c显示测量有核细胞总数目和自然杀伤细胞数目的增加的结果,其通过使用多种t细胞作为饲养细胞培养cd3(+)细胞耗尽的pbmc种子细胞14天获得(下表1中的条件3)。
图1d显示测量有核细胞总数目和自然杀伤细胞数目的增加的结果,其通过使用pbmc饲养细胞培养cd3(+)细胞耗尽的pbmc种子细胞,且随后使用作为饲养细胞发挥作用的多种t细胞再次刺激细胞并培养细胞直至第21天获得(下表1中的条件4)。
图1e显示测量在下表1的条件3下培养的不良增殖供体的有核细胞总数目的增加的结果,。
图2显示使用多种t细胞作为饲养细胞培养的自然杀伤细胞的细胞活力。(a):在表1中所示的条件1下培养的自然杀伤细胞的细胞活力;(b):在表1中所示的条件2下培养的自然杀伤细胞的细胞活力;(c):在表1中所示的条件3下培养的自然杀伤细胞的细胞活力;(d):在表1中所示的条件4下培养的自然杀伤细胞的细胞活力;和(e)在表1中所示的条件2下培养的不良增殖供体的自然杀伤细胞的细胞活力。
图3a显示通过使用多种t细胞作为饲养细胞培养pbmc种子细胞14天获得的自然杀伤细胞的同一性和纯度(下表1中的条件1)。
图3b显示通过使用多种t细胞作为饲养细胞培养pbmc种子细胞且随后使用作为饲养细胞发挥作用的多种t细胞再次刺激细胞并培养细胞直至第21天获得的自然杀伤细胞的同一性和纯度(下表1中的条件2)。
图3c显示通过使用多种t细胞作为饲养细胞培养cd3(+)细胞耗尽的pbmc种子细胞14天获得的自然杀伤细胞的同一性和纯度(下表1中的条件3)。
图3d显示通过使用pbmc饲养细胞培养cd3(+)细胞耗尽的pbmc种子细胞且随后使用作为饲养细胞发挥作用的多种t细胞再次刺激细胞并培养细胞直至第21天获得的自然杀伤细胞的同一性和纯度(下表1中的条件4)。
图3e显示通过在下表1的条件3下培养获得的不良增殖供体的自然杀伤细胞的同一性和纯度。
图4a显示通过使用多种t细胞作为种子细胞培养pbmc种子细胞14天获得的自然杀伤细胞中的活化标记物(下表1中的条件1)。
图4b显示通过使用多种t细胞作为饲养细胞培养cd3(+)细胞耗尽的pbmc种子细胞14天获得的自然杀伤细胞中的活化标记物(下表1中的条件3)。
图5a显示自然杀伤细胞对抗多种癌症的细胞杀伤活性,所述自然杀伤细胞通过使用多种t细胞作为饲养细胞培养pbmc种子细胞14天获得(下表1中的条件1)。
图5b显示自然杀伤细胞对抗多种癌症的细胞杀伤活性,所述自然杀伤细胞通过使用多种t细胞作为饲养细胞培养pbmc种子细胞,且随后使用作为饲养细胞发挥作用的多种t细胞再次刺激细胞并培养细胞直至第21天获得(下表1中的条件2)。
图5c显示自然杀伤细胞对抗多种癌症的细胞杀伤活性,所述自然杀伤细胞通过使用多种t细胞作为饲养细胞培养cd3(+)细胞耗尽的pbmc种子细胞14天获得(下表1中的条件3)。
图5d显示自然杀伤细胞对抗多种癌症的细胞杀伤活性,所述自然杀伤细胞通过使用pbmc饲养细胞培养cd3(+)细胞耗尽的pbmc种子细胞,且随后使用作为饲养细胞发挥作用的多种t细胞再次刺激细胞并培养细胞直至第21天获得(下表1中的条件4)。
图5e显示不良增殖的供体的自然杀伤细胞对抗k562的细胞杀伤活性,所述自然杀伤细胞通过在下表1的条件3下培养获得。
实施本发明的最佳模式
除非另外表明,否则本文使用的全部技术和科学术语具有与本发明所属领域的技术人员通常所理解相同的含义。一般而言,下文将进行描述的本文使用的命名法和实验方法是本领域熟知且通常采用的那些。
在本发明中,发现了在通过使用多种t细胞作为饲养细胞增殖细胞产生自然杀伤细胞的过程中,t细胞特别是cd4(+)t细胞诱导自然杀伤细胞的选择性增殖,且因此自然杀伤细胞的增殖增加且其细胞杀伤活性也增加。
一方面,本发明涉及用于产生自然杀伤细胞的方法,其中cd4(+)t细胞用作刺激自然杀伤细胞的饲养细胞。
具体地,本发明涉及用于产生自然杀伤细胞的方法,其中离体分离的cd4(+)t细胞、离体培养的cd4(+)t细胞或cd4(+)t细胞系用作饲养细胞,且将一种或多种类型的选自下组的细胞用作种子细胞:外周血细胞、外周血白细胞、外周血单核细胞(pbmc)、富集的自然杀伤细胞和分离的自然杀伤细胞。
本发明的用于产生自然杀伤细胞的方法可具体包括下述步骤,但不限于此:
(i)从人外周血分离外周血白细胞、外周血单核细胞(pbmc)、t细胞耗尽的单核细胞或自然杀伤细胞的步骤;
(ii)在灭活(inactivated)或非灭活(non-inactivated)的t细胞存在下,在含有白介素蛋白和对t细胞具有低亲和力的t细胞刺激抗体的培养基中培养自然杀伤细胞的步骤;
(iii)在含有白介素蛋白和对t细胞具有低亲和力的t细胞刺激抗体的培养基中使用t细胞再次刺激自然杀伤细胞并进一步培养自然杀伤细胞的步骤。
此后,将进一步对本发明进行详述。
自然杀伤(nk)细胞在正常人的血液中以约10-15%的量存在,且当其与非自身材料反应时具有高杀伤能力。自然杀伤细胞非特异性且立即发挥作用响应多种病毒对细胞的感染,细菌的穿透或异常细胞的产生以由此去除外来物质。然而,存在于体内的自然杀伤细胞的数目并不大,但呈现治疗效果所需的有效自然杀伤细胞的数目应该是非常大的。由于该原因,需要用于增殖和产生有效自然杀伤细胞的方法。
用于增殖自然杀伤细胞的方法包括:包括仅分离自然杀伤细胞、使用饲养细胞适当刺激分离的自然杀伤细胞和增殖经刺激的自然杀伤细胞的方法,和包括从外周血淋巴细胞(pbl)或外周血单核细胞(pbmc)选择性地增殖自然杀伤细胞以由此获得相对大量的自然杀伤细胞的方法。为从外周血分离自然杀伤细胞,可使用本领域的技术人员已知的常规方法,也可购买和使用商业上可获得的自然杀伤细胞。
pbmc分成淋巴细胞和单核细胞,且淋巴细胞进一步分为t细胞、b细胞和自然杀伤细胞。其中,t细胞进一步分为辅助t细胞(th细胞)和细胞毒性的t细胞(tc细胞)。在使用pbmc饲养细胞培养自然杀伤细胞的方法中,诱导t细胞的大量增殖,并限制自然杀伤细胞的增殖,且由于该原因,在培养前或培养后需要去除t细胞的昂贵复杂的步骤。因此,在本发明中,检查了pbmc群中的任何细胞群是否有助于自然杀伤细胞的增殖。结果是,发现t细胞有助于自然杀伤细胞的增殖,且其中,th细胞在自然杀伤细胞的增殖中非常重要。基于该发现,将可增殖同时具有th细胞特性的t细胞用作在自然杀伤细胞的培养中能够pbmc的饲养细胞。
如本文使用的术语"饲养细胞"指即使这些细胞不能增殖,但由于其代谢活性产生多种代谢物以由此辅助靶细胞增殖的细胞。
在本发明中使用的饲养细胞可以是离体分离的cd4(+)t细胞、离体扩大培养的cd4(+)t细胞或cd4(+)t细胞系(t淋巴瘤细胞系)。在本发明中使用的cd4(+)t细胞系(t淋巴瘤细胞系)具体是h9、hut78、loucy、molt3、molt-13、peer、rpmi8402或tall-01,更具体为h9或hut78,但不限于此。
用作饲养细胞的t细胞可以是其增殖受到抑制的灭活细胞或非灭活的细胞。具体地,可灭活t细胞以确保其安全性。作为用于灭活t细胞的方法,可使用本领域已知的常规方法,且例如,可使用以γ-射线辐射t细胞的方法。如果使用非灭活的t细胞,由于其大多数为肿瘤细胞,在培养的过程中其可被自然杀伤细胞杀伤。
如本发明中所述的增殖方法使用t细胞作为饲养细胞。该方法具有的优势是,由于在种子细胞如pbmc中选择性地诱导自然杀伤细胞的培养而不去除t细胞,可稳定实施培养而在供体间的培养结果中无显著差异。因此,可以有效和稳定的方式获得增加的量的自然杀伤细胞用于治疗性目的。
如本文使用的术语"种子细胞"意为通过适当的培养能够增殖为自然杀伤细胞的细胞。具体地,在本发明中使用的种子细胞可以是选自下组的一种或多种类型:外周血细胞、外周血白细胞、pbmc(外周血单核细胞)、富集的自然杀伤细胞和分离的自然杀伤细胞,但不限于此。更具体地,种子细胞可以是cd3(+)细胞耗尽的细胞(cd3(-)细胞)。
此外,在本发明的用于产生自然杀伤细胞的方法中,自然杀伤细胞具体地在含有白介素蛋白和对于t细胞具有低亲和力的t细胞刺激抗体的培养基中培养,但本发明的范围不限于此。在本文中,对于t细胞具有低亲和力的t细胞刺激抗体是与cd3抗原特异性反应的蛋白,其为与t细胞受体(tcr)结合以形成抗原识别复合物的分子的群,其中cd3分子具有比tcr更长的细胞内结构域并发挥功能以将抗原识别信号转移入细胞。可在本发明中使用的对于t细胞具有低亲和力的t细胞刺激抗体具体为抗cd3抗体,更具体为okt-3、ucht1、hit3a等,最具体地为okt-3抗体。
如本文使用的术语“白细胞介素(il)蛋白”指由免疫细胞如淋巴细胞、单核细胞或巨噬细胞产生的生物活性蛋白的集合,且意为一组细胞因子中的分子类型。可在本发明中使用的白介素蛋白的实例包括il-2、il-15、il-12、il-18、il-21等。具体地,白介素蛋白是il-2蛋白。
本发明的用于产生自然杀伤细胞的方法具体包括:将自然杀伤细胞和t淋巴瘤细胞系添加至常规动物细胞培养基如aim-v培养基、rimi1640、cellgroscgm、x-vivo20、imdm或dmem;将白介素蛋白和对于t细胞具有低亲和力的t细胞刺激抗体添加至培养基;和培养细胞,但不限于此。在本发明的实例中,在含有okt-3抗体和il-2的培养基中培养细胞。在本发明中,以0.1-100ng/ml的浓度使用okt-3抗体,具体地约10ng/ml,且以10-2000u/ml的浓度使用il-2,具体地约500u/ml。此外,培养基可进一步含有血清或血浆和其他支持淋巴细胞增殖的生长因子。添加至培养基的血清或血浆的类型无具体限制,且因此可将多种商业可获得的血清或血浆类型用于本发明。具体地,在本发明中使用自体人血清或血浆。
本发明的用于产生自然杀伤细胞的方法包括下述步骤:在作为刺激自然杀伤细胞的饲养细胞的t细胞存在下,在含有白介素蛋白和对于t细胞具有低亲和力的t细胞刺激抗体的培养基中培养自然杀伤细胞。为在培养步骤中使用,具体地将饲养细胞和种子细胞以至少1:1,更具体地2:1-20:1,最具体地5:1的比率混合,但不限于此。在本文中,术语"比率"指基于细胞数目的比率。
此外,在本发明的用于产生自然杀伤细胞的方法中,使用作为饲养细胞发挥作用的cd4(+)t细胞刺激和培养自然杀伤细胞可重复实施进而获得增加数目的自然杀伤细胞。因此,本发明的方法可进一步包括以至少1:1,具体地2:1-20:1,最具体地5:1的饲养细胞/种子细胞比率再次刺激自然杀伤细胞。在本文中,术语"比率"指基于细胞数目的比率。
在再次刺激中使用的cd4(+)t细胞具体为h9或hut78细胞,但不限于此。此外,其增殖受到抑制的灭活细胞或非灭活细胞可用于再次刺激。
此外,再次刺激具体以5-12天的时间间隔(更具体地7天,但不限于此)实施于含有白介素蛋白和对于t细胞具有低亲和力的t细胞刺激抗体的培养基中,且可重复至少一次。本发明的方法可进一步包括在含有白介素蛋白和对于t细胞具有低亲和力的t细胞刺激抗体的培养基中培养细胞的步骤后在无抗体的培养基中培养细胞的步骤。
在本文中,对于t细胞具有低特异性的t细胞刺激抗体可以是抗-cd3抗体,具体地是至少一种选自下组的抗体:okt3、ucht1和hit3a抗体,最具体地okt3抗体,且白介素蛋白可以是选自下组的至少一种:il-2、il-12、il-15、il-18和il-21,具体地il-2。
如本文使用的术语"刺激"意为通过添加饲养细胞等诱导自然杀伤细胞的增殖。在刺激步骤中,还可使用对于t细胞具有低亲和力的t细胞刺激抗体。如本文使用的术语"再次刺激"意为在一段培养时间后通过添加饲养细胞和/或对于t细胞具有低亲和力的t细胞刺激抗体至培养基再次诱导自然杀伤细胞的增殖。
在本发明的方法中,培养自然杀伤细胞至少5天,具体地5-60天,更具体地14-21天,但不限于此。
刺激可在培养的第0天开始并可以5-12天(具体地7天,但不限于此)的时间间隔重复。最终刺激后可在第5天或更晚,具体地第14天收获细胞,但不限于此。
可冷冻根据如上文所述的本发明的方法培养的自然杀伤细胞,且即使当其融化时功能上也不受损。此外,这些细胞相比使用pbmc作为饲养细胞的常规细胞表达较高水平的活化受体如nkp44和nkp46,且因此具有增加的杀伤肿瘤细胞并分泌细胞因子的能力,表明这些细胞可呈现出色的抗癌效果。因此,根据本发明,对于肿瘤治疗有效的细胞治疗剂可使用大量能够临床应用的活化的自然杀伤细胞制备。
实施例
在下文中,将参照实施例进一步详述本发明。对本领域的技术人员显而易见的是,这些实施例仅出于阐述性目的且不应理解为是对本发明范围的限制。因此,本发明的实质范围将通过附加的权利要求及其等同进行限定。
实施例1:pbmc和多种t细胞的制备
1-1:pbmc种子细胞和cd3(+)-耗尽的种子细胞的制备
将外周血单核细胞(pbmc)分散入小瓶并在液氮中冷冻。融化一个冷冻的pbmc小瓶并转移入50ml的管中,并将细胞悬浮于包含1vol%fbs(胎牛血清)或自体血浆的20mlpbs(磷酸盐缓冲液)中并于4℃在1200rpm离心10分钟。将pbmc沉淀悬浮于10ml的macs运行缓冲液中,并使用adam细胞计数系统对细胞进行计数。
将1×107个pbmc种子细胞分别分散入50ml管中。为获得pbmc饲养细胞和cd3(+)细胞耗尽的种子细胞,将5×107个细胞分别转移入50ml新鲜的管中并于4℃在1200rpm离心10分钟。在pbmc饲养细胞的情况中,将细胞沉淀悬浮于10ml含有1vol%自体血浆的cellgro培养基(cellgenix)中。
为获得cd3(+)-耗尽的种子细胞,将400μl的macs运行缓冲液和100μl的cd3磁珠(miltenyibiotech)添加至5×107个pbmc细胞沉淀,随后将其在4℃温育20分钟。使用10-20ml的macs运行缓冲液洗涤获得的细胞,且随后于4℃在1200rpm离心10分钟并再次悬浮于2ml的macs运行缓冲液中。使用配备了variomacs(miltenyibiotech)的cs柱(miltenyibiotech,130-041-305)分离细胞,并洗涤柱以获得20ml的最终体积,由此回收细胞。使用adam细胞计数系统计数细胞,并将1×107个细胞悬浮于50ml新鲜的管中并于4℃在1200rpm离心10分钟。将细胞沉淀悬浮在10ml含有1vol%自体血浆的cellgro培养基(cellgenix)中。
1-2:pbmc饲养细胞和多种t饲养细胞
将实施例1-1中分离的5×107个pbmc饲养细胞沉淀悬浮于10ml含有1vol%自身血浆的cellgro培养基(cellgenix)中并在γ-射线辐射仪中使用2000cgy的γ射线辐射,由此制备pbmc饲养细胞。
从培养烧瓶回收多种t细胞并于4℃在1200rpm离心10分钟,且随后将5×107个细胞悬浮于每个管并于4℃在1200rpm离心10分钟。将t细胞悬浮于10ml含有1vol%自体血浆的cellgro培养基(cellgenix)中,且随后在γ射线辐射仪中使用15000-30000cgy的γ射线辐射,由此制备t细胞,用于作为饲养细胞使用。
实施例2:使用多种t细胞作为饲养细胞培养自然杀伤细胞
使用t细胞作为饲养细胞用于培养pbmc种子细胞和cd3(+)-耗尽的种子细胞的条件示于下文表1中。
[表1]
2-1:14天培养条件
对于自然杀伤细胞的培养,将500iu的il-2和10ng/ml的okt-3添加至培养容器(烧瓶或细胞培养袋)。在培养的第0天,对于每种细胞类型,将pbmc种子细胞和pbmc饲养细胞或t饲养细胞以0.5-10ml的量以1:5的比率添加至培养容器,并将0.5-10ml含有1vol%自身血浆的cellgro培养基(cellgenix)添加至细胞,随后将其在温育器中于37℃静止培养3-5天(条件1)。此外,在培养的第0天,对于每种细胞类型,将cd3(-)种子细胞和pbmc饲养细胞或t种子细胞以0.5-10ml的量以1:5的比率添加至培养容器,并将0.5-10ml含有1vol%自身血浆的cellgro培养基(cellgenix)添加至细胞,随后将其在温育器中于37℃静止培养3-5天(条件3)。
在表1中所示的条件1和3的情况中,在培养的第3-5天计数细胞,并使用含有500iu的il-2(proleukin)和1vol%自身血浆的cellgro培养基(cellgenix)稀释至约2-5×105个细胞/ml的密度。在适当的培养容器中再次静止培养稀释的细胞。接下来,悬浮培养细胞直至第14天同时以2-3天的时间间隔计数细胞并稀释至5-10×105个细胞/mlcellgro培养基(cellgenix)(含有500iu的il-2和1vol%自身血浆)的密度。在悬浮培养的第14天,收获自然杀伤细胞。
比较了在条件1下培养的自然杀伤细胞的增殖速率,结果是,表明pbmc饲养细胞在有核细胞总数目(tnc)上显示了147倍的增加,且h9饲养细胞和hut78饲养细胞分别显示了298倍的增加和485倍的增加,其显著高于pbmc饲养细胞显示的倍数增加。此外,在全部有核细胞中自然杀伤细胞的增殖速率中,pbmc饲养细胞显示了自然杀伤细胞数目247倍的增加,h9饲养细胞显示了2752倍的增加,其比pbmc饲养细胞所示的高约10倍,且hut78饲养细胞显示了5649倍的增加,其比pbmc饲养细胞所示的高约20倍。此外,其他t细胞显示了低于pbmc所示的增殖速率(参见图1a)。
此外,比较了条件3下培养的自然杀伤细胞的增殖速率,结果是,pbmc显示了有核细胞总数目184倍的增加,h9饲养细胞显示了62倍的增加,且hut78饲养细胞显示了217倍的增加(参见图1c)。其他t细胞全部显示低于h9所示的增殖速率。
2-2:21天培养中的再次刺激条件
对于自然杀伤细胞的培养,将500iu的il-2和10ng/ml的okt-3添加至培养容器(烧瓶或细胞培养袋)。在培养的第0天,对于每种细胞类型,将pbmc种子细胞和pbmc饲养细胞或t饲养细胞以0.5-10ml的量以1:5的比率添加至培养容器,并将0.5-10ml含有1vol%自身血浆的cellgro培养基(cellgenix)添加至细胞,随后将其在温育器中于37℃静止培养3-5天(条件1)。对于在培养第7天的再次刺激,使用pbmc饲养细胞和多种t饲养细胞再次刺激在第0天使用pbmc饲养细胞刺激和培养的自然杀伤细胞,且使用与饲养细胞相同的细胞再次刺激在第0天使用t饲养细胞刺激和培养的细胞(条件2)。此外,在培养的第0天,对于每种细胞类型,将cd3(-)种子细胞和pbmc饲养细胞以0.5-10ml的量以1:5的比率添加至培养容器,并将0.5-10ml含有1vol%自身血浆的cellgro培养基添加至细胞,随后将其在温育器中于37℃静止培养3-5天,由此实现自然杀伤细胞的第一刺激。在该情况中,对于在培养第7天的再次刺激,使用pbmc饲养细胞和多种t饲养细胞再次刺激自然杀伤细胞并培养21天(条件4)。
对于在培养第7天的再次刺激,计数正在培养的自然杀伤细胞并使用含有1vol%自身血浆的cellgro培养基(cellgenix)稀释至2-5×105个细胞/ml的密度,并将pbmc和t饲养细胞稀释3至10倍并悬浮于含有1vol%自身血浆的cellgro培养基(cellgenix)中,且随后分别在γ-射线辐射仪中通过使用2000和15000-30000cgy的γ-射线辐射灭活。将500iu的il-2和10ng/ml的okt-3添加至培养基,并共培养所制备的两种类型的细胞。接下来,悬浮培养细胞直至第21天同时以2-3天的时间间隔计数细胞并使用含有500iu的il-2和1vol%自身血浆的cellgro培养基(cellgenix)稀释至5-10×105个细胞/ml的密度。在悬浮培养的第21天,收获自然杀伤细胞。
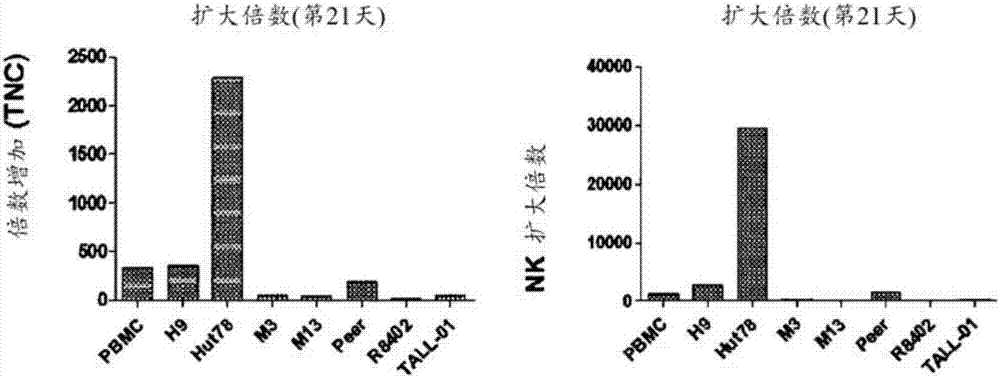
比较了表1中所示的条件2下培养的自然杀伤细胞的增殖速率。结果是,显示有核细胞总数目的倍数增加较高的顺序为:pbmc(334倍)、h9(358倍)和hut78(2282倍)。自然杀伤细胞数目的倍数增加对于pbmc为1257倍,对于h9为2677倍且对于hut78为29455倍(图1b)。
此外,比较了在表1条件4下培养同时实施使用pbmc饲养细胞的第一刺激及使用pbmc饲养细胞和每种类型的t饲养细胞的第二刺激的自然杀伤细胞的增殖速率。结果是,显示有核细胞总数目的倍数增加对于pbmc为1402倍、对于h9为720倍且对于hut78为1393倍(图1d)。其他t细胞显示了细胞数目约500倍的增加。
如上文所述,可以看到的是,相比pbmc,就增殖速率而言,在14天培养和21天培养中,h9和hut78可用作非常出色的饲养细胞。
使用cd3(-)细胞作为种子细胞和使用多种t细胞作为饲养细胞实施的评价结果略不同于使用pbmc作为饲养细胞获得的结果。具体地,自然杀伤细胞的增殖速率在pbmc饲养细胞和hut78饲养细胞间相似,且h9饲养细胞显示了相比pbmc饲养细胞减少的自然杀伤细胞增殖速率。
2-3:不良增殖供体细胞的培养
选择当在表1的条件4下使用pbmc饲养细胞培养时显示不良增殖的供体细胞并用于比较自然杀伤细胞的增殖速率。
结果是,表明使用pbmc饲养细胞的培养显示了自然杀伤细胞数目中平均21倍的增加,但h9和hut78分别显示了64倍的增加和161倍的增加。具体地,hut78显示了细胞数目的增加,其比pbmc饲养细胞所示高约8倍(图1e)。因此,可以看到的是,不同于pbmc饲养细胞,对于自然杀伤细胞的增殖,t饲养细胞可克服供体间的差异。
在pbmc饲养细胞的情况中,由于当t细胞存在于种子细胞时诱导了t细胞而非自然杀伤细胞的增殖,必然需要从种子细胞耗尽t细胞的过程。此外,由于供体间的增殖速率差异是显著的,对于之前选择的供体需要预培养过程。然而,发现了t细胞特别是表达cd4的t细胞可诱导自然杀伤细胞的选择性增殖,而无论种子细胞中存在或不存在t细胞,且当实施使用pbmc饲养细胞的培养时也可容易地诱导不良增殖的供体细胞的增殖。
实施例3:体外细胞活力
采用能够结合胞内核的pi染料的细胞计数系统中,将adam细胞计数系统用于比较性地评价体外细胞活力。通过从测量的总细胞计数减去测量的死细胞计数确定活细胞数目,且随后使用下述等式计算细胞活力。
细胞活力(%)=(活细胞计数/总细胞计数)×100
在表1中所示的条件1和2(即,使用多种饲养细胞的pbmc种子细胞的14天培养和21天培养)下培养后,测量自然杀伤细胞的活力。结果是,表明使用pbmc饲养细胞显示了低于80%的活力,且h9和hut78显示80%或更高的活力(图2a和2b)。
在表1中所示的条件3和4(即,使用多种t饲养细胞的cd3(+)t细胞耗尽的种子细胞的14天培养和21天培养)下培养后,测量自然杀伤细胞的活力。结果是,表明在全部条件中显示了约90%或更高的高活力。在不良增殖供体细胞的情况中,pbmc饲养细胞显示了82%的活力,且hut78显示了93%的活力,其比pbmc饲养细胞所示至少高10%(图2c和2d)。
使用pbmc和多种t饲养细胞培养14天或21天的细胞的活力一般在cd3(-)种子细胞中高于在pbmc种子细胞中,且在种子细胞类型间未显示显著差异。然而,在不良增殖的供体细胞的情况中,hut78显示了比pbmc饲养细胞高约10%的活力。
因此,可以看到的是,hut78细胞是用于培养自然杀伤细胞的饲养细胞,就细胞活力而言,其比pbmc有效。
实施例4:细胞表型的体外分析
在培养之前和之后收集根据实施例1和2的方法培养的自然杀伤细胞并在1200rpm离心5分钟,并通过抽吸去除培养基。使用1ml的facs缓冲液(含有2.5%fbs的pbs)稀释细胞,计数,且随后使用facs缓冲液稀释至5×106个细胞/ml的密度。将100l经稀释的细胞溶液悬浮于每个5mlfacs管(falcon,352052)中,并使用下述抗体分析了细胞的表型:
管1:抗-人cd3-fitc(bdpharmingen,555332)、抗-人cd16-pe(bdpharmingen,555407)、抗-人cd56-pe-cy5(bdpharmingen,555517)
管2:抗-人cd14-fitc(bdpharmingen,555397)、抗-人cd19-pe(bdpharmingen,555413)、抗-人cd3-pe-cy5(bdpharmingen,555341)
管3:抗-人cd3-fitc、抗-人nkg2a-pe(r&dsystem,fab1059p)、抗-人cd56-pe-cy5
管4:抗-人cd3-fitc、抗-人nkg2c-pe(r&dsystem,fab138p)、抗-人cd56-pe-cy5
管5:抗-人cd3-fitc、抗-人nkg2d-pe(r&dsystem,fab139p)、抗-人cd56-pe-cy5
管6:抗-人cd3-fitc、抗-人nkp30-pe(bdpharmingen,558407)、抗-人cd56-pe-cy5
管7:抗-人cd3-fitc、抗-人nkp44-pe(bdpharmingen,558563)、抗-人cd56-pe-cy5
管8:抗-人cd3-fitc、抗-人nkp46-pe(bdpharmingen,557991)、抗-人cd56-pe-cy5
管9:抗-人cd3-fitc、抗-人dnam-1-pe(bdpharmingen,559789)、抗-人cd56-pe-cy5
管10:抗-人cd3-fitc、抗-人cd25-pe(bdpharmingen,555432)、抗-人cd56-pe-cy5
管11:抗-人cd3-fitc、抗-人cd62l-pe(ebioscience,12-0629-42)、抗-人cd56-pe-cy5
管12:抗-人cd3-fitc、抗-人cd69-pe(r&dsystems,fab23591p)、抗-人cd56-pe-cy5
管13:抗-人cd3-fitc、抗-人cxcr3-pe(bdpharmingen,557185)、抗-人cd56-pe-cy5
管14:抗-人cd3-fitc、抗-人cd57-pe(bdpharmingen,560844)、抗-人cd56-pe-cy5
管15:抗-人cd3-fitc、pe小鼠igg1k同型对照(bdpharmingen,555749)、抗-人cd56-pe-cy5
管16:fitc小鼠igg1k同型对照(bdpharmingen,555748)、pe小鼠igg1k同型对照(bdpharmingen,555749)、pe-cy5小鼠igg1k同型对照(bdpharmingen)
在冷温将管染色30分钟,并将染色的细胞添加至2ml的facs缓冲液并在1500rpm离心5分钟。去除上清,并再次将残留的细胞添加至2ml的facs缓冲液并在1500rpm离心5分钟。接下来,去除上清,并将残留的细胞悬浮于300μl的facs缓冲液中,并使用facslsriifortessa(bectondickinson)分析了其表型,由此确定细胞的同一性和纯度。含量表示为cd3(-)cd56(+)细胞和cd16(+)cd56(+)细胞的含量,且对于t细胞使用cd3(+)测量纯度,对于单核细胞使用cd14(+)测量纯度,且对于b细胞使用cd19(+)测量纯度。
4-1:细胞同一性和纯度
分析了在表1中所示的条件1和2下培养的自然杀伤细胞的同一性和纯度。结果是,使用多种饲养细胞培养pbmc种子细胞14天后评价的自然杀伤细胞的含量对于pbmc为15.9%,对于h9为73.3%且对于hut78为83.3%,且培养21天后评价的自然杀伤细胞的含量对于pbmc为17.4%、对于h9为61.1%且对于hut78为83.5%(参见图3a和3b)。因此,可以看到的是,当将含有t细胞的pbmc用作种子细胞时,在pbmc饲养细胞的情况中,t细胞增殖了80%或更多,而在h9和hut78的情况中,自然杀伤细胞而非t细胞选择性增殖。具体地,hut78显示了80%或更多的高自然杀伤细胞含量。
分析了在表1中所示的条件3和4下培养的自然杀伤细胞的同一性和纯度。结果是,表明由于在两种条件下都使用了t细胞耗尽的cd3(-)种子细胞,全部类型的饲养细胞都显示了95%或更高的高自然杀伤细胞含量,且t细胞、单核细胞和b细胞的含量经测量全部为1%或更少(图3c和3d)。
此外,在表1所示的条件3下培养的不良增殖的供体细胞的情况中,表明使用pbmc饲养细胞的培养相比使用hut78的培养显示了纯度上约4%的减少和cd16表达上约16%的减少(图3e)。因此,可以看到的是,表达cd4的t细胞可仅诱导自然杀伤细胞的选择性增殖且可显著克服供体间自然杀伤细胞的培养的差异。
4-2:细胞表达标记物
除细胞的同一性和纯度,还分析了依赖于饲养细胞的类型而不同的典型自然杀伤细胞报道分子的表达。
分析了在表1的条件1下培养的自然杀伤细胞的细胞表型。结果是,对于nkp44、nkp46和cd69,观察到培养条件间表型上的差异(图4a)。
此外,分析了表1的条件3下培养的自然杀伤细胞的细胞表型。结果是,显示nkp44和nkp46的表达在使用h9和hut78的培养中高于使用pbmc的培养,且cd69的表达在使用pbmc的培养和使用hut78的培养间相似,但在使用h9的培养中增加(图4b)。
因此,可以看到的是,尽管细胞表型标记物的表达的确依赖于种子细胞的类型不同,但自然杀伤细胞活化标记物如nkp44和nkp46的表达在使用t饲养细胞的培养中显著高于使用pbmc饲养细胞的培养。这些标记物在自然杀伤细胞的活性中是重要的因素,且上述结果表明自然杀伤细胞的效力在使用t细胞的培养中高于使用pbmc饲养细胞的培养。
实施例5:对抗多种肿瘤细胞系的体外细胞杀伤活性
将1×106个细胞的每种靶肿瘤细胞系(k562、hut7、huh-7等)分散入每个15ml的管中并离心。随后,在1ml的rpmi1640-10%fbs培养基中悬浮细胞沉淀,其后将30μl的1mmcalcein-am(molecularprobe,c34852)添加其中,且随后在温育器中于37℃将细胞染色1小时同时使用银纸阻断光。使用calcein-am染色的肿瘤细胞系以10-15ml的rpmi1640-10%fbs培养基洗涤并离心,并在10ml的rpmi中悬浮沉淀至1×105个细胞/ml的浓度。
将3×106个自然杀伤细胞分散入每个15ml的管中并离心,并在rpmi1640-10%fbs培养基中以相对靶肿瘤细胞系预期的比率悬浮沉淀。将100μl每种经制备的靶肿瘤细胞系和自然杀伤细胞系分散入圆底96孔板的每个孔,并一式三份制备各孔。对每个自发释放的孔,添加100μl经染色的肿瘤细胞系和100μl的rpmi1640-10%fbs培养基。对每个最大释放孔,添加100μl经染色的肿瘤细胞系和100μl的2%triton-x100溶液。为校正rpmi1640-10%fbs培养基和2%triton-x100溶液中存在的自发荧光值,添加200μl的rpmi1640-10%fbs培养基以制备中值,添加100μl的2%triton-x100溶液至100μl的rpmi1640-10%fbs培养基以制备两溶液混合物的值。将通过从中值减去混合物的值获得的差异(a)添加至最大释放值,由此校正自发荧光值。
光遮蔽条件下在温育器中于37℃温育细胞4小时,且随后在2000rpm离心平板3分钟。将100μl上清添加至96-孔黑板的每个孔,并使用荧光平板读取器(perkinelmer,victorx3)测量荧光值(od480/535nm)。基于测量的荧光值,使用下述等式计算自然杀伤细胞的肿瘤细胞杀伤活性:
杀伤的%=(样品孔的平均荧光值–自发孔的平均荧光值)/{(最大孔的平均荧光值+a)–自发孔的平均荧光值}×100
允许使用多种饲养细胞培养的自然杀伤细胞与多种肿瘤细胞系反应,并测量自然杀伤细胞的直接肿瘤细胞杀伤活性。
评价了在表1所示的条件1(使用多种饲养细胞的pbmc种子细胞的14天培养)下培养的自然杀伤细胞对抗血液癌细胞系k562、肝癌细胞系huh-7、淋巴瘤细胞系hut78、脑瘤细胞系u87-mg、成视网膜细胞瘤细胞系snuot-rbl、成神经细胞瘤细胞系sk-n-sh和卵巢癌细胞系ovcar-3的细胞杀伤活性。结果是,表明相比使用h9和hut78的培养,使用pbmc饲养细胞的培养显示了对抗全部肿瘤靶标更高的细胞杀伤活性(图5a)。
测量了表1中所示的条件2(pbmc种子细胞的21天培养)下培养的自然杀伤细胞的细胞杀伤活性。结果是,表明对抗k562肿瘤细胞系的细胞杀伤活性较高的顺序为hut78>h9>pbmc(图5b)。
此外,评价了在条件3(使用多种饲养细胞的cd3(-)种子细胞的14天培养)下培养的自然杀伤细胞对抗血癌细胞系k562、肝癌细胞系huh-7、淋巴瘤细胞系hut78、脑瘤细胞系u87-mg、成视网膜细胞瘤细胞系snuot-rbl、成神经细胞瘤细胞系sk-n-sh和卵巢癌细胞系ovcar-3的杀伤活性。结果是,表明相比使用pbmc饲养细胞的培养,使用h9和hut78的培养显示了对抗大多数肿瘤靶标(排除k562)更高的细胞杀伤活性,且具体地,该差异在对自然杀伤细胞的杀伤活性具有抗性的癌细胞的情况中更加显著(图5c)。
测量了在表1中所示的条件4(cd3(-)种子细胞的21-天培养)下培养的自然杀伤细胞的细胞杀伤活性。结果是,表明对抗k562肿瘤细胞系的细胞杀伤活性在饲养细胞类型间相似(图5d)。饲养细胞类型间该特异性的不显著差异似乎是由于以相同的方式在种子细胞的第一刺激中使用pbmc且仅在第二刺激中使用pbmc和多种t细胞。
在不良增殖供体细胞的情况中,测量了表3的条件3下培养的自然杀伤细胞的细胞杀伤活性。结果是,表明hut78显示最高的对抗k562肿瘤细胞系的杀伤活性,且h9和pbmc饲养细胞显示相似的杀伤活性(图5e)。
总之,在大多数条件下,hut78显示最高的对抗多种肿瘤细胞系的细胞杀伤活性。具体地,使用h9和hut78培养的自然杀伤细胞显示较高的对抗具有抗性的肿瘤细胞系的杀伤活性,表明h9和hut78细胞就效力而言是优于pbmc的饲养细胞。
在条件1、2、3和4下培养的自然杀伤细胞的特性总结于下表2-5中。
[表2]
条件1下培养的自然杀伤细胞的特性
平均值(sd)
[表3]
条件2下培养的自然杀伤细胞的特性
平均值(sd)
[表4]
条件3下培养的自然杀伤细胞的特性
平均值(sd)
[表5]
条件4下培养的自然杀伤细胞的特性
平均值(sd)
工业应用性
如上文所述,本发明的使用t细胞用于产生自然杀伤细胞的方法是能够通过从少量种子细胞仅选择性地增殖自然杀伤细胞产生自然杀伤细胞同时保持自然杀伤细胞的高杀伤活性的方法。本发明的方法可产生大量可被冷冻且因此可用于细胞治疗剂的商业化的自然杀伤细胞。
尽管参照具体特征已对本发明进行了详述,对本领域技术人员显而易见的是,本说明书仅针对优选的实施方案,且并不限制本发明的范围。因此,本发明的实质范围将通过附加的权利要求及其等同进行限定。
- 还没有人留言评论。精彩留言会获得点赞!