用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
本申请涉及细胞免疫疗法。具体地,涉及一种通过向多能性干细胞中导入编码期望抗原特异性t细胞受体的基因来制备细胞免疫疗法用细胞的方法。
背景技术:
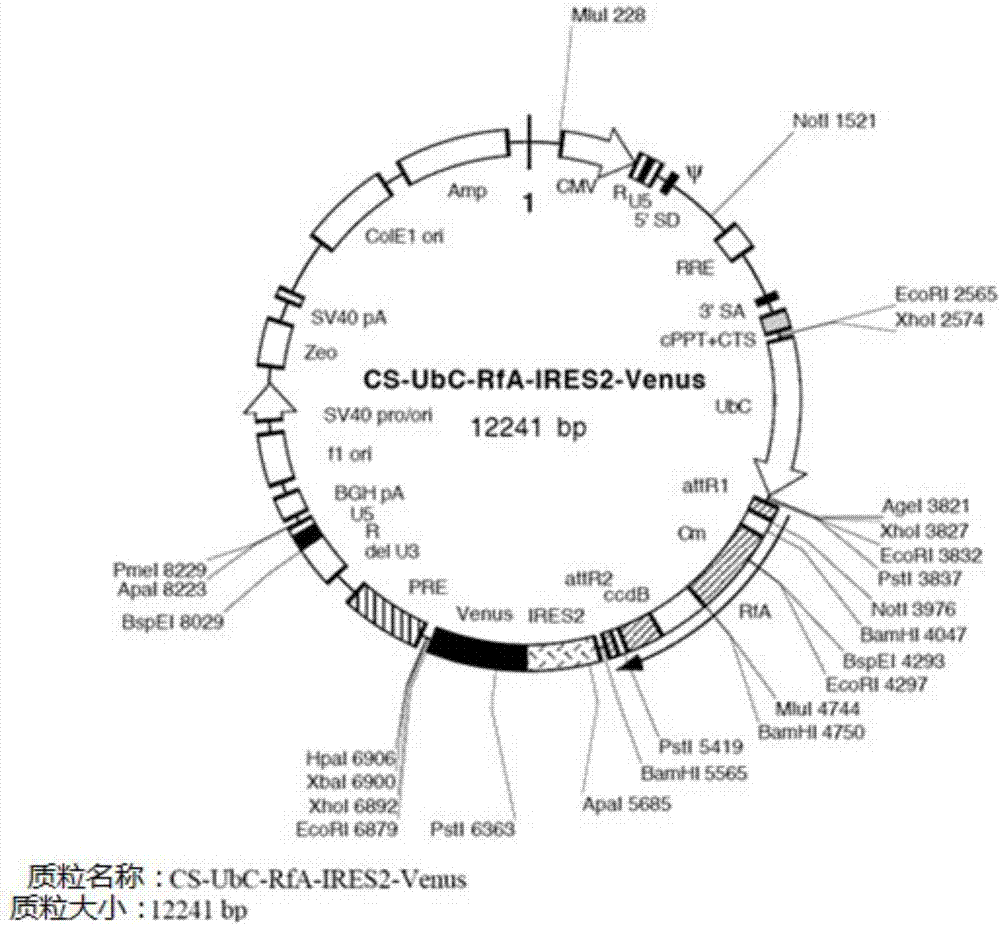
:每个t细胞表达具有不同特异性的t细胞受体(tcr)。当传染病发展时,具有适合特异性的t细胞会增殖从而形成t细胞群(克隆集落),这种t细胞群会与病原体进行斗争。这是获得性免疫的基本理念。如果有可能人工扩增具有期望特异性的t细胞,就可将扩增的t细胞用于过继性免疫治疗。给定t细胞的扩增被称为“克隆”。事实上,抗原特异性t细胞的自体移植已进行了临床实施,这种抗原特异性t细胞是通过扩增取自患者的抗原特异性t细胞而制得。然而,几乎所有的自体t细胞移植治疗不使用纯化到“克隆”细胞程度的细胞群。此外,细胞的重复体外继代培养可能造成杀死癌细胞功能的损失。提出了一种通过使细胞不死化而能够使其无限增殖的细胞提供方法。可使细胞不死化并使其增殖而形成克隆的细胞群。细胞不死化的方法可以包括细胞与癌细胞的融合以及在细胞因子存在下借助刺激tcr而进行的长期培养。然而,由于细胞为癌细胞,由此获得的不死化t细胞的自体移植可能是危险的。此外,克隆过程可能降低细胞功能。至今业已提出的移植t细胞的细胞免疫疗法简单介绍如下。a.使用重编程技术克隆t细胞提出的方法中,通过利用重编程技术对具有编码抗原特异性tcr的基因的干细胞进行克隆扩增。期望通过该方法来解决t细胞自体移植中的问题。具体而言,通过核移植或建立ips细胞技术从t细胞生成多能性干细胞。针对该理念业已提交了专利申请(wo2008/038579和wo2011/096482)。关于该方法的论文也已在2010和2013年发表:1)wataraih,arybouchkin,nhongo,ynagata,ssakata,esekine,ndashtsoodol,ttashiro,s-ifujii,kshimizu,kmori,k.masuda,hkawamoto,hkoseki和mtaniguchi,从具有重排的不变vα14-jα18tcrα基因体外生成功能性nkt细胞,blood,115:230-237,2010。2)vizcardor,masudak,yamadad,ikawat,shimizuk,fujiis-i,kosekih和kawamotoh,从源自于cd8+t细胞的ips细胞再生人类肿瘤抗原特异性t细胞,cellstemcell,12:31-36,2013。3)nishimurat等,cellstemcell,12:114-226,2013。在这些方法中,从患者的t细胞建立es细胞或ips细胞,从这些es或ips细胞再生t细胞,然后将再生的t细胞移植到患者(自体移植)。然而,这些方法至少存在以下三个问题:a1)必须分别从每位患者建立ips细胞,因此预先准备适用于不同人治疗的ips细胞是不可能的;a2)必须分别为每位患者建立ips细胞,因此得到的ips细胞的质量和安全性可能每次都不同,以及a3)从t-ips细胞分化的t细胞可能变癌。b.使用导入有编码tcr的基因的t细胞的t细胞疗法已经在各地实施了基因疗法的临床测试,其中包括:分离出编码抗原特异性t细胞受体(tcr)的基因并将该基因转染到从待治疗患者获取的正常t细胞中,然后将转染的t细胞移植到患者(自体移植)(morganr.a.等,science,314:126,2006)。得到的t细胞为各种克隆集落(clone)的聚集体。根据该方法,原来存在于正常t细胞中的tcr的表达被抑制了,例如被sirna抑制(okamotos等,cancerres,69:9003,2009)。对如此得到的只表达特异性tcr的t细胞进行自体移植。例如,已经分离出了编码wt1抗原特异性t细胞受体的基因。已经实施了使用tcr基因来治疗wt1表达癌的基因疗法。在方法b中,还从待治疗的患者的t细胞制备出了治疗用t细胞。该方法存在以下三个问题。b1)因为是基因疗法,患者的t细胞有变癌的风险;b2)编码待移植的t细胞中的原始tcr的内源基因的表达可能不会完全被抑制,因此存在发生非期望反应的风险;b3)必须从每位患者制备t细胞,因此预先制备适用于各种人治疗的t细胞是不可能的。c.供体淋巴细胞输注用于治疗恶性血液病(比如白血病)的骨髓移植也有细胞移植的方面。也就是说,含在移植的供体骨髓细胞中的t细胞预期攻击受体中的白血病细胞。人们还知道的是,在供体淋巴细胞输注中,为了提高效果而在骨髓移植之后再单独输注供体的t细胞。最近提出了一种新方法,其中输注克隆扩增的给定抗原特异性t细胞(chapuis等,scitranslmed,5:174ra27,2013)。在该方法中,输注的t细胞源自于供体。然而,接收骨髓移植后的受体的造血系统变为与供体的造血系统相同。因此,骨髓移植后的t细胞输注被认为是一种自体移植。该方法需要骨髓移植并且患者在他/她的整个生命当中都要服用免疫抑制剂。d.治疗他人用脐带血淋巴细胞的利用接受了脐带血移植的患者由于免疫能力降低有时会发展病毒性传染病。为了治疗这种患者,提出了:输注含在源自于其他人(而不是原始脐带的提供者)的脐带血中的病毒特异性ctl(blood,116:5045,2010)。关于移植供体(具有与患者的hla匹配至一定程度而非完全匹配的hla)的ctl的构思已经提交专利申请(wo2011/021503)。然而,脐带血中的t细胞为克隆集落的聚集体,即,具有大量不同tcr的细胞的聚集体。因此,不能很好地避免发生移植物抗宿主病(gvhd)的风险。如上所述,已经提出了使用t细胞的各种细胞免疫疗法。除了d之外的疗法均为自体细胞移植或被认为是自体移植。异体细胞移植与常规技术知识相违背。在恶性血液病(比如白血病)的治疗中,例如,通常进行造血干细胞的骨髓移植。为了避免受体对供体的骨髓的排斥,使用的骨髓的供体具有与受体的hla相匹配的hla。然而,二者之间除了hla之外的各种蛋白质的氨基酸序列不匹配,供体的t细胞可能将这些错误配对识别为攻击目标。结果,部分移植的供体t细胞攻击受体的身体,即可能发生移植物抗宿主反应并导致受体死亡(ito等,lancet,331:413,1988)。借助具有纯合的hla单倍型(频频发现于日本人中)的供体形成高通用性ips细胞银行的项目正在进行中(curanoski,nature,卷488:139,2012)。然而,在t细胞移植中,即使供体具有的hla完全与受体的hla匹配,仍然存在移植物抗宿主反应的风险。此外,当hla错误配对时,预期发生更加严重的移植物抗宿主反应。因此,这种ips细胞库对于使用t细胞的细胞免疫疗法来说不适用。现有技术文献专利文献【专利文献1】wo2008/038579【专利文献2】wo2011/096482【专利文献3】wo2011/021503非专利文献【非专利文献1】watarai等,blood,115:230-237,2010。【非专利文献2】vizcardo等,cellstemcell,12:31-36,2013。【非专利文献3】nishimurat等,cellstemcell,12:114-226,2013。【非专利文献4】morganr.a.等,science,314:126,2006。【非专利文献5】okamotos等,cancerres,69:9003,2009。【非专利文献6】chapuis等,scitranslmed,5:174ra27,2013。【非专利文献7】blood,116:5045,2010【非专利文献8】ito等,lancet,331:413,1988【非专利文献9】cyranoski,nature,卷488:139,2012【非专利文献10】takahashi和yamanaka,cell,126:663-673,2006【非专利文献11】takahashi等,cell,131:861-872,2007【非专利文献12】grskovic等,nat.rev.drug.dscov,10:915-929(2011)【非专利文献13】morganr.a.等,science,314:126,2006【非专利文献14】timmermans等,journalofimmunology,182:6879-6888,2009【非专利文献15】blood,111:1318,2008【非专利文献16】natureimmunology,11:585,2010以上所列的现有技术文献以引用的形式结合于此。技术实现要素:本申请的目的在于提供一种比常规免疫疗法更有效且更安全的细胞免疫疗法。根据本申请的一种细胞免疫治疗方法,其包括从具有编码期望抗原特异性tcr的基因的多能性干细胞诱导t细胞祖细胞或成熟t细胞,以及将得到t细胞祖细胞或成熟t细胞同种异体地投放于患者,所述患者具有的hla与供体的hla匹配至预定程度并且从所述供体建立所述多能性干细胞。在本申请的所述方法中,具有编码期望抗原特异性t细胞受体的基因的所述多能性干细胞可以通过将编码所述抗原特异性t细胞受体的基因导入到所述多能性干细胞中而得到。用于所述细胞免疫疗法中的所述t细胞为克隆扩增的t细胞群,因此细胞群中的所有细胞都具有单一tcr。因此,造成移植物抗宿主反应的可能性明显较低,并且所述细胞不仅可用于自体移植还可以用于同种异体移植。鉴于“t细胞的同种异体移植为绝对禁忌”的常识,本文提供的所述方法是现有技术无法预料的。【发明效果】根据本申请,发明人可出乎意料地在一定程度上解决上述公认的问题。具有以下优点:1)无需为每位患者制备移植用t细胞。因此,能够预先进行细胞免疫疗法用t细胞的制备。2)在治疗之前可以检验移植细胞的安全性和质量。3)即使对于hla匹配的患者和供体之间的异体移植,一些小抗原不匹配,也会因此造成最终移植的细胞被患者的免疫反应所排斥。可以进行移植细胞的癌变风险明显较小的安全治疗。此外,鉴于本申请移植用t细胞可以通过具有将编码期望抗原特异性t细胞受体(tcr)的基因导入多能性干细胞步骤的方法获得的事实,还预期具有以下优点:1)通过导入效果和安全性已经确认的编码tcr的基因,可以保证移植用t细胞的质量;2)可以识别出tcr基因插入位点并且可以提前确认安全克隆集落。因此,能够避免移植细胞的癌变问题。3)将导入有编码tcr的基因的多能性干细胞重新分化为t细胞后,导入的tcr将先于初始干细胞的tcr(内源tcr)而表达,因而内源tcr链不会被重排,并且可能不发生非期望的反应。附图说明图1示出了实施例1中使用的pta2载体。图2示出了实施例1中使用的慢病毒载体。图3示出了实施例1中从tcr-ips细胞再生了具有wt1-tcr的成熟t细胞(wt1-tcr被导入到ips细胞中从而得到tcr-ips细胞)。图4示出了实施例2中得到了导入有编码hla-a0201限制性wt1特异性tcr的基因的ips细胞。图5示出了实施例2中得到了导入有编码hla-a0201限制性wt1特异性tcr的基因的ips细胞的克隆集落。图6示出了实施例3中编码wt1特异性tcr的基因被适当导入到ips细胞中。图7示出了实施例4中编码wt1特异性tcr的基因被适当导入到ips细胞中。具体实施方式在说明书和权利要求书中,“多能性干细胞”是指具有多能性(即能在体内分化成为多种类型的细胞的能力以及自我繁殖的能力)的干细胞。多能性干细胞的例子可以包括胚胎干细胞(es细胞)、核移植胚胎干细胞(ntes细胞)、生殖干细胞(gs细胞)、胚胎生殖细胞(eg细胞)、诱导多能性干细胞(ips细胞)、培养的成纤维细胞以及源自于髓样干细胞的多能性细胞(muse细胞)。为了从具有特异性hla的人类供体形成细胞免疫疗法用细胞银行,优选使用ips细胞。在说明书和权利要求书中,通过导入tcr而得到的ips细胞被称之为“tcr-ips细胞“。ips细胞可以是从任何体细胞建立的那些。从体细胞诱导ips细胞的方法是现有技术已知的。可以通过向体细胞中导入山中因子(yamanakafactor)来建立ips细胞(takahashiandyamanaka,cell,126:663-673,2006;takahashi等,cell,131:861-872,2007;以及grskovic等,nat.rev.drugdscov,10:915-929,2011)。用于诱导ips细胞的重编程因子不限于山中因子,可采用为现有技术已知的任何重编程因子或方法。
背景技术:
“b“中所述的t细胞疗法中临床使用的编码各种抗原特异性t细胞受体的基因是现有技术已知的并且也被确认是安全的。例如,编码wt1抗原特异性tcr的基因已为人们所知。编码tcr的基因可以是现有技术已知的那些以及从现在开始即将被识别出的tcr基因。编码tcr的基因还可以从带有期望抗原特异性的t细胞分离得到,这些t细胞是从患有癌症或传染性疾病的患者分离或诱导而得的。根据本申请的方法,可以识别出导入基因的位点并且在使用之前可以检验治疗用克隆集落的安全性。因此,能够避免癌变的风险。在本申请的方法中,可以将tcr基因导入ips细胞中。用于将tcr基因导入ips细胞中的方法可以是任何本领域已知的方法并且可以按照文献(morganr.a.等,science,314:126,2006)教导的方法来进行。尤其是,可以将载有tcr基因的适合载体导入到ips细胞中。例如,可以通过载体(比如病毒、质粒和人工染色体载体)或通过脂质体转染、脂质体或显微注射来导入tcr基因。病毒载体的例子包括逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体以及仙台(sendai)病毒载体。人工染色体载体的例子包括人类人工染色体(hac)、酵母人工染色体(yac)以及细菌人工染色体(bac和pac)。可利用的质粒的例子包括用于哺乳动物细胞的质粒。载体可以含有调控序列,比如启动子、增强子、核糖体结合序列,终止子和/或多聚腺苷酸化位点,用以使tcr基因能够表达。如有需要,载体还可以含有选择标记(selectionmarker)和报告基因(reporter);选择标记比如有耐药基因(例如,卡那霉素抗性基因、氨苄青霉素抗性基因或嘌呤霉素抗性基因)、胸苷激酶基因或白喉毒素基因;报告基因比如有绿色荧光蛋白(gfp)、β-葡萄糖苷酸酶(gus)或flag。如上所述,当通过使用载体将编码tcr的基因导入到ips细胞中时,tcr基因是被导入到基因组上的位点上而不是编码内源tcr的位点。可替代地,基因组上的tcr位置可以被编码期望tcr的基因置换。为了使用载体导入编码tcr的基因,优选从体细胞而不是从t细胞诱导的那些ips细胞。可替代地,当通过“置换“的方法导入tcr基因时,优选从t细胞建立的ips细胞。例如,通过基因组编辑的方式可以用期望的tcrα和tcrβ置换已经重排的tcrα和tcrβ基因。这个方法的优点可包括1)能够调节导入的tcr表达的时间和水平,从而使其近似于内源tcr,因此能够生成高质量t细胞,以及2)能够不损害基因组的条件下导入tcr。可以通过将编码tcr的基因导入到ips细胞中来得到tcr-ips细胞,然后将tcr-ips细胞分化为t细胞祖细胞或成熟t细胞。将多能性干细胞分化为t细胞的方法可以是文献(timmermans等,journalofimmunology,182:6879-6888,2009)公开的方法。在说明书和权利要求书中,“t细胞祖细胞“可以涵盖t细胞发展的任何阶段中的细胞,即从与造血干细胞对应的未分化细胞到刚好在细胞经历阳性选择/阴性选择之前阶段的细胞。t细胞分化的细节介绍于文献(blood,111:1318,2008;以及natureimmunology,11:585,2010)中。在从tcr-ips细胞再分化的t细胞祖细胞或成熟t细胞中,将会表达导入的tcr而不表达内源tcr。因此,可以不发生不期望的反应并能提供一种安全疗法。在另一实施例中,可以敲除ips细胞中的rag1和/或rag2基因,从而完全避免内源tcr的重排。通过采用如此制备的细胞能够提供更加安全的治疗。敲除rag1基因和rag2基因中的一个即足够。此外,可以同时导入抑制内源tcr表达的sirna。本申请提供的细胞免疫疗法可用于治疗与抗原有关的疾病,其中导入的tcr特异性结合于该抗原。例子可以包括癌症、传染病、自身免疫性疾病和过敏性疾病。在本申请的方法中,再生的t细胞分散在适合的介质中,比如生理盐水或pbs;然后将分散液投药给患者(具有与供体匹配至一定水平的hla),其中从该供体的细胞建立多能性干细胞。供体与患者的匹配水平可以是完全匹配。当供体为hla单倍型纯合性(以下称之为“hla单倍型纯合子”)并且患者为hla单倍型杂合性(以下称之为“hla单倍型杂合子”),患者的hla单倍型其中之一需要与供体的纯合的hla单倍体相匹配。可以通过静脉来投放细胞。例如,ips细胞可以是具有与待治疗的患者的hla单倍型中的至少一个相匹配的hla单倍型并且选自ips细胞银行的那些,其中,从具有纯合的hla单倍型的供体的细胞建立的ips细胞与每个供体的hla信息相关联地存储在ips细胞银行中。投放的细胞的数量没有限制并且可基于,例如患者的年龄、性别、身高和体重以及待治疗的疾病和病情来确定。最佳细胞数量可以通过临床研究来确定。t细胞可以靶向各种抗原,因此本申请的方法可以应用于针对各种疾病的细胞免疫疗法,这些疾病包括但不限于癌症、传染病、自身免疫性疾病和过敏性疾病。例如,高比例的造血器官肿瘤(比如白血病、骨髓增生异常综合征、多发性骨髓瘤和恶性淋巴瘤)以及实体瘤(比如胃癌、结肠癌、肺癌、乳腺癌、生殖细胞癌、肝癌、皮肤癌、膀胱癌、前列腺癌、子宫癌、宫颈癌和卵巢癌)表达wt1基因。因此,当通过将wt1抗原特异性tcr基因导入ips细胞来产生tcr-ips细胞并且然后从tcr-ips细胞再生ctl细胞时,这样的ctl细胞对于治疗wt1基因表达癌的细胞免疫疗法就是有效的。在提出的各种疗法(其中从ips细胞分化的各种细胞或组织被移植,而不是t细胞被移植)中,期望移植的细胞在患者的整个生命当中都会固定在他/她的体内。在使用从同种异体移植用ips细胞库再生的细胞或组织的再生性治疗中,患者在其整个生命当中都需要服用免疫抑制药。相比于自体移植,这是一种缺点。另一方面,根据本申请从tcr-ips细胞再生的t细胞,同种异体移植的t细胞在一定时间段之后最终被排斥。也就是说,基于甚至hla匹配的供体和受体中小的组织相容性抗原中的错误配对,同种异体移植物最终会被排斥。鉴于此,本申请提供的细胞免疫疗法优于从ips细胞再生的细胞或组织的其它同种异体移植。此外,本方法不需要为每位患者制备细胞。可以存储并使用预先制备的具有期望抗原特异性的tcr-ips细胞,或从tcr-ips细胞再生的t细胞祖细胞或成熟t细胞。因此,本方法的优点不仅在于缩短了细胞免疫疗法的准备时间还能够在移植之前检验细胞的质量。例如,可以提供靶向癌抗原的t细胞制备。例如,将编码tcr的基因(已经证实为在癌症的tcr基因疗法中安全有效)导入ips细胞(从具有纯合的hla单倍体的供体建立的)中。可以用这些tcr-ips细胞形成ips细胞银行。对于患有表达抗原(会被导入的tcr识别)的癌症并具有杂合的hla单倍型的患者的治疗来说,可以从选自tcr-ips细胞银行的tcr-ips细胞重新分化t细胞并将t细胞同种异体地投放于患者。为了提供更快的治疗,可以预先从tcr-ips细胞再生t细胞祖细胞或t细胞并将其冷冻保存。可用于本申请方法中的tcr基因的例子包括编码wt1抗原特异性tcr的基因,该基因由爱媛大学的masakiyasukawa教授从tak-1细胞克隆而得(blood,95:286,2000;blood,118:1495,2011)。ips细胞可以是获取自由ips细胞研究和应用中心存储在ips细胞库项目下的那些。存在rikenbioresourcecenter(rikenbrc)的ips细胞株hps0077可以用作具有频繁出现于日本人中的纯合的hla单倍型的ips细胞。通过以下所示实施例将对本发明进行更加详细的解释。【实施例1】其中导入有i类限制性wt1抗原特异性tcr的ips细胞的建立本文使用的原始ips细胞为在日本京都的京都大学前沿医药科学研究所免疫学系制备的lmp2-t-ips细胞(克隆集落lmp2#1)。本文使用的hla-a2402限制性wt1特异性tcr是从克隆集落b10获得,克隆集落b10是在日本大阪吹田市大阪大学的医药研究生学院免疫学系的免疫和造血实验室克隆得到的(anticancerresearch,32(12):5201-5209,2012)。tcr以hla-a2402限制性方式识别具有氨基酸序列cmtwnqmnl(序列id号:4)的肽。1)通过cdna端的快速扩增(race)来克隆wt1特异性tcr基因对从wt1-t-ips细胞诱导的wt1特异性ctl克隆集落或ctl克隆集落进行扩增并且获取细胞的rna。通过使用smarterracecdna扩增试剂盒(clontechlaboratories,inc.)获取全长度cdna并将其用作模板。通过使用靶向tcrα链的3'端或tcrβ链的3'端的引物扩增tcr基因,从而得到双链wt1-tcrcdna,其中tcrα链为:cacaggctgtcttacaatcttgcagatc(序列id号:1),tcrβ链为:ctccacttccagggctgccttca(序列id号:2)或tgacctgggatggttttggagcta(序列id号:3)。将如此获得的双链cdna插入pta2载体中(toyobo,见图1),然后将载体导入细胞株中。使用转染细胞来评价wt1tcr的性能,其中包括wt1tcr特异性。2)结合有wt1-tcr的慢病毒载体的制备从日本茨城筑波的rikenbioresourcecenter的细胞命运操纵分组获得cs-ubc-rfa-ires2-venus载体(图2)。采用gateway系统将wt-tcr基因结合到载体中从而得到cs-ubc-rfa-ires2-venus/wt1-tcr。3)导入有wt1-tcr的慢病毒的上清液的制备用x-treamgene9(roche)将cs-ubc-rfa-ires2-venus/wt1-tcr导入lentix-293t包装细胞中。在第二天更换培养液,并且在第二天收集培养上清液并将其用作慢病毒上清液。4)转染了wt1-tcr的t-ips细胞的建立用trypleselect(lifetechnologies)处理lmp2-t-ips细胞从而得到完全单细胞悬浮液。离心分离悬浮液并用慢病毒上清液将沉淀(pellet)分散,然后,将得到的悬浮液在32℃以3000rpm离心一个小时,从而感染慢病毒,之后,将wt1-tcr导入lmp2-t-ips细胞中。感染之后,将细胞悬浮在ips细胞用培养液中,然后接种在饲养细胞上。基于包含在载体中的venus蛋白的表达,将导入有wt1-tcr的lmp2-t-ips细胞(wt1-tcr/lmp2-t-ips细胞)进行透视筛选。c.从培养物中拾取wt1-tcr/lmp2-t-ips细胞集落1.导入山中因子两周后,目视观察ips细胞集落。2.使用200μl的吸量头机械拾取集落。3.单独建立数个克隆集落。3)从ips细胞诱导t细胞。使用的培养液如下:【表1】培养液a:用于维持op9基质细胞内含物添加量最终浓度αmem培养液500mlfcs125ml20%青霉素-链霉素溶液*6.25ml1%总量631.25ml*青霉素(10000u/ml)和链霉素(10000μg/ml)的混合物。最终浓度分别为100u/ml和100μg/ml。【表2】培养液b:用于诱导t细胞的分化内含物添加量最终浓度αmem培养液500mlfcs125ml20%青霉素-链霉素溶液*5ml1%hril-7(stock:10μg/ml)315μl5ng/mlhrflt-3l(stock:10μg/ml)315μl5ng/mlhrscf(stock:10μg/ml)630μl10ng/ml总量631.26ml*青霉素(10000u/ml)和链霉素(10000μg/ml)的混合物。最终浓度分别为100u/ml和100μg/ml。【表3】培养液c:用于将未成熟t细胞诱导为成熟t细胞内含物添加量最终浓度αmem培养液500mlfcs125ml20%青霉素-链霉素溶液*5ml1%hril-7(stock:10μg/ml)315μl5ng/ml总量630.315ml*青霉素(10000u/ml)和链霉素(10000μg/ml)的混合物。最终浓度分别为100u/ml和100μg/ml。a.op9细胞的制备将六毫升(6ml)的0.1%明胶溶液(在pbs中)添加到一个10cm的培养皿(falcon)并在37℃下培养30分钟。然后去除明胶溶液并向培养皿中添加10ml培养液a。从一汇合培养物中获取op9基质细胞并将其接种到上述培养皿中。四天后,向培养皿中再添加10ml的培养液a(总量20ml)。b.从ips细胞诱导造血祖细胞吸出共培养用op9基质细胞培养物中的培养液并用新鲜培养液a更换。吸出人类ips细胞培养皿中的培养液,然后加入10ml的新鲜培养液a。使用ez-passage辊切割ips细胞块(ipscellmass)。使用带有200μl吸头的吸管将切割得到的ips细胞块悬置。目测计算ips细胞簇(ipscellcluster)的数量,并将约600个细胞簇接种于op9细胞上。人类ips细胞的每个克隆集落使用三个或更多培养皿,当进行继代培养时,将所有培养皿中的细胞一次汇集在一个培养皿中,然后重新分配到相同数目的培养皿中,从而降低不同培养皿之间的差异。第1天:(更换培养液)确认ips细胞块是否粘附到培养皿以及是否开始细胞分化。用20ml的新鲜培养液a更换细胞培养物中的培养液。第5天:(更换一半的培养液)用10ml的新鲜培养液a更换一半的细胞培养物中的培养液。第9天:(更换一半的培养液)用10ml的新鲜培养液a更换一半的细胞培养物的培养液。第13天:(将诱导的中胚层细胞从op9细胞层转移到op9/dll1细胞层)吸取去除细胞培养物的培养液,并使用hbss(+mg+ca)洗掉培养细胞表面的培养液。将10ml的胶原酶iv250u(在hbss(+mg+ca)溶液中)添加到培养皿中,然后在37℃培养45分钟。吸取去除胶原酶溶液并使用10mlpbs(-)清洗细胞。然后,将0.05%胰蛋白酶/edta溶液添加到培养皿中,在37℃培养20分钟。培养之后,从培养皿的底部剥离片状细胞聚集体,然后通过吹吸(pipetting)将细胞聚集体机械破碎至较小的尺寸。将如此处理的细胞加入20ml新鲜培养液a,并在37℃培养45分钟。将含有漂浮细胞的培养液过100μm筛并收集细胞。然后将细胞在4℃以1200rpm离心7分钟。将得到的沉淀悬浮于10ml的培养液b中。分离出十分之一的悬浮液用于facs分析。将剩余的细胞悬浮液接种到含有op9/dll1细胞的多个新培养皿上。将数个培养皿的细胞悬浮液进行汇集,然后重新分配到相同数目的培养皿。为了确认得到的细胞当中是否含有造血祖细胞,使用抗cd34抗体和抗cd43抗体进行facs分析。当可以确认足够数量的细胞是在cd34lowcd43+细胞分级时,即确认诱导形成了造血祖细胞。c.从造血祖细胞诱导t细胞。然后,得到的细胞接种于op9/dll1细胞上。在这一步骤中,不进行cd34lowcd43+细胞分级的细胞分选。相比于不进行分选的情况,当此分级被分选时,由于分选造成的细胞减少或损失,t细胞的分化效率可能会降低。在培养期间,进行数次facs分析用以确认分化阶段。在培养期间观察到大量的死亡细胞。优选地,在facs分析之前,通过使用例如碘化丙啶(pi)或7-aad将死亡细胞消除。第16天:(细胞的继代培养)通过轻轻数次吹吸将松散地粘附于op9/dll1细胞的细胞解离。将细胞过100μm筛,并收集到一个50ml锥形管中。将锥形管在4℃以1200rpm离心7分钟。将沉淀分散在10ml培养液b中。然后将制得的细胞接种到的op9/dll1细胞上。第23天:(细胞的继代培养)血细胞集落开始出现通过轻轻数次吹吸将松散地粘附于op9/dll1细胞的细胞解离。将细胞过100μm筛,并收集到一个50ml锥形管中。将锥形管在4℃以1200rpm离心7分钟。将沉淀分散在10ml培养液b中。然后将制得的细胞接种到的op9/dll1细胞上。第30天:(细胞的继代培养)通过轻轻数次吹吸将松散地粘附于op9/dll1细胞的细胞解离。将细胞过100μm筛,并收集到一个50ml锥形管中。将锥形管在4℃以1200rpm离心7分钟。将沉淀分散在10ml培养液b中。然后将制得的细胞接种到的op9/dll1细胞上。第37天:细胞的继代培养通过轻轻数次吹吸将松散地粘附于op9/dll1细胞的细胞解离。将细胞过100μm筛,并收集到一个50ml锥形管中。将锥形管在4℃以1200rpm离心7分钟。将沉淀分散在10ml培养液b中。然后将制得的细胞接种到的op9/dll1细胞上。第44天:cd4+cd8+t细胞被确认并开始诱导为cd8sp细胞为了确认t细胞正如期望地被诱导,在第44天用抗cd4抗体和抗cd8抗体对细胞进行facs分析。确认生成了cd4+cd8+细胞。然后,将抗cd3/28抗体和huil-2加入细胞中。以3×105个细胞/孔的密度将含有cd4+cd8+细胞的t细胞接种到24孔板的每个孔中的新鲜op9/dll1细胞层上。将抗cd3抗体(50ng/ml)、抗cd28抗体(2ng/ml)和huil-2(200u/ml)一起添加个每个孔中。第50天:观察到了cd4-cd8+细胞。在添加抗cd3抗体的第6天,生成了成熟的cd8单阳性细胞。用wt1四聚体和抗cd3抗体使生成的细胞染色(图3)。确认生成了表达导入的wt1-tcr的t细胞。【实施例2】导入有i类限制性wt1抗原特异性tcr且带有纯合的hla的ips细胞的建立原始ips细胞是在日本京都的京都大学前沿医药科学研究所免疫学系从健康供体的末梢血单核细胞建立的。ips细胞克隆集落具有纯合的hla单倍型:hla-a*33:03;b*44:03;c*140:3;drb1*1302。hla-a0201限制性wt1特异性tcr源自于opt3e2,是在日本大阪吹田市的大阪大学药学研究生院免疫学系的免疫和造血实验室克隆而来的。tcr识别具有氨基酸序列rmfpnapyl(序列id号:5)的肽。制备载体并将其按照与实施例1相同的方式转染到ips细胞中。1.使用流式细胞术对转染有所述基因的ips细胞的单细胞悬浮液进行分析。确认了:编码hla-a0201限制性wt1特异性tcr的基因被有效地导入了ips细胞中(图4)。2.将转染有tcr基因的ips细胞接种在培养皿上进行克隆扩增。图5示出了一周培养后的ips细胞集落。确认了导入有所述基因的ips细胞集落为荧光阳性集落。图5确认得到了导入有编码hla-a0201限制性wt1特异性tcr的基因的ips细胞克隆集落。然后,拾取阳性集落。【实施例3】导入有ii类限制性wt1抗原特异性tcr且带有纯合的hla的ips细胞的建立按照与实施例2中相同的方法,原始ips细胞是在日本京都的京都大学前沿医药科学研究所免疫学系从健康供体的末梢血单核细胞建立的。ips细胞系具有纯合的hla。ii类限制性wt1特异性tcr基因源自于克隆集落k和克隆集落10,是在日本大阪吹田市的大阪大学药学研究生院免疫学系的免疫和造血实验室克隆而来的。克隆集落k和克隆集落10分别限于hla-drb1*0405和hla-dpb1*0501,并且识别肽序列wt1-332(kryfklshlqmhsrkh(序列id号:6)(microbiolimmunol,52:591-600,2008)制备载体并将其按照与实施例1相同的方式转染到ips细胞中。1.使用流式细胞术对转染有所述基因的ips细胞的单细胞悬浮液进行分析。结果如图6中所示。确认了:源自于克隆集落10和克隆集落k的wt1特异性tcr正如期望地被导入到了ips细胞中。【实施例4】导入有i类限制性wt1抗原特异性tcr且带有纯合的hla的ips细胞的建立按照与实施例2中相同的方法,原始ips细胞是在日本京都的京都大学前沿医药科学研究所免疫学系从健康供体的末梢血单核细胞建立的。ips细胞株具有纯合的hla。i类限制性wt1特异性tcr基因是在日本京都的京都大学前沿医药科学研究所免疫学系从克隆集落wt1#9和克隆集落wt1#3-3克隆而来。制备载体并将其按照与实施例1相同的方式转染到ips细胞中。2.使用流式细胞术对转染有所述基因的ips细胞的单细胞悬浮液进行分析。结果如图7中所示。确认了:源自于克隆集落#9和克隆集落#3-3的wt1特异性tcr基因正如期望地被导入ips细胞中。sequencelisting<110>河本宏<120>用于建立具有编码抗原特异性t细胞受体的基因的多能性干细胞的方法<130>672488<150>62/026336<151>2014-07-18<160>6<170>patentinversion3.5<210>1<211>28<212>dna<213>人工<220><223>pcr引物<400>1cacaggctgtcttacaatcttgcagatc28<210>2<211>23<212>dna<213>人工<220><223>pcr引物<400>2ctccacttccagggctgccttca23<210>3<211>24<212>dna<213>人工sequence<220><223>pcr引物<400>3tgacctgggatggttttggagcta24<210>4<211>9<212>prt<213>homosapiens<400>4cysmetthrtrpasnglnmetasnleu15<210>5<211>9<212>prt<213>homosapiens<400>5argmetpheproasnalaprotyrleu15<210>6<211>16<212>prt<213>homosapiens<400>6lysargtyrphelysleuserhisleuglnmethisserarglyshis151015当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种肿瘤特异抗原及其应用的制作方法与工艺
- 用于制备具有增加的特异性基因表达的树突细胞的方法和包含使用所述方法制备的树突细胞的用于治疗或预防自身免疫性疾病的组合物与流程
- 一种兼有NK细胞特质的抗原特异性T细胞的制备方法与流程
- 一种特异性肿瘤抗原NSE的CTL识别表位肽及其应用的制作方法与工艺
- 一种特异性肿瘤抗原SF的CTL识别表位肽及其应用的制作方法与工艺
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 特异性识别胃癌细胞的DNA适配子GCA‑5及其应用的制造方法与工艺
- 一种制备结直肠癌抗原特异性T细胞的方法与流程
- 用作诱导抗原特异性T细胞反应的免疫原性增强剂的融合蛋白的制造方法与工艺