一种产松柏醇的工程菌、构建方法及产松柏醇的用途与流程
本发明所属生物医药技术领域,涉及一种产松柏醇的工程菌、构建方法及产松柏醇的用途。
背景技术:
松柏醇(coniferylalcohol),分子式是c10h12o3,分子量为180.20,片状晶体,易溶于乙醚,溶于乙醇,不溶于水。松柏醇作为重要医药中间体,在医药上用作合成抗癌药物鬼臼毒素和抗肝炎药物水飞蓟宾的重要中间体。
目前对松柏醇的合成主要有以下三种方法。
(1)以乙酰阿魏酸为原料,制得酰氯后,再酯化,最后还原得到松柏醇,但其总收率仅24.4%;(2)以阿魏酸为原料,经酯化,乙酰化,再经还原得到松伯醇,总收率70.2%;这两种方法都需要用到氢化铝锂还原,收率欠佳,且操作不便;(3)以香草醛为原料,与丙二酸缩合后得到阿魏酸,经酯化和乙酰化后得乙酰阿魏酸乙酯,再用硼氢化锂还原后得到松伯醇,总收率可达73.6%,改进后的路线原料易得,反应条件温和,收率提高,成本降低,为松柏醇的大量制备提供了可能。
但是,上述有机合成原料与生产工艺存在环境污染,不符合绿色环保可持续发展的要求。近年来,随着合成生物技术的不断进步,使用工程微生物生产化学品逐渐成为备受关注的方法。但目前为止还没有任何文献报道利用工程微生物合成松柏醇。
技术实现要素:
本发明的目的是克服现有技术的不足,提供产松柏醇的工程菌。
本发明的第二个目的是提供产松柏醇的工程菌发酵制备松柏醇的方法。
本发明的第三个目的是提高工程菌产松柏醇产量的方法。
本发明的技术方案概述如下:
产松柏醇的工程菌的构建方法,包括如下步骤:
(1)化学合成tal、comt、4cl和ccr基因,所述基因tal、comt、4cl和ccr的核苷酸序列依次用seqidno.05,seqidno.06,seqidno.07,seqidno.08所示;
(2)pcr克隆hpabc、yahk、metk和pntab基因;所述基因hpabc、yahk、metk、pntab的核苷酸序列依次用seqidno.01,seqidno.02,seqidno.03,seqidno.04所示;
(3)全化学合成以seqidno.09所示的表达载体骨架pbpe001、以seqidno.10所示的表达载体骨架pbpe002、以seqidno.11所示的表达载体骨架pbpe003;
(4)将所述基因tal、hpabc、comt与表达载体骨架pbpe001通过酶切连接方式进行连接,得到重组表达载体pthm;将所述基因4cl、ccr、yahk与表达载体骨架pbpe002通过酶切连接方式进行连接,得到重组表达载体plrh;将所述基因pntab、metk与表达载体骨架pbpe003通过酶切连接的方式进行连接,得到重组表达载体pnam;
(5)从大肠杆菌bl21(de3)菌中克隆得到t7rna聚合酶基因,通过λred同源重组技术整合到sybe-002447底盘菌株染色体上得到sybe-002447(de3)菌株;
(6)将重组表达载体pthm、重组表达载体plrh和重组表达载体pnam转化到底盘菌株sybe-002447(de3),对单克隆进行筛选,得到工程菌sybe-cnf。
上述方法构建的产松柏醇的工程菌sybe-cnf。
上述产松柏醇的工程菌发酵制备松柏醇的方法,包括如下步骤:将重组菌sybe-cnf接种在lb培养基中,37℃,220rpm,震荡培养2-4h,在od600到达0.8-1.0之间时,转接到含有葡萄糖的m9培养基中,进行发酵,当葡萄糖浓度低于0.5g/l时,补加5g/l葡萄糖,持续合成松伯醇。
本发明的优点:
松柏醇是重要的医药中间体,在医药上用作合成抗癌药物鬼臼毒素和抗肝炎药物水飞蓟宾的重要中间体。本发明使用工程大肠杆菌,以葡萄糖为碳源,以l-酪氨酸为前体,进行发酵生产松柏醇。本发明可解决松柏醇的来源问题,同时最大限度的降低了生产成本,有利于工业化生产。
附图说明
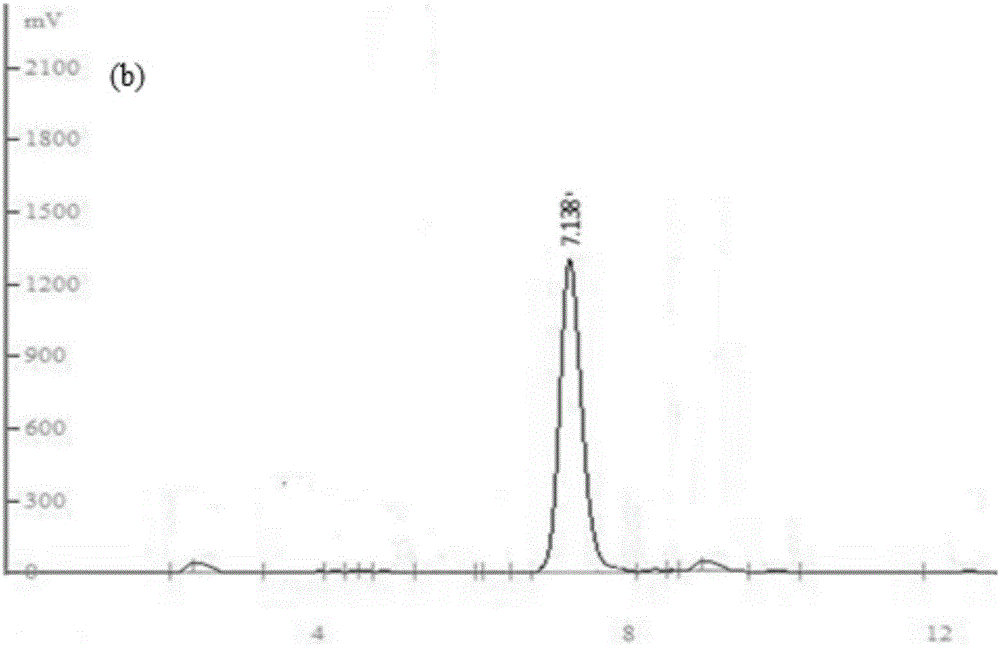
图1为松柏醇验证的hplc图谱。图中:图1a为标准品松柏醇图1b为重组菌的发酵液。
图2为连续发酵生产松柏醇的产量图。
具体实施方式
下面结合具体实施例对本发明作进一步的说明。
本发明设计的松柏醇的详细生物合成途径如下:以葡萄糖为碳源,经过芳香氨基酸代谢途径,合成酪氨酸。在酪氨酸脱氨酶tal的作用下脱氨基将底物l-酪氨酸转化为咖啡酸,并依次在4-羟基苯乙酸-3-单加氧酶hpabc、o-甲基转移酶comt、香豆酯-4-coa连接酶4cl、肉桂酰辅酶a还原酶ccr等酶的作用下转化为松柏醛,最后经乙醇脱氢酶yahk催化,生成松柏醇。s-腺苷甲硫氨酸合成酶metk能促进甲基供体的供给,吡啶核苷酸转氢酶pntab能促进细胞内nadph的供给,在工程菌株中过表达metk基因和pntab基因能大大提高松柏醇的产量。
本发明所用大肠杆菌是高产酪氨酸的菌株,名称为sybe-002447,分类命名为大肠埃希氏菌escherichiacoli,现于中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏中心登记入册编号为cgmccno.7962。保藏时间为2013年7月22日,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编100101。
本发明所用大肠杆菌菌株bl21(de3)和e.colidh5α购买自北京全式金生物技术有限公司。
本发明所用pkd46质粒和pcp20质粒购买自普如汀生物技术(北京)有限公司。
lb培养基组成为:10g/lnacl、10g/l蛋白胨和5g/l酵母粉,余量为水,0.1mpa压力121℃下灭菌20min。
含有葡萄糖的m9培养基组成为:0.5g/lnacl、1.0g/lnh4cl、3.0g/lkh2po4、17.1g/lna2hpo4·12h2o、0.025%酵母粉,余量为水,培养基在0.1mpa压力121℃下灭菌20min。灭菌完后加入过膜的终浓度为5mmmgso4、0.1mmcacl2以及灭菌的5g/l葡萄糖。
实施例1tal、comt、4cl和ccr基因的设计
优选黄孢原毛平革菌(phanerochaetechrysosporium)来源的酪氨酸脱氨酶tal,拟南芥(arabidopsisthaliana)的o-甲基转移酶comt、香豆酯-4-coa连接酶4cl、肉桂酰辅酶a还原酶ccr,使用jcat在线密码子优化软件(http://www.jcat.de)结合optimizer密码子优化工具(http://genomes.urv.es/optimizer/),以大肠杆菌对密码子的偏好性进行优化,设计全长tal、comt、4cl和ccr基因,基因tal、comt、4cl和ccr的核苷酸序列依次如序列表中seqidno.05、seqidno.06、seqidno.07和seqidno.08所示。
实施例2λ-red同源重组方法整合t7rna聚合酶基因到底盘菌株sybe-002447染色体上。
整合t7rna聚合酶基因到底盘菌株sybe-002447染色体上的底盘菌株构建过程详细步骤如下:
1、以大肠杆菌bl21(de3)基因组为模板,使用fastpfu酶进行pcr反应克隆得到t7rna聚合酶基因。
2、利用重叠延伸pcr制备具有氯霉素抗性的t7rna聚合酶片段。
3、把pkd46质粒导入菌种sybe-002447,获得sybe-002447/pkd46,将活化的菌种sybe-002447/pkd46,接种于10mllb液体培养基中,30℃,200rpm,培养至od600为0.4-0.6。加入终浓度为10mml-阿拉伯糖,继续培养3h。4℃下4000rpm离心8min,收集细胞。弃上清,加入冰预冷的10%甘油洗涤细胞2次,再用10%甘油重悬细胞,制备成电转感受态细胞。取抗性片段2μl,加入到100μl电转感受态细胞中,轻轻旋转混匀。将混合物加入2mm的冰预冷电击杯中,2.5kv电击4-6ms。然后加入1mllb培养基,37℃复苏3h后涂布对应抗性的平板,42℃过夜培养。
4、挑取pcr验证正确单菌落,在42℃下氯霉素抗性平板传代3次,氨苄青霉素抗性平板验证pkd46缺失,37℃培养保存,获得将t7rna聚合酶片段整合到底盘菌株sybe-002447染色体上的菌株。
5、利用步骤4中得到的重组菌,制备感受态细胞,同样方法电转化质粒pcp20,30℃过夜培养。挑取单菌落,无抗性平板划线,42℃传代3次,筛选氯霉素和氨苄青霉素抗性缺失的菌株,37℃培养保存,得到成功无痕整合的优化底盘菌株sybe-002447(de3)。
实施例3重组表达载体pthm的构建
以大肠杆菌的基因组为模板,使用fastpfu酶进行pcr反应获得两端分别带有kpni和xhoi酶切位点的hpabc基因(核苷酸序列用seqidno.01)。利用pcr反应使化学全合成得到的tal基因片段两端分别带有hindiii和bamhi酶切位点;使comt基因片段两端带有hindiii和noti酶切位点。
全化学合成表达载体骨架pbpe001,其序列如序列表seqidno.09所示。
使用fastdigest内切酶hindiii和bamhi对tal基因和pbpe001进行酶切反应,反应体系为:5μl10*fdbuffer,2.5μlhindiii、2.5μlbamhi、30μltal基因片段和10μl超纯水。反应条件为:37℃,1h。使用pcr纯化试剂盒回收酶切体系,在50μl酶切产物中,加入250μlbindingbuffer溶液,混匀后加入吸附柱中,静置一分钟,10000g离心1分钟,弃出流出液。加入650μlwashbuffer,10000g离心1分钟,弃出流出液。10000g离心2分钟,去除残留的washbuffer。将吸附柱置于一个干净的离心管中,在柱的中央加入30μlelutionbuffer(elutionbuffer提前在65℃水浴锅中预热),室温静置1分钟,10000g离心1分钟,洗脱酶切后的tal基因片段和pbpe001。将酶切后的tal基因片段和pbpe001载体片段进行连接反应。反应体系为:1μl10*t4dnaligasebuffer,1μlt4dnaligase,6μl酶切后的tal基因片段和2μl酶切后的pbpe001载体片段。反应条件为:22℃,0.5h。连接后转化感受态细胞dh5α,菌落pcr和酶切验证筛选阳性克隆,最后通过测序验证,获得表达载体ptal。
以相同的酶切连接方法,依次将hpabc基因和comt基因连接到重组载体ptal上,最终得到连接了tal、hpabc和comt基因的表达载体pthm。
实施例4重组表达载体plrh的构建
以大肠杆菌的基因组为模板,使用fastpfu酶进行pcr反应获得两端分别带有kpni和xhoi酶切位点的yahk基因(核苷酸序列用seqidno.02所示)。利用pcr反应使化学全合成得到的4cl基因片段两端分别带有hindiii和bamhi酶切位点;使ccr基因片段两端带有hindiii和noti酶切位点。
全化学合成表达载体骨架pbpe002,其序列如序列表seqidno.10所示。
以相同的酶切连接方法,先后将基因yahk、4cl、ccr连接到表达载体骨架pbpe002上,得到连接yahk、4cl、ccr基因的表达载体plrh。
实施例5重组表达载体pnam的构建
以大肠杆菌的基因组为模板,使用fastpfu酶进行pcr反应获得两端分别带有ecori和hindiii酶切位点的metk基因(核苷酸序列用seqidno.03所示),以及两端分别带有kpni和xhoi酶切位点的pntab基因片段(核苷酸序列用seqidno.04所示)。
全化学合成表达载体骨架pbpe003,其序列如序列表seqidno.11所示。
以相同的酶切连接的方法,先后将metk基因和pntab基因连接到上表达载体骨架pbpe003,最终得到连接metk和pntab基因的表达载体pnam。
实施例6重组菌株sybe-cnf构建
利用大肠杆菌菌株sybe-002447(de3)制备感受态细胞,将实施例3中构建的重组表达载体pthm,电转化到sybe-002447(de3)感受态细胞,具体方法为:
1、将活化的大肠杆菌菌株sybe-002447(de3)100μl,接种于10mllb培养基中,37℃,220rpm,培养至od600为0.8-1.0时,转入10ml离心管中,在预冷的4℃离心机中,4500rpm/min,离心5min,去上清,收集菌体;
2、用预冷的灭过菌的10%甘油洗涤菌体,重复三次;
3、尽量倒尽上清,加入100μl10%甘油重悬菌体,制成感受态细胞;
4、将实施例3中构建的表达载体pthm取2.5μl加入到100μl电转感受态细胞中,轻轻旋转混匀。将混合物分别加入2mm的冰预冷电击杯中,2.5kv电击4-6ms。迅速分别加入1mllb培养基,37℃复苏2h后涂布对应抗性的平板,过夜培养;
5、挑选菌落pcr验证的阳性转化子到5mllb培养基中过夜培养,得到重组菌株thm,并保存菌株。
利用菌株thm制备感受态细胞,转化实施例4中构建的表达载体plrh,得到重组菌株t-lrh。利用菌株t-lrh制备感受态细胞,转化实施例5中构建的表达载体pnam,得到重组菌株sybe-cnf,即为最后的发酵菌株。
实施例7菌株sybe-cnf的发酵检测
将重组菌sybe-cnf接种在lb培养基中,37℃,220rpm,震荡培养2-4h,在od600到达0.8-1.0之间时,然后转接到含有葡萄糖的m9培养基中,进行发酵,当葡萄糖浓度低于0.5g/l时,补加5g/l葡萄糖,持续合成松伯醇。
在发酵过程中不同时间点,取发酵液1ml,加入等体积的乙酸乙酯,利用涡旋振荡器震荡1min,然后12000r/min离心3分钟,取上清,用0.22μm的微孔滤膜过滤后进行hplc检测。色谱条件如下:c18(4.6×250mm)色谱柱;流动相为乙腈-0.01%磷酸=3:7;流速1ml/min;进样量20μl;柱温室温;紫外检测器,检测波长281nm。
结果见图1和图2。
以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!