合成2‑取代的‑1,4‑二苯胺的方法与流程
技术领域
本申请的主题涉及合成2-取代的-1,4-二苯胺,例如2-甲氧基甲基-1,4-二苯胺及其生理上相容的盐。
背景技术:
2-取代的-1,4-二苯胺及其生理上相容的盐可在氧化性毛发着色中被用作主要中间体。例如,2-甲氧基甲基-1,4-二苯胺及其生理上相容的盐可在氧化性毛发着色中被用作主要中间体。目前用于合成2-甲氧基甲基-1,4-二苯胺的方法可按照美国专利4,997,451和美国专利6,648,923中所阐述来完成。此方法由以下列反应方案说明:
然而,仍期望发现降低所需产物的制造成本的替代方法。因此,仍存在利用比较便宜的原料来获得所需产物的需求。
技术实现要素:
本申请的一个实施例涉及制备2-取代的-1,4-二苯胺的方法,所述方法包括:(a)向4-硝基-2-(或3-)取代的氯苯中引入氨以获得4-硝基-2-(或3-)取代的氨基苯:
(b)在存在氢化催化剂的情况下,氢化所述4-硝基-2-(或3-)取代的氨基苯以形成2-取代的-1,4-二苯胺:
其中式(I)-(III)的X选自:(a)C1-C6烷基;(b)甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基;(c)羟基取代的C1-C6烷基;(d)-(CH2)yOCH3;其中y为1-3;(e)-(CH2)yOCH2CH3;其中y为1-3;(f)-(CH2)yOCH2CH2CH3;其中y为1-3;(g)其中Z为氢或C1-3烷基;以及(h)它们的混合物。
本申请的另一个实施例涉及制备2-取代的-1,4-二苯胺的方法,所述方法包括:(a)向4-硝基-2-取代的氯苯中引入氨以获得4-硝基-2-取代的氨基苯:
(b)在存在氢化催化剂的情况下,氢化所述4-硝基-2-取代的氨基苯以形成2-取代的-1,4-二苯胺
其中式(Ia)、(IIa)和(III)的X选自:(a)C1-C6烷基;(b)甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基;(c)具有羟基取代的C1-C6烷基;(d)-(CH2)yOCH3;其中y为1-3;(e)-(CH2)yOCH2CH3;其中y为1-3;(f)-(CH2)yOCH2CH2CH3;y为1-3;(g)其中Z为氢或C1-3烷基;以及(h)它们的混合物。
本申请的另一个实施例涉及制备2-取代的-1,4-二苯胺的方法,所述方法包括:(a)向4-硝基-3-取代的氯苯中引入氨以获得4-硝基-3-取代的氨基苯:
(b)在存在氢化催化剂的情况下,氢化所述4-硝基-3-取代的氨基苯以形成2-取代的-1,4-二苯胺:
其中式(Ib)、(IIb)和(III)的X选自:(a)C1-C6烷基;(b)甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基;(c)羟基取代的C1-C6烷基;(d)-(CH2)yOCH3;其中y为1-3;(e)-(CH2)yOCH2CH3;其中y为1-3;(f)-(CH2)yOCH2CH2CH3;其中y为1-3;(g)其中Z为氢或C1-3烷基;以及(h)它们的混合物。
本申请的另一个实施例涉及制备2-甲氧基甲基-1,4-二苯胺的方法,所述方法包括以下步骤:(a)向4-硝基-3-甲氧基甲基氯苯中引入氨以获得4-硝基-3-甲氧基甲基氨基苯;和(b)在存在氢化催化剂的情况下,氢化4-硝基-3-甲氧基甲基氨基苯以获得2-甲氧基甲基-1,4-二苯胺。
本申请的另一个实施例涉及制备2-甲氧基甲基-1,4-二苯胺的方法,所述方法包括以下步骤:(a)硝化3-卤代苄基卤化物以获得4-硝基-3-卤代甲基卤代苯;(b)将3-卤代甲基基团转换成3-甲氧基甲基基团以获得4-硝基-3-甲氧基甲基卤代苯;(c)向4-硝基-3-甲氧基甲基卤代苯中引入氨以获得4-硝基-3-甲氧基甲基氨基苯;和(d)在存在氢化催化剂的情况下,氢化4-硝基-3-甲氧基甲基氨基苯以获得2-甲氧基甲基-1,4-二苯胺。
附图说明
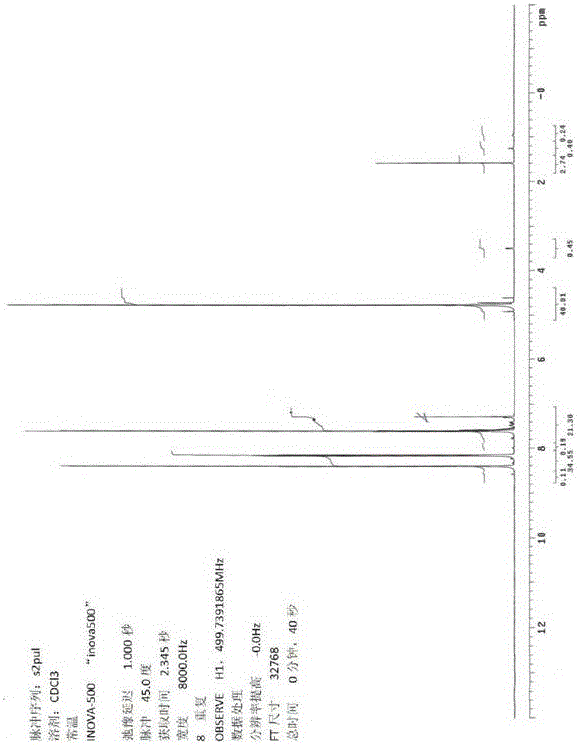
图1显示所述方法和步骤中的式(XVI)的1H NMR扫描。
图2显示所述方法和步骤中的式(X)的1H NMR扫描。
图3显示所述方法和步骤中的式(VII)的1H NMR扫描。
图4显示所述方法和步骤中的式(VIII)的1H NMR扫描。
图5显示所述方法和步骤中的式(IV)2-甲氧基甲基-1,4-二苯胺的1H NMR扫描。
图6显示所述方法和步骤中作为与苹果酸加合物的2-甲氧基甲基-1,4-二苯胺的1H NMR扫描。
具体实施方式
现已发现,2-取代的-1,4-二苯胺可由下述方法有效地生产。式(IV)所示的一个优选的化合物2-甲氧基甲基-1,4-二苯胺:
可由简单方式获得而无需进一步纯化的步骤。
因此,制备2-取代的-1,4-二苯胺的方法包括氨步骤,随后是氢化步骤。
其中式(I)–(III)的X选自:
(a)C1-C6烷基,如甲基、乙基、丙基、丁基;
(b)甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基;
(c)具有羟基取代的C1-C6烷基;
(d)-(CH2)yOCH3;y为1-3;
(e)-(CH2)yOCH2CH3;y为1-3;
(f)-(CH2)yOCH2CH2CH3;y为1-3;
(g)Z为氢或C1-3烷基;
以及它们的混合物。
如本文所用,“生理上相容的盐”是指适用于人类的盐,并对人类具有有限的刺激性至无刺激性。
X部分的取代可在如下所示的苯环的2或3位上。
因此,经由以下异构体中任意一个,所述方法可用来制备式(IV)所示的2-甲氧基甲基-1,4-二苯胺。
3-取代异构体以形成2-甲氧基甲基-1,4-二苯胺
2-取代异构体以形成2-甲氧基甲基-1,4-二苯胺
氨步骤
上文反应方案的氨步骤包括通过亲核取代向式(I)所示的4-硝基-2(或3-)取代的氯苯中引入氨(如无水的氨)以获得式(II)所示的4-硝基-2(或3-)取代的氨基苯中间体产品。在一个实施例中,4-硝基-2-(或3-)取代的氨基苯中间体产品为4-硝基-2-(或3-)甲氧基甲基氨基苯(氨基苯还已知可为苯胺)。通常,仅芳族氟原子可被取代,但根据本文详述的具体的取代模式,氯原子也具有足够的活性以被取代。作为另外一种选择,氯原子可被氟原子交换(例如但不限于通过使用氟化钾和18-冠醚-6),或者在与氨反应期间原位进行,或者在用氨处理之前在不连续的步骤中进行。参见Finkelstein,H.Ber.,1910,43,1528。
氨步骤的实施例可包括在搅拌的反应器中将液体氨与4-硝基-2(或3-)取代的氯苯混合,用氮填充反应器至约75psig(89.7psi或618kPa)和约100psig(114.7psi或791kPa)范围内的压力,加热混合物至约150℃至约220℃,更典型地约180℃至约200℃范围内的温度,并在该温度下搅拌混合物约1小时至约20小时的时间。氨步骤的实施例可在溶剂中进行。此类溶剂的实例包括但不限于甲酰胺或乙腈。
氢化步骤
上文反应方案的氢化步骤包括在存在氢化催化剂(如钯系、铂系、镍系催化剂,如Raney镍)的情况下氢化式(II)所示的4-硝基-2-(或3-)取代的氨基苯中间体产品以获得式(III)所示的2-取代的-1,4-二苯胺。催化氢化反应可在氢化溶剂,如乙酸乙酯、甲苯、乙酸丁酯、乙醇、甲醇、以及它们的混合物中发生。
氢化步骤的实施例可包括将4-硝基-2(或3)取代的氨基苯与氢化催化剂和溶剂混合,在反应混合物上应用约50-60psig(64.7-74.7psi或446-515kPa)压力的氢气氛,并在氢气氛下搅拌混合物约30分钟至约4小时的时间。作为另外一种选择,反应混合物可在氢气氛下被加热至约20℃至约80℃,更典型地约60℃至约80℃范围内的温度。此外,氢化步骤的实施例可进一步包括过滤、洗涤和干燥2-取代的-1,4-二苯胺的子步骤。
任选的醚化步骤
在本方法中,任选的步骤在氨步骤之前进行,并且4-硝基-2(或3-)卤代甲基取代的氯苯被引入到作为成醚剂的醇或醇盐中,得到4-硝基-2-(或3-)取代的氯苯的醚衍生物。
其中式(IX)的X1选自卤素,如F、Cl和Br;C1-C4卤代烷基,如氟代甲基、氯甲基、溴甲基溴化物、氟乙基、氯乙基、溴乙基等等;其中卤素为F、Cl或Br、以及它们的混合物。
YOH的Y代表C1-C4烷基部分,如甲基、乙基、丙基和丁基。碱可选自碱醇盐和/或碱金属氢氧化物
其中式(I)中的X选自:(b)甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基(d)-(CH2)yOCH3;y为1-3(e)-(CH2)yOCH2CH3;y为1-3(f)-(CH2)yOCH2CH2CH3;y为1-3(g)Z为氢或C1-3烷基;以及它们的混合物。
X1和X部分的取代可在如下所示的苯环的2或3位上。
其中YOH的X1、X和Y如上文中式(IX)和(I)所定义。
因此,经由下文所示的异构体(经由2-位置异构体),所述方法可用来制备式(IV)所示的2-甲氧基甲基-1,4-二苯胺。
其中YOH的Y为甲醇的甲基。
IX、X和VII的3-位异构体同样适于形成2-甲氧基甲基-1,4-二苯胺。
反应方案的任选醚化步骤包括通过亲核取代向式(IX)所示的4-硝基-2(或3-)卤代烷基部分取代的氯苯中间体产品中引入成醚基团,以获得式(I)所示的4-硝基-2(或3-)取代的氯苯中间体产品。
碱的溶液,如碱醇盐和/或碱金属氢氧化物在C1-C3醇(甲醇、乙醇和丙醇)中的溶液,可提供成醚基团。
适宜的碱醇盐非限制性实例包括甲醇钠、甲醇锂、甲醇钾、乙醇钠、乙醇锂、乙醇钾、丙醇钠、丙醇锂、丙醇钾、以及它们的混合物。适宜的碱金属氢氧化物的非限制性实例包括氢氧化钠和氢氧化钾。在C1-C3醇中碱醇盐和/或碱金属氢氧化物的浓度在约10%至约30%,更典型地约20%的范围内。
醚化步骤的实施例可包括将4-硝基-2(或3-)卤代烷基卤代苯与成醚剂(如碱醇盐和/或碱金属氢氧化物溶液)在C1-C4醇如甲醇中混合,在室温或任选地在回流下加热,并在该温度下搅拌混合物约30分钟至约2小时的时间。醚化步骤的其它实施例还包括在与碱醇盐和/或碱金属氢氧化物溶液混合之前,首先在甲醇、乙醇、丙醇或丁醇中溶解4-硝基-2(或3-)卤代烷基部分取代的氯苯的附加子步骤。
任选的用卤代烷醚化
作为另外一种选择,醚化步骤可使用碱,如碱醇盐和/或碱金属氢氧化物的溶液,并且卤代烷可提供成醚基团。本方法中的另一个任选步骤在氨步骤之前发生,其中4-硝基-2(或3-)取代的氯苯被引入到卤代烷上,得到4-硝基-2-(或3-)取代的氯苯的醚衍生物。
其中式(XI)的X2选自:-(CH2)yOH;y为1-3;以及它们的混合物。
代表卤代烷成醚剂的Y卤化物的Y,可为C1-C4烷基。Y卤化物的“卤化物”可为卤素,如F、Cl或Br。
碱为碱醇盐和/或碱金属氢氧化物。
其中式(I)中的X选自:(d)-(CH2)yOCH3;y为1-3(e)-(CH2)yOCH2CH3;y为1-3(f)-(CH2)yOCH2CH2CH3;y为1-3(g)Z为C1-C4烷基;以及它们的混合物。
X2或X部分取代可在苯环的2-或3-位上。
任选的溴化/甲氧基化步骤
反应方案的任选的溴化/甲氧基化步骤包括用溴气(Br2)和三苯基膦溴化式(XII)所示的4-硝基-3-羟甲基氯苯以获得式(XIII),随后与甲醇反应以获得式(IX)中所示的4-硝基-3-甲氧基甲基氯苯中间体产品。应用前面讨论的步骤以获得式(IV)所示的2-甲氧基甲基-1,4-二苯胺。
任选的甲氧基化步骤
反应方案的任选的甲氧基化步骤包括在约100℃,如介于100℃和180℃之间,如介于120℃和170℃之间,优选150℃的高温下甲氧基化式(XIV)所示的4-硝基-3-羟甲基氯苯。获得了式(V)所示的4-硝基-3-甲氧基甲基氯苯中间体产品。应用前面讨论的步骤以获得式(IV)所示的2-甲氧基甲基-1,4-二苯胺。(参见J.Org.Chem.,1999,64,3012-3018)。该任选的甲氧基化步骤还可经由Williamson醚合成或本领域的技术人员常见的各种方法来进行。
任选的硝化步骤
在本方法中,在醚化步骤之前进行的任选步骤为氯苯的硝化步骤。
其中式(XV)和(IX)的X1选自C1-C4烷基卤化物,如甲基氟化物、氯甲烷、甲基溴化物、乙基氟化物、乙基氯化物、乙基溴化物等等;以及它们的混合物,如F、Cl、Br、以及它们的混合物;C1-C6烷基;C1-C6烷基或具有羟基取代;-(CH2)yOCH3;其中y为1-3;-(CH2)yOCH2CH3;其中y为1-3;-(CH2)yOCH2CH2CH3;其中y为1-3;其中Z为氢或C1-C3烷基;以及它们的混合物。
因此,可应用所述方法经由下文所示的2-位置异构体来制备式(IV)所示的2-甲氧基甲基-1,4-二苯胺。
反应方案的任选硝化步骤包括硝化式(XVI)所示的2-氯苄基氯化物以获得式(X)所示的4-硝基-2-氯甲基氯苯中间体产品。此类硝化步骤描述于Journal of Chemical Research Synopses(8),247,1987,和Canadian Journal of Chemistry 86(11),1010-1018,2008中。
任选的酸沉淀步骤
反应方案的任选酸沉淀步骤包括用酸沉淀式(III)所示的2-取代的-1,4-二苯胺以获得特定期望的盐。酸沉淀步骤的实施例可包括向含有还原剂(如亚硫酸钠)以防止氧化的酸溶液中添加2-取代的-1,4-二苯胺,如2-甲氧基甲基-1,4-二苯胺,同时应用外部冷却以保持反应温度在约0℃至约40℃,更典型地约10℃至约30℃的范围内,并保持约30分钟至3小时的时间直至盐从溶液中结晶出来。然而,向含有还原剂的2-取代的-1,4-二苯胺,如2-甲氧基甲基-1,4-二苯胺的溶液中添加酸溶液的反向添加也是适宜的。适宜的酸溶液的非限制性实例包括苹果酸、硫酸、盐酸、磷酸和酒石酸。此外,酸沉淀步骤的实施例可进一步包括过滤、洗涤和干燥2-取代的-1,4-二苯胺的盐,例如2-甲氧基甲基-1,4-二苯胺盐的子步骤。
下面的实例说明了上述合成,但不限制本发明的广泛概念。
实例1
制备2-甲氧基甲基-1,4-二苯胺
硝化步骤-制备4-硝基-2-氯甲基氯苯。
将50.0g(0.31mol)2-氯苄基氯化物(参见图1)溶解于141ml浓硫酸中,并在冰/甲醇浴中冷却至内部-5℃的温度。将20.66g(0.328mol)发烟硝酸置于相连的滴液漏斗中。以保持内部温度低于0℃的速率来添加硝酸。当反应接近结束时,产物从溶液中沉淀,并且停止搅拌。将反应混合物倾倒在1升锥形瓶内的750ml冰上。添加额外的冰以保持反应冷却。保持冷却反应以便固体沉淀。倒出上清液。所述固体用250ml水磨碎。最终的固体溶解于400ml的二氯甲烷中并用两部分的(2)200ml的饱和碳酸氢钠溶液洗涤。然后干燥(硫酸钠)二氯甲烷相,过滤并蒸发。产物,4-硝基-3-氯甲基氯苯(56g,0.272mol)以半固体形式获得并且可直接使用而无需进一步纯化。1H-NMR(CDCl3):8.41(d),1H;8.17(dd)1H;7.594(d),1H;4.756(s),2H。参见图2。
甲氧基甲基化步骤-制备4-硝基-2-甲氧基甲基氯苯。
实施例A:应用甲氧基碱
在50ml无水甲醇中搅拌15.0g(72.8mmol)的4-硝基-2-氯甲基氯苯。在室温下,添加13.9g的甲醇钠溶液(30%于甲醇)。在添加过程中,氯化钠沉淀出来并且获得无色至玫瑰色的悬浮液。30分钟后停止添加甲醇钠溶液,在该时间段内,内部温度升至大约30℃。然后将反应混合物在回流下加热30分钟,并且热滤悬浮液以获得澄清的溶液。在冷却时,产物4-硝基-2-甲氧基甲基氯苯结晶出来并被过滤掉。产物收率为11.0g的淡黄色固体。滤液被浓缩至大约一半的体积并且在冰浴中冷却以提供另一份3.8g的产物。总产物收率为14.8g。1H-NMR(DMSO-d6):8.27(d),1H;8.18(dd),1H;7.77(d),1H;4.58(s),2H;3.44ppm(s),3H。参见图3。
实施例B:应用碱金属氢氧化物
在450ml无水甲醇中搅拌180.0g 4-硝基-2-氯甲基氯苯。加热至回流后,在一小时的时间内,添加已制备好的41.9g氢氧化钠的270ml甲醇溶液。为了完成反应,将混合物在回流下再另外搅拌一小时。在添加过程中,氯化钠沉淀出来并且获得淡黄色的悬浮液。反应完成后,悬浮液在冰浴中冷却。在低于10℃下连续冷却,在15分钟的时间内添加90ml乙酸的540ml水溶液。添加后,悬浮液在冰浴中再另外搅拌30分钟。最后,反应产物4-硝基-3-甲氧基甲基氯苯被过滤出来并用水和甲醇(9:1)的混合物洗涤。产物在40℃干燥。产物收率为165.4g。
制备4-硝基-3-甲氧基甲基氯苯
将5.61g 5-氯-2-硝基苄醇与9.1g三苯基膦于100ml的二氯甲烷中混合。在5分钟内分批向该溶液添加6.1g N-溴代琥珀酰亚胺(为了避免反应升温至大约50℃时而起泡)。搅拌30分钟后,添加10重量%的三苯基膦(900mg)和N-溴代琥珀酰亚胺(600mg)。另外搅拌30分钟后,反应混合物浓缩至大约10ml,倾倒至层上,然后用0.1%的甲醇的二氯甲烷溶液冲洗。蒸发滤液得到2.43g为浅黄色油的5-氯-2-硝基苄基溴化物。1H-NMR(500MHz,CDCl3)δ(ppm)4.806(s,2H),7.457-7.479(dd,1H),7.589-7.593(s,1H),8.033-8.051(d,1H)。
在室温下,将2.15g 5-氯-2-硝基苄基溴化物溶解于大约25ml甲醇中。添加1.86g 25%的甲醇钠的甲醇溶液,并且在10重量%额外的甲醇钠被加入以完成转化之后,继续在0℃下搅拌1小时。蒸发溶剂并且残余物溶解于100ml二氯甲烷中,并且用25ml水(2X)洗涤。蒸发得到1.6g4-硝基-3-甲氧基甲基氯苯。1H-NMR(500MHz,CDCl3)δ(ppm)3.527(s,3H),4.838(s,2H),7.399-7.416(dd,1H),7.824-7.826(d,1H),8.066-8.084(d,1H)。
氨步骤-制备4-硝基-3-甲氧基甲基氨基苯。
实施例A:甲酰胺的亲核取代
反应在600ml的具有样品浸料管(在其顶端具有不锈钢烧结的玻璃料)、温度控制、压力传感器和底部排料口的Parr搅拌反应器中进行。底物(5g 4-硝基-3-甲氧基甲基氯苯)为固体,其悬浮在甲酰胺(225g)中,加热至溶解,并在真空下加注至反应器中,随后冲洗以清洁管路。通过用大于70psig(大于84.7psi或大于584kPa)的氮填充反应器来清除反应器中的空气,然后排气,然后真空至小于-13psig(小于1.7psi或小于11.7kPa)。进行三次所述加压/排气/真空循环。在压力下从置于天平上的加料槽中添加液体氨(41g)。反应器用大于80psig(大于94.7psi或大于653kPa)的氮填充。将反应加热至约200℃并且搅拌约6小时,然后冷却。从反应器中排出物料时,发现反应混合物为黑色。在旋转蒸发器上将反应混合物蒸发至干燥。
获得2.0g纯净的所需产物。ISMS MH+m/z 183。1H-NMR(CDCl3,500MHz)δ3.36(s,3H,CH3),4.526(s,2H,CH2),4.989(s(br),2H,NH2)6.63-6.64(d,J=8.79Hz,1H,芳族),8.018-8.071(m,2H,芳族)。参见图4。
实施例B:乙腈的亲核取代
反应在600ml的具有样品浸料管(在其顶端具有不锈钢烧结的熔块)、温度控制、压力传感器和底部排料口的Parr搅拌反应器(自始至终使用约250rpm)中进行。底物(5g)为固体,在10ml乙腈中打成浆液,加热至溶解,并且在真空下被加注至反应器中,随后冲洗以清洁管路。通过用大于70psig(大于84.7psi或大于584kPa)的氮填充反应器来清除反应器中的空气,然后排气,然后真空至小于-13psig(小于1.7psi或小于11.7kPa)。进行三次所述加压/排气/真空循环。在压力下从置于天平上的加料槽中添加液体氨(25g)。反应器用大于80psig(大于94.7psi或大于653kPa)的氮填充。将反应加热至210℃,保持大约24小时,然后冷却至室温。从反应器中排出物料时,发现反应混合物为黑色。在旋转蒸发器上将反应混合物蒸发至干燥。
获得1.0g纯净的所需产物。ISMS MH+m/z 183。1H-NMR(CDCl3,500MHz)δ3.36(s,3H,CH3),4.526(s,2H,CH2),4.989(s(br),2H,NH2)6.63-6.64(d,J=8.79Hz,1H,芳族),8.018-8.071(m,2H,芳族)。
氢化步骤-制备2-甲氧基甲基-1,4-二苯胺
将5g(27.5mmol)4-硝基-2-甲氧基甲基氨基苯和0.250g钯(10%于碳)置于250ml的Parr瓶中,并且添加50g乙酸乙酯。氢化在50-60psig(64.7-74.7psi或446-515kPa)的氢压力下于Parr设备中进行。在反应期间,灰黄色的悬浮液转变成更深的灰色的悬浮液。由于氢迅速被吸收,因而反应需要严格的监控,并且引入额外的氢以保持压力高于50psig(64.7psi或446kPa)。1小时后,悬浮液澄清,留下黄色溶液。反应继续2.5小时以确保完全转化。催化剂通过使用玻璃微纤维滤纸过滤而被除去。将滤液浓缩至大约25ml,并且加入25ml甲苯以沉淀产物。产物通过抽吸而被收集在滤纸上,并且在60℃下真空干燥。产物收率为4.5g。
1H-NMR(DMSO-d6):6.41(d),1H;6.37(d),1H;6.33(dd),1H;4.24(s),2H;4.21(s),2H;4.11(s),2H;3.23ppm(s),3H参见图5。
实例2
制备作为苹果酸加合物的2-甲氧基甲基-1,4-二苯胺
酸沉淀步骤
应用上文所述步骤,将80g(0.44mol)4-硝基-2-甲氧基甲基氨基苯在240ml乙醇和80ml水中,使用0.4g 10%Pd/C氢化。通过过滤除去催化剂,并且用80ml乙醇在惰性气氛下洗涤。滤液和洗涤溶液经混合后添加至第二溶液中,第二溶液为66.7g(0.483mol)D,L-苹果酸和0.4g亚硫酸钠溶解于320ml乙醇和40ml水中的混合物。加料在约30分钟的时间内完成。在添加了约50%之后,最终产品开始结晶出来。添加完成后,得到的浅黄色悬浮液可经搅拌在约30分钟的时间内冷却至室温。过滤掉沉淀并且洗涤四次,每一次洗涤使用60ml乙醇。产物在60℃下真空干燥。产物收率为109g。
核磁共振(NMR)谱与化学结构一致,并且显示苹果酸和2-甲氧基甲基-1,4-二苯胺的特征信号图谱。参见图6。用高氯酸和氢氧化钠滴定确认1:1化学计量的2-甲氧基甲基-1,4-二苯胺与苹果酸。
尽管本文的合成细节在2-甲氧基甲基-1,4-二苯胺及其生理上相容的盐的制备方法的实施例中已经说明,但是并非旨在将此类合成仅限于所说明的细节,并且在不以任何方式背离本发明实质的情况下可以做出多个其他改变和变型。
本文所公开的量纲和值不旨在被理解为严格地限于所述的精确值。相反,除非另外指明,每个这样的量纲是指所引用的数值以及围绕该值功能上等同的范围。例如,公开为“40mm”的量纲旨在表示“约40mm”。
除非明确地排除或以其它方式限制,本文所引用的每个文献,包括任何交叉引用或相关的专利或专利申请,均以引用方式全文并入本文。任何文献的引用不是对其作为本文所公开的或受权利要求书保护的任何发明的现有技术的认可,或者对其单独或与任何其它参考文献的任何组合教授、建议或公开任何此类发明的认可。此外,当本发明中术语的任何含义或定义与引入以供参考的文件中术语的任何含义或定义矛盾时,应当服从在本发明中赋予该术语的含义或定义。
虽然已经举例说明和描述了本发明的具体实施例,但是对于本领域技术人员来说显而易见的是,在不背离本发明实质和范围的情况下可以做出多个其他改变和变型。因此,权利要求书意欲包括在本发明范围内的所有这样的改变和变型。
- 还没有人留言评论。精彩留言会获得点赞!