TNS11在制备诊治子宫内膜癌产品中的应用的制作方法
本发明涉及癌症诊断、治疗、预测预后领域,更具体地,本发明涉及以检测TNS11异常为手段的癌症诊断、预测预后方法;及激活TNS11基因或蛋白质的癌症治疗剂。
背景技术:
子宫内膜癌又称子宫体癌,是指原发于子宫内膜的一组上皮性恶性肿瘤,其中多数起源于内膜腺体,称子宫内膜腺癌或子宫内膜样腺癌。子宫内膜癌为女性生殖道常见的三大恶性肿瘤之一,约占女性总癌瘤7%,占女性生殖道恶性肿瘤20%-30%。近年来,由于人类寿命的延长和外源性雌激素广泛应用等原因,国内外子宫内膜癌发病率明显增加,且发病年龄有年轻化趋势。子宫内膜癌的病因不十分清楚,目前认为子宫内膜可能有两种发病机制,一种是雌激素依赖型,即在无孕激素拮抗的雌激素长期作用下,发生子宫内膜增生甚至癌变,这一类型占子宫内膜癌的大多数;另一种是非雌激素依赖型,发病与雌激素无明确关系。
此外长期的子宫内膜炎症也与子宫内膜癌的发病有关。目前子宫内膜癌的治疗主要以手术为主,结合放化疗与药物治疗等方法。以往均认为子宫内膜癌5年存活率较高,是相对预后较好的癌肿,但若仔细对内膜癌患者存活资料进行全面评估,则可发现即使病变局限于子宫的患者其治疗和结局也常有较大差异。寻找子宫内膜癌新的预防和治疗方法仍是目前临床医生面临的任务之一。
技术实现要素:
本发明的目的之一在于提供一种通过检测TNS11基因或蛋白表达差异来诊断子宫内膜癌的方法。
本发明的目的之二在于提供一种通过检测TNS11基因或蛋白表达差异来预测子宫内膜癌预后的方法。
本发明的目的之三在于提供一种通过激活TNS11基因或TNS11蛋白来治疗子宫内膜癌的方法。
本发明的目的之四在于提供一种用于筛选治疗子宫内膜癌的药物的方法。
本发明的目的之五在于提供一种用于治疗子宫内膜癌的药物。
为了实现上述目的,本发明采用了如下技术方案:
本发明提供了检测TNS11基因或TNS11蛋白的产品在制备子宫内膜癌诊断工具中的用途。
本发明还提供了检测TNS11基因或TNS11蛋白的产品在制备预测子宫内膜癌预后工具中的用途。
进一步,所述检测TNS11基因或TNS11蛋白的产品包括检测TNS11基因或TNS11蛋白的表达水平的产品。所述产品包括能够结合TNS11基因的核酸或者能够结合TNS11蛋白的物质(例如抗体)。所述核酸能够检测TNS11基因的表达水平;所述物质能够检测TNS11蛋白的表达水平。
本发明的检测TNS11基因的产品可基于使用核酸分子的已知方法来发挥其功能:如PCR、如Southern杂交、Northern杂交、点杂交、荧光原位杂交(FISH)、DNA微阵列、ASO法、高通量测序平台等。使用该产品可以定性地、定量地、或半定量地实施分析。
包含在上述产品中的核酸可以通过化学合成来获得,或通过从生物材料制备含有期望核酸的基因,然后使用设计用于扩增期望核酸的引物扩增它来获得。
进一步,所述PCR方法为已知方法,例如,ARMS(Amplification Refractory Mutation System,扩增不应突变系统)法、RT-PCR(逆转录酶-PCR)法、嵌套PCR法等等。扩增的核酸可以通过使用点印迹杂交法、表面等离子共振法(SPR法)、PCR-RFLP法、原位RT-PCR法、PCR-SSO(序列特异性寡核苷酸)法、PCR-SSP法、AMPFLP(可扩增片段长度多态性)法、MVR-PCR法、和PCR-SSCP(单链构象多态性)法来检测。
上面所述的核酸包括扩增TNS11基因的引物,产品中包括的引物可以通过通过化学合成来制备,通过使用本领域技术人员知道的方法参考已知信息来适当地设计,并通过化学合成来制备。
在本发明的具体实施方案中,所述核酸为QPCR实验中使用的扩增引物,所述引物的序列如SEQ ID NO.1(正向序列)和SEQ ID NO.2(反向序列)所示。
上面所述的核酸还可包括探针,所述探针可以通过化学合成来制备,通过使用本领域技术人员知道的方法参考已知信息来恰当设计,并通过化学合成来制备,或者可以通过从生物材料制备含有期望核酸序列的基因,并使用设计用于扩增期望核酸序列的引物扩增它来制备。
本发明的检测TNS11蛋白的产品可基于使用抗体的已知方法来发挥其功能:例如,可以包括ELISA、放射免疫测定法、免疫组织化学法、Western印迹等。
本发明的检测TNS11蛋白的产品包括特异性结合TNS11蛋白的抗体或其片段。可以使用任何结构、尺寸、免疫球蛋白类别、起源等的抗体或其片段,只要它结合靶蛋白质即可。本发明的检测产品中包括的抗体或其片段可以是单克隆的或多克隆的。抗体片段指保留抗体对抗原的结合活性的抗体一部分(部分片段)或含有抗体一部分的肽。抗体片段可以包括F(ab′)2、Fab′、Fab、单链Fv(scFv)、二硫化物键合的Fv(dsFv)或其聚合物、二聚化V区(双抗体)、或含有CDR的肽。本发明的检测TNS11蛋白的产品可以包括编码抗体或编码抗体片段的氨基酸序列的分离的核酸,包含该核酸的载体,和携带该载体的细胞。
抗体可以通过本领域技术人员公知的方法来获得。例如,制备保留整个或部分靶蛋白质的多肽或整合编码它们的多核苷酸的哺乳动物细胞表达载体作为抗原。使用抗原免疫动物后,从经过免疫的动物获得免疫细胞并融合骨髓瘤细胞以获得杂交瘤。然后从杂交瘤培养物收集抗体。最后可以通过使用被用作抗原的TNS11蛋白或其部分对获得的抗体实施抗原特异性纯化来获得针对TNS11蛋白的单克隆抗体。可以如下制备多克隆抗体:用与上文相同的抗原免疫动物,从经过免疫的动物收集血液样品,从血液中分离出血清,然后使用上述抗原对血清实施抗原特异性纯化。可以通过用酶处理获得的抗体或通过使用获得的抗体的序列信息来获得抗体片段。
标记物与抗体或其片段的结合可以通过本领域普遍知道的方法来实施。例如,可以如下荧光标记蛋白质或肽:用磷酸盐缓冲液清洗蛋白质或肽,添加用DMSO、缓冲剂、等准备的染料,然后混合溶液,再于室温放置10分钟。另外,标记可使用商品化的标记试剂盒,诸如生物素标记试剂盒,如生物素标记试剂盒-NH2、生物素标记试剂盒-SH(DojindoLaboratories);碱性磷酸酶标记试剂盒诸如碱性磷酸酶标记试剂盒-NH2、碱性磷酸酶标记试剂盒-SH(Dojindo Laboratories);过氧化物酶标记试剂盒诸如过氧化物酶标记试剂盒-NH2、过氧化物酶标记试剂盒-NH2(Dojindo Laboratories);藻胆蛋白标记试剂盒诸如藻胆蛋白标记试剂盒-NH2、藻胆蛋白标记试剂盒-SH、B-藻红蛋白标记试剂盒-NH2,B-藻红蛋白标记试剂盒-SH、R-藻红蛋白标记试剂盒-NH2、R-藻红蛋白标记试剂盒SH(DojindoLaboratories);荧光标记试剂盒诸如荧光素标记试剂盒-NH2、HiLyte Fluor(TM)555标记试剂盒-NH2、HiLyte Fluor(TM)647标记试剂盒-NH2(Dojindo Laboratories);及DyLight 547和DyLight647(Techno Chemical Corp.)、Zenon(TM)、Alexa Fluor(TM)抗体标记试剂盒、Qdot(TM)抗体标记试剂盒(Invitrogen Corporation)和EZ-标记物蛋白质标记试剂盒(Funakoshi Corporation)。为了正确标记,可以使用适宜的仪器来检测经过标记的抗体或其片段。
作为依照本发明的检测产品的样品,可以使用例如自活检受试者获得的组织样品或流体。样品不受特别限制,只要它适于本发明的测定;例如,它可以包括组织、血液、血浆、血清、淋巴液、尿液、浆膜腔液、脊髓液、滑液、房水、泪液、唾液、或其级分或经过处理的材料。
在本发明的具体实施方案中,所述样品来自受试者的组织。
在本发明中,“预后”是指癌症患者在通过手术处理等抑制或缓解肿瘤生长后的过程或结果。在本说明书中,预后可以是通过手术处理抑制或缓解肿瘤生长后1、2、3、4、5、6、7、8、9、10、15、20年或更久时的生机状态。预后可以通过检查生物标志物即TNS11蛋白或编码TNS11蛋白的基因来预测。预后预测可以这样进行:根据生物标志物的有或无,或者升高或降低,确定患者的预后是良好还是不良,或者确定良好预后或不良预后的概率。
在本发明中,“预后良好”是指在通过手术处理等为患者抑制或缓解肿瘤生长之后,患者长时期(例如3、5、6、7、8、9、10、15、20年或更长)没有危急状况。或者,预后好可以意指在这样长时间内存活、无转移、无复发、或无再发。例如,预后良好可以意指至少3年或尤其是至少5年存活,优选没有转移或复发。预后良好最优选的状态是长期无疾病的存活。如本文中所使用的,“预后良好”还可以包括任何这样的状态,其中可以发现疾病如转移,但是恶性低且不严重地影响生存能力。
在本发明中,“预后不良”是指患者在通过手术处理等抑制或缓解肿瘤生长后的短时期(例如1、2、3、4、5年或更短)内发生致命状况。或者,预后差是指在这样的短时期里死亡、转移、复发、或再发。例如,预后差可以意指至少3年或尤其至少5年内复发、转移、或死亡。
预测预后是指预测患者状况的过程或结果,并不意味着能以100%的准确度预测患者状况的过程或结果。预测预后是指确定某些过程或结果的可能性是否增加,而并不意味着通过与某些过程或结果不发生的情况比较来确定发生某些过程或结果的可能性。如本发明而言,本发明中TNS11基因或TNS11蛋白的水平降低的患者中,与不显示该特征的患者相比,更有可能观察到特定过程或结果。
进一步,所述检测TNS11基因或TNS11蛋白的产品可以是检测TNS11基因或TNS11蛋白的试剂、也可以是包含所述试剂的试剂盒、芯片、试纸等,也可以是使用所述试剂的高通量测序平台。
本发明还提供了一种诊断子宫内膜癌的工具,所述工具能够检测TNS11基因或TNS11蛋白的表达水平。所述工具包括能够结合TNS11基因的核酸或者能够结合TNS11蛋白的物质(例如抗体)。所述核酸能够检测TNS11基因的表达水平;所述物质能够检测TNS11蛋白的表达水平。
进一步,所述核酸和所述物质的性质同前面所述。
进一步,所述诊断子宫内膜癌的工具包括但不限于芯片、试剂盒、试纸、或高通量测序平台;高通量测序平台是一种特殊的诊断子宫内膜癌的工具,随着高通量测序技术的发展,对一个人的基因表达谱的构建将成为十分便捷的工作。通过对比疾病患者和正常人群的基因表达谱,容易分析出哪个基因的异常与疾病相关。因此,在高通量测序中获知TNS11基因的异常与子宫内膜癌相关也属于TNS11基因的用途,同样在本发明的保护范围之内。
本发明还提供了一种预测子宫内膜癌预后的工具,所述预测子宫内膜癌预后工具包括能够结合TNS11基因的核酸或者能够结合TNS11蛋白的物质(例如抗体)。所述核酸能够检测TNS11基因的mRNA水平;所述物质能够检测TNS11蛋白的表达水平。
进一步,所述核酸和所述物质的性质同前面所述。
进一步,所述预测子宫内膜癌预后的工具包括但不限于芯片、试剂盒、试纸、或高通量测序平台;高通量测序平台是一种特殊的诊断子宫内膜癌的工具,随着高通量测序技术的发展,对一个人的基因表达谱的构建将成为十分便捷的工作。通过对比疾病患者和正常人群的基因表达谱,容易分析出哪个基因的异常与疾病相关。因此,在高通量测序中获知TNS11基因的异常与子宫内膜癌相关也属于TNS11基因的用途,同样在本发明的保护范围之内。
本发明的检测产品、诊断工具中使用的抗TNS11抗体或其片段所识别的氨基酸的数目没有特别限制,只要抗体能够结合TNS11即可。
本发明还提供了一种诊断子宫内膜癌或预测子宫内膜癌预后的方法,所述方法包括如下步骤:
(1)获取受试者的样品;
(2)检测受试者样品中TNS11基因或蛋白的表达水平;
(3)将测得的TNS11基因或蛋白的表达水平与受试者的患病与否关联起来。
(4)与对照相比,TNS11基因或蛋白的表达水平降低,则该受试者被诊断为子宫内膜癌,或该受试者被确定为预后不良。
本发明还提供了一种子宫内膜癌的治疗方法,所述方法包括激活TNS11基因或TNS11蛋白。
进一步,所述方法包括促进TNS11基因的表达,或促进TNS11蛋白的表达或增强TNS11蛋白的活性。
本发明还提供了一种癌症药物的筛选方法,可以通过在对癌细胞添加测试药物后或在对癌症模型动物施用测试药物后的某个时期测量TNS11基因或者TNS11蛋白的表达水平来测定癌症药物改善癌症预后的效果。更具体地说,当TNS11基因或者TNS11蛋白的表达水平在添加或施用测试药物后升高时或者恢复正常水平时,可选择该药物作为改善癌症预后的治疗药物。
本发明还提供了一种含有TNS11基因或TNS11蛋白的激活剂的药物。
本发明还提供了上述激活剂在制备治疗子宫内膜癌的药物中的应用。
本发明的TNS11基因或TNS11蛋白的激活剂不受限制,只要是可以促进或者增强TNS11或涉及TNS11上游或下游途径的物质的表达或活性,且对于治疗癌症有效的药物即可。
进一步,所述激活剂包括TNS11基因、TNS11蛋白、促进型miRNA、促进型转录调控因子、或促进型靶向小分子化合物。
所述激活剂还包括包含携带TNS11基因的载体或者宿主细胞。
本发明的激活剂一方面可以用于补充内源性的TNS11蛋白的缺失或不足,通过提高TNS11蛋白的表达,从而治疗因TNS11蛋白缺乏导致的子宫内膜癌。另一方面可以用于增强TNS11蛋白的活性,从而治疗子宫内膜癌。
本发明的药物可以作为医药单独施用或与其它药物一起施用。可以与本发明的药物一起施用的其它药物不受限制,只要它不损害本发明的治疗性或预防性药物的效果即可,优选的是,用于治疗或预防癌症的药物可以包括例如烷化剂,诸如异环磷酰胺、环磷酰胺、达卡巴嗪、替莫唑胺、尼莫司汀、白消安、丙卡巴肼、美法仑、和雷莫司汀;抗代谢物,诸如依诺他滨、卡培他滨、卡莫氟、克拉屈滨、吉西他滨、阿糖胞苷、阿糖胞苷十八烷基磷酸盐(cytarabine ocfosfate)、替加氟、替加氟-尿嘧啶、替加氟吉美嘧啶奥替拉西钾、去氧氟尿苷、羟基脲、氟尿嘧啶、氟达拉滨、培美曲塞、喷司他丁、巯嘌呤、和甲氨蝶呤;植物生物碱,诸如伊立替康、依托泊苷、索布佐生、多西他赛、nogitecan、帕利他赛、长春瑞滨、长春地辛、和长春碱;抗癌抗生素,诸如放线菌素D、阿柔比星、氨柔比星、伊达比星、表柔比星、净司他丁stimalamer、柔红霉素、多柔比星、吡柔比星、博来霉素、培洛霉素、丝裂霉素C、和米托蒽醌;基于铂的药物,诸如奥沙利铂、卡铂、顺铂、和奈达铂;激素药物,诸如阿那曲唑、依西美坦、雌莫司汀、炔雌醇、氯地孕酮、戈舍瑞林、他莫昔芬、地塞米松、托瑞米芬、比卡鲁胺、氟他胺、泼尼松龙、磷雌酚、米托坦、甲睾酮、甲羟孕酮、美雄烷、亮丙瑞林、和来曲唑;生物反应修饰剂,诸如干扰素α、干扰素β、干扰素γ、白介素、乌苯美司、干BCG、和香菇多糖;和分子靶向药物,诸如伊马替尼(imatinib)、吉非替尼(gefitinib)、吉姆单抗、奥佐米星、他米巴罗汀、曲妥单抗、维A酸、硼替佐米(bortezomib)、和利妥昔单抗等。
本发明的药物可根据需要制备成各种剂型。包括但不限于,经皮、粘膜、鼻、口颊、舌下或经口使用的片剂、溶液剂、颗粒剂、贴剂、膏剂、胶囊剂、气雾剂或栓剂。
本发明的药物的施用途径不受限制,只要它能发挥期望的治疗效果或预防效果即可,包括但不限于静脉内,腹膜内,眼内,动脉内,肺内,口服,小泡内,肌肉内,气管内,皮下的,通过皮肤,通过胸膜,局部的,吸入,通过粘膜,皮肤,肠胃,关节内,心室内,直肠,阴道,颅骨内,尿道内,肝内,瘤内。在某些情况下,可以系统地给药。在某些情况下是局部地给药。
本发明的药物的剂量不受限制,只要获得期望的治疗效果或者预防效果即可,可以依据症状、性别、年龄等来恰当的确定。本发明的治疗药物或预防药物的剂量可以使用例如对疾病的治疗效果或者预防效果作为指标来确定。
在本发明的上下文中,“诊断子宫内膜癌”既包括判断受试者是否已经患有子宫内膜癌、也包括判断受试者是否存在患有子宫内膜癌的风险。
本文所用的“治疗”涵盖患有相关疾病或病症的哺乳动物例如人类中治疗相关的疾病或疾病状态,并且包括:
(1)预防疾病或疾病状态在哺乳动物中发生,尤其是当该哺乳动物易感于所述疾病状态,但尚未被诊断出患有这种疾病状态时;
(2)抑制疾病或疾病状态,即阻止其发生;或者
(3)缓解疾病或疾病状态,即使疾病或疾病状态消退。
术语“治疗”通常涉及治疗人类或动物(例如,被兽医所应用),其中可达到某些预期的治疗效果,例如,抑制病症的发展(包括降低发展速度、使发展停止)、改善病症和治愈病症。还包括作为预防措施(例如预防)的治疗。对还没有发展为病症但有发展为该病症危险的患者的用途,也包括在术语“治疗”中。
本发明的优点和有益效果:
本发明的发现了一种诊断子宫内膜癌的分子标志物,使用该分子标志物可以在子宫内膜癌发生的早期即可作为判断,提供了患者的生存率。
另外,通过预测患者的预后,本发明能够提供有意义的信息来为患者决定治疗方案策略。
本发明的包括TNS11基因或蛋白的激活剂的治疗药物可用作新的子宫内膜癌的治疗药物。
附图说明
图1显示利用Western blot检测TNS11蛋白在子宫内膜癌组织与正常子宫内膜组织中的表达情况;
图2显示利用Western blot检测TNS11基因过表达情况。
具体的实施方式
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring HarborLaboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1基因芯片筛选差异表达基因
1、样本收集:
子宫内膜癌组织样本:收集子宫内膜癌患者,全部患者均经手术治疗,手术石蜡标本10例。所有患者均经过病理检查确诊患有子宫内膜癌。其他入组条件为:所有患者入院前未接受过任何治疗:未合并其他恶性肿瘤;未合并其他激素相关性疾病;临床资料完整。
10例子宫内膜癌患者,发病平均年龄58岁。患者主要临床表现为阴道不规则出血、下腹痛、月经紊乱、阴道排液等,亦有部分患者无明显症状而于健康查体发现。子宫内膜癌标本经HE染色切片,组织形态学确诊为子宫内膜癌。
正常子宫内膜组织样本:10例正常子宫内膜手术石蜡标本。样本来源的病人所患疾病包括:子宫肌瘤、子宫脱垂、膀胧膨出、直肠膨出。
2、组织RNA的获取
使用Trizol一步法提取组织总RNA,通过Nanodrop ND-1000读取260nm和280nm处的吸光度值(A)测定RNA溶液的纯度。经1%甲醛变性琼脂糖凝胶电泳,紫外透射光下观察,检测RNA的完整性。
3、基因芯片杂交及扫描
总RNA经线性化扩增后,cy3-UTP标记,荧光标记后的cRNAs采用RNEASY Mini Kit纯化,用Amhion的RNA Fragmentation Reagents对标记好的cRNAs进行片段化处理。采用美国Agilent公司的人全基因表达谱芯片(4x 44K基因),在芯片杂交炉中65℃杂交17h,然后洗脱、染色,最后用Agilent DNA MicroarrayScanner扫描仪扫描。
4、芯片数据处理与分析
杂交后的芯片经芯片扫描仪读取数据点后,将数据导入分析软件,对于两组比值的自然对数绝对值大于2.0或小于0.5的基因作为差异表达基因。
5、统计学处理
采用SPSS 13.0统计软件进行数据分析,组间差异比较采用单因素方差分析法,P<0.05差异有显著性意义。
6、结果
芯片结果显示,子宫内膜癌组织与正常子宫内膜组织之间共筛选出654个差异表达基因,其中表达水平上调的基因421个,表达水平下调的基因233个。
实施例2大样本验证筛选出的差异表达基因
考虑现有技术中还未见关于该基因与子宫内膜癌相关性进行研究的基因作为候选基因,同时考虑基因测序的结果,选择TNS11基因(其表达在子宫内膜癌组织中下调)进行验证。
1、样本收集
按照实施例1的方法收集子宫内膜癌组织50例,正常子宫内膜组织60例。
2、在mRNA水平上进行验证
2.1提取组织RNA
步骤同实施例1。
2.2逆转录
使用逆转录试剂盒,用逆转录缓冲液对lμg总RNA进行逆反录合成cDNA。采用25μl反应体系,每个样品取1μg总RNA作为模板RNA,在PCR管中分别加入以下组分:DEPC水,5×逆转录缓冲液,10mmol/l dNTP,0.1mmol/l DTT,30μmmol/l Oligo dT,200U/μl MMLVRT,模板RNA。42℃孵育1小时,72℃10分钟,短暂离心。
2.3PCR
使用引物设计软件Primer Premier 5.0设计mRNA荧光定量上下游PCR引物,合成引物序列,使用SYBR Green PCR Master Mix试剂盒操作,具体步骤按说明书进行操作,采用25μl反应体系,每个样本设置3个平行管,所有扩增反应均重复三次以上以保证结果的可靠性。配制以下反应体系(如表1所示),各项操作均于冰上进行:
表1荧光定量PCR各组分及相应体积
以GAPDH为内参,以SYBR Green I作为荧光标记物,在Light Cycler荧光定量PCR仪上进行PCR反应,通过融解曲线分析和电泳确定目的条带,ΔΔCT法进行相对定量。
TNS11基因引物序列如下所示:
上游引物:5’-CACTACAGCAACATTTCT-3’(SEQ ID NO.1);
下游引物:5’-GCACAATCTTATCCTCATA-3’(SEQ ID NO.2)。
GAPDH基因引物序列如下所示:
上游引物:5’-TTTAACTCTGGTAAAGTGGATAT-3’(SEQ ID NO.3);
下游引物:5’-GGTGGAATCATATTGGAACA-3’(SEQ ID NO.4)
2.4结果
结果显示,与正常子宫内膜组织相比,子宫内膜癌组织中TNS11基因的mRNA水平明显下调,相对表达量为0.19±0.011,差异具有统计学意义(P<0.05)。
3、在蛋白水平上进行验证
3.1提取组织总蛋白
按照EpiQuik组织/细胞总蛋白提取试剂盒的说明书进行蛋白提取的操作。
3.2Western blot检测
将提取的蛋白定量进行SDS-PAGE电泳,之后进行转膜、封闭、一抗孵育、二抗孵育、显色。
3.3统计学处理
将蛋白条带的灰度值使用Image J软件进行分析,以β-actin为内参,将TNS11蛋白条带的灰度值进行归一化处理。结果数据都是以平均值±标准差的方式来表示,采用SPSS13.0统计软件来进行统计分析的,两者之间的差异采用t检验,认为当P<0.05时具有统计学意义。
3.4结果
结果如图1所示,与正常子宫内膜组织相比,子宫内膜癌组织中TNS11蛋白水平显著降低,差异具有统计学意义(P<0.05)。
实施例3TNS11基因过表达
1、质粒构建
根据TNS11基因的编码序列设计扩增引物,引物的设计为本领域技术人员所熟知。从成人胎脑的cDNA文库(clontech公司,货号:638831)中扩增全长的TNS11基因的编码序列,上述cDNA序列插入到真核细胞表达载体pcDNA3.1中,连接获得的重组载体pcDNA3.1-TNS11用于后续实验。
2、子宫内膜癌细胞的培养与转染
2.1细胞培养
Ishikawa3-H-12细胞系均用50ml的培养瓶贴壁培养于RPMI 1640培养基(含10%胎牛血清,100U/ml青霉素,100g/ml链霉素)中,在37℃,5%CO2饱和湿度的培养箱中连续培养。
2.2细胞转染
1、转染前一天将0.5-2*105个肿瘤细胞悬浮于500μl不含抗生素的培养基,接种至24孔培养板。
2、转染当天细胞密度应达80%-90%,准备以下复合物A:将1μg质粒DNA稀释于无血清培养基中,轻轻混匀;复合物B:取4μl Lipofectamine2000稀释于无血清培养基中,混匀。
3、将复合物A和B混合,轻轻混匀,室温孵育。
4、将100μl脂质体复合体加入肿瘤细胞中,上下左右轻轻混匀,将细胞放入37℃含5%CO2培养箱孵育5-7小时。
5、加1ml含有2倍正常血清和抗生素浓度的生长培养基,继续培养细胞18-24小时。
3、利用QPCR实验检测pcDNA3.1-TNS11的过表达情况
3.1提取细胞总RNA利用常规方法进行操作。
3.2逆转录
步骤同实施例2。
3.3QPCR
步骤同实施例2。
3.4结果
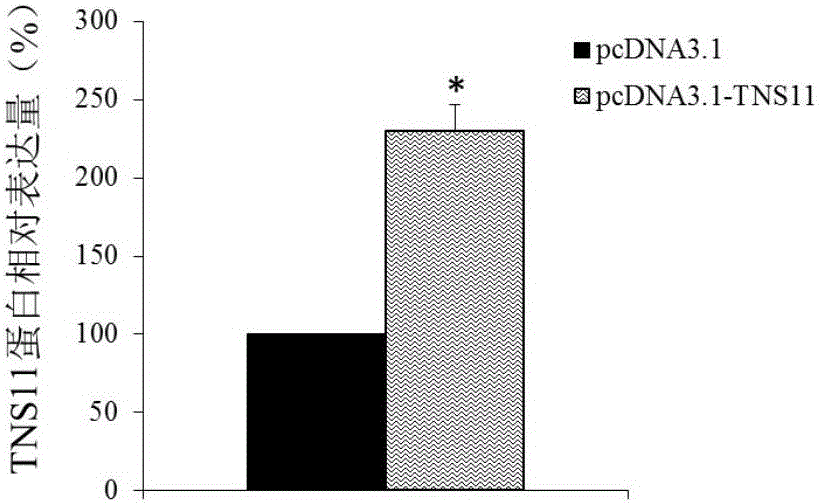
结果显示,pcDNA3.1-TNS11能够成功过表达,相对表达量为6.74±0.62,差异具有统计学意义(P<0.05)。
3、Western blot实验检测pcDNA3.1-TNS11过表达情况
步骤同实施例2。
结果如图2所示,与转染pcDNA3.1组相比,转染pcDNA3.1-TNS11的细胞中TNS11蛋白的含量明显增加,差异具有统计学意义(P<0.05)。
实施例4TNS11基因的表达对子宫内膜癌细胞增殖能力的测定
1、步骤:
应用5-溴-2′脱氧尿嘧啶(Brd U)标记及检测试剂盒。参照试剂盒使用说明,细胞转染(转染步骤同实施例3)48小时后,吸弃培养基,加入Brd U标记培养基,37℃,5%CO2培养箱中培育60min。弃去培养基,PBS冲洗后,以70%乙醇固定,过夜。用一抗为小鼠的抗Brd U抗体,二抗为带FITC的抗小鼠的荧光抗体,进行免疫反应。然后进行流式细胞学检测。
2、Brd U掺入结果:
结果显示:转染pcDNA3.1细胞组掺入率平均为:(28.74±1.18)%;pcDNA3.1-TNS11细胞组掺入率平均为(12.68±0.52)%,差异具有统计学意义(P<0.05)。上述实验结果表明,TNS11基因表达抑制了子宫内膜癌细胞的增殖。
实施例7Transwell实验检测TNS11基因表达对细胞迁移的影响
步骤:
1、从-80℃的冰箱中取出冻存的Matrigel物,然后在4℃温度条件下过夜,使其变成液体。
2、取出200μl无血清细胞培养基,加入50μl的Matrigel试剂,在低温条件,最好是在冰面上操作将其混和均匀,然后各加入100μl,放在37℃,二氧化碳的培养箱中培育5h,此间常观察液体情况,当液体变成稍白色时,说明其已变为凝固态。
3、将转染过的细胞(按照实施例3步骤操作)用胰酶消化,用不含血清的培养基清洗3次,然后计数,再将其配成细胞悬浮液。
4、用无血清的培养基将凝胶轻轻洗1次,然后将2*105细胞悬浮于100μl RPMI 1640中,再接种于transwell上室。
5、下室加600μl 10%FBS RPMI 1640。
6、37℃培养箱中,培养12h后,取出transwell小室,每组均重复4个样本。
7、其中1个小室弃去培养基,用无钙的PBS洗3遍,4%多聚甲酵固定10min,棉签擦掉上层未迁移的细胞,PBS洗3遍,结晶紫染色或Giemsa染色,在显微镜下观察。剩余3个小室将其下层迁移细胞用0.25%膜蛋白酶消化,计算迁移细胞数。
结果:
迁移实验结果显示,转染pcDNA3.1细胞组细胞迁移个数平均为229个,转染pcDNA3.1-TNS11细胞组细胞迁移个数平均为138个,差异具有统计学意义(P<0.05)。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!