一种半夏天冬氨酸蛋白酶及其应用的制作方法
本发明属于生物化学与分子生物学技术领域,具体涉及一种半夏天冬氨酸蛋白酶及其应用。
背景技术:
天冬氨酸蛋白酶是一类重要的蛋白水解酶,其活性中心由2个催化性天冬氨酸残基组成,存在于哺乳动物,植物,真菌,细菌以及病毒之中,是生物界广泛存在的一个基因。在动物中天冬氨酸蛋白酶与结直肠癌、乳腺癌等浸润转移密切相关,还与衰老,程序性死亡有关。在真菌,细菌中具有的功能研究较少,在植物中,天冬氨酸蛋白酶研究也比较少。
天冬氨酸蛋白酶在不同的物种当中具有不同的生物学功能。在细胞程序化死亡方面目前研究的比较多,在动物中,有确凿证据证明天冬氨酸蛋白酶参与动物细胞的程序化死亡,植物细胞中也找到了相关的证据,如拟南芥天冬氨酸蛋白酶通过RNAi低表达会引起绒毡层细胞过早成熟,从而引起细胞脱落。在植物的花药发育过程中,油菜和烟草中都检测出了高活性天冬氨酸蛋白酶活性,暗示该酶具有调控花药发育的功能。
目前,尚没有报道在半夏中克隆到天冬氨酸蛋白酶基因,也不知道该基因在药用植物半夏中起到何种功能。
技术实现要素:
本发明的目的在于提供一种半夏天冬氨酸蛋白酶及其在抗旱及抗虫中的应用。
一种半夏天冬氨酸蛋白酶,所述半夏天冬氨酸蛋白酶的氨基酸序列如序列表SEQ ID NO1所示。
所述半夏天冬氨酸蛋白酶的基因序列如序列表SEQ ID NO2所示。
一种含上述半夏天冬氨酸蛋白酶的基因载体。
上述半夏天冬氨酸蛋白酶的基因载体的宿主菌。
扩增上述的半夏天冬氨酸蛋白酶中任一片段的引物。
一种半夏天冬氨酸蛋白酶突变体,所述半夏天冬氨酸蛋白酶突变体的氨基酸序列如序列表SEQ ID NO3所示。
所述半夏天冬氨酸蛋白酶突变体的基因序列如序列表SEQ ID NO4所示。
上述半夏天冬氨酸蛋白酶或半夏天冬氨酸蛋白酶突变体在植物抗旱中的应用。
本发明的有益效果:本发明在天然有毒的中药材半夏中克隆得到了一个天冬氨酸蛋白酶基因,经研究,该基因具有明显的抗旱作用。本发明还发现了上述天冬氨酸蛋白酶的一个突变体,该突变体蛋白具有更高的抗旱活性,且具有部分抗虫的功能。
附图说明
图1为本发明克隆的半夏天冬氨酸蛋白酶基因鉴定电泳图;
图中,全式金15kb Maker(500bp,1kb,1.5kb,3kb,5kb,7.5kb,10kb,15kb);1.2300-APs,2.2300-APs(EcoRI+HindIII)。
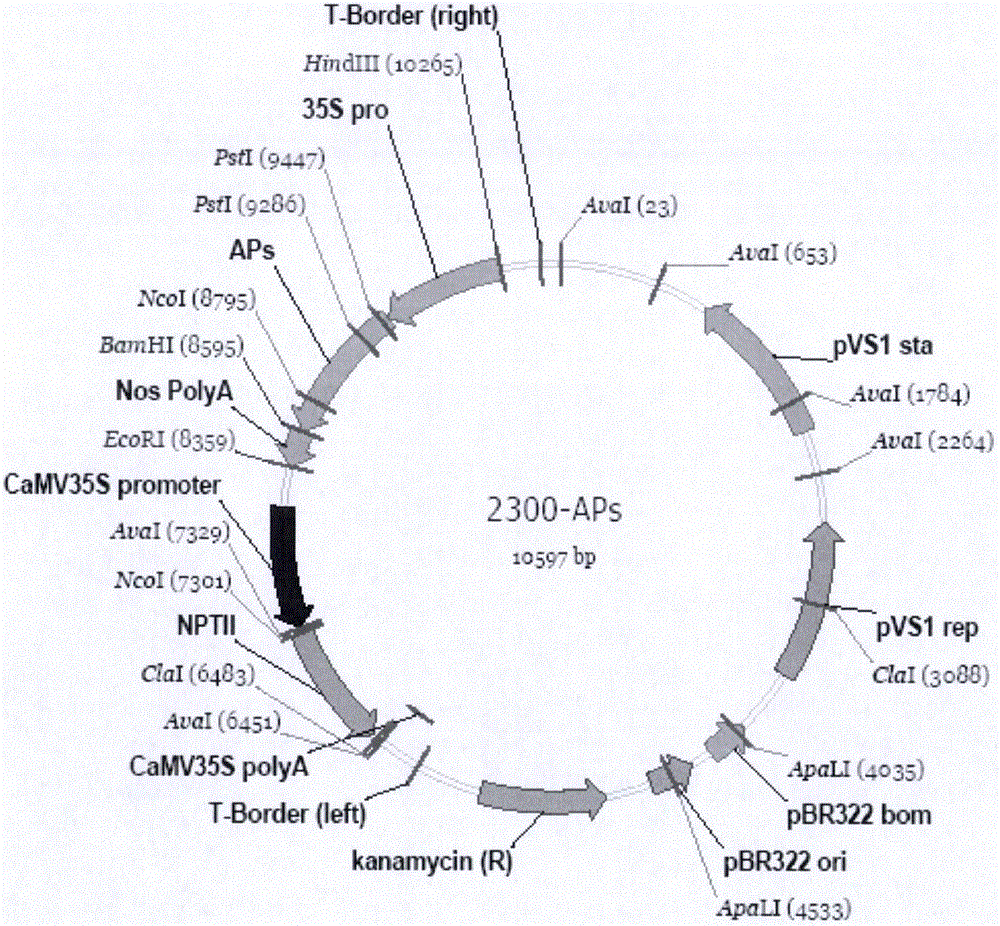
图2为本发明构建的pCAMBIA2300-APs载体结构示意图。
具体实施方式
下面结合附图和具体实施例对本发明做进一步说明。
以下实施例并不限定本发明,实施例中未详细说明的操作步骤请参照《分子克隆实验指南》第三版相应部分(J.萨姆布鲁克E.F.弗里奇等,科学出版社)或参阅所用试剂盒的说明书。
实施例1
根据已获得的水稻天冬氨酸蛋白酶基因保守区序列设计简并引物:
Fw:TCGCTCACCTGGCTGCAGTG(SEQ ID NO5)
Rv:CGAGGCGTCGAGGGAGTTGG(SEQ ID NO6)
利用同源克隆技术以提取的三叶半夏RNA反转录得到的cDNA为模板,通过PCR扩增获得了约528bp的基因片段,然后通过3’和5’RACE技术克隆得到了该基因的全长cDNA序列,序列分析表明:该基因开放读码框为888bp,编码296个氨基酸的前体蛋白。半夏天冬氨酸蛋白酶基因命名为APs。
1.反转录生成cDNA第一链
(1)、在0.2mL eppendorf管中加入下列试剂:总RNA 2μg,500μg/mL锚定引物oligo d(T)15 1μL,补水至15μL,70℃变性5min,迅速置冰上冷却。
(2)、按顺序加入下列组分:
(3)、混匀后42℃温浴30min,然后99℃温浴5min,最后置于5℃环境中。
2.PCR反应获得中间片段
(1)、按下列组分配制PCR反应液
(2)、按以下条件进行PCR反应
3. 3’RACE(按照Takara公司3’Full RACE Kit操作说明书进行)
(1)、反转录反应体系如下:
注:总RNA的使用量约为1μg,根据提取的RNA的浓度加入相应体积。
(2)、反应条件如下:
(3)、套式PCR反应。
使用TaKaRa LA (TaKaRa Code:DRR02AM)进行PCR反应时的实验操作如下。
①一轮PCR反应。反应体系如下:
反应条件如下:
②二轮PCR反应。反应体系如下:
反应条件如下:
4. 5’RACE(按照Invitrogen公司5’RACE System for Rapid Amplification of cDNA Ends,Version 2.0操作说明书进行)
(1)、获得cDNA第一链
1、按以下组分配制反应液:
合成反转录引物 2.5pmol
RNA 1-5μg
DEPC H2O至15.5μl
2、于70℃加热10min,使RNA变性,然后置于冰上1min,用离心机离一下,然后加入如下组分:
提示:对于结构复杂的RNA,在加入体系1后,70℃加热10min,立即转到50℃环境下,体系2也要预热到50℃,且整个反应体系要加倍。
3、离心使体系2混匀,在42℃温浴1min。
4、加入1μl反转录酶SuperscriptTMII RT,于体系2中,混匀。
5、在70℃温浴15min,终止反应。
6、用离心机离心10-20s,然后置于37℃。
7、加入1μl RNase Mix轻轻混匀后于37℃下放置30min,使cDNA:RNA链中RNA降解掉
8、离心收集样品,然后置于冰上。
(2)、S.N.A.P去除包含在cDNA中的蛋白、dNTPs、引物、DNA
1、将结合液放置于室温条件下
2、每纯化一个样品,取约100μl无菌水,于65℃预热备用
3、向cDNA液中加入120μl结合液
4、将结合液/cDNA加入柱子中,13000rpm离心20sec
5、将吸附柱从收集管中移走,将管中的液体转到另一离心管中,保存该溶液直至确定回收回来了cDNA,然后重新将吸附柱放到收集管中。
6、向柱子中加入冰预冷的1x的400μl洗脱液,于13000rpm下离心20sec,抛弃洗脱液,重复此过程4次
50μl wash buffer
1x洗脱液配制:900μl蒸馏水
1050μl无水乙醇
7、用400μl 70%乙醇洗涤柱子,按照步骤6的方法洗涤两次
8、洗脱完毕后,丢弃70%乙醇,于13000rpm下空甩1min
9、将柱子放置到一个新的样品收集管中,向柱子中加入约50μl 65℃预热的灭菌蒸馏水,然后于13000rpm下离心20sec,收集cDNA
(3)、TdT加尾
1、按以下组分配制反应液:
2、在94℃下孵育2-3min,然后立即置于冰上1min,通过离心收集下样品,然后置于冰上
3、向离心管中加入1μl的TdT,轻轻混匀,然后在37℃下孵育10min
4、然后在65℃下加热10min,然后离心收集样品
(4)、PCR反应
1、一轮反应
反应体系如下:
反应条件如下:
2、二轮反应
反应体系如下:
反应条件如下:
5.全长的获得
(1)、根据3’端测序序列和5’端测序序列,进行拼接,然后从编码框两头设计引物,引物的5’端加入合适的酶切位点从cDNA和基因组DNA中进行PCR
(2)、反应体系如下:
(3)、反应条件如下:
将获得的半夏天冬氨酸蛋白酶基因构建CaMV35S启动子驱动,CaMV35S-PolA终止的植物表达载体(pCAMBIA2300-APs,如图2所示),并通过农杆菌介导法转化烟草,获得了35S启动子驱动的APs基因的转基因烟草植株。
克隆得到的APs基因表达框:SmaI-CaMV35S-APs-CaMV35S-PolA-XbaIR,经双酶切连接载体pCAMBIA2300。
实施例2 APs基因突变体载体的获得
利用p2300-35S-APs植物表达载体为模版,通过重叠延伸PCR的方法获得突变体,突变位点为第10和第11位氨基酸残基SQ突变为KK。重新构建植物表达载体p2300-35S-Aps1,并通过农杆菌介导法转化烟草,获得了35S启动子驱动的Aps1基因的转基因烟草植株。
实施例3 转APs基因烟草的抗旱实验
选取3个株系转基因型(APs-1,APs-2,APs-3)与非转基因野生型(WT)各100粒大小均匀,饱满,无病虫的烟草种子进行发芽试验。将6层吸水纸放入培养皿中,再放一层滤纸作为发芽床,处理组发芽床加10mL10%的PEG6000溶液,对照组分别选取三个株系转基因型(APs-1,APs-2,APs-3)与非转基因野生型(WT)各100粒大小均匀,饱满,无病虫的烟草种子进行发芽,加10mL蒸馏水,置于恒温25℃室内在自然光照下进行发芽。7天后测定存活幼苗数、计算成苗率,随机选取10株幼苗测定苗高,主根长,单株鲜重。实验重复3次,计算和测定方法如下:
相对发芽率=(处理发芽率/对照发芽率)X 100%;
相对苗高=(处理苗高/对照苗高)X 100%;
相对鲜重=(处理鲜重/对照鲜重)X 100%;
相对活力数=(处理成苗率X处理幼苗苗高)/(对照成苗率X对照幼苗苗高)100%;
实验结果如表1所示;表明转APs基因种子的萌发率和幼苗生长情况优于野生型。
表1干旱胁迫对转APs基因种子萌发和幼苗生长的影响
实施例4 转Aps1基因烟草的抗旱实验
选取3个株系转基因型(Aps1-1,Aps1-2,Aps1-3)与非转基因野生型(WT)各100粒大小均匀,饱满,无病虫的烟草种子进行发芽试验。将6层吸水纸放入培养皿中,再放一层滤纸作为发芽床,处理组发芽床加10mL10%的PEG6000溶液,对照组分别选取三个株系转基因型(Aps1-1,Aps1-2,Aps1-3)与非转基因野生型(WT)各100粒大小均匀,饱满,无病虫的烟草种子进行发芽,加10mL蒸馏水,置于恒温25℃室内在自然光照下进行发芽。7天后测定存活幼苗数、计算成苗率,随机选取10株幼苗测定苗高,主根长,单株鲜重。实验重复3次,计算和测定方法如下:
相对发芽率=(处理发芽率/对照发芽率)X 100%;
相对苗高=(处理苗高/对照苗高)X 100%;
相对鲜重=(处理鲜重/对照鲜重)X 100%;
相对活力数=(处理成苗率X处理幼苗苗高)/(对照成苗率X对照幼苗苗高)100%;
实验结果如表1所示;表明转Aps1基因种子的萌发率和幼苗生长情况优于野生型和转Aps1基因植株。
表1干旱胁迫对转Aps1基因种子萌发和幼苗生长的影响
实施例5 转Aps基因烟草的抗虫实验
种植转Aps基因的烟草和野生型烟草,烟草生长到60天,苗期将要结束的时候,取生长大小一致,叶片数目一致的烟草植株,转Aps基因的烟草植株30株,野生型烟草30株,每株烟草上接40头大小一致的同龄蚜虫幼虫,30小时后,统计蚜虫抑制率:蚜虫抑制率%=(40-叶片上剩余蚜虫)/40。
实验结果:转Aps基因的烟草的蚜虫抑制率为75%,野生型烟草的蚜虫抑制率为2%。
实施例6 转Aps1基因烟草的抗虫实验
种植转Aps1基因的烟草和野生型烟草,烟草生长到60天,苗期将要结束的时候,取生长大小一致,叶片数目一致的烟草植株,转Aps1基因的烟草植株30株,野生型烟草30株,每株烟草上接40头大小一致的同龄蚜虫幼虫,30小时后,统计蚜虫抑制率:蚜虫抑制率%=(40-叶片上剩余蚜虫)/40。
实验结果:转Aps1基因的烟草的蚜虫抑制率为85%,野生型烟草的蚜虫抑制率为2%。
- 还没有人留言评论。精彩留言会获得点赞!