新的手性金属络合物及其用于通过1HNMR光谱分析带电化合物的手性的用途的制作方法
本申请根据35U.S.C.§119要求2015年8月19日向韩国知识产权局提交的韩国专利申请No.2015-0116903的优先权,该申请的公开内容通过引用整体并入本文。
技术领域
以下公开内容涉及新的配体、包含其的手性金属络合物、以及所述手性金属络合物用于通过1H NMR光谱分析带电化合物的手性的用途。本发明的手性金属络合物可用作手性溶剂化剂以通过1H NMR光谱方便地分析带电化合物的光学纯度,所述带电化合物例如多种胺衍生物、羧酸衍生物、氰醇衍生物以及带电金属络合物。
背景技术:
许多显示出生理活性的化合物具有手性,也因此具有旋光性,本领域公知,在许多情况下,彼此具有对映关系的两种光学异构体在人体中表现出彼此不同的生理活性。过去,这些化合物以外消旋混合物的形式商品化,但现今,因为需要更好的选择活性,所以显然需要将形成外消旋混合物的两种对映异构体分离的技术,以及测量旋光性化合物的光学纯度的技术。
生理活性的这种差异表现为手性药物中的药理作用,所以更加重要。因此在开发新药物的过程中,需要发展通过不对称合成或光学拆分分离光学纯的光学异构体的技术,以及准确测量光学纯度的技术。
所述光学异构体的分离包括将外消旋体分离为纯光学异构体(光学拆分)以及对两种光学异构体进行区分(测量光学纯度)的所有方法。
已开发出色谱法如气相色谱和高效液相色谱(HPLC)作为测量具有手性的化合物的光学纯度的方法。特别地,质子核磁共振(1H-NMR)光谱近来受到关注,原因是NMR设备分布广泛,以及分析物可回收,并且还由于可以用少量样品进行溶液状态下的实验,可以进行固体样品和液体样品两者的分析。在使用NMR测量光学纯度的方法中,光学纯度可通过使用手性衍生剂(CDA)、手性镧系位移试剂(CLSR)、手性溶剂化剂(CSA)等将手性分析物转化为两种非对映化合物并通过NMR进行分析来测定。
在这些方法中,手性衍生剂方法的缺点在于,需要进行一次衍生化过程,并且需要存在能够被衍生化的官能团;手性镧系位移试剂方法的缺点在于光谱中发生谱线增宽效应。然而,手性溶剂化剂的优点在于在NMR管中直接进行无损分析,使得可以看到非对映异构对的峰分离,从而方便地示出旋光性,并且1H NMR光谱中的两个非对映异构体显示出彼此不同的化学位移(δ),且可以使用其积分值的差异测定手性化合物的光学纯度。
到现在为止,即使已开发出多种手性溶剂化剂,但其中的大多数仅可用于测量特定手性分析物的光学纯度,因此,难以将其应用于更广泛的手性分析物的光学纯度测量。
[相关技术文献]
(专利文献1)韩国专利早期公开No.1998-067965
(专利文献2)韩国专利注册No.0170925
(非专利文献1)J.Org.Chem.1969,34,2543
(非专利文献2)Angew.Chem.Int.Ed.49,7955-7957(2010)
(非专利文献3)Acc.Chem.Res.46,2635-2644(2013)
技术实现要素:
发明人意图开发用于通过1H NMR光谱简单地测量手性化合物的光学纯度的手性溶剂化剂,所述光学纯度被认为难以用常规色谱方法测量。
本发明的一个实施方案涉及提供新的配体以及包含其的金属络合物。
本发明的另一个实施方案涉及提供使用所述金属络合物作为手性溶剂化剂通过1H NMR光谱测量多种手性化合物的光学纯度的方法。
本发明涉及新的配体、包含所述配体的手性金属络合物、以及所述手性金属络合物用于通过1H NMR光谱分析带电化合物的手性的用途。本发明的手性金属络合物可用作手性溶剂化剂以通过1H NMR光谱方便地分析带电化合物的光学纯度,所述带电化合物例如多种胺衍生物、羧酸衍生物、氰醇衍生物以及带电金属络合物。
以下将详细描述本发明。
除非另外限定,否则本文所使用的技术和科学术语具有本领域普通技术人员通常理解的含义。此外,省略对于与现有技术相同的技术结构和操作的重复描述。
在一个一般的方面,N2O2配体由以下化学式1表示:
[化学式1]
其中
R1和R2彼此独立地为(C1-C10)烷基或(C6-C20)芳基,或R1和R2通过(C2-C6)亚烷基连接以形成脂环族环;以及
R3和R4彼此独立地为氢、(C1-C10)烷基、(C6-C20)芳基或卤素。
本文所使用的术语“烷基”指的是仅由碳原子和氢原子组成的单价直链或支链饱和烃基,所述烷基的实例包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基、辛基、十二烷基等,但不限于此。
本文所使用的术语“芳基”指的是通过移除一个氢原子由芳香族烃衍生的有机基团,包括每个环中适当地包含4至7个环原子,优选5或6个环原子的单环或稠环体系,甚至是其中多个芳基通过单键连接的形式。其具体实例包括苯基、萘基、联苯基、蒽基、茚基、芴基等,但不限于此。
在本发明的一个示例性实施方案中,在化学式1中,R1和R2可以彼此独立地为甲基、乙基、丙基、丁基、戊基、己基、苯基、联苯基、萘基或蒽基,或R1和R2可以通过(C3-C4)亚烷基连接以形成脂环族环;以及R3和R4可以彼此独立地为氢、甲基、乙基、丙基、丁基、戊基、己基、苯基、联苯基、萘基、蒽基、氯、溴或氟。
在本发明的一个示例性实施方案中,化学式1的配体可选自以下结构,但不限于此:
在本发明的一个示例性实施方案中,化学式1的配体通过(A)手性1,2-二胺衍生物与(B)2,2′-二羟基二苯甲酮衍生物之间的亚胺化反应和还原胺化反应有效地制备。
更具体地说,化学式1的配体通过以下步骤制备,如以下反应式1所示:
1)手性1,2-二胺衍生物(化学式A)与2,2′-二羟基二苯甲酮衍生物(化学式B)反应以制备二亚胺化合物(化学式S);以及
2)还原二亚胺化合物(化学式S)以制备仲胺形式的配体(化学式1)。
[反应式1]
其中R1和R2彼此独立地为(C1-C10)烷基或(C6-C20)芳基,或R1和R2通过(C2-C6)亚烷基连接以形成脂环族环;以及R3和R4彼此独立地为氢、(C1-C10)烷基、(C6-C20)芳基或卤素。
手性1,2-二胺衍生物(化学式A)与2,2′-二羟基二苯甲酮衍生物(化学式B)反应以产生二亚胺化合物(化学式S)。相对于手性1,2-二胺衍生物(化学式A)使用超过2当量或更多的2,2′-二羟基二苯甲酮衍生物(化学式B),优选相对于1当量的手性1,2-二胺衍生物(化学式A)使用2至10当量的2,2′-二羟基二苯甲酮衍生物(化学式B)。亚胺化反应可在典型的反应温度,优选20℃至60℃下进行。
二亚胺化合物(化学式S)可在有机溶剂中制备,或者也可在纯净条件下制备,无需限制有机溶剂,只要其溶解反应物即可。在“纯净”条件下,亚胺的形成在不使用有机溶剂的情况下通过混合手性1,2-二胺衍生物(化学式A)和2,2′-二羟基二苯甲酮衍生物(化学式B)进行。考虑到反应物的溶解度及除去其的容易性,优选的是反应溶剂为选自以下的惰性溶剂:甲醇、乙醇、异丙醇、丁醇、丙酮、乙酸乙酯、乙腈、异丙醚、甲乙酮、二氯甲烷、二氯苯、氯苯、二氯乙烷、四氢呋喃、甲苯、苯、二甲苯、均三甲苯、二甲基甲酰胺、二甲亚砜等,更优选的是使用甲醇、乙醇或其混合溶剂。
由此产生的二亚胺化合物(化学式S)可在不进行分离、纯化和另外的纯化过程的情况下用于接下来的反应,或者如果需要的话可经历纯化过程。
使用还原剂还原所产生的二亚胺化合物(化学式S)以制备仲胺形式的配体(化学式1)。可使用金属氢化物,优选选自以下的一种或更多种作为还原剂:NaBH4、NaBH(OAc)3、NaBH2(OAc)2、NaBH3OAc、NaBH3CN、KBH4、KBH(OAc)、LiAlH4、B2H6和DIBAL-H(二异丁基氢化铝),更优选地可使用NaBH4。还原剂的含量不受限制,然而相对于二亚胺化合物(化学式S)以等量或过量使用,并且优选的是相对于1当量的二亚胺化合物(化学式S),使用1至10当量,优选地3至10当量,更优选地5至10当量。还原反应可在典型的反应温度,优选20℃至40℃下进行。
仲胺形式的配体(化学式1)可在有机溶剂中制备,并且无需限制有机溶剂,只要其溶解反应物即可。考虑到反应物的溶解度和除去其的容易性,优选的是反应溶剂为选自以下的惰性溶剂:甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、乙腈、异丙醚、甲乙酮、二氯甲烷、二氯苯、氯苯、二氯乙烷、四氢呋喃、甲苯、苯和二甲苯,更优选的是使用甲醇、乙醇或其混合溶剂。
通过TLC等确定起始材料全部消耗之后,全部反应完成。当反应完成时,如果需要的话,减压蒸馏溶剂,然后所期望的材料可通过例如过滤、柱色谱、重结晶等典型方法分离和纯化。
在另一个一般的方面,包含化学式1的N2O2配体的手性金属络合物由以下化学式2表示:
[化学式2]
其中
R1和R2彼此独立地为(C1-C10)烷基或(C6-C20)芳基,或R1和R2通过(C2-C6)亚烷基连接以形成脂环族环;
R3和R4彼此独立地为氢、(C1-C10)烷基、(C6-C20)芳基或卤素;
当M为Al3+或Sc3+时,n为-1,Y为H+、Li+、Na+、K+、Ag+、Cs+、NR4+、1/2Mg2+、1/2Ca2+、1/2Zn2+或1/3Al3+;以及
当M为Ti4+时,n为0,且Y不存在。
本发明的化学式2的手性金属络合物为由于结合化学式1的配体而在金属中心具有Δ或Λ结构的手性八面体络合物,并且可以立体选择性地控制金属中心的Δ或Λ手性。
本发明的化学式2的手性金属络合物可具有随Y的氧化数变化的化学式1的配体数,当Y的氧化数为+2时,化学式1的配体数为2,当Y的氧化数为+3时,化学式1的配体数为3。
具体地,在根据本发明的一个示例性实施方案的化学式2的手性金属络合物中,R1和R2可彼此独立地为甲基、乙基、丙基、丁基、戊基、己基、苯基、联苯基、萘基或蒽基,或R1和R2可通过(C3-C4)亚烷基连接以形成脂环族环;R3和R4可彼此独立地为氢、甲基、乙基、丙基、丁基、戊基、己基、苯基、联苯基、萘基、蒽基、氯、溴或氟;M可为Al3+、Sc3+或Ti4+;n可为0或-1;以及Y可以不存在,或可为H+或Na+。
更优选地,在根据本发明的一个示例性实施方案的化学式2的手性金属络合物中,R1和R2可彼此独立地为(C1-C10)烷基,苯基、联苯基、萘基或蒽基,或R1和R2可通过(C3-C4)亚烷基连接以形成脂环族环;R3和R4可彼此独立地为氢;M可为Al3+、Sc3+或Ti4+;n可为0或-1;以及Y可以不存在,或可为H+或Na+。
更具体地,根据本发明的一个示例性实施方案的化学式2的手性金属络合物可选自以下结构,但不限于此:
在本发明的一个示例性实施方案中,当化学式2的手性金属络合物的中心金属M为Al3+或Sc3+时,化学式1的配体、化学式3-1的金属盐以及化学式4的碱发生反应以产生化学式2-1的手性金属络合物,或化学式2-1的手性金属络合物经历酸处理以制备化学式2-2的手性金属络合物,如以下反应式2所示:
[反应式2]
其中
R1和R2彼此独立地为(C1-C10)烷基或(C6-C20)芳基,或R1和R2通过(C2-C6)亚烷基连接以形成脂环族环;
R3和R4彼此独立地为氢、(C1-C10)烷基、(C6-C20)芳基或卤素;
M为Al3+或Sc3+;
当p为整数1时,X为单价阴离子,例如卤素、乙酰丙酮酸根(acac)、氢氧根、烷氧根、三氟甲磺酸根、硝酸根、乙酸根或高氯酸根;
当p为整数2时,X为二价阴离子,例如硫酸根;
n为整数1;
Ya为Li+、Na+、K+、Ag+、Cs+、NR4+、1/2Mg2+、1/2Ca2+、1/2Zn2+或1/3Al3+;
Z为OH-或H-;以及
Yb为H+。
手性金属络合物(化学式2-1)通过使仲胺形式的配体(化学式1)与碱(化学式4)和金属盐(化学式3-1)反应制备。优选的是使用选自LiOH、NaOH、KOH、NMe4OH、NaH和KH的一种或更多种作为碱(化学式4)。碱(化学式4)的含量不受限制,但是相对于仲胺形式的配体(化学式1)使用4至6当量的碱。金属络合反应可在典型反应温度,优选20℃至80℃下进行。金属盐(化学式3-1)可选自AlF3、AlCl3、AlBr3、Al(acac)3、Al2(SO4)3、Al(OH)3、Al(OEt)3、Al(OiPr)3、ScF3、ScCl3、ScBr3、ScI3、Sc(OTf)3、Sc(NO3)3、Sc(OiPr)3、Sc(OAc)3、Sc(ClO4)3和Sc2(SO4)3。
手性金属络合物可在有机溶剂中制备,并且无需限制有机溶剂,只要其溶解反应物即可。考虑到反应物的溶解度和除去其的容易性,优选的是反应溶剂为选自以下的惰性溶剂:甲醇、乙醇、异丙醇、丁醇、丙酮、乙酸乙酯、乙腈、异丙醚、甲乙酮、二氯甲烷、二氯苯、氯苯、二氯乙烷、四氢呋喃、甲苯、苯、二甲苯、均三甲苯、二甲基甲酰胺,二甲亚砜等,更优选的是使用甲醇。
此外,通过使手性金属络合物(化学式2-1)经历酸处理制备其中Yb为H+的手性金属络合物(化学式2-2),并且可使用任何常用的酸。具体而言,可用的酸可例示为三氟乙酸(TFA)、对甲苯磺酸(p-TsOH)、苯磺酸(PhSO3H)、乙酸、磷酸(H3PO4)、氯化氢(HCl)、溴化氢(HBr)、硫酸(H2SO4)以及硝酸(HNO3),但不限于此。
由此产生的手性金属络合物可在不进行分离、纯化和另外的纯化过程的情况下用于接下来的反应,或者如果需要的话可经历纯化过程。
此外,在本发明的一个示例性实施方案中,当化学式2的手性金属络合物的中心金属M为Ti4+时,化学式1的配体与化学式3-2的钛盐发生反应以产生化学式2-3的手性金属络合物,如以下反应式3所示:
[反应式3]
其中
R1和R2彼此独立地为(C1-C10)烷基或(C6-C20)芳基,或R1和R2通过(C2-C6)亚烷基连接以形成脂环族环;
R3和R4彼此独立地为氢、(C1-C10)烷基、(C6-C20)芳基或卤素;以及
X为单价阴离子,例如卤素、乙酰丙酮酸根(acac)、氢氧根、烷氧根、三氟甲磺酸根、硝酸根、乙酸根或高氯酸根。
手性金属络合物(化学式2-3)通过使仲胺形式的配体(化学式1)与钛盐(化学式3-2)反应制备。金属络合反应可在典型的反应温度,优选20℃至80℃下进行。钛盐(化学式3-2)可选自TiCl4、TiBr4、Ti(OEt)4、Ti(OiPr)4以及Ti(OtBu)4。
手性金属络合物可在有机溶剂中制备,并且无需限制有机溶剂,只要其溶解反应物即可。考虑到反应物的溶解度和除去其的容易性,优选的是反应溶剂为选自以下的惰性溶剂:甲醇、乙醇、异丙醇、丁醇、丙酮、乙酸乙酯、乙腈、异丙醚、甲乙酮、二氯甲烷、二氯苯、氯苯、二氯乙烷、四氢呋喃、甲苯、苯、二甲苯、均三甲苯、二甲基甲酰胺、二甲亚砜等,更优选的是使用甲醇。
由此产生的手性金属络合物可在不进行分离、纯化和另外的纯化过程的情况下用于接下来的反应,或者如果需要的话可经历纯化过程。
在另一个一般的方面,化学式2的手性金属络合物的用途为用于通过光谱分析带电化合物的手性,更具体的说,将化学式2的手性金属络合物用作手性溶剂化剂以提供通过1H NMR光谱测量多种手性化合物的光学纯度的方法。
在本发明的一个示例性实施方案中,光谱为核磁共振(NMR)光谱,使用1H NMR测量手性分析物的光学纯度的方法具体如下。
将用于测量其光学纯度的分析物溶解在NMR溶剂中,并且置于NMR管中以测量NMR,其后,将分析物和本发明的手性金属络合物(化学式2)混合并溶解在如上所述的相同NMR溶剂中,并且置于NMR管中以测量NMR。当添加本发明的手性金属络合物时,出现非对映体的非平衡,两种异构体的峰位移值示出差异,对经区分的两个峰进行积分,从而测量分析物的光学纯度。
用于测量其光学纯度的分析物为带电化合物,例如多种胺衍生物、羧酸衍生物、氰醇衍生物以及带电金属络合物,甚至包括商品外消旋药物,其由于高极性和在有机溶剂中的低溶解度而难以进行色谱分析。
作为能够溶解分析物和手性金属络合物的有机溶剂的NMR溶剂可用于NMR分析,并且包括由氘取代的极性或非极性有机溶剂。极性溶剂可例示为CD3CN、CD3OD、(CD3)2CO、(CD3)2SO或D2O,非极性溶剂可例示为CDCl3,C6D6或CD2Cl2。
已证实随着本发明的手性金属络合物(化学式2)的添加量增加,分析物的峰分离距离变得更宽,相对于分析物添加0.1当量或更多,优选0.5至10当量的本发明的手性金属络合物(化学式2),但即使在相对于分析物以少量添加的情况下,NMR峰也充分地分离。
常规地仅使用非极性溶剂,使得分析物的范围极其受限,然而,在本发明中,可使用极性溶剂以及非极性溶剂,因此,甚至可以使用具有高极性且先前不能用作分析物的分析物。
其他特征和方面将由以下详细说明、附图和权利要求而明显。
附图说明
图1是实施例9和比较例1至6的1H NMR谱图
图2是实施例10和比较例7至12的1H NMR谱图
图3是实施例11和比较例13至18的1H NMR谱图
图4是实施例12的1H NMR谱图
图5是实施例13的1H NMR谱图
图6是实施例14的1H NMR谱图
具体实施方式
本发明的优势、特征和方面将由以下参照附图(在其后公布)对实施方案的说明而变得明显。然而,本发明可以不同形式实施,并且不应理解为受限于本文提出的实施方案。更准确地说,提供这些实施方案以使得本公开全面和完整,并且向本领域技术人员充分传达本发明的范围。本文所使用的术语仅用于描述具体实施方案的目的,而无意限制示例性实施方案。如本文中所使用的,无数量词的单数形式旨在也包括复数形式,除非上下文明确地另有指示。还应当理解,本说明书所使用的术语“包含”和/或“包括”说明了所述特征、整数、步骤、操作、要素、和/或组分的存在;但不排除存在或添加一个或更多个其他特征、整数、步骤、操作、要素、组分、和/或其组。
下文将参照附图详细说明示例性实施方案。
使用市售化合物而不进行另外的纯化或干燥。1H NMR(400MHz)和13C NMR(100MHz)光谱使用Bruker Ascend 400光谱仪获得。HRMS(高分辨质谱)使用Bruker Daltonik microTOF-QII光谱仪获得。
[实施例1]配体1a的制备
化合物S1的制备
将(R,R)-1,2-环己二胺(1.14g,10.0mmol)与MeOH(20.0mL)混合,然后在搅拌的同时向其中加入2,2′-二羟基二苯甲酮(5.14g,24.0mmol),并且在50℃下继续搅拌6小时。将反应混合物过滤,分离的固体用乙醚洗涤,然后在真空中干燥,从而得到为黄色固体的标题化合物S1(4.41g,87%)。
1H NMR(400MHz,DMSO-d6)δ15.55–15.27(br,2H),9.81(br,2H),7.39–7.32(m,2H),7.26–7.20(m,2H),7.12–6.81(m,8H),6.73–6.61(m,4H),3.56–3.45(m,2H),1.88–1.69(m,2H),1.58(br,2H),1.32(br,2H),1.09(br,2H);13C NMR(100MHz,DMSO-d6)δ171.5,162.1,154.0,132.1,130.7,130.5,128.5,120.4,119.5,119.2,117.5,117.2,115.8,64.9,30.9,23.5;HRMS(EI)m/z计算C32H30N2O4[H]+:507.2278,测得:507.2314.
化合物1a的制备
将化合物S1(2.53g,5.00mmol)与MeOH(25.0mL)混合,然后在搅拌的同时在0℃下分批加入NaBH4(6当量,1.13g,30.0mmol),在25℃下继续搅拌2小时。在真空中移除全部挥发性残留物,然后将反应混合物溶解在EtOAc中,并用盐水洗涤。有机层用MgSO4干燥、过滤并浓缩。通过再浆化(CHCl3,10.0mL)来纯化得到作为白色固体的标题化合物1a(1.66g,65%)。
1H NMR(400MHz,DMSO-d6)δ8.29(br,6H),7.10–7.02(m,6H),6.80–6.78(m,4H),6.75-6.70(m,4H),6.65(td,J=7.5,1.1Hz,2H),5.36(s,2H),2.45(br,2H),2.02(br,2H),1.56(br,2H),1.16(br,4H);13C NMR(100MHz,DMSO-d6)δ156.6,155.8,128.6,128.2,128.0,127.9,127.7,126.7,118.9,118.5,115.7,115.5,57.0,55.5,28.5,22.9;HRMS(EI)m/z计算C32H34N2O4[H]+:511.2591,测得:511.2607。
[实施例2]配体1b的制备
化合物S2的制备
将(R,R)-1,2-二苯乙烯二胺(2.12g,10.0mmol)与MeOH(20.0mL)混合,然后在搅拌的同时向其中加入2,2′-二羟基二苯甲酮(5.14g,24.0mL),在50℃下继续搅拌12小时。将反应混合物过滤,分离的固体用乙醚洗涤,然后在真空中干燥,从而得到作为黄色固体的标题化合物S2(5.51g,91%)。
1H NMR(400MHz,DMSO-d6)δ15.39-15.32(br,2H),9.40(br,2H),7.31-7.22(m,4H),7.18-6.80(m,14H),6.74-6.50(m,6H),6.21-6.08(m,2H),4.95-4.84(m,2H);13C NMR(100MHz,DMSO-d6)δ172.8,161.9,154.0,139.8,132.4,131.1 130.5,128.0,127.7,127.0,119.8,119.5,118.6,117.7,117.5,117.2,115.3,71.8;HRMS(EI)m/z计算C40H32N2O4[H]+:605.2435,测得:605.2476.
化合物1b的制备
将化合物S2(3.02g,5mmol)与MeOH(25.0mL)混合,然后在搅拌的同时在0℃下分批加入NaBH4(6当量,1.13g,30.0mmol),在25℃下继续搅拌2小时。在真空中除去全部挥发性残留物,然后将反应混合物溶解在EtOAc中,并用盐水洗涤。有机层用MgSO4干燥、过滤并浓缩。通过再浆化(CHCl3。10.0mL)来纯化得到作为白色固体的标题化合物1b(2.47g,81%)。
1H NMR(400MHz,DMSO-d6)δ10.07(br,4H),7.16-7.08(m,8H),7.01-6.92(m,8H),6.77(dd,J=8.1,1.0Hz,2H),6.75-6.71(m,4H),6.69(dd,J=8.0,1.1Hz,2H),6.60(td,J=7.5,1.2Hz,2H),4.94(s,2H),3.79(s,2H);13C NMR(100MHz,DMSO-d6)δ155.9,155.8,139.6,128.9,128.2,128.1,128.0,128.0,128.0,127.8,127.7,127.0,125.8,118.9,118.4,115.6,115.5,65.2,55.5;HRMS(EI)m/z计算C40H36N2O4[H]+:609.2748,测得:605.2473.
[实施例3]金属络合物Na[Al-1a]的制备
将化合物1a(511mg,1.00mmol)与MeOH(20.0mL)混合以制备化合物1a的溶液。将NaOH(160mg,4.00mmol)与MeOH(40.0mL)混合以制备NaOH溶液。将NaOH溶液与AlCl3·6H2O(241mg,1.00mmol)加入化合物1a的溶液中,在25℃下搅拌2小时。将反应混合物减压浓缩,溶解在EtOAc中,并用盐水洗涤。有机层用Na2SO4干燥、过滤并减压浓缩以得到作为灰白色固体的标题化合物Na[Al-1a](559mg,99%)。
1H NMR(400MHz,DMSO-d6)δ7.08(dd,J=7.5,1.7Hz,2H),6.95-6.86(m,4H),6.78(ddd,J=8.1,7.1,1.9Hz,2H),6.62(dd,J=8.1,1.3Hz,2H),6.38(td,J=7.3,1.3Hz,2H),6.31(dd,J=8.2,1.2Hz,2H),6.26(td,J=7.2,1.3Hz,2H),4.87(s,2H),3.77(d,J=10.2Hz,2H),2.48-2.41(m,2H),2.23(d,J=12.7Hz,2H),1.65(d,J=9.8Hz,2H),1.27(d,J=11.5Hz,2H),1.01-0.90(m,2H);13C NMR(100MHz,DMSO-d6)δ162.3,161.8,130.4,129.2,128.5,127.8,127.3,124.9,120.1,120.1,113.4,113.0,63.3,55.8,27.3,24.1;HRMS(EI)m/z计算C32H30AlN2NaO4[H]+:557.1991,测得:557.2035.
[实施例4]金属络合物H[Al-1a]的制备
将Na[Al-1a](278mg,0.500mmol)与MeOH(5.00mmol)混合,然后向其中加入TFA(38.3uL,0.500mmol),并在25℃下搅拌2小时。将反应混合物干燥,用冷MeOH洗涤,然后真空中干燥以得到作为灰白色固体的标题化合物H[Al-1a](235mg,88%)。
1H NMR(400MHz,DMSO-d6)δ7.18-7.14(m,4H),6.99-6.93(m,4H),6.64(d,J=8.0Hz,2H),6.59-6.54(m,4H),6.48(t,J=7.2Hz,2H),5.07(s,2H),4.61(br,2H),2.45-2.36(m,2H),2.21(d,J=13Hz,2H),1.63(d,J=9.4Hz,2H),1.29(d,J=7.8Hz,2H)0.96-0.85(m,2H);13C NMR(100MHz,DMSO-d6)δ160.9,157.0,130.0,129.4,129.3,128.7,128.3,125.9,120.2,119.9,117.5,115.3,62.9,56.6,27.2,24.4;HRMS(EI)m/z计算C32H31AlN2O4[Na]+:557.1991,测得:557.1990。
[实施例5]金属络合物Na[Al-1b]的制备
将化合物1b(609mg,1.00mmol)与MeOH(20.0mL)混合以制备化合物1b的溶液。将NaOH(160mg,4.00mmol)与MeOH(40.0mL)混合以制备NaOH溶液。将NaOH溶液与AlCl3·6H2O(241mg,1.00mmol)加入化合物1b的溶液中,并在25℃下搅拌2小时。将反应混合物减压浓缩,溶解在EtOAc中,并用盐水洗涤。有机层用Na2SO4干燥、过滤并减压浓缩以得到作为灰白色固体的标题化合物Na[Al-1b](648mg,99%)。
1H NMR(400MHz,DMSO-d6)δ7.21-7.14(m,6H),6.94-6.89(m,4H),6.86-6.84(m,4H),6.76-6.73(m,4H),6.65(dd,J=8.2,1.4Hz,2H)6.49(dd,J=8.2,1.2Hz,2H)6.34(ddd,15.1,7.6,1.1Hz,2H)6.29(td,J=7.3 1.2Hz,2H),4.31(s,2H),4.14-4.07(m,2H),3.88-3.83(m,2H);13C NMR(100MHz,DMSO-d6)δ162.1,161.6,136.3,129.3,129.1,128.7,128.3,128.2,128.1,127.9,127.6,124.2,120.3,120.2,113.7,113.6,64.7,62.4;HRMS(EI)m/z计算C40H32AlN2NaO4[H]+:655.2148,测得:655.2167.
[实施例6]金属络合物H[Al-1b]的制备
将Na[Al-1b](327mg,0.500mmol)与DCM(5.00mmol)混合,然后向其中加入TFA(38.3μL,0.500mmol),并在25℃下搅拌2小时。将反应混合物过滤、用冷MeOH洗涤、然后在真空中干燥以得到作为灰白色固体的标题化合物H[Al-1b](312mg,99%)。
1H NMR(400MHz,CD3CN)δ7.24-7.11(m,6H),6.99-6.70(m,16H),6.99-6.97(m,6H)6.85-6.78(m,6H),6.74-6.70(m,2H),6.48-6.45(m,2H),4.63(br,2H),4.60(d,J=1.8Hz,2H),4.32-4.25(m,2H);13C NMR(100MHz,CD3CN)δ135.6,130.6,130.0,129.9,129.8,129.8,129.4,129.3,128.7,125.0,121.6,120.4,65.3,64.1;HRMS(EI)m/z计算C40H33AlN2O4[Na]+:655.2148,测得:655.2180.
[实施例7]金属络合物Na[Sc-1a]的制备
将化合物1a(511mg,1.00mmol)与MeOH(20.0mL)混合以制备化合物1a的溶液。将NaOH(160mg,4.00mmol)与MeOH(40.0mL)混合以制备NaOH溶液。将NaOH溶液与Sc(OTf)3(492mg,1.00mmol)加入化合物1a的溶液中,并在25℃下搅拌2小时。将反应混合物减压浓缩,溶解在EtOAc中,并用盐水洗涤。有机层用Na2SO4干燥、过滤并减压浓缩以得到作为灰白色固体的标题化合物Na[Sc-1a](568mg,99%)。
1H NMR(400MHz,DMSO-d6)δ7.11(d,J=6.2Hz,2H),6.91(d,J=7.4Hz,2H),6.86(t,J=7.5Hz,2H),6.75(t,J=7.5Hz,2H),6.32(t,J=7.3Hz,2H),6.28(d,J=8.1Hz,2H),6.23-6.19(m,4H),4.91(s,2H),3.44(d,J=9.4Hz,2H),2.53-2.57(m,2H),2.33(d,J=10.9Hz,2H),1.63(d,J=7.7Hz,2H),1.25-1.15(m,2H),0.99-0.88(m,2H)。
[实施例8]金属络合物[Ti-1a]的制备
将化合物1a(511mg,1.00mmol)与甲醇(10.0mL)混合以制备化合物1a的溶液。将Ti(OiPr)4(0.296mL,1.00mmol)加入化合物1a的溶液中,并在25℃下搅拌2小时。将反应混合物过滤,然后用甲醇洗涤。干燥固体化合物以得到作为黄色固体的标题化合物[Ti-1a](477mg,86%)。
1H NMR(400MHz,DMSO-d6)δ7.46(dd,J=7.6,1.7Hz,2H),7.22(dd,J=7.7,1.8Hz,2H),7.10(ddd,J=8.0,7.3,1.7Hz,2H),6.97(ddd,J=8.1,7.2,1.8Hz,2H),6.76(td,J=7.4,1.2Hz,2H),6.58(td,J=7.4,1.2Hz,2H),6.52(dd,J=8.0,1.2Hz,2H),6.33(dd,J=8.1,1.2Hz,2H),6.07(d,J=8.2Hz,2H),5.36-5.28(m,2H),2.69-2.79(m,2H),2.32-2.28(m,2H),1.65-1.67(m,2H),1.48-1.40(m,2H),0.95-0.84(m,2H)。
[实施例9和比较例1至6]使用手性溶剂化剂通过1H NMR测量外消旋-1-苯乙胺的光学纯度
如下表1所示,将多种手性溶剂化剂与外消旋-1-苯乙胺在25℃下溶解在NMR溶剂中,然后进行1H NMR光谱测量,从而确定两种对映异构体是否区分,结果在图1中示出。图1中的(a)为CD3OD中的外消旋-1-苯乙胺的甲基的1H NMR。
[表1]
已证实,与现有溶剂化剂(比较例1到6)相比,两种对映异构体仅在使用本发明的手性溶剂化剂(实施例9)的情况下分离。
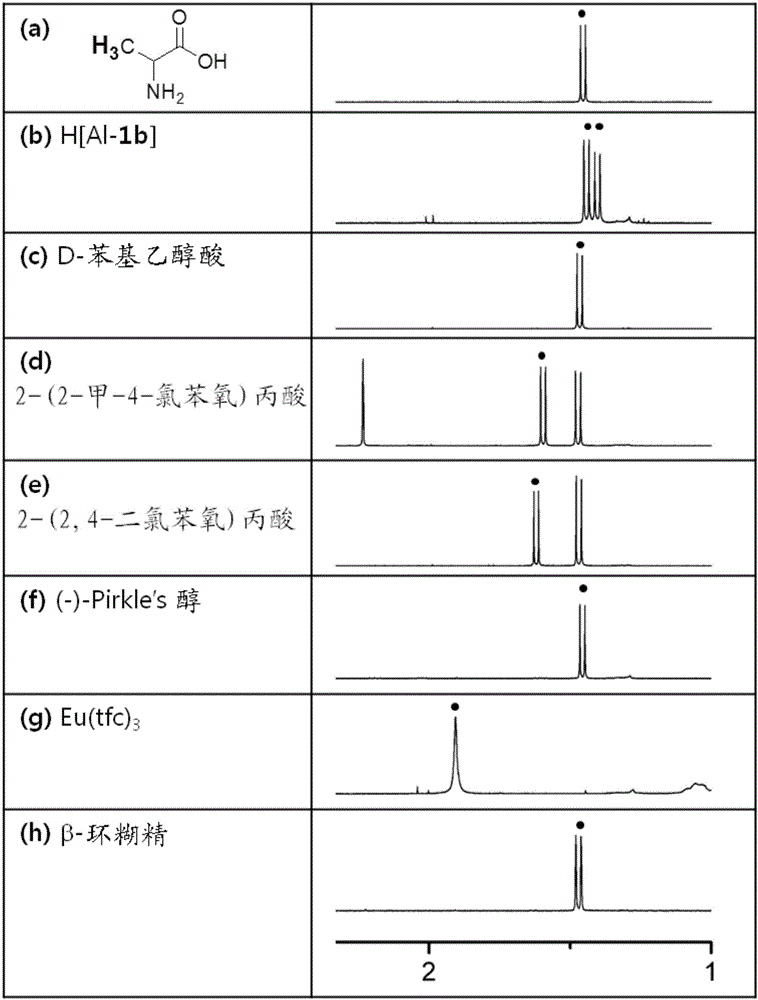
[实施例10和比较例7至14]使用手性溶剂化剂通过1H NMR测量DL-丙氨酸的光学纯度
如下表2所示,将多种手性溶剂化剂与DL-丙氨酸在25℃下溶解在NMR溶剂中,然后进行1H NMR光谱测量,从而确定两种对映异构体是否区分,结果在图2中示出。图2中的(a)为CD3OD中的DL-丙氨酸的甲基的1H NMR。
[表2]
已证实,与现有溶剂化剂(比较例7至12)相比,两种对映异构体仅在使用本发明的手性溶剂化剂(实施例10)的情况下分离。
[实施例11和比较例13至18]使用手性溶剂化剂通过1H NMR测量外消旋-2-甲基丁胺的光学纯度
如下表3所示,将多种手性溶剂化剂与外消旋-2-甲基丁胺在25℃下溶解在NMR溶剂中,然后进行1H NMR光谱测量,从而确定两种异构体是否区分,结果在图3中示出。图3中的(a)为外消旋-2-甲基丁胺的甲基的1H NMR。
[表3]
已证实,与现有溶剂化剂(比较例13至18)相比,两种对映异构体仅在使用本发明的手性溶剂化剂(实施例11)的情况下分离。
根据所述实施例和比较例,与使用本领域常规已知的手性溶剂化剂不同,当使用本发明的金属络合物H[Al-1b]作为手性溶剂化剂时,在例如CD3OD或CD3CN的极性质子溶剂中观察到峰分离。
[实施例12]使用本发明的金属络合物H[Al-1b]作为手性溶剂化剂通过1H NMR测量胺或带正电化合物的光学纯度
为了确定本发明的金属络合物的手性溶剂化程度,将本发明的金属络合物H[Al-1b]与手性分析物的1:1混合物在25℃下溶解在NMR溶剂中至20mM,然后进行1H NMR光谱测量。结果在图4中示出。
使用胺化合物或带正电化合物作为手性分析物,使用以下作为胺化合物:外消旋-1-苯乙胺(a)、外消旋-3,3-二甲基丁-2-胺(b)、外消旋-1-(1-萘基)乙胺(c)、外消旋-2,3-二氢-1H-茚-1-胺(d)、外消旋-2-甲基丁胺(e)、外消旋-2-苯基-1-丙胺(f)、外消旋-2-甲基丁-1-胺(g)、3-(2-甲氧基苯基)-3-甲基戊-1-胺(h)、外消旋-2-甲基哌啶(i)、3-甲基哌啶(j)、外消旋-环己烷-1,2-二胺(k)、外消旋-N,N-二甲基-1-苯乙胺(l)、DL-丙氨酸(m)、DL-苯丙氨酸(n)、DL-缬氨醇(o)、DL-氨基丙醇(p)以及N-甲基-1-(2-(甲氨基)萘-1-基)萘-2-胺(q),使用[Fe(dmbp)3]+2(dmbp=4,4′-二甲基-2,2′-联吡啶)作为带正电化合物,使用CD3OD(a至d、i至n)、CD3CN(e至h、o至q)或CDCl3(r)作为NMR溶剂。
[实施例13]使用本发明的金属络合物Na[Al-1b]作为手性溶剂化剂通过1H NMR测量羧酸化合物的光学纯度
为了确定本发明的金属络合物的手性溶剂化程度,将本发明的金属络合物Na[Al-1b]与作为手性分析物的羧酸化合物的1:1混合物在25℃下溶解在NMR溶剂中至20mM,然后进行1H NMR光谱测量。结果在图5中示出。
使用以下作为羧酸化合物:外消旋-2-苯基丙酸(a)、外消旋-2-甲氧基-2-苯基乙酸(b)、外消旋-2-溴丙酸(c)、外消旋-2-溴-3-甲基丁酸(d)、外消旋-2-甲基丁酸(e)、外消旋-3-苯基丁酸(f)、外消旋-苯基乙醇酸(g)、外消旋-3-氯苯基-2-羟基乙酸(h)、外消旋-2-(甲基亚磺酰基)苯甲酸(i)以及外消旋-2-羟基-2-苯乙腈(j),使用CDCl3(a至f)、CD3CN(g、h、j)或CD3OD(i)作为NMR溶剂。
[实施例14]使用本发明的金属络合物M[Al-1b](M=H+或Na+)作为手性溶剂化剂通过1H NMR测量商品药物的光学纯度
为了确定本发明的金属络合物的手性溶剂化程度,将本发明的金属络合物M[Al-1b](M=H+或Na+)与作为手性分析物的商品药物的1:1混合物在25℃下溶解在NMR溶剂中至20mM,然后进行1H NMR光谱测量。结果在图6中示出。
商品药物由于其高极性和在有机溶剂中的低溶解度而难以进行色谱分析,使用商品外消旋药物作为手性分析物,它们的结构如下:
对于商品药物a至d,使用H[Al-1b]作为手性溶剂化剂;对于商品药物e至i,使用Na[Al-1b]作为手性溶剂化剂。此外,使用CD3CN(a至c、h)、CDCl3(e、f)、C6D6(d、i)或CD3OD(g)作为NMR溶剂。
从上述实施例中看出,在使用本发明的金属络合物作为手性溶剂化剂的情况下,可通过1H NMR分析多种手性化合物的手性,例如多种胺衍生物、羧酸衍生物、氰醇衍生物、带电金属络合物以及商品外消旋药物。
本发明的手性金属络合物为由于结合化学式1的配体而在金属中心具有Δ或Λ结构的手性八面体配合物,并且可以立体选择性地控制金属中心的Δ或Λ手性。
此外,本发明的手性金属络合物可在所有带有手性电荷的化合物的光学纯度的测量中用作高效而实用的手性溶剂化剂,所述化合物被认为难以进行色谱分析,例如由于高极性和在有机溶剂中的低溶解度而难以进行色谱分析的商品外消旋药物。常规地仅使用非极性溶剂,使得分析物的范围极其受限,然而在本发明中,使用手性金属络合物作为手性溶剂化剂,从而允许使用极性溶剂以及非极性溶剂,因此,甚至可以使用具有高极性且先前不能用作分析物的分析物。
此外,本发明的手性金属络合物可以仅以亚化学计量的量示出足以在用于测量1H NMR的极性溶剂中测量光学纯度的峰分离,并且将分析物的立体中心从带电官能团延伸到δ位。
因此,本发明的手性金属络合物可用作广泛使用的用于带电手性化合物的手性溶剂化剂。
- 还没有人留言评论。精彩留言会获得点赞!
- 金属络合物及使用了其的发光元件的制作方法与工艺
- 一种金属杂化POSS络合物及其制备方法和应用与流程
- 新的手性金属络合物及其用于通过1H NMR光谱分析带电化合物的手性的用途的制作方法与工艺
- 新的手性金属络合物及其用于通过1H NMR光谱分析带电化合物的手性的用途的制作方法与工艺
- 金属络合物催化剂和采用金属络合物催化剂的聚合方法与流程
- 金属络合物的合成及其用途的制作方法与工艺
- 是SOD模拟物的金属络合物作为食品试剂和作为化妆品的应用的制作方法与工艺
- 还原球团中金属铁含量的测定方法与流程
- 具有三脚架配位体的过渡金属络合物和其在OLED中的用途的制作方法与工艺
- 在金(I)络合物存在的情况下基于炔烃与二甲基呋喃的分子间反应形成色满的制造方法与工艺
- 一种金属杂化POSS络合物及其制备方法和应用与流程
- 新的手性金属络合物及其用于通过1H NMR光谱分析带电化合物的手性的用途的制作方法与工艺
- 新的手性金属络合物及其用于通过1H NMR光谱分析带电化合物的手性的用途的制作方法与工艺
- 金属络合物催化剂和采用金属络合物催化剂的聚合方法与流程
- 金属络合物的合成及其用途的制作方法与工艺
- 是SOD模拟物的金属络合物作为食品试剂和作为化妆品的应用的制作方法与工艺
- 具有三脚架配位体的过渡金属络合物和其在OLED中的用途的制作方法与工艺
- 在金(I)络合物存在的情况下基于炔烃与二甲基呋喃的分子间反应形成色满的制造方法与工艺
- 金属络合物制剂的制造方法与工艺
- 金属络合物和使用该金属络合物的发光元件的制造方法与工艺