一类维甲酸N‑羟基酰胺类衍生物及其制备和应用的制作方法
本发明涉及一类维甲酸的n-羟基酰胺类衍生物及其制备方法,以及作为肿瘤治疗药物及生化试剂的应用。
背景技术:
维甲酸共有3种常见的顺反异构体:全反式维甲酸、9-顺式维甲酸及13-顺式维甲酸。其中,全反式维甲酸用于急性早幼粒细胞白血病的分化治疗已经有20余年临床应用历史,取得了很好的效果。相对于传统化疗,分化治疗有着更低的副作用以及更可靠的疗效。但是,除m3型急性早幼粒细胞白血病细胞外,其他恶性肿瘤对维甲酸的敏感性很低(ic50通常大于100μm),使得维甲酸分化治疗方案十分局限。国内外很多学者尝试通过对维甲酸进行结构修饰,以增强其细胞毒性或改变其作用靶点,进而突破维甲酸抗肿瘤治疗的局限性。然而目前这些维甲酸衍生物仍存在一些不足之处:一方面,它们对肿瘤细胞的ic50值(多数衍生物在20-50μm之间)还有较大幅度的提升空间,因为绝大多数已上市抗肿瘤药对敏感肿瘤细胞的ic50均低于10μm;另一方面,它们对正常细胞的毒性研究相对缺乏,难以判断它们的药用潜力与价值。因此,突破维甲酸抗肿瘤治疗局限性的重要环节之一,就是从众多维甲酸的衍生物或类似物中,通过研究它们对肿瘤及正常细胞的毒性,寻找出高活性、高选择性的分子。
技术实现要素:
本发明涉及的维甲酸n-羟基酰胺类衍生物对脑胶质瘤u87细胞的ic50仅3.26μm,显著提升了维甲酸衍生物对实体瘤治疗效果;同时,这种衍生物对正常成纤维细胞l929的ic50为25.7μm,表现出很好的肿瘤靶向性,有望开发成新型抗肿瘤药物或作为先导化合物用于维甲酸类抗肿瘤药物的研发。
本发明是通过以下技术方案来实现:
1.维甲酸的n-羟基酰胺类衍生物,是具有下列结构1-3化合物中的
一种或二种以上以任意比例组成的混合物:
结构1:全反式n-羟基维甲酰胺
结构2:13-顺式-n-羟基维甲酰胺
结构3:9-顺式-n-羟基维甲酰胺
2.如技术方案1所述化合物,其制备方法由以下步骤组成:
(1)将维甲酸异构体溶于溶剂,其浓度范围为0.01m至1m,随后加入相对于维甲酸1-5倍摩尔当量的羧基活化剂及相对于维甲酸0-10倍摩尔当量的催化剂并混合均匀,反应时间为10min–48h,反应温度为0℃至80℃,制得维甲酸的活性酯或酰胺;
(2)将相对于维甲酸1-20倍摩尔当量的盐酸羟胺溶于醇或水中的一种或两种,加入相对于维甲酸0.05-1倍当量碱的醇或水溶液中的一种或两种,滤去沉淀;
(3)将步骤(1)所制得的溶液与步骤(2)所制得的溶液混合,继续反应0.5–48h,反应温度为0℃至50℃;
(4)以大孔树脂为固定相,醇-水混合物为流动相,对步骤(3)制得的产物进行纯化,得到相应的n-羟基维甲酰胺衍生物。
3.如技术方案2所述制备方法,其特征在于:维甲酸异构体是指全反式维甲酸、9-顺式维甲酸、13-顺式维甲酸中的一种或二种以上的任意比例组成的混合物;
步骤(1)所述羧基活化剂是环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)、羰基二咪唑(cdi)、对甲苯磺酰氯中的一种或二种以上的任意比例组成的混合物;
步骤(1)所述催化剂是吡啶、三乙胺、对二甲胺基吡啶、n-乙基二异丙胺(dipea)、n-羟基琥珀酰亚胺(nhs)、1-羟基苯并三氮唑中(btoh)中的一种或二种以上的任意比例组成的混合物;
4.如技术方案2所述制备方法,其特征在于:步骤(1)所述的溶剂是乙醚、乙腈、丙酮、四氢呋喃、乙酸乙酯、二氯甲烷、氯仿中的一种或二种以上的任意比例组成的混合物;
步骤(2)所述的醇是甲醇、乙醇中的一种或二种的任意比例组成的混合物。
5.如技术方案2所述制备方法,其特征在于:步骤(2)所述的碱是指甲醇钠、乙醇钠、氢氧化钠、氢氧化钾中的一种或二种以上的任意比例组成的混合物。
6.如技术方案2所述制备方法,其特征在于:步骤(4)所述的大孔树脂是d-101、d-101-i、ab-8、dm130、hpd100、da-201、dm-301、x-5、s-8、nka-ii、nka、nka-9、d3520、d4020、d4006、h103、d1400、ads-7、ads-17、d941、d1300、hp20中的一种或二种以上的任意比例组成的混合物。
7.如技术方案2所述制备方法,其特征在于:步骤(4)所述的醇-水混合物是乙醇体积分数为0%-95%的水溶液或甲醇体积分数为0%-95%的水溶液。
8.一种技术方案1中所述化合物的应用,所述化合物能使细胞发生明显的周期抑制而停止生长,其使用浓度范围为1.0μm–100μm,作用时间为4h至72h;
或,所述化合物能使细胞形态发生改变,最终凋亡,其使用浓度范围为3.0μm–500μm,作用时间为12h至72h。
9.一种技术方案1中所述化合物的应用,所述化合物能使干细胞发生分化,产生明显的形态学及功能性改变,其使用浓度范围为0.05μm–50μm,作用时间为12h至120h。
10.一种技术方案1中所述化合物的应用,所述化合物作为活性成分用于制备肿瘤治疗的药物,其能够促使肿瘤细胞发生周期阻滞、分化及凋亡,抑制肿瘤细胞生长并杀伤肿瘤细胞,起到延长生存期的作用;此化合物的治疗剂量为1.5mg/kg体重至60mg/kg体重,给药次数总为1-20次。
本方案采用的合成原料易得,步骤简便,反应条件温和,重复性好,有利于制备规模的放大。同时,本发明涉及的维甲酸n-羟基酰胺类衍生物对肿瘤细胞的抗增殖活性高,而对正常细胞影响小,有望开发成新型抗肿瘤药物或作为先导化合物用于维甲酸类抗肿瘤药物的研发。
附图说明
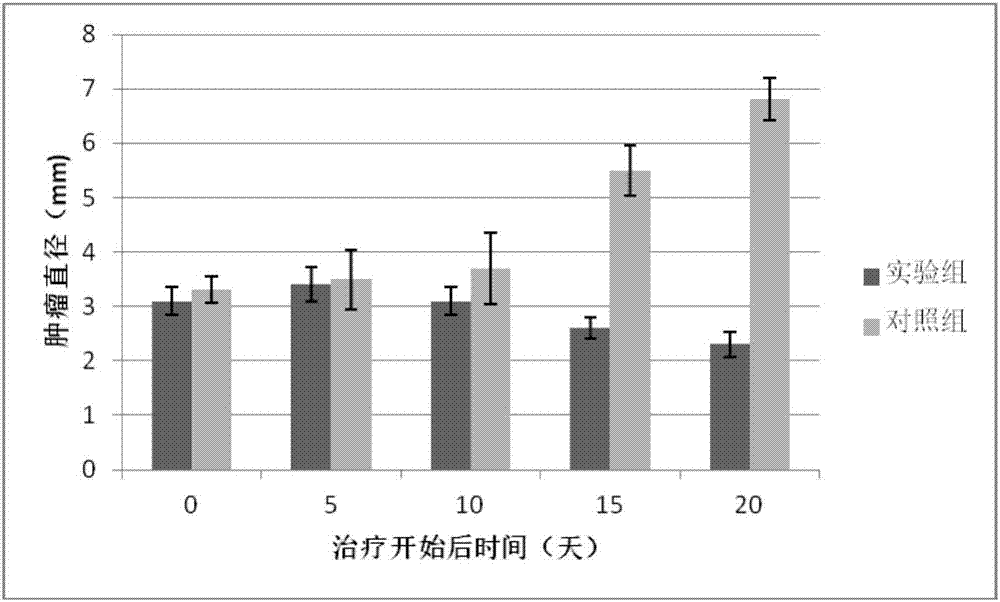
图1n-羟基全反式维甲酰胺对原位脑胶质瘤瘤体直径的影响。
图2n-羟基-13-顺式维甲酰胺对原位脑胶质瘤瘤体直径的影响。
具体实施方式
实施例1
将300mg全反式维甲酸溶于1ml无水四氢呋喃,加入247mgdcc、230mgnhs、24.4mgdmap及20μldipea,室温反应12h,滤去不溶物,得维甲酸nhs酯溶液。另将695mg盐酸羟胺溶于10ml甲醇,加入8ml1m新制的乙醇钠乙醇溶液,滤去氯化钠沉淀,得羟胺醇溶液。将上述维甲酸nhs酯溶液与羟胺醇溶液混合,室温下反应12h,得n-羟基全反式维甲酰胺粗品溶液。
将n-羟基全反式维甲酰胺粗品溶液与水按照13:7体积比混合,转移至以65%乙醇平衡的d101大孔树脂柱中,以65%乙醇洗脱至流出物基本无紫外吸收,随后以85%乙醇洗脱,收集流出物,旋转蒸发浓缩,冷冻干燥,得n-羟基全反式维甲酰胺纯品。产物经高分辨质谱检测,其负离子准分子离子峰为314.21255,符合目标产物特征。
实施例2
将30mg9-顺式维甲酸溶于10ml无水二氯甲烷,加入60mgdic、12.2mgdmap及50μldipea,室温反应12h,得维甲酸nhs酯溶液。另将14mg盐酸羟胺溶于8ml甲醇,加入2ml0.1m新制的乙醇钠乙醇溶液,滤去氯化钠沉淀,得羟胺醇溶液。将上述维甲酸nhs酯溶液与羟胺醇溶液混合,在冰水混合物中反应48h,得n-羟基-9-顺式维甲酰胺粗品溶液。
将n-羟基全反式维甲酰胺粗品溶液蒸干,加入60%乙醇5ml溶解,转移至以60%乙醇平衡的dm-301大孔树脂柱中,以60%乙醇洗脱至流出物基本无紫外吸收,随后以80%乙醇洗脱,收集流出物,旋转蒸发浓缩,冷冻干燥,得n-羟基-9-顺式维甲酰胺纯品。产物经高分辨质谱检测,其负离子准分子离子峰为314.21255,符合目标产物特征。
实施例3
将150mg13-顺式维甲酸溶于1ml无水乙腈,加入90mgcdi,80℃反应1h,得维甲酸活性酰胺溶液。另将690mg盐酸羟胺溶于8ml甲醇,加入0.5ml1m新制的乙醇钠乙醇溶液,滤去氯化钠沉淀,得羟胺醇溶液。将上述维甲酸活性酰胺溶液与羟胺醇溶液混合,在50℃反应0.5h,得n-羟基-13-顺式维甲酰胺粗品溶液。
将n-羟基-13-顺式维甲酰胺粗品溶液蒸干,加入60%乙醇5ml溶解,转移至以60%乙醇平衡的h-103大孔树脂柱中,以60%乙醇洗脱至流出物基本无紫外吸收,随后以85%乙醇洗脱,收集流出物,旋转蒸发浓缩,冷冻干燥,得n-羟基-13-顺式维甲酰胺纯品。
实施例4
将300mg9-顺式维甲酸溶于2ml无水丙酮,加入250mgdcc、230mgnhs、12.2mgdmap及30μldipea,55℃反应10min,得维甲酸nhs酯溶液。另将70mg盐酸羟胺溶于4ml甲醇,加入1ml1m新制的乙醇钠乙醇溶液,滤去氯化钠沉淀,得羟胺醇溶液。将上述维甲酸nhs酯溶液与羟胺醇溶液混合,在冰水混合物中反应48h,得n-羟基全反式维甲酰胺粗品溶液。
将n-羟基全反式维甲酰胺粗品溶液蒸干,加入55%乙醇5ml溶解,转移至以55%乙醇平衡的d1300大孔树脂柱中,以55%乙醇洗脱至流出物基本无紫外吸收,随后以80%乙醇洗脱,收集流出物,旋转蒸发浓缩,冷冻干燥,得n-羟基-9-顺式维甲酰胺纯品。
实施例5
将u87mg细胞以6000个/孔的密度接种于96孔板,37℃孵育贴壁24h后,将原培养基替换成分别含有0、0.2、0.4、0.8、1.6、3.2、6.3、12.5、25、50、100μmn-羟基全反式维甲酰胺或全反式维甲酸的dmem培养基继续孵育48h,每组设4个复孔。孵育完成后,吸去含药培养基,再以pbs洗2次,每次每孔200μl,随后每孔加入含0.05%mtt的无血清dmem培养基100μl,在37℃孵育4h。最后,吸去上述含mtt的培养基,加100μldmso溶解生成的色素,以酶标仪测定各孔吸光度,并以spss软件中提供的probit概率法计算ic50值,n-羟基全反式维甲酰胺为3.26μm,而全反式维甲酸为87.5μm。n-羟基全反式维甲酰胺对肿瘤细胞具有明显的杀伤效果。
实施例6
将l929细胞以6000个/孔的密度接种于96孔板,孵育贴壁24h后,将原培养基替换成分别含有0、0.2、0.4、0.8、1.6、3.2、6.3、12.5、25、50、100μmn-羟基全反式维甲酰胺或全反式维甲酸的rmpi-1640培养基继续孵育48h,每组设4个复孔。以mtt法检测细胞增殖率并计算ic50值。孵育完成后,吸去含药培养基,再以pbs洗2次,每次每孔200μl,随后每孔加入含0.05%mtt的无血清dmem培养基100μl,在37℃孵育4h。最后,吸去上述含mtt的培养基,加100μldmso溶解生成的色素,以酶标仪测定各孔吸光度,并以spss软件中提供的probit概率法计算ic50值,n-羟基全反式维甲酰胺为25.7μm,而全反式维甲酸为90.1μm。n-羟基全反式维甲酰胺对正常细胞不敏感。
实施例7
将u87mg细胞以2×106个/皿的密度接种于10cm培养皿,37℃孵育贴壁24h后,将原培养基替换成分别含有0、1、10μmn-羟基-9-顺式维甲酰胺的dmem培养基继续孵育48h,消化收集细胞后以70%乙醇4℃固定过夜,随即以细胞周期检测试剂盒进行染色,以流式细胞仪分析各周期细胞,其结果如下:0μm:g0/g1,78%;s,9%;g2/m,13%。1μm:g0/g1,81%;s,10%;g2/m,9%。10μm:g0/g1,92%;s,6%;g2/m,2%。n-羟基-9-顺式维甲酰胺明显促使u87mg细胞发生周期阻滞,抑制其生长。
实施例8
将u118mg细胞以2×106个/皿的密度接种于10cm培养皿,37℃孵育贴壁24h后,将原培养基替换成分别含有0、10、100μmn-羟基-9-顺式维甲酰胺的dmem培养基继续孵育48h,消化收集细胞后以70%乙醇4℃固定过夜,随即以细胞周期检测试剂盒进行染色,以流式细胞仪分析各周期细胞,其结果如下:0μm:g0/g1,83%;s,6%;g2/m,11%。10μm:g0/g1,87%;s,8%;g2/m,5%。100μm:g0/g1,95%;s,4%;g2/m,1%。n-羟基-9-顺式维甲酰胺明显促使u118mg细胞发生周期阻滞,抑制其生长。
实施例9
将u87mg细胞以无血清培养基筛选,得到cd133阳性的肿瘤干细胞样细胞,随后将此干细胞以2×106个/皿的密度接种于10cm培养皿,37℃孵育贴壁24h后,将原培养基替换成分别含有0、1、10μmn-羟基-9-顺式维甲酰胺的无血清培养基继续孵育48h,消化收集细胞后分别以兔抗人cd133抗体、fitc标记羊抗兔igg抗体孵育,以流式细胞仪分析cd133阳性率,结果如下:0μm:cd133+97.3%;1μm:cd133+86.0%;10μm:cd133+2.7%。n-羟基-9-顺式维甲酰胺能够杀死cd133阳性的肿瘤干细胞样细胞。
实施例10
将u87mg细胞以无血清培养基筛选,得到cd133阳性的干细胞样细胞,随后将此干细胞以2×106个/皿的密度接种于10cm培养皿,37℃孵育贴壁24h后,将原培养基替换成分别含有0、1、10μmn-羟基全反式维甲酰胺的无血清培养基继续孵育48h,消化收集细胞后分别以兔抗人cd133抗体、fitc标记羊抗兔igg抗体孵育,以流式细胞仪分析cd133阳性率,结果如下:0μm:cd133+98.2%;1μm:cd133+74.7%;10μm:cd133+5.6%。n-羟基全反式维甲酰胺能够杀死cd133阳性的肿瘤干细胞样细胞。
实施例11
将2×106个u87mg细胞种植于裸鼠颅内,待肿瘤形成并经mri确定其直径超过3mm时,实验组(6只)进行治疗:2mg/kg体重腹腔注射n-羟基全反式维甲酰胺溶液,每天注射一次,共20次;对照组(6只)予以等剂量生理盐水注射。在治疗的20天内,每5天以mri测量一次小鼠颅内肿瘤大小,其结果见图1。n-羟基全反式维甲酰胺能够抑制体内肿瘤的生长。
实施例12
将2×106个u87mg细胞种植于裸鼠颅内,待肿瘤形成并经mri确定其直径超过3mm时,实验组(6只)进行治疗:60mg/kg体重静脉注射n-羟基-13-顺式维甲酰胺溶液,每三天注射一次,共2次;对照组(6只)予以等剂量生理盐水注射。在治疗开始后的20天内,每5天以mri测量一次小鼠颅内肿瘤大小,其结果见图2。n-羟基-13-顺式维甲酰胺能够显著抑制体内肿瘤的生长。
- 还没有人留言评论。精彩留言会获得点赞!
- 苯甲酰胺类,含有苯甲酰胺类的组合物以及苯甲酰胺类的制备方法与流程
- 一种硫酰胺的加工工艺的制作方法与工艺
- 一种硫酰胺的制备方法与流程
- 含苯甲酰胺类、二硝基苯胺类、二硫代氨基甲酸酯类杀菌剂和生防菌的组合物、制剂及应用的制作方法与工艺
- 含羧酸酰胺类、苯甲酰胺类杀菌剂和生防菌的菌药组合物、制剂及应用的制作方法与工艺
- 一种N‑烷基羟肟酸‑二硫代氨基甲酸酯捕收剂、制备及其应用的制作方法与工艺
- 含酰胺键的1,3,4‑噁二唑硫/氧醚类化合物及其制备方法及应用与流程
- 来自羟基官能的缩酮酸、酯或酰胺的高再循环含量的聚酯型多元醇的制造方法与工艺
- N‑羟基硫代琥珀酰亚胺生物素酯及其衍生物的制备方法与流程
- 包含(硫代)磷酸三酰胺和其它化合物如胺和着色剂的具有改进脲酶抑制效果的组合物的制造方法与工艺