一种重组牛干扰素α标准品、其制备方法及效价测定方法与流程
本发明涉及一种重组牛干扰素α标准品、其制备方法及效价测定方法。
背景技术:
干扰素(interferon,IFN)是病毒感染诱导机体产生的一种具有广谱抗病毒、抗肿瘤和具有免疫调节作用的蛋白质,于1957年Issacs和Lindeman首先发现,它是一类多功功能的细胞因子,与细胞受体结合后,可诱导机体产生特异的蛋白质和酶类,主要通过抑制病毒基因转录和降解病毒RNA来抑制病毒的生长繁殖及发挥抗肿瘤的活性。
按照干扰素的产生细胞、生化特征及在机体免疫方面所发挥的作用不同,分为α、β、γ三类,其中α型干扰素在机体内能发挥广谱、高效抗病毒作用机制是抑制病毒蛋白质的合成,是由白细胞分泌的一类具有抗病毒和免疫调节功能的细胞因子。IFN-α与靶细胞的表面受体结合后可以激活靶细胞内潜在抗病毒基因的表达,产生具有酶活性的抗病毒蛋白(anti-viralprotein,AVP),使细胞具备抗病毒的能力,降低病毒在细胞内的增殖速度,同时减少细胞感染的损伤,并能选择性地作用于受感染细胞,而对正常宿主细胞无作用或作用微弱,在临床上得到广泛的应用。
我国是养牛大国,但由于多种传染病的影响,严重制约了养牛业的发展,随着奶牛集约化养殖程度不断提高,奶牛病毒性疾病的感染率也在逐年上升。如:奶牛乳腺炎病毒、口蹄疫病毒、牛病毒性腹泻病毒、牛呼吸道合胞体病毒等,这些病毒性疾病严重影响了奶牛的产奶量和牛肉的品质,对畜牧场造成了严重的经济损失。
一系列研究表明,重组牛干扰素α(rBoIFN-α)的体外表达具有抗水疱性口炎病毒、口蹄疫病毒、牛病毒性腹泻病毒、呼吸道合胞体病毒、副流感病毒等多种病毒的作用。干扰素广泛的抗病毒作用和免疫调节功能,使牛干扰素对普通传染病均具有一定的预防和治疗作用。因此基因重组牛干扰素α推广应用前景非常广阔。
然而由于生产工艺和成本等问题,牛干扰素的研制还停留在实验室阶段,并未在临床上大量使用。大肠杆菌表达系统具有操作简单和成本低廉两个显著特征,是应用最广泛的表达系统之一。
为了有效预防和控制人畜共患病,减少病毒性疾病对养牛业带来的损失,本实验室己经构建了可高效表达具有生物学活性的重组牛干扰素α(rBoIFN-α)的重组菌以期为rBoIFN-α规模化生产以及实际应用奠定基础。
对于生物制品来说,其质量评价的有效性指标多采用生物学方法,如动物法和细胞法等进行检测。这些方法本身变异性较大,因此标准品是生产中必不可少的组成部分,在生物制品标准化、质量控制和效力评价中标准品是药品质量评价的标尺,起着非常重要的作用。然而目前国际国内均没有rBoIFN-α的标准品,这给实际研究工作带来很多不便。
技术实现要素:
本发明提供一种重组牛干扰素α标准品的制备方法,此标准品可用于生物学活性检测,可用作重组牛干扰素α效价测定的参考标准。
本发明还提供了根据上述制备方法制备得到的重组牛干扰素α标准品,其效价为1.0×106~1.0×107IU/mL;SDS-PAGE检测其纯度为≥95%;HPLC检测其纯度为97.83%;相对分子量为35KD;N-末端氨基酸序列从第十个氨基酸开始为CHLPHTHSLANRRVL。
本发明还提供了重组牛干扰素α标准品的效价测定方法。
本发明采取的技术方案为:
一种重组牛干扰素α干扰素标准品的制备方法,所述制备方法包括以下步骤:
(1)将重组牛干扰素α的重组菌进行发酵和诱导,后直接收集菌体破碎后上清提取总蛋白,所述重组牛干扰素α的重组菌为BL21/pET-32a-rBoIFNα工程菌,其DNA序列如序列表SEQUENCE LISTING 400〈1〉所示;
(2)总蛋白经亲和层析纯化、脱盐和缓冲液置换、离子交换层析纯化和分子筛层析纯化,即可得重组牛干扰素α纯化后蛋白溶液;
(3)向重组牛干扰素α纯化后蛋白溶液中加入冻干保护剂,经真空冷冻干燥,即可制得重组牛干扰素α标准品。
所述步骤(1)具体包括以下步骤:
(1-1)培养工程菌BL21/pET-32a-rBoIFNα,得到工程菌菌液;
(1-2)将工程菌菌液按体积比1:80~100接种到含100μg/mL氨苄青霉素的150mL LB培养基中,培养后作为发酵种子菌液;
(1-3)发酵种子菌液接种到装有LB培养基的发酵罐中进行发酵、诱导,得到发酵液;
(1-4)发酵液离心、破碎后收集上清液,即可得到重组牛干扰素α蛋白溶液。
所述步骤(1-1)具体包括以下步骤:将BL21/pET-32a-rBoIFNα工程菌经四区划线接种于含有100μg/ml氨苄青霉素的LB固体培养基上,37℃培养过夜;挑取单个阳性菌落接种至4~5ml含有氨苄青霉素的LB液体培养基,摇床振荡培养,培养温度为35~38℃,时间为17~20小时,测OD值在0.6~0.8时,收获得到菌液。
所述步骤(1-2)中的培养条件为:培养温度为35~38℃,时间为17~20小时,转速为220r/min,OD值在0.6~0.8之间。
所述步骤(1-3)具体包括以下步骤:将发酵种子菌液接种到装有LB培养基的发酵罐中,发酵种子菌液与LB培养基的体积比为1:100~200,设置温度为35~38℃、PH值为7~8、溶氧为25~35%、转速为220~270r/min条件下发酵;当发酵罐内的OD600达到0.6~0.8时,加入异丙基-β-D-硫代吡喃半乳糖苷至终浓度为100μg/ml,调温度至30~35℃,诱导表达5h,得到发酵液。
所述步骤(1-4)具体包括以下步骤:将发酵液4℃条件下4000r/min离心15min,收集菌体,菌体用10%培养基体积的0.1mol/L PBS(pH7.4)重悬菌体,在800bar压力下,高压均质机破碎,重复破碎两次;4℃条件下12000~20000r/min离心15min,重复离心一次,收集上清液,即可得到重组牛干扰素α蛋白。
所述步骤(2)具体包括以下步骤:
(2-1)亲和层析纯化:将粗制蛋白过滤处理后过GST亲和层析柱,用Elution buffer梯度洗脱,收集重组牛干扰素α峰;
(2-2)脱盐和缓冲液置换:亲和层析纯化的重组牛干扰素α过脱盐柱,用缓冲液置换;
(2-3)离子交换层析纯化:将脱盐和缓冲液置得到的重组牛干扰素α峰分别用Loading buffer平衡好柱体,上样后用Elution buffer梯度洗脱,收集重组牛干扰素α峰;
(2-4)分子筛层析纯化:离子交换层析收集到的重组牛干扰素α过分子筛层析柱,Elution buffer收集重组牛干扰素α峰;
所述步骤(2-1)具体包括以下步骤:将粗制蛋白过滤处理后过GST亲和层析柱,用Elution buffer梯度洗脱,收集重组牛干扰素α峰;所述GST亲和层析纯化所用的平衡液为(Binding Buffer)PBS(pH7.4),洗脱液(Elution Buffer)为50mM Tris-Cl与40mM还原性谷胱甘肽组成的混合液,其pH为8.0;
所述步骤(2-2)具体包括以下步骤:所述脱盐、缓冲液置换方法如下:将亲和层析纯化的重组牛干扰素α过脱盐柱,用缓冲液置换,准备下一步离子交换层析;所述缓冲液含有50mMTris-Cl,pH为6.5;
所述步骤(2-3)具体包括以下步骤:将脱盐和缓冲液置得到的重组牛干扰素α峰分别用Loading buffer平衡好柱体,上样后用Elution buffer梯度洗脱,收集重组牛干扰素α峰;所述阴离子交换层析纯化使用的Loading buffer含有50mMTris-Cl;洗脱液(Elution Buffer)为50mM Tris-Cl与0→1M NaCl组成的混合液进行线性梯度洗脱,其pH值为6.5;
所述步骤(2-4)具体包括以下步骤:分子筛层析纯化:离子交换层析收集到的牛干扰素α过分子筛层析柱,Elution buffer收集牛干扰素α峰;所述分子筛层析纯化所用的Elution buffer洗脱液为50mM Na2HPO4与0.15M NaCl组成的混合液,其pH为7.0。
所述步骤(3)具体包括以下步骤:将重组牛干扰素α纯化后蛋白溶液用0.22μm滤膜过滤除菌,用10mM PBS(pH7.4)稀释至效价为1.0×107IU/ml后,按1:1体积比加入冻干保护剂,进行冷冻真空干燥;所述冻干保护剂:终浓度为5%甘油、0.12g/ml甘露醇、0.025g/ml蔗糖,其作用是冻干前在溶液中加些填充剂,使之形成团块结,防止药性物质在抽空时与水蒸气一起飞散;本保护剂不影响其药物活性。
本发明还提供了一种根据上述制备方法制备得到的重组牛干扰素α标准品。
重组牛干扰素α标准品的效价为1.0×106~1.0×107IU/mL;SDS-PAGE检测其纯度为≥95%;HPLC检测其纯度为97.83%;相对分子量为35KD。
本发明还提供了重组牛干扰素α标准品的效价测定方法:牛肾细胞作为测试细胞,重组牛干扰素α标准品作为供试品,重组人干扰素α作为对照品,将供试品和对照品分别制成不同的稀释度,在MDBK/VSV系统上对重组牛干扰素α标准品效价进行标定。
目前国际国内均没有重组牛干扰素α的标准品,本发明提供一种重组牛干扰素α生物学活性检测用标准品的制备方法,为建立重组牛干扰素α质量标准奠定基础。
本发明制得的重组牛干扰素α的标准品为冻干制剂,2~8℃可长期保存,在低于25℃室温下可保存两年。
按此方法制备的重组牛干扰素α作为标准品可用于重组牛干扰素α特性鉴别和效价测定的比对,以此为标准可使不同批次测定的重组牛干扰素α效价检测结果更为可靠可信。
附图说明
图1为重组牛干扰素αSDS-PAGE检测结果图;M:Marker;1:重组牛干扰素α分子筛层析纯化后目的蛋白样;
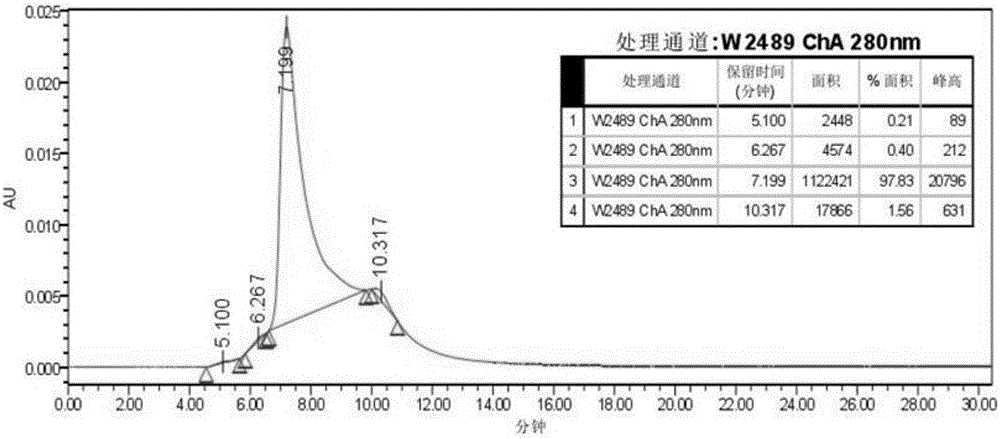
图2为重组牛干扰素αHPLC C18反相层析C蛋白纯度检测结果图。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
BL21/pET-32a-rBoIFNα工程菌,由安徽九川生物科技有限公司构建,具体构建方法参见2015年4月22日公开的中国专利CN104531691。
实施例1
一种重组牛干扰素α标准品的制备方法,所述制备方法包括以下步骤:
(1)重组牛干扰素α蛋白溶液的制备
(1-1)将BL21/pET-32a-rBoIFNα工程菌经四区划线接种于含有100μg/ml氨苄青霉素的LB固体培养基上,37℃培养过夜;挑取单个阳性菌落接种至4~5ml含有氨苄青霉素的LB液体培养基,摇床振荡培养,培养温度为35℃,时间为17小时,测OD值在0.6时,收获得到菌液;
(1-2)将步骤(1-2)得到的菌液接种至150ml含氨苄青霉素100μg/ml的LB培养基中,菌液与培养基的体积比为1:80,培养温度为35℃,时间为20小时,转速为220r/min,测OD值在0.6时,收获得到种子菌液,作为发酵种子菌液;
(1-3)将步骤(1-2)得到的发酵种子菌液接种到装有已灭菌LB培养基的发酵罐中,发酵种子菌液与LB培养基的体积比为1:100,设置温度为35℃、PH值为7、溶氧为25%、转速为220r/min条件下发酵;当发酵罐内的OD600达到0.6时,加入异丙基-β-D-硫代吡喃半乳糖苷至终浓度为100μg/ml,调温度至30℃,诱导表达5h,得到发酵液;发酵菌液诱导5小时后结束发酵,放出发酵液在4℃下4000r/min离心15min,弃上清,收集菌体;
(1-4)将步骤(1-3)得到的菌体用10%培养基体积的0.1mol/L PBS(pH7.4)重悬菌体;在800bar压力下,高压均质机破碎,重复破碎两次;破碎菌体4℃条件下12000r/min离心15min,收集上清液,即可得到重组牛干扰素α蛋白溶液。
(2)重组牛干扰素α蛋白溶液的纯化
(2-1)亲和层析
将步骤(1)得到的重组牛干扰素α蛋白溶液用0.22μm孔径的滤膜过滤后,上样通过连接在AKTA explorer 100蛋白纯化系统上,用Binding BufferⅠ(PBS pH7.4)平衡好的GST亲和层析柱,用PBS缓冲液洗去未结合的蛋白,直到A280nm稳定,再用Elution bufferⅠ(50mM Tris-Cl,40mM还原性谷胱甘肽,pH8.0)洗脱,收集rBoIFN-α蛋白峰。将第一步纯化的重组牛干扰素α过脱盐柱,用缓冲液置换,准备下一步离子交换层析;所述缓冲液含有50mMTris-Cl,pH为6.5。
(2-2)DEAE阴离子交换层析
将上步纯化后收集的蛋白置换到Binding BufferⅡ(50mM Tris-Cl,pH6.5)中后,上样通过用Binding BufferⅡ平衡好的DEAE阴离子交换层析柱,再用Binding BufferⅡ过柱至A280nm值稳定后,用Elution BufferⅡ(50mM三羟甲基氨基甲烷,1M NaCl,pH6.5)线性梯度洗脱,收集rBoIFN-α蛋白峰。
(2-3)分子筛层析
将离子交换层析收集到的样品浓缩后上样通过用Elution bufferⅢ(50mM Na2HPO4,0.15M NaCl,pH7.0)平衡好Superdex 200分子筛层析柱,用Elution bufferⅢ洗脱,收集rBoIFN-α蛋白峰。
(3)重组牛干扰素α标准品的制备
将重组牛干扰素α纯化后蛋白溶液用0.22μm滤膜过滤除菌,用10mmol/L PBS(pH7.4)稀释至效价为1.0×107IU/ml后,按1:1的体积比加入终浓度达5%甘油、0.12g/ml甘露醇、0.025g/ml蔗糖冻干保护剂混匀后,分装成规格为2.2mL/瓶的半成品,分装后迅速冷冻真空干燥,按制品冷冻真空干燥法进行,即可制得重组牛干扰素rBoIFN-α标准品。
(4)重组牛干扰素α标准品的检测
(4-1)蛋白质含量测定:对上述纯化后的rBoIFN-α标准品用Lowry法检测蛋白浓度,其蛋白含量为1mg/mL。
(4-2)SDS-PAGE进行纯度鉴定:对rBoIFN-α标准品进行SDS-PAGE鉴定纯度,其纯度为≥95%,相对分子量35kD(图1)。
(4-3)HPLC纯度鉴定:rBoIFN-α标准品经μRPC C18ST 4.6/100反相层析柱进行分析只得到一个主吸收峰如图2,有3个峰为杂峰。通过计算峰面积得出主峰面积占总面积的97.83%(图2)。
(4-4)N-端氨基酸序列测定:
(a)酶切:取纯化后的rBoIFN-α蛋白200μg,加4单位重组肠激酶,与酶切缓冲液中4℃条件下酶切16小时。
(b)SDS-PAGE电泳:取酶切产物进行SDS-PAGE电泳,上样前先将配置好的聚丙烯酰胺凝胶装到垂直电泳仪上,用50V恒压空跑30min。
(c)转膜:将蛋白电转到PVDF(聚偏氟乙烯)膜上,电转缓冲液用CAPS缓冲液。
(d)立春红染色:将PVDF膜放到立春红染液中染色,待看到蛋白条带后拿出,用水洗去背景颜色。
(e)将目的条带剪下放于Eppendorf管中,-20℃保存,用Edman降解法进行N端氨基酸测序。
(f)N-末端氨基酸序列从第十个氨基酸开始为CHLPHTHSLANRRVL,说明纯化后的目的蛋白就是重组牛干扰素α。
实施例2
一种重组牛干扰素α标准品的制备方法,所述制备方法包括以下步骤:
(1)重组牛干扰素α蛋白溶液的制备
(1-1)将BL21/pET-32a-rBoIFNα工程菌经四区划线接种于含有100μg/ml氨苄青霉素的LB固体培养基上,37℃培养过夜;挑取单个阳性菌落接种至4~5ml含有氨苄青霉素的LB液体培养基,摇床振荡培养,培养温度为37℃,时间为18小时,测OD值在0.7时,收获得到菌液;
(1-2)将步骤(1-2)得到的菌液接种至150ml含氨苄青霉素100μg/ml的LB培养基中,菌液与培养基的体积比为1:90,培养温度为37℃,时间为18小时,转速为220r/min,测OD值在0.7时,收获得到种子菌液,作为发酵种子菌液;
(1-3)将步骤(1-2)得到的发酵种子菌液接种到装有已灭菌LB培养基的发酵罐中,发酵种子菌液与LB培养基的体积比为1:150,设置温度为37℃、PH值为7.5、溶氧为30%、转速为250r/min条件下发酵;当发酵罐内的OD600达到0.7时,加入异丙基-β-D-硫代吡喃半乳糖苷至终浓度为100μg/ml,调温度至32℃,诱导表达5h,得到发酵液;发酵菌液诱导5小时后结束发酵,放出发酵液在4℃下4000r/min离心15min,弃上清,收集菌体;
(1-4)将步骤(1-3)得到的菌体用10%培养基体积的0.1mol/L PBS(pH7.4)重悬菌体;在800bar压力下,高压均质机破碎,重复破碎两次;破碎菌体4℃条件下16000r/min离心15min,收集上清液,即可得到重组牛干扰素α蛋白溶液。
采用与实施例1相同的方法进行纯化、真空冷冻干燥和检测。
实施例3
一种重组牛干扰素α标准品的制备方法,所述制备方法包括以下步骤:
(1)重组牛干扰素α蛋白溶液的制备
(1-1)将BL21/pET-32a-rBoIFNα工程菌经四区划线接种于含有100μg/ml氨苄青霉素的LB固体培养基上,37℃培养过夜;挑取单个阳性菌落接种至4~5ml含有氨苄青霉素的LB液体培养基,摇床振荡培养,培养温度为38℃,时间为17小时,测OD值在0.8时,收获得到菌液;
(1-2)将步骤(1-2)得到的菌液接种至150ml含氨苄青霉素100μg/ml的LB培养基中,菌液与培养基的体积比为1:100,培养温度为38℃,时间为17小时,转速为220r/min,测OD值在0.8时,收获得到种子菌液,作为发酵种子菌液;
(1-3)将步骤(1-2)得到的发酵种子菌液接种到装有已灭菌LB培养基的发酵罐中,发酵种子菌液与LB培养基的体积比为1:200,设置温度为38℃、PH值为8、溶氧为35%、转速为270r/min条件下发酵;当发酵罐内的OD600达到0.8时,加入异丙基-β-D-硫代吡喃半乳糖苷至终浓度为100μg/ml,调温度至35℃,诱导表达5h,得到发酵液;发酵菌液诱导5小时后结束发酵,放出发酵液在4℃下4000r/min离心15min,弃上清,收集菌体;
(1-4)将步骤(1-3)得到的菌体用10%培养基体积的0.1mol/L PBS(pH7.4)重悬菌体;在800bar压力下,高压均质机破碎,重复破碎两次;破碎菌体4℃条件下20000r/min离心15min,收集上清液,即可得到重组牛干扰素α蛋白溶液。
采用与实施例1相同的方法进行纯化、真空冷冻干燥和检测。
实施例4
重组牛干扰素α标准品的效价测定
本检测方法根据rBoIFN-α可以保护牛肾细胞(MDBK)免受水疱性口炎病毒(vesicuLar stomatitis virus,VSV)的侵害作用的原理,以干扰素抑制病毒致细胞病变效应(cytopathic effect,CPE)现象作为检测其活性的方法。即以每毫升干扰素检品的最高稀释度仍能保护半数细胞(50%)免受病毒攻击的稀释度的倒数定为干扰素单位(或称效价),常以单位(IU)表示,并用国家标准品校正结果。该结果经用结晶紫染料对存活MDBK细胞染色观察后,根据着色深浅,按Reed-Munch公式计算出所测定干扰素的效价。
1.实验材料
重组人干扰素α标准品:作为对照品,购自北京中国食品药品鉴定研究院,干扰素α国家标准品,批号:97/04,下称标化干扰素;
重组牛干扰素α标准品:由实施例一制得,作为供试品;
细胞:牛肾细胞(MDBK);
病毒:攻击病毒为水疱性口炎病毒(VSV),由安徽医科大学临床病毒研究所惠赠;
2.主要操作步骤和方法
2.1稀释待检干扰素:
供试品溶液的制备将供试品按标示量溶解后,用测定培养液稀释得到1000倍稀释物,然后在96孔细胞培养板中,做4倍系列稀释,共10个稀释度,每个稀释度做2孔,在无菌条件下操作。
2.2干扰素标准品溶液制备:
取人干扰素生物学活性测定的国家标准品,按说明书复溶后,用测定培养液稀释3000倍至每lml含1000IU。在96孔细胞培养板中,做4倍系列稀释,共10个稀释度,每个稀释度做2孔,在无菌条件下操作。
2.3分别设置细胞对照和病毒对照。
2.4效价测定
MDBK细胞处于对数生长期即传代后36~48h已形成单层,镜下观察时,细胞透亮立体感强,即可用于细胞悬液制备。调整细胞数为5×105/ml,按100μl/孔加入上述96孔板孔中,置37℃、5%CO2电热恒温培养箱培养24h左右。
观察到细胞长满了单层而且其生长状态良好时,弃去各孔内培养液,加入新鲜配制的维持液稀释至100TCID50的VSV病毒悬液,每孔100μl,细胞对照组加入等量的维持液,然后置37℃、5%CO2电热恒温培养箱内培养24h左右。
2.5结果观察
将温箱培养物置倒置显微镜下观察。首先观察“细胞对照孔”和“病毒对照孔”,各孔中出现的CPE用“+”表示。当病毒对照孔出现“+++或++++”,即病毒对照孔中的细胞出现75%~100%的明显病变和死亡脱落,而细胞对照孔中的细胞基本生长状态良好时,则表明本次试验对照系统合格,否则弃去重做。此时即可判定结果。加结晶紫染色液50μl/孔,3~5min后脱色即可记录结果。
++++ 表示全部细胞病变;
+++ 表示75%细胞病变;
++ 表示50%细胞病变;
+ 表示25%细胞病变;
- 表示无细胞病变。
2.6结果计算
肉眼观察记录,板孔着色完整良好呈紫色全覆盖状态如细胞对照孔C,则判为CPE(-);干扰素保护孔应有板孔结果呈紫色全覆盖状态(-),100%病变细胞为细胞全脱落故无色,如病毒对照孔和无干扰素保护的板孔均无色,则判为CPE(++++)。
表1 某批次重组牛干扰素α效价滴定结果(以“+”“-”记号记录形式)(术式)
备注:病变细胞与正常细胞统计按照CPE进展程度+~++++
表2 50%保护细胞的重组牛干扰素α标准品稀释度计算(Reed Muench计算)(术式)
根据Reed-Munch公式计算
按表2中,此次牛α干扰素标准品能保护半数(50%)细胞不被病毒损害的最高稀释度在1:46×10-3~1:47×10-3之间。
即此次牛α干扰素标准品稀释到46.23×103倍即5.63×106倍时,能保护半数细胞免受“攻击病毒”损害。即此次重组牛干扰素α标准品的工作单位为5.63×106IU/ml;按照相同的计算方法将重组人干扰素α的工作效价为3.07×106IU/ml。
2.7工作单位修正
各实验室所测得的干扰素单位,习惯上一般都称为该实验室“工作单位”;为了表明某种干扰素效价的高低,就必须用同型国家(际)干扰素标准品加以修正。具体修正方法如下:R1:R2=X1:X2
如上所示:R1=3.0×106IU/ml,R2=3.07×106IU/ml,X2=5.63×106IU/ml;
则按上式可得出:X1=5.50×106IU/ml。
R1:干扰素标准品的标准工作单位;R2:在相同条件下测定的干扰素标准品的工作单位;X2:待检干扰素测定的工作单位X1:修正后待检干扰素的工作单位。
修正后所得效价:X1=5.50×106IU/ml即为最终所得结果。
经过测试,制备的重组牛干扰素α标准品效价达到1×106~1×107IU/ml。
上述参照实施例对重组牛干扰素α标准品、其制备方法及效价测定方法进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!