人防御素mHD‑5基因及其相关应用的制作方法
本发明属于基因工程技术领域,更具体地,本发明涉及一种优化的人防御素mHD-5基因及其相关应用。
背景技术:
炎症性肠病(Inflammatory bowel disease,IBD)是一种病因未明的肠道非特异性慢性炎症,包括溃疡性结肠炎(Ulcerative colitis)和克罗恩病(Crohn’s disease),其病因及发病机制仍未完全阐明,近年来成为消化系统常见的疾病。尽管IBD的发病机制尚未明确,有关资料证明炎症的起始与复发与肠道免疫反应相关,肠道中TNF-α、IFN-γ表达增加。同时,肠道炎症中高表达的炎症因子也是潜在的致病因子,损害粘膜屏障功能及提高肠道通透性。肠道上皮屏障功能破坏引起持续性免疫反应,从而加重肠道炎症。
防御素5(human defensing,HD-5)是在人体中发现的一种人源α防御素,主要存在于肠道潘氏细胞及隐窝中,在肠道炎症、感染和损伤时HD-5分泌明显增加。在固有层的HD-5,可以同时触发促进炎症和抑制炎症反应两种机制。肠道防御素可诱导肠道上皮细胞产生白介素8(IL-8),激活中性粒细胞,引起T淋巴细胞增殖和向炎症部位趋化运动。同时HD-5也介导抗炎反应,能抑制细菌脂多糖活化的单核细胞释放白介素1β(IL-1β),并抑制固有层中产生白介素17(IL-17)的辅助性T细胞的增殖。
目前,虽然防御素在缓解肠道炎症及协同调节免疫方面起到一定作用,但是防御素的提取主要从天然资源中获得,成本高、得率低、工序繁琐等制约着其广泛应用;而化学合成法则价格相对昂贵,也难以应用于临床。利用分子生物学技术,在大肠杆菌、酵母等表达系统中表达防御素被认为是一种可行的策略,但其安全性及后续抗菌肽的纯化限制了这些表达系统的实际应用。
近几年,随着对乳酸菌性质的不断研究,其益生特性逐渐被人们所认识并接受,可治疗肠道菌群失调等方面所引起的相关疾病,并且在炎症性肠病中有降低疾病活动度、缓解炎症,保护肠道屏障完整性等作用,具有普通药物所不具备的优势。以乳酸菌作为表达系统,使防御素或其他功能性蛋白在粘膜表面进行表达释放,可以有效地避免传统表达系统(大肠杆菌)所带来的安全隐患及后续蛋白纯化的问题,同时避免了在口服过程中蛋白的降解和口服耐受,更能促进防御素或功能性蛋白被消化系统所吸收等。
外源蛋白在乳酸菌中的表达方式有三种,其中在信号肽作用下将目的蛋白分泌到培养基中是最为主要的一种方式。多项实验结果表明乳酸菌以分泌表达的形式在肠道粘膜表面表达功能性蛋白分子(如IL-10,IL-12)可以起到非常明显的治疗效果。
技术实现要素:
基于此,为了克服上述现有技术的缺陷,本发明提供了一种优化的人防御素mHD-5基因、人防御素mHD-5基因的表达蛋白以及分泌表达该人防御素mHD-5基因的重组表达质粒、重组乳酸乳球菌及其构建方法和应用。通过对抗菌肽(Antibacterial peptides)中Defensin家族的人源防御素HD-5的基因进行乳酸菌偏爱密码子优化得到优化后的基因mHD-5,并以此为基础构建分泌表达防御素HD-5基因的重组表达质粒pNZ8148-SH和重组乳酸乳球NZ9000-SHD5。
为了实现以上发明目的,本发明采取了以下技术方案:
一种优化的人防御素mHD-5基因,所述人防御素mHD-5基因具有如SEQ IDNo:1所示的碱基序列。
本发明还提供了一种人防御素mHD-5基因的表达蛋白,其具有如SEQ IDNo:2所示的氨基酸序列。
本发明还提供了分泌表达人防御素mHD-5基因的重组表达质粒,所述重组表达质粒插入有上述优化的人防御素mHD-5基因。
本发明还提供了上述重组表达质粒的构建方法,将优化的人防御素mHD-5基因克隆到乳酸乳球菌的表达质粒pNZ8148上,构建得到重组表达质粒pNZ8148-SH。
本发明还提供了分泌表达人防御素mHD-5基因的重组乳酸乳球菌,所述重组乳酸乳球菌插入有上述优化的人防御素mHD-5基因。
本发明还提供了上述重组乳酸乳球菌的构建方法,将上述重组表达质粒pNZ8148-SH电转入宿主菌株L.lactis NZ9000而获得重组乳酸乳球菌NZ9000-SHD5。
本发明还提供了优化的人防御素mHD-5基因、人防御素mHD-5基因的表达蛋白、分泌表达人防御素mHD-5基因的重组表达质粒或分泌表达人防御素mHD-5基因的重组乳酸乳球菌在制备炎症性肠病的药物中的应用。
本发明还提供了一种治疗炎症性肠病的药物,其活性成份包括有上述的人防御素mHD-5基因、上述的分泌表达人防御素mHD-5基因的重组表达质粒或上述的分泌表达人防御素mHD-5基因的重组乳酸乳球菌;其活性成份包括有上述的人防御素mHD-5基因的表达蛋白。
与现有技术相比,本发明具有以下有益效果:
1、本发明通过对人防御素5的天然基因成熟肽段进行密码子优化,得到了优化的人防御素mHD-5基因,并由此构建了分泌表达人源防御素HD-5基因的重组乳酸乳球菌NZ9000-SHD5,通过体内外实验对其降低肠道炎症的效果进行了研究,发现优化的人防御素mHD-5基因可以在乳酸乳球菌内高效表达,并发挥较好的缓解炎症的作用;人源防御素5(HD-5)在小肠潘氏细胞中分泌表达,可因炎症、感染和细胞恶性转化等因素刺激而分泌上调,同时具有广谱抗菌活性和参与肠道免疫调节作用,同时,HD-5为人体自分泌多肽,最大限度降低对人体毒副作用,且对益生菌无抑菌作用;相比传统的治疗方式,重组表达防御素的乳酸乳球菌结合了益生菌与防御素两者的优点,创新性地应用于降低其疾病活动度并且缓解炎症性肠病的炎症;
2、本发明所用的乳酸菌因为其可食用,不用经过灭活及纯化处理即可用于临床使用,并且乳酸菌作为一种常见的微生物,培养及后续操作过程简单,成本较低,可以通过制成粉状制剂、胶囊等形式的药品,携带方便,无需特殊条件即可自行服用。
附图说明
图1为本发明实施例1中优化的人防御素5(mHD-5)基因的氨基酸序列;
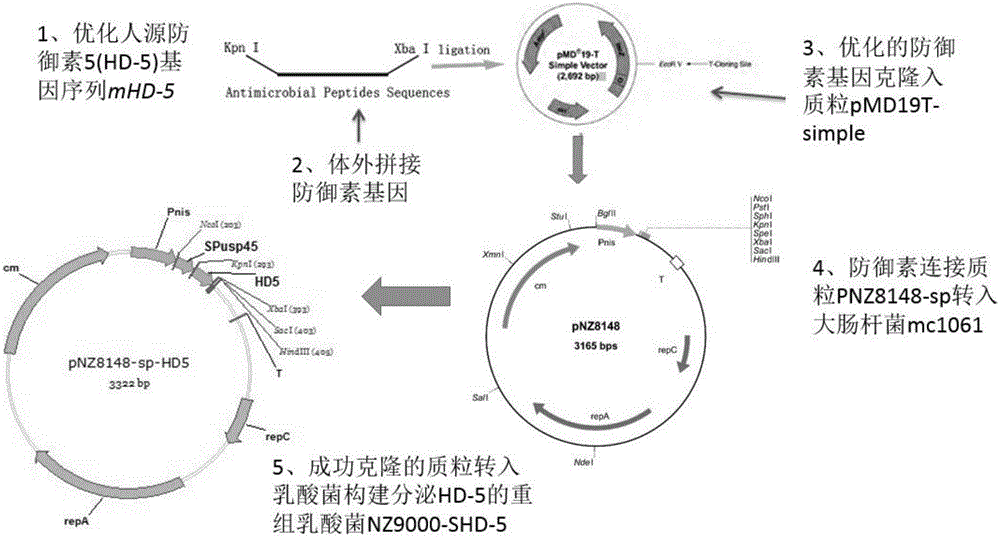
图2为本发明实施例1中重组乳酸乳球菌NZ9000-SHD5的构建步骤图;
图3为本发明实施例1中重组乳酸乳球菌NZ9000-SHD5的双酶切鉴定图谱,可见100bp大小的防御素基因;
图4为本发明实施例1中重组乳酸乳球菌NZ9000-SHD5的基因测序鉴定图;
图5为本发明试验例1中重组乳酸乳球菌NZ9000-SHD5中的人防御素5(mHD-5)蛋白的Western blot检测结果;
图6为本发明试验例2中重组乳酸乳球菌NZ9000-SHD5对细胞炎症模型的抗炎结果;
图7为本发明试验例2中重组乳酸乳球菌NZ9000-SHD5在细胞炎症模型中的缓解炎症的结果图;其中A为DAI评分表,DAI=体重下降评分+粪便性状评分+粪便隐血评分;B为小鼠模型的DAI评分;C为小鼠模型不同分组间结肠长度;
图8为本发明试验例2中重组乳酸乳球菌NZ9000-SHD5在动物模型中的缓解炎症的结果图;其中A为小鼠模型不同分组的炎症因子基因表达水平;B为小鼠模型不同分组的炎症因子蛋白表达水平;
图9为本发明试验例2中重组乳酸乳球菌NZ9000-SHD5在小鼠模型不同分组的病理切片(HE染色)。
具体实施方式
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
下面将结合具体实施例对本发明做更详细的说明。
实施例1优化的人防御素5(mHD-5)基因、及乳酸乳球菌表达质粒构建
1、人防御素5的基因优化
参照来源于防御素Defensin家族中的人源防御素5(HD-5)天然基因序列(GeneBank:NM_021010.1),基于乳酸乳球菌基因组的特点,根据GC含量、稀有密码子使用情况等对其进行基因优化,得到优化后的基因序列mHD-5(SEQ ID No:1),其氨基酸序列见图1。
2、乳酸乳球菌表达质粒NZ9000-SHD5的构建
请参阅图2,为构建重组乳酸乳球菌NZ9000-SHD5的实验过程,将优化后的基因mHD-5克隆到质粒pMD19T-simple(生工生物工程(上海)有限公司)上,得到pMD19TS-mHD-5质粒,用化学转化法转化到大肠杆菌Top10中。得到阳性克隆子后,提取质粒,通过双酶切鉴定法和基因测序进行验证。将验证正确的四种抗菌肽重组子进行双酶切,切胶回收抗菌肽基因序列片段,与分泌型表达载体pNZ8148-sp质粒(购自中国江南大学)连接,获得分泌表达型重组表达质粒pNZ8148-SH,并将表达质粒电转入宿主菌株L.lactis NZ9000(购自中国江南大学)中,得到重组乳酸乳球菌株NZ9000-SHD5。通过菌液PCR法、双酶切法(图3)和基因测序(图4)鉴定阳性转化子。
试验例1重组乳酸乳球菌NZ9000-SHD5中人源防御素5(mHD-5)的检测
将实施例1中获得的重组乳酸乳球菌NZ9000-SHD5活化后,按1:50接种于50ml GM17培养基(1000ml培养基:胰蛋白胨5g,大豆蛋白胨5g,牛肉膏5g,酵母粉2.5g,β-磷酸甘油二钠19g,维生素C 0.5g,1M MgSO41ml,葡萄糖5g)中(含10μg/ml的氯霉素),在30℃培养至OD600=0.5,加入nisin(Sigma-Aldrich)至终浓度10ng/ml,诱导培养2小时后;12000rpm离心5min,收集上清液。
分泌蛋白样品的处理:取1ml上清液加入2ml EP管中,然后加入150μl 100%三氯乙酸(100%TCA)混合均匀后,放在冰上2h,然后12000rpm离心10min;加入1ml预冷的丙酮,将沉淀重悬并离心,重复两次;然后室温下晾干,加入48μl 50mM NaOH重悬,最后加入12μl 5×loading buffer(250mM Tris-HCl,10%(w/v)SDS,50%(w/v)甘油,5%(w/v)β-巯基乙醇),在沸水中煮10min;
所有样品取30μl上样,经5-12%SDS-PAGE电泳分离后,通过电转转移至PVDF膜(Millipore公司,美国)上,分别用HD-5特异性单克隆抗体(一抗)(ALPHADIAGNOSTIC,美国)及HRP标记的羊抗兔IgG抗体(二抗)(北京博鳌森公司)杂交后,加入发光液(Millipore公司,美国),检测结果如图5所示。
实验结果及结论:1号泳道可以检测蛋白信号(阳性对照),分子量大小为3.5KDa左右;同时在2号泳道检测不到信号;结果说明人防御素HD-5基因可以在重组乳酸乳球菌株NZ9000-SHD5内特异性表达。
试验例2重组乳酸乳球菌NZ9000-SHD5对炎症的缓解作用
细胞实验如下:
1、大鼠IEC-6细胞炎症模型的构建
具体的构建过程为:首先以1*105/孔均匀铺板于6孔板中,24h后加入10ug/ml的LPS(Sigma,美国)孵育12h。
2、乳酸乳球菌上清液的准备
将实施例1中获得的乳酸乳球菌NZ9000-SHD5及空载体NZ9000活化后,按照1:50的比例接入GM17培养基中(加入10μg/ml氯霉素)进行培养,至OD=0.5左右,然后加入nisin至终浓度10ng/ml,30℃培养6h后,8000rpm 5min离心收集上清液,用0.22uM的无菌过滤器重新滤过上清液除去菌液中的细菌,收集过滤液于1.5ml的EP管中。
3、实验组的设计
空白组:往培养IEC-6细胞的六孔板中空白组孔加入200ul无菌水
NZ9000-SHD5及空载体NZ9000模型组:分别将200ul重组菌株NZ9000-SHD5、和NZ9000(空质粒)的上清液加入对应治疗孔继续孵育12h。
炎症模型组:培养IEC-6细胞的六孔板中炎症组孔加入200ul无菌水
4、炎症因子表达水平检测
提取6孔板中细胞RNA,通过逆转录试剂盒(Takara,日本)逆转录成DNA,进行q-pcr相对定量检测TNF-α,IL-6的基因表达水平。
5、实验结果
重组乳酸乳球菌NZ9000-SHD5、NZ9000空载体可降低炎症细胞TNF-α,IL-6的基因表达水平(P<0.01),同时两者间差异有统计学意义(P<0.01)(参见图6);
实验结果说明,重组乳酸乳球菌NZ9000-SHD5降低炎症因子表达有一定作用,与单独乳酸菌相比也具有一定优势。
动物实验如下:
1、动物模型的构建
6-8W的C57雄性小鼠自由饮用3%的DSS水(MP,美国)7天,就可成功构建DSS诱导结肠炎模型。
2、小鼠灌胃乳酸乳球菌的制备
将实施例1中获得的乳酸乳球菌NZ9000-SHD5活化后,按照1:50的比例接入GM17培养基中(加入10μg/ml氯霉素)进行培养,至OD=0.5左右,然后加入nisin至终浓度10ng/ml,30℃培养6h后,8000rpm 5min离心收集菌体,用预冷的灭菌的生理盐水洗涤2遍后,加入一定体积的生理盐水,调整菌落数为5x1010CFU/ml,取200μl进行小鼠灌胃。
3、实验组的设计
空白对照组:每日200μl PBS灌胃,维持7天。
乳酸菌空载体组:每日予1*1011CFU空载体乳酸菌NZ9000灌胃,维持7天,同时自由饮用3%DSS水。
防御素组:每日予1*1011CFU分泌防御素5的乳酸菌NZ9000-SHD5灌胃,维持7天,同时自由饮用3%DSS水。
DSS组:每日予200μl PBS灌胃,维持7天,同时自由饮用3%DSS水。
4、疾病活动度及检测结果
疾病活动度:根据体重下降、粪便性状、便隐血评分平均数评价每日疾病活动度,连续记录7天后做折线图分析。疾病活动度(DAI)评分标准见图7A。同时,结肠长度作为评价炎症程度的一个指标,取小鼠结肠长度进行统计学分析。
检测结果:与重组乳酸乳球菌NZ9000-SHD5灌胃的小鼠与DSS炎症模型组相比,疾病活动度评分有一定下降,取造模最后一天评分坐统计学分析发现重组乳酸乳球菌NZ9000-SHD5与炎症模型组相比,两组间差异具有统计学意义(见图7B)。而结肠长度分析结果提示NZ9000-SHD5与空载体NZ9000组、炎症模型组相比,两组间差异均具有统计学意义(参见图7C)。
实验结果说明重组乳酸乳球菌NZ9000-SHD5可一定程度降低结肠炎小鼠的疾病活动度。
5、炎症因子水平检测及检测结果
炎症因子检测:在实验结束处死小鼠时,取小鼠血液,然后室温静置2h,2000rpm离心10min,取上层血清,使用相应ELISA试剂盒(Mutiplescience,China)测定其中TNF-α,IL-6、IL-1β的浓度。同时取一段小鼠结肠组织提取组织RNA,逆转录后进行q-pcr相对定量检测TNF-α,IL-6、IL-1β的基因表达水平。
其中,q-pcr所使用的引物分别为:
IL-6primer(Forward primer:5-ACTTCACAAGTCGGAGGCTT-3;Reverse primer:5-AGCATTGGAAGTTGGGGTAGG-3);
TNF-αprimer(Forward primer:5-CGGAAAGGACACCATGAGCA-3;Reverse primer:5-GGGAGCCCATTTGGGAACTT-3);
GAPDH primer(Forward primer:5-CCCTCTGGAAAGCTGTGG-3;Reverse primer:5-GCTTCACCACCTTCTTGATGT-3)
检测结果:与炎症组相比,防御素治疗组、空载体组结肠组织中的IL-6、TNF-α、IL-1β的mRNA水平均明显降低(P<0.01)。同空载体治疗组相比,防御素组的IL-6、TNF-α、IL-1β的mRNA水平均明显降低(P<0.01)(参见图8A)。同时,血清中炎症因子检测结果显示,防御素治疗组、空载体组结肠组织中的IL-6、TNF-α的水平均明显比炎组症降低(P<0.01)。同空载体治疗组相比,防御素组的IL-6、TNF-α的水平均明显降低(P<0.01)。而两者IL-1β表达水平虽与炎症组相比有明显降低(P<0.01),但两者间差异无统计学意义(参见图8B)。
实验结果说明重组乳酸乳球菌NZ9000-SHD5可一定程度在基因及蛋白表达水平上降低炎症因子的表达。
6、小鼠结肠病理切片及结果
HE病理切片:取距离直肠相同距离的1cm结肠组织,然后放入10%的多聚甲醛中保存过夜,然后的清水冲洗过夜,将多聚甲醛冲洗干净,然后经脱水、包埋及切片染色后,用光学显微镜观察结肠的组织形态、组织炎症细胞浸润水平及肠道上皮绒毛完整性。
实验结果:炎症模型组结肠黏膜呈明显的急性炎症反应,光镜下表现为表面上皮脱落,大量炎症细胞浸润,炎性细胞以中性粒细胞为主,伴少量淋巴细胞和单核细胞,上皮内杯状细胞减少,隐窝破坏,腺体消失。空载体NZ9000治疗组同样有大部分上皮脱落,腺体减少,炎症细胞浸润,而重组菌株NZ9000-SHD5保持大部分上皮完整性,隐窝、腺体结构清晰,仅有少量炎症细胞浸润(参见图9)。
实验结果说明口服重组乳酸乳球菌NZ9000-SHD5可减少DSS诱导性结肠炎的炎症浸润,及对肠道上皮、粘膜及腺体有一定保护作用,可改善其病理情况。
试验例2的体内外实验结果说明,口服本发明的重组乳酸乳球菌NZ9000-SHD5可通过降低结肠炎的疾病活动度,抑制炎症因子的表达水平,减少了炎症细胞在发炎部位的聚集,从而在整体上一定程度起到缓解结肠炎的炎症情况。同时与空载体NZ9000相比,分泌表达防御素HD-5基因的重组菌株NZ9000-SHD5具有更好的效果。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!