一种鼠妇纤溶活性蛋白及其应用的制作方法
本发明涉及制药领域,具体涉及一种鼠妇纤溶活性蛋白及其应用。
背景技术:
血栓是三大致死性心血管疾病(心脏病、中风和静脉血栓栓塞症)的根源,发病率较高,在全球范围内呈现渐增之势。国际血栓与止血学会提供的资料显示,在美国,每年有10万-30万人死于静脉血栓;在欧洲,每年有50万人死于静脉血栓,超过艾滋病、乳腺癌、前列腺癌和高速公路交通事故死亡人数之和;在中国,因血栓性疾病及其并发症死亡的人数也众多。目前,临床应用的抗栓药物虽然能大幅度降低死亡率和致残率,但是这些溶栓药物仍然存在缺点,诸如出血副作用大,剂量难以控制,可能出现再阻塞和再梗死。此外,在临床治疗血栓性疾病过程中,一般先使用溶栓药物将已经形成的血栓溶解,然后使用抗凝药物,避免血栓再次形成。然而,目前市场上很少有口服药物同时具有溶栓和抗凝作用,因此,寻找一种副作用小,避免再阻塞和再梗死的溶栓抗凝药物势在必行。
鼠妇为甲壳纲等足目鼠妇科动物鼠妇Porcellio scaber Latreille的干燥虫体,别名潮虫,地虱,西瓜虫,豌豆虫等,始载于《神农本草》,具有破血利水,解毒止痛之功效。鼠妇是一味传统的虫类中药,可用于治疗中重度癌性疼痛,扁平疣,痔疮,百日咳等。
技术实现要素:
本发明的目的是提供一种鼠妇纤溶活性蛋白,不仅具有溶栓和抗凝活性,且适于口服给药。
本发明的另一目的是提供上述鼠妇纤溶活性蛋白在制备治疗血栓性疾口服病药物中的应用。
本发明的目的采用如下技术方案实现。
一种鼠妇纤溶活性蛋白,是将鼠妇粉碎物依次采用胃蛋白酶、和胰蛋白酶酶解后分离得到,其分子量为8k-10k Da,具有溶栓和抗凝活性。
鼠妇粉碎物酶解后,依次采用离子交换层析、凝胶过滤层析和超滤浓缩,分离得到纤溶活性蛋白。
所述离子交换层析中采用HiTrap Capto Q离子交换层析柱进行分离,采用1.5-3个柱体积的含有0.1-0.3mol/L NaCl的洗脱剂进行洗脱,收集洗脱液。
凝胶过滤层析中采用的色谱柱为SephacrylS-200HR凝胶层析柱和Superdex75pg凝胶层析柱。
所述SephacrylS-200HR凝胶层析柱分离过程中,洗脱剂为pH7-8、10-30mmol/L的Tris-HCl缓冲液,洗脱剂流速为0.5-1mL/min,收集具有纤溶活性的洗脱液。
所述Superdex75pg凝胶层析柱分离过程中,洗脱剂为pH7-8、10-30mmol/L的Tris-HCl缓冲液,洗脱剂流速为0.5-1mL/min,收集具有纤溶活性的洗脱液。
采用超滤浓缩获得分子量大于5kDa小于10kDa的组分。
酶解时,所述胃蛋白酶、胰蛋白酶与鼠妇粉碎物的质量比为0.5-1.5:1。
酶解温度为37.5-38.5,酶解时间为3.5-4.5小时。
所述鼠妇纤溶活性蛋白在制备治疗血栓性疾病口服药物中的应用。
本发明提供的鼠妇纤溶活性蛋白,不仅具有溶栓和抗凝活性,且适于口服给药。本发明鼠妇纤溶活性蛋白是将鼠妇粉碎物依次采用胃蛋白酶、和胰蛋白酶酶解后分离得到,因此适于口服给药。本发明鼠妇纤溶活性蛋白在溶栓和抗凝方面的活性显著强于PSLTro01,且经试验验证大鼠口服后具有较强的体内抗血栓活性。本发明鼠妇纤溶活性蛋白并非是直接溶解纤维蛋白,而是通过激活纤溶酶原,使纤溶酶原转化为纤溶酶,进而溶解纤维蛋白,因此,该鼠妇纤溶活性蛋白的溶栓作用相对温和,因而不会出现大量出血倾向,降低了组织大出血的风险。另外,本发明所提供鼠妇纤溶活性蛋白,制备方法行之有效,工艺过程简便,易操作,适应于工业化生产。本发明鼠妇纤溶活性蛋白还可以应用于制备治疗血栓性疾病口服药物。
附图说明
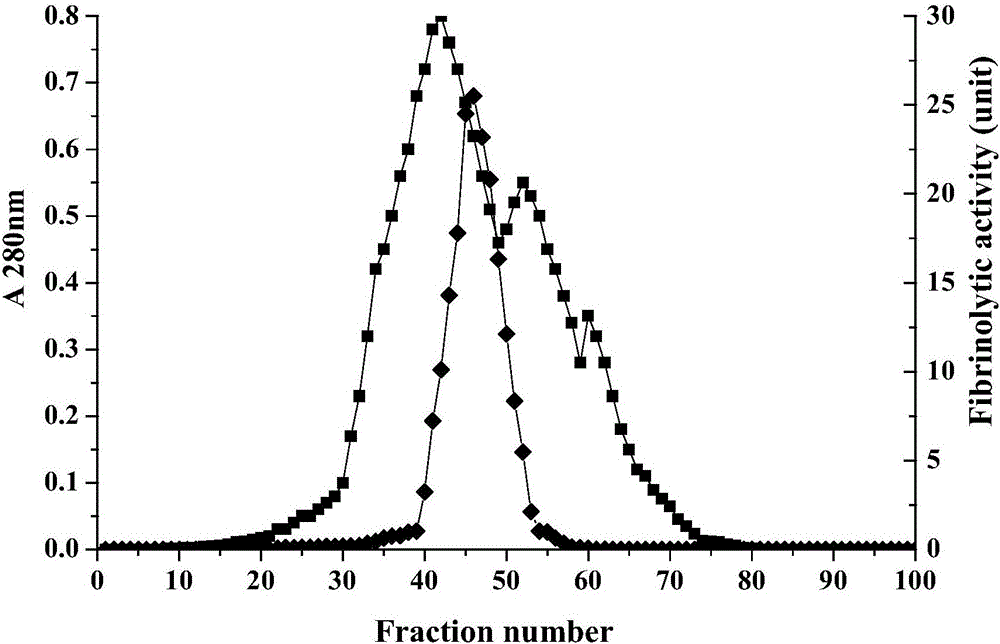
图1是SephacrylS-200HR凝胶层析结果,▉表示A280nm值,◆表示纤溶活性,横坐标为收集管数。
图2是Superdex 75pg凝胶层析结果,▉表示A280nm值,◆表示纤溶活性,横坐标为收集管数。。
图3是PSLTro02分离纯化过程中各步骤所得组分的电泳图,各泳道分别为:1.鼠妇粉碎物的酶解物;2.过HiTrap Capto Q离子交换层析柱后所得组分F-A;3.过Sephacryl S-200HR凝胶层析柱后所得组分F-C;4.过Superdex75pg凝胶层析柱后所得组分F-E;5.采用超滤离心管纯化后所得组分F-F;M.蛋白Marker。
图4是HPLC检测PSLTro02的色谱图。
图5 MALDI-TOF MS质谱法分子量测定图谱
图6显示了PSLTro02的一级质谱图。
图7显示了PSLTro02的二级质谱图。
图8显示温度对PSLTro02纤溶活性影响.
图9显示PSLTro02的温度稳定性,不同颜色的柱状图表示不同处理时间。
图10金属离子对PSLTro02纤溶活性影响
图11各物质纤溶活性的比较,a:尿激酶;b:胰蛋白酶;c:蚓激酶;d:胃蛋白酶;e:鼠妇纤溶粗蛋白;f:PSLTro01;g:PSLTro02;h:生理盐水。
具体实施方式
实施本发明可以按如下实施例进行,但并不意味着对本发明范围的限制。
实施例1鼠妇粉碎物及其酶解物
1.鼠妇湿法超微粉碎物的制备
称取干燥鼠妇100.0g,加入鼠妇质量8倍的蒸馏水,在25℃水浴中浸泡1h后,加入超微粉碎机中在25℃条件下采用湿法超微粉碎10min。将粉碎后得到的浆料在4℃条件下,10000r/min离心10min,取上清液,冷冻干燥可得鼠妇湿法超微粉碎物9.6g。
1.鼠妇粉碎物的酶解物的制备
称取鼠妇湿法超微粉碎物500mg,复悬于50mL人工胃液(见于2010版中国药典人工胃液的配制,胃蛋白酶浓度为10mg/mL)中,保证人工胃液中胃蛋白酶(批号313A0313,Solarbio公司)与鼠妇湿法超微粉碎物质量相等,放入恒温38℃摇床酶解4h,12000r/min离心10min,上清液即为人工胃液酶解液。冷冻干燥成冻干粉,再复悬于50mL人工肠液中,保证人工肠液(见于2010版中国药典人工肠液的配制,胰蛋白酶浓度10mg/ml)中胰蛋白酶(批号112B1220,Solarbio公司)与鼠妇湿法超微粉碎物质量相等,放入恒温38℃摇床酶解4h,12000r/min离心10min,上清液即为人工肠液酶解液,冷冻干燥后,得到鼠妇粉碎物的酶解物。
2.酶解物中胃蛋白酶和胰蛋白酶的酶活
酶解物在进行柱层析前按以下步骤灭活胃蛋白酶和胰蛋白酶:酶解物冻干粉先加入到pH7.0缓冲液(例如10-30mmol/L、pH7.0的磷酸缓冲液或Tris-HCl缓冲液)中灭活胃蛋白酶,然后加入到含有25mg/mL TLCK(对甲苯磺酰-L-赖氨酰氯甲酮)和1mmol/L EDTA(乙二胺四乙酸)的溶液(溶剂为10-30mmol/L、pH7.2的磷酸缓冲液或Tris-HCl缓冲液)中灭活胰蛋白酶。
实施例2具有溶栓抗凝活性的鼠妇提取物的制备
(1)HiTrap Capto Q离子交换层析
HiTrap Capto Q离子交换层析柱(100ml,购买于美国GE Healthcare)用5个柱体积的平衡缓冲液Ⅰ(pH8.0、浓度为20mmol/L Tris-HCl缓冲液)平衡,流速为1.0mL/min。将鼠妇粉碎物酶解物的冻干粉(已灭活胃蛋白酶和胰蛋白酶),用20mmol/L Tris-HCl缓冲液(pH8.0)配制成10mg/mL的溶液,上样于平衡后的HiTrap Capto Q离子交换层析柱,先用平衡缓冲液Ⅰ洗脱未吸附的蛋白,洗脱至基线后再用洗脱缓冲液Ⅰ(含1mol/LNaCl的pH8.0、20mmol/LTris-HCl缓冲液)与平衡缓冲液Ⅰ进行洗脱,洗脱2个柱体积,洗脱缓冲液Ⅰ与平衡缓冲液Ⅰ的体积比为1:4,每2mL为一管收集。洗脱流速为1.0mL/min。各管蛋白液在280nm处测定吸光度并进行纤溶活性检测,经检测,各管均具有纤溶活性(检测方法同申请号为201510043911.7的发明专利申请),混合后冷冻干燥,得到组分F-A。
(2)SephacrylS-200HR凝胶层析
SephacrylS-200HR凝胶层析柱用5个柱体积的平衡缓冲液Ⅱ(pH7.4、20mmol/L Tris-HCl缓冲液)平衡,流速为0.5mL/min。组分F-A用平衡缓冲液Ⅱ配制成5mg/mL的溶液,通过系统泵以流速0.5mL/min上样于层析柱顶部进行凝胶分离。用平衡缓冲液Ⅱ进行洗脱,流速为0.5mL/min,每3mL为一管进行收集。各管蛋白液在280nm处测定吸光度并进行纤溶活性检测,收集具有纤溶活性的洗脱液并混合,冷冻干燥,得到组分F-C。见图1。
(3)Superdex75pg凝胶层析
Superdex75pg凝胶层析柱用5个柱体积平衡缓冲液Ⅱ(pH7.4、20mmol/L Tris-HCl缓冲液)平衡,流速为0.5mL/min;将组分F-C用平衡缓冲液Ⅱ配制成5mg/mL溶液,通过系统泵以流速0.5mL/min上样于层析柱顶部进行凝胶分离。用平衡缓冲液Ⅱ以相同的流速进行洗脱,每2mL为一管进行收集。各管蛋白液在280nm处测定吸光度并进行纤溶活性检测。将具有纤溶活性的洗脱液混合,得到组分F-E,见图2。将组分F-E过截留分子量为10kDa的超滤离心管( ultra-15),取透过液过截留分子量为5kDa的超滤离心管(ultra-15),取截留液,获得组分F-F。将组分F-F命名为鼠妇纤溶活性蛋白PSLTro02。鼠妇纤溶活性蛋白PSLTro02的电泳图,如图3。从图3可以看出,纤溶活性蛋白PSLTro02,分子量在8.0-10.0kDa范围内。
(4)纤溶活性蛋白PSLTro02的分离纯化结果及鉴定
①分离纯化结果
从3000mg鼠妇粉碎物的酶解物中分离纯化得到了0.86mg纤溶活性蛋白PSLTro02,其相对效价为1509.8U/mg,回收率为9.6%,纯化倍数334.8。详细结果如表1。
表1鼠妇纤溶活性蛋白PSLTro02的纯化结果
②HPLC纯度检测
如图4所示HPLC检测得到一个对称峰,其峰面积积分结果提示分离纯化所得纤溶活性蛋白PSLTro02的纯度达到93.86%。
③MALDI-TOF MS质谱法分子量测定
PSLTro02经过MALDI-TOF MS质谱法测定,蛋白的相对分子量为8480.55Da,如图5,这与SDS-PAGE结果吻合。
④MALDI-TOF MS质谱法蛋白质鉴定
将PSLTro02送上海中科院生命科学院检测中心,采用MALDI-TOF MS质谱法对其进行鉴定,一级质谱图和二级质谱图见图6、7。在National Center for Biotechnology Information(NCBI)数据库里下载同种属纤溶活性蛋白的质谱数据,利用Mascot软件分析PSLTro02质谱数与所下载质谱数据的匹配情况,结果发现PSLTro02与同种属Porcellio scaber和Armadillidium vulgare中获得的蛋白匹配度均低于20%,因此可以确定,纤溶活性蛋白PSLTro02与目前数据库里收录的同种属间的蛋白均不同,即PSLTro02是目前首次酶解鼠妇纤溶活性蛋白获得的一种新的纤溶活性蛋白。
实施例2纤溶活性蛋白PSLTro02的酶学性质
1、pH对其纤溶活性的影响
鼠妇纤溶活性蛋白PSLTro02在不同的pH环境下纤溶活性差异明显。在强酸和强碱环境下,纤溶活性急剧下降,在pH6-pH8之间活性较强,在pH=7其纤溶活性达到最强,而且在碱性环境中的纤溶活性强于酸性环境中活性。
通过实验,发现PSLTro02在碱性和中性环境中稳定性高于在酸性环境中稳定性。在强酸条件下,随着时间的推移,纤溶活性逐渐下降。人体中血液的pH一般维持在7.34-7.45,体液环境也为弱碱性环境,这与PSLTro02的最适反应pH相吻合。此结果同时也验证了胃蛋白酶最优失活条件对其活性无影响。
2、温度对其纤溶活性的影响
温度对PSLTro02纤溶活性的影响见图8,可以看出,温度对其影响较大,尤其温度在超过50℃时,活性急剧下降,超过60℃,其活性几乎降到0。温度低于10℃时其活性也降至0。但在40℃时,其活性达到了最大。
考察PSLTro02在不同的温度下处理不同时间对其纤溶活性的影响,即考察PSLTro02的稳定性。从图9可以看出,在温度为20℃时,其活性最稳定,温度在超过20℃后,随着处理时间的推移,其活性逐渐缓慢下降,在超过50℃后,随着处理时间的推移,活性急剧下降。所以保存PSLTro02最适温度最好在20℃。
3、金属离子对其纤溶活性的影响
将PSLTro02加入到不同的金属离子(0.1mmol/L)中,考察金属离子对PSLTro02纤溶活性的影响见图10,可以看出Na+,K+,Mg2+对PSLTro02纤溶活性没有影响,Cu2+,Mn2+,Fe2+,Ca2+,Zn2+,Al3+,Fe3+均有不同程度抑制其纤溶活性,尤其是Fe2+,Fe3+明显抑制其活性,与PSLTro02作用后,残余酶的活力仅为空白对照的12.5%以下。
4、酶抑制剂和表面活性剂对其纤溶活性的影响
PepstainA(胃蛋白酶抑制剂A)、KTI(大豆胰蛋白酶抑制剂)、SBTI(大豆蛋白酶抑制剂)、Aprotinin(抑肽酶)、β-mercaptoethanol(β-巯基乙醇)对PSLTro02纤溶活性影响较大。但PMSF(苯甲基磺酰氟,0.1-100mmol/L),TLCK(对甲苯磺酰-L-赖氨酰氯甲酮,0.1-50mg/ml),TPCK(对甲苯磺酰-L-苯丙氨酰氯甲酮,0.1-50mg/mL),EDTA(乙二胺四乙酸,0.5-50mmol/L),EGTA(乙二醇-双-(2-氨基乙醚)四乙酸,0.5-50mmol/L)和SDS各浓度对PSLTro02的纤溶活性基本没有影响。
5鼠妇纤溶活性蛋白PSLTro02对发色底物特异性的确定
在96孔板的各孔中分别加入175μL的PSLTro01溶液(含有1μg的PSLTro02,溶剂为pH 7.2、20mmol·L-1的Tris-HCl缓冲液),然后分别加入25μL浓度为0.5mmol·mL-1的凝血酶特异性发色底物S-2238(H-D-Phe-Pip-Arg-pNA)、纤溶酶特异性发色底物S-2251(H-D-Val-Leu-Lys-pNA)或尿激酶特异性发色底物S-2444(pyro-Glu-Gly-Arg-pNA)溶液(溶剂为pH 7.2、20mmol·L-1的Tris-HCl缓冲液)(发色底物均购自法国HYPHEN BioMed公司)。将96孔板放入EnSpire Multimode Plate Reader酶标仪控温测试区,测试区温度始终保持在37℃,保温5min后,在405nm紫外波长下连续扫描5mim测定释放出的pNA(对硝基苯胺)的吸光度。通过各孔内溶液吸光度的变化来计算pNA的释放量。PSLTro02活性定义为:在37℃条件下,每毫克鼠妇纤溶酶在1min内水解发色底物释放1μmol pNA的蛋白量为1U。
鼠妇纤溶活性蛋白PSLTro02对这三种发色底物均有水解作用,结果见表2,从表中可以看出,PSLTro02对纤溶酶最适底物H-D-Val-Leu-Lys-pNA的水解活性最大,对凝血酶最适底物H-D-Phe-Pip-Arg-pNA和尿激酶最适底物pyro-Glu-Gly-Arg-pNA的水解活性相当,但都低于对纤溶酶最适底物的水解活性,由此结果可以推测出PSLTro02的特异性水解产物为S-2251。
表2PSLTro02作用于发色底物的酰胺水解活性(n=5)
实施例3纤溶活性蛋白PSLTro02溶栓抗凝活性
1、体内抗血栓活性
取SD大鼠40只,雌雄各半,随机分为5组:生理盐水组(即空白对照组),尿激酶组和蚓激酶组(阳性对照组),纤溶活性蛋白PSLTro02高剂量组和低剂量组,各组连续灌胃5天,每天1次,剂量见表3。用2%戊巴比妥钠溶液(按40mg/kg)麻醉上述5组SD大鼠,制作动静脉环路血栓模型,大鼠仰卧位固定于手术板上,分离出右侧颈总动脉和左侧颈外静脉,在注满肝素钠生理盐水(50U/mL)的聚乙烯管中放一根长约8cm的已称重的手术线,用该聚乙烯管连通右侧颈总动脉和左侧颈外静脉,用药30min后开放动静脉环路15min,中断血流形成血栓。15min后取出血栓,在滤纸上来回滚动,来去除多余浮血,放置于已称重的载玻片上称重,减去载玻片和手术线的重量即是血栓湿重,并计算血栓抑制率。在75℃干燥箱中80min后,待其冷却后称其干重,求出血栓抑制率。
血栓抑制率(%)=(空白对照组血栓重量-实验组血栓重量)/空白对照组血栓重量×100%。统计数据方法:采用SPSS软件计算机处理,统计结果以(表示平均值,s表示标准偏差)表示,组间差距显著性用T检验判定。
表3PSLTro02对大鼠动静脉环路血栓形成重量的影响(n=5)
注:表3中,与空白对照组相比,*P<0.05,**P<0.01。
从表3可以看出,PSLTro02高剂量组的抑制率明显比阳性对照尿激酶组的抑制率高,具有非常好的体内抗血栓活性。
2、体外抗凝血活性
选择日本大耳兔雄性,以盐酸普鲁卡因局部麻醉,颈动脉插聚乙烯管取血,按体积比1:9加入3.8%的柠檬酸钠溶液后轻轻混匀,3000r/min离心10min,收集上清血浆备用。采用购自北京中勤世帝科学仪器有限公司体外诊断试剂盒:TT(批号STY50301-35),APTT(批号STY50201-36),PT(批号STY50101-58),分别检测凝血酶时间(TT)、凝血酶原时间(PT)、活化部分凝血酶时间(APTT)。
检测中,纤溶活性蛋白PSLTro02溶液分为小、中和大三个剂量组,PSLTro02的终浓度分别为5μg·mL-1,10μg·mL-1,20μg·mL-1;空白对照组中加入去离子水,阳性对照组中加入肝素钠(终浓度为1U·mL-1)。鼠妇纤溶酶PSLTro01按照申请号为201510043911.7的发明专利申请中方法制备。
从表4可以看出,PSLTro02可以明显延迟TT、PT、APTT的时间,但延迟作用不尽相同。在PSLTro02浓度达到10ug/mL时,对TT的延迟作用时间基本与肝素钠等效,在其浓度达到20ug/mL时,对PT的延迟作用时间与肝素钠等效,尤其是对APTT的延迟作用时间随着浓度的递增延迟作用时间最明显。通过本实验结果表明,PSLTro02同时作用于凝血过程中TT、PT、APTT三个途径,主要是抑制内源性凝血途径和共同凝血途径,延迟血浆凝固时间,而且随着PSLTro02浓度的增大,抗凝作用越强。同时与鼠妇纤溶酶PSLTro01在同样环境下进行抗凝活性对比,体外抗凝活性差异显著。
表4显示PSLTro02和PSLTro01对TT、PT、APTT的影响(n=5)
注:与空白对照相比:*P<0.05,**P<0.01。
3、体外抗血栓活性研究
称定100mg琼脂糖,加入10mL PBS缓冲液(pH7.8),加热至沸腾使其充分溶解后,放置50℃的水浴锅中至恒温,得到琼脂糖溶液。称定45mg纤维蛋白原,加入15mLPBS,放置50℃的水浴锅中使其充分溶解,得到纤维蛋白原溶液。凝血酶一瓶为2000U,加入4mL生理盐水充分溶解(500U/mL)50uL进行分装。取20uL凝血酶,加入3mL生理盐水混匀,得到凝血酶溶液。依次将纤维蛋白原溶液,凝血酶溶液,琼脂糖溶液倒入到培养皿中,快速混匀,室温静置1h,或者4℃冰箱静置30mn至凝固完全,得到纤维蛋白平板。打孔器打孔,将尿激酶、蚓激酶(10mg/ml)、鼠妇粉碎物的酶解物(灭活胃蛋白酶和胰蛋白酶)(10mg/ml)、鼠妇纤溶酶PSLTro01(10mg/ml)、纤溶活性蛋白PSLTro02(10mg/ml)、胃蛋白酶(10mg/ml)、胰蛋白酶(10mg/ml)、生理盐水分别取80uL点样于平板孔内,将平板置于37℃烘箱中,18h后观察有无溶圈,比较大小。其中鼠妇纤溶酶PSLTro01、纤溶活性蛋白PSLTro02加入的质量相等。
从图11可以看出,纤溶活性比较:尿激酶>胰蛋白酶>蚓激酶>PSLTro02>PSLTro01>胃蛋白酶>鼠妇纤溶粗蛋白,PSLTro02与PSLTro01的纤溶活性差异显著,溶圈面积PSLTro02明显大于PSLTro01的溶圈面积。
4鼠妇纤溶活性蛋白PSLTro02溶栓机理
分析纯纤维蛋白原中通常含有少许的纤溶酶原,这样会导致配制的纤维蛋白平板含有微量的纤溶酶原,容易混淆样品的纤溶机理,因此配制不加热的平板称为阳性平板。将阳性平板置于恒温恒湿培养箱中85℃加热35min,可使纤溶酶原完全失活,制成不含纤溶酶原的纤维蛋白平板,即为阴性平板。在阳性平板和阴性平板上打出若干直径约为2mm的小孔,分别加入10μL鼠妇纤溶活性蛋白PSLTro02溶液(20ug/ml),超纯水,尿激酶溶液(浓度10U/ml)。放入37℃恒温培养箱中,18h后观察纤维平板溶圈变化。结果:阳性平板上可以明显的看到尿激酶和PSLTro02有溶圈,而在阴性平板上,两者均无溶圈出现,由此提示PSLTro02溶栓方式是激活纤溶酶原转化为纤溶酶,再进一步溶解纤维蛋白,而并不是直接溶解纤维蛋白。
5鼠妇纤溶活性蛋白PSLTro02对纤维蛋白原的裂解
取200μL浓度为5mg·mL-1纤维蛋白原溶液和100μL浓度为0.2mg/mL PSLTro02纤溶活性蛋白溶液的充分混合后,放置于37℃恒温水浴锅中水浴5min,15min,30min,1h,4h,8h,16h,24h后取出20μL样品液,加入4μL上样缓冲液,进行SDS-PAGE垂直板电泳(分离胶T=12%),电泳时以纤维蛋白原作空白对照。电泳结束后观察凝胶成像,分析纤维蛋白原α,β,γ链的降解情况。从电泳图可以看出PSLTro02降解纤维蛋白的顺序是降解纤维蛋白原的α链,β链,γ链,这一点与人纤溶酶顺次降解纤维蛋白各亚基的情况相似。
- 还没有人留言评论。精彩留言会获得点赞!