锌‑四氮环配合物及其制备方法和在抗肿瘤药物中的应用与流程
本发明属于生物化工领域,特别涉及一种锌-四氮环配合物及其制备方法和在抗肿瘤药物中的应用。
背景技术:
肿瘤组织缺氧是恶性肿瘤的重要生物学特征,缺氧是实体瘤中常见现象。缺氧诱导因子(HIF)在肿瘤中发挥重要作用,缺氧可激活HIF途径及其介导的两个最基本功能:血管生成和葡萄糖代谢,进而导致肿瘤恶化,抵抗化疗和放疗,且增加肿瘤细胞侵入和转移潜能。针对HIF-1α的靶向抗肿瘤研究也是目前抗肿瘤研究的热点,主要是通过抑制HIF-1α的表达或活性等达到抗肿瘤目的,如化学药物、HIF-1α反义核酸药物等。目前已有一些抑制HIF的化合物进入临床试验及通过了FDA认证用于临床治疗癌症。
与铂、金、钌贵金属不同,锌是人体必需的微量元素,广泛存在于生物体内。Zn2+与DNA合成、基因表达、蛋白质的稳定性以及催化功能密切相关,而众多金属抗肿瘤药物中锌配合物在抗肿瘤活性方面的研究相对较少。
发明目的
本发明的目的之一是提供一种锌-四氮环配合物。
目的之二是提供上述配合物的制备方法。
目的之三是提供上述配合物或其药物组合物在制备抗肿瘤药物中的应用。
为了实现上述目的,本发明采用以下技术方案:一种锌-四氮环配合物,所述配合物C44H42N5O3ZnCl的结构式如式1:
所述锌-四氮环配合物的制备采用以下步骤:
(1)由2,6-二羟甲基吡啶制备2,6-二溴甲基吡啶(B);
(2)由二乙烯三胺制备1,4,7-三对甲苯磺酰基-1,4,7-三氮杂庚烷(C);
(3)由B和C制备3,6,9-三对甲苯磺酰基-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(D);
(4)由D制备3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(L1);
(5)由L1和1-氯甲基萘制备3,6,9-三甲基萘-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(F);
(6)由F制备配合物C44H42N5O3ZnCl。
所述2,6-二溴甲基吡啶的制备采用以下步骤:将2,6-二羟甲基吡啶溶解在48%的HBr溶液中,60℃磁力搅拌反应19小时,结束后将反应冷却至室温,再继续用冰盐浴冷却并用冰的饱和碳酸钠调至碱性,将生成的白色固体过滤后,用蒸馏水水洗多次,再用正己烷在室温条件下重结晶,得到无色透明针状晶体产物。
所述1,4,7-三对甲苯磺酰基-1,4,7-三氮杂庚烷的制备采用以下步骤:将二乙烯三胺溶于丙酮中,冰水浴同时用两个恒压滴液漏斗分别滴加NaOH的水溶液和对甲苯磺酰氯的丙酮溶液,之后在常温下机械搅拌反应3小时,反应完毕后加入冰水过滤得到白色固体产物。
所述3,6,9-三对甲苯磺酰基-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(D)的制备采用以下步骤:将2,6-二溴甲基吡啶、1,4,7-三对甲苯磺酰基-1,4,7-三氮杂庚烷和NaOH,用N,N-二甲基甲酰胺溶解,在100℃反应12小时,反应结束后立刻倒入400mL冰水中充分搅拌,将析出的白色固体用乙醇重结晶得到白色固体产物。
所述3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(L1)的制备采用以下步骤:将3,6,9-三对甲苯磺酰基-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯用浓硫酸和盐酸溶液溶解,将反应物在室温条件下反应72小时,反应结束后冷却至室温,旋蒸至原来体积的十分之一,之后将所得溶液中缓慢加入无水乙醚析出的黄白色固体过滤,再用无水乙醚洗多次,并在真空下干燥,得到四盐酸盐白色固体,将该固体溶于蒸馏水中,用饱和碳酸钠调节pH至9.5,然后将该水溶液用三氯甲烷连续萃取4小时。最后将三氯甲烷溶液用无水硫酸钠干燥过夜,过滤旋干,得到淡黄色油状物并最终在室温下固化变成淡黄色蜡状固体产物。
所述3,6,9-三甲基萘-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(F)的制备采用以下步骤:将1-氯甲基萘、L1和三乙胺用乙醇溶解,磁力搅拌下室温反应24小时,冷却至室温后将所得溶液过滤旋干,将所的产物用三氯甲烷重新溶解,并用蒸馏水洗涤,把有机相合并用无水硫酸钠干燥过夜,之后过滤旋干得到暗黄色固体,将所得粗产品硅胶柱层析后得到黄色固体产物。
所述配合物C44H42N5O3ZnCl(L-Zn)的制备采用以下步骤:将六水合硝酸锌和F用甲 醇-水混合溶液溶解,用稀盐酸溶液调节pH至7.4,磁力搅拌,回流反应1小时,之后将溶液冷却至室温并过滤,将所得滤液旋干得到黄色粉末产物。
一种锌-四氮环配合物在制备抗肿瘤药物中的应用。所述肿瘤为肺癌、乳腺癌、肝癌、肾癌或胃癌。
Zn2+-四氮环配合物,具有良好的DNA水解切割活性,以顺铂作为阳性对照药物,运用MTT方法研究了Zn2+-四氮环配合物对癌细胞株、正常细胞株和顺铂耐药性细胞株的细胞增殖影响,结果表明Zn2+-四氮环配合物对细胞增殖的抑制作用比顺铂更好,且对正常肝细胞的毒性略小于肝癌细胞。利用ICR小鼠皮下种植H22肝癌细胞模型研究Zn2+-四氮环配合物体内抗肿瘤增殖活性,发现Zn2+-四氮环配合物有较好的抑制肿瘤增殖活性。
附图说明
图1是2,6-二溴甲基吡啶(B)在乙腈中的电喷雾质谱图。
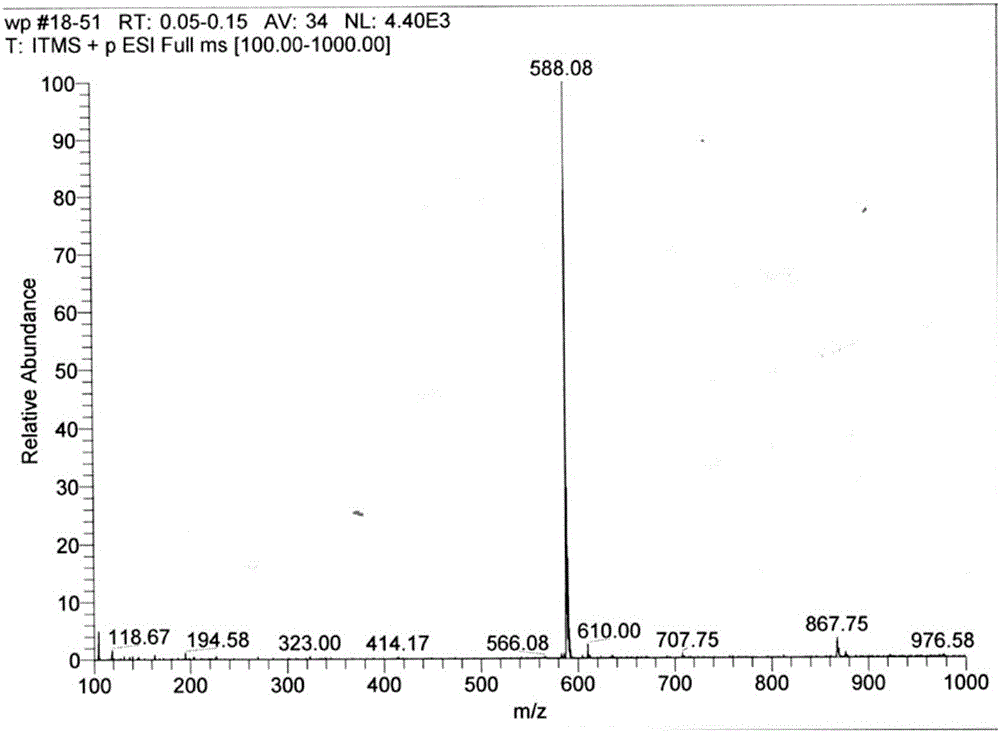
图2是1,4,7-三对甲苯磺酰基-1,4,7-三氮杂庚烷(C)在乙腈中的电喷雾质谱图。
图3是3,6,9-三对甲苯磺酰基-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(D)在乙腈中的电喷雾质谱图。
图4是3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(L1)在乙腈中的质谱图。
图5是3,6,9-三甲基萘-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(F)在乙腈中的电喷雾质谱图。
图6是配合物C44H42N5O3ZnCl(L-Zn)在缓冲液(50mM Tris-HCl,pH 7.4;乙腈/水,v/v 1/999)中的电喷雾质谱图。分子量727处的峰归属于[F+Zn+Cl]+(左),右边的是理论计算的[F+Zn+Cl]+的同位素峰。
图7是L-Zn(a)和DDP(b)在不同浓度梯度下对A549细胞存活率的影响图。
图8是L-Zn(a)和DDP(b)在不同浓度梯度下对NCI-H446细胞存活率的影响图。
图9是L-Zn(a)和DDP(b)在不同浓度梯度下对NCI-H1299细胞存活率的影响图。
图10是L-Zn(a)和DDP(b)在不同浓度梯度下对Hela细胞存活率的影响图。
图11是L-Zn(a)和DDP(b)在不同浓度梯度下对MCF-7细胞存活率的影响图。
图12是L-Zn(a)和DDP(b)在不同浓度梯度下对Ketr-3细胞存活率的影响图。
图13是L-Zn(a)和DDP(b)在不同浓度梯度下对BGC-823细胞存活率的影响图。
图14是L-Zn(a)和DDP(b)在不同浓度梯度下对SGC-7901细胞存活率的影响图。
图15是L-Zn(a)和DDP(b)在不同浓度梯度下对SGC-7901/DDP耐药株细胞存活率的影响图。
图16是L-Zn(a)和DDP(b)在不同浓度梯度下对HepG2细胞存活率的影响图。
图17是L-Zn(a)和DDP(b)在不同浓度梯度下对LO2细胞存活率的影响图。
图18是溶剂DMSO对不同细胞存活率的影响图。
具体实施方式
下面结合附图和具体实施例对本发明做进一步的说明。
锌-四氮环配合物的制备采用以下制备路线:
具体制备步骤和表征如下:
2,6-二溴甲基吡啶(B)的合成与表征:
将2,6-二羟甲基吡啶(10.0g,71.9mmol)加入250mL三口烧瓶中,用恒压滴液漏斗缓慢滴加48%的HBr(95mL)溶液溶解,之后保持60℃磁力搅拌反应19小时。结束后将反应冷却至室温,再继续用冰盐浴冷却并用冰的饱和碳酸钠调至碱性。将生成的白色固体过滤后,用蒸馏水水洗多次,再用正己烷在室温条件下重结晶,得到无色透明针状晶体(12.3g,65%)。质谱:ES-MS(CH3CN),m/z(%):266.00(100)[M+H]+。2,6-二溴甲基吡啶(B)在乙腈中的电喷雾质谱图见附图1。
1,4,7-三对甲苯磺酰基-1,4,7-三氮杂庚烷(C)的合成与表征:
将二乙烯三胺(4.4mL)溶于丙酮(40mL)中,加入500mL三口烧瓶中,冰水浴同时用两个恒压滴液漏斗分别滴加溶有5M NaOH的水溶液(132mL)和对甲苯磺酰氯(25.2g,132.0mmol)的丙酮溶液(132mL)。之后在常温下机械搅拌反应3小时。反应完毕后加入冰 水(800mL),过滤得到白色固体,烘干(59.7g,80%)。质谱:ES-MS(CH3CN),m/z(%):588.08(100)[M+Na]+。1,4,7-三对甲苯磺酰基-1,4,7-三氮杂庚烷(C)在乙腈中的电喷雾质谱图见附图2。
3,6,9-三对甲苯磺酰基-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(D)的合成与表征:
在500mL单口烧瓶中分别加入2,6-二溴甲基吡啶(2.2g,8.3mmol),1,4,7-三对甲苯磺酰基-1,4,7-三氮杂庚烷(4.7g,8.3mmol)和NaOH(2.23g,55.8mmol)),用400mL N,N-二甲基甲酰胺溶解,在100℃反应12小时。反应结束后立刻倒入400mL冰水中充分搅拌,将析出的白色固体用乙醇重结晶得到白色固体(4.4g,79%)。质谱:ES-MS(CH3CN),m/z(%):691.17(100)[M+Na]+。3,6,9-三对甲苯磺酰基-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(D)在乙腈中的电喷雾质谱图见附图3。
3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(L1)的合成与表征:
将3,6,9-三对甲苯磺酰基-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(5.5g,8.2mmol)加入250mL三口烧瓶中,用浓硫酸和盐酸(v/v 64/35)溶液(112mL)溶解,将反应物在室温条件下反应72小时。反应结束后冷却至室温,旋蒸至原来体积的十分之一。之后将所得溶液磁力剧烈搅拌,缓慢加入无水乙醚(15-20mL),析出的黄白色固体过滤,再用无水乙醚洗多次,并在真空下干燥,得到四盐酸盐白色固体。将该固体溶于蒸馏水中(10mL),用饱和碳酸钠调节pH至9.5,然后将该水溶液用三氯甲烷连续萃取4小时。最后将三氯甲烷溶液用无水硫酸钠干燥过夜,过滤旋干,得到淡黄色油状物并最终在室温下固化变成淡黄色蜡状固体(1.0g,59%)。质谱:ES-MS(CH3CN),m/z(%):207.17(100)[M+H]+。3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(L1)在乙腈中的质谱图见附图4。
3,6,9-三甲基萘-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(F)的合成与表征:
将1-氯甲基萘(830mg,3mmol),L1(206mg,1mmol)和三乙胺(303mg,3mmol))加入100mL圆底烧瓶中,用50mL乙醇溶解。磁力搅拌下室温反应24小时。冷却至室温后将所得溶液过滤旋干,将所的产物用三氯甲烷(200mL)重新溶解,并用蒸馏水洗涤(100mL×3)。把有机相合并用无水硫酸钠干燥过夜,之后过滤旋干得到暗黄色固体。将所得粗产品硅胶柱层析(三氯甲烷/甲醇v/v 10/1)得到黄色固体F(380mg,61%)。1H NMR谱(500MHz,CDCl3):δH 7.81(d,J=10Hz,3H),7.73(t,J=10Hz,3H),7.55-7.61(m,3H),7.48(t,J=7.5Hz,3H),7.42(t,J=7.5Hz,3H),7.38(t,J=7.5Hz,3H),7.26(t,J=10Hz,1H),7.16-7.20(m,3H),6.91(d,J=10Hz,2H),3.81(s,4H),3.68(s,2H),3.09(s,4H),2.64(br s,8H); 氢谱:ES-MS(CH3CN),m/z(%):627.67[M+H]+。3,6,9-三甲基萘-3,6,9,15-四氮杂[9.3.1]十五元双环-1(15),11,13-三烯(F)在乙腈中的电喷雾质谱图见图5。
配合物C44H42N5O3ZnCl(L-Zn)的合成与表征:
将六水合硝酸锌(149mg,0.5mmol)和F(313mg,0.5mmol)加入50mL圆底烧瓶中,用甲醇-水混合溶液(20mL,v:v 1:1)溶解,用稀盐酸溶液调节pH至7.4,磁力搅拌,回流反应1小时。之后将溶液冷却至室温并过滤,将所得滤液旋干得到黄色粉末C44H42N5O3ZnCl(L-Zn)(288mg,73%)。1H NMR谱(500MHz,CDCl3):δH 7.97(t,J=10Hz,2H),7.88(t,J=10Hz,6H),7.61-7.74(m,8H),7.50(t,J=7.5Hz,4H),7.43(d,J=10Hz,2H),7.33(t,J=7.5Hz,2H),4.92(s,2H),4.49(s,4H),4.38(s,2H),4.07(s,2H),3.20(br s,4H),3.06(br s,2H),2.85(br s,2H);氢谱:ES-MS(50mM Tris-HCl缓冲液,pH 7.4;乙腈/水,v/v1/999),m/z(%):727.33[M+Zn+Cl]+。将以上滤液缓慢挥发得到用于X-射线单晶衍射测试的黄色块状单晶。元素分析:计算值(%)for C44H42N5O3ZnCl:C 66.86,H 5.32,N 8.86;实验值:C 67.02,H 5.54,N 8.65。配合物C44H42N5O3ZnCl(L-Zn)在缓冲液(50mM Tris-HCl,pH7.4;乙腈/水,v/v 1/999)中的电喷雾质谱图,分子量727处的峰归属于[F+Zn+Cl]+(左),右边的是理论计算的[F+Zn+Cl]+的同位素峰(图6)。
锌-四氮环配合物的抗肿瘤活性表征:
(1)材料
主要仪器:SANYA CO2培养箱M18,酶联免疫测定仪(Thermo Scientific),江南牌相差显微镜,Millipore Milli-Q Advantage超纯水系统,Becton-Dickinson流式细胞仪,蔡司共聚焦显微镜,Nano Drop微量核酸定量仪,LabConco真空冻干机,Vortex Genie 2振荡器,小型垂直电泳系统和转膜系统(Bio-rad),Bio-Rad Gel XR凝胶成像仪,LAS500超灵敏化学发光成像仪。
试剂:Zn2+-四氮环配合物(L-Zn);顺铂(DDP),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)购于Sigma公司;胎牛血清FBS购于美国HyClone公司;DMEM培养基,常用的无机药品和有机溶剂均为分析纯或者更高级别。
实验中用到的细胞:
人源肿瘤细胞株:
A549:人肺癌细胞 NCI-H446:人小细胞肺癌细胞
NCI-H1299:人非小细胞肺癌细胞 Hela:人宫颈癌细胞
MCF-7:人乳腺癌细胞 Ketr-3:人肾癌细胞
BGC-803:人胃癌细胞 HepG2:人肝癌细胞
SGC7901:人胃癌细胞
人源正常细胞株:
LO2:人正常肝细胞系
顺铂耐药细胞株:
SGC7901/DDP:人胃癌顺铂耐药株
实验用ICR小鼠,雄性,18-22g,均由南京中医药大学实验动物中心提供,合格证。
瘤株:腹水型肝癌H22瘤株购买于凯基生物公司。
(2)实验方法
细胞培养:
细胞培养于含10%胎牛血清的DMEM完全培养基中,37℃、5%CO2培养箱中培养。细胞贴壁生长,待细胞融合至90%时进行传代,弃去培养瓶中的培养基,PBS洗两遍,加入1ml含0.02%EDTA的0.25%胰酶消化,在显微镜下观察细胞变圆,轻拍细胞培养瓶,使细胞脱落,加入3ml DMEM完全培养基终止消化,1,000rpm离心5min。细胞重悬于DMEM完全培养基中,以1:3比例继续传代培养。
体外细胞毒活性(MTT实验):
在10cm培养皿培养细胞至对数生长期,用含0.02%EDTA的0.25%胰酶消化液消化细胞,离心后弃上清收集细胞,血球计数板计数并稀释成2×104的单细胞悬液,将稀释好的细胞悬液用排枪接种于96孔培养板中,每孔100μL,于37℃,5%CO2培养箱中培养。细胞贴壁后每孔加入含有不同浓度L-Zn的培养液100μL,设置6个复孔。小分子处理24h、48h之后,每孔加入5mg/mL-1MTT溶液20μL,培养箱中孵育4h后,小心弃孔中培养液,每孔加入150μL DMSO,在平板振荡器上振荡培养板20min,使甲瓒晶体充分溶解,用酶标仪测量各孔570nm波长的吸收值。
药物对细胞增殖抑制效果可用细胞的存活率来进行评估:
用Origin Pro8.0软件拟合不同浓度药物对细胞增殖的抑制曲线,得到化合物对细胞增殖的抑制效果。
动物实验:
小鼠的饲养:给药前后,试验小鼠,分笼饲养,喂饲全价颗粒饲料(江苏省协同医药生 物公司供给),自由饮水,室温20±2℃,湿度50~70%。
H22小鼠模型的建立:体外复苏培养H22细胞:将H22细胞培养于含体积分数为10%胎牛血清的RPMI1640培养基中(含青霉素1x10-5U/L和链霉素100mg/L)中,置于37℃、含5%CO2的培养箱中。在细胞的指数生长期收集细胞,1,000rpm离心,PBS洗涤2次,离心去上清,用无菌生理盐水稀释,调整到2~3×106/mL。
随机选取5只健康的ICR小鼠,每只腹腔注射上述H22细胞悬液0.4mL,每天注意观察接种小鼠的腹水生长情况,约一周后接种小鼠腹部明显涨大、凸出,将小鼠颈椎脱臼处死,固定于蜡板上,在超净台内无菌抽取乳白色腹水液,用生理盐水稀释,调整细胞数为1~2×106/mL,用0.2%台酚蓝染色,计算活细胞数为95%~98%。取0.2mL于每只小鼠右上肢腋窝消毒后皮下接种。接种40只ICR小鼠。从抽取腹水开始,到接种完最后1只小鼠的总时间控制在lh内。
分组和给药:观察皮下接种H22的小鼠,10-15后皮下实体瘤体积大概为80-100mm3,将40只小鼠随机分为五组,分别为溶剂对照组(含与高剂量组等同浓度的溶剂),L-Zn低剂量组(10mg/kg),L-Zn中剂量组(25mg/kg),L-Zn高剂量组(50mg/kg)和顺铂阳性对照组(1.5mg/kg),每组6只小鼠,除顺铂组尾静脉注射,其他组均通过灌胃给药,给药体积均为100uL,每三天给药一次,并量取瘤组织的长和宽,通过Volume=a*b2/2,a为肿瘤最长处长度,b为肿瘤最窄处长度,计算肿瘤体积。给药5次,末次给药24h后,颈椎脱臼处死小鼠,解剖剥离瘤块。
肿瘤抑制率(抑瘤率)的计算:
称量瘤块重量,计算肿瘤抑制率。并将各组结果进行统计学处理。
疗效评价公式:抑瘤率(%)=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重×100%。半定量RT-PCR检测:
总RNA提取:取对数生长期的细胞,调节浓度至4×105/mL,每孔2.5mL接种于6孔平板中,培养至完全贴壁。吸弃旧培养基并用PBS洗涤细胞2次,每孔加入含不同浓度L-Zn的培养基2.5mL,孵育24h后,弃去细胞培养液,用PBS洗涤2次,尽可能弃残留的PBS,每孔加入1mL Trizol试剂裂解细胞,通过细胞刮刀刮下细胞,并将其转移到1.5mL进口离心管中,4℃避光静置保存。提RNA前盖紧样品管盖,涡旋仪剧烈振荡30sec,按体积比1:5加入5份氯仿,剧烈涡旋30sec,室温静置10min后,4℃12,000rpm离心10min。离心管内出现分层现象,其中下层红色的为苯酚-氯仿层、中间层及上层的为无色的水相层,RNA存在于水相层中。将水相转移到一个进口的离心管中,不要吸到中间层,加入等体积的异丙醇来沉淀RNA,涡旋混匀,-20℃静置1h以上,使RNA沉淀充分析出。然后4℃12,000rpm 离心10min,弃掉上层液,用DEPC水配置的75%的乙醇洗涤RNA沉淀两次,并4℃12,000rpm离心5min,弃乙醇,尽量干燥去除残留的乙醇,加入20μL无RNase酶的DEPC水使RNA充分溶解,分装-80℃保存。通过NanoDrop-1000测定提取的RNA的浓度及纯度,并用DEPC水稀释至0.5μg/μL。
cDNA逆转录:
参照Takara RNA PCR Kit(M-MLV)试剂盒合成cDNA。20μL的反应体系如表1
表1
得到的cDNA-80℃保存,使用前适当比例稀释。
引物设计:从GenBank(http://www.ncbi.nlm.nih.gov/Entrez)中获取相应基因的编码序列,用Primer 5.0软件按引物设计原则设计引物,并将设计好的引物在NIH核酸数据库中进行BLAST,以确保引物配对的唯一性。
引物序列:
HIF-1α-sense 5’-AGTGTACCCTAACTAGCCG-3’,
HIF-1α-antisense 5’-CACAAATCAGCACCAAGC-3’,
VEGF-sense 5’-GAAGGAGGAGGGCAGAAT-3’,
VEGF-antisense 5’-CACAGGATGGCTTGAAGAT-3’,
GLUT-1-sense 5’-GATGCAGGTGTTCAAGAG-3’,
GLUT-1-antisense 5’-GAAGGCTACAAAGACCAA-3’,
β-Actin-sense 5’-GACCTGACTGACTACCTC-3’,
β-Actin antisense 5’-TCTTCATTGTGCTGGGTGC-3’.
PCR:以反转录产物cDNA作为模板,进行PCR扩增反应,反应体系如表2
表2
反应体系混匀后按以下条件进行PCR,见表3:
表3
琼脂糖凝胶电泳:称取0.5g琼脂糖置于锥形瓶中,加入50mL 1×TAE,微波加热1min至琼脂糖完全融化,冷却后加入10μL 0.5μg/mL的溴化乙锭,摇匀,倒入已固定好梳子的制胶槽中配制成1%的琼脂糖凝胶。胶完全凝固后,垂直轻拔梳子,将凝胶及内槽放入电泳槽中。加1×TAE电泳缓冲液超过胶板1-2mm。在点样板上将PCR产物和点样缓冲液混合,加样,80V电泳,当溴酚蓝移动到距离胶底端1cm处时,停止电泳。运用伯乐凝胶成像系统在紫外光下拍照保存。
图像处理和分析:用图像分析软件Quantity One处理图片中的条带,确定目标基因条带灰度值,然后与β-Actin灰度值相比,作直方图比较。
Western blot检测:
细胞内总蛋白提取:取对数生长期的细胞,调节浓度至4×105/mL,每孔2.5mL接种于6孔板中,培养12h左右直至完全贴壁。吸弃旧培养基并用PBS洗涤细胞表面2次,每孔加入含不同浓度L-Zn的培养基2.5mL,孵育24h后经预冷的PBS漂洗后在冰上放置,加入100μL的RIPA裂解液(20mM Tris-HCl(pH 8.0)、250mM NaCl、0.4mM Na3VO4、1%SDS和1%蛋白酶抑制剂混合物(cocktail,sigma))冰上裂解30min。用细胞刮刀刮取细胞后,将细胞碎片和裂解液加入到预冷的1.5mL离心管中。4℃12,000g离心5min,收集上清液并分装于-80℃保存。用Bradford法测定蛋白浓度。
配制电泳样品:电泳样品由细胞全蛋白液、样品缓冲液和蛋白裂解液组成。依据已测定的蛋白浓度,吸取一定量的细胞全蛋加样体积加入5×点样缓冲液,用蛋白裂解液补足体积,混匀样品,煮沸5min,冷却后离心收集吸附于管壁的残留液体,准备上样。
SDS-PAGE电泳:按照《分子克隆实验指南(第二版)》提供的方案配制12%的分离胶和浓缩胶。浓缩胶的电压维持80V,等染料前沿进入分离胶后,将电压提高到120V继续电泳直至溴酚蓝到达分离胶底部,关闭电源,卸下凝胶。根据彩虹蛋白marker条带的位置确定目的蛋白条带的大致位置,切去多余部分的凝胶,用去离子水洗涤凝胶2次,用于转膜。
转膜:依据目标凝胶的面积大小,剪取一张适合大小的0.22μm PVDF膜,置于甲醇中活化1min,把含有目标条带的凝胶和PVDF膜都浸入到转膜缓冲液中。1000mL转膜缓冲液配方:39mmol/L甘氨酸、48mmol/L Tris、0.037%SDS和20%甲醇,提前配制在冰上预冷。按照负极(黑板)-海绵垫-滤纸-凝胶-PVDF膜-滤纸-海绵垫-正极(白板)顺序依次装好,装垫时保持各层间湿润并且驱除各层间的气泡,加入1L转膜缓冲液,使之完全浸没凝胶,填入冰盒,将转膜槽放入冰桶使其保持在4℃左右的环境中,250mA恒流转膜60min。
封闭:预先将进口脱脂奶粉溶解在TBST缓冲液中配制成5%(m/v)的封闭液。1000mL TBST配方:2.42g Tris-HCl,8g NaCl,调pH值为7.6,使用前加入0.1%Tween-20。湿转完成后,取出PVDF膜,用10mL TBST缓冲液洗涤2次,然后加入10mL封闭液,在水平摇床上荡摇1h。
抗体孵育:封闭结束后,用10mL TBST缓冲液洗涤PVDF膜3次,每次5min。加入用封闭液配置的一抗稀释液(1:1000),4℃摇晃过夜,使其充分与目标蛋白结合。一抗孵育完成后,用10mL TBST缓冲液洗涤PVDF膜5次,每次5min。加入用封闭液配置的二抗稀释液(1:5000),摇床上室温孵育1h后用10mL TBST缓冲液洗涤PVDF膜5次,每次5min。
发光显影:取少量(依据PVDF膜的大小而定)ECL试剂盒中A、B试剂等量混合配制成ECL工作液(曝光前10min配制),避光保存。提前打开曝光仪,连接软件使其温度降低至-30℃。滤纸吸干PVDF膜上多余的液体,将其放入仪器暗盒中,滴加适量的ECL工作液,曝光1-10min(视情况而定),调整曝光度,保存照片。
图像处理和分析:用图像分析软件Quantity One处理图片中的条带,确定目标蛋白条带灰度值,然后与β-actin灰度值相比,作直方图比较。
酶联免疫吸附(ELISA)检测:
将对数生长期的细胞按每孔4×105的密度接种于六孔板内培养12h左右直至完全贴壁。吸弃旧培养基并用PBS洗涤细胞表面2次,每孔加入含不同浓度L-Zn的培养基2.5mL,孵育24h后吸取1ml细胞培养液上清,4℃12,000g离心5min,收集上清液并分装于-80℃保存待用。从密封袋中取出试验所需板条,空白孔内加标准品稀释液,其余相应孔中加样品或不同浓度标准品(100μL/孔),用封板胶纸封住反应孔,37℃孵育90min后洗板五次,2min/次。预先20min配置好生物素化抗体工作液,空白孔内加生物素化抗体稀释液,其余孔内加入生物素化抗体工作液(100μL/孔)。用新封板胶纸封住反应孔,37℃孵育后洗板五次,2min/次。提前20min配置酶结合物工作液避光室温放置。空白孔内加酶结合物稀释液,其余孔内加入酶结合物工作液(100μL/孔)。用新封板胶纸封住反应孔,37℃孵育,避光孵育30min后洗板五次,2min/次。加入显色底物100ul/孔,避光37℃避光孵育15min。加入终止液100μL/孔,混匀后立即通过酶标仪测量OD450值。绘制标准曲线,然后计算出样品中的蛋白含量。
(3)结论
采用MTT法,用Zn2+-四氮环配合物(L-Zn)和顺铂(DDP)分别对9种癌细胞A549、NCI-H446、NCI-H1299、Hela、MCF-7、Ketr-3、BGC823、SGC7901和HepG2;1种正常细胞LO2及1种顺铂耐药株癌细胞SGC7901/DDP进行了抗肿瘤活性的初步筛选。将相关数据进行分析并拟合细胞生长曲线(如图7-图17)经计算得出相应的IC50值(见表4)。L-Zn和DDP对不同癌细胞增殖抑制呈现浓度依赖性,随着配合物浓度增高,抑制效应增强。L-Zn对所研究的9种癌细胞具有广谱的抑制作用,从抑制细胞生长曲线可以看出,24h就可以有很好的抑制作用,其对这9种癌细胞的IC50值均小于10μM,均显著小于相同时间下DDP处理的IC50值,说明L-Zn抑制细胞增殖效果比顺铂抑制效果更好,可能对细胞增殖抑制机理也不同。对于顺铂耐药性细胞株SGC7901,L-Zn仍有很好的抑制细胞增殖活性,这或许可以改善化疗过程中顺铂耐药性的问题。L-Zn对正常肝细胞系LO2的抑制活性低于肝癌细胞HepG2细胞,说明该配合物的毒副作用可能比较小。L-Zn的溶解性不好,需要DMSO的助溶,通过溶剂对照实验(图18)表明DMSO含量在0.5%对细胞是低毒的,不影响L-Zn对细胞增殖的抑制作用。肝癌是全世界第二高致死的癌症,虽然外科肝切除仍是严重的肝细胞癌患者的最佳选择,而大多数患者由于肿瘤大小,血管侵袭或肝代谢失调而被拒绝手术,因此,研究化疗药物对治疗肝癌非常重要。通过MTT法检测发现L-Zn对肝癌细胞HepG2细胞有很好的抑制效果,且对正常的肝细胞LO2毒性较低,如L-Zn对HepG2细胞24h的IC50值为6.827±0.209μM,在此浓度下,LO2细胞存活率74%。
表4L-Zn和DDP对不同细胞的IC50值
在实验结束后,处死小鼠,剥离肿瘤后称其重量,顺铂作为阳性对照药,对肿瘤生长有显著的抑制作用,肿瘤显著小于对照组,通过测量计算顺铂对肿瘤的抑制率为55.9%,说明顺铂具有很好的体内抗癌活性同时也说明我们的小鼠肿瘤模型是合适的。L-Zn设置了低、中和高三个浓度梯度,L-Zn对体内肿瘤生长的抑制作用存在剂量依赖性,随着药物浓度的增高,肿瘤生长的抑制作用越显著,从低浓度组21.7%的抑制率,到中浓度组36.1%的抑制率以及高浓度组40.9%的抑制率,说明L-Zn对H22肝癌小鼠模型肿瘤增殖具有很好的抑制作用。
虽然本发明已以较佳实施例公开如上,但实施例和附图并不是用来限定本发明,任何熟悉此技艺者,在不脱离本发明之精神和范围内,自当可作各种变化或润饰,但同样在本发明的保护范围之内。因此本发明的保护范围应当以本申请的权利要求保护范围所界定的为准。
序列表
<110>南京大学
<120>锌-四氮环配合物及其制备方法和在抗肿瘤药物中的应用
<160>8
<210>SEQ ID N0.1
<211>19
<212>DNA
<213>HIF-1α-sense
<400>
agtgtaccct aactagccg 19
<210>SEQ ID N0.2
<211>18
<212>DNA
<213>HIF-1α-antisense
<400>
cacaaatcag caccaagc 18
<210>SEQ ID N0.3
<211>18
<212>DNA
<213>VEGF-sense
<400>
gaaggaggag ggcagaat 18
<210>SEQ ID N0.4
<211>19
<212>DNA
<213>VEGF-antisense
<400>
cacaggatgg cttgaagat 19
<210>SEQ ID N0.5
<211>18
<212>DNA
<213>GLUT-1-sense
<400>
gatgcaggtg ttcaagag 18
<210>SEQ ID N0.6
<211>18
<212>DNA
<213>GLUT-1-antisense
<400>
gaaggctaca aagaccaa 18
<210>SEQ ID N0.7
<211>18
<212>DNA
<213>β-Actin-sense
<400>
gacctgactg actaccta 18
<210>SEQ ID N0.8
<211>19
<212>DNA
<213>β-Actin antisense
<400>
tcttcattgt gctgggtgc 19
- 还没有人留言评论。精彩留言会获得点赞!