改性聚乙二醇/碳酸钙复合材料、其制备方法及应用与流程
本发明属于生物
技术领域:
,尤其涉及一种改性聚乙二醇/碳酸钙复合材料、其制备方法及应用。
背景技术:
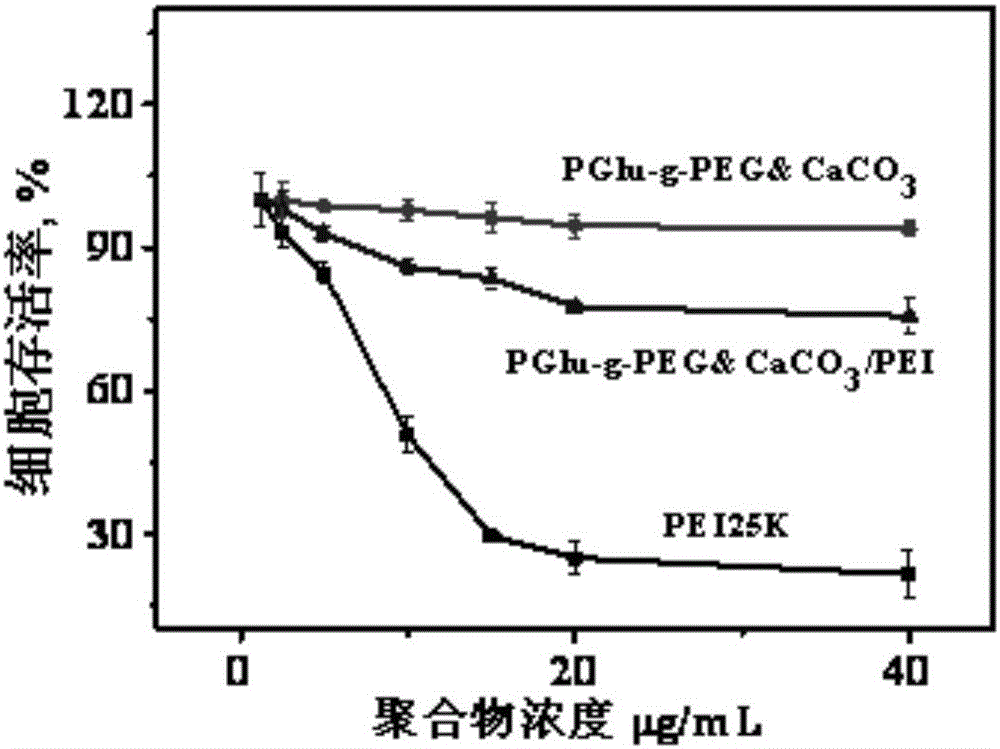
:随着生物科学技术的不断进步,基因治疗将在人类攻克癌症及遗传疾病等顽症的过程中占据重要地位,并将逐步成为一种常见的有效手段(参见JeongJH,KimSW,ParkTG.Park.Moleculardesignoffunctionalpolymersforgenetherapy.Prog.Polym.Sci.2007;32(11):1239-1274.)。基因治疗是指将人的正常基因或有治疗作用的基因通过一定方式导入人体靶细胞以纠正基因的缺陷或者发挥治疗作用,从而达到治疗疾病目的的生物医学新技术。成功的基因治疗依赖于有效的基因载体,常见的载体分为病毒类载体和非病毒载体。病毒类载体包括逆转录病毒、腺病毒(AV)、腺相关病毒(AAV)、单纯疱疹病毒(HSV)、痘苗病毒(VV)等,但是病毒类载体在临床应用中存在着很大的安全隐患,在基因治疗历史上首例患者死亡事件以及著名的法国“气泡婴儿”事件,在很大程度上都是由病毒类基因载体的不安全性造成的。非病毒载体多为高分子阳离子聚合物,因其安全、有效、无免疫原性等优点,已成为病毒类载体最有希望的替代者(参见GodbeyWT,WuKK,MikosAG.Poly(ethylenimine)anditsroleingenedelivery.J.ControlRelease.1999Aug5;60(2-3):149-160.RemyJS,AbdallahB,ZantaMA,BoussifO,BehrJP,DemeneixB.Genetransferwithliposperminesandpolyethylenimines.Adv.DrugDeliver.Rev1998Mar2;30(1-3):85-95.)。其中,阳离子聚合物如聚乙烯亚胺(PEI)是常用的一个非病毒类载体,它已经在体外和体内的转染实验中得到应用,但由于其毒性高、转染效率低、在体内运输过程的非特异性吸附以及没有靶向性的缺点,阻碍了它的进一步发展(参见LungwitzU,BreunigM,BlunkT,GopferichA.Polyethylenimine-basednon-viralgenedeliverysystems.Eur.J.Pharm.Biopharm2005;60(2):247-266.)。理想的基因治疗过程是,载有质粒DNA的基因载体在血液中循环,到达肿瘤组织后被肿瘤细胞内吞并完成转染治疗。但实际过程中有很多因素阻碍了载体体系到达肿瘤组织。首先血液中含有很多带负电的蛋白类物质,可与带正电的载体体系吸附凝聚成大颗粒沉淀或被清除掉(参见Liu,Y.,andReineke,T.M.Poly(glycoamidoamine)sforgenedelivery.Structuraleffectsoncellularinternalization,bufferingcapacity,andgeneexpression.BioconjugateChem.2007;18,19-30.);其次,由于正常体液环境中,细胞表面带负电荷,带正电的载体体系也容易接近正常细胞,被正常细胞内吞,细胞内吞阳离子复合物颗粒的重要机理就是首先通过静电作用吸附复合物颗粒,然后复合物颗粒进入细胞。这些都最终影响了转染效率,因此开发体内应用的基因载体,就要增加基因载体体系进入目标组织细胞的效率,降低其被非目标组织吸附的几率。为了提高基因载体体系进入目标组织细胞的效率,常用的方法是引入生物相容性的聚乙二醇(PEG)来降低在血液运输过程中的非特异性吸附。然而单纯的遮蔽体系会影响载体体系与细胞的结合效率,从而降低细胞转染效率。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供一种改性聚乙二醇/碳酸钙复合材料、其制备方法及应用,该改性聚乙二醇/碳酸钙复合材料可作为遮蔽体系降低血液运输过程中的非特异性吸附。本发明提供了一种改性聚乙二醇/碳酸钙复合材料,包括改性聚乙二醇与生长在改性聚乙二醇上的纳米碳酸钙;所述改性聚乙二醇由聚乙二醇接枝聚合物得到;所述聚合物为聚氨基酸和/或聚丙烯酸。优选的,所述聚乙二醇的分子量为5000~30000。优选的,所述聚乙二醇与聚合物的摩尔比为(3~10):1。优选的,所述聚氨基酸为聚谷氨酸和/或聚天冬氨酸。本发明还提供了一种改性聚乙二醇/碳酸钙复合材料的制备方法,包括以下步骤:将改性聚乙二醇与可溶性钙盐在水中混合,然后加入可溶性碳酸盐混合搅拌,离心后将上层溶液透析,冷冻干燥后得到改性聚乙二醇/碳酸钙复合材料;所述改性聚乙二醇由聚乙二醇接枝聚合物得到;所述聚合物为聚氨基酸和/或聚丙烯酸。优选的,所述可溶性钙盐为氯化钙;所述可溶性碳酸盐为碱金属碳酸盐。优选的,所述改性聚乙二醇与可溶性钙盐的摩尔比为1:(20~100)。优选的,所述混合搅拌的时间为8~20h。本发明还提供了上述改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料的应用。优选的,所述基因载体为聚乙烯亚胺。本发明提供了一种改性聚乙二醇/碳酸钙复合材料、其制备方法及应用,该改性聚乙二醇/碳酸钙复合材料包括改性聚乙二醇与生长在改性聚乙二醇上的纳米碳酸钙;所述改性聚乙二醇由聚乙二醇接枝聚氨基酸和/或聚丙烯酸得到。与现有技术相比,本发明以改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料,其不仅可降低血液运输过程中的非特异性吸附还可有效提高基因载体对基因物质的传输能力,进而提高了基因载体的细胞转染效率,同时该复合材料还具有较好的生物相容性。附图说明图1为本发明实施例1中得到的改性聚乙二醇/碳酸钙复合材料的扫描电镜照片;图2为本发明实施例1中得到的改性聚乙二醇/碳酸钙复合材料的细胞毒性实验结果曲线图。具体实施方式下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明提供了一种改性聚乙二醇/碳酸钙复合材料,包括改性聚乙二醇与生长在改性聚乙二醇上的纳米碳酸钙;所述改性聚乙二醇由聚乙二醇接枝聚氨基酸和/或聚丙烯酸得到。按照本发明,所述改性聚乙二醇由聚乙二醇接枝聚氨基酸和/或聚丙烯酸得到;所述聚乙二醇为本领域技术人员熟知的聚乙二醇即可,并无特殊的限制,本发明中所述聚乙二醇的分子量优选为5000~30000;所述聚氨基酸为本领域技术人员熟知的聚氨基酸即可,并无特殊的限制,本发明中优选为聚谷氨酸和/或聚天冬氨酸;所述聚氨基酸的分子量优选为5000~50000;所述聚丙烯酸的分子量优选为5000~50000;所述聚乙二醇与接枝物的摩尔比优选为(3~10):1,更优选为(3~9):1;所述接枝物为聚氨基酸和/或聚丙烯酸。本发明提供的复合材料在所述改性聚乙二醇上生长有纳米碳酸钙;所述纳米碳酸钙与改性聚乙二醇的摩尔比优选为(20~100):1,更优选为(40~100):1,再优选为(60~80):1,最优选为80:1。本发明以改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料,其不仅可降低血液运输过程中的非特异性吸附还可有效提高基因载体对基因物质的传输能力,进而提高了基因载体的细胞转染效率,同时该复合材料还具有较好的生物相容性。本发明还提供了一种上述改性聚乙二醇/碳酸钙复合材料的制备方法,包括以下步骤:将改性聚乙二醇与可溶性钙盐在水中混合,然后加入可溶性碳酸盐混合搅拌,离心后将上层溶液透析,冷冻干燥后得到改性聚乙二醇/碳酸钙复合材料;所述改性聚乙二醇由聚乙二醇接枝聚合物得到;所述聚合物为聚氨基酸和/或聚丙烯酸。其中,所述聚乙二醇与聚合物均同上所述,在此不再赘述。按照本发明,优选将改性聚乙二醇溶于水中,并调节pH值至弱碱性,更优选调节pH值为7.5~8.5,再优选调节pH值为8;所述改性聚乙二醇与水的质量体积比优选为5~30毫克/毫升,更优选为10~20毫克/毫升,再优选为10毫克/毫升。调节pH值后优选搅拌10~40min,更优选搅拌20~30min,再优选搅拌20min,再加入可溶性钙盐;所述可溶性钙盐为本领域技术人员熟知的可溶于水的钙盐即可,并无特殊的限制,本发明中优选为氯化钙;所述改性聚乙二醇与可溶性钙盐的摩尔比优选为1:(20~100),更优选为1:(40~100),再优选为1:(60~80),最优选为1:80。加入可溶性钙盐后,优选混合搅拌20~50min,更优选混合搅拌25~40min,再优选混合搅拌30~35min,最优选混合搅拌30min,然后加入可溶性碳酸盐;所述可溶性碳酸盐为本领域技术人员熟知的水溶性碳酸盐即可,并无特殊的限制,本发明中优选为碱金属碳酸盐,更优选为碳酸钠;所述可溶性碳酸钠与可溶性钙盐的摩尔比优选为1:1;所述可溶性碳酸盐优选以溶液的形式缓慢滴加,边滴加边搅拌;所述滴加的速度优选为2毫升/分钟。加入可溶性碳酸盐后,混合搅拌;所述混合搅拌的时间优选为8~20h,更优选为10~16h,再优选为12~14h,最优选为12h。混合搅拌后离心;所述离心的速率优选为6000~8000转/分;所述离心的时间优选为2~10min,更优选为3~8min,再优选为4~6min,最优选为5min。离心后,取上层溶液透析;所述透析的时间优选为40~120h,更优选为50~100h,再优选为60~90h,再优选为70~80h,最优选为72h;透析期间,优选换水4~6次。透析结束后,冷冻干燥,得到改性聚乙二醇/碳酸钙复合材料。本发明还提供了一种上述的改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料的应用;其中所述基因载体为本领域技术人员熟知的基因载体即可,并无特殊的限制,本发明中优选为聚乙烯亚胺;所述改性聚乙二醇/碳酸钙复合材料与基因载体的质量比优选为1:(0.5~5),更优选为1:(0.5~3),再优选为1:(1~2),最优选为1:1。按照本发明,所述改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料,可用于遮蔽基因载体与质粒DNA体系,作为质粒DNA的载体体系;此时,所述改性聚乙二醇/碳酸钙复合材料与质粒DNA的质量比优选为(10~1):1,更优选为(5~1):1,再优选为(3~2):1,最优选为2.5:1;所述改性聚乙二醇/碳酸钙复合材料作为质粒DNA的载体体系可适用于目前各种细胞系,如HeLa,293T,293F,293S,BE(2)C,CHO,CHO-S,COS7,COS-7L,CV-1,HEK-293,HT-1080,MDCK,NIH-3T3,SKBR3,Vero等细胞系;其作为质粒DNA的载体体系时的用法为本领域技术人员熟知的用法即可,并无特殊的限制,本发明中优选按照以下步骤进行:1)细胞培养;所述细胞培养的方法为本领域技术人员熟知的方法即可,并无特殊的限制,本发明中优选将细胞置于胎牛血清的培养液中进行培养;所述培养液中胎牛血清的体积分数优选为10%;所述培养条件优选为37℃含体积分数为5%二氧化碳的孵箱中连续培养。2)体外转染;转染前24小时内,取对数生长期细胞,胰酶消化后用达尔伯克改良伊格尔培养基稀释,按每孔1×104细胞的密度接种于96孔培养板,置于37℃含体积分数为5%二氧化碳的孵箱中继续培养至汇合度达到80%~90%;转染时,吸弃前一天加注的细胞培养板中的培养液,用磷酸盐缓冲液洗涤两次后,改性聚乙二醇/碳酸钙复合材料、基因载体与质粒DNA以及含有体积分数为10%胎牛血清的达尔伯克改良伊格尔培养基(改性聚乙二醇/碳酸钙复合材料、基因载体与质粒DNA混合物的体积应不超过培养液体积的1/10)混合至终体积200μL,继续培养24小时。3)体外转染效率的测定:a)绿色荧光蛋白(GFP)表达:用荧光显微镜观察绿色荧光蛋白信号。阳性细胞发出明亮的绿色荧光,而阴性细胞则无。用流式细胞仪检测阳性细胞的百分率。b)荧光素酶活性检测:取出培养板,吸去培养液,用磷酸盐缓冲液洗涤2次,加入细胞裂解液裂解,然后加入荧光素酶底物,用照度计测定转染效率。c)β-半乳糖苷酶染色:细胞用0.01mol/L的PBS洗涤,用0.4%多聚甲醛固定5min,PBS冲洗后加入5-溴-4-氢-3-吲哚-β-D-半乳糖苷(X-gal)染色液(配方为0.04%X-gal,5mmol/L亚铁氰化钾,5mmol/L高铁氰化钾和2mmol/LMgCl2),放置37℃,5%CO2孵育3h。阳性细胞呈深蓝色,计算阳性细胞的百分率。4)细胞毒性测试:采用噻唑蓝比色法比较评价基因载体材料的细胞毒性。实验前24小时内,取对数生长期细胞,胰酶消化后用达尔伯克改良伊格尔培养基稀释,按每孔1×104细胞的密度接种于96孔培养板,置于37℃含体积分数为5%二氧化碳的孵箱中继续培养至汇合度达到80%~90%。将不同浓度的材料与细胞共同培养24小时后,每孔分别加入20μl含质量分数为0.5%噻唑蓝的磷酸盐缓冲液。混合物在37℃继续作用4小时,加入200μl二甲基亚砜溶解噻唑蓝甲臢结晶10分钟。然后用酶标仪测试每孔的吸收,测试波长选用492nm。细胞存活率按下公式计算:细胞存活率(%)=(Asample/Acontrol)×100Asample是转染后的细胞样品孔的吸收,Acontrol是不与改性聚乙二醇/碳酸钙复合材料、基因载体与质粒DNA混合物作用的细胞样品孔的吸收,每组实验重复三次。按照本发明,所述改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料可用于遮蔽基因载体与质粒siRNA体系,作为质粒siRNA的载体体系;此时,所述改性聚乙二醇/碳酸钙复合材料与质粒siRNA的质量比优选为(10~1):1,更优选为(5~1):1,再优选为(3~2):1,最优选为2.5:1;所述改性聚乙二醇/碳酸钙复合材料作为质粒siRNA载体可适用于目前各种细胞系,如HeLa,293T,293F,293S,BE(2)C,CHO,CHO-S,COS7,COS-7L,CV-1,HEK-293,HT-1080,MDCK,NIH-3T3,SKBR3,Vero等细胞系;所述作为载体时转染的方法为本领域技术人员熟知的方法即可,本发明中优选按照以下步骤进行:1)用常规方法合成siRNA:所述的siRNA为本领域技术人员熟知的siRNA即可,并无特殊的限制,在本发明实施例中优选以沉默荧光素酶的LucsiRNA为例,其序列为5′-CUUACGCUGAGUACUUCGAdTdT-3′。2)细胞的培养:细胞置于含体积分数为10%胎牛血清的培养液中,在37℃含体积分数为5%二氧化碳的孵箱中连续培养。3)体外转染转染前24小时内,取对数生长期细胞,胰酶消化后用达尔伯克改良伊格尔培养基稀释,按每孔1×104细胞的密度接种于96孔培养板,置于37℃含体积分数为5%二氧化碳的孵箱中继续培养至汇合度达到80%~90%。转染时,吸弃前一天加注的细胞培养板中的培养液,用磷酸盐缓冲液洗涤两次后,加入改性聚乙二醇/碳酸钙复合材料、基因载体与质粒siRNA混合物以及含有体积分数为10%胎牛血清的达尔伯克改良伊格尔培养基(改性聚乙烯亚胺与质粒siRNA混合物的体积应不超过培养液体积的1/10)至终体积200μL,继续培养24小时。4)体外转染效率的测定取出培养板,吸去培养液,用磷酸盐缓冲液洗涤2次,加入细胞裂解液裂解,然后加入荧光素酶底物,用照度计测定转染效率。按照本发明,所述改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料,可用于pDNA转染。其中,所述改性聚乙二醇/碳酸钙复合材料与基因的质量比优选为(10~1):1,更优选为(5~1):1,再优选为(3~2):1,最优选为2.5:1;所述体内pDNA转染的方法为本领域技术人员熟知的方法即可,并无特殊的限制,本发明中优选按照以下步骤进行:1)CT26细胞的培养取小鼠结肠癌CT26细胞,在含有10%(质量/体积百分数)的牛血清的培养液中,在含5%(体积百分数)CO2、温度为37℃的孵箱中培养。2)肿瘤接种购买重量在20g的Balb/C小鼠,肿瘤接种前,取对数生长期的CT26细胞,胰酶消化后用DMEM中和胰酶,1×103转/min离心5min,PBS洗涤三次后,用PBS重悬细胞,按每只小鼠2×106细胞的密度接种于腋下,10天后,瘤径长大至10mm时进行体内转染。3)体内转染基因组转染的复合物颗粒(改性聚乙二醇/碳酸钙复合材料、基因载体与转染基因混合物)在含有5%(质量/体积百分数)的葡萄糖溶液(复合物颗粒的体积所占总体积的比例应低于10%)中至终体积0.5mL,尾静脉注射。4)体内转染效率的测定体内转染48h后,处死小鼠,取出肿瘤,PBS洗涤2次,加入裂解液裂解,匀浆,然后加入荧光素底物,测定转染效率。按照本发明,所述改性聚乙二醇/碳酸钙复合材料作为基因载体遮蔽材料,还可用于体内siRNA转染。其中,所述改性聚乙二醇/碳酸钙复合材料与基因的质量比优选为(10~1):1,更优选为(5~1):1,再优选为(3~2):1,最优选为2.5:1;所述体内siRNA转染的方法为本领域技术人员熟知的方法即可,并无特殊的限制,本发明中优选按照以下步骤进行:1)CT26细胞的培养取小鼠结肠癌CT26细胞,在含有10%(质量/体积百分数)的牛血清的培养液中,在含5%(体积百分数)CO2、温度为37℃的孵箱中培养。2)肿瘤接种购买重量在20g的Balb/C小鼠,肿瘤接种前,取对数生长期的CT26细胞,胰酶消化后用DMEM中和胰酶,1×103转/min离心5min,PBS洗涤三次后,用PBS重悬细胞,按每只小鼠2×106细胞的密度接种于腋下,8天后,瘤径长大至7mm时进行体内siRNA的转染。3)体内转染基因物质选用沉默血管内皮生长因子的VEGFsiRNA,通过抑制VEGF的表达实现抑制肿瘤生长的目的,基因组转染的复合物颗粒(改性聚乙二醇/碳酸钙复合材料、基因载体与转染基因混合物)在含有5%(质量/体积百分数)的葡萄糖溶液中至终体积50μL,尾静脉注射给药。4)体内肿瘤生长的测定从第一次给药开始测量瘤径大小,实验共14天。本发明提供的改性聚乙二醇/碳酸钙复合材料用于提高聚乙烯亚胺的基因转染效率并做为阳离子载体的遮蔽材料,一方面增加生物相容性,另一方面提高阳离子载体的细胞转染效率,其是新型载体遮蔽材料。以商业化分子量为25000Da的聚乙烯亚胺(PEI25K)为例,PEI25K在细胞水平有较高的转染效率,但用于体内动物实验,容易与血液中负电物质结合,降低其转染效率。引入遮蔽体系PGlu-g-PEG(聚谷氨酸接枝改性的聚乙二醇,PEG可以有效防止PEI与血液中负电物质作用)可以降低体PEI体内应用时的负面作用,然而PEG会严重影响载体的转染效率。采用PGlu-g-PEG&CaCO3(聚谷氨酸接枝改性的聚乙二醇/碳酸钙复合材料)作为遮蔽,可以有效克服PEG对转染带来的负面影响,并提高原有载体的转染效率。如在同等条件下对HeLa和MCF7细胞介导荧光素酶质粒的转染时,PGlu-g-PEG&CaCO3遮蔽PEI(pDNA/PEI/PGlu-g-PEG&CaCO3)的转染效率是pDNA/PEI的5~7倍,是pDNA/PEI/PGlu-g-PEG的1000~2000倍。在最佳转染比例范围内,pDNA/PEI/PGlu-g-PEG&CaCO3可以有效降低细胞毒性,细胞存活率在90%以上;其基因沉默效率高,对恒定表达荧光素酶的Huh7以及CT26细胞的最高基因沉默效率均可达到80%以上,该复合体系相对于商业转染试剂PEI25K有较高基因沉默效率和较小的细胞毒性,并适合于体内应用,有广泛的应用前景。为了进一步说明本发明,以下结合实施例对本发明提供的一种改性聚乙二醇/碳酸钙复合材料、其制备方法及应用进行详细描述。以下实施例中所用的试剂均为市售。实施例1改性聚乙二醇/碳酸钙复合材料(PGlu-g-PEG&CaCO3)的制备室温,一定量聚谷氨酸接枝聚乙二醇(PGlu-PEG)溶解于去离子水中,并调节pH值至8.0,搅拌20分钟;向PGlu-PEG溶液中加入一定量溶解好的氯化钙,搅拌30分钟;然后将一定量碳酸钠溶液缓慢滴加到上述溶液中,边加边搅,加完再搅拌12小时。把反应完的溶液转入离心管6000~8000转/分,离心5分钟,取上层溶液转入透析带透析72小时,期间换水4~6次,冷冻干燥,得到PGlu-g-PEG&CaCO3。PGlu-g-PEG的组成及其与碳酸钙(CaCO3)的摩尔比对应关系列于表1。作为对比相应的PGlu-g-PEG的组成对应关系列于表2。利用扫描电子显微镜对实施例1中得到的改性聚乙二醇/碳酸钙复合材料PGlu-g-PEG&CaCO3进行分析,得到其扫描电镜照片,如图1所示。表1原料的摩尔比对应关系产品编号PGlu-PEG、氯化钙与碳酸钠的摩尔比例PGlu、PEG及CaCO3的摩尔比例PPCa11:80:801:3:80PPCa21:80:801:6:80PPCa31:80:801:9:80表2PGlu-g-PEG的组成产品编号PGlu、PEG的摩尔比例PP11:3:PP21:6:PP31:9:实施例2以HeLa细胞为例,利用PGlu-g-PEG&CaCO3、PEI载体体系介导pGL3(荧光素酶质粒)、pEGFPN1(绿色荧光蛋白质粒)、pCMV-lacZ(β-半乳糖苷酶质粒)对HeLa细胞的体外转染HeLa细胞的培养(1)取人宫颈癌细胞(HeLa细胞),在含有10%小牛血清的培养液中连续培养(5%CO2、37℃孵箱)。(2)体外转染转染前24小时内,取对数生长期细胞,胰酶消化后用达尔伯克改良伊格尔培养基稀释,按每孔1×104细胞的密度接种于96孔培养板,置于37℃含体积分数为5%二氧化碳的孵箱中继续培养至汇合度达到80~90%。转染时,吸弃前一天加注的细胞培养板中的培养液,用磷酸盐缓冲液洗涤两次后,基因组转染的复合物颗粒(PGlu-g-PEG&CaCO3、PEI载体体系与质粒混合物)以及含有体积分数为10%胎牛血清的达尔伯克改良伊格尔培养基至终体积200μL,继续培养24小时。(3)体外转染效率的测定取出培养板,吸去培养液,PBS洗涤2次,加入裂解液裂解,然后加入荧光素底物,用光度计测定转染效率。表3给出了荧光素酶质粒的复合物的组成及其转染效率。绿色荧光蛋白(GFP)表达用荧光显微镜观察绿色荧光蛋白信号。阳性细胞发出明亮的绿色荧光,而阴性细胞则无。用流式细胞仪检测阳性细胞的百分率。表4给出了绿色荧光蛋白质粒的复合物的组成及其转染效率。β-半乳糖苷酶染色细胞用0.01mol/L的PBS洗涤,用0.4%多聚甲醛固定5min,PBS冲洗后加入5-溴-4-氢-3-吲哚-β-D-半乳糖苷(X-gal)染色液(配方为0.04%X-gal,5mmol/L亚铁氰化钾,5mmol/L高铁氰化钾和2mmol/LMgCl2),放置于37℃,5%CO2孵育3h。阳性细胞呈深蓝色,计算阳性细胞的百分率。表5给出了β-半乳糖苷酶质粒的复合物的组成及其转染效率。表3荧光素酶质粒的体外转染效率其中P25K为商业化分子量为25000Da的聚乙烯亚胺;载体为聚乙烯亚胺。表4绿色荧光蛋白质粒的体外转染效率表5β-半乳糖苷酶质粒的体外转染效率4)细胞毒性测试:采用噻唑蓝比色法比较评价基因载体材料的细胞毒性。细胞毒性测试结果如图2所示,其中,PEI25K为商业化分子量为25000Da的聚乙烯亚胺;PGlu-g-PEG&CaCO3中PGlu-g-PEG与CaCO3的摩尔比为1:80;PGlu-g-PEG&CaCO3/PEI中PGlu-g-PEG&CaCO3与PEI的质量比为1:1。实施例3以Huh7细胞为例,利用PGlu-g-PEG&CaCO3、PEI载体体系介导沉默荧光素酶的LucsiRNA在Huh7细胞系中的转染(1)Huh7细胞的培养:取Huh7细胞,在含有10%小牛血清的培养液中连续培养(5%CO2、37℃孵箱)。(2)体外转染转染前24小时内,取对数生长期细胞,胰酶消化后用达尔伯克改良伊格尔培养基稀释,按每孔1×104细胞的密度接种于96孔培养板,置于37℃含体积分数为5%二氧化碳的孵箱中继续培养至汇合度达到80~90%。转染时,吸弃前一天加注的细胞培养板中的培养液,用磷酸盐缓冲液洗涤两次后,基因组转染的复合物颗粒以及含有体积分数为10%胎牛血清的达尔伯克改良伊格尔培养基至终体积200μL,继续培养24小时。(3)体外转染效率的测定取出培养板,吸去培养液,PBS洗涤2次,加入裂解液裂解,然后加入荧光素底物,用光度计测定转染效率。表6给出了荧光素酶沉默效率。表6LucsiRNA体外转染效率实施例4以MCF7细胞为例,PGlu-g-PEG&CaCO3、PEI载体体系在体内pDNA转染中的应用(1)MCF7细胞的培养取MCF7细胞,在含有10%(质量/体积百分数)的牛血清的培养液中,在含5%(体积百分数)CO2、温度为37℃的孵箱中培养;(2)肿瘤接种购买重量在20g的Balb/C小鼠,肿瘤接种前,取对数生长期的MCF7细胞,胰酶消化后用DMEM中和胰酶,1×103转/min离心5min,PBS洗涤三次后,用PBS重悬细胞,按每只小鼠2×106细胞的密度接种于腋下,10天后,瘤径长大至直径10mm时进行体内转染。(3)体内转染基因组转染的复合物颗粒在含有5%(质量/体积百分数)的葡萄糖溶液中至终体积0.5mL,尾静脉注射。(4)体内转染效率的测定体内转染48h后,处死小鼠,取出肿瘤,PBS洗涤2次,加入裂解液裂解,匀浆,然后加入荧光素底物,测定转染效率。表7给出了体内实验荧光素酶质粒的复合物的转染效率。表7荧光素酶质粒体内转染效率实施例5以CT26细胞为例,PGlu-g-PEG&CaCO3、PEI载体体系在体内siRNA转染中的应用(1)CT26细胞的培养取小鼠结肠癌CT26细胞,在含有10%(质量/体积百分数)的牛血清的培养液中,在含5%(体积百分数)CO2、温度为37℃的孵箱中培养。(2)肿瘤接种购买重量在20g的Balb/C小鼠,肿瘤接种前,取对数生长期的CT26细胞,胰酶消化后用DMEM中和胰酶,1×103转/min离心5min,PBS洗涤三次后,用PBS重悬细胞,按每只小鼠2×106细胞的密度接种于腋下,8天后,瘤径长大至7mm时进行体内siRNA的转染。(3)体内转染基因物质选用沉默血管内皮生长因子的VEGFsiRNA,通过抑制VEGF的表达实现抑制肿瘤生长的目的,基因组转染的复合物颗粒在含有5%(质量/体积百分数)的葡萄糖溶液中至终体积50μL,尾静脉注射给药。(4)体内肿瘤生长的测定从第一次给药开始测量瘤径大小,实验共14天。表8给出了体内实验VEGFsiRNA的复合物对肿瘤抑制14天后的瘤径。表8VEGFsiRNA体内转染后瘤径大小本发明提供的PGlu-g-PEG&CaCO3作为遮蔽体系遮蔽PEI,转染效率高,其在同等条件下对HeLa细胞介导荧光素酶质粒的转染效率最高为商业化PEI25K的5~7倍,在最佳转染比例范围内,细胞存活率在90%以上;其基因沉默效率高,对恒定表达荧光素酶的Huh7细胞的最高基因沉默效率为82.5%,该聚合物相对于商业转染试剂PEI25K有较高基因沉默效率和较小的细胞毒性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1