从生物组织分离细胞的方法和设备与流程
本发明涉及从生物组织分离细胞的方法和设备。本发明尤其涉及通过以下方式来从生物组织分离活的目标细胞的方法:通过一系列中空针将适当的释放试剂递送入生物组织中,由此从组织基本结构释放目标细胞。
背景技术:
难以从组织中将强烈地相互连接以形成生物组织的细胞(像上皮细胞)分离成单个的活细胞。虽然有可能机械破坏生物组织的基本结构,并从所得的碎片中分离单细胞,但是,如此获得的未受伤害的活细胞的得率相当低。
已知以更温和的灌注方法从器官分离细胞,但是这需要用一连串缓冲溶液,通过适当的血管对器官进行麻烦的灌注。已知此类方法用于分离心肌细胞或肝细胞等。
分离无损伤的肝细胞的程序由Howard和Pesch (1967) J Cell Biol 35, 675-684首先提出,并由Berry和Friend (1969) J Cell Biol 43, 506-520; Seglen (1976) Methods Cell Biol. 13, 29-34 和Klaunig (1981) In Vitro 17, 913-925改进。成果是两阶段的灌注规程,其在几十年后仍然代表目前的标准程序,获得大量有活力的肝细胞。通常,环绕靠近肝脏的适当的血管(大鼠:门静脉;小鼠:腔静脉)放置一根松的结扎线,将插管插入该血管,并通过收紧线头(thread ends)来固定结扎线。首先,以约10-15ml/min 的流速持续10-15min通过血管将含有EDTA或EGTA的耗钙缓冲液递送入器官,以便削弱依赖钙的细胞-细胞连接并除去血细胞。其次,以约10-15ml/min的流速经由血管引导包含胶原酶(处于每毫升约0.1 Wünsch单位)的缓冲液通过该器官(大鼠:10-15min;小鼠:5-10min),用来破坏结缔组织,进一步释放细胞而不损害目标细胞。现在可以将肝脏从动物移除,并放置在培养皿上的适当介质中。撕开肝包膜导致游离(liberated)肝细胞的释放,经由过滤通过100µm尼龙过滤筛(mesh filter)以及(任选重复的)低旋转离心步骤(5min 50g于4℃)来进一步纯化所述肝细胞,以富集肝细胞。
一种类似的但离体的方法用于从更大型的脊椎动物的肝脏分离肝细胞,且/或用于分离成体心肌细胞。在这些应用中,在将插管插入血管之前切除目标器官。
关于人肝细胞的产生,参见Gomez-Lechon和Castell的综述(“Isolation and cultre of human hepatocytes” in Berry and Edwards, The Hepatocyte Review, (2000), 11-15)。尽可能快地将组织放在冰上并检查大血管。将插管插入切口表面的最大血管中并用组织胶固定。在第一步骤中,以约10ml/导管(的量),用含有EGTA (或 EDTA) 的耗钙缓冲液广泛灌注肝组织。在第二步骤中,以相同的流速,用约0.2 U/ml 的含胶原酶的酶混合物对该组织进行灌注,直到其显示不可逆的变形。通常,使酶缓冲液再循环,以减少成本。消化后,用抹刀轻轻分散肝组织。类似于啮齿动物程序,过滤细胞悬浮液,并通过(任选重复的)低旋转离心来富集肝细胞。
通过所谓的Langendorff灌注系统来产生心肌细胞。从身体快速切除心脏,并且在显微镜下仔细地将插管插入主动脉,并用结扎线固定。然后,用无钙缓冲液灌注心脏,以阻止收缩,随后用基于胶原酶的酶溶液灌注,以消化心脏的细胞外基质。消化后,用镊子机械解离心脏,并将心肌细胞分散成单细胞悬浮液。
通过在气管中插入并固定插管,并应用适当的缓冲液和酶,以类似的程序分离肺泡上皮细胞。
公开了通过组织片段的研磨提取来溶解组织的设备。通过真空将该设备固定在组织上,用研磨组件从该组织上切下细胞并通过适当的酶进行进一步溶解。
总之,从生物组织分离细胞的已知方法是复杂的、耗时的并且总是由技术人员来执行。
在另一技术领域中,已知通过多个插管将药理活性化合物注射入组织(像皮肤)。可按具有共同输入腔的阵列来装配插管,例如US6689103、US8349554B2、US8366677B2、US8708965B2、US2011/0213335A1、WO2014/047287A1或 EP2749306中所公开的。这些出版物都没有涉及解离组织,以产生单细胞。
技术实现要素:
因此,本发明的目的是提供用于从生物组织分离活细胞的设备和方法,其没有将插管插入独特(distinct)的腔或洞(像血管)的冗长乏味且不方便的需求。
惊奇地发现,可以通过包含多个进入生物组织的注射位点的设备来递送从生物组织释放目标细胞的试剂,由此以目标细胞的优良得率和成活力来释放目标细胞作为单细胞悬浮液。
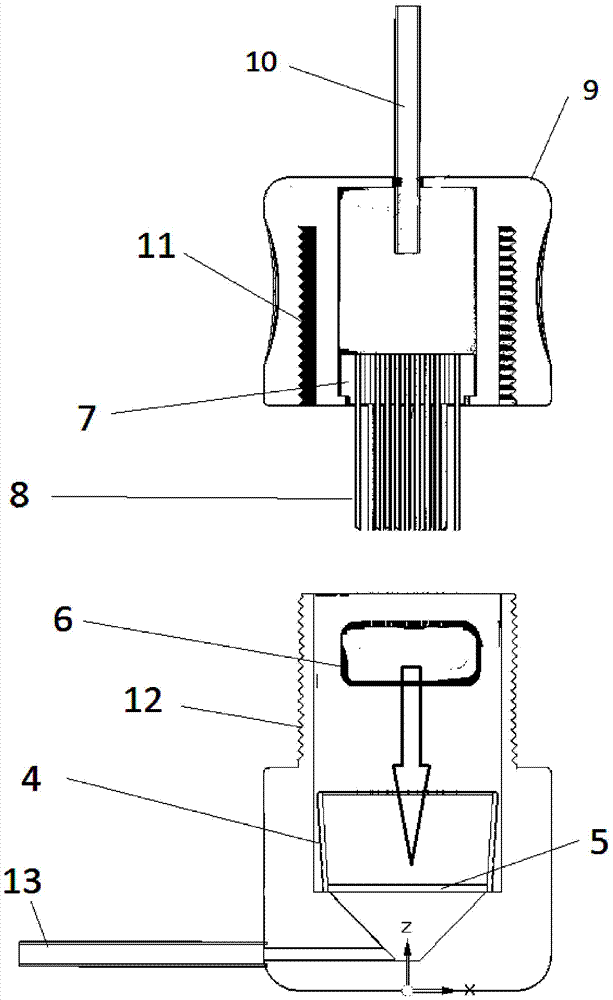
因此,本发明的目的是用于生物组织的灌注设备,其包含外壳,其具有两个部件:第一部件1和第二部件9;用于多个中空穿透(penetration)结构8的支架(holder)7,其中中空穿透结构8具备至少一个孔,所述孔实现通过支架7的流体连通(fluid communication through the holder 7);用于生物组织6的支撑体5;其中用于生物组织6的支撑体5与支架7隔开一定距离而位于外壳中,支架7通过将第一部件1和第二部件9结合来形成外壳,中空穿透结构8贴近(in proximity to)支架7。
通过手工挤压支架连同指向(pointed against)位于支撑体5上的生物组织6的中空穿透结构8,可以使中空穿透结构8至少部分穿透入生物组织6。穿透过程可以手动触发,但是优选通过关闭外壳来触发。对外壳的第一部件和第二部件进行改造(adapted)或配置,以致通过将第一部件1与第二部件9结合来形成外壳,中空穿透结构8可至少部分穿透入生物组织6。
本发明的另一个目的是用所公开的设备使生物组织解聚集的方法,其中通过将第一部件1与第二部件9结合来形成外壳使生物组织至少部分被中空穿透结构8中的至少一个穿透,并且通过中空穿透结构8将至少一种使生物组织解聚集成目标细胞的试剂施用(administered)入生物组织6中。
术语“生物组织解聚集成目标细胞”指其中至少部分破坏细胞结构、细胞聚集物或细胞基质,而不杀死、破坏或溶解目标细胞的任何方法。最好地,作为单个、分离的且活的细胞来获得目标细胞。例如,如果肝脏用作生物组织,那么用本发明的设备将适当的酶施用入肝脏。使肝组织解聚集,以得到不离开肝脏的单个肝细胞。为了收获目标细胞,机械地打开肝脏的上皮细胞片(肝脏的包膜),并且可从剩余组织中洗涤出肝细胞。
附图说明
图1、2、3、4、5、9a和9b显示了本发明的设备的变体,其具有外壳,具有第一部件1和第二部件9,各自具有关闭机构11、12;具有适合外壳的尺寸或外径的过滤笼4和支撑体5;用于多个中空穿透结构8的支架7,其也具有适合外壳的尺寸或外径;中空穿透结构8,其通过支架7流体连通(with fluidic connection through the holder);输入口/输出口11、13。其中附图标记2和3分别表示第一部件1的上端和下端。
图4、5和10进一步显示用于流体的储存腔14和整合的泵15。
图6a和6b显示通过现有技术的灌注技术(采用通过Percoll离心来进一步富集肝细胞)分离的小鼠肝细胞的流式细胞仪分析。
图7a和7b显示通过无灌注步骤的机械/酶促规程(没有通过Percoll离心来进一步富集肝细胞)分离的小鼠肝细胞的流式细胞仪分析。
图8a和8b显示根据本发明制备(采用通过Percoll离心来进一步富集肝细胞)的小鼠肝细胞的流式细胞仪分析。
图9a和9b显示根据本发明制备(采用通过Percoll离心来进一步富集肝细胞)的大鼠肝细胞的流式细胞仪分析。
图10显示具备齿轮泵的设备。
图11a和11b显示根据本发明制备(采用通过Percoll离心来进一步富集心肌细胞)的小鼠心肌细胞的流式细胞仪分析。
图12显示根据本发明获得的心肌细胞的显微镜视图。
具体实施方式
可以对通过本发明的方法和设备获得的细胞进行培养、分析和/或用本领域的技术人员已知的方法移植入患者。
本发明的设备
经由图1至图5中的数个实施方式中的实例来显示本发明的设备。
在一个优选的实施方式中,外壳的第一部件1和第二部件9各自具备相应的关闭机构11、12用于结合这两个部件。
在另一个实施方式中,外壳的第一部件1和/或第二部件9具备至少一个用于输入和/或输出流体的孔10、13。在该实施方式中,中空穿透结构8具备至少一个孔,其实现通过支架7至这些孔10、13中的至少一个流体连通(at least one orifice having fluid communication through the holder (7) to at least one of these orifices (10, 13))。
设备的外壳可以是打开的,以及通过外壳的第一部件和第二部件的相应的关闭机构以优选水密的方式关闭。外壳的第一部件1和第二部件9的相应的关闭机构11、12可以是螺纹件(threads)、卡口座(bayonet mounts)、圆锥形闭合件(cone closings)、扭转闭合件(twist closings)、磁铁或凸露头(bold head),各自能够将第一部件与第二部件联锁或结合,以形成外壳。此外,可将外壳的第一部件和第二部件之一构建为翻盖或铰接盖,在外壳的相应的另一部件上具有适当的关闭机构。
外壳的第一部件和第二部件、关闭机构11、12和支架7可被结合成一个或两个单独的构件,但是也可以被单独地提供。如果外壳的第一部件和第二部件以及一个或两个关闭机构11、12是单独的器件(device),那么它们需要具备诸如孔之类的工具(means),以便在关闭该设备时实现机械结合。将生物组织放置在可被流体穿透的支撑体5上,随后在该支撑体与穿透针(即,支架)之间受压,这导致生物组织至少部分被中空穿透结构8穿透。
当对着组织挤压(pressed against)穿透结构时,支撑体5充当支架7的对应物。为此,可将组织放置在支撑体上并对着穿透结构进行挤压,或者可将组织放置在穿透结构上并对着支撑体进行挤压。
支撑体5可以是外壳(即,第一部件或第二部件)的组成部分,或者可以被插入外壳和从外壳移除。在后一种情况下,支撑体需要具有比外壳小的直径。当针穿透入组织时,支撑体5具有为支架7提供机械对应物的功能。到这种程度,支撑体5的设计不是必需的,且可以以过滤器、筛(mesh)、架子、格栅或甚至具有孔的板的形式来提供(以便防止组织被浸泡在流体中)。
支架7可以被插入外壳和从外壳移除,即,支架7应具有适合主外壳的尺寸或外径。优选地,支架7具有一定的尺寸或外径来以水密方式适合外壳;和/或具备适当的密封,以防止流体(释放试剂)绕过支架/中空穿透结构8。
术语“中空穿透结构”指具有针样形状、圆锥样形状或金字塔样形状的任何伸长的物体,其具备变尖的末端。在下文中,术语“中空穿透结构”与“针”用作同义词。
中空穿透结构和支架可以单独制备或作为一个构件制备。
优选地,中空针8具备当针的开口没有放置于生物组织内时(即,针没有穿透入组织或针穿透通过组织的情况中),停止试剂流过针的工具。
中空穿透结构8可具有基于0.05至5 mm(优选0.2至1 mm,最优选0.3至0.7 mm)的外径,独立地具有基于0.02至4 mm(优选0.1至1 mm,最优选0.1至0.6 mm)的内径,且独立地具有1至100 mm(优选2至20 mm,最优选4至5 mm)的长度。
中空穿透结构8的数量取决于生物组织的尺寸,并可以在2个和500个之间(优选5个和100个之间,最优选20个和70个之间)变化。中空穿透结构8可以按任何几何形状或阵列布置在支架上,并且可以具有相同的长度或不同的长度。支架可以不被机械地固定在主外壳中。这实现了取决于生物组织的尺寸和厚度来使用不同支架,所述不同支架具有不同数量的中空穿透结构8和/或不同长度的中空穿透结构8和/或支架上的不同几何形状或阵列的中空针。
取决于生物组织的尺寸、厚度和外部形状,可以选择中空穿透结构8的数量、长度、外径/内径和面积,以达到最大的穿透效果。
本发明的设备(即,包含第一部件和第二部件的外壳、支架7和中空穿透结构8)可以由相同的材料或不同的材料生产,所述材料像不锈钢、聚丙烯酰胺、聚苯乙烯、聚烯烃(像聚乙烯和聚丙烯)、聚碳酸酯、聚甲醛、聚甲基丙烯酸甲酯、聚乳酸或聚酰胺。
可以通过本领域技术人员已知的任何方法来制造本发明的设备。优选的方法是注射成型和3D打印,例如通过挤出沉积、熔融沉积成型、立体平版印刷或感光聚合物数字光处理来实现。
根据本发明的灌注设备具有以下优点:只有与生物组织具有机械接触的部件(即,用于多个中空针的支架和支撑体)是单次使用的一次性物品,然而主外壳和盖在适当的清洁后可使用多次。在本发明的一种变体中,提供一次性的设备。
根据本发明的灌注设备可以手工使用(即,用注射器和适当的容器),但也可以在包含一个或更多个泵和管道组的自动化环境中使用。
在另一个实施方式中,该设备具备至少一个泵,像图10中显示的齿轮泵。泵可以直接与外壳的输入孔/输出孔连接,或者可以具备过滤器系统或检测设备,以监测细胞的释放过程。可以将泵整合在外壳中(在外壳的第一部件中或者在外壳的第二部件中),或者可以在外部提供泵,并用适当的管道组将其与设备连接。鉴于生物组织,泵的位置不重要。可以由内部马达或外部马达来驱动泵。如果将泵整合到外壳的第一部件或第二部件中,那么优选通过如针对支架7所公开的3D打印制造方法来制造泵和外壳。
本发明的方法
本发明的方法的特征在于生物组织至少部分被多个中空穿透结构8穿透。如本文中所使用的术语“穿透”表示将针放置入生物组织中,以便将释放试剂施用入生物组织中。不希望使针刺穿或戳穿生物组织,因为释放试剂则不会进入或不会充分进入生物组织,以释放目标细胞。在本发明的方法中应当心的是,使大多数的针放置于生物组织内并且不刺穿或戳穿生物组织。最好地,以生物组织的厚度的30-70%(优选大约50%)将所有的针放置入生物组织中。
在本发明的方法中,在可被流体穿透的支撑体5和针之间挤压生物组织,这导致针至少部分穿透入生物组织中。支撑体5可以是例如过滤笼4(例如由Miltenyi Biotec GmbH商品化的“Smart Strainer”过滤笼)的过滤区域。
在根据本发明的方法的一个实施方式中,通过以下方式使多个中空针穿透生物组织:将生物组织放置在支撑体(例如为如已公开的设备的过滤笼的筛)上,关闭具有盖的主外壳,通过所述盖的至少一个孔施用至少一种试剂,以使生物组织解聚集,并且从在主外壳的另一端(优选较低端)的至少一个孔收集流过液(flow-through)。
在本发明的一个变体中,以一定量将至少一种试剂施用入生物组织中,以致从生物组织漏出过量体积的释放试剂,并且将所述过量体积的试剂再次施用入生物组织中。术语“过量体积”表示相比于生物组织的体积,施用大得多的体积的试剂,没有被生物组织吸收的试剂体积漏出。该实施方式可包括以第一新鲜流施用试剂,所述第一新鲜流或者作为恒定的漏出流或者逐批再循环进入生物组织。
漏出流可能已经含有目标细胞。在该变体中,可在一次或更多次循环之后收集漏出流作为细胞悬浮液。
可将本发明的方法应用于各种各样的生物组织。然而,取决于生物组织的制备和宏观性质,通过施用试剂使目标细胞从生物组织的细胞基本结构分解,但是不能从生物组织上释放/提取并且/或离开生物组织。如果生物组织的外部结构仍未受损或者如果生物组织具备包膜(例如上皮细胞片),则可能发生这种情况。从此类生物组织提取目标细胞需要机械打开此包膜。
在本发明的另一个实施方式中,在将至少一种释放试剂施用入生物组织之后,机械打开生物组织并从生物组织提取目标细胞。在该实施方式的变体中,通过经由适当的工具手工切割、刺穿或破裂生物组织来机械打开该生物组织。在优选的变体中,本发明的设备具备用于机械打开生物组织的工具,例如采用构建在主外壳、过滤笼或用于中空针的支撑体中的切割器件。在另一个变体中,中空穿透结构用作切割器件,例如通过对着组织旋转支架。
该方法可以包括额外的步骤,以在施用至少一种试剂来使生物组织解聚集之前除去不需要的“非目标细胞”,例如血细胞。在该步骤中,通过将至少一种洗涤液施用入生物组织中,从生物组织提取非目标细胞。在根据本发明的方法的该变体中,首先用缓冲液洗涤生物组织6,以从生物组织6释放非目标细胞,并且将含有非目标细胞的流体储存在储存腔14中。
在又一个变体中,例如通过泵将使生物组织6解聚集的试剂和/或缓冲液重复施用入生物组织6中。在该变体中,使流体再循环数次经过生物组织6/进入生物组织6,由此改善得率。
目标细胞
可应用本发明的方法,以产生所有类型的目标细胞,其为驻留在组织中的细胞(tissue-resident cells),尤其来自脊椎动物组织或无脊椎动物组织的细胞,优选上皮细胞、内皮细胞、成纤维细胞、肌成纤维细胞、肝细胞、肝星形细胞、心肌细胞、足细胞、角质形成细胞、黑素细胞、神经元细胞(包括神经元、星形胶质细胞、小胶质细胞和少突胶质细胞)、白细胞(包括树突细胞、嗜中性白细胞、巨噬细胞和淋巴细胞(包括T细胞、B细胞、NK细胞、NKT细胞和先天性淋巴样1-3型细胞))、组织干细胞(包括MSC和以上提及的细胞的祖细胞)。
生物组织
可将本发明的方法应用于所有类型的生物组织,像脊椎动物或无脊椎动物的器官,优选应用于脾、心脏、肝脏、脑和其它神经组织、肾、肺、胰腺、乳房、脐带、皮肤、胎盘、卵巢、输卵管、子宫、前列腺、扁桃体、胸腺、胃、睾丸、气管、软骨、腱、骨、骨骼肌、平滑肌、肠(gut)、结肠、肠(intestine)、膀胱、尿道、眼、胆囊、来自细胞培养物和肿瘤的器官样结构。
解聚集试剂
如在本文中使用的术语“解聚集试剂”表示包含用于破坏组织内目标细胞的固着(anchorage)而不影响目标细胞本身的物质的流体,像缓冲液。该固着源自细胞与细胞外基质或与相邻细胞的相互作用。这些相互作用(例如紧密连接、间隙连接、桥粒和半桥粒)主要由蛋白质(例如钙粘着蛋白、连接蛋白、密蛋白和整联蛋白)建立,大多数以钙依赖性方式建立。因此,破坏组织完整性的释放试剂可以含有无钙试剂和/或耗钙(calcium-depleting)试剂和/或降解细胞外基质或细胞外蛋白-蛋白相互作用的酶。可以按序或同时施用释放试剂的组分。
例如,使生物组织6解聚集的试剂选自胰蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、胶原酶、弹性蛋白酶、分散酶、嗜热菌蛋白酶、透明质酸酶、梭菌蛋白酶和来自溶组织梭状芽孢杆菌(clostridium histolyticum)的中性蛋白酶、链霉蛋白酶、脱氧核糖核酸酶I、胃蛋白酶、蛋白酶K、溶菌酶、用于二价离子的螯合剂(像EDTA或柠檬酸盐)、以及它们的混合物。
优选的是先后施用无钙或耗钙缓冲液和降解细胞外基质或细胞外蛋白-蛋白相互作用的含酶缓冲液。耗钙试剂可以是含有EDTA、EGTA或柠檬酸盐的缓冲液。
在根据本发明的方法的另一个实施方式中,在第一步骤中使用无钙缓冲液或耗钙缓冲液,且在第二步骤中使用含有钙离子(优选至少50µM钙离子)以及钙依赖性酶的缓冲液。
最优选地,在第一步骤中使用无钙缓冲液或耗钙缓冲液,并且在第二步骤中将含有钙离子以及钙依赖性酶的缓冲液浓缩物掺入(spiked into)作为浓缩物的第一缓冲液。
作为缓冲液,可以使用具有在生理范围内的pH值、穿透性和离子浓度的任何水性流体。优选的缓冲液是PBS、D-PBS、 HBSS(汉克斯(Hanks)的平衡盐溶液)、EBSS、DMEM (杜伯克(Dulbecco)的改性伊格尔培养基)、DMEM/F12、IMDM、RPMI、RPMI-1640,所述缓冲液或者是完整的形式或者是其变体,具有或没有苯酚红,具有或没有HEPES,具有或没有葡萄糖,任选包括蛋白质组分,像FCS(胎牛血清)、FBS(胎牛血清)、HAS(人血清白蛋白)或BSA(牛血清白蛋白)。缓冲液的pH在6.0和8.0之间,优选在7.0和7.5之间。
施用于组织的第一缓冲液可含有抗凝剂(像EDTA、EGTA、柠檬酸盐或肝素)以避免血液在组织内凝固。
酶
在本发明的方法中,可以使用各种各样的酶,例如公开于Barry, Edwards和Barritt (1991) ,Laboratory Techniques in Biochemistry and Molecular Biology 第21卷中的酶。以下酶可以用作释放试剂中的组分:
来自溶组织梭状芽孢杆菌(clostridium histolyticum)的胶原酶(EC 3.3.24.3):也称为梭菌肽酶A,是能够造成胶原分子在它们的天然构象中和在它们的螺旋区水解裂解的酶混合物。这些酶对胶原的特异性很强,并且对于Pro-X- Gly-Pro (X =中性氨基酸)动机(motive)具有特异性。它们需要针对活性的Ca2+,并且通常含有Zn2+。胶原酶还可以从许多其它细菌来源分离(例如解毒无色杆菌(Achromobacter iophagus)、结核分枝杆菌(Mycobacterium tuberculosis)、绿脓假单胞菌(Pseudomonas aeruginosa)和其它微生物)。然而,溶组织梭状芽孢杆菌(clostridium histolyticum)提供胶原酶的主要商业来源。粗制备物还含有污染蛋白酶活性,像梭菌蛋白酶、中性蛋白酶和进一步的胰蛋白酶、酪蛋白酶和脂酶活性。这些能水解在螺旋形式中缠绕得不紧的胶原部分。这些污染活性的相对量的差异是造成观察到的批次之间变化的原因。
透明质酸酶(EC 3.2.1.35):对内-N-乙酰氨基己糖键具有特异性的内切糖苷酶,通常来源于牛和羊的睾丸。它水解透明质酸中的2-乙酰氨基(acetacido)-2-脱氧-ß-D-葡萄糖和D-葡糖醛酸残基之间的1,4连接键(linkage),透明质酸是在实际上所有结缔组织的基质中发现的糖胺聚糖。
胰蛋白酶(EC 3.4.21.4):一种胰丝氨酸蛋白酶,能够水解肽,优选在包括碱性氨基酸(L-精氨酸或L-赖氨酸)的羧基的键处(水解肽),并且也显示一些酯酶和酰胺酶活性。纯化的胰蛋白酶对抗天然胶原是无效的,因此,其本身不适合用于成体肝组织的解离。
梭菌蛋白酶(EC 3.4.22.8):像胶原酶,来源于溶组织梭状芽孢杆菌(clostridium histolyticum),并且对精氨酸的羧基肽键具有高度特异性。其由钙激活,并发现于商品粗制胶原酶制品中。
溶菌酶(EC 3.2.1.17):一种内切糖苷酶,催化糖胺聚糖中N-乙酰胞壁酸和N-乙酰葡糖胺残基之间的1,4-ß-连接键的水解。
链霉蛋白酶(EC 3.3.24.4):一种分离自灰色链霉菌(Streptomyces griseus)的非特异性蛋白酶,水解几乎所有的天然存在的肽键。
分散酶(EC 3.4.24.28):一种由多粘芽孢杆菌(Bacillus polymyxa)产生的蛋白酶,能够裂解纤连蛋白、胶原IV以及较少程度裂解胶原I,并且能够水解牵涉亮氨酸或苯丙氨酸的键。
胰弹性蛋白酶(EC 3.4.21.36)或弹性蛋白酶1:一种丝氨酸蛋白酶,降解弹性蛋白(一种弹性纤维,其与胶原一起决定了结缔组织的机械性质)。
嗜热菌蛋白酶(EC 3.4.24.27):一种由嗜热溶蛋白芽孢杆菌(Bacillus thermoproteolyticus)产生的热稳定性中性金属蛋白酶,就酶活性而言其需要Zn2+,并且就结构稳定性而言其需要四个Ca2+,其具有34.6 kDa的分子量并且特异性催化含有疏水氨基酸的肽键的水解。
木瓜蛋白酶(EC 3.4.22.2):一种半胱氨酸蛋白酶,是源自番木瓜的酶。
胰凝乳蛋白酶(EC 3.4.21.1):胰液的一种消化酶组分,消化十二指肠中的蛋白质和多肽,并优先裂解芳族氨基酸(酪氨酸、苯丙氨酸和色氨酸)处的肽酰胺键。在作为非活性的前体(胰凝乳蛋白酶原)被合成后,其由胰蛋白酶裂解激活。
蛋白酶K (EC 3.4.21.64):一种由白色侧齿霉菌(Engyodontium album)(旧名:白色念球菌(Tritirachium album))生产的28.9 kDa的广谱丝氨酸蛋白酶,能够消化毛发角蛋白。其普遍用于分子生物学中以消化蛋白质,由此从核酸制品中除去污染物。
胃蛋白酶(EC 3.4.23.1):其酶原(胃蛋白酶原)由胃中的主细胞释放,将食物蛋白质降解为肽。其在裂解疏水性且优选芳族氨基酸(例如苯丙氨酸、色氨酸和酪氨酸)之间的肽键中是最有效的。
脱氧核糖核酸酶I(EC 3.4.21.1)是核酸酶,其优先在邻近嘧啶核苷酸的磷酸二酯连接键处裂解DNA,产生以5'-磷酸为末端,在位置3'上具有游离羟基的多核苷酸,平均产生四核苷酸。其作用于单链DNA、双链DNA和染色质。关于组织解离,脱氧核糖核酸酶I有用于减少由游离DNA造成的细胞聚集。
在根据本发明的方法的一个实施方式中,在第一灌注循环中使用无钙缓冲液,在第二灌注循环中使用含有显著量的钙(优选至少50 µM)以及来自溶组织梭状芽孢杆菌(Clostridium histolyticum)的胶原酶(优选在0.05和 1Wünsch单位之间)的缓冲液。在根据本发明的方法的另一个实施方式中,在第一循环中使用耗钙缓冲液,在第二循环中使用含有显著量的钙(优选至少50 µM)以及来自溶组织梭状芽孢杆菌(Clostridium histolyticum)的胶原酶(优选在0.05和 1Wünsch单位之间)的缓冲液。
洗涤液
本发明的方法中使用的洗涤液可以包含具有在生理范围内的pH、穿透性和离子浓度的水性缓冲液。优选的缓冲液是PBS、D-PBS、 HBSS(汉克斯(Hanks)的平衡盐溶液)、EBSS、DMEM (杜伯克(Dulbecco)的改性伊格尔培养基)、DMEM/F12、IMDM、RPMI、RPMI-1640,所述缓冲液或者是完整的形式或者是其变体,具有或没有苯酚红,具有或没有葡萄糖,任选包括蛋白质组分,像FCS(胎牛血清)、FBS(胎牛血清)、HAS(人血清白蛋白)或BSA(牛血清白蛋白)。缓冲液的pH在6.0和8.0之间,优选地在7.0和7.4之间。
方法的用途
本发明的方法和设备可以用于从适当的生物组织分离以上提及的目标细胞。由此分离的目标细胞可以用于研究、诊断和细胞治疗中的各种应用。例如,用本发明的设备和方法分离的肝细胞、心肌细胞或原代细胞(primary cell)可用于分析,以对它们本身或它们与其它细胞类型或分析物的反应进行调查研究。肝细胞和心肌细胞是用于化学品(尤其潜在的药物化合物)的毒理筛选的有用来源。本发明的设备和方法可进一步用于分离用于移植入受伤的器官的活细胞或用来产生人工器官或器官样(organoid-like)结构的活细胞。
虽然以下实施例限于某些目标细胞和组织(尤其来自肝脏的肝细胞),但是本发明的范围不应限于所述实施例,因为所述设备和方法可用于解离无脊椎动物或脊椎动物来源的任何生物组织。
实施例
比较例1:小鼠肝脏的常用灌注
根据金标准(the gold standard)(例如Methods Mol Biol;633,185-196,2010中Li等人的程序)分离原代小鼠肝细胞。校准加热模块和蠕动泵(流速3.2 ml/min),以允许在管道出口处达到37℃。在处死Balb/C小鼠后,通过用带子绑住四肢将动物固定。从下腹部直到肋骨篮(rib cage)的侧面(lateral aspect)的皮肤做出一道切口,并且将皮肤折回以覆盖在胸上。将肠移到右侧,以暴露门静脉和腔静脉。围绕肝脏附近的腔静脉松散地系一根缝合线。将插管插入腔静脉中,并围绕插管固定缝合线。在移除插管的内针之后,将管道连接到插管,并将灌注介质I(含有10mM HEPES、6.7mM KCl、5mM葡萄糖和0.2mM EDTA的PBS,pH7.4)灌注通过肝脏。在灌注开始后立即切除门静脉,以允许血液的排出。几秒钟后,肝脏清除了血液。灌注15 min后,将管道转移到灌注缓冲液II(含有30mM HEPES、6.7mM KCl、5mM葡萄糖、1mM CaCl2和胶原酶的PBS,pH7.4)的瓶中,而不引入气泡,对肝脏进一步灌注15 min。然后停止灌注,小心地切除整个肝脏并转移至容纳灌注介质II的培养皿。用镊子撕开肝包膜。用移液管小心地捣碎样品数次,并且将细胞悬浮液转移至SmartStrainer(100µm)。在4℃下以64g将流过物(flow-through)离心5 min,以使肝细胞成丸(pellet)。一部分样品通过Percoll离心步骤进一步纯化。为此目的,将细胞悬浮液与相同体积的90% Percoll/10% PBS混合并以64 g 离心5 min。在PBS中洗涤丸状物一次。在MACSQuant流式细胞仪上分析所得的单细胞(图6a和6b)。通过吸收碘化丙啶所测量的肝细胞的得率(在Percoll之前和之后分别为每个小鼠肝脏1x108和0.8x108)和成活力(在Percoll之前和之后分别为85%和94%)显示良好的性能。通过显微镜分析(锥虫蓝染色)来确认成活力。肝细胞被成功放入培养物中并存活至少两天。
比较例2:没有灌注的结合的机械及酶促肝脏解离
在将CD1小鼠处死后,小心地切除肝脏并(将其)转移至容纳灌注介质I的培养皿。将经洗涤的肝脏转移至容纳5 ml灌注介质I的gentleMACS C管,并且对gentleMACS Octo开始程序h_tumor_03,以将组织机械切割成更小的碎片。在15 min孵育步骤之后,将样品离心并在灌注缓冲液II中对丸状物洗涤一次。然后,将丸状物在含有胶原酶和脱氧核糖核酸酶的灌注缓冲液II中孵育15 min。在孵育后,将样品转移到可从Miltenyi Biotec GmbH得到的SmartStrainer过滤笼上。在4℃下以64g将流过物离心5 min,以使肝细胞成丸。在MACSQuant流式细胞仪上分析所得的单细胞(图7a和7b)。通过吸收碘化丙啶所测量的肝细胞的得率(每个小鼠肝脏2x106)和成活力(2%)非常低。在Percoll离心步骤后,看不到细胞丸状物。因此,没有灌注的机械和酶促解离的组合无用于获得成活的肝细胞。
实施例3:使用中空针阵列的小鼠肝脏的灌注
使用如图1中显示的组织灌注工具,其在塑料支架中具有呈平行方式的64个中空针(不锈钢;长度:18 mm;内径:0.19 mm;外径0.34 mm)。将蠕动泵设定至75 ml/min并且校准加热模块,以允许在管道出口达到37℃。将管道的出口与泵的入口连接。与比较例1相反,将含有中空针阵列的组织灌注工具与管道出口连接。在将CD1小鼠处死后,剖开肝脏,在培养皿上用PBS洗涤并放置到SmartStrainer的尼龙筛上。用灌注缓冲液I(见比较例1)填充组织灌注工具,并简单放置到肝脏上,以致所有的中空针出口均插入该组织中。两分钟(期间该组织清除了血液)后,引入循环以减少所需的缓冲液体积。为此目的,使用第二根管道来连接流出物和容纳缓冲液的烧瓶。15分钟后,通过从灌注缓冲液I移除第二根管道的出口来停止循环。将第一根管道的入口放入容纳灌注缓冲液II的第二个烧瓶中而不引入气泡。两分钟后,通过连接流出物与容纳灌注缓冲液II的烧瓶来引入循环。15分钟后,停止泵并移除组织灌注工具。将灌注的组织小心地转移至容纳5 ml灌注缓冲液II的培养皿。
用镊子撕开肝包膜以释放细胞。用移液管小心捣碎样品数次,并且将细胞悬浮液转移至SmartStrainer(100µm)。在4℃下以64g将流过物离心5 min,以便使肝细胞成丸。一部分样品通过Percoll梯度离心进一步纯化。在MACSQuant流式细胞仪上分析所得的单细胞(图8a和8b)。通过碘化丙啶染色所计算的肝细胞的得率(在Percoll之前和之后分别为每个肝脏8.6x107和6.6x107)和成活力(在Percoll之前和之后分别为77%和92%)显示优异的结果。肝细胞被成功放入培养物中并存活至少两天。用其它小鼠品种(Balb/C和C57/Bl6)获得可媲美的性能。
实施例4:用中空针阵列灌注大鼠肝叶(liver lobe)
将Wistar大鼠处死,将肝剖成单叶。用等同于实施例3的组织灌注工具对肝叶之一进行处理。在MACSQuant流式细胞仪上分析所得的单细胞(图9a和9b)。通过碘化丙啶染色所计算的肝细胞的得率(在Percoll之前和之后分别为每个肝裂片7.1x108和3.7x108)和成活力(在Percoll之前和之后分别为90%和87%)显示优异的结果。用另一种大鼠品种(Sprague Dawley)达到可媲美的性能。
总之,结果显示,使用组织灌注工具的新程序是现有技术程序的优异代替,现有技术程序是复杂、不方便的,并且仅可由经大量培训的人员来执行,以发现和操作小血管。
实施例5:用中空针阵列灌注小鼠心脏
使用如图1中显示的组织灌注工具,但将塑料支架中的呈平行方式的中空针(不锈钢;长度:18 mm;内径:0.19 mm;外径:0.34 mm)减少至7个。将蠕动泵设定至30 ml/min,并且校准加热模块,以允许在管道出口达到37℃。将管道的出口与泵的入口连接。将含有中空针阵列的组织灌注工具与管道出口连接。处死CD1小鼠,打开胸腔,用缝合线阻断从心脏上升的血管和下降的血管。靠近缝合线切割血管,在培养皿上用PBS洗涤心脏并(将其)放置到SmartStrainer的尼龙筛上。用灌注缓冲液III(含有2,3-丁二酮一肟的无钙Tyrode)填充组织灌注工具,并简单放置到心脏上,以致所有的中空针出口均插入该组织中。90秒(期间该组织清除了血液)后,引入循环以减少所需的缓冲液体积。为此目的,使用第二根管道来连接流出物和容纳缓冲液的烧瓶。10分钟后,通过从灌注缓冲液III移除第二根管道的出口来停止循环。将第一根管道的入口放入容纳灌注缓冲液IV(含有2,3-丁二酮一肟与胶原酶和胰蛋白酶的Tyrode)的第二个烧瓶中而不引入气泡。两分钟后,通过连接流出物与含有灌注缓冲液IV的烧瓶来引入循环。15分钟后,停止泵并移除组织灌注工具。小心地将灌注的组织转移至容纳5 ml含有FCS的Tyrode的培养皿。
用镊子撕开心包膜以释放细胞。用移液管小心捣碎样品数次,并且将细胞悬浮液转移至SmartStrainer(100µm)。在4℃下以88g将流过物离心1 min,以使心肌细胞成丸。一部分样品通过Percoll梯度离心进一步纯化。在MACSQuant流式细胞仪上分析所得的单细胞(图11a和11b)。通过碘化丙啶染色所计算的具有高散射参数的心肌细胞的得率(每个心脏0.9x106)和成活力(83%)显示良好的结果。显微镜分析主要显示典型的杆状心肌细胞(图12)。
- 还没有人留言评论。精彩留言会获得点赞!