一种促进人癌细胞发生凋亡的化合物及其应用的制作方法
本发明涉及一种化合物,涉及了一种促进癌细胞发生凋亡的化合物及其应用,该化合物是通过改变癌细胞中突变的p53蛋白的转录活性而能够诱导癌细胞发生凋亡。
背景技术:
p53蛋白作为转录因子,是基因组的守卫者,当基因组发生损伤会激活p53蛋白的转录活性,从而引起细胞周期的阻滞和细胞的凋亡。据已有的统计发现,50%的人类癌症中p53均发生了点突变,从而影响了p53蛋白的功能。且有相关文献报道,突变的p53蛋白恢复活性能够显著的阻止癌症的发生和发展。
传统的p53蛋白激活因子的筛选多是从细胞层面的筛选,通过构建p53蛋白缺陷的细胞系,然后从已有的化合物库中筛选出能够影响p53缺陷的细胞系的化合物,而该化合物不影响p53正常的细胞系。通过这种筛选方法,国外的一些研究机构已经发现了几种能够激活突变型p53蛋白的化合物。这些化合物中,有的是直接与突变的p53蛋白结合从而提高p53蛋白的稳定性而发挥功能,另一方面,有的化合物可以间接的通过改变与p53蛋白相互作用的蛋白而激活突变的p53蛋白。因为p53蛋白在癌症中发生突变的几率很大,所以找到能特异性与突变型p53蛋白结合并恢复其野生型的功能,对于癌症的治疗会提供一个有益的思路。
技术实现要素:
为了解决背景技术中的问题,本发明提出了一种促进癌细胞发生凋亡的化合物及其应用,本发明中该化合物通过激活突变的p53蛋白的转录活性,而促进了癌细胞发生凋亡,为癌症的治疗提供一种思路。
本发明采用的技术方案是:
一、一种促进癌细胞发生凋亡的化合物:
所述化合物是2-(4-羟基苯胺)酚,其分子式如下:
所述化合物具体采用以下方式合成:
所述化合物用二甲基亚砜(DMSO)溶解,分装后放置于-80℃冰箱中进行保存。
所述化合物能够与人的p53蛋白结合后,恢复突变型p53蛋白为野生型的构象,引起癌细胞发生凋亡。
二、化合物的应用是在抗癌和制备抗癌药物的应用。
所述化合物能够与人的p53蛋白结合后,恢复突变型p53蛋白为野生型的构象,引起癌细胞发生凋亡,从而实现抗癌作用。
所述化合物能抑制细胞增殖并促进细胞的凋亡,能够增加p53蛋白的转录活性。
所述化合物能在体外与人的重组p53蛋白结合。
所述的重组p53蛋白是谷胱甘肽转移酶(GST)为标签的融合蛋白。
所述的重组p53蛋白采用以下方式进行构建:
a)通过构建人的cDNA文库中,通过PCR扩增得到人p53基因并经过测序为野生型的p53基因,然后使用Fast Mutagenesis System试剂盒,获得在175位精氨酸突变为组氨酸和在220位酪氨酸突变为半胱氨酸的突变体p53基因;
b)将步骤a)中获得野生型的p53基因和突变体p53基因均通过内切酶BamH1和Xho1双酶切后连接到原核表达的载体pGEX6p-2质粒上,然后转化到原核表达菌株BL21DE3中;
c)将步骤b)中的原核表达菌株BL21DE3在37℃培养至OD600为0.6左右时,加入异丙基硫代半乳糖苷使其在培养液中的浓度为0.5mM,然后摇菌培养收集菌体,用磷酸盐缓冲液重悬细胞,超声破碎,离心后取上清液与Glutathione sepharose 4FastFlow琼脂糖介质结合,4摄氏度孵育3个小时后,用30ml磷酸盐缓冲液清洗介质,再用10mM还原型谷胱甘肽洗脱,得到重组p53蛋白。
本发明是将化合物重组的GST-p53蛋白与孵育后,通过葡聚糖凝胶层析柱sephadex G50填料后,收集流出G50葡聚糖凝胶柱280nm波长下的蛋白峰,蛋白会与化合物结合,并随着蛋白一起流出G50填料,以此来证明该化合物能与化合物在体外发生相互作用。
具体地采用以下方式证明该化合物能够与重组的p53蛋白结合:
用从原核表达系统得到的重组p53蛋白与该化合物在25℃温度下孵育1小时,以使蛋白与化合物能够充分的结合,然后将蛋白小分子复合物通过分子筛sephadex G50(葡聚糖凝胶G50,GE Healthcare,美国),流出G50葡聚糖凝胶柱后收集蛋白峰,冻干后再用甲醇溶解,离心去除变性的蛋白后,取上清液的化合物,即为与重组p53蛋白结合的化合物。
假定当该化合物与p53蛋白结合后,形成了蛋白小分子复合物,通过G50凝胶柱时,p53蛋白由于分子量远大于化合物,所以会早于化合物从G50柱子中流出,而p53蛋白如果与该化合物结合形成复合物后,会带着小分子化合物先从柱子中流出,因此需要收集280nm波长下蛋白峰,然后将其冻干,再用甲醇溶解,离心去除变性的蛋白后,上清中的化合物,用GC-MS(气相色谱质谱联用仪)进行鉴定,得到与重组p53蛋白结合的化合物。
本发明实施通过有机合成获得该化合物纯品,并通过细胞实验验证该化合物的功能,通过MTS,Caspase3/7酶活测定,发现该化合物能够抑制细胞增殖并促进细胞的凋亡,通过Annexi V/PI染色,流式细胞仪测定,发现该化合物确实通过凋亡来抑制癌细胞的增殖,然后通过构建含与p53结合的启动子的荧光素酶报告质粒,测定经化合物处理后荧光素酶的活性,从而得知该化合物能够增加p53的转录活性。
本发明的有益效果是提供了一种能特异与p53蛋白结合进而恢复其野生型功能的化合物,通过激活突变的p53蛋白的转录活性,而促进了癌细胞发生凋亡,并且经实验验证该化合物能够抑制细胞增殖并促进细胞的凋亡,能够增加p53的转录活性。
附图说明
图1是用气相色谱质谱联用仪(GC-MS)鉴定本发明化合物的质谱图。
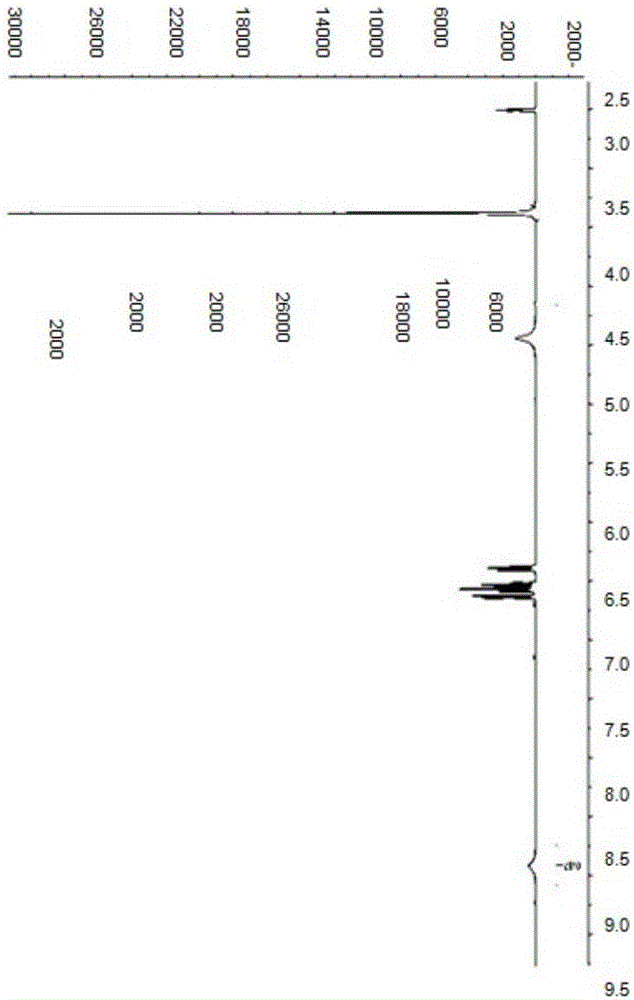
图2是用1H的NMR(核磁共振)鉴定本发明化合物的NMR(核磁共振)图。
图3是实施例通过MTS实验测定A375细胞在不同浓度化合物处理后的细胞增殖情况示意图。
图4是实施例获得不同的化合物浓度处理下,检测A375细胞的caspase3/7酶活数量情况图,在50uM和10uM下,细胞caspase3/7酶活增加,细胞发生凋亡。
图5是实施例A375细胞分别在DMSO处理和本发明化合物处理后,用Annexin V/PI法检测细胞凋亡情况的示意图。
图6是实施例在不同浓度的化合物处理后,A375细胞通过western blot检测细胞内p53蛋白的表达情况图。
图7是实施例在不同浓度的化合物处理后,MDA-MB-435细胞通过western blot检测细胞内p53蛋白的表达情况图。
图8是实施例A375细胞在分别用DMSO和本发明化合物处理后再用单克隆抗体Pab1620处理后并荧光二抗标记后双光子激光共聚焦显微镜的结果图。
具体实施方式
下面结合附图和实施例对本发明作进一步说明。
本发明的实施例如下:
1)构建重组GST-p53蛋白,采用GST标签进行标记:
a)通过用Trizol法提取MCF-7细胞(一种乳腺癌细胞,p53蛋白为野生型)的RNA,然后用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TAKRA,大连宝生生物)将RNA反转为单链的DNA,并以此单链DNA为模板,通过PCR扩增得到人的野生型的p53基因,然后使用Fast Mutagenesis System(Transgen,北京全式金生物技术有限公司)试剂盒,获得175位精氨酸(R)突变为组氨酸(H),220位酪氨酸突变为半胱氨酸(C)的突变体p53基因,野生型和突变型的p53基因序列均通过测序验证;
b)将步骤a)中获得野生型的p53基因和突变体p53基因均通过内切酶BamH1和Xho1(Thermo)双酶切后连接到原核表达的载体pGEX6p-2(GE Healthcare)质粒上,然后转化到原核表达菌株BL21DE3中;
c)将步骤b)中的原核表达菌株BL21DE3在37℃培养至OD600(600nm光密度)为0.6左右时,加入异丙基硫代半乳糖苷(IPTG,半乳糖类似物)使其在培养液中的浓度为0.5mM;然后在16℃和转速120rpm下摇菌培养20h,然后收集菌体,用磷酸盐缓冲液(PBS)重悬细胞,超声破碎,通过Glutathione sepharose 4FastFlow(GE Healthcare)琼脂糖柱子纯化得到重组GST-p53蛋白。
2)上述得到产物采用重组GST-p53蛋白进一步体外筛选:
用从原核表达系统得到的重组GST-p53蛋白与上述提取到的化合物在25℃温度下孵育1小时,然后将此混合物过分子筛sephadex G50(葡聚糖凝胶G50,GE Healthcare,美国),流出G50葡聚糖凝胶柱后收集280nm波长下的蛋白峰,冻干后再用甲醇溶解,离心去除变性的蛋白后,取上清液的化合物,即为与重组GST-p53蛋白结合的化合物,然后将该提取到的化合物用气相色谱-质谱(GC-MS,Thermo Fisher)进行化合物的鉴定。
当有小分子化合物与蛋白结合后,随着蛋白一起先从柱子中流出,而不与蛋白结合的小分子化合物则后于蛋白流出,因此收集蛋白,然后用甲醇萃取其中的化合物。
实施例用气相色谱质谱联用仪(GC-MS)鉴定本发明化合物的色谱质谱图如图1所示,气相色谱-质谱(GC-MS)鉴定实施例获得的与重组p53蛋白特异结合后的化合物,电子轰击电离得碎片离子峰质谱如图(70电子伏的能量),再通过与NIST(美国国家标准与技术局)2005版的数据可进行正向和反向的比较,获得该化合物的可能分子式和结构式如下:
并且该化合物的1H NMR(核磁共振)如图2所示。
3)实施例以下进一步通过细胞实验验证该化合物的功能,是否能够影响到癌细胞的增殖,凋亡。通过对几株胃癌细胞系和乳腺癌细胞系的处理发现,该化合物能够不同程度的促进这些癌细胞的凋亡,并通过caspase3/7酶活和Annexin V/PI染色的方法加以验证。
进一步本发明的实施例获得的化合物采用以下方式进行验证,证明本发明化合物处理癌细胞后,能够在50uM/L的浓度下抑制癌细胞的增值,促进癌细胞发生凋亡。
MDA-MB-435细胞(乳腺癌细胞,购自美国典型培养物中心ATCC)用L15培养基10%的胎牛血清(FBS)37℃培养,A375细胞(黑色素瘤细胞,购自ATCC)用DMEM培养基,10%胎牛血清(FBS)在5%二氧化碳37℃培养。取生长状态良好的A375细胞和MDA-MB-435细胞,铺到96孔板,10000个细胞每个孔,使细胞过夜贴壁后,加入对照二甲基亚砜(DMSO),使其终浓度为1%(V/V,体积比)以及处理组100uM,50uM,10uM三个浓度梯度,使化合物作用24h后,用Caspase-GloTM37细胞凋亡检测试剂盒(Promega,美国)用化学发光发检测化合物处理后细胞内天冬氨酸特异性半胱氨酸蛋白酶3和7的酶活(caspase3/7)。如果化合物处理后,细胞发生凋亡,那么细胞内的caspase3/7的酶活性会增加。
同时,为了进一步确认该化合物能够促进癌细胞发生凋亡,也用Annexin V/PI法检测细胞的早期凋亡。其具体方法如下:6孔板铺A375细胞和MDA-MB-435细胞,200000个细胞每个孔,使细胞贴壁12h后,加入终浓度为1%的二甲基亚砜(DMSO)作为对照,然后加入100uM,50uM,10uM的化合物处理细胞,处理4小时后,用FITC Annexin V Apoptosis Detection Kit I(BD美国)这个试剂盒标记细胞,然后用流式细胞仪(Beckman美国)检测凋亡。如果化合物处理后,细胞发生了凋亡,那么在凋亡的早期,细胞膜上的磷脂酰丝氨酸会从细胞膜内外翻到细胞外,便能与Annexin V这种磷脂特异结合蛋白结合,然而Annexin V被FITC(异硫氰酸荧光素)偶联,而细胞核被PI(碘化丙啶)特异染色,然后用流失细胞仪分析荧光情况,从而得到在化合物处理后细胞凋亡的情况。
4)该化合物能够改变突变型p53蛋白的构象,使其恢复到野生型p53蛋白的构象。其中用到的两种特殊的单克隆抗体Pab1620和Pab240(Abcam美国),其中Pab1620能够识别野生型构象的p53蛋白,而Pab240能够识别出突变型构象的p53蛋白,将MDA-MB-435细胞和A375细胞分别铺到培养皿中,用DMSO和溶于DMSO的化合物处理细胞,处理24小时后,用PBST(磷酸盐缓冲液和Tween20)将细胞破膜,用BSA(牛血清白蛋白)封阻1小时后,用Pab1620和Pab240与细胞孵育12小时,然后用一种带有绿色荧光抗鼠的二抗Alexa Fluor488Dye(Molecular probe,美国)处理1小时后,再用DAPI(一种染细胞核的蓝色荧光燃料)处理5分钟,然后用双光子激光共聚焦显微镜(Zesiss,德国)观察在化合物处理前后蓝色荧光强弱的变化,从而得到化合物处理后p53蛋白构象的变化。
实施例获得的化合物分别加入到A375细胞和MDA-MB-435细胞进行细胞增殖检测,96孔板铺细胞10000个/孔,待细胞过夜贴壁,然后分别加入不同浓度的化合物处理,DMSO组作为对照(三个重复为一组),然后用MTS(四唑化合物,Promega公司),20ul/每孔,然后在37℃孵育2h后,用酶标仪在490nm处检测每孔的吸光值,结果如图3所示。
测定细胞在化合物处理后,细胞内caspase3/7的酶活。因为细胞发生凋亡时,主要是依靠激活caspase3/7来发生细胞凋亡的,用Promega公司提供的偶联游荧光素酶的caspase底物,当caspase3/7发挥作用时,会切割底物发出荧光,且荧光值大小反应出caspase3/7酶活的大小,进而反映出凋亡发生的情况,结果如图4所示。图中可见,MDA-MB-435细胞中,在50uM和10uM下,发现细胞caspase3/7酶活增加,细胞发生凋亡。
流式细胞仪检测在化合物处理后,细胞发生凋亡的情况。将50000个细胞铺到6孔板,50000个/孔,使其贴壁12个小时,然后用DMSO和50uM化合物处理处理细胞24小时后,用胰酶消化下贴壁细胞,再用冷的PBS洗,然后用Annexin V/PI室温下标记15分钟,然后用流式细胞仪检测凋亡情况,结果如图5所示。
图5上面两张图分别表示实施例通过A375细胞在DMSO(左)和50uM化合物处理后(右),用Annexin V/PI标记染色后,经过流式细胞仪检测细胞早期凋亡比例,图中可见50uM化合物处理后细胞凋亡程度明显。
图5下图两张图分别表示通过MDA-MB-435细胞(一株乳腺癌细胞)上在DMSO(左)和50uM化合物处理后(右),用Annexin V/PI标记染色后,经过流式细胞仪检测细胞早期凋亡比例,图中可见50uM化合物处理后流式细胞仪检测细胞凋亡程度明显。
为了验证该化合物促进细胞凋亡的机制,首先检测在化合物处理时,细胞内p53蛋白含量的变化,因此在6孔板,每孔50000个细胞,过夜贴壁后,用化合物处理24小时,然后将细胞消化下来,然后超声破碎,通过western blot的方法检测在不同处理情况下,细胞内p53蛋白含量的变化。结果分别如图6和图7所示。图6中可见,A375细胞通过western blot检测细胞内p53蛋白在化合物处理时表达并没有差异性。图7中可见MDA-MB-435细胞通过western blot检测细胞内p53蛋白在化合物处理时表达并没有差异性。
上述处理后的MDA-MB-435细胞分别用DMSO和本发明50uM化合物处理后用可以特异性的识别p53野生型构象的单克隆抗体Pab1620(abcam)处理,并用荧光二抗标记后双光子激光共聚焦显微镜观察,其结果分别如图5左侧和右侧所示.MDA-MB-435细胞用50uM浓度的化合物处理细胞后,用Pab1620检测细胞内p53蛋白野生型构象的变化,其中A为对照组DMSO处理后的蓝色荧光强度,B为50uM化合物处理后蓝色荧光的强度,可以看出在化合物处理后蛋白的野生型构象增多,结果如图8所示,并且通过荧光共定位的方法发现,当用该化合物处理后,pab1620单克隆抗体染色加深,相反的是,pab240单克隆抗体的染色减弱,由此该化合物处理后确实能够显著提高p53蛋白的转录活性。
由此可证明本发明的该化合物能通过增强p53的转录活性而促进细胞的凋亡,在化合物处理细胞后不能够改变细胞内p53蛋白含量的变化,但是能够改变p53蛋白的构像,并促进p53蛋白的转录活性。
上述可见,本发明的该化合物确实是通过影响p53蛋白的活性发挥功能,并可进一步构建含有p53下游基因的转录结合区作为启动子的报告基因质粒。
- 还没有人留言评论。精彩留言会获得点赞!