一种检测羊边界病毒的实时荧光定量RT‑PCR试剂盒及应用的制作方法
本发明涉及微生物检测技术领域,具体说是涉及一种快速、简便并且可实时定量检测羊边界病病毒(bdv)的实时荧光定量rt-pcr试剂盒及其应用。
背景技术:
边界病(borderdisease,bd),因首先发现于英格兰和威尔士的边界地区而得此名,又称羔羊被毛颤抖病(hairyshakerdiseaseoflambs),是由边界病病毒引起新生羔羊以身体多毛,生长不良和神经异常为主要特征的一种先天性传染病。
边界病病毒(bdv)属黄病毒科瘟病毒属,是有囊膜的单股正链rna病毒。边界病病毒有免疫抑制作用,怀孕期感染边界病病毒后,无论胎儿是否具有免疫应答能力,病毒均可在体内的各种组织中持续存在而成为病毒的携带者和疾病的传染源。被感染的羔羊在生长成熟后的几年内,仍具有对其后代的感染性,边界病病毒的主要自然宿主是绵羊,山羊也可感染,牛和猪均有易感性;血清学调查表明某些品种的野生鹿和野生反刍动物也可感染本病,并成为家养反刍动物的感染原。实验条件下兔子可感染本病毒,并用于边界病病毒复制。
边界病病毒主要存在于流产的胎儿,胎膜、羊水及持续感染动物的分泌物和排泄物中,动物可通过吸入和食入而感染本病。垂直感染是本病传播的重要途径之一。
绵羊经肌肉、静脉、脑内、皮下、腹膜和气管接种均可引发本病,用受到边界病病毒污染的活毒疫苗接种怀孕母羊可引起本病的暴发。子宫和卵巢或睾丸生殖细胞中存在的病毒,可经胎盘和精液发生垂直传播。感染了边界病病毒的成年羊主要表现为繁殖力下降和流产。羔羊表现为发育不良和畸形,多见断奶羊死亡。因此,建立特异、敏感和快速的诊断技术非常重要。
目前,羊边界病病毒的检测技术主要有病毒分离鉴定、荧光免疫技术检测抗原和普通pcr方法。病毒的分离鉴定,其结果准确可靠,但也存在操作复杂,需要复杂的仪器设备,所需时间长,以及受影响的因素多等缺点,不利于羊边界病病毒的快速诊断。荧光免疫技术是一种相对快速和敏感的检测方法,但其敏感性较差。相比普通pcr方法,实时荧光定量pcr方法不需要进行琼脂糖凝胶电泳来判读结果,反应结束即可获得检测结果,更为快速便捷;此外,其灵敏度比普通pcr方法灵敏度更高,还可进行定量。
技术实现要素:
本发明的目的是为了解决实验室快速、批量、准确检测羊边界病病毒(bdv),提供一种方快捷准确地检测bdv的实时荧光定量rt-pcr试剂盒。为实现本发明目的所使用的技术方案为:一种检测羊边界病病毒的实时荧光定量rt-pcr试剂盒,该试剂盒包含a液、b液和c液;
所述a液为荧光定量rt-pcr反应液,2×ultrasybrmixture,上游引物forwardprimer与下游引物reverseprimer;
所述b液为含羊边界病病毒cdna,作为阳性对照;
所述c液为rnase-freewater,作为阴性对照;
所述的上游引物forwardprimer:5'-gcccatagtaggactagca-3';
所述的下游引物reverseprimer:5'-cgaactactgacgactgtc-3';
序列扩增大小为115bp。
优选的,该试剂盒含有一次性荧光定量pcr反应八联管。
优选的,所述的上游引物forwardprimer与下游引物reverseprimer使用前稀释到2pmol/l。
优选的于,所述的2×ultrasybrmixture组分包括goldstartaqdnapolymerase1-5u、kcl20-30mm、mgso43-10mm、和eachdntp200-400um。。
一种检测羊边界病病毒的实时荧光定量rt-pcr试剂盒的应用,其特征在于,具体步骤如下:
(1)引物设计与合成;
(2)制备反应模板cdna;
(3)rt-pcr反应体系的建立;
(4)rt-pcr反应程序的建立;
(5)rt-pcr反应产物扩增。
优选的,所述的反应模板cdna提取自病毒基因组dna/rna提取试剂盒提取羊边界病病毒的rna,再将rna反转录为cdna。
优选的,所述pcr反应体系的建立为,按20μl体系配置:
2×ultrasybrmixture11.25μl
forwardprimer(2pmol/l)0.4μl
reverseprimer(2pmol/l)0.4μl
反应模板cdna2μl
rnase-freewater补足20μl。
优选的,所述pcr反应产物扩增的程序为:为95℃5min;随后进行40个95℃20s,60℃20s,68℃20s的循环;最后68℃延伸5min。
本发明的实质性特点和显著的进步是:
1)特异性强
本发明的实时荧光定量rt-pcr检测试剂盒特异性检测出羊边界病病毒(bdv),所检测的阴性对照病毒(羊支原体、布鲁氏杆菌、巴氏杆菌、大肠杆菌)均无阳性结果。
2)灵敏度高
本发明的羊边界病病毒(bdv)实时荧光定量rt-pcr检测试剂盒灵敏度高,最小检出量为4×102拷贝/μl病毒基因组拷贝数。
3)耗时少、结果判读简便
与通过病原分离鉴定来检测相比,本发明的羊边界病病毒(bdv)实时荧光定量rt-pcr检测试剂盒,在时间成本、工作量等方面具有明显的优势,从组织样品中提取rna,进行反转录和荧光定量rt-pcr检测,到获得最终结果可在4-5小时内完成,与普通rt-pcr相比,实时荧光定量rt-pcr反应结束即可进行结果判定,不需要再进行琼脂糖凝胶电泳和凝胶成像系统分析来判读结果。本发明的实时荧光定量rt-pcr检测试剂盒特别适用于羊边界病病毒(bdv)的实验室快速诊断和疫情监测。
4)准确性高、稳定性好
用1.0×106、1.0×105和1.0×104拷贝/μl的重组质粒标准样品分3管同时进行实时荧光定量pcr,分别重复5次检测。结果其ct值平均数分别为15.01+1.10、17.85+0.83、21.03+0.69,变异系数分别为2.34%、2.21%和2.07%,表明反应批内和批间ct值差异均不显著,该反应体系重复性好。
5)可实时定量
本发明利用荧光定量pcr仪实时分析rt-pcr反应的结果,荧光定量pcr仪会根据各个标准品测得的ct值,以样本拷贝数的对数为横坐标,以ct值为纵坐标建立标准曲线,获得标准曲线方程。通过从仪器读取待测样品的ct值,代入表达式就可以换算出其初始拷贝数。本方法建立的标准曲线检测范围广,在6个数量级之间(ct值从14.50~31.33之间)有很好的线性关系。
附图说明
图1溶解曲线分析结果:温度以0.5℃/10s的速率从55℃缓慢递增到94℃,连续测定样品的荧光强度以获取熔解曲线。熔解温度为86.5℃,只有一个特异峰,从而排除了非特异性产物和形成引物二聚体对结果带来影响的可能,同时说明设计的引物有很好的特异性,pcr反应条件得到了很好的优化。
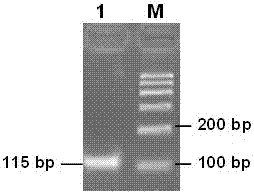
图2目标产物电泳检测分析结果:其中1:羊边界病病毒样本;m:dna标准600bp。
图3是本发明特异性检测结果,以羊支原体、布氏杆菌、巴氏杆菌、大肠杆菌为对照,同时进行实时荧光定量pcr检测,其中:m:100bpladder,1:羊边界病毒,2:羊支原体,3:布氏杆菌,4:巴氏杆菌,5:大肠杆菌,6:水对照;结果显示,只有羊边界病病毒反应管有扩增曲线,为阳性结果,4株对照反应管和水对照反应管均无扩增情况出现,为阴性结果。
图4是本发明实时荧光定量rt-pcr检测敏感性检测结果;其中反应模板(阳性重组质粒)的起始浓度为4×1010拷贝/μl,经10倍倍比连续稀释后,进行实时荧光定量pcr扩增,其中1:4×108ng/μl、2:4×107ng/μl、3:4×106ng/μl、4:4×105ng/μl、5:4×104ng/μl、6:4×103ng/μl和7:4×102ng/μl;结果显示本发明的检测方法检测限为4×102ng/μl。
图5是本发明定量检测羊边界病病毒(bdv)的标准曲线;设置对照:浓度为4×108ng/μl、4×107ng/μl、4×106ng/μl、4×105ng/μl、4×104ng/μl、4×103ng/μl和4×102ng/μl的阳性重组质粒标准样品各一个,以拷贝数的对数为横坐标,以ct值为纵坐标,得到标准曲线:ct=-3.295×log拷贝数+5.068,斜率为-3.295,截距为5.068,r2=0.998,成良好的线性关系。通过从仪器读取待测样品的ct值,代入表达式就可以换算出其初始拷贝数。
具体实施方式
实施例1羊边界病病毒(bdv)实时荧光定量rt-pcr检测
1、材料的准备
羊边界病病毒、羊支原体、布氏杆菌、巴氏杆菌和大肠杆菌为市售疫苗或广西兽医研究所保存。2×ultrasybrmixture、病毒基因组dna/rna提取试剂盒(cw0548s)、反转录试剂盒hifiscriptcdnasynthesiskit(cw2569m)购自康为世纪生物科技有限公司。
2、rt-pcr引物的设计与合成
根据genbank中的羊边界病病毒5’非编码区基因序列进行同源性比较分析,选择保守序列区作为扩增区域,利用oligo6.0引物设计软件和blast软件程序设计出特异性扩增引物,其中引物的序列分别为:
forwardprimer:5'-gcccatagtaggactagca-3'
reverseprimer:5'-cgaactactgacgactgtc-3'
序列扩增大小为115bp。
上、下游引物使用前稀释到2pmol/l。
3、病毒rna提取及反转录
使用病毒基因组rna提取试剂盒提取试验毒株的dna/rna,以及疑似羊边界病病毒感染引起病变组织的rna,再使用反转录试剂盒hifiscriptcdnasynthesiskit将rna反转录为cdna。
4、rt-pcr反应体系建立
所述的实时荧光定量rt-pcr试剂盒反应体系建立以20μl计,
2×ultrasybrmixture11.25μl
forwardprimer(2pmol/l)0.4μl
reverseprimer(2pmol/l)0.4μl
反应模板cdna2μl
rnase-freewater补足20μl。
5、rt-pcr反应程序及目标产物电泳分析
检测过程在实时荧光定量pcr仪密闭进行,全程监控,反应程序为95℃5min;随后进行40个95℃20s,60℃20s,68℃20s的循环;最后68℃延伸5min。
荧光定量pcr仪会根据各个标准品测得的ct值,以样本拷贝数的对数为横坐标,以ct值为纵坐标建立标准曲线,通过从仪器读取待测样品的ct值,代入表达式就可以换算出其初始拷贝数。
反应结束后,取8ul产物进行2%琼脂糖凝胶电泳,检测是否扩增出目的片段,片段大小为115bp。
6、实时荧光定量rt-pcr检测方法
1)实时荧光定量pcr条件的优化
在icycleriqtm荧光定量pcr仪上进行扩增和数据分析,对不同退火温度(58~62℃)进行优化,然后,以优化的退火温度对引物浓度(2~25pmol/μl)进行优化,确定其最佳扩增条件。
2)熔解曲线分析
为排除非特异性扩增和引物二聚体的形成对实时荧光定量pcr结果造成影响的可能性,在pcr后进行熔解曲线分析以确定引物的特异性和所得产物是否为目的产物。温度以0.5℃/10s的速率从55℃缓慢递增到94℃,连续测定样品的荧光强度以获取熔解曲线。反应结束后取6μl产物进行电泳,判断有无115bp的特异性条带出现。
3)特异性检测
以提取的试验毒株和对照毒株的基因组dna/rna进行实时荧光定量rt-pcr扩增,检验rt-pcr方法的特异性。
4)敏感性检测
将羊边界病病毒rna反转录为cdna,以此为反应模板,以优化的反应条件进行常规pcr扩增。pcr产物经3%琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像系统检测,在紫外灯下切取目的片段,利用dna胶回收试剂盒按说明回收纯化。将回收纯化的目的片段与pmd-18t载体连接,转化大肠杆菌dh5α,用质粒小量抽提试剂盒抽提质粒,经酶切和pcr鉴定,重组质粒送上海捷瑞公司测序。纯化阳性重组质粒,测定起起始浓度后,用rna-freewater连续10倍倍比稀释,采用优化的反应条件进行实时荧光定量pcr,进行敏感性检测。
5)准确性和稳定性检测
用1.0×106、1.0×105和1.0×104拷贝/μl的重组质粒标准样品分3管同时进行实时荧光定量pcr,分别重复5次检测。检验本发明检测方法的准确性和稳定性。
实施例2实时荧光定量rt-pcr反应条件优化结果
分别对退火温度和引物浓度进行优化,获得了羊边界病病毒的实时荧光定量pcr的最佳反应条件和体系。总反应体系为20μl,包括2×反应缓冲液11.25μl、上下游引物(2pmol/l)各0.4μl、cdna模板2μl以及ddh2o5.95μl。循环条件为:95℃5min;随后进行40个95℃20s,60℃20s,68℃20s的循环;最后68℃5min延伸。将荧光rt-pcr扩增产物进行琼脂糖凝胶电泳,检测到目的条带115bp(图2)。
实施例3实时荧光定量rt-pcr熔解曲线分析
熔解曲线分析结果见图1,熔解温度为86.5℃,只有一个特异峰,从而排除了非特异性产物和形成引物二聚体对结果带来影响的可能,同时说明设计的引物有很好的特异性,pcr反应条件得到了很好的优化。
实施例4rt-pcr检测方法的特异性结果
以羊支原体、布氏杆菌、巴氏杆菌、大肠杆菌为对照,同时进行实时荧光定量pcr检测,检测本发明检测方法的特异性,结果显示,只有羊边界病病毒反应管有扩增曲线,为阳性结果,4株对照反应管和水对照反应管均无扩增情况出现,为阴性结果,表明本方法具有很好的特异性(图3)。
实施例5实时荧光定量rt-pcr检测方法的敏感性结果
阳性重组质粒起始浓度为4×1010拷贝/μl,用rnase-freewater进行10倍系列稀释,采用优化的反应条件进行实时荧光定量pcr扩增(图4),结果显示,当模板浓度为4×102拷贝/μl时,仍有荧光曲线,表明该方法检测灵敏度为4×102拷贝/μl。
实施例5羊边界病病毒(bdv)实时荧光定量rt-pcr方法标准曲线的绘制
设置对照:浓度为4×108ng/μl、4×107ng/μl、4×106ng/μl、4×105ng/μl、4×104ng/μl、4×103ng/μl和4×102ng/μl的阳性重组质粒标准样品各一个,以拷贝数的对数为横坐标,以ct值为纵坐标,得到标准曲线(图5):ct=-3.295×log拷贝数+5.068,斜率为-3.295,截距为5.068,r2为0.998,呈良好的线性关系。通过从仪器读取待测样品的ct值,代入表达式就可以换算出其初始拷贝数,从而达到定量的效果。
实施例6羊边界病病毒(bdv)实时荧光定量rt-pcr方法准确性和稳定性检测
用1.0×106、1.0×105和1.0×104拷贝/μl的标准样品分3管同时进行实时荧光定量pcr,分别重复5次检测。结果其ct值平均数分别为15.01+1.10、17.85+0.83、21.03+0.69,变异系数分别为2.34%、2.21%和2.07%,表明反应批内和批间ct值差异均不显著,该反应体系重复性好。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种C型EV71病毒的TaqMan荧光实时定量PCR检测方法
- 一种鲤春病毒血症病毒的荧光定量pcr检测方法
- 一种利用实时荧光pcr检测偏肺病毒的方法和组合物的制作方法
- 一种病毒三重荧光定量rt-pcr检测方法及其试剂盒的制作方法
- 一种麻疹病毒一步实时荧光定量rt-pcr试剂盒的制作方法
- 一种用于检测日本乙型脑炎病毒的荧光rt-pcr试剂盒的制作方法
- 尼帕病毒和猪瘟病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 尼帕病毒和猪繁殖与呼吸综合症病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 用于辛德比斯病毒荧光rt-pcr检测的引物和lna探针及其试剂盒的制作方法
- 鸭痘病毒的实时荧光pcr检测方法及检测用引物和探针的制作方法
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种燕麦花叶病毒的实时荧光RT‑PCR检测方法、引物和探针及试剂盒与流程
- 一种检测羊边界病毒的实时荧光定量RT‑PCR试剂盒及应用的制造方法与工艺
- 检测口蹄疫病毒的荧光定量PCR试剂盒及系统的制造方法与工艺
- 五种猪腹泻病毒多重实时荧光定量PCR快速诊断试剂盒及应用的制造方法与工艺
- Sweepoviruses病毒实时荧光定量PCR检测的通用引物、探针及其检测方法与流程
- 一种鹅星状病毒实时荧光定量PCR检测的引物和探针的制作方法与工艺
- 一种葡萄斑点病毒荧光定量PCR检测的专用引物和方法与流程
- 一种樱桃病毒A荧光定量PCR检测的专用引物和方法与流程
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 检测禽呼肠孤病毒的通用PCR引物及其检测试剂盒的制作方法与工艺
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种用于绝对定量检测猪繁殖与呼吸综合征病毒的ddPCR方法、引物及其应用和试剂盒与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺
- 一种基于荧光定量PCR鉴定啮齿类螺杆菌的引物、试剂盒及鉴定方法与流程
- 一种检测包含潜伏期结核感染的试剂盒及其引物对和探针的制造方法与工艺
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺