一株多孔木霉菌株及其制备萜类化合物的方法与流程
本发明涉及微生物发酵技术领域,尤其涉及萜类菌种发酵技术领域。
背景技术:
从真菌分离的活性天然产物属于萜类化合物(terpestacin),萜类化合物(terpestacin)碳骨架为一个十五元环和一个五元环稠合而成的双环骨架,其中,十五元环上有三个反式三取代双键,同时具有四个手性中心,其中包括一个季碳手性中心,而五元环为官能团密集的1,2-双酮结构,其中一个羰基呈现烯醇式结构。其分子结构式为:
萜类化合物(terpestacin)具有温和的抗菌活性,并具有良好的生物选择活性,因而作为一种非常有前景的药物受到广泛的关注。但是现有制备萜类化合物的方法生产周期长,效率低。
技术实现要素:
本发明的目的是提供一株多孔木霉(Tolypocladium inflatum)菌株P086。
多孔木霉菌株的分离
多孔木霉(Tolypocladium inflatum),是本实验室从冬虫夏草子实体中分离而得,属于真菌界双核亚界(Dikarya)子囊菌门(Ascomycota)子囊菌亚门(Pezizomycotina)粪壳菌纲(Sordariomycetes)肉座菌亚纲(Hypocreomycetidae)肉座菌目(Hypocreales)虫草科(Ophiocordycipitaceae)弯颈霉属(Tolypocladium)。
本发明的多孔木霉(Tolypocladium inflatum)菌株P086,已于2016年11月22日,保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏编号为CGMCC NO.13191。
本发明的多孔木霉(Tolypocladium inflatum)菌株P086的鉴定中的ITS序列测序所使用引物为:ITS1:5’-TCCGTAGGTGAACCTGCGG-3’及ITS4:5’-TCCTCCGCTTATTGATATGC-3’,PCR结果为见图1。
本发明还提供了利用多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)制备萜类化合物的方法及萜类化合物对巨噬细胞释放NO的抑制作用及细胞毒性。
利用多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)制备萜类化合物(terpestacin)的方法,包括以下步骤:
(1)将活化的多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)接种到固体培养基上进行发酵培养。
(2)在步骤1)发酵后,向培养物加入有机溶剂提取,得到提取液,将所述提取液减压蒸馏,得到粗提物和子馏分。
优选的,所述的固体培养基为大米培养基。
优选的,所述的发酵培养的条件是18-28℃,静止培养20-60天。
优选的,所述的有机溶剂是乙酸乙酯、丙酮、甲醇、乙醇、氯仿、异丙醇和正丁醇等。
优选的,所述的方法中,还包括将所述粗提物和子馏分进行正向硅胶柱层层析或凝胶柱层析分离得到萜类化合物。
优选的,所述的层析,以石油醚-二氯甲烷(比例为100:0、100:1、100:2、100:3、20:1、10:1、8:1、5:1、4:1、3:1、2:1、1:1、0:1v/v)或二氯甲烷-甲醇(比例为100:0、100:1、100:2、100:3、20:1、10:1、8:1、5:1、4:1、3:1、2:1、1:1、0:1v/v))为流动相梯度洗脱;反向硅胶柱色谱分离,以甲醇-水(比例为5:95、10:90、15:85、20:80、25:75、30:70、35:65、40:60、45:55、50:50、55:45、60:40、65:35、70:30、75:25、80:20、85:15、90:10、95:5、100:0v/v)为流动相梯度洗脱;凝胶柱层析则选用甲醇为流动相洗脱。子馏分经正相、反相硅胶柱层析,馏分减压浓缩干燥后溶解于甲醇溶液中,室温静置,得到各馏分样品。在经过制备型高效液相等现代天然药物化学提取分离手段得到纯净的萜类化合物。
优选的,所述步骤1)中,还包括在固体发酵之前将多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)在固体培养基上进行预培养,取预培养后的菌丝体转接到液体培养基中进行活化培养或接种于若干固体培养基上进行活化;培养的条件均为:25℃,培养7天。
本专利菌株生长迅速,且生产萜类化合物效率很高;本专利菌株在PDB培养基上进行液体发酵72小时即可产出萜类化合物,而在大米培养基上进行固体发酵时7天即可产出萜类化合物;另外,本专利菌株产出萜类化合物总量占次级代谢产物粗提物的0.5%(10g粗提物纯化出50mg萜类化合物),产率非常高。
附图说明
图1多孔木霉菌株(菌株名)鉴定图。
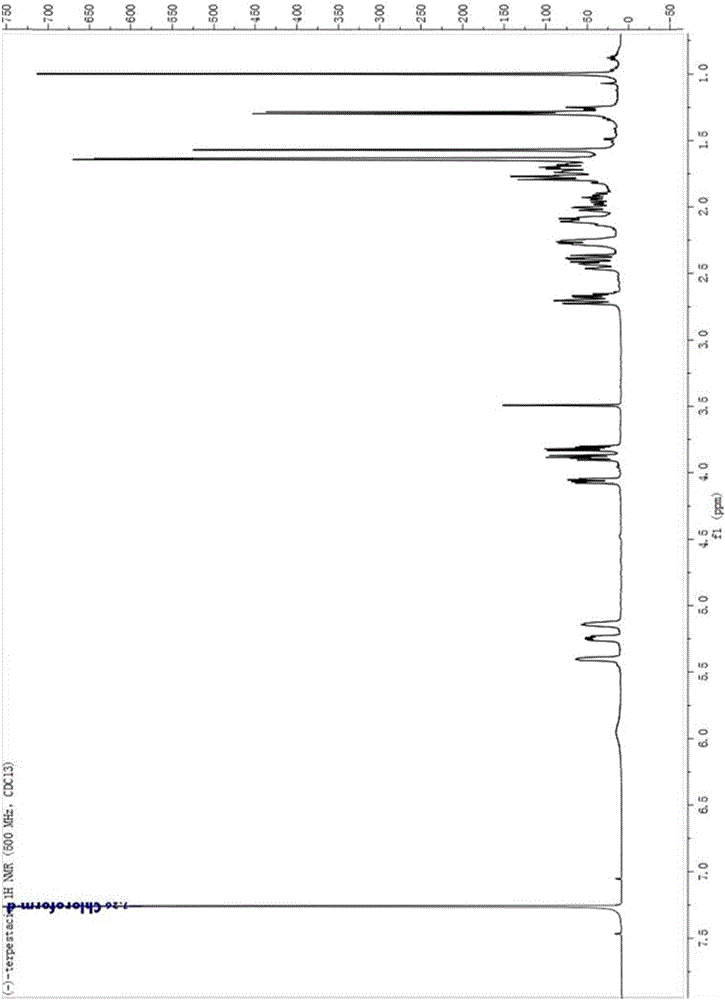
图2萜类化合物的1H-NMR(CDCl3)谱图。
图3萜类化合物的1H-NMR(Acetone-d6)谱图。
图4萜类化合物的13C-NMR(Acetone-d6)谱图。
具体实施方式
下面用实施例来进一步详述本发明,但本发明的内容并不局限于此。
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和生物材料,如无特殊说明,均可从商业途径获得。
实施例1
多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)获得
(1)菌株分离
在从冬虫夏草子实体中分离得到的一株真菌内生菌多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)。
具体分离方法是,首先,用消毒酒精对冬虫夏草子实体进行表面消毒(75%酒精30s,5%NaClO 90s)并用无菌水漂洗置于灭菌滤纸上干燥,切成小块后接种于PDA平板上培养分离纯化菌株
(2)多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)鉴定
使用艾德莱生物科技有限公司产品真菌基因组DNA快速提取试剂盒,对菌株进行DNA提取,利用引物ITS1:5’-TCCGTAGGTGAACCTGCGG-3’及ITS4:5’-TCCTCCGCTTATTGATATGC-3’对其DNA进行PCR,送于北京擎科新业生物技术有限公司测序,其ITS序列如图1所示。在美国国家生物技术信息中心(NCBI)将序列进行核酸BLAST将菌株鉴定为多孔木霉(Tolypocladium inflatum)。
多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)已于2016年11月22日,保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏编号为CGMCC NO.13191。
实施例2
多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)发酵制备萜类化合物
(1)菌株活化、发酵培养
将多孔木霉(Tolypocladium inflatum)菌株P086(CGMCC NO.13191)从低温冰箱、液氮储罐或其它保藏条件下取出,挑选菌丝接种到PDA培养基的斜面或平板上,进行预培养;预培养的条件为:25℃培养3-7天,可根据菌株的生长情况适当延长或缩短培养时间。
待菌落长到3.0–5.0cm即可将菌丝体切成约0.5cm2小块,取约10-15个菌块转接到PDB培养基中进行培养,得到种子培养液;液体培养的条件为:25℃培养3-7天,摇床速度150-300rpm。
取10毫升种子培养液接种到大米培养基的中,接种40瓶;发酵条件为25℃培养30天。
上述操作为无菌操作,各培养基需经过高压蒸汽灭菌。
其中,PDA培养基的组成为:土豆200g,葡萄糖20g,琼脂粉16g,水定容至1L。
其中,PDB液体培养基组成为:土豆200g,葡萄糖20g,水定容至1L。
其中,大米培养基的配制方法为:500毫升广口瓶中加入80g大米和100ml水,高压蒸汽灭菌。
发酵菌株需定期检查生长状态,防止污染杂菌。
(2)化合物的提取分离
A有机溶剂提取
固体发酵结束后,将300毫升乙酸乙酯分别加到各发酵瓶中,在室温用超声波清洗机超声30min,继而常温浸泡提取,24小时一次,重复提取3次,合并乙酸乙酯提取液减压蒸馏干燥,得到多孔木霉(Tolypocladium inflatum)菌株P086的次级代谢产物粗提物约10g。
B化合物的分离纯化
将所述粗提物及实验过程中的子馏分进行硅胶柱层层析或凝胶柱层析分离。其中,正向硅胶柱以石油醚-二氯甲烷(比例为100:0、100:1、100:2、100:3、20:1、10:1、8:1、5:1、4:1、3:1、2:1、1:1、0:1v/v)或二氯甲烷-甲醇(比例为100:0、100:1、100:2、100:3、20:1、10:1、8:1、5:1、4:1、3:1、2:1、1:1、0:1v/v))为流动相梯度洗脱;反向硅胶柱色谱分离,以甲醇-水(比例为5:95、10:90、15:85、20:80、25:75、30:70、35:65、40:60、45:55、50:50、55:45、60:40、65:35、70:30、75:25、80:20、85:15、90:10、95:5、100:0v/v)为流动相梯度洗脱;凝胶柱层析则选用甲醇为流动相洗脱。子馏分经正相、反相硅胶柱层析,馏分减压浓缩干燥后溶解于甲醇溶液中,室温静置,得到各馏分样品。在经过制备型高效液相等现代天然药物化学提取分离手段得到纯净的萜类化合物50mg,占粗提物总量的:0.5%(=50mg/10g)。
C化合物结构确证
萜类化合物为白色固体;比旋光度值(0.1mg/ml,MeOH);HRESIMS m/z 403.2869[M+H]+,827.5475[2M+Na]+;不同氘代试剂下氢谱(1H-NMR)、碳谱(13C-NMR)如下:依据化合物的理化性质、氢谱数据,并与参考文献数值比对(Johann Chan,Timothy F.Jamison,Synthesis of(–)-terpestacin via Catalytic,Stereoselective Fragment Coupling:Siccanol is terpestacin,not 11-epi-terpestacin,J.Am.Chem.Soc.,2003,125(38),pp 11514–11515),确定该化合物的结构与相同。
萜类化合物的1H-NMR(CDCl3)谱图如图2,谱图分析:
1H NMR(500MHz,CDCl3):δ5.94(s,1H),5.40(m,1H),5.24(dd,J=23.6,11.7Hz,1H),5.14(dd,J=4.2Hz,1H),4.06(dd,J=9.6,3.6Hz,1H),3.89(dd,J=10.4,7.0Hz,1H),3.82(dd,J=10.4,5.4Hz,1H),2.71(dd,J=11.4,2.0Hz,1H),2.67(m,1H),2.43(d,J=17.3Hz,1H),2.39(dd,J=13.6,10.5Hz,1H),2.22-2.32(m,2H),2.06-2.16(m,2H),2.02(m,1H),1.93(m,1H),1.75-1.83(m,3H),1.75–1.66(m,3H),,1.64(d,J=3.4Hz,3H),1.57(s,3H),1.30(d,J=7.1Hz,3H),0.99(s,3H)。
萜类化合物的1H-NMR(Acetone-d6)谱图如图3,谱图分析:
1H NMR(500MHz,Acetone-d6):δ5.33(m,2H)5.20(d,J=8.6Hz,1H)3.99(dd,J=9.4,4.5Hz,1H)3.84(dd,J=10.2,6.7Hz,1H)3.73(dd,,J=10.2,6.2Hz,1H)3.39(s,1H)2.81(s,1H)2.76(dd,J=11.4,2.2Hz,1H)2.64(m,1H)2.45(d,J=17.1Hz,1H)2.22-2.35(m,2H)2.07-2.17(m,2H)1.94(sextuplete,1H)1.81(dd,J=22.8,9.5Hz,1H)1.74(m,2H),谱图请见附录3。
萜类化合物的13C-NMR(Acetone-d6)谱图如图4,谱图分析:
13CNMR(500MHz,Acetone-d6):δ207.7qC,150.0qC,148.4qC,138.0qC,137.9qC,133.7qC,128.9CH,124.8CH,123.4CH,76.3CH,65.9CH2,50.4CH,49.5qC,41.1CH2,40.1CH2,38.5CH,35.7CH2,31.3CH2,29.8CH2,24.6CH2,16.9CH3,16.0CH,15.5CH3,14.9CH3,10.6CH3。
实施例3
萜类化合物的抑制巨噬细胞释放NO的生物活性测定及细胞毒性研究
将小鼠单核巨噬细胞RAW 264.7用RPMI 1640培养基(含10%胎牛血清(FBS)、100U/ml青霉素钠、100μg/ml链霉素)在CO2的恒温培养箱(含5%CO2,37℃)中孵育生长。
取对数生长期小鼠巨噬细胞RAW 264.7,将其细胞浓度用RPMI 1640培养基稀释至5×105cells/ml,将稀释后的小鼠巨噬细接种于96孔细胞培养板中,每孔加入200μl细胞悬浮液,重新置于CO2恒温培养箱中培养1h。
配制不同浓度的萜类化合物样品并取0.4μl(DMSO终浓度0.2%)分别加入96孔板中,每孔加入LPS使其终浓度为1μg/ml,在CO2恒温培养箱中培养24h。本步骤设置LPS组(即不加入被测试样品)和空白对照组(DMSO),每样品设置3个重复。
吸取培养液上清100μl至酶标板中,加入等体积的Griess试剂,室温下反应10min后测定550nm处的吸光值。Griess试剂A:w(N-萘乙胺盐酸盐)=0.1%溶于水中;Griess试剂B:w(对氨基苯磺酰胺)=1%溶于φ(H3PO4)=5%中,使用前等体积混合试剂A和B。
用浓度分别为0,1,2,5,10,50,100μmol/L的NaNO2绘制标准曲线,根据NaNO2标准曲线计算细胞培养上清液中NO2-的浓度以及对NO释放的抑制率。在上述培养板每孔加入MTT溶液(终浓度200μg/mL),置于CO2培养箱中继续培养4h后,弃去上清,吸干残留液体,加入DMSO 150μL,振摇10min使生成的甲瓒结晶充分溶解后,以630nm为参比波长在570nm下测定吸光值,评价样品的细胞毒性。
上述所使用RPMI 1640培养基配方来自文献Moore,G.E.Gerner,R.E.andFranklin,H.A.(1967)A.M.A.,199,519,用之前热灭活30min,56℃。
所使用Griess试剂的A液:对氨基苯磺酸0.5g,稀醋酸(10%左右)150mL;B液:α萘胺0.1g,蒸馏水20mL,稀醋酸(10%左右)150mL。
采用上述方法对萜类化合物进行了抑制小鼠巨噬细胞中NO释放活性的测试,选择氢化可的松(Hydrocortisone)作为阳性对照药,只有在不影响正常细胞正常增值的浓度范围内,表现出来的对巨噬细胞释放NO的抑制活性才具有真正意义。
实验测得萜类化合物确有抑制巨噬细胞释放NO的生物活性,其半数抑制浓度IC50=10.36±1.28μM;此外,萜类化合物也具有一定的细胞毒性,样品的细胞毒性为85±6.27μM。
序列表
<110> 中国科学院微生物研究所
<120> 一株多孔木霉菌株及其制备萜类化合物的方法
<160> 1
<210> 1
<211> 529
<212> DNA
<213> 多孔木霉(Tolypocladium inflatum)
<400> 1
ctgcggaggg atcattaccg agttatcaac tcccaaaccc ctgtgaacat acccaacgtt 60
gcttcggcgg gaccgccccg gcgcctcggc gtcccggaac caggcgcccg ccggaggacc 120
caaactcttg tttaaccata gtggcatatt ctgagtctca caagaaaaat gaatcaaaac 180
tttcaacaac ggatctcttg gctctggcat cgatgaagaa cgcagcgaaa tgcgataagt 240
aatgtgaatt gcagaattca gtgaatcatc gaatctttga acgcacattg cgcccgccag 300
tattctggcg ggcatgcctg ttcgagcgtc atttcaaccc tcaagcccca gcggcttggt 360
gttggggacc ggccccggcc gccccccaaa tgcagtggcg acctcgccgc agcctcccct 420
gcgtagtagc acaactcgca ccggagcgcg gagacggtca cgccgtaaaa cgcccaactt 480
ctcagagttg acctcggatc aggtaggaat acccgctgaa cttaagcat 529
- 还没有人留言评论。精彩留言会获得点赞!