免疫调节化合物的制作方法
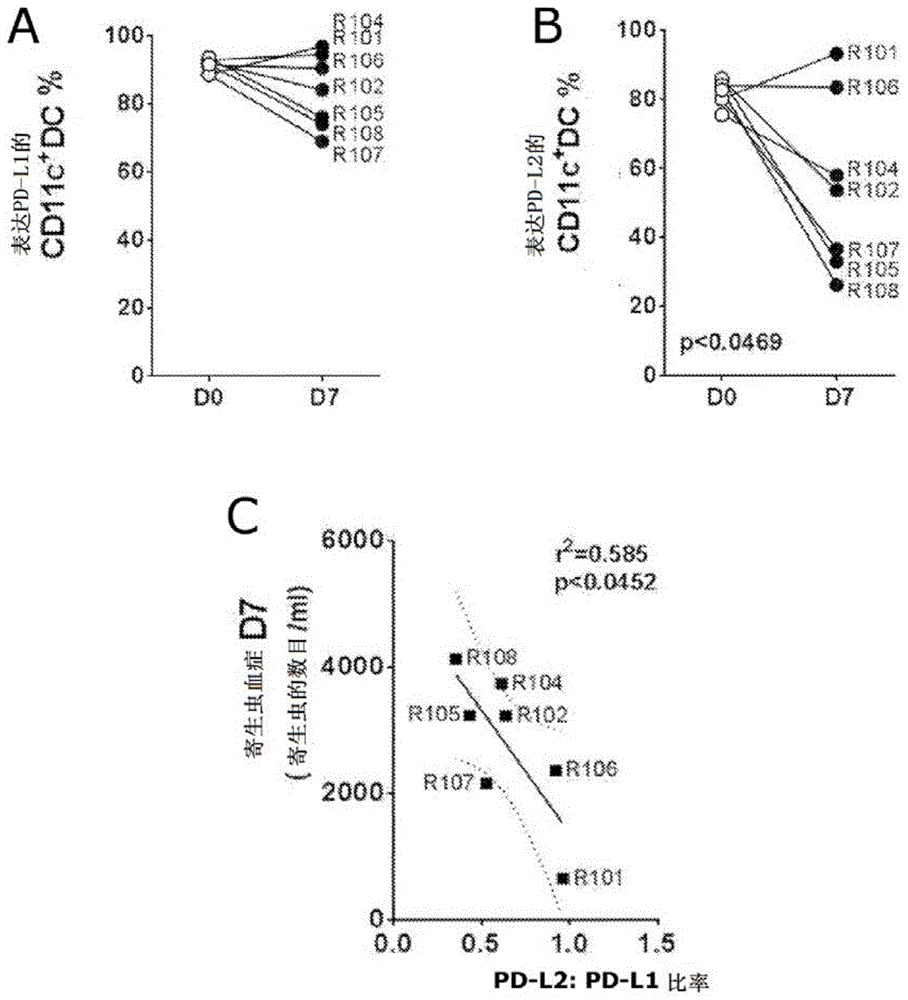
本发明一般涉及用于调节免疫应答的化合物。更具体地,本发明涉及用于调节th1免疫应答的pd-l2的寡聚形式。本发明化合物可用于一系列th1介导的疾病,包括病原性感染和过度增殖性疾病。
背景技术:
:程序性细胞死亡蛋白1(pd-1)被认为是免疫调节中的重要参与者,通过其作为效应t细胞的制动,并降低组织微环境中的免疫应答。pd-1在活化的t细胞上表达,包括免疫抑制性cd4+t细胞(treg)和耗尽的cd8+t细胞,也在b细胞、骨髓树突细胞(mdc)、单核细胞、胸腺细胞和自然杀伤(nk)细胞上表达。这种广泛的pd-1表达提示有效免疫和维持t细胞稳态所需的pd-1信号传导途径的广泛意义(gianchecchi等人,autoimmun.rev.12:1091-100,2013)。值得注意的是,pd-1信号传导途径有助于维持正常个体的中枢和外周耐受。在胸腺中,pd-1与其配体的相互作用抑制了阳性选择,从而抑制cd4-cd8-双阴性细胞向cd4+cd8+双阳性t细胞的转化(keir等人,j.immunol.175:7329-7379,2005)。pd-1信号传导还负责抑制自身反应性和逃避阴性选择的炎症效应t细胞,以避免附带的免疫介导的组织损伤(keir等人,j.exp.med.203:883-895,2006)。pd-1具有两种已知的配体:蛋白死亡配体1(pd-l1;freeman等人,j.exp.med.192:1027-34,2000),在人类中也被称为b7-h1(dong等人,nat.med.5:1365-9,1999),和蛋白死亡配体2(pd-l2;latchman等人,nat.immunol.2:261-8,2001),也称为b7-dc(tseng等人,j.exp.med.193:839-46,2001)。pd-l1和pd-l2的表达模式非常不同。pd-l1由多种免疫细胞和非免疫细胞进行组成型表达,并且在强烈炎症信号存在下似乎在大多数正常组织细胞中上调(matzinger等人,nat.rev.immunol.11:221–230,2011;mühlbauer等人,j.hepatol.45:520–528,2006;pinchuk等人,gastroenterol.135:1228–1237,2008;stanciu等人,j.infect.dis.,193:404–412,2006)。相比之下,pd-l2的组成型基础表达与pd-l1相比较低,尽管pd-l2表达最初被认为仅限于抗原呈递细胞,如单核细胞、巨噬细胞和树突细胞(dc)(latchman等人,natureimmunol.2:261–268,2001;yamazaki等人,j.immunol.169:5538-5545,2002),最近有几组研究表明可以在多种其他免疫细胞和非免疫细胞上诱导pd-l2的表达,这取决于微环境刺激(kinter等人,j.immunol.181:6738–6746,2008;zhong等人,eur.j.immunol.37:2405–2410,2007;messal等人,mol.immunol.48:2214–2219,2011;lesterhuis等人,mol.immunol.49:1-3,2011)。恶性细胞和周围的微环境细胞异常表达pd-1及其配体。在肿瘤微环境中,pd-1在来自许多不同肿瘤类型的大部分肿瘤浸润淋巴细胞(til)中高度表达,并抑制局部效应免疫应答。pd-1的til表达与效应功能受损(细胞因子产生和对肿瘤细胞的细胞毒性效力)和/或几种肿瘤类型的不良结果相关(thompson等人,clin.cancerres.13:1757–1761,2007;zhang等人,mol.immunol.7:389–395,2010;ahmadzadehm等人,blood114:1537–1544,2009;shi等人,int.j.cancer128:887–896,2011),包括肾细胞癌、转移性黑色素瘤、以及胃癌、乳癌、卵巢癌、胰腺癌和肺癌。类似地,已经观察到pd-l2在人肿瘤的子集中得以上调,并且有时与不良结果相关(rozali等人,clin.dev.immunol.2012:656340,2012)。鉴于其在肿瘤微环境中与癌症相关的免疫抑制中的潜在作用,已经提出将靶向pd-1/pd-配体途径作为有吸引力的治疗策略。在这方面的一些研究已经研究了阻断性抗体对pd-1/pd-l1途径的治疗效果,证明了增强的肿瘤控制率(curran等人,proc.natl.acadsci.usa107:4275-4280,2010;iwai等人,proc.natl.acadsci.usa99:12293-12297,2002;pilon-thomas等人,j.immunol.184:3442-3449,2010;zhang等人,blood114:1545-1552)。然而,很少有研究调查阻断pd-l2作为明确的治疗策略。虽然在很少的研究中使用pd-l2阻断策略,但这总是与靶向pd-l1相结合(parekh等人,j.immunol.182:2816-1826,2009;he等人,j.immunol.173:4919-4928,2004),其无法推断抗pd-l2策略的真实价值。技术实现要素:本发明部分基于这样一种确定,即pd-l2在与抗原特异性免疫效应细胞(iec)(所述免疫效应细胞包括t淋巴细胞)相互作用的细胞(如抗原呈递细胞(apc))上的表达与th1相关疾病的严重程度呈负相关,以及pd-l2是建立th1免疫的必要条件。还发现,pd-l2聚集在这种iec-相互作用细胞的表面上可以抑制pd-l1与pd-1的结合,从而抑制pd-l1对iec的免疫抑制功能。令人惊讶的是,本发明人还确定了,相较于二聚体pd-l2与pd-1的结合,寡聚度大于2的pd-l2寡聚体具有显著更高的亲和力,并且这种“更高量级的pd-l2寡聚体”可以显著降低pd-l1对iec功能的抑制作用,包括cd4+t细胞功能。如下所述,这些发现已经实践到用于调节th1免疫的新试剂和方法中。因此,在一个方面,本发明提供了可用于刺激或增强th1免疫的多肽复合物,该复合物通常由式(i)所示:[p]n(i)其中:p,每次出现时独立地代表蛋白分子,所述蛋白分子包含pd-l2多肽、由pd-l2多肽组成、或基本上由pd-l2多肽组成;以及n代表大于2的整数。适当地,p缺少肿瘤或肿瘤相关的新生血管靶向结构域。在一些实施方案中,pd-l2多肽包含pd-l2的可溶部分、由pd-l2的可溶部分组成、或基本上由pd-l2的可溶部分组成,说明性示例包括有信号肽的pd-l2胞外域或没有信号肽的pd-l2胞外域。在具体的实施方案中,蛋白分子缺少pd-l2跨膜结构域和pd-l2胞质结构域中的一者或两者。适当地,n为≥3、≥4、≥5、≥6、≥7或≥8。在此类型的说明性示例中,n为≤100、≤50、≤30或≤20。在具体的实施方案中,n为3至20,适当地为4至16,更适当地为8至12。蛋白分子化学偶联在一起以形成多肽复合物。或者单个蛋白分子还包含至少一个寡聚化结构域,所述寡聚化结构域促进蛋白分子的自组装以形成多肽复合物。在这些实施方案中,典型地,至少一个寡聚化结构域与pd-l2多肽可操作地连接以形成单链嵌合多肽。在至少一个寡聚化结构域可操作连接至pd-l2多肽的实施方案中,另一方面本发明提供了一种蛋白分子,其包含上文和本文其他地方广泛描述的pd-l2多肽、由上文和本文其他地方广泛描述的pd-l2多肽组成、或基本上由上文和本文其他地方广泛描述的pd-l2多肽组成,所述pd-l2多肽可操作地连接至少一个寡聚化结构域以形成根据式(i)的多肽复合物,其中所述寡聚化结构域促进所述蛋白分子的自组装。寡聚化结构域可操作地连接至所述pd-l2多肽的上游(即氨基末端)和/或下游(即羧基末端)。例如,在至少一个寡聚化结构域可操作地连接至pd-l2多肽下游的实施方案中,蛋白分子包含式(ii)所示单个多肽链、由式(ii)所示单个多肽链组成、或基本上由式(ii)所示单个多肽链组成:pd-l2-l-omda(ii)其中:pd-l2代表pd-l2多肽;omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i≥3,适当地为3、4、5或6;以及l是键或肽接头。或者,蛋白分子包含式(iii)所示单个多肽链、由式(iii)所示单个多肽链组成、或基本上由式(iii)所示单个多肽链组成:pd-l2-l-omda-l-omdb(iii)其中:omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i≥2,适当地为2、3、4、5或6;l,每次出现时独立地代表键或肽接头;以及omdb是寡聚化结构域,其形成j个亚基omdb的寡聚体(omdb)j,其中j是大于i的整数,适当地为i+1、i+2、i+3、i+4、i+5或i+6;在这种类型的说明性示例中,i是2并且j是4或6。在一些实施方案中,至少一个寡聚化结构域可操作地连接至pd-l2多肽上游,蛋白分子包含式(iv)所示单个多肽链、由式(iv)所示单个多肽链组成、或基本上由式(iv)所示单个多肽链组成:omda-l-pd-l2(iv)其中:omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i≥3,适当地为3、4、5或6;l是键或肽接头;以及pd-l2代表pd-l2多肽。或者,蛋白分子包含式(v)所示单个多肽链、由式(v)所示单个多肽链组成、或基本上由式(v)所示单个多肽链组成:omdb-l-omda-l-pd-l2(v)其中:omdb是寡聚化结构域,其形成j个亚基omdb的寡聚体(omdb)j,其中j≥2,适当地为2、3、4、5或6;l,每次出现时独立地代表键或肽接头;以及omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i是大于j的整数,适当地为j+1、j+2、j+3、j+4、j+5或j+6;以及pd-l2代表pd-l2多肽。在这种类型的说明性示例中,j是2并且i是4或6。在一些实施方案中,个体寡聚化结构域(例如,omda或omdb)在结合配偶体存在下组装成异寡聚体。寡聚化结构域和所述结合配偶体可以是特异性结合对的成员,示例性示例包括生物素-抗生物素蛋白、生物素-链霉亲和素、抗原-抗体、半抗原-抗半抗原、配体-受体以及受体-共受体。本发明考虑使用任何合适的寡聚化结构域,包括例如二聚化结构域(例如,免疫球蛋白fc结构域、亮氨酸拉链等)、三聚化结构域(例如,大肠杆菌天冬氨酸转氨甲酰酶(atcase)的催化亚基、来自t4噬菌体次要纤维蛋白(fibritin)的“foldon”三聚序列、颈区肽、人肺表面活性剂蛋白d、寡聚化卷曲螺旋粘附素、i类包膜病毒融合蛋白的互补七肽重复区等)、四聚化结构域(例如,四臂粘联蛋白(tetrabrachion)的卷曲螺旋结构域)、五聚化结构域(例如,色氨酸拉链或软骨寡聚基质蛋白(comp)的五聚化结构域等)和六聚化结构域(例如,来自iga抗体重链c-末端的尾部)。在一些实施方案中,至少一个寡聚化结构域直接与pd-l2多肽连接。在其他实施方案中,至少一个寡聚化结构域通过肽接头和pd-l2多肽连接,所述肽接头通常由约1个至约100个氨基酸残基(以及其间的所有整数个氨基酸残基)组成,通常约1至约30个氨基酸残基(和其间的所有整数个氨基酸残基),通常约1至约20个氨基酸残基(和其间的所有整数个氨基酸残基)。肽接头可包含至少一个部分,所述部分选自:促进纯化所述蛋白分子的纯化部分、调节对所述蛋白分子免疫应答的免疫调节部分、和赋予结构灵活性的部分。可以合成产生或通过重组方法产生蛋白分子。在重组产生蛋白分子的实施方案中,另一方面本发明提供了一种核酸构建体,其包含上文和本文其他地方广泛描述的蛋白分子的编码序列,其可操作地连接至可在宿主细胞中操作的调节元件。在相关方面,本发明提供了一种宿主细胞,其含有上文和本文其他地方广泛描述的核酸构建体。宿主细胞可以是原核或真核宿主细胞。在蛋白分子至少包含寡聚化结构域的实施方案中,蛋白分子可以在合适的条件下(例如,在水溶液中)自组装以形成根据式(i)的多肽复合物。因此,在另一方面,本发明提供了一种产生多肽复合物的方法,其中所述方法包括:在适于形成多肽复合物的条件下(例如,在水溶液中),将上文和本文其他地方广泛限定的蛋白分子进行组合,从而产生多肽复合物,其包含n个亚基蛋白分子的寡聚体。另一方面,本发明提供一种免疫调节组合物,其包含上文和本文其他地方广泛描述的多肽复合物,以及药学上可接受的载体或佐剂。本发明的多肽复合物或组合物可用于在受试者或生产动物中刺激、引发或增强免疫应答,所述免疫应答包括th1免疫应答。因此,本发明的另一方面提供了一种在受试者中刺激、引发或增强免疫应答的方法,所述免疫应答包括th1免疫应答,其中所述方法包括向所述受试者施用上文和本文其他地方广泛描述的多肽复合物或组合物。在相关方面,本发明提供了治疗受试者中与th1相关的疾病或病症的方法。这些方法通常包括向受试者施用有效量的上文和本文其他地方广泛描述的多肽复合物或组合物。在一些实施方案中,当受试者被鉴定为具有受损的th1免疫时,将本发明的多肽复合物或组合物施用于受试者。可以使用任何合适的方法评估受试者的th1免疫状态。在有利的实施方案中,通过以下方法评估受试者的th1免疫状态:(1)确定获自受试者的样品中的th1免疫状态生物标记物谱,其中所述th1免疫状态生物标记物谱包含样品中至少一种th1免疫状态生物标记物的生物标记物值,其中所述至少一种th1免疫状态生物标记物包含与所述样品中iec-相互作用细胞相互作用的细胞中的pd-l2、和任选的pd-l1;以及(2)使用所述生物标记物值确定指示物,其中所述指示物至少部分指示所述受试者的th1免疫状态。在具体的实施方案中,iec-相互作用细胞是apc,其适当地选自树突细胞和巨噬细胞。在这种类型的代表性示例中,apc是表达cd11c的树突细胞。在其他实施方案中,iec-相互作用细胞是肿瘤细胞。适当地,生物标记物值至少部分地指示获自受试者的样品中th1免疫状态生物标记物的浓度,在该类型的一些实施方案中,生物标记物物值包括th1免疫状态生物标记物的丰度。在代表性示例中,个体生物标记物值包括:在细胞表面上表达th1免疫状态生物标记物的iec-相互作用细胞的百分比(例如,pd-l2+树突细胞、pd-l2+肿瘤细胞等)。在这种类型的一些实施方案中,th1免疫状态生物标记物是pd-l2并且生物标记物值是聚集在iec-相互作用细胞(例如apc(如树突细胞)或肿瘤细胞)表面上的pd-l2的量度。当确定受试者的th1免疫状态时,在一些实施方案中,相对于pd-l2的对照水平而言,样品中pd-l2的水平降低,其中所述pd-l2的对照水平与存在正常的th1免疫或未受损的th1免疫相关,因此确定指示物至少部分指示th1免疫受损。在其他实施方案中,样品中pd-l2的水平与pd-l2的对照水平大致相同,所述pd-l2的对照水平与存在正常的th1免疫或未受损的th1免疫相关,因此确定指示物以至少部分指示正常的th1免疫或未受损的th1免疫。在其他实施方案中,相对于pd-l2的对照水平,样品中pd-l2的水平增加,所述pd-l2的对照水平与存在正常的th1免疫或未受损的th1免疫相关,因此确定指示物至少部分地指示th1免疫升高。在这些实施方案的代表性示例中,不向受试者施用本发明的多肽复合物或组合物。当至少一种th1免疫状态生物标记物包含pd-l1时,用于评估th1免疫状态的指示物更可靠并具有更强的诊断能力。因此,在一些实施方案中,来自th1免疫状态生物标记物对的生物标记物值用于确定指示物。例如,在一些优选的实施方案中,生物标记物对是pd-l2和pd-l1。当在本发明的方法中使用多于一种th1免疫状态的生物标记物时,适当地该方法还包括将组合功能应用于生物标记物值。在这方面,合适的组合功能的说明性示例选自:加性模型、线性模型、支持向量机、神经网络模型、随机森林模型、回归模型、遗传算法、退火算法、加权和、近邻模型和概率模型。优选地,上述和本文其他地方所述的方法适用于包括:(a)确定第一th1免疫状态生物标记物的生物标记物值;(b)确定第二th1免疫状态生物标记物的相应生物标记物值;(c)使用第一和第二th1免疫状态生物标记物记录的生物标记物值来确定指示物,所述指示物指示第一和第二th1免疫状态生物标记物记录的生物标记物值的比率。在这种类型的说明性方法中,第一th1免疫状态生物标记物是pd-l2,并且第二th1免疫状态生物标记物是pd-l1。例如,在一些实施方案中,相对于对照pd-l2:pd-l1生物标记物值的比率而言,样品中确定的第一和第二th1免疫状态生物标记物值的比率(“样品th1免疫状态生物标记物的比率”)降低,其中所述对照pd-l2:pd-l1生物标记物值的比率与存在正常的th1免疫或未受损的th1免疫相关,并且确定所述指示物至少部分指示th1免疫受损。例如,适当地,样品的生物标记物值的比率不超过对照生物标记物值的比率(例如,从具有正常的th1免疫应答或未受损的th1免疫应答的受试者所得的对照样品中确定的)的约95%、94%、93%、92%、91%、90%、80%、70%、60%、50%、40%、30%、20%或10%(和其间的每个整数)。相反,相对于对照pd-l2:pd-l1生物标记物值的比率,当样品pd-l2:pd-l1生物标记物值的比率提高时,确定指示物至少部分地指示th1免疫升高,其中所述对照pd-l2:pd-l1生物标记物值的比率与存在正常的th1免疫或未受损的th1免疫相关。在这些情况下,样品pd-l2:pd-l1生物标记物值的比率至少为对照生物标记物值的比率(例如,从具有正常的th1免疫应答或未受损的th1免疫应答的受试者所得的对照样品中确定的)的约105%、106%、107%、108%、109%、110%、120%、130%、140%、150%、160%、170%、180%、190%、200%、250%、300%、400%、500%、600%、700%、800%、900%或1000%(以及介于两者之间的每个整数)。在其他实施方案中,当样品pd-l2:pd-l1生物标记物值的比率与对照pd-l2:pd-l1生物标记物值的比率大致相同时,确定指示物以至少部分地指示正常或未受损的th1免疫,其中所述对照pd-l2:pd-l1生物标记物值的比率与存在正常的th1免疫或未受损的th1免疫相关。在这些情况下,样品pd-l2:pd-l1生物标记物值的比率通常为对照生物标记物值的比率(例如,从具有正常的th1免疫应答或未受损的th1免疫应答的受试者所得的对照样品中确定的)的约96%至104%(以及其间的所有整数百分比)。在这些实施方案的代表性示例中,不向受试者施用本发明的多肽复合物或组合物。用于测量蛋白生物标记物或核酸生物标记物的任何已知技术都适用于本发明。例如,可以使用流式细胞术、免疫测定、质谱、测序平台、阵列和杂交平台或其组合来测量生物标记物。本发明人的发现使得能够实现诊断具有不期望th1免疫状态的疾病和/或病症(在本文中也可互换地称为“th1相关疾病”或“th1相关病症”)的方法、以及用于施用治疗方案,所述治疗方案包括本发明的多肽复合物或组合物用于治疗这些疾病。因此,在另一方面,本发明提供上文和本文其他地方所述的方法,其中所述指示物用于诊断th1相关疾病或病症的存在或不存在。在一些实施方案中,所述疾病或病症与降低的或抑制的th1免疫状态相关,并且当从受试者获得的样品中pd-l2水平低于预定阈值时,诊断所述疾病或病症。例如,与降低的或抑制的th1免疫状态相关的疾病或病症可以是癌症(包括转移性癌症)或病原性感染。附图说明图1是来自facs分析的图形表示输出,其表征细胞表面上生物标记物的表达。dc上的pd-l2表达与人类中疟疾寄生虫血症呈负相关。(a-c)7名健康人志愿者接种恶性疟原虫(p.falciparum),并感染前和感染后7天检查血液中表达(a)pd-l1和(b)pd-l2的cd11c+dc的百分比。(c)图显示每毫升血液的寄生虫数与%pd-l2:%pd-l1dc的比率。r101至r108代表每个志愿者。p值检验整体斜率为零的零假设。图2的图示显示(a)小鼠中典型感染过程的寄生虫血症平均百分比,小鼠感染有非致死性夏氏疟原虫(p.chabaudi)或约氏疟原虫(p.yoelii)17xnl株疟疾,并监测长达40天。(b)感染致死性约氏疟原虫ym株或柏氏鼠疟原虫(p.berghei)的小鼠中典型感染过程的寄生虫血症平均百分比,并监测10天。误差条表示sem(n=4-8)。图3的图示显示(a)表达pd-l1的总cd11c+dc的百分比,和(b)pd-l1+cd11c+脾dc上表面pd-l1表达的平均荧光强度(mfi),所述脾dc来自初始的(naive)和感染的小鼠(感染后7天)。(c)表达pd-l2的总cd11c+dc的百分比,和(d)来自初始和感染小鼠(感染后7天)的pd-l2+cd11c+脾dc上表面pd-l2表达的mfi。散点图上的条形表示平均值。通过wilcoxon匹配对符号秩检验来分析匹配的第0天和第7天人样品之间的显著性。使用单因素anova和tukey多重比较检验来分析多组之间的显著性(*p<0.05;**p<0.01;***p<0.001;****p<0.0001用于组间比较)。(a)和(c)的数据表示合并的独立实验,独立实验获得了类似的结果。图4的图示显示来自致死性和非致死性疟疾的dc上pd-l1和pd-l2表达水平。(a)-(e)来自(a)初始小鼠、和感染疟疾菌株(b)非致死性约氏疟原虫17xnl株、或(c)非致死性夏氏疟原虫、(d)致死性约氏疟原虫ym株、或(e)致死性柏氏鼠疟原虫的小鼠的活cd19-cd3-d11c+dc上pd-l1、pd-l2和cd8表达的流式细胞谱。(f)图3b和d中使用的,在不同电压设置的不同流式细胞仪上测量的,来自初始小鼠和感染小鼠(感染后7天)表达pd-l1和pd-l2的cd11c+脾dc的mfi重复实验。(g)在来自分离自dc(初始或在第7天用约氏疟原虫17xnl株和ym株感染)的rna中pd-l1和pd-l2的定量rt-pcr分析。将结果对三个管家基因(cxxc1、tbp和mrpl13a)的几何平均值进行归一化。数值表示为三次独立实验的平均值±sem,并且表示为相对于未感染小鼠的结果。图5的图示显示pd-l2改善对疟疾感染的免疫力和存活。(a-c)对于(a)pd-l2ko和野生型小鼠(n=4)或(b)用大鼠igg或抗pd-l2阻断性抗体(n=5)治疗的野生型小鼠中,约氏疟原虫17xnl株疟疾的典型过程中寄生虫血症百分比的平均值;以及(c)用大鼠igg或抗pd-l2阻断性抗体治疗的野生型小鼠中(n=5),夏氏疟原虫疟疾的典型过程中寄生虫血症百分比的平均值(在对数尺度上)。箭头表示大鼠igg治疗的小鼠中寄生虫清除比抗pd-l2治疗的小鼠早4天。数据代表获得类似结果的两个独立实验之一。使用基于双侧的非参数mann-whitneyu检验分析某些时间点的显著性。误差条表示sem(*p<0.05;**p<0.005)。图6的图示显示在约氏疟原虫17xnl株疟疾期间,pd-l2调节保护、症状和th1免疫。(a-d)在(a)-(b)野生型小鼠和pd-l2ko小鼠(n=5)或(c)-(d)用大鼠igg或抗pd-l2阻断性抗体(n=5)治疗的野生型小鼠中,在约氏疟原虫17xnl株疟疾的典型期间,来自图5a和b重复实验的寄生虫血症和临床症状评分。(e)图2c所述的重复实验中,用大鼠igg或抗pd-l2阻断性抗体(n=5)治疗的野生型小鼠中,夏氏疟原虫疟疾典型过程期间的寄生虫血症。箭头表示大鼠igg治疗的小鼠中寄生虫清除比抗pd-l2治疗的小鼠早3天。图7的图示显示(a)用于通过流式细胞术评估cd4+t细胞中tbet表达的门控策略。(b)-(c)散点图显示用大鼠igg(n=7)或抗pd-l2阻断性抗体(n=7)治疗的野生型小鼠中、或用约氏疟原虫17xnl株感染14天的pd-l2ko小鼠(n=3)中每脾脏中t细胞的数目。(b)每脾脏中表达tbet的cd4+cd62lhi或cd4+cd62llot细胞的平均数目。(c)在初始dc存在下,对寄生虫抗原(msp119)产生应答且在elispot培养物中分泌ifn-γ的每脾脏中cd4+t细胞的平均数目。(d)散点图显示,在第14天,在初始dc存在下对寄生虫肽(pb1)产生应答且在elispot培养物中分泌ifn-γ的每脾脏中cd8+t细胞的数目。除了pd-l2ko小鼠评估一次外,数据来自2个独立实验。使用基于双侧的非参数mann-whitneyu检验分析显著性(*p<0.05;***p<0.001)。图8的图示显示在感染约氏疟原虫17xnl株的小鼠中阻断pd-l2抑制寄生虫特异性cd4+t细胞的扩增。用约氏疟原虫17xnl株感染野生型小鼠,并用大鼠igg或抗pd-l2阻断性抗体(n=7)治疗。(a)、(b)、(c)在(a)第0天、(b)第7天、和(c)第14天每脾脏中表达tbet的cd4+cd62lhi或cd4+cd62llot细胞的数目;(d)在初始dc存在下对寄生虫抗原(msp119)产生应答且在elispot培养物中分泌ifn-γ(ifn-γ)的cd4+t细胞数目。(e)通过掺入edu测量的,在初始dc存在下对寄生虫抗原msp119产生应答且在培养物中增殖的cd4+t细胞数目;(f)和(g)约氏疟原虫17xnl株感染小鼠血清中(f)ifn-γ和(g)il-10的平均水平。(h)每脾脏表达cd25和foxp3的cd4+t细胞(调节性t细胞)的平均数目。散点图上的条表示中值。数据代表两个合并的独立实验。使用基于双侧的非参数mann-whitneyu检验分析显著性(*p<0.05;**p<0.01;***p<0.001)。图9的图示显示dc表达的pd-l1和pd-l2对t细胞和免疫的不同作用。在致死性约氏疟原虫ym株感染第7天采集,并针对dc亚群的标记物(cd4+;cd8+;b220+pdc;和cd11b+dc)进行标记,来自(a)野生型和(b)pd-l1ko小鼠的cd19-cd3-cd11c+dc的流式细胞谱。(c)存活曲线显示没有pd-l1表达的dc对致死性疟疾的保护作用。用104约氏疟原虫ym株prbc的致死剂量感染野生型和pd-l1ko小鼠,从感染的(药物治愈的)小鼠中分离dc,并将1x107个dc转移到每组四只初始小鼠的每只小鼠中,实验一式两份。24小时后,每只小鼠用104约氏疟原虫ym株prbc感染,每1至3天监测存活,持续50天。(d)-(e)重复实验,其中在致死性约氏疟原虫ym株感染的第7天采集,输注有来自野生型和pd-l1ko小鼠的约1×107dc的初始小鼠中的寄生虫血症。24小时后,用104约氏疟原虫ym株prbc感染每只输注的小鼠,并每1至3天进行监测,持续50天。结果是平均值±sem,n=4只小鼠/组。(i)存活曲线显示pd-1ko小鼠对致死性疟疾具有免疫。在一式两份实验中,五只野生型和pd-1ko小鼠的组用致死性104约氏疟原虫ym株prbc进行感染,每1至3天监测存活,持续50天。(j)-(k)重复实验,其中用104约氏疟原虫ym株prbc感染的野生型和pd-1ko小鼠中的寄生虫血症,每1至3天监测,持续50天。结果是平均值±sem,n=5只小鼠/组。(l)-(p)用表达pd-l1和pd-l2的dc培养的cd4+cd62llopd-1+t细胞上cd3和icos表达的流式细胞术分析;其中(l)是仅包含t细胞不含dc的阴性对照;(m)是包含t细胞和dc的阳性对照;(n)pd-1的阻断;(o)pd-l1的阻断;和(p)pd-l2的阻断;36小时后。从约氏疟原虫17xnl株感染12-14天的小鼠脾脏中分离t细胞和dc。基于在抗pd-l1培养物中发现的清晰双峰选择确定高cd3或icos表达的门。(q)散点图显示在来自三个独立实验的重复孔中(n=3至5)具有高cd3和icos表达的cd4+cd62lot细胞的百分比/孔,三个独立实验显示为白色、淡蓝色和深蓝色的点。误差条表示平均值。使用来自三个实验之一的非配对t-检验(单侧)来分析显著性(*p<0.05;**p<0.005;***p<0.0005;****p<0.0001)。图10的图示显示在患有转移性黑色素瘤的患者中血液dc上pd-l2表达降低。(a-c)血液来自8名健康人志愿者、4名患有非黑色素瘤病变和4名患有转移性黑色素瘤的患者。检查他们的血液中表达(a)pd-l1和(b)pd-l2的cd11c+dc的百分比。(c)图显示每组中%pd-l2:%pd-l1dc的比率。各组之间使用mannwhitney检验的(a)和(b)的p值,(c)通过kruskal-wallis多重比较检验进行计算。图11的图示显示pd-l2的八聚体形式防止致死性疟疾。(a)寄生虫血症的平均百分比;(b)对数尺度显示患有寄生虫血症的小鼠的数目;(c)存活(x轴表示感染后的天数);(d)感染后3、5和7天,在用阴性对照(人)igg或二聚体pd-l2治疗的野生型小鼠中约氏疟原虫ym株疟疾典型过程的寄生虫血症百分比。以及(e)在寄生虫血症可检测后,在第3天、然后是第5天和第7天(总共n=12,来自三次独立实验)用对照(人)igg或pd-l2治疗的野生型小鼠中约氏疟原虫ym株疟疾典型过程的临床症状评分(x轴显示感染后的天数)。让所有存活的小鼠休息,并在150天后用相同剂量的致死性约氏疟原虫ym株疟疾(不施用另外的pd-l2)再次攻击,连同年龄匹配的新对照小鼠(对照ig-r)。(f)在用约氏疟原虫ym株再次攻击后20天,给予来自pd-l2治疗小鼠的200μl血液的初始小鼠中寄生虫血症的峰值百分比(x轴显示感染后的天数)。该试验检测供体小鼠血液中寄生虫的低数目。(g)临床症状评分,(h)存活(x轴表示感染后的天数),和(i)在感染后第3、5和7天(总共n=9,来自2次独立实验),用对照(人)igg或pd-l2治疗的野生型小鼠中柏氏鼠疟原虫感染典型过程中寄生虫血症的平均百分比(x轴显示感染后的天数)。误差条表示sem。使用log-rank(mantel-cox)检验分析存活的显著性。图12显示可溶性十二聚体pd-l2(spd-l2)对晚期黑色素瘤的保护作用的图示。将6只c57bl/6小鼠的组皮下植入5×105个b16.f0黑色素瘤细胞。在第9天左右,当平均肿瘤尺寸为约100mm3时,在第9、11和13天给予小鼠200μg人igg或spd-l2,每1-2天监测肿瘤尺寸。数据表示合并的两个独立实验中的一个,两个独立实验获得了类似的结果。使用基于单侧的非参数mann-whitneyu检验确定p值(***p=0.0006用于组之间的比较)。图13显示spd-l2对黑色素瘤的早期保护的图示。将6只c57bl/6小鼠的组皮下植入1×105个b16.f10黑色素瘤细胞。在第9天左右,当平均肿瘤尺寸为约100mm3时,在第3、9和15天给予小鼠200μg人igg或spd-l2,每1-2天监测肿瘤尺寸。数据表示合并的两个独立实验中的一个,两个独立实验获得了类似的结果。使用基于单侧的非参数mann-whitneyu检验确定p值(***p=0.03用于组之间的比较)。具体实施方式1.定义除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些类似或等同的任何方法和材料可用于本发明的实践或测试,但描述了优选的方法和材料。出于本发明的目的,以下术语定义如下。本文使用的冠词“一种(a)”和“一种(an)”指的是一个或多于一个(即至少一个)冠词语法对象。举例来说,“一种元件”表示一个元件或多于一个元件。如本文所使用的,“和/或”是指并且涵盖一个或多个相关所列项目的任何和所有可能的组合,以及在替代(或)解释时,缺少组合。此外,如本文所用术语“约”和“近似”,当涉及可测量值(例如量、剂量、时间、温度、活性、水平、数目、频率、百分比、尺寸、大小、量、重量、位置、长度等)时,意味着包括指定量、剂量、时间、温度、活性、水平、数目、频率、百分比、尺寸、大小、量、重量、位置、长度等的±15%、±10%、±5%、±1%、±0.5%或甚至±0.1%的变化。在术语“约”和“近似”与参考多肽内的定位或位置结合使用的情况下,这些术语包括±多达20个氨基酸残基、±多达15个氨基酸残基、±多达10个氨基酸残基、±多达5个氨基酸残基、±多达4个氨基酸残基、±多达3个氨基酸残基、±多达2个氨基酸残基、或甚至±1个氨基酸残基的变化。术语“同时施用(concurrently)”或“同时施用”或“共同施用”等是指施用含有两种或更多种活性物质的单一组合物,或者将每种活性物质作为分开的组合物施用,和/或在足够短的时间内同步(contemporaneously)或同时(simutaneously)或顺序地通过分开途径进行递送,使得有效结果等于所有这些活性物质作为单一组合物施用时获得的结果。“同时”是指活性剂基本上同时施用,并且理想地在同一制剂中一起施用。“同步”是指活性剂在时间上紧密施用,例如一种药剂在另一种药剂之前或之后约一分钟至约一天内施用。任何同时的时间都是有用的。然而,通常情况是,当没有同时施用时,药剂将在约1分钟内至约8小时内施用,并适当地在少于约1至约4小时内施用。当同步施用时,所述药剂适当地在受试者的相同部位施用。术语“相同部位”包括确切的位置,但可以在约0.5至约15厘米内,优选在约0.5至约5厘米内。本文所用的术语“分开”是指药剂间隔施用,例如以约一天至几周或几个月的间隔施用。活性剂可以以任何顺序施用。本文所用的术语“顺序地”是指药剂依次施用,例如以数分钟、数小时,数天或数周的一个或多个间隔施用。如果合适,可以在规则的重复循环中施用活性剂。本文使用的术语“佐剂”是指当与特异性免疫原(例如,本发明的多肽复合物)组合使用时,将增强所得的免疫应答(例如,th1免疫应答)的化合物,包括强化或扩大抗体和细胞免疫应答之一或两者的特异性。术语“药剂”或“调节剂”包括诱导所需药理学和/或生理学作用的化合物。该术语还包括本文特别提及的那些化合物的药学上可接受的和药理学活性成分,包括但不限于盐、酯、酰胺、前药、活性代谢物、类似物等。当使用上述术语时,应理解其包括活性剂本身以及药学上可接受的药理学活性盐、酯、酰胺、前药、代谢物、类似物等。不可以狭义地解释术语“药剂”,但可以延伸到小分子、蛋白分子(如肽、多肽和蛋白)以及包含它们的组合物、和遗传分子(如rna、dna和模拟物)及其化学类似物以及细胞试剂。术语“药剂”包括能够产生和分泌本文所述多肽的细胞,以及包含编码多肽的核苷酸序列的多核苷酸。因此,术语“药剂”延伸至核酸构建体,包括载体,例如病毒或非病毒载体、表达载体和用于在细胞范围内表达和分泌的质粒。如本文所用,术语“抗原”及其语法上等同的表达(例如,“抗原性”)是指可以与特异性体液或细胞免疫产物特异性结合的化合物、组合物或物质,例如抗体分子或t细胞受体。抗原可以是任何类型的分子,包括例如半抗原、简单的中间代谢物、糖(例如寡糖)、脂质和激素以及大分子例如复杂碳水化合物(例如多糖)、磷脂和蛋白。常见类别的抗原包括但不限于病毒抗原、细菌抗原、真菌抗原、原生动物和其他寄生虫抗原、肿瘤抗原、参与自身免疫疾病、过敏和移植排斥的抗原、毒素和其他各种抗原。“抗原结合分子”是指对靶标抗原具有结合亲和力的分子。应理解,该术语延伸至表现出抗原结合活性的免疫球蛋白、免疫球蛋白片段和非免疫球蛋白衍生蛋白框架。可用于实施本发明的代表性抗原结合分子包括多克隆和单克隆抗体以及它们的片段(例如fab、fab'、f(ab')2、fv)、单链(scfv)和结构域抗体(包括例如鲨鱼和骆驼科动物抗体)和包含抗体的融合蛋白,以及包含抗原结合/识别位点的免疫球蛋白分子的任何其他修饰构型。抗体包括任何类别的抗体,例如igg、iga或igm(或其亚类),并且抗体不需要是任何特定类别。取决于其重链恒定区的抗体氨基酸序列,可以将免疫球蛋白分到不同的类别。免疫球蛋白有五大类:iga、igd、ige、igg和igm,其中一些可进一步分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同免疫球蛋白类别的重链恒定区分别称为α、δ、ε、γ和μ。不同类别的免疫球蛋白的亚基结构和三维构型是众所周知的。抗原结合分子还包括二聚体抗体,以及多价形式的抗体。在一些实施方案中,抗原结合分子是嵌合抗体,其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而所述链其余部分与衍生自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源,以及抗原结合分子还包括此类抗体的片段,只要它们表现出所需的生物活性(参见,例如美国专利号4,816,567;以及morrison等人,1984,proc.natl.acad.sci.usa81:6851-6855)。还考虑了人源化抗体,通常通过将来自非人(例如,啮齿动物,优选小鼠)免疫球蛋白的重链和轻链可变链的互补决定区(cdr)转移到人可变结构域中而产生。然后在非人对应物的框架区中取代人抗体的典型残基。使用源自人源化抗体的抗体组分消除了与非人恒定区的免疫原性相关的潜在问题。用于克隆非人(特别是鼠)免疫球蛋白可变结构域的一般技术描述于例如orlandi等人(1989,proc.natl.acad.sci.usa86:3833)。用于产生人源化单克隆抗体的技术描述于例如jones等人(1986,nature321:522)、carter等人(1992,proc.natl.acad.sci.usa89:4285)、sandhu(1992,crit.rev.biotech.12:437)、singer等人(1993,j.immun.150:2844)、sudhir(编,antibodyengineeringprotocols,humanapress,inc.1995)、kelley(“engineeringtherapeuticantibodies,”inproteinengineering:principlesandpracticecleland等人编,399-434页(johnwiley&sons,inc.1996)以及queen等人,美国专利号5,693,762(1997)。人源化抗体包括“灵长类化”抗体,其中抗体的抗原结合区衍生自通过用兴趣抗原免疫猕猴而产生的抗体。还考虑作为抗原结合分子的是人源化抗体。术语“抗原呈递细胞”(apc)是指能够以免疫系统特异性效应细胞(本文也称为“免疫效应细胞”或“iec”)识别的肽-mhc复合物形式来呈递一种或多种抗原,从而调节(例如,刺激/增强或减少/耐受/不应答)对所呈递抗原的免疫应答的细胞类别。在本发明的具体实施方案中,apc能够激活iec,例如t淋巴细胞,包括cd8+和/或cd4+淋巴细胞。体内具有潜在作为apc作用的细胞,不仅包括例如专职apc(如树突细胞、巨噬细胞、朗格汉斯细胞、单核细胞和b细胞),还包括非专职apc,其说明性示例包括活化的上皮细胞、成纤维细胞、神经胶质细胞、胰腺β细胞和血管内皮细胞。许多类型的细胞能够在其细胞表面呈递抗原以用于iec(包括t细胞)的识别。术语“生物标记物”通常是指可测量的特征,其反映生理和/或病理生理状态的存在或性质(例如,严重程度或状态),包括发展成特定生理或病理生理状态的风险的指示物。例如,生物标记物可以存在于从生理或病理生理状态(包括其症状)发作之前的受试者获得的样品中。因此,从受试者获得的样品中生物标记物的存在可能指示着风险增加,即受试者将发展成生理或病理生理状态或其症状的风险。或者,或者另外,生物标记物可以在个体中正常表达,但其表达可能在生理或病理生理状态(包括其症状)发作之前改变(即,它提高(上调;过度表达)或减少(下调;低表达))。因此,生物标记物的水平变化可能指示增加的风险,即受试者将发展为生理或病理生理状态或其症状的风险。或者,或者另外,生物标记物的水平变化可以反映受试者中特定生理或病理生理状态或其症状的变化,从而允许生理或病理生理状态的性质(例如,严重程度)或其症状被跟踪一段时间。该方法可用于例如监测治疗方案以评估其在受试者中的有效性(或其他方面)的目的。如本文所述,提及生物标记物的水平包括生物标记物的浓度、或生物标记物的表达水平、或生物标记物的活性,下面将更详细描述。术语“生物标记物值”是指对于受试者的至少一种相应的生物标记物测量或得出的值,并且其通常至少部分地指示取自受试者的样品中生物标记物的丰度或浓度。因此,生物标记物值可以是测量的生物标记物的值(它是针对受试者而测量的生物标记物的值)或者可以是推导(derived)的生物标记物的值(它是从一个或多个测量的生物标记物的值推导而来的值,例如通过将函数应用于一个或多个测量的生物标记物的值)。生物标记物值可以是任何适当的形式,具体取决于确定数值的方式。例如,可以使用高通量技术确定生物标记物值,例如质谱、测序平台、阵列和杂交平台、免疫测定、流式细胞术、或这些技术的任何组合。在一个优选示例中,生物标记物值涉及使用如流式细胞术等技术定量的蛋白表达产物或其他可测量分子的活性水平或丰度。在这种情况下,生物标记物值可以是在样品中表达生物标记物的细胞的百分比值的形式,如本领域技术人员将理解的并且将在下面更详细地描述。术语“生物标记物谱”是指一种或多种类型中一种或多种生物标记物(例如,多肽分子、cdna分子等)或其指代(indication),以及例如可测量方面的生物标记物特征(例如,生物标记物值)。生物标记物谱可包括单一生物标记物整体水平、丰度或量,其与受试者的th1免疫状态相关(例如,增强的th1免疫状态或降低的th1免疫状态)。或者,生物标记物谱可以包括至少两种这样的生物标记物或其指代,其中生物标记物可以是相同或不同的类别,例如多肽和核酸。因此,生物标记物谱可包括至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100或更多生物标记物或其指代。在一些实施方案中,生物标记物谱包括几种、若干、几十种或数百种生物标记物或其指代。生物标记物谱还可以包含一种或多种对照或内部标准。在某些实施方案中,生物标记物谱包括用作内部标准的至少一种生物标记物或其指代。在其他实施方案中,生物标记物谱包括一种或多种类型的生物标记物的指代。在本文中使用的术语“指代”仅指这种情况,即生物标记物谱包含生物标记物的符号、数据、缩写或其他类似标识,而不是生物标记物分子的实体本身。本文所用术语“生物标记物谱”也用于指生物标记物值或至少两种生物标记物值的组合,其中个体生物标记物值对应于来自一个或多个受试者可以测量的或推导所得生物标记物的值,其组合的特征在于th1免疫状态、离散状态、病症分级、病症亚型或预后离散状态、病症分级、病症亚型。术语“谱生物标记物”用于指生物标记物的子集,其已被鉴定用于生物标记物谱,可用于进行临床评估,例如用于纳入或排除特定病症、病症的不同分级或严重程度、不同病症的亚型或不同的预后。谱生物标记物的数目将不同,但通常为10个或更小的量级。当提及分子时,术语“嵌合”是指该分子含有衍生自、获得或分离自、或基于两种或更多种不同起源或来源的部分。因此,当多肽包含不同来源的两种或更多种氨基酸序列时,并且包括(1)在自然界中不能一起发现的多肽序列(即,至少一种氨基酸序列和其他氨基酸序列中的至少一种是异源的)或(2)非天然邻接的氨基酸序列,则该分子是嵌合的。本文使用的“聚集(clustering)”和语法等同物是指两个以上相同的th1免疫状态生物标记物(例如,pd-l2)的任何可逆或不可逆的关联。集群(cluster)可以由3、4、5、6、7、8、9、10、12、20个等生物标记物组成。两个生物标记物的集群被称为二聚体。三个或更多生物标记物的集群通常被称为寡聚体,其中集群的个体数具有其各自的指代,例如三个生物标记物的集群是三聚体,四个生物标记物的集群是四聚体,五个生物标记物的集群是五聚体,六个生物标记物的集群是六聚体,七个生物标记物的集群是七聚体,八个生物标记物的集群是八聚体,九个生物标记物的集群是九聚体,十个生物标记物的集群是十聚体,十二个生物标记物的集群是十二聚体,以及二十个生物标记物的集群是二十聚体。“编码序列”是指有助于编码基因的多肽产物或基因的最终mrna产物(例如,剪接后基因的mrna产物)的任何核酸序列。相反,术语“非编码序列”是指对编码基因的多肽产物或基因的最终mrna产物没有贡献的任何核酸序列。在本文中术语“卷曲螺旋”或“卷曲螺旋结构”可互换使用,指蛋白中的结构基序,其中两个或更多个α-螺旋(最常见的是2-7个α-螺旋)卷曲在一起,如同绳子的链(二聚体和三聚体是最常见的类型)。许多卷曲螺旋型蛋白参与重要的生物学功能,例如基因表达的调节例如转录因子。卷曲螺旋通常但不总是包含疏水性(h)和极性(p)氨基酸残基的重复模式hpphppp或hppphpp,称为七肽重复(参见本文下文)。具有这种重复模式的序列折叠成为α-螺旋二级结构,导致疏水性残基呈现为“条纹”,条纹以左旋方式在螺旋周围轻轻缠绕形成两亲结构。在充满水的环境中,两个这样的螺旋排列的最有利方式是将疏水链彼此相对包裹并夹在亲水性氨基酸之间。因此,疏水表面的埋藏为α-螺旋的寡聚化提供了热力学驱动力。卷曲螺旋界面中的包装非常紧密。α-螺旋可以是平行的或反平行的,并且通常采用左旋超螺旋。虽然不是很有利,但在自然界和设计蛋白中也观察到少量右旋卷曲螺旋。基于公知常识,术语“卷曲螺旋”或“卷曲螺旋结构”对于本领域技术人员而言是清楚的。在这方面尤其参考有关卷曲螺旋结构的论文,例如cohen和parry(1990.proteins7:1-15);kohn和hodges(1998.trendsbiotechnol16:379-389);schneider等人(1998.folddes3:r29-r40);harbury等人(1998.science282:1462-1467);mason和arndt(2004.chem-biochem5:170-176);lupas和gruber(2005.advproteinchem70:37-78);woolfson(2005.advproteinchem70:79-112);parry等人2008.jstructbiol163:258-269);以及mcfarlane等人(2009.eurjpharmacol625:101-107)。如本文所用,“伴随诊断”是指用于鉴定对特定治疗易感的受试者或用于监测治疗和/或鉴定受试者或受试者亚群或其他群体有效剂量的诊断方法和/或试剂。出于本文的目的,伴随诊断是指试剂,例如用于确定样品中th1免疫系统生物标记物(例如,如本文所述)的生物标记物值的试剂。伴随诊断是指试剂以及用试剂进行的试验。如本文所用,术语“互补”及其语法等同表达是指两种或更多种结构元件(例如,肽、多肽、核酸、小分子或其部分等)能够杂交、寡聚化(例如,二聚化、三聚化、四聚化、五聚化、六聚化、七聚化、八聚化、九聚化、十聚化、十一聚化、十二聚化)、相互作用或以其他方式彼此形成复合物的特征。例如,“多肽的互补区”能够聚在一起形成复合物。如本文所用,术语“复合物”是指彼此直接和/或间接接触的分子(例如,肽、多肽等)的组合体或聚集体。在具体的实施方案中,“接触”或更具体地“直接接触”意指两个或更多个分子足够接近以使得有吸引力的非共价相互作用,例如范德华力、氢键、离子和疏水相互作用等,主导分子的相互作用。在这种实施方案中,在这样的条件下形成分子的复合物(例如,肽和多肽),使得复合物在热力学上是有利的(例如,与其组成分子的非聚集或非复合状态相比)。本文使用的术语“多肽复合物”或“蛋白复合物”是指三聚体、四聚体、五聚体、六聚体、七聚体、八聚体、九聚体、十聚体、十一聚体、十二聚体或更高级的寡聚体。在具体的实施方案中,通过嵌合多肽自组装形成多肽复合物,所述嵌合多肽包含pd-l2多肽和至少一个寡聚化结构域。在整个说明书中,除非上下文另有指明,否则词语“包括”、“包含”和“含有”将被理解为暗示包括所述步骤或元件、或步骤或元件的组,但不排除任何其他步骤或元件、或步骤或元件的组。因此,术语“包括”等的使用表示所列出的元件是必需的或强制性的,但是其他元件是可选的并且可以存在或不存在。“由...组成”意味着包括并限于短语“由...组成”之后的内容。因此,短语“由...组成”表示所列出的元件是必需的或强制的,并且不存在其他元件。“基本上由...组成”是指包括在短语之后列出的任何元件,并且限于不干扰或有助于本公开中针对所列元件指定的活性或作用的其他元件。因此,短语“基本上由...组成”表示所列出的元件是必需的或强制性的,但是其他元件是可选的,并且可以存在或不存在,这取决于它们是否影响所列元件的活性或作用。如本文所用,术语“缀合的”、“连接的”、“融合的”或“融合”及其语法等同物,在两种或更多种元件或组分或结构域通过任何方式(包括化学缀合或重组方式(例如,通过遗传融合))连接在一起的情况下,可互换使用。化学缀合的方法(例如,使用异双功能交联剂)是本领域已知的。更具体地,如本文所用,pd-l2多肽-寡聚化结构域融合或缀合物是指pd-l2多肽与至少一个寡聚化结构域的遗传或化学缀合。在具体的实施方案中,至少一个寡聚化结构域通过肽接头间接融合至pd-l2多肽,例如甘氨酸-丝氨酸(gly-ser)接头。在其他实施方案中,至少一个寡聚化结构域直接与pd-l2多肽融合。“保守氨基酸取代”是其中氨基酸残基被具有相似侧链的氨基酸残基取代的氨基酸取代。本领域已经定义了具有相似侧链的氨基酸残基家族,其通常可以按照以下进行亚分类:表1氨基酸的亚分类保守氨基酸取代还包括基于侧链的分组。例如,具有脂肪族侧链的氨基酸组是甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;具有脂肪族-羟基侧链的氨基酸组是丝氨酸和苏氨酸;具有含酰胺侧链的氨基酸组是天冬酰胺和谷氨酰胺;具有芳香族侧链的氨基酸组是苯丙氨酸、酪氨酸和色氨酸;具有碱性侧链的氨基酸组是赖氨酸、精氨酸和组氨酸;具有含硫侧链的氨基酸组是半胱氨酸和蛋氨酸。例如,可以合理地预期用异亮氨酸或缬氨酸取代亮氨酸,用谷氨酸取代天冬氨酸,用丝氨酸取代苏氨酸,或用结构相关氨基酸类似地取代某氨基酸不会对所得变体多肽的性质产生大的影响。通过测定其活性可以容易地确定氨基酸改变是否产生功能性多肽。保守取代如表2所示,标题为示例性和优选的取代。一般来说,落入本发明范围内的氨基酸取代是通过选择其对维持以下方面的作用没有显著差异的取代来实现的:(a)取代区域中的肽骨架结构,(b)在靶位点处分子的电荷或疏水性,或(c)侧链的部分。在引入取代后,筛选变体的生物活性。表2示例性和优选的氨基酸取代术语“构建体”是指重组遗传分子,其包括来自不同来源的一种或更多种分离的核酸序列。因此,构建体是嵌合分子,其中不同来源的两种或更多种核酸序列组装成单个核酸分子,并且包括含有以下的任何构建体:(1)核酸序列,其包含天然中未发现在一起的调节序列和编码序列(即,至少一种核苷酸序列相对于至少一种其它核苷酸序列是异源的)、或(2)编码非天然邻接的功能性rna分子或蛋白部分的序列,或(3)非天然邻接的启动子部分。代表性构建体包括衍生自任何来源并且能够基因组整合或自主复制的任何重组核酸分子(例如质粒、粘粒、病毒、自主复制的多核苷酸分子、噬菌体、或线性或环状单链或双链dna或rna核酸分子),其包含已可操作连接的一种或更多种核酸分子的核酸分子。本发明的构建体通常包括指导兴趣核酸序列表达的必需元件,所述兴趣核酸序列也包含在构建体中,例如靶标核酸序列或调节核酸序列。这些元件可以包括控制元件,例如与兴趣核酸序列可操作地连接(以便指导转录)的启动子,并且通常还包括多聚腺苷酸化序列。在本发明的某些实施方案中,构建体可以包含在载体内。除了构建体的组分之外,载体可以包括,例如一个或多个可选择的标记物、一个或多个复制起点(例如原核和真核起点)、至少一个多克隆位点、和/或促进构建体稳定整合到宿主细胞基因组中的元件。两个或更多个构建体可以包含在单个核酸分子内,例如单个载体,或者可以包含在两个或更多个单独的核酸分子内,例如两个或更多个单独的载体。“表达构建体”通常至少包括与兴趣核苷酸序列可操作连接的控制序列。例如,以这种方式,在表达构建体中提供与待表达的核苷酸序列可操作连接的启动子,用于在生物体或其部分(包括宿主细胞)中表达。对于本发明的实践,用于制备和使用构建体和宿主细胞的常规组合物和方法是本领域技术人员公知的,参见例如molecularcloning:alaboratorymanual,第三版,卷1、2和3,jfsambrook,dwrussell和n.irwin,coldspringharborlaboratorypress,2000。术语“相关”是指确定一种类型的数据与另一种类型的数据或与状态(例如,th1免疫状态)之间的关系。“对应于”或“对应着”是指与参考氨基酸序列显示实质序列相似性或同一性的氨基酸序列。通常,氨基酸序列和参考氨基酸序列的至少部分将显示至少约70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、97、88、89、90、91、92、93、94、95、96、97、98、99%或甚至高达100%的序列相似性或同一性。术语“寡聚化程度”是指根据式(i)的多肽复合物中蛋白分子单元的数目(n)。如本文所使用的,术语“诊断”、“诊断中”等在本文中可互换地使用,以包括确定受试者将发展病症的可能性、或受试者中病症的存在或性质。这些术语还包括确定疾病或疾病发作的严重程度,以及在合理治疗的背景下,诊断指导治疗,包括治疗的初始选择、治疗的改变(例如,剂量或剂量方案的调整)等。“可能性”是指在给定数学模型基础上测量具有特定测量的或推导生物标记物值的受试者是否实际上患有(或未患有)病症。例如,增加的可能性可以是相对的或绝对的,并且可以定性或定量地表达。例如,基于先前的群体研究,可以简单地通过确定受试者中至少两个th1免疫状态生物标记物的测量或推导的生物标记物值,并将受试者归为“增加的可能性”类别中,来确定增加的可能性。术语“可能性”在本文中也可与术语“概率”互换使用。术语“风险”涉及特定事件在未来某个时刻发生的可能性或概率。“风险分层”是指排列已知的临床风险因素,以允许医生将患者分类为发展特定疾病的低、中、高或最高风险。如本文所用,术语“结构域”是指具有共同的物理化学特征的分子或结构的一部分,例如但不限于疏水、极性、球状和螺旋结构域、或例如配体-结合、膜融合、信号转导、细胞穿透、寡聚化等性质。通常,结构域具有折叠的蛋白结构,其具有独立于蛋白其余部分而保留其三级结构的能力。通常,结构域负责蛋白的离散功能特性,并且在许多情况下可以添加、去除或转移到其他蛋白中而不丧失蛋白和/或结构域的其余部分的功能。结构域可以与区域或其部分共同延伸;结构域还可以包括不同的、非连续的分子区域。蛋白结构域的示例包括但不限于细胞或细胞外定位结构域(例如,信号肽;sp)、免疫球蛋白(ig)结构域、胞外域、跨膜(tm)结构域和细胞质(c)结构域。如本文所用,术语“编码”、“编码的”等是指核酸提供另一种核酸或多肽的能力。例如,如果核酸序列可以被转录和/或翻译以产生多肽,或者如果它可以被加工成可转录和/或翻译以产生多肽的形式,则称其“编码”多肽。此类核酸序列可包括编码序列或编码序列和非编码序列。因此,术语“编码”、“编码的”等包括由dna分子的转录而产生的rna产物;由rna分子的翻译产生的蛋白;由dna分子转录形成rna产物、以及随后的rna产物翻译所产生的蛋白;或由dna分子转录以提供rna产物、rna产物经加工以提供加工的rna产物(例如,mrna)、以及随后的加工的rna产物翻译而产生的蛋白。“胞外域”是细胞膜蛋白的结构域,其延伸到细胞外空间(即细胞外的空间)。通常,胞外域是启动与表面接触的蛋白部分,从而导致信号转导。因此,本文所定义的pd-l2的胞外域是指pd-l2延伸到细胞外空间的部分(细胞外结构域),但也包括负责结合相应受体(如pd-1)的较短部分或其片段。因此,术语“pd-l2的胞外域或其片段”是指形成细胞外结构域的pd-l2细胞外结构域,或其仍然能够与受体结合的部分(即,受体结合结构域)。在引发对包膜病毒融合蛋白或融合蛋白复合物的免疫应答、或治疗或预防疾病或病症的背景下,“有效量”是指向有需求的个体施用一定量的药剂,而无论是单剂量还是作为系列的一部分,其对于引发、治疗或预防都是有效的。有效量将根据待治疗个体的健康和身体状况、待治疗个体的分类组、组合物的配方、医学状况的评估、以及其他相关因素而变化。预计该量将落入相对宽的范围内,这可以通过常规试验来确定。术语“内源性产生”是指生物中核酸的表达以及生物中核酸表达产物的相关产生和/或分泌。在具体的实施方案中,生物是多细胞的(例如,脊椎动物,优选哺乳动物,更优选灵长类动物,例如人),并且核酸在多细胞生物的细胞或组织内表达。关于基因序列的术语“表达”是指基因转录产生rna转录物(例如,mrna、反义rna、sirna、shrna、mirna等),并且适当时,将所得mrna转录物翻译成蛋白。因此,从上下文中可以清楚地看出,编码序列的表达产生自编码序列的转录和翻译。相反,非编码序列的表达产生自非编码序列的转录。如本文所用,“融合”蛋白是指两个或更多个偶联在一起的多肽,其不是天然存于该偶联排列中。如本文所用,术语“基因”是指能够用于产生mrna、反义rna、sirna、shrna、mirna等的核酸分子,并且在一些实施方案中,是指多肽。基因能或不能用于产生功能性蛋白质。基因可包括编码区和非编码区(例如,内含子、调节元件,包括启动子、增强子、终止序列和5'和3'非翻译区)。基因可以是“分离的”,是指核酸分子基本上或本质上不含与核酸分子天然状态通常结合的组分。这些组分包括其他细胞材料、来自重组生产的培养介质、和/或用于化学合成核酸分子的各种化学品。对“基因”的提及在其范围内还包括具有连续序列的基因,从而如本文所定义的限定连续的核酸实体;或非连续序列的基因,从而如本文所定义的限定非连续的核酸实体。在某些实施方案中,术语“基因”在其范围内包括开放阅读框,其编码特定的多肽、内含子和参与表达调节的邻近5'和3'的非编码核苷酸序列。在这方面,该基因可以还包含控制序列,例如与给定基因天然结合的启动子、增强子、终止和/或多聚腺苷酸化信号、或异源控制序列。基因序列可以是cdna或基因组dna或其片段。可以将基因导入合适的载体中用于染色体外维持或引入宿主。本文使用的术语“异源”是指任何蛋白部分,其序列的选择使得该序列与pd-l2多肽的融合产物具有与野生型pd-l2多肽的前体或成熟形式不同的序列。术语“宿主”是指任何生物或其细胞,无论是真核生物还是原核生物,其中可以引入本发明的构建体。在具体的实施方案中,术语“宿主”是指真核生物,包括单细胞真核生物,例如酵母和真菌,以及多细胞真核生物,例如动物,其非限制性示例包括无脊椎动物(例如,昆虫、刺胞动物、棘皮动物、线虫等);真核寄生虫(例如,疟疾寄生虫,如恶性疟原虫(plasmodiumfalciparum)、蠕虫等);脊椎动物(例如鱼、两栖动物、爬行动物、鸟、哺乳动物);和哺乳动物(例如,啮齿动物、灵长类动物如人和非人灵长类动物)。因此,术语“宿主细胞”适当地包括此类真核生物的细胞以及衍生自这些真核生物的细胞系。术语“宿主细胞”在其范围内还包括单个细胞或细胞培养物,其可以是或已经是本发明的任何重组载体或分离的多核苷酸的接受者。宿主细胞包括单个宿主细胞的后代,并且由于天然的、偶然的或人为的突变和/或改变,后代可能不一定与原始亲本细胞(在形态学上或在总dna互补方面)完全相同。宿主细胞包括用本发明的重组载体或多核苷酸在体内或体外转染或感染的细胞。包含本发明重组载体的宿主细胞是重组宿主细胞。如本文所用,术语“免疫效应细胞”(iec)是指白细胞群(包括淋巴细胞),其在其表面上呈现效应部分受体,例如细胞因子受体和/或fc受体,通过所述受体而结合效应部分(例如细胞因子和/或抗体fc区),有助于靶标细胞(例如肿瘤细胞)的破坏。iec可以例如介导细胞毒性或吞噬作用。iec细胞包括但不限于效应t细胞,例如cd8+细胞毒性t细胞、cd4+辅助t细胞、γδt细胞、nk细胞、nk样t细胞和淋巴因子活化的杀伤(lak)细胞。iec的活性可以通过它们与apc的相互作用来调节,包括专业的抗原呈递细胞,如巨噬细胞、树突细胞、朗格汉斯细胞、b细胞和单核细胞。如本文所用,术语“免疫原性组合物”或“免疫原性制剂”是指当施用于脊椎动物,尤其是动物(如哺乳动物)时,将诱导免疫应答(包括th1免疫应答)的制剂。本文使用的术语“指示物”是指结果或结果的表示,包括技术人员可以评估和/或确定受试者是否患有特定疾病的可能性或风险的任何信息、数量、比率、信号、符号、标记或注释。在本发明的情况下,“指示物”可任选地与其它临床特征一起使用,以实现受试者th1免疫状态的确定。这种指示物是“确定的”,并不意味着暗示指示物是100%准确的。熟练的临床医生可以将指示物与其他临床标记一起使用以实现诊断。“接头”是指连接两个分子的分子或分子组(例如单体或聚合物),并且通常用于将两个分子置于所需的构型中。在具体的实施方案中,“肽接头”是指连接两个蛋白、多肽、肽、结构域、区或基序的氨基酸序列,并且可以提供与两个亚结合(例如,寡聚化)结构域相互作用兼容的间隔功能,使得所得多肽与靶标分子保持特异性结合亲和力或保持信号传导活性(例如,pd-l2多肽)。在某些实施方案中,接头包含约2至约35个氨基酸,例如,或约4至约20个氨基酸或约8至约15个氨基酸或约15至约25个氨基酸。如本文所用,术语“部分”是指分子的一部分,其可以是分子内的官能团、一组官能团和/或原子的特定组,其负责分子的特征性化学、生物和/或药用特性。“获得”意味着占有。如此获得的样品包括例如分离或衍生自特定来源的核酸提取物或多肽提取物。例如,提取物可以直接从受试者生物流体或组织中分离。本文所用的“寡聚化结构域”是指蛋白结构域,其直接或通过桥连分子优先与一个或多个其他蛋白结构域相互作用或结合,其中其他蛋白结构域的相互作用基本上有助于或有效促进寡聚化(即,形成二聚体、三聚体、四聚体、五聚体、六聚体、七聚体、八聚体、九聚体、十聚体、十一聚体、十二聚体或更高级的寡聚体、其可以是同寡聚体或异寡聚体)。这种“互补的”寡聚化结构域包括二聚化结构域(例如,免疫球蛋白fc结构域、亮氨酸拉链等)、三聚化结构域(例如,大肠杆菌天冬氨酸转氨甲酰酶(atcase)的催化亚基、来自t4噬菌体次要纤维蛋白(fibritin)的“foldon”三聚序列、颈区肽、人肺表面活性剂蛋白d、寡聚化卷曲螺旋粘附素、i类包膜病毒融合蛋白的互补七肽重复区等)、四聚化结构域(例如,四臂粘联蛋白的卷曲螺旋结构域)、五聚化结构域(例如,色氨酸拉链或软骨寡聚基质蛋白(comp)的五聚化结构域等)和六聚化结构域(例如,来自iga抗体重链c-末端的尾部),需要时,可以组合使用以形成更高级的寡聚体,如七聚体、八聚体、九聚体、十聚体、十一聚体、十二聚体等。如本文所用的术语“可操作地连接”或“可操作连接的”是指并置,其中所述组分处于允许它们以其预期方式起作用的关系中。例如,与兴趣核苷酸序列(例如,编码和/或非编码序列)“可操作地连接”的调节序列(例如,启动子)是指,控制序列相对于兴趣核苷酸序列的位置和/或定位,允许在与控制序列兼容的条件下表达该序列。控制序列不需要与兴趣核苷酸序列邻接,只要它们起到指导其表达的作用即可。因此,例如在启动子和编码序列之间可以存在插入的非编码序列(例如,非翻译但转录的序列),并且启动子序列仍然可以认为与编码序列“可操作地连接”。同样,pd-l2多肽与至少一个异源寡聚化结构域“可操作地连接”包括寡聚化结构域相对于pd-l2多肽的位置和/或定位,以允许pd-l2-寡聚化结构域嵌合多肽的自组装以形成多肽复合物。本文中可互换使用的术语“患者”、“受试者”、“宿主”或“个体”是指任何受试者,特别是脊椎动物受试者,甚至更具体地是哺乳动物受试者,其需要治疗或预防。落入本发明范围内合适的脊椎动物包括但不限于脊索亚属的任何成员,包括灵长类动物(例如,人、猴和猿,并且包括来自猕猴属(macaca)的猴物种(例如,食蟹猴,如猕猴(macacafascicularis)和/或恒河猴(macacamulatta))和狒狒(papioursinus)、以及狨猴(来自狨属(callithrix)的物种)、松鼠猴(来自松鼠猴属(saimiri)的物种)和金丝猴(来自柽柳猴属(saguinus)的物种)以及猿的物种(比如黑猩猩(pantroglodytes))、啮齿动物(例如,小鼠、大鼠、豚鼠)、兔形目(例如,兔子、野兔)、牛科(例如,牛)、绵羊科(例如,绵羊)、山羊科(例如,山羊)、猪科(例如,猪)、马科(例如,马)、犬科(例如,狗)、猫科(例如,猫)、禽(例如,鸡、火鸡、鸭、鹅、伴侣鸟(如金丝雀、虎皮鹦鹉等))、海洋哺乳动物(例如,海豚、鲸)、爬行动物(蛇、蛙、蜥蜴等)和鱼。优选的受试者是需要引发对包膜病毒融合蛋白或融合蛋白复合物的免疫应答的人。但是,应该理解,上述术语并不意味着存在症状。如本文可互换使用的,“pd-l2活性”、“pd-l2的生物活性”或“pd-l2的功能活性”是指,根据标准技术在体内或体外测定的,pd-l2多肽或核酸分子对pd-l2响应细胞或组织、或对pd-l2多肽结合配偶体发挥的活性。在一些实施方案中,pd-l2活性是直接活性,例如与pd-l2结合配偶体的结合。如本文所用,“靶标分子”或“结合配偶体”是pd-l2多肽所天然结合或相互作用的分子,从而实现pd-l2介导的功能。在具体的实施方案中,pd-l2靶标分子选自pd-1受体和排斥性指导分子b(rgmb)。或者,pd-l2活性是间接活性,例如由pd-l2多肽与天然结合配偶体(例如,pd-1或rgmb)相互作用介导的细胞信号传导活性。本文描述了pd-l2的生物学活性。例如,本发明的pd-l2多肽可具有一种或多种以下活性:1)结合和/或调节受体pd-1或其他pd-l2天然结合配偶体(例如rgmb)的活性,2)调节细胞内或细胞间信号传导,3)调节免疫细胞的活化,例如t淋巴细胞,和4)调节生物(例如哺乳动物,如人或其他灵长类动物)的免疫应答,包括th1免疫应答。术语“pd-l2表达”和“pd-l1表达”分别指pd-l2和pd-l1的转录和/或翻译和/或活性。可使用几种方法来确定pd-l2和pd-l1表达的水平,例如本文所述。“pd-l2多肽”是指具有对应于pd-l2分子的氨基酸序列的多肽。该术语包括但不限于具有氨基酸序列的多肽,其中所述氨基酸序列与seqidno:1、2、3、4、5或6中任何一个所述的序列具有至少70%(至少71%至至少99%、以及之间的所有整数百分比)序列同一性或相似性。它还包括pd-l2多肽的天然等位基因变异,所述天然等位基因变异可以存在并出现于一个生物到另一个生物中。此外,糖基化的程度和位置或其他翻译后修饰,可以根据所选择的宿主和宿主细胞环境的性质而变化。术语“pd-l2多肽”还旨在包括其前体形式的pd-l2多肽,以及已经加工以产生它们各自的生物活性形式的那些。其进一步包括相对于参考或天然存在的pd-l2多肽而经过化学修饰的pd-l2多肽、和/或相对于参考或天然存在的pd-l2多肽而言含有一个或多个氨基酸序列改变的pd-l2多肽、和/或相对于参考或天然存在的全长或前体pd-l2多肽或其结构域而言包含截短的氨基酸序列的pd-l2多肽(包括pd-l2信号肽、igv和igc结构域、胞外域、跨膜结构域和胞质结构域)。或者,或另外,pd-l2多肽(包括其复合物)可以表现出相对于参考或天然存在的pd-l2多肽的不同特性,包括改变的(例如,提高的)稳定性和改变的(例如,增强的)生物活性,例如但不限于:1)增强与受体pd-1或其他pd-l2天然结合配偶体(如rgmb)的结合和/或信号传导,2)增强的细胞内或细胞间信号传导,3)增强的免疫细胞活化,例如t淋巴细胞,以及4)在受试者中(例如哺乳动物,如人或其他灵长类动物)增强的免疫应答(包括th1免疫应答)。术语“pd-l2多肽”还包括具有轻微修饰的氨基酸序列的蛋白分子,例如具有修饰的n-末端(包括n-末端氨基酸缺失或添加)的多肽,和/或相对于参考或天然存在的pd-l2多肽而经化学修饰的多肽。pd-l2多肽还包括相较于参考或天然存在的pd-l2多肽显示基本上相同或更好生物活性的蛋白分子,或者包括相对于参考或天然存在的pd-l2多肽显示出基本上改变的或降低的生物活性的蛋白分子。“药学上可接受的载体”是指固体或液体填充剂、稀释剂或包封物质,其可安全地用于局部或全身施用至动物,优选哺乳动物,包括人。代表性的药学上可接受的载体包括以下的任一或全部:本领域普通技术人员已知的溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如,抗菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、凝胶、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料、类似物质及其组合(参见,例如remington’spharmaceuticalsciences,第18版,mackprintingcompany,1990,pp.1289-1329,通过引用并入本文)。除非任何常规载体与活性成分不相容,否则考虑其用于药物组合物中。本文使用的术语“多核苷酸”或“核酸”表示mrna、rna、crna、cdna或dna。该术语通常是指长度为至少10个碱基的聚合形式的核苷酸,可以是核糖核苷酸或脱氧核苷酸、或任一类型核苷酸的修饰形式。该术语包括单链和双链形式的dna。本文中“多肽”、“肽”、“蛋白”和“蛋白分子”可互换使用,是指包含氨基酸残基聚合物、或由氨基酸残基聚合物组成的分子,并涉及其变体和合成类似物。因此,这些术语适用于这样的氨基酸聚合物,其中一个或多个氨基酸残基是合成的非天然存在的氨基酸,例如相应天然存在的氨基酸以及天然存在的氨基酸聚合物的化学类似物。本文使用的术语“重组多核苷酸”是指通过将核酸操作成自然界中通常不存在的形式而在体外形成的多核苷酸。例如,重组多核苷酸可以是表达载体的形式。通常,此类表达载体包括与核苷酸序列可操作地连接的转录和翻译调节核酸。“重组多肽”是指使用重组技术(即通过表达重组多核苷酸)制备的多肽。本文中“调节元件”、“调节序列”、“控制元件”、“控制序列”等可互换使用,以指代位于编码序列上游(5'非编码序列)、内部、或下游(3'非编码序列)的核苷酸序列,其直接或间接地影响相关编码序列的转录、rna加工或稳定性、或翻译。调节元件包括增强子、启动子、翻译先导序列、内含子、rep识别元件、基因间区域和多聚腺苷酸化信号序列。它们包括天然和合成序列以及可以是合成和天然序列组合的序列。本文使用的术语“样品”包括可以从受试者中提取、未处理、处理、稀释或浓缩的任何生物样本。样品可包括但不限于生物流体,例如全血、血清、红细胞、白细胞、血浆、唾液、尿液、粪便(即排泄物)、泪、汗、皮脂、乳头抽吸物、导管灌洗液、肿瘤渗出物、滑液、腹水、腹膜液、羊水、脑脊液、淋巴液、细针抽吸物、羊水、任何其他体液、细胞裂解液、细胞分泌产物、炎症液、精液和阴道分泌物。样品可包括组织样品和活组织检查、组织匀浆等。有利样品可包括含有任何一种或多种本文所教导可检测量的生物标记物的样品。适当地,样品可通过微创方法容易地获得,该微创方法允许从受试者中移除或分离样品。在某些实施方案中,样品含有血液,尤其是外周血或其部分或提取物。通常,样品包含血细胞,例如成熟的、未成熟的或发育中的白细胞,包括淋巴细胞、多形核白细胞、中性粒细胞、单核细胞、网织红细胞、嗜碱性粒细胞、体腔细胞、血细胞、嗜酸性粒细胞、巨核细胞、巨噬细胞、树突细胞、自然杀伤细胞、或这种细胞的部分(例如,核酸或蛋白部分)。在具体的实施方案中,样品包含白细胞,包括外周血单核细胞(pbmc)。“自组装”是指自发组装高级结构的过程,其依赖于高级结构的组分(例如,分子)彼此的自然吸引力。基于大小、形状、组成或化学性质,它通常通过分子的随机运动和键的形成而发生。如本文所用的术语“序列同一性”是指在比较窗口中在核苷酸-核苷酸或氨基酸-氨基酸的基础上,序列相同的程度。因此,“序列同一性的百分比”如下计算:在比较窗口中比较两个最佳比对序列、确定两个序列中出现相同核酸碱基(例如a、t、c、g、i)或相同氨基酸残基(例如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys和met)的位置数目以产生匹配位置的数目、将匹配位置的数目除以比较窗口中的位置总数(即,窗口大小)、并将结果乘以100以产生序列同一性的百分比。本发明考虑在本发明的方法和系统中使用全长il-22多肽及其生物活性片段。通常,全长il-22多肽的生物活性片段可参与相互作用,例如分子内或分子间相互作用。“相似性”是指相同或构成保守取代的氨基酸的百分比数目,如上文表1和2中所定义的。使用序列比较程序如gap(deveraux等人1984,nucleicacidsresearch12:387-395)确定相似性。以这种方式,与本文引用的序列具有相似长度或基本上不同长度的序列,可以通过在比对中插入空位来进行比较,例如通过gap使用的比较算法来确定这种空位。用于描述两个或更多个多核苷酸或多肽之间序列关系的术语,包括“参考序列”、“比较窗口”、“序列同一性”、“序列同一性的百分比”和“基本同一性”。“参考序列”的长度为至少12个,但通常为15至18个,通常至少25个单体单元(包括核苷酸和氨基酸残基)。因为两个多核苷酸可各自包含(1)两个多核苷酸之间相似的序列(即,仅完整多核苷酸序列的一部分),和(2)两个多核苷酸之间不同的序列,两个(或更多个)多核苷酸之间的序列比较通常通过比较“比较窗口”中两个多核苷酸的序列来进行,以鉴定和比较序列相似性的局部区域。“比较窗口”是指至少6个连续位置的概念性片段,通常为约50至约100,更通常为约100至约150,其中,两个序列最佳比对后,序列与具有相同连续位置数目的参考序列进行比较。对于两个序列的最佳比对,与参考序列(其不含添加或缺失)相比,比较窗口可以包括约20%或更少的添加或缺失(即,空位)。用于比对比较窗口的序列最佳比对,可以通过计算机化的算法实施(wisconsingeneticssoftwarepackagerelease7.0中的gap、bestfit、fasta和tfasta,geneticscomputergroup,575sciencedrivemadison,wi,usa)或通过检查以及通过所选的任何各种方法产生的最佳比对(即,在比较窗口上产生最高的百分比同源性)来实现。还可以参考blast系列程序,例如altschul等人,1997,nucl.acidsres.25:3389公开的。序列分析的详细讨论可以在ausubel等人“currentprotocolsinmolecularbiology”,johnwiley&sonsinc,1994-1998的单元19.3第15章中找到。如本文所用,术语“单链”是共价连接的氨基酸的单一线性且连续的排列。如本文所用,术语“可溶性”多肽(如可溶性pd-l2多肽)是指非天然存在的多肽,其通常是膜结合的,而现在在非膜结合状态下起作用,同时保留了结合分子并被其膜结合对应物(例如pd-1)所识别的能力。“th1相关疾病”或“th1相关病症”本文中可互换使用,是指与th1免疫应答的发展相关的疾病。本文所用的“th1免疫应答”是指th1细胞的增殖或增加的分化。适当地,通过以下鉴定th1相关疾病或病症:(1)th1细胞、th1细胞因子和/或th1抗体的水平,其超过通常在人、动物或细胞培养物中发现的水平;(2)与疾病或医学病症相关的病理学发现,其通过施用上调th1细胞增殖或分化的药剂可在动物中实验模拟;或(3)通过用抑制th1细胞增殖或分化的药剂进行处理,可以抑制或消除在疾病或医学病症的实验动物模型中诱导的病理学。在大多数th1相关的疾病中,至少满足三个条件中的两个。如本文所用,术语“治疗”、“处理”等是指获得所需的药理学和/或生理学作用。就完全或部分预防疾病或其症状而言,该效果可以是预防性的,和/或就部分或完全治愈疾病和/或可归因于疾病的不良作用而言,可以是治疗性的。如本文所用,“治疗”涵盖哺乳动物(特别是人)疾病的任何治疗,并且包括:(a)预防疾病发生在可能易患该疾病但尚未诊断为患有该疾病的受试者中;(b)抑制疾病,即阻止其发展;以及(c)缓解疾病,即引起疾病的消退。“载体”是指多核苷酸分子,适当地例如衍生自质粒、噬菌体、酵母或病毒的dna分子,向其中可插入或克隆多核苷酸。载体可以含有一个或多个独特的限制性位点,并且在限定的宿主细胞(包括靶标细胞或组织或祖细胞或其组织)中能够自主复制,或者可以与限定的宿主基因组整合,使得可繁殖克隆的序列。因此,载体可以是自主复制载体,即作为染色体外实体存在的载体,其复制独立于染色体复制,例如线性或闭合环状质粒、染色体外元件、微型染色体或人工染色体。载体可以包含任何确保自我复制的方法。或者,载体可以是这样的载体,当其被引入宿主细胞时,整合到基因组中并与其整合的染色体一起复制。载体系统可以包含单个载体或质粒,两个或多个载体或质粒,它们一起含有待引入宿主细胞基因组的总dna或转座子。载体的选择通常取决于载体与要导入载体的宿主细胞的相容性。在本发明的情况下,载体优选是病毒或病毒衍生的载体,其在动物和优选哺乳动物细胞中可操作地发挥作用。这种载体可以衍生自痘病毒、腺病毒或酵母。载体还可以包括选择标记物,例如抗生素抗性基因,其可以用于选择合适的转化体。此类抗性基因的示例是本领域技术人员已知的,并且包括赋予抗生素卡那霉素和g418抗性的nptii基因和赋予抗生素潮霉素b抗性的hph基因。术语“野生型”、“天然的”和“天然存在的”在本文中可互换使用,是指当从天然存在的来源分离时具有该基因或基因产物特征的基因或基因产物。野生型、天然或天然存在的基因或基因产物(例如,多肽)是群体中最常观察到的,因此任意设计基因或基因产物的“正常”或“野生型”形式。除非另有明确说明,否则本文所述的每个实施方案在细节上作必要的修改后应用于每个实施方案。2.多肽复合物本发明人惊奇地发现,在iec-相互作用细胞(如apc(例如,树突细胞))上的pd-l2表达与th1相关病症的严重程度成反比,并且pd-l2是建立th1免疫所必需的。换言之,如果apc上的pd-l2表达低于与存在正常或未受损的th1免疫相关的阈值,则th1免疫力受损。本发明人还发现,apc表面上pd-l2的聚集可以抑制pd-l1与pd-1的结合,从而抑制pd-l1对抗原特异性iec(例如抗原特异性t细胞)的免疫抑制功能。这使得发明人比较了pd-l2的不同寡聚体对阻断pd-l1与pd1结合的作用。值得注意的是,发现pd-l2的二聚体形式不能有效阻断这种结合。然而,本发明人还发现更高级的pd-l2寡聚体,即具有3或更高的寡聚度(例如,3、4、5、6、7、8、9、10、11、12等),具有比二聚体pd-l2与pd-1结合更高的亲和力,并且这种更高级的pd-l2寡聚体可以显著降低pd-l1对iec功能的抑制作用,包括cd4+t细胞功能。因此,本发明提供具有3或更高寡聚度(例如,3、4、5、6、7、8、9、10、11、12等)的pd-l2寡聚体,其用于调节th1免疫和治疗th1相关疾病,如下面更详细描述的。因此,本发明提供了可用于刺激或增强th1免疫的多肽复合物,该复合物通常由式(i)所示:[p]n(i)其中:p,每次出现时独立地代表蛋白分子,所述蛋白分子包含pd-l2多肽、由pd-l2多肽组成、或基本上由pd-l2多肽组成;以及n代表大于2的整数。2.1pd-l2多肽pd-l2是跨膜蛋白,并且处于其单体形式,其包含信号肽、igv和igc结构域,其构成分子的细胞外结构域(本文中也称为“胞外域”),igv样结构域全部或部分负责pd-1结合以及其他功能(包括信号传导)。pd-l2还含有短的胞质内结构域和单个跨膜结构域。pd-l2蛋白的非限制性示例可选自以下pd-l2直系同源物:人pd-l2黑猩猩pd-l2小鼠pd-l2一种多肽,其与seqidno:1至3中任一个所示序列具有至少70%(和至少71%至99%以及其间所有整数百分比)的序列相似性或同一性。有用的pd-l2多肽包括可溶性片段,其是pd-l2的适当片段,其可以从产生细胞中脱落、分泌或以其他方式提取。在一些实施方案中,pd-l2多肽包括pd-l2的整个胞外域。pd-l2的胞外域包括哺乳动物pd-l2的约20至约氨基酸221的氨基酸或其活性片段。在其他实施方案中,pd-l2多肽包括pd-l2的igc和igv结构域。在其他实施方案中,pd-l2多肽包括pd-l2的igv结构域。在具体的实施方案中,pd-l2多肽包含pd-l2胞外域、由pd-l2胞外域组成或基本上由pd-l2胞外域组成,说明性示例包括:人pd-l2胞外域加信号肽黑猩猩pd-l2胞外域加信号肽小鼠pd-l2胞外域加信号肽人pd-l2胞外域黑猩猩pd-l2胞外域小鼠pd-l2胞外域一种胞外域,其与seqidno:4至9中任一个所示序列具有至少70%(和至少71%至99%以及其间所有整数百分比)的序列相似性或同一性。在一些实施方案中,pd-l2多肽包含pd-l2跨膜结构域的至少一部分。许多其他哺乳动物pd-l2序列(包括灵长类动物序列)是本领域已知的,例如在genpept数据库或onlamoon等人(immunology124:277-293,2008)中公开的。可以通过任何合适的方法使本发明的蛋白分子寡聚化。例如,寡聚体可以通过化学连接在蛋白分子之间形成,例如通过使用异双功能接头、或通过寡聚化结构域与蛋白分子的pd-l2多肽的可操作连接。2.2异双功能连接试剂将蛋白分子与其他蛋白分子连接以产生本发明的多肽复合物可以是直接的或间接的。例如,两个或更多个蛋白分子的连接可以通过化学连接来实现或通过异双功能接头得以促进。用于在氨基和巯基之间形成共价键并将巯基引入蛋白的许多异双功能交联剂是本领域技术人员已知的(参见,例如piercecatalog,immunotechnologycatalog&handbook,1992-1993,其描述了这些试剂的制备和使用,并为这些试剂提供了商业来源;还参见,例如cumber等人bioconjugatechem.3:397-401,1992;thorpe等人cancerres.47:5924-5931,1987;gordon等人proc.natl.acadsci.usa84:308-312,1987;walden等人j.mol.cellimmunol.2:191-197,1986;carlsson等人biochem.j.173:723-737,1978;mahan等人anal.biochem.162:163-170,1987;wawrzynczak等人br.j.cancer66:361-366,1992;fattom等人infection&immun.60:584-589,1992)。这些试剂可用于在pd-l2多肽和另一种pd-l2多肽之间形成共价键,包括但不限于:n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp;二硫键接头);磺基琥珀酰亚胺基6-[3-(2-吡啶基二硫代)丙酰胺基]己酸酯(磺基-lc-spdp);琥珀酰亚胺氧基羰基-α-甲基苄基硫代硫酸酯(smbt,受阻的二硫酸酯接头);琥珀酰亚胺基6-[3-(2-吡啶基二硫代)丙酰胺基]己酸酯(lc-spdp);磺基琥珀酰亚胺基4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯(磺基-smcc);琥珀酰亚胺基3-(2-吡啶基二硫代)丁酸酯(spdb;受阻的二硫键接头);磺基琥珀酰亚胺基2-(7-叠氮基-4-甲基香豆素-3-乙酰胺)乙基-1,3'-二硫代丙酸酯(saed);磺基琥珀酰亚胺基7-叠氮基-4-甲基香豆素-3-乙酸酯(samca);磺基琥珀酰亚胺基-6-[α-甲基-α-(2-吡啶基)甲苯酰胺]己酸酯(磺基-lc-smpt);1,4-二-[3'-(2'-吡啶基二硫代)丙酰胺基]丁烷(dpdpb);4-琥珀酰亚胺基氧基羰基-α-甲基-α-(2-吡啶基硫代)-甲苯(smpt,受阻的二硫酸酯接头);磺基琥珀酰亚胺基-6-[α-甲基-α-(2-嘧啶基-硫代)甲苯酰胺]己酸酯(磺基-lc-smpt);间-马来酰亚胺基苯甲酰基-n-羟基-琥珀酰亚胺酯(mbs);间-马来酰亚胺基苯甲酰基-n-羟基磺基-琥珀酰亚胺酯(磺基-mbs);n-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab;硫醚接头);磺基琥珀酰亚胺基-(4-碘乙酰基)氨基苯甲酸酯(磺基-siab);琥珀酰亚胺基-4-(对马来酰亚胺基-二苯基)丁酸酯(smpb);磺基琥珀酰亚胺基-4-(对马来酰亚胺基-苯基)丁酸酯(磺基-smpb);叠氮基苯甲酰肼(abh)。例如,这些接头可以与肽接头组合使用,例如那些增加柔韧性或溶解度或提供或消除空间位阻的肽接头。可以使用本领域技术人员已知的用于将多肽分子连接到另一分子的任何其他接头。一般性质使得所得分子与pd-1或另一种靶标分子结合(例如,另一同源受体)。2.3寡聚化结构域三个或更多个pd-l2多肽的相互作用,可以通过它们直接或间接地连接到本身能够相互作用以形成稳定结构的任何部分或其他多肽而得以促进。例如,可通过寡聚化连接单独的pd-l2多肽链以形成本发明的蛋白分子,由此多肽的寡聚化由寡聚化结构域来介导。通常,寡聚化结构域提供在至少3、4、5、6、7、8、9、10、11、12或甚至更多含pd-l2多肽的蛋白分子之间形成稳定的蛋白-蛋白相互作用。单独的pd-l2多肽的寡聚化结构域可以与本发明多肽复合物中的另一种pd-l2多肽的寡聚化结构域不同,只要不同的寡聚化结构域是“互补的”,它们就优先彼此发生相互作用或相互结合以允许蛋白分子的寡聚化(即形成寡聚体,如三聚体、四聚体、五聚体、六聚体、七聚体、八聚体、九聚体、十聚体、十一聚体、十二聚体或更高级的寡聚体,其可以是同寡聚体或异寡聚体)。通常,寡聚化结构域包括能够形成稳定的蛋白-蛋白相互作用的任何氨基酸序列。寡聚化结构域可以通过免疫球蛋白序列相互作用(例如,fc结构域;见例如,国际专利公布wo93/10151和wo2005/063816us;美国专利公开号2006/0024298;美国专利号5,457,035)、亮氨酸拉链(例如,来自核转化蛋白fos和jun或原癌基因c-myc或来自generalcontrolofnitrogen(gcn4))、疏水区、亲水区或在同源或异源寡聚体嵌合分子之间形成分子间二硫键的游离巯基。另外,寡聚化结构域可包括含有突起的氨基酸序列,所述突起与包含空穴的氨基酸序列互补,例如描述于美国专利号5,731,168;国际专利公开号wo98/50431和wo2005/063816;ridgway等人(1996)proteinengineering9:617-621。可以工程改造这种寡聚化区域,使得空间相互作用不仅促进稳定的相互作用,而且和同二聚体相比,更加促进从嵌合单体混合物形成异二聚体。通常,通过用较大的侧链(例如,酪氨酸或色氨酸)取代第一多肽界面的小氨基酸侧链,来构建突起。任选地,通过用较小的氨基酸侧链(例如,丙氨酸或苏氨酸)取代第二多肽界面的较大氨基酸侧链,产生与突起具有相同或相似大小的互补腔。示例性寡聚化结构域如下所述。pd-l2多肽,例如任何本文提供的,可以在任何地方进行连接,但通常通过其n-或c-末端连接到包含至少一个寡聚化结构域的寡聚化模块的n-或c-末端,以形成嵌合多肽。连接可以直接或通过接头间接进行。此外,嵌合多肽可以是融合蛋白或可以通过化学连接形成,例如通过共价或非共价相互作用。例如,当制备包含具有至少一个寡聚化结构域的寡聚化模块的嵌合多肽时,编码pd-l2多肽的核酸可以直接或间接或任选地通过接头肽与编码寡聚化模块的核酸可操作地连接,以形成核酸构建体。通常,构建体编码嵌合多肽,其中pd-l2多肽的c-末端与寡聚化模块的n-末端连接。在某些情况下,构建体可编码嵌合多肽,其中pd-l2多肽的n-末端与寡聚化结构域的c-末端连接。例如,在其中至少一个寡聚化结构域可操作地连接在pd-l2多肽下游的实施方案中,所述蛋白分子包含式(ii)所示单个多肽链、由式(ii)所示单个多肽链组成、基本上由式(ii)所示单个多肽链组成:pd-l2-l-omda(ii)其中:pd-l2代表pd-l2多肽;omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i≥3,适当地为3、4、5或6;以及l是键或肽接头。或者,所述蛋白分子包含式(iii)所示单个多肽链、由式(iii)所示单个多肽链组成、基本上由式(iii)所示单个多肽链组成:pd-l2-l-omda-l-omdb(iii)其中:omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i≥2,适当地为2、3、4、5或6;l,每次出现时独立地代表键或肽接头;以及omdb是寡聚化结构域,其形成j个亚基omdb的寡聚体(omdb)j,其中j是大于i的整数,适当地为i+1、i+2、i+3、i+4、i+5或i+6;在其中至少一个寡聚化结构域可操作地连接在pd-l2多肽上游的实施方案中,蛋白分子包含式(iv)所示单个多肽链、由式(iv)所示单个多肽链组成、基本上由式(iv)所示单个多肽链组成:omda-l-pd-l2(iv)其中:omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i≥3,适当地为3、4、5或6;l是键或肽接头;以及pd-l2代表pd-l2多肽。或者,所述蛋白分子包含式(v)所示单个多肽链、由式(v)所示单个多肽链组成、基本上由式(v)所示单个多肽链组成:omdb-l-omda-l-pd-l2(v)其中:omdb是寡聚化结构域,其形成j个亚基omdb的寡聚体(omdb)j,其中j≥2,适当地为2、3、4、5或6;l,每次出现时独立地代表键或肽接头;以及omda是寡聚化结构域,其形成i个亚基omda的寡聚体(omda)i,其中i是大于j的整数,适当地为j+1、j+2、j+3、j+4、j+5或j+6;以及pd-l2代表pd-l2多肽。许多寡聚化结构域是本领域已知的,其代表性示例包括:2.3.1免疫球蛋白结构域寡聚化结构域包括包含游离巯基部分的那些,其中游离巯基部分能够与其他氨基酸序列的寡聚化结构域反应形成分子间二硫键。例如,寡聚化结构域可包括免疫球蛋白分子的一部分,例如来自igg1、igg2、igg3、igg4、iga、igd、igm或ige的一部分。通常,这种部分是免疫球蛋白恒定区(fc)。已经描述了融合蛋白的制剂,其含有融合至抗体衍生多肽不同部分(包括fc结构域)的多肽,参见例如ashkenazi等人proc.natl.acad.sciusa88:10535,1991;byrn等人nature,344:667,1990;以及hollenbaugh和aruffo(2002)在currentprotocolsinimmunology中的“constructionofimmunoglobulinfusionproteins”第十章pp.10.19.1-10.19.11。在一些实施方案中,寡聚化结构域包含全长免疫球蛋白多肽。或者,免疫球蛋白多肽小于全长,即含有重链、轻链、fab、fab2、fv或fc。在一个示例中,pd-l2多肽-免疫球蛋白嵌合多肽组装为异-或同-寡聚体,特别是作为四聚体。可以利用具有不同结构的链或基本单元来组装异-或同-寡聚体。例如,pd-l2多肽可以融合至免疫球蛋白分子的全部或部分,包括免疫球蛋白分子的全部或部分ch、cl、vh或vl结构域(参见例如美国专利号5,116,964)。转化有合适核酸分子的哺乳动物细胞可以容易地产生和分泌嵌合的pd-l2多肽-免疫球蛋白多肽。分泌形式包括pd-l2多肽存在于重链和轻链异四聚体中的那些,其中pd-l2多肽与一条或多条轻链或重链融合,包括在其中多达四个和所有四个可变区类似物被取代的异四聚体。在一些示例中,可以将一种或多于一种核酸融合分子转化到宿主细胞中以产生寡聚体,其中寡聚体的pd-l2多肽部分相同或不同。fc结构域通常,pd-l2多肽嵌合多肽的免疫球蛋白部分包括免疫球蛋白多肽的重链,最常见的是重链的恒定结构域。示例性人igg亚型的重链恒定区序列选自以下序列:其中ch1结构域对应于氨基酸1-98,铰链区对应于氨基酸99-110,ch2结构域对应于氨基酸111-223,以及ch3结构域对应于氨基酸224-330。在一个示例中,免疫球蛋白多肽嵌合蛋白可包括免疫球蛋白多肽的fc区。通常,这种融合至少保留免疫球蛋白重链恒定区的功能活性铰链,ch2和ch3结构域。例如,igg1的全长fc序列包括seqidno:10所示序列的氨基酸99-330。示例性人igg1的fc序列是:其含有几乎所有的铰链序列,以及seqidno:10所示的ch2和ch3结构域的完整序列。或者,人igg1的fc多肽选自:除了人igg1fc之外,其他fc区也可以包括在本文提供的pd-l2多肽-寡聚化模块嵌合蛋白中。例如,由fc/fcγ受体(fc/fcγr)相互作用介导的免疫效应功能有待最小化的情况下,可以考虑与难以募集补体或免疫效应细胞的igg同种型融合,例如igg2或igg4的fc。另外,fc融合体可含有免疫球蛋白序列,其基本上由属于任何抗体类别的免疫球蛋白基因编码,包括但不限于igg(包括人亚类igg1、igg2、igg3或igg4)、iga(包括人亚类iga1和iga2)、igd、ige和igm类抗体。此外,接头可用于将fc与另一多肽共价连接以产生fc嵌合体。本文考虑修饰的fc结构域用于具有pd-l2多肽的嵌合体。在一些示例中,修饰fc区使得其表现出与fcr改变的结合,从而导致比野生型免疫球蛋白重链fc区的效应功能(即,或多或少)改变的效应功能。因此,修饰的fc结构域可以具有改变的亲和力,包括但不限于对fc受体的亲和力增加或降低或没有。例如,不同的igg亚类对fcγr具有不同的亲和力,其中igg1和igg3通常比igg2和igg4实质上更好地结合受体。修饰的fc结构域是本领域技术人员已知的,并且在文献中有描述,参见,例如美国专利号5,457,035;u.s专利公开号us2006/0024298;和国际专利公开号wo2005/063816用于示例性修饰。2.3.2卷曲螺旋结构域参与蛋白寡聚化的一种常见结构基序是卷曲螺旋结构域,并且这种结构域也可作为寡聚化结构域用于制备pd-l2多肽复合物。卷曲的α-螺旋结构基序本身可以形成螺旋,并且两个、三个、四个或五个α-螺旋可以彼此环绕而形成左旋超螺旋,称为“卷曲螺旋”,即便如此已经设计过人工的右旋超螺旋(burkhard等人,trendscellbiol11:82-88,2001;section5.5.2ofproteinsbycreighton(isbn0-7167-2317-4);yuadvdrugdelivrev54:1113-1129,2002;muller等人,methodsenzymol328:261-282,2000;beck&brodskyjstructbiol122:17-29,1998;lupastrendsbiochemsci21:375-382,1996;adamson等人,curropinbiotechnol4:428-347,1993)。卷曲螺旋结构域的简单性使其成为设计具有确定的寡聚化状态的嵌合蛋白的常用选择(muller等人,methodsenzymol328:261-282,2000)。在卷曲螺旋结构中,α-螺旋通过疏水性残基相互作用,所述疏水性残基沿每个螺旋的一侧形成非极性条带,并且在该条带任一侧上的侧链之间也可存在稳定的静电相互作用。在α-螺旋的abcdefg七肽重复中,由残基a和d处的疏水侧链来限定非极性条带,其中任何静电相互作用主要位于残基e和g处。位置a最常见的是leu、ile或ala,位置d通常是leu或ala。残基e和g通常是glu或gln,而arg和lys在位置g也很突出。带电残基在位置b、c和f处是常见的,因为这些残基与溶剂接触。然而,这种常规七肽模式也有例外,并且有时在七肽中发现pro残基。这些例外通常具有功能意义,包括例如寡聚化结构域的去稳定化以允许重折叠和重排,例如在f蛋白中发生的重折叠和重排。数百个卷曲螺旋结构域序列是本领域已知的,只要它保留与其他卷曲螺旋结构域进行寡聚化的能力并且它不破坏或显著损害pd-l2多肽内其他结构域的功能,则任何合适的序列可以用作本发明的寡聚化结构域。作为使用天然卷曲螺旋结构域的替代方案,可以使用人工卷曲螺旋结构域(chao等人,jchromatogbbiomedsciappl715:307-329,1998;arndt等人,structure10:1235-1248,2002)。由于卷曲螺旋结构域的高度重复结构,结构域特别适合于计算机建模,因为每个氨基酸残基的主链部分可以参数化,而不用将残基的每个骨架部分作为具有自身变量的独特单元进行处理。结构域(b)可包括亮氨酸拉链序列或丙氨酸拉链序列(liu&lujbiolchem277:48708-48713,2002)。已经显示卷曲螺旋以二聚体、三聚体、四聚体和五聚体形式存在。已经在许多类型的蛋白中发现它们,包括转录因子,例如但不限于fos、jun、c-myc、gcn4、病毒融合肽、snare复合物和某些trna合酶等。在蛋白中发现很长的卷曲螺旋,如原肌球蛋白、中间丝和纺锤极体成分。其他示例是血小板反应蛋白和软骨寡聚基质蛋白(comp),其中连接三个(血小板反应蛋白1和2)或五个(血小板反应蛋白3、4和comp)链。这些分子具有花束状外观,其寡聚化结构的原因可能是c-末端结构域与细胞受体的多价相互作用。酵母转录激活因子gcn4是超过30种鉴定的真核蛋白中的一种,其含有基本区亮氨酸拉链(bzip)dna结合基序,ellenberger等人(cell71:1223-1237,1982)。bzip二聚体是一对连续的α螺旋,它们在其羧基末端的34个残基上形成平行的卷曲螺旋,并逐渐向其氨基末端发散以跨越dna结合位点的主沟。另一个示例是从牛气管软骨分离的cmp(软骨基质蛋白抗原(matrilin-1),其作为mr52,000亚基的同三聚体(paulsson和heinegardbiochemj.197:367-375,1981),其中每个亚基由vwfa1模块、单个egf结构域、vwfa2模块和跨越五个七肽的卷曲螺旋结构域组成(kiss等人j.biol.chem.264:8126-8134,1989;hauser和paulssonj.biol.chem.269:25747-25753,1994)。另一个示例是软骨寡聚基质蛋白(comp)。非胶原糖蛋白comp首先在软骨中被鉴定出来(hedbom,等人j.biol.chem.267:6132-6136,1992)。该蛋白是524kda的5个亚基的同五聚体,由n-末端七肽重复区(cc)和随后的四个表皮生长因子(egf)样结构域(ef)、七个钙结合结构域(t3)和c-末端球状结构域(tc)组成。根据该结构域的结构,comp属于血小板反应蛋白家族。在具体的实施方案中,卷曲螺旋寡聚化结构域是亮氨酸拉链。由亮氨酸拉链结构域形成的二聚体被七肽重复序列稳定,七肽重复序列命名为(abcdefg)n(见例如,mclachlan和stewart,j.mol.biol.98:293,1978),其中残基a和d通常是疏水残基,其中d是亮氨酸,其排列在螺旋的同一面上。带有相反电荷的残基通常出现在位置g和e。因此,在由两个螺旋亮氨酸拉链结构域形成的平行卷曲螺旋中,由第一螺旋的疏水侧链形成的“突起”被填到第二螺旋侧链之间形成的“空穴”中。用作本文寡聚化结构域的说明性亮氨酸拉链,可以衍生自两种核转化蛋白中的任意,fos和jun,其显示亮氨酸拉链结构域,或小鼠原癌基因的产物,c-myc。亮氨酸拉链结构域是这些蛋白中生物活性(dna结合)所必需的。核原癌基因的产物fos和jun含有优先形成异二聚体的亮氨酸拉链结构域(o'shea等人science,245:646,1989;turner和tijianscience,243:1689,1989)。例如,已显示人转录因子c-jun和c-fos的亮氨酸拉链结构域以1:1的化学计量形成稳定的异二聚体(参见例如,busch和sassone-corsi,trendsgenetics,6:36-40,1990;gentz等人,science,243:1695-1699,1989)。尽管已显示形成jun-jun同二聚体,但它们比jun-fos异二聚体稳定性低约1000倍。通常,c-jun或c-fos的亮氨酸拉链结构域融合在pd-l2多肽的c-末端。c-jun和c-fos亮氨酸拉链的示例性氨基酸序列包括,分别为:此外,pd-l2多肽与亮氨酸拉链的连接可以是直接的或可以使用柔性接头结构域,例如igg的铰链区、或其他小氨基酸的多肽接头(例如各种长度和组合的甘氨酸、丝氨酸、苏氨酸或丙氨酸,如下面更详细描述的)。在一些情况下,可以通过与编码蛋白酶切割位点的序列(例如凝血酶切割位点)进行融合,来实现亮氨酸拉链与编码多肽c-末端的分离。用作寡聚化结构域的另一示例性亮氨酸拉链结构域衍生自核蛋白,其起到参与酿酒酵母(saccharomycescerevisiae)中常规氮控制(gcn4)代谢的基因家族的转录激活因子的作用。该蛋白能够二聚化,并结合含有gcn4识别序列的启动子序列,从而在氮耗竭时激活转录。这种结构域是本领域已知的(o'shea等人,science243,534-542,1989;harbury等人,science262,1401-1407,1993)。能够形成二聚化复合物的gcn4亮氨酸拉链的示例性序列适当地选自:已发现,代表gcn4亮氨酸拉链结构域的合成肽中a和d残基的氨基酸取代(即,seqidno:16所示序列中的氨基酸取代)改变了亮氨酸拉链结构域的寡聚化性质。例如,当位置a上的所有残基都变为异亮氨酸时,亮氨酸拉链仍然形成平行的二聚体。除了这种变化之外,当位置d上的所有亮氨酸残基也变为异亮氨酸时,所得肽在溶液中自发形成三聚体平行卷曲螺旋。能够形成三聚体的这种gnc4亮氨酸拉链结构域的示例性序列选自:用异亮氨酸取代位置d的所有氨基酸,并用亮氨酸取代位置a的所有氨基酸,得到四聚化的肽。能够形成四聚体的gcn4的亮氨酸拉链结构域的代表性序列适当地选自:含有这些取代的肽仍被称为亮氨酸拉链结构域,因为认为寡聚体形成的机制与传统亮氨酸拉链结构域的机制相同,例如上述和seqidno:16所示gcn4。可选的卷曲螺旋结构域是取自形成三聚体的细菌跨膜蛋白的那些。合适的跨膜蛋白子集是粘附素(即介导粘附至其他细胞或粘附至表面的细胞表面蛋白),特别是非伞状粘附素(例如,在寡聚化卷曲螺旋粘附素或“oca”家族中)。用于本发明的具体序列包括参考文献24中公开的那些,其来自小肠结肠炎耶尔森氏菌(yersiniaenterocolitica)粘附素yada、脑膜炎奈瑟氏菌(neisseriameningitidis)粘附素nada、卡他莫拉菌(moraxellacatarrhalis)表面蛋白uspa2和其他粘附素,例如来自流感嗜血杆菌埃及生物型(haemophilusinfluenzaebiogroupaegyptius)的hada粘附素等(参见,wo2006/011060的seqidno28-31和42-58)。另外,真核热休克转录因子具有卷曲螺旋三聚化结构域,其可以单独表达,并因此与本发明一起使用。可以与本发明一起使用的另一类寡聚化结构域存在于称为胶原螺旋的左旋三螺旋中(creighton的proteins第5.5.3节(isbn0-7167-2317-4))。这些三螺旋形成序列涉及1gly2xaa3xaa的基础三肽重复序列,其中2xaa通常是pro,3xaa通常是4-羟脯氨酸。虽然这个基序被称为“胶原蛋白”螺旋,但它在许多蛋白中被发现,而不仅仅是胶原蛋白。因此,寡聚化结构域可以是包含多个重复序列基序1gly2xaa3xaa的序列,该基序折叠以形成螺旋结构,该螺旋结构可以与其它多肽链中的相应螺旋结构寡聚化。胶原蛋白还提供另一类寡聚化结构域。zhang&chen(jbiolchem274:22409-22413,1999)描述了在x型胶原蛋白的非胶原蛋白结构域1(nc1)中发现的基序,该基序可用于形成没有三螺旋的三聚体和更高级的寡聚体。这种三聚化的结合是高度热稳定的,没有分子间二硫键。因此,寡聚化结构域可以包含nc1序列。t4噬菌体次要纤维蛋白(fibritin)的三聚化结构域(foldon)(tao等人,structure5:789-798,1997;guthe等人j.mol.biol.337,905-915,2004),特别是foldon的c-末端27至30个残基或其衍生物也可用于pd-l2多肽的寡聚化。该三聚化结构域可以具有序列gyipeaprdgqayvrkdgewvllstfl[seqidno:25]或gsgyipeaprdgqayvrkdgewvllstfl[seqidno:26]。还设想了该结构域的小修饰。这些修饰可以是cys取代asp9,目的是在相邻结构域之间形成二硫桥。这种结构域表面氨基酸的其他修饰可以包括残基的取代,以优化相邻寡聚化结构域之间界面上的相互作用,如疏水、亲水或离子相互作用或共价键如二硫桥。然而,这种结构域表面氨基酸的其它修饰可以包括氨基酸的取代(例如,取代为半胱氨酸或赖氨酸),以产生官能团的连接位点。在其他实施方案中,四臂粘联蛋白(tetrabrachion)卷曲螺旋结构域的四聚化结构域(stetefeld等人,naturestructuralbiology7(9):772-776,2000)或其衍生物用于pd-l2多肽的寡聚化。该四聚化结构域适当地包含序列iinetaddivyrltviiddryeslknlitlradrlmiindnvstilasg[seqidno:27]。卷曲螺旋的序列的特征在于具有3,4-疏水重复的七个残基的七肽重复序列。在少数转角之后,允许残基占据准(quasi-)等价位置的下一个周期是三个转角或11个残基。基于11个残基重复的存在,来自超嗜热古细菌海葡萄超嗜热菌(staphylothermusmarinus)的表面层糖蛋白四臂粘联蛋白的c-末端形成右旋的卷曲螺旋结构。它形成70nm长的四聚化α-螺旋卷曲螺旋茎,其在c-末端锚定在细胞膜上。本发明还考虑了用于pd-l2多肽寡聚化的五聚化结构域。这种类型的非限制性结构域是comp的五聚化结构域(malashkevich等人,science274:761-765,1996)或其衍生物。这种五聚化结构域可包含序列lapqmlrelqetnaalqdvrellrqqvkqitflkntvmecdcg[seqidno:28]。还设想了该序列的较短构建体,例如缺少c-末端的cdacg基序,其中半胱氨酸在该五聚化结构域c-末端形成分子间二硫桥。或者,五聚化结构域是色氨酸拉链(liuj等人,procnatlacadsciusa101:16156-16161,2004)或其衍生物。这种类型的非限制性五聚化结构域包含序列ssnakwdqwssdwqtwnakwdqwsndwnawrsdwqawkddwarwnqrwdnwat[seqidno29]。另一种有用的寡聚化结构域是iga免疫球蛋白重链的c-末端,也称为α尾部(αtp),其形成六聚体。代表性的六聚化αtp序列长度为18个氨基酸,来源于人iga分子。在一个实施方案中,α尾部是pthvnvsvvmaevdgtcy[seqidno:30]。然而,如果需要,可以通过改变残基5-7(nvs)处的1或2个氨基酸来修饰肽以除去糖基化位点。例如,在位置5的天冬酰胺(n)可以变为谷氨酰胺(q)。或者,位置7的丝氨酸(s)可以变为丙氨酸(a)。另外,还可以包括iga恒定区的少数氨基酸残基,例如iga恒定区的约4个氨基酸。具有有用α尾部的合适iga分子包括但不限于人iga1、人iga2、兔iga和小鼠iga。该肽直接或间接连接到免疫球蛋白的恒定结构域,例如包括ch2和ch3结构域的片段。2.3.3亚基之间的蛋白-蛋白相互作用用于pd-l2多肽寡聚化的替代寡聚化结构域是其中通过不同亚基多肽之间蛋白-蛋白相互作用而促进寡聚化的那些。这种寡聚化结构域,例如衍生自激酶a锚蛋白(akap)的camp依赖性蛋白激酶(pka)及其锚定结构域(ad)的机制。因此,异寡聚化pd-l2多肽可以通过将pd-l2多肽与pka的r亚基序列(直接或间接)融合而产生,说明性示例是:shiqippgltellqgytvevlrqqppdlvefaveyftrlreara[seqidno:31]。由于r亚基影响的二聚体的自发形成,这产生同二聚体分子。随后,通过将另一种pd-l2多肽与akap的ad序列融合,来产生另一种pd-l2多肽融合,其包含例如序列:qieylakqivdnaiqq[seqidno:32]。在宿主细胞中共表达这些嵌合多肽中每一个的编码序列时,二聚化r亚基提供与ad序列结合的停靠位点,产生异寡聚化分子。该结合事件可以通过共价键进一步稳定,例如二硫键。在一些示例中,柔性接头残基可以在pd-l2多肽和寡聚化结构域之间融合。在另一个示例中,pd-l2多肽的融合可以是含有半胱氨酸残基的r亚基,所并入的半胱氨酸残基邻近r亚基的氨基末端以促进共价连接。这种经修饰的pka的r亚基可包含例如序列:cshiqippgltellqgytvevlrqqppdlvefaveyftrlreara[seqidno:33]。类似地,pd-l2多肽的融合可以是ad亚基,其也包含向ad氨基末端和羧基末端并入的半胱氨酸残基。这种修饰的ad亚基的代表性序列包含序列:cgqieylakqivdnaiqqagc[seqidno:34]。可以用于pd-l2多肽寡聚化、促进分别产生并表达为pd-l2多肽融合的两种或更多种多肽的蛋白-蛋白相互作用的其他寡聚化结构域,包括例如芽孢杆菌rna酶-芽胞杆菌rna酶(barnase-barnase)模块(见,例如,deyev等人,nat.biotechnol.21:1486-1492,2003);特定蛋白结构域的使用(参见例如,terskikh等人,procnatlacadsciusa94:1663-1668,1997;以及muller等人,febslett.422:259-264,1998);特定肽基序的使用(参见例如,dekruif等人,j.biol.chem.271:7630-7634,1996;以及muller等人,febslett.432:45-49,1998);以及使用二硫桥增强稳定性(dekruif等人,j.biol.chem.271:7630-7634,1996;以及schmiedl等人,proteineng.13:725-734,2000),以及特异性结合对,如生物素-抗生物素蛋白、生物素-链霉亲和素、抗原-抗体、半抗原-抗半抗原、配体-受体和受体-共受体。2.4接头本发明的嵌合多肽可包含将pd-l2多肽与寡聚化结构域隔开、或使两个寡聚化结构域隔开的接头。接头通常包括不能明确指定为七肽重复序列的任何氨基酸残基。接头经常用于蛋白工程领域以互连不同的功能单元,例如,产生衍生自抗体可变轻链(vl)和可变重链(vh)的单链可变片段(scfv)构建体。它们通常在溶液中具有构象上的柔性,并且适合于并且主要由极性氨基酸残基类型组成。柔性接头中的典型(常用)氨基酸是丝氨酸和甘氨酸。次优选地,柔性接头还可包括丙氨酸、苏氨酸和脯氨酸。因此,嵌合多肽的中间(intervening)接头优选在构象上是柔性的,以确保pd-l2多肽和寡聚化结构域或两个寡聚化结构域的自由(无阻碍)结合。用于本文所设想的多肽的合适接头对于本领域技术人员来说是清楚的,并且只要接头在结构上是柔性的,通常其它可以是本领域中用于连接氨基酸序列的任何接头,即它们不影响pd-l2多肽的生物活性或寡聚化结构域的寡聚化特性。本领域技术人员将能够任选地在进行有限数量的常规实验之后确定最佳接头。适当的,中间接头是这样的氨基酸序列,其通常由至少1个氨基酸残基组成,通常由至少2个氨基酸残基组成,为方便起见,选择非临界上限为约100个氨基酸残基。在具体的实施方案中,接头由约1至约50个氨基酸残基、或约50至约100个氨基酸残基、通常约1至约40个氨基酸残基、通常约1至约30个氨基酸残基组成。特别地,在非限制性实施方案中,接头序列的至少50%氨基酸残基选自脯氨酸、甘氨酸和丝氨酸。在进一步的非限制性实施方案中,接头序列的至少60%,例如至少70%,例如80%,更特别是90%的氨基酸残基选自脯氨酸、甘氨酸和丝氨酸。在其他具体实施方案中,接头序列基本上由极性氨基酸残基组成;在这些具体的实施方案中,接头序列的至少50%,例如至少60%,例如70%或80%,更特别是90%或至多100%的氨基酸残基选自甘氨酸、丝氨酸、苏氨酸、丙氨酸、脯氨酸、组氨酸、天冬酰胺、天冬氨酸、谷氨酰胺、谷氨酸、赖氨酸和精氨酸。在一些实施方案中,接头序列包含gg、[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1到10的整数,适当地1到5,更适当地1到3。在具体的实施方案中,示例性接头可选自:ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、aapa[seqidno:43]。2.5其他部分本发明的嵌合多肽可以进一步包括纯化部分以促进pd-l2多肽-寡聚化结构域嵌合体的纯化。纯化部分通常包含一段氨基酸,其能够通过亲和力结合回收嵌合多肽。许多纯化部分或“标签”是本领域已知的,其说明性示例包括生物素羧基载体蛋白标签(bccp-标签)、myc-标签(c-myc标签)、钙调蛋白-标签、flag-标签、ha-标签、his-标签(六组氨酸-标签,his6,6h)、麦芽糖结合蛋白-标签(mbp-标签)、nus-标签、纤维素结合结构域-标签(cbd-标签)、t7肽-标签(t7-标签)、泛素-标签、几丁质-结合蛋白-标签(cbp-标签)、谷胱甘肽-s-转移酶-标签(gst-标签)、绿色荧光蛋白-标签(gfp-标签)、聚谷氨酸-标签、淀粉样蛋白β-标签、硫氧还蛋白-标签、s-标签、softag1、softag3、葡萄球菌蛋白a-标签(蛋白a-标签)、链球菌蛋白g-标签(蛋白g-标签)、链霉亲和素-结合肽-标签(sbp-标签)、生物素-标签、链霉亲和素-标签和v5标签。在一些实施方案中,pd-l2多肽和/或寡聚化结构域包括免疫沉默或抑制部分,所述免疫沉默或抑制部分抑制受试者对这些成分中的任何一种或多种引发或产生免疫应答。免疫沉默部分可以是被糖基化酶(特别是糖基转移酶)所特异性识别并糖基化的糖基化位点。糖基化可以是n-连接的或o-连接的。n-连接是指碳水化合物部分与天冬酰胺残基的侧链连接。三肽序列n-x-s和n-x-t(其中x是除p外的任何氨基酸)是碳水化合物部分与天冬酰胺侧链进行酶促连接的识别序列,这些序列通常称为“糖基化位点”。o-连接的糖基化是指糖n-乙酰半乳糖胺、半乳糖或木糖中的一种与羟基氨基酸的连接,最常见的羟基氨基酸是丝氨酸或苏氨酸,尽管如此也可以使用5-羟脯氨酸或5-羟基赖氨酸。3.代表性的嵌合多肽构建体适当地,本发明的示例性嵌合多肽是式(vi)所示:pd-l2-l-omdx(vi)其中:pd-l2选自seqidno:1至9中的任一个、或与seqidno:1至9中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n为1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43];以及omdx选自:(a)三聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:21、22、25和26中的任何一个,或与seqidno:21、22、25和26中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;(b)四聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:23、24和27中的任何一个,或与seqidno:23、24和27中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;(c)五聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:28或29;以及(d)六聚化结构域,其适当地包含seqidno:30所示氨基酸序列或由seqidno:30所示氨基酸序列组成。在其他实施方案中,本发明的嵌合多肽适当地是式(vii)所示:pd-l2-l-omdy-l-omdz(vii)其中:pd-l2选自seqidno:1至9中的任一个、或与seqidno:1至9中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;-l-每次出现时独立地代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43];omdy是寡聚化结构域,其形成i个亚基omdy的寡聚体(omdy)i,适当地选自:(a)二聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:10、11、12、13、14、15、16、17、18、19和20中的任何一个,或与seqidno:10、11、12、13、14、15、16、17、18、19和20中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽,或者包含寡聚化结构域或由寡聚化结构域组成,该结构域适当地是选自以下的特异性结合对的成员:akap的pka-ad序列的r亚基序列(例如,seqidno:31和32或seqidno:33和34)、生物素-抗生物素蛋白、生物素-链霉亲和素、抗原-抗体、半抗原-抗半抗原、配体-受体和受体-共受体;(b)三聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:21、22、25和26中的任何一个,或与seqidno:21、22、25和26中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;(c)四聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:23、24和27中的任何一个,或与seqidno:23、24和27中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;(d)五聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:28或29;以及(e)六聚化结构域,其适当地包含seqidno:30所示氨基酸序列或由seqidno:30所示氨基酸序列组成;以及omdz是一种寡聚化结构域,其形成j个亚基omdz的寡聚体(omdz)j,其中j是大于i的整数,适当地i+1、i+2、i+3、i+4、i+5或i+6,其中omdz适当地选自:(a)三聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:21、22、25和26中的任何一个,或与seqidno:21、22、25和26中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;(b)四聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:23、24和27中的任何一个,或与seqidno:23、24和27中的任一个所示序列具有至少70%(以及至少71%至99%、以及之间的所有整数百分比)序列相似性或同一性的多肽;(c)五聚化结构域,其适当地包含氨基酸序列,或由氨基酸序列组成,其中所述氨基酸序列选自:seqidno:28或29;以及(d)六聚化结构域,其适当地包含seqidno:30所示氨基酸序列或由seqidno:30所示氨基酸序列组成;以及本发明的嵌合多肽的非限制性示例如下:3.1人pd-l2胞外域-l-gcn4三聚化结构域其中:-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。gcn4三聚化结构域促进将嵌合多肽自组装成三聚体。3.2人pd-l2胞外域-l-foldon三聚化结构域其中:-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。foldon三聚化结构域促进将嵌合多肽自组装成三聚体。3.3人pd-l2胞外域-l-gcn4四聚化结构域其中:-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。gcn4四聚化结构域促进嵌合多肽自组装成四聚体。3.4人pd-l2胞外域-l-四臂粘联蛋白的四聚化结构域其中:-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。四臂粘联蛋白的四聚化结构域促进嵌合多肽自组装成四聚体。3.5人pd-l2胞外域-l-comp五聚化结构域其中:-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。comp五聚化结构域促进嵌合多肽自组装成五聚体。3.6人pd-l2胞外域-l-色氨酸拉链五聚化结构域其中:-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。色氨酸拉链五聚化结构域促进嵌合多肽自组装成五聚体。3.7人pd-l2胞外域-l-αtp六聚化结构域其中:-l-代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。αtp六聚化结构域促进嵌合多肽自组装成六聚体。3.8人pd-l2胞外域-l-fc二聚化结构域-l-foldon三聚化结构域其中:-l-每次出现时独立地代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。fc二聚化结构域和foldon三聚化结构域的组合促进嵌合多肽自组装成六聚体。3.9人pd-l2胞外域-l-fc二聚化结构域-l-gcn4四聚化结构域其中:-l-每次出现时独立地代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。fc二聚化结构域和gcn4四聚化结构域的组合促进嵌合多肽自组装成八聚体。3.10人pd-l2胞外域-l-fc二聚化结构域-l-comp五聚化结构域其中:-l-每次出现时独立地代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。fc二聚化结构域和comp五聚化结构域的组合促进嵌合多肽自组装成十聚体。3.11人pd-l2胞外域-l-fc二聚化结构域-l-αtp六聚化结构域其中:-l-每次出现时独立地代表键(例如,肽键)或肽接头,其选自:[ggsg]ngg、[ggggs]n、[ssssg]n、[ssssg]n、[aapa]n、[gggkgggg]n、[gggngggg]n、[gggcgggg]n,其中n是1至10的整数,适当地1至5,更适当地1至3;gg,ggggg[seqidno:35]、ggggs[seqidno:36]、ssssg[seqidno:37]、gkssgsgsesks[seqidno:38]、gstsgsgksssegsgstkg[seqidno:39]、gstsgsgkpgsgegstkg[seqidno:40]、egkssgsgseskef[seqidno:41]、ggstsgsgkssegkg[seqidno:42]、以及aapa[seqidno:43]。fc二聚化结构域和αtp六聚化结构域的组合促进嵌合多肽自组装成十二聚体。4.嵌合多肽的产生可以通过化学合成或重组方法制备本发明的pd-l2多肽-寡聚化结构域嵌合体。通常,尽管可以使用任何合适的方法,可通过在合适的宿主细胞中表达编码嵌合多肽的重组构建体来制备嵌合多肽。合适的宿主细胞包括,例如,昆虫细胞(例如,埃及伊蚊(aedesaegypti)、苜蓿苜蓿(autographacalifornica)、家蚕(bombyxmori)、黑腹果蝇(drosophilamelanogaster)、草地夜蛾(spodopterafrugiperda)和粉纹夜蛾(trichoplusiani)、哺乳动物细胞(例如,人、非人灵长类动物、马、牛、绵羊、狗、猫和啮齿动物(例如,仓鼠)、禽细胞(例如,鸡、鸭和鹅)、细菌(例如,大肠杆菌(escherichiacoli)、枯草芽孢杆菌(bacillussubtilis)和链球菌属(streptococcusspp.))、酵母细胞(例如,酿酒酵母(saccharomycescerevisiae)、白色念珠菌(candidaalbicans)、麦芽假丝酵母(candidamaltosa)、多型汉逊酵母(hansenulapolymorphs)、脆弱克鲁维酵母(kluyveromycesfragilis)、乳酸克鲁维酵母(kluyveromyceslactis)、毕赤酵母(pichiaguillerimondii)、巴斯德毕赤酵母(pichiapastoris)、粟酒裂殖酵母(schizosaccharomycespombe)和解脂耶氏酵母(yarrowialipolytica))、四膜虫细胞(例如,嗜热四膜虫(tetrahymenathermophile))或其组合。许多合适的昆虫细胞和哺乳动物细胞在本领域中是众所周知的。合适的昆虫细胞包括,例如sf9细胞、sf21细胞、tn5细胞、施耐德s2细胞和highfive细胞(源自亲本粉纹夜蛾bti-tn-5b1-4细胞系的克隆分离物(invitrogen))。合适的哺乳动物细胞包括,例如中国仓鼠卵巢(cho)细胞、人胚肾细胞(hek293细胞,通常转化有剪切的腺病毒5型dna)、nih-3t3细胞、293-t细胞、vero细胞、hela细胞、perc.6细胞(ecacc保藏号96022940)、hepg2细胞、mrc-5(atccccl-171)、wi-38(atccccl-75)、胎儿恒河猴肺细胞(atcccl-160)、madin-darby牛肾(“mdbk”)细胞、madin-darby犬肾(“mdck”)细胞(例如,mdck(nbl2),atccccl34;或mdck33016,dsmacc2219)、幼仓鼠肾(bhk)细胞,如bhk21-f、hkcc细胞等。合适的禽类细胞包括,例如鸡胚胎干细胞(例如,细胞)、鸡胚成纤维细胞、鸡胚胎生殖细胞、鸭细胞(例如age1.cr和age1.cr.pix细胞系(probiogen),它们在例如vaccine27:4975-4982(2009)和wo2005/042728中得以描述)、eb66细胞等。合适的昆虫细胞表达系统(例如杆状病毒系统)是本领域技术人员已知的,并描述于例如summers和smith,texasagriculturalexperimentstationbulletinno.1555(1987)中。用于杆状病毒/插入细胞表达系统的材料和方法可以以试剂盒形式从尤其是invitrogen,sandiegocalif商购获得。禽类细胞表达系统也是本领域技术人员已知的,并且描述于例如美国专利号5,340,740;5,656,479;5,830,510;6,114,168;和6,500,668;欧洲专利号ep0787180b;欧洲专利申请号ep03291813.8;wo03/043415;和wo03/076601。类似地,细菌和哺乳动物细胞表达系统也是本领域已知的,并描述于例如yeastgeneticengineering(barr等人主编1989)伦敦巴特沃斯。可以使用常规方法在合适的载体中制备编码本发明嵌合多肽的重组构建体。用于在昆虫或哺乳动物细胞中表达重组蛋白的一些合适载体是本领域公知和常规的。合适的载体可含有多种组分,包括但不限于以下一种或多种:复制起点;可选择的标记物基因;一种或多种表达控制元件,如转录控制元件(例如,启动子、增强子、终止子)和/或一个或多个翻译信号;和在所选宿主细胞中用于靶向分泌途径的信号序列或先导序列(例如,哺乳动物来源或来自异源哺乳动物或非哺乳动物物种)。例如,为了在昆虫细胞中表达,合适的杆状病毒表达载体,如pfastbac(invitrogen)可用于产生重组杆状病毒颗粒。扩增杆状病毒颗粒并用于感染昆虫细胞以表达重组蛋白。为了在哺乳动物细胞中表达,使用将驱动构建体在所需哺乳动物宿主细胞中表达的载体(例如,中国仓鼠卵巢细胞)。可以使用任何合适的方法纯化嵌合多肽。用于纯化所需蛋白的合适方法是本领域熟知的,包括沉淀和各种类型的色谱,例如疏水相互作用、离子交换、亲和、螯合和尺寸排阻。可以使用这些或其他合适方法中的两种或更多种来产生合适的纯化方案。如果需要,嵌合多肽可包括促进纯化的纯化部分或“标签”,如章节3.5中所述。可以通过螯合色谱或亲和色谱,方便地例如从条件介质中纯化这种带标签的多肽。5.基于嵌合多肽的多肽复合物本发明的嵌合多肽可以在合适的条件下自组装以形成多肽复合物。因此,本发明还包括产生多肽复合物的方法,其中这种方法包括:在适于形成多肽复合物的条件下(例如,在水溶液中)组合本发明的嵌合多肽,由此产生包含三个或更多个嵌合多肽的多肽复合物,其特征在于具有pd-l2的至少一种功能活性,例如本文所述。通常,嵌合多肽在缓冲水溶液中(例如,ph约5至约9)自组装。如果需要,可以使用温和的变性条件,例如通过引入尿素、少量有机溶剂或加热,使嵌合多肽温和地变性,以促进重新折叠和自组装。在这种方法中可以使用任何合适的嵌合多肽制剂。例如,含有所需嵌合多肽的条件细胞培养介质可用于这种方法中。然而,优选在这种方法中使用纯化的嵌合多肽。6.组合物本发明进一步提供组合物,包括药物组合物,其包含上文和本文其他地方广泛描述的多肽复合物或嵌合多肽、或可表达嵌合多肽或复合物的核酸构建体,和任选药学上可接受的载体或佐剂。代表性组合物可包括缓冲液,其根据嵌合多肽或复合物的所需用途进行选择,并且还可包括适合于预期用途的其他物质。当预期用途是调节免疫应答(包括th1免疫应答)时,这种组合物被称为“免疫调节”或“免疫调节性”组合物。这些组合物包括预防组合物(即,为防止th1相关疾病或病症而施用的组合物)和治疗组合物(即,为治疗th1相关疾病或病症而施用的组合物)。因此,本发明的免疫调节组合物可以施用于接受者,以用于预防、改善、缓解或治疗目的。本领域技术人员可以容易地选择适合于预期用途的适当缓冲液,其众多种类在本领域中是众所周知的。在一些情况下,组合物可包含药学上可接受的赋形剂,其中的多种是本领域已知的,并且无需在本文中详细讨论。药学上可接受的赋形剂已在各种出版物中充分描述,包括例如a.gennaro(2000)“remington:thescienceandpracticeofpharmacy”第20版lippincott,williams,&wilkins;pharmaceuticaldosageformsanddrugdeliverysystems(1999)h.c.ansel等人编辑第七版增补,lippincott,williams,&wilkins;以及handbookofpharmaceuticalexcipients(2000)a.h.kibbe等人编辑第三版增补amer.pharmaceuticalassoc。本发明的药物组合物可以是适合于通过注射施用的形式、适于口服摄入的制剂形式(例如,胶囊、片剂、囊、酏剂)、适于局部施用的软膏、霜或乳液的形式、适于滴眼递送的形式、适于通过吸入施用的气溶胶形式(例如通过鼻内吸入或口服吸入)、或适于肠胃外施用的形式(即皮下、肌肉内或静脉内注射)。补充的活性成分如佐剂或生物应答调节剂也可掺入本发明的药物组合物中。尽管佐剂可以包括在本发明的药物组合物中,但组合物不一定需要包含佐剂。在这种情况下,可以避免由于使用佐剂而引起的反应原性问题。通常,在本发明的药物组合物的背景下,佐剂活性包括但不限于(定量或定性)增强组合物中免疫原性组分(例如,本发明的嵌合多肽或复合物)诱导的免疫应答的能力。这可以降低产生免疫应答(包括th1免疫应答)所需的免疫调节组分的剂量或水平,和/或减少产生所需免疫应答所需的免疫次数或频率。任何合适的佐剂可包括在本发明的药物组合物中。例如,可以使用铝基佐剂。合适的铝基佐剂包括但不限于氢氧化铝、磷酸铝及其组合。可以使用的铝基佐剂的其他具体示例描述于欧洲专利号1216053和美国专利号6,372,223中。其它合适的佐剂包括弗氏不完全佐剂和完全佐剂(difcolaboratories,detroit,mich.);merck佐剂65(merckandcompany,inc.,rahway,nj);as-2(smithklinebeecham,宾夕法尼亚州费城);铝盐,如氢氧化铝凝胶(明矾)或磷酸铝;钙、铁或锌的盐;酰化酪氨酸的不溶性悬浮液;酰化糖;阳离子或阴离子衍生的多糖;聚磷腈;可生物降解的微球;单磷酰脂质a和quila;水包油乳剂,包括欧洲专利号0399843、美国专利号7,029,678和pct公开号wo2007/006939中描述的那些;和/或其他细胞因子,例如gm-csf或白细胞介素-2、-7或-12、粒细胞-巨噬细胞集落刺激因子(gm-csf)、肿瘤坏死因子(tnf)单磷酰脂质a(mpl)、霍乱毒素(ct)或其组成亚基、热不稳定肠毒素(lt)或其组成亚基、toll样受体配体佐剂如脂多糖(lps)及其衍生物(例如,单磷酰脂质a和3-脱酰基单磷酰脂质a)、黄病毒ns1和胞壁酰二肽(mdp)。可以在试剂盒中提供本发明的药物组合物。试剂盒可包含有助于实施本发明方法的其他组分,例如施用装置、缓冲液和/或稀释剂。试剂盒可包括用于容纳各种组分的容器和使用本发明方法中试剂盒组分的说明书。通常,试剂盒包括使用本发明的免疫调节组合物的说明书,免疫调节组合物独自使用或与伴随诊断剂一起使用,例如本文所述。本发明的多肽复合物可用于增强对免疫调节剂的免疫应答,包括疾病相关抗原(例如肿瘤抗原和病原性生物的抗原)和抗原结合分子。本发明考虑在本发明的组合物中使用任何抗原,其对应于兴趣靶标抗原的至少一部分,而用于刺激针对靶标抗原的免疫应答。这种抗原可以是可溶形式(例如肽、多肽、或者可以表达肽或多肽的核酸分子)、或者是全细胞或减毒病原体制剂的形式(例如,减毒病毒或细菌)、或者可以通过抗原呈递细胞进行呈递,如下面更详细描述的。6.1抗原可用于本发明的靶标抗原可以是任何类型的生物分子,包括例如简单的中间代谢物、糖、脂质和激素以及大分子,例如复合碳水化合物、磷脂、核酸、多肽和肽。靶标抗原可选自宿主产生的内源性抗原或宿主外源的外源性抗原。合适的内源性抗原包括但不限于癌症或肿瘤抗原。癌症或肿瘤抗原的非限制性示例包括来自选自以下癌症或肿瘤的抗原:abl1原癌基因、aids相关癌症、听神经瘤、急性淋巴细胞白血病、急性髓性白血病、腺样囊性癌、肾上腺皮质癌、特发性骨髓化生、秃头症、肺泡软部分肉瘤、肛门癌、血管肉瘤、再生障碍性贫血、星形细胞瘤、共济失调-毛细血管扩张症、(皮肤)基底细胞癌、膀胱癌、骨癌、肠癌、脑干胶质瘤、脑和中枢神经系统肿瘤、乳癌、中枢神经系统肿瘤、良性肿瘤、宫颈癌、儿童脑肿瘤、儿童癌症、儿童白血病、儿童软组织肉瘤、软骨肉瘤、绒毛膜癌、慢性淋巴细胞白血病、慢性髓性白血病、结肠直肠癌、皮肤t细胞淋巴瘤、皮肤纤维肉瘤-突起、增生性小-圆形-细胞肿瘤、导管癌、内分泌癌、子宫内膜癌、室管膜瘤、食管癌、ewing氏肉瘤、肝外胆管癌、眼癌、眼:黑色素瘤、视网膜母细胞瘤、输卵管癌、范可尼贫血、纤维肉瘤、胆囊癌、胃癌、胃肠道癌、胃肠道良性肿瘤、泌尿生殖系统肿瘤、生殖细胞肿瘤、妊娠滋养细胞疾病、胶质瘤、妇科癌症、血液系统恶性肿瘤、毛细胞白血病、头颈癌、肝细胞癌、遗传性乳癌、组织细胞增多症、霍奇金病、人乳头瘤病毒、葡萄胎、高钙血症、下咽癌、眼内黑色素瘤、胰岛细胞癌、卡波西氏肉瘤、肾癌、朗格汉斯细胞组织细胞增生症、喉癌、平滑肌肉瘤、白血病、李-弗劳梅尼综合征、唇癌、脂肪肉瘤、肝癌、肺癌、淋巴水肿、淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、男性乳癌、恶性横纹肌样肾肿瘤、髓质肺母细胞瘤、黑色素瘤、merkel细胞癌、间皮瘤、转移性癌、口癌、多发性内分泌肿瘤、蕈样真菌病、骨髓增生异常综合征、骨髓瘤、骨髓增生性疾病、鼻癌、鼻咽癌、肾母细胞瘤、神经母细胞瘤、神经纤维瘤病、奈梅亨断裂综合征、非黑色素瘤皮肤癌、非小细胞肺癌(nsclc)、眼癌、食道癌、口腔癌、口咽癌、骨肉瘤、造瘘术卵巢癌、胰腺癌、鼻窦癌、甲状旁腺癌、腮腺癌、阴茎癌、外周神经外胚层肿瘤、垂体癌、真性红细胞增多症、前列腺癌、罕见癌症和相关疾病、肾细胞癌、视网膜母细胞瘤、横纹肌肉瘤、rothmund-thomson综合征、唾液腺癌、肉瘤、神经鞘瘤、sezary综合征、皮肤癌、小细胞肺癌(sclc)、小肠癌、软组织肉瘤、脊髓肿瘤、(皮肤)鳞状细胞癌、胃癌、滑膜肉瘤、睾丸癌、胸腺癌、甲状腺癌、(膀胱)移行细胞癌、(肾-骨盆-/-输尿管)移行细胞癌、滋养细胞癌、尿道癌、泌尿系统癌症、尿路斑块(uroplakins)、子宫肉瘤、子宫癌、阴道癌、外阴癌、华氏巨球蛋白血症、维尔姆斯瘤。在某些实施方案中,癌症或肿瘤涉及黑色素瘤。黑色素瘤相关抗原的说明性示例包括黑素细胞分化抗原(例如,gp100、mart、melan-a/mart-1、trp-1、tyros、trp2、mc1r、muc1f、muc1r或其组合)和黑色素瘤特异性抗原(例如,bage、gage-1、gp100in4、mage-1(例如,genbank登录号x54156和aa494311)、mage-3、mage4、prame、trp2in2、nynso1a、nynso1b、lage1、p97黑色素瘤抗原(例如,genbank登录号m12154)、p5蛋白、gp75、瘤胎抗原、gm2和gd2神经节苷脂、cdc27、p21ras、gp100pmel117或其组合。其他肿瘤特异性抗原包括但不限于:etv6、aml1、亲环蛋白b(急性淋巴细胞白血病);ig-独特型(b细胞淋巴瘤);e-钙粘蛋白、α-连环蛋白、β-连环蛋白、γ-连环蛋白、p120ctn(神经胶质瘤);p21ras(膀胱癌);p21ras(胆管癌);muc家族、her2/neu、c-erbb-2(乳癌);p53、p21ras(宫颈癌);p21ras、her2/neu、c-erbb-2、muc家族、cripto-1蛋白、pim-1蛋白(结肠癌);结肠直肠相关抗原(crc)-co17-1a/ga733、apc(结肠直肠癌);癌胚抗原(cea)(结肠直肠癌;绒毛膜癌);亲环蛋白b(上皮细胞癌);her2/neu、c-erbb-2、ga733糖蛋白(胃癌);α-胎蛋白(肝细胞癌);imp-1、ebna-1(霍奇金淋巴瘤);cea、mage-3、ny-eso-1(肺癌);亲环蛋白b(淋巴细胞衍生白血病);muc家族、p21ras(骨髓瘤);her2/neu、c-erbb-2(非小细胞肺癌);imp-1、ebna-1(鼻咽癌);muc家族、her2/neu、c-erbb-2、mage-a4、ny-eso-1(卵巢癌);前列腺特异性抗原(psa)及其抗原表位psa-1、psa-2和psa-3、psma、her2/neu、c-erbb-2、ga733糖蛋白(前列腺癌);her2/neu、c-erbb-2(肾癌);病毒产物如人乳头瘤病毒蛋白(子宫颈和食道鳞状细胞癌);ny-eso-1(睾丸癌);以及htlv-1表位(t细胞白血病)。适当地,外源抗原选自病原性生物。示例性病原性生物包括但不限于病毒、细菌、真菌、寄生物、藻以及原生动物和变形虫。病毒的说明性示例包括负责某些疾病的病毒,这些疾病包括但不限于:麻疹、腮腺炎、风疹、脊髓灰质炎、甲型肝炎、乙型肝炎(如genbank登录号e02707)和丙型肝炎(如genbank登录号e06890)、以及其他肝炎病毒、流感、腺病毒(如4和7型)、狂犬病(如genbank登录号m34678)、黄热病毒、eb病毒和其他疱疹病毒如乳头瘤病毒、艾波拉病毒、流感病毒、日本脑炎(如genbank登录号e07883)、登革热(如genbank登录号m24444)、汉他病毒、仙台病毒、呼吸道合胞病毒、正粘病毒(othromyxoviruses)、水泡性口炎病毒、绵羊髓鞘脱落病毒、巨细胞病毒和人免疫缺陷病毒(hiv)(如genbank登录号u18552)。衍生自这些病毒的任何合适抗原均可用于实施本发明。例如,衍生自hiv的说明性逆转录病毒抗原包括但不限于:抗原如gag、pol和env基因的基因产物、nef蛋白、逆转录酶和其他hiv成分。肝炎病毒抗原的说明性示例包括但不限于:抗原如乙型肝炎病毒的s、m和l蛋白、乙型肝炎病毒的前s抗原,以及其他肝炎(如甲、乙和丙型肝炎)病毒成分(如丙型肝炎病毒rna)。流感病毒抗原的说明性示例包括但不限于:抗原如血凝素和神经氨酸酶和其他流感病毒成分。麻疹病毒抗原的说明性示例包括但不限于:抗原如麻疹病毒融合蛋白和其他麻疹病毒成分。风疹病毒抗原的说明性示例包括但不限于:抗原如蛋白e1和e2以及其他风疹病毒成分;轮状病毒抗原如vp7sc和其他轮状病毒成分。巨细胞病毒抗原的说明性示例包括但不限于:抗原如包膜糖蛋白b和其他巨细胞病毒抗原成分。呼吸道合胞病毒抗原的说明性示例包括抗原如rsv融合蛋白、m2蛋白和其他呼吸道合胞病毒抗原成分。单纯疱疹病毒抗原的说明性示例包括但不限于:抗原如立即早期蛋白、糖蛋白d和其他单纯疱疹病毒抗原成分。水痘带状疱疹病毒抗原的非限制性示例包括抗原如9pi、gpii和其他水痘带状疱疹病毒抗原成分。日本脑炎病毒抗原的非限制性示例包括抗原如蛋白e、m-e、m-e-ns1、ns1、ns1-ns2a、80%e和其他日本脑炎病毒抗原成分。狂犬病病毒抗原的代表性示例包括但不限于:抗原如狂犬病糖蛋白、狂犬病核蛋白和其他狂犬病病毒抗原成分。乳头瘤病毒抗原的说明性示例包括但不限于:l1和l2衣壳蛋白以及与宫颈癌有关的e6/e7抗原,其他病毒抗原的示例请参见fundamentalvirology第二版fields,b.n.和knipe,d.m.编,1991,ravenpress,纽约。真菌的说明性示例包括枝顶孢属(acremoniumspp.)、曲霉属(aspergillusspp.)、蛙粪霉菌(basidiobolusspp.)、双极霉属(bipolarisspp.)、皮炎芽生菌(blastomycesdermatidis)、念珠菌属(candidaspp.)、卡氏支孢瓶霉(cladophialophoracarrionii)、粗球孢子菌(coccidioidesimmitis)、耳霉属(conidiobolusspp.)、隐球菌属(cryptococcusspp.)、弯孢菌属(curvulariaspp.)、表皮癣菌属(epidermophytonspp.)、甄氏外瓶霉(exophialajeanselmei)、突脐蠕孢菌属(exserohilumspp.)、紧密着色真菌(fonsecaeacompacta)、裴氏着色真菌(fonsecaeapedrosoi)、尖孢镰刀菌(fusariumoxysporum)、腐皮镰刀茵(fusariumsolani)、白地霉(geotrichumcandidum)、荚膜组织胞浆菌荚膜变种(histoplasmacapsulatumvar.capsulatum)、荚膜组织胞浆菌杜氏变种(histoplasmacapsulatumvar.duboisii)、hortaeawerneckii、lacazialoboi、座腔双胞菌(lasiodiplodiatheobromae)、塞内加尔钓端球体(leptosphaeriasenegalensis)、灰色马杜拉分支菌(madurellagrisea)、足马杜拉分枝菌(madurellamycetomatis)、糠秕马拉色菌(malasseziafurfur)、小芽胞菌属(microsporumspp.)、罗萨梯新龟甲形菌(neotestudinarosatii)、onychocolacanadensis、巴西酿母菌(paracoccidioidesbrasiliensis)、疣状瓶霉(phialophoraverrucosa)、何德毛结节菌(piedraiahortae)、piedraiahortae、花斑癣(pityriasisversicolor)、pseudallesheriaboydii、罗梅罗刺壳孢菌(pyrenochaetaromeroi)、少根根霉(rhizopusarrhizus)、小帚样霉菌(scopulariopsisbrevicaulis)、双间柱顶孢(scytalidiumdimidiatum)、申克孢子丝菌(sporothrixschenckii)、毛癣菌属(trichophytonspp.)、毛孢子菌属(trichosporonspp.)、接合菌(zygomcetefungi)、伞枝犁头霉(absidiacorymbifera)、微小根毛霉(rhizomucorpusillus)和少根根霉(rhizopusarrhizus)。因此,可用于本发明组合物和方法的说明性真菌抗原包括但不限于:念珠菌属真菌抗原成分;组织浆菌属真菌抗原如热休克蛋白60(hsp60)和其他组织浆菌属真菌抗原成分;隐球菌属真菌抗原如荚膜多糖和其他隐球菌属真菌抗原成分;球孢子菌属真菌抗原如小球体抗原和其他球孢子菌属真菌抗原成分;以及癣真菌抗原如发癣菌素和其他球孢子菌属真菌抗原成分。细菌的说明性示例包括负责疾病的细菌,包括但不限于:白喉(如白喉棒杆菌(corynebacteriumdiphtheriae))、百日咳(如百日咳博德特菌(bordetellapertussis),genbank登录号m35274)、破伤风(如破伤风梭菌(clostridiumtetani),genbank登录号m64353)、结核病(如结核杆菌(mycobacteriumtuberculosis))、细菌性肺炎(如流感嗜血杆菌(haemophilusinfluenzae))、霍乱(如霍乱弧菌(vibriocholerae))、炭疽(如炭疽杆菌(bacillusanthracis))、伤寒、鼠疫、志贺菌病(如痢疾志贺菌(shigelladysenteriae))、肉毒中毒(如肉毒梭菌(clostridiumbotulinum))、沙门菌病(如genbank登录号l03833)、消化性溃疡(如幽门螺杆菌(helicobacterpylori))、军团病、莱姆病(如genbank登录号u59487);其他病原菌包括大肠杆菌(escherichiacoli)、产气荚膜梭菌(clostridiumperfringens)、铜绿假单胞菌(pseudomonasaeruginosa)、金黄色葡萄球菌(staphylococcusaureus)和化脓链球菌(streptococcuspyogenes)。因此,可用于本发明组合物和方法的细菌抗原包括但不限于:百日咳细菌抗原如百日咳毒素、丝状血凝素、百日咳杆菌粘附素(pertactin)、fm2、fim3、腺苷酸环化酶和其他百日咳细菌抗原成分;白喉细菌抗原如白喉毒素或类毒素和其他白喉细菌抗原成分;破伤风细菌抗原如破伤风毒素或类毒素和其他破伤风细菌抗原成分,链球菌细菌抗原如m蛋白和其他链球菌细菌抗原成分;革兰阴性杆菌细菌抗原如脂多糖和其他革兰阴性细菌抗原成分;结核杆菌(mycobacteriumtuberculosis)细菌抗原如分枝菌酸、热休克蛋白65(hsp65)、30kda主要分泌蛋白、抗原85a和其他分枝杆菌抗原成分;幽门螺杆菌(helicobacterpylori)细菌抗原成分,肺炎球菌细菌抗原如肺炎链球菌溶血素、肺炎球菌荚膜多糖和其他肺炎球菌细菌抗原成分;流感嗜血杆菌(haemophilusinfluenz)细菌抗原如荚膜多糖和其他流感嗜血杆菌细菌抗原成分;炭疽细菌抗原如炭疽保护抗原和其他炭疽细菌抗原成分;立克次体细菌抗原如rompa和其他立克次体细菌抗原成分。本文所述细菌抗原也包括任何其他细菌、分枝杆菌、支原体、立克次体或衣原体抗原。原生动物的说明性示例包括负责疾病的原生动物,包括但不限于:疟原虫(如genbank登录号x53832)、钩虫、盘尾丝虫(如genbank登录号m27807)、血吸虫(如genbank登录号los198)、弓形体、锥虫、利什曼原虫、贾第鞭毛虫(genbank登录号m33641)、阿米巴、丝虫(如genbank登录号j03266)、疏螺旋体(borreliosis)和旋毛虫。因此,可用于本发明组合物和方法的原生动物抗原包括但不限于:恶性疟原虫(plasmodiumfalciparum)抗原如裂殖子表面抗原、子孢子表面抗原、环孢子体抗原、配子母细胞/配子表面抗原、血液期抗原pf155/resa和其他疟原虫抗原成分;弓形体抗原如sag-1、p30和其他弓形体抗原成分;血吸虫抗原如谷胱甘肽-s-转移酶、副肌球蛋白和其他血吸虫抗原成分;硕大利什曼原虫和其他利什曼原虫抗原如gp63、脂磷酸聚糖及其相关蛋白和其他利什曼原虫抗原成分;以及克氏锥虫(trypanosomacruzi)抗原如75-77kda抗原、56kda抗原和其他锥虫抗原成分。本发明也考虑将毒素成分用作抗原。毒素的说明性示例包括但不限于葡萄球菌肠毒素、中毒性休克综合征毒素;逆转录病毒抗原(如衍生自hiv的抗原)、链球菌抗原、葡萄球菌肠毒素-a(sea)、葡萄球菌肠毒素-b(seb)、葡萄球菌肠毒素1-3(se1-3)、葡萄球菌肠毒素-d(sed)、葡萄球菌肠毒素-e(see)以及衍生自支原体、分支杆菌和疱疹病毒的毒素。对应于至少一部分靶标抗原的抗原可从天然来源分离,或可用本领域已知的重组技术制备。例如,可由需要调节免疫应答的细胞群或组织获得的抗原呈递细胞的mhc和其他呈递分子洗脱肽抗原。可采用本领域已知的标准蛋白纯化技术纯化洗脱的肽(rawson等,2000,cancerres60(16),4493-4498)。如果需要,可对纯化的肽进行测序,并用如下所述的标准蛋白合成技术生产合成版本的肽。或者,可通过分离需要调节免疫应答的细胞群或组织的样品,接着裂解该样品或使该样品处于导致形成凋亡细胞的条件下(如紫外线或γ射线辐射、病毒感染、细胞因子或通过耗尽细胞培养介质中的细胞营养、与过氧化氢孵育、或者与药物如地塞米松、神经酰胺化疗药和抗-激素药如醋酸亮丙瑞林(lurpon)或他莫昔芬进行孵育),来产生粗抗原制剂。接着,裂解物或凋亡细胞可用作粗抗原的来源,以可溶形式使用或与抗原呈递细胞接触,下面作进一步详述。在示例性实施方案中,本发明的多肽复合物或嵌合多肽或可表达嵌合多肽的核酸构建体(“免疫调节剂”)用于治疗癌症。在这些实施方案的一些中,免疫调节剂可以与抑制肿瘤细胞增殖、存活或活力的至少一种癌症疗法同时施用。免疫调节剂可以在癌症疗法后用于治疗、或者可以在施用疗法之前或与疗法一起使用。因此,本发明考虑了组合疗法,其采用本发明的免疫调节剂和同时施用癌症疗法,其非限制性示例包括放射疗法、外科手术、化学疗法、激素消融疗法、促凋亡疗法和免疫疗法。6.2放射疗法放射疗法包括诱导dna损伤的辐射和波,例如,γ-辐照、x-射线、uv辐照、微波、电子发射、放射性同位素等。疗法可以通过用以上描述的辐射形式辐照局部肿瘤部位来实现。最有可能的是,所有这些因素对dna、dna的前体、dna的复制和修复以及染色体的组装和维持产生广泛范围的损伤。x-射线的剂量范围为范围从50-200伦琴的每天剂量持续延长的时间段(3-4周),至2000-6000伦琴的单次剂量。放射性同位素的剂量范围变化很宽,并且取决于同位素的半衰期、发射的辐射的强度和类型,以及赘生性细胞的摄取。放射疗法的非限制性示例包括单次击发或分次击发的适形外部束放射疗法(50-100格雷在4-8周内分次(fractions)提供)、高剂量率近距离放射疗法、永久性间质近距离放射疗法、全身放射性同位素(例如,锶89)。在一些实施方案中,放射疗法可以与放射增敏剂组合施用。放射增敏剂的说明性示例包括但不限于乙丙昔罗(efaproxiral)、依他硝唑(etanidazole)、氟路索(fluosol)、米索硝唑(misonidazole)、尼莫拉唑(nimorazole)、替莫泊芬(temoporfin)和替拉扎明(tirapazamine)。6.3化学疗法化学治疗剂可以选自以下类别的任何一种或更多种:(i)抗增殖药/抗肿瘤药及其组合,如医学肿瘤学中使用的,例如烷化剂(例如顺铂、卡铂、环磷酰胺、氮芥、美法仑(melphalan)、苯丁酸氮芥(chlorambucil)、白消安(busulphan)和亚硝基脲类)、抗代谢物(例如抗叶酸剂例如氟嘧啶类(fluoropyridines),如5-氟尿嘧啶和替加氟(tegafur)、雷替曲塞(raltitrexed)、氨甲蝶呤(methotrexate)、阿糖胞苷和羟基脲);抗肿瘤抗生素(例如蒽环霉素,如阿霉素、博来霉素、多柔比星(doxorubicin)、道诺霉素、表柔比星(epirubicin)、伊达比星(idarubicin)、丝裂霉素-c、更生霉素(dactinomycin)和光辉霉素(mithramycin));抗有丝分裂剂(例如长春花生物碱,如长春花新碱(vincristine)、长春花碱(vinblastine)、长春地辛(vindesine)和长春瑞滨(vinorelbine)和紫衫烷如紫杉醇和多西他赛)以及拓扑异构酶抑制剂(例如表鬼臼毒素如依托泊苷和替尼泊苷、安吖啶(amsacrine)、拓扑替康和喜树碱);(ii)细胞生长抑制剂例如抗雌激素(例如他莫昔芬(tamoxifen)、托瑞米芬(toremifene)、雷洛昔芬(raloxifene)、屈洛昔芬(droloxifene)和艾多昔芬(iodoxyfene))、雌激素受体下调物(例如氟维司群(fulvestrant))、抗雄激素(例如比卡鲁胺(bicalutamide)、氟他胺(flutamide)、尼鲁米特(nilutamide)和乙酸环丙孕酮)、uh拮抗剂或lhrh激动剂(例如戈舍瑞林(goserelin)、亮丙瑞林(leuprorelin)和布舍瑞林(buserelin))、孕激素(例如醋酸甲地孕酮)、芳香酶抑制剂(例如如阿那曲唑(anastrozole)、来曲唑(letrozole)、伏氯唑(vorozole)和依西美坦(exemestane))以及5α-还原酶抑制剂例如非那雄胺;(iii)抑制癌细胞侵袭的试剂(例如金属蛋白酶抑制剂如马立马司他(marimastat)和尿激酶型纤溶酶原活化物受体功能的抑制剂);(iv)生长因子功能抑制剂,例如此类抑制剂包括生长因子抗体、生长因子受体抗体(例如抗-erbb2抗体曲妥珠单抗[herceptintm]和抗-erbb1抗体西妥昔单抗[c225])、法呢基转移酶抑制剂、mek抑制剂、酪氨酸激酶抑制剂和丝氨酸/苏氨酸激酶抑制剂,例如表皮生长因子家族的其他抑制剂(例如其他egfr家族酪氨酸激酶抑制剂例如n-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉代丙氧基)喹唑啉-4-胺(吉非替尼(gefitinib),azd1839)、n-(3-乙炔基苯基)-6,7-双(2-甲氧基乙氧基)喹唑啉-4-胺(厄洛替尼(erlotinib),osi-774)和6-丙烯酰胺基-n-(3-氯-4-氟苯基)-7-(3-吗啉代丙氧基)喹唑啉-4-胺(ci1033)),例如血小板来源的生长因子家族的抑制剂和例如肝细胞生长因子家族的抑制剂;(v)抗血管生成剂,例如抑制血管内皮生长因子作用的那些(例如,抗血管内皮细胞生长因子抗体贝伐单抗[avastintm],化合物例如在国际专利申请wo97/22596、wo97/30035、wo97/32856和wo98/13354中公开的那些化合物)和通过其他机制发挥作用的化合物(例如,利诺安(linomide)、整联蛋白αvβ3功能的抑制剂、和血管抑素);(vi)血管损伤剂,例如考布他汀a4和在国际专利申请wo99/02166、wo00/40529、wo00/41669、wo01/92224、wo02/04434和wo02/08213中公开的化合物;(vii)反义疗法,例如针对以上列出的靶标的那些,例如isis2503,一种抗-ras反义物;以及(viii)基因治疗方法,包括例如替代异常基因例如异常p53或异常gdept(基因导向的酶前药治疗)方法的方法,例如使用胞嘧啶脱氨酶、胸苷激酶或细菌硝基还原酶的那些,以及增加患者对化学疗法或放射疗法的耐受性的方法,例如多-药物耐受性基因疗法。6.4免疫疗法免疫疗法的方法包括,例如提高患者肿瘤细胞的免疫原性的离体和体内方法,如用细胞因子(例如白细胞介素2、白细胞介素4或粒细胞-巨噬细胞集落刺激因子)进行转染;降低t细胞无反应性的方法;用转染的免疫细胞(如细胞因子转染的树突细胞)的方法;用细胞因子转染的肿瘤细胞系的方法;以及用抗独特型抗体的方法。这些方法通常依赖于使用免疫效应物细胞和分子来靶向和破坏癌细胞。免疫效应物可以是例如抗原结合分子(如对肿瘤细胞表面上的标记物具有特异性的抗体)。单独的抗原结合分子可以用作疗法的效应物,或者其可以募集其他细胞以事实上促进细胞杀伤。抗原结合分子还可以与药物或毒素(化学治疗剂、放射性核素、蓖麻毒蛋白a链、霍乱毒素、百日咳毒素等)缀合,并且仅用作靶向剂。可选地,免疫效应物可以是淋巴细胞,其携带与恶性细胞靶标直接或间接相互作用的表面分子。各种免疫效应物细胞包括细胞毒性t细胞和nk细胞。在这些实施方案的一些中,适当地抗原结合分子靶向的细胞表面抗原是肿瘤相关抗原,其说明性示例包括her2/neu、egfr、epcam、vegfr、fgfr、muc-1、ca125、cea、mage、cd20、cd19、cd40、cd33、a3、a33抗体的特异性抗原、bre3抗原、cd1、cd1a、cd5、cd8、cd14、cd15、cd16、cd21、cd22、cd23、cd30、cd33、cd37、cd38、cd40、cd45、cd46、cd52、cd54、cd74、cd79a、cd126、cd138、cd154、b7、ia、ii、hm1.24、hla-dr(例如,hla-dr10)、nca95、nca90、hcg和亚单位、cea(ceacam5)、ceacam-6、csap、egp-1、egp-2、ba733、kc4抗原、ks-1抗原、ks1-4、le-y、muc2、muc3、muc4、plgf、ed-b纤连蛋白、nca66a-d、pam-4抗原、psa、psma、rs5、s100、tag-72、t101、tagtrail-r1、trail-r2、p53、肌腱蛋白、胰岛素生长因子-1(igf-i)、tn抗原等。6.5其他疗法其他癌症疗法的示例包括光疗法、冷冻疗法、毒素疗法或促凋亡疗法。本领域的技术人员将知道,该列表并非可用于癌症和其他增生性损伤的治疗方式类型的穷举。众所周知,化疗和辐射疗法快速靶向分裂细胞和/或破坏细胞周期或细胞分裂。这些治疗作为治疗几种形式的癌症的一部分被提供,旨在通过治愈性治疗来减缓其进展或逆转疾病的症状。然而,这些癌症治疗可能导致免疫受损状态和随后的病原性感染,并且因此本发明也延伸至组合疗法,所述组合疗法采用多肽复合物、癌症疗法和抗感染剂两者,所述抗感染剂有效对抗由于癌症疗法引起的免疫受损状况而导致的感染或由于癌症疗法引起的免疫受损状况而增加风险的感染。适当地,抗感染药物选自抗微生物剂,所述抗微生物剂包括但不限于杀伤或抑制微生物(例如病毒、细菌、酵母、真菌、原生动物等)生长的化合物,并且因此包括抗生素、抗阿米巴药、抗真菌剂、抗原虫药、抗疟药、抗结核药和抗病毒药。抗感染药物在其范围内也包括驱肠虫药(anthelmintics)和杀线虫剂。说明性抗生素包括喹诺酮(quinolones)(例如,氨氟沙星(amifloxacin)、西诺沙星(cinoxacin)、环丙沙星(ciprofloxacin)、依诺沙星(enoxacin)、氟罗沙星(fleroxacin)、氟甲喹(flumequine)、洛美沙星(lomefloxacin)、萘啶酸(nalidixicacid)、诺氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、左氧氟沙星(levofloxacin)、洛美沙星、恶喹酸(oxolinicacid)、培氟沙星(pefloxacin)、罗索沙星(rosoxacin)、替马沙星(temafloxacin)、托氟沙星(tosufloxacin)、司帕沙星(sparfloxacin)、克林沙星(clinafloxacin)、加替沙星(gatifloxacin)、莫西沙星(moxifloxacin);吉米沙星(gemifloxacin);和加雷沙星(garenoxacin))、四环素(tetracyclines)、甘氨环素(glycylcyclines)和噁唑烷酮(oxazolidinones)(例如,金霉素(chlortetracycline)、地美环素(demeclocycline)、多西环素(doxycycline)、赖甲环素(lymecycline)、美他环素(methacycline)、米诺环素(minocycline)、氧四环素(oxytetracycline)、四环素(tetracycline)、替加环素(tigecycline);利奈唑胺(linezolide)、依哌唑胺(eperezolid))、糖肽(glycopeptides)、氨基糖苷(aminoglycosides)(例如,阿米卡星(amikacin)、阿贝卡星(arbekacin)、丁苷菌素(butirosin)、地贝卡星(dibekacin)、福提霉素(fortimicins)、庆大霉素(gentamicin)、卡那霉素(kanamycin)、新霉素、奈替米星(netilmicin)、核糖霉素(ribostamycin)、西索米星(sisomicin)、壮观霉素(spectinomycin)、链霉素(streptomycin)、妥布霉素(tobramycin))、β-内酰胺(例如,亚胺培南(imipenem)、美罗培南(meropenem)、比阿培南(biapenem)、头孢克洛(cefaclor)、头孢羟氨苄(cefadroxil)、头孢羟唑(cefamandole)、头孢曲秦(cefatrizine)、头孢西酮(cefazedone)、头孢唑啉(cefazolin)、头孢克肟(cefixime)、头孢甲肟(cefmenoxime)、头孢地秦(cefodizime)、头孢尼西(cefonicid)、头孢哌酮(cefoperazone)、头孢雷特(ceforanide)、头孢噻肟(cefotaxime)、头孢替安(cefotiam)、头孢咪唑(cefpimizole)、头孢匹胺(cefpiramide)、头孢泊肟(cefpodoxime)、头孢磺啶(cefsulodin)、头孢他啶(ceftazidime)、头孢特仑(cefteram)、头孢替唑(ceftezole)、头孢布烯(ceftibuten)、头孢唑肟(ceftizoxime)、头孢曲松(ceftriaxone)、头孢呋辛(cefuroxime)、头孢唑南(cefuzonam)、cephaacetrile、头孢氨苄(cephalexin)、头孢来星(cephaloglycin)、头孢噻啶(cephaloridine)、头孢噻吩(cephalothin)、头孢匹林(cephapirin)、头孢拉定(cephradine)、头孢美唑(cefinetazole)、头孢西丁(cefoxitin)、头孢替坦(cefotetan)、氨曲南(azthreonam)、卡芦莫南(carumonam)、氟氧头孢(flomoxef)、拉氧头孢(moxalactam)、美西林(amidinocillin)、阿莫西林(amoxicillin)、氨苄青霉素(ampicillin)、阿洛西林(azlocillin)、羧苄青霉素(carbenicillin)、苄青霉素(benzylpenicillin)、卡非西林(carfecillin)、氯唑西林(cloxacillin)、双氯西林(dicloxacillin)、甲氧西林(methicillin)、美洛西林(mezlocillin)、萘夫西林(nafcillin)、苯唑西林(oxacillin)、青霉素g(penicilling)、哌拉西林(piperacillin)、磺苄西林(sulbenicillin)、替莫西林(temocillin)、替卡西林(ticarcillin)、头孢托仑(cefditoren)、sc004、ky-020、头孢地尼(cefdinir)、头孢布烯(ceftibuten)、fk-312、s-1090、cp-0467、bk-218、fk-037、dq-2556、fk-518、头孢唑兰(cefozopran)、me1228、kp-736、cp-6232、ro09-1227、opc-20000、ly206763)、利福霉素(rifamycins)、大环内酯(macrolides)(例如阿奇霉素(azithromycin)、克拉霉素(clarithromycin)、红霉素(erythromycin)、竹桃霉素(oleandomycin)、罗他霉素(rokitamycin)、罗沙米星(rosaramicin)、罗红霉素(roxithromycin)、醋竹桃霉素(troleandomycin))、酮内酯抗生素(ketolides)(例如泰利霉素(telithromycin)、喹红霉素(cethromycin))、香豆霉素(coumermycins)、林可酰胺抗生素(lincosamides)(例如,克林霉素(clindamycin)、林可霉素(lincomycin)和氯霉素(chloramphenicol))。说明性抗病毒药包括硫酸阿巴卡韦(abacavirsulfate)、阿昔洛韦钠(acyclovirsodium)、盐酸金刚烷胺(amantadinehydrochloride)、安普那韦(amprenavir)、西多福韦(cidofovir)、甲磺酸地拉韦啶(delavirdinemesylate)、地达诺新(didanosine)、依非韦伦(efavirenz)、泛昔洛韦(famciclovir)、福米韦生钠(fomivirsensodium)、膦甲酸钠(foscarnetsodium)、更昔洛韦(ganciclovir)、硫酸茚地那韦(indinavirsulfate)、拉米夫定(lamivudine)、拉米夫定/齐多夫定(zidovudine)、甲磺酸奈非那韦(nelfinavirmesylate)、奈韦拉平(nevirapine)、磷酸奥司他韦(oseltamivirphosphate)、利巴韦林(ribavirin)、盐酸金刚乙胺(rimantadinehydrochloride)、利托那韦(ritonavir)、沙奎那韦(saquinavir)、甲磺酸沙奎那韦(saquinavirmesylate)、司他夫定(stavudine)、盐酸万乃洛韦(valacyclovirhydrochloride)、扎西他滨(zalcitabine)、扎那米韦(zanamivir)、和齐多夫定。抗阿米巴药或抗原虫药的非限制性示例包括阿托伐醌(atovaquone)、盐酸氯喹(chloroquinehydrochloride)、磷酸氯喹(chloroquinephosphate)、甲硝唑(metronidazole)、盐酸甲硝唑(metronidazolehydrochloride)、和喷他脒羟乙磺酸盐(pentamidineisethionate)。驱肠虫药可以是选自以下的至少一种:甲苯达唑(mebendazole)、双羟萘酸噻嘧啶(pyrantelpamoate)、阿苯达唑(albendazole)、伊维菌素(ivermectin)和噻苯达唑(thiabendazole)。说明性抗真菌剂可以选自两性霉素b(amphotericinb)、两性霉素b胆固醇硫酸酯复合物(amphotericinbcholesterylsulfatecomplex)、两性霉素b脂质复合物(amphotericinblipidcomplex)、两性霉素b脂质体(amphotericinbliposomal)、氟康唑(fluconazole)、氟胞嘧啶(flucytosine)、灰黄霉素微粒(griseofulvinmicrosize)、超微粉化灰黄霉素(griseofulvinultramicrosize)、伊曲康唑(itraconazole)、酮康唑(ketoconazole)、制霉菌素(nystatin)、和盐酸特比萘芬(terbinafinehydrochloride)。抗疟药的非限制性示例包括盐酸氯喹(chloroquinehydrochloride)、磷酸氯喹(chloroquinephosphate)、多西环素、硫酸羟基氯喹(hydroxychloroquinesulfate)、盐酸甲氟喹(mefloquinehydrochloride)、磷酸伯氨喹(primaquinephosphate)、乙胺嘧啶(pyrimethamine)、和乙胺嘧啶-磺胺多辛(pyrimethaminewithsulfadoxine)。抗结核药物包括但不限于氯法齐明(clofazimine)、环丝氨酸(cycloserine)、氨苯砜(dapsone)、盐酸乙胺丁醇(ethambutolhydrochloride)、异烟肼(isoniazid)、吡嗪酰胺(pyrazinamide)、利福布丁(rifabutin)、利福平(rifampin)、利福喷丁(rifapentine)、和硫酸链霉素(streptomycinsulfate)。在th1相关疾病是病原性感染的其他实施方案中,本发明的多肽复合物与抗感染剂同时施用,例如上文所述。如以上指出的,本发明涵盖本发明的免疫调节剂与额外的或辅助性的药剂一起共施用。将理解,在包括施用免疫调节剂与其他一种或多种药剂的实施方案中,组合中活性物质的剂量可以自身包含有效量,并且额外的药剂可以进一步增加对患者的治疗或预防益处。可选地,免疫调节剂和另外的药剂可以一起包含用于预防或治疗th1相关疾病或病症的有效量。还将理解,可以在特定治疗方案的背景下定义有效量,特定治疗方案包括,例如施用的时间和次数、施用方式、制剂等。在一些实施方案中,免疫调节剂和任选地癌症疗法按常规时间表施用。可选地,可以在症状出现时施用癌症疗法。如本文使用的“常规时间表”指预定的指定时间段。只要时间表是预定的,常规时间表可以涵盖相同或不同长度的时间段。例如,常规时间表可以包括每天、每两天、每三天、每四天、每五天、每六天、每周、每月或期间的任何设定天数或者周数、每两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月等施用多肽复合物。可选地,预定的常规时间表可以包括第一周每天同时施用多肽复合物和癌症疗法,随后持续数月进行每月施用,然后在此之后每三个月施用。只要事先确定适当的时间表包括在具体某天的施用,则常规时间表涵盖任何特定的组合。6.6剂量和施用途径以“有效量”施用组合物,即在受试者中有效实现预期目的的量。施用于患者的活性化合物的剂量应足以在受试者中随时间实现有益反应,例如减少与th1相关的疾病或病症相关的至少一种症状。待施用的药物活性化合物的量或剂量频率可取决于待治疗的受试者,包括其年龄、性别、体重和一般健康状况。在这方面,用于施用的活性化合物的精确量将取决于操作者的判断。通过常规实验,本领域技术人员能够确定本文所述的免疫调节剂的有效、无毒量,以包括在本发明的药物组合物中以获得所需的治疗结果。通常,本发明的药物组合物可以按照与施用途径和接受者的身体特征(包括健康状态)相容的方式施用,并且以这样的方式施用引起所需的效果(即,治疗有效性、免疫原性和/或保护性)。例如,本发明药物组合物的合适剂量可取决于多种因素,包括但不限于受试者的身体特征(例如,年龄、体重、性别);这种化合物是否用作单一药剂或辅助疗法;患者的mhc限制类型;病毒感染的进展(即病理状态);以及本领域技术人员可以认识到的其他因素。在确定本发明药物组合物的合适剂量时,可以考虑的各种一般考虑因素描述于例如gennaro(2000)“remington:thescienceandpracticeofpharmacy”,第20版,lippincott,williams,&wilkins;和gilman等人(编)(1990)“goodman和gilman's:thepharmacologicalbasesoftherapeutics”,pergamonpress。在一些实施方案中,受试者免疫调节剂的“有效量”是足以实现期望的预防或治疗效果的量,例如以减少与th1相关的疾病或病症相关的症状。在这些实施方案中,与未用免疫调节剂治疗的个体症状相比,有效量在个体中将与th1相关的疾病或病症相关的症状减少至少约10%,至少约20%,至少约30%,至少约40%,至少约50%,至少约60%,至少约70%,至少约80%,或至少约90%或更多。各种th1相关疾病或病症的症状以及测量这些症状的方法是本领域已知的。例如,用于测量肿瘤负荷、肿瘤分级、个体中病原性生物数量等的方法是本领域中标准的。在一些实施方案中,受试者免疫调节剂的“有效量”是在选择的施用途径中有效引发免疫应答(包括th1免疫应答)的量。测量免疫应答(包括th1免疫应答)的方法是本领域普通技术人员已知的。示例性方法包括固相非均相测定(例如,酶联免疫吸附测定)、溶液相测定(例如,电化学发光测定)、扩增的发光邻近均相测定、流式细胞术、细胞内细胞因子染色、功能性t细胞测定、功能性b细胞测定、功能性单核细胞-巨噬细胞测定、树突和网状内皮细胞测定、nk细胞应答的测量、免疫细胞产生的ifn-γ、组织或生物流体中病毒rna/dna的定量(例如,血清或其他流体或组织/器官中病毒rna或dna的定量)、氧化爆发测定、细胞毒性-特异性细胞裂解测定、五聚体结合测定、以及吞噬作用和细胞凋亡评估。本发明的药物组合物可通过标准途径施用至接受者,包括但不限于肠胃外(例如,静脉内)。本发明的药物组合物可以分离地或与另外的治疗剂联合施用至接受者。在药物组合物与治疗剂同时施用的实施方案中,施用可以是同时的或顺序的(即施用药物组合物,然后施用药剂,反之亦然)。通常,在治疗应用中,治疗可用于疾病状态或病症期间的持续期间。此外,对于本领域普通技术人员显而易见的是,将由待治疗的疾病状态或病症的性质和程度、施用的形式、途径和部位以及待治疗的特定个体的性质,确定个体剂量的最佳量和间隔。可以使用常规技术确定最佳条件。在许多情况下(例如,预防性应用),可能需要若干次或多次施用本发明的药物组合物。例如,药物组合物可以施用1、2、3、4、5、6、7、8、9、10或更多次。施用可以是约1至约12周的间隔,并且在某些实施方案中,可以是约1至约4周的间隔。在反复暴露于由本发明药物组合物所靶向的特定病原体或其他疾病相关成分的情况下,可能需要定期再施用。对于本领域普通技术人员来说,显而易见的是,可以使用治疗确定测试的常规过程,来确定最佳施用过程。当两个或更多个实体“联合”或“同时”施用于受试者时,它们可以同时以单一组合物施用,或在单独的组合物中同时施用,或者在时间上分开的单独组合物中施用。某些实施方案中,本发明涉及以多个单独剂量施用药物组合物。因此,本文用于预防和治疗th1相关疾病或病症的方法包括,例如在限定的时间段内向受试者施用多个分开的剂量。因此,本文公开的预防和治疗感染的方法包括施用引发剂量的本发明的药物组合物。引发剂量之后可以是加强剂量。加强剂量可以用于再接种。在各种实施方案中,药物组合物或疫苗施用至少一次、两次、三次或更多次。7.治疗方法本发明的免疫调节剂可用于治疗与th1免疫应答降低或受损相关的疾病。例如,th1相关疾病可能是病毒、细菌、真菌或寄生虫感染。病毒包括但不限于逆转录病毒科人免疫缺陷病毒,例如hiv-1(也称为htlv-iii、lav或htlv-iii/lav或hiv-iii);和其他分离株(例如hiv-lp);小核糖核酸病毒科(picornaviridae)(例如脊髓灰质炎病毒、甲型肝炎病毒、肠道病毒、人类柯萨奇病毒、鼻病毒、埃可病毒)、杯状病毒科(calciviridae)(例如引起胃肠炎的株,包括诺瓦克及相关病毒);披膜病毒科(togaviridae)(例如马脑脊髓炎病毒、风疹病毒);黄病毒科(flaviviridae)(例如登革热病毒、脑炎病毒、黄热病毒);冠状病毒科(coronoviridae)(例如冠状病毒);弹状病毒科(rhabdoviridae)(例如,水泡性口炎病毒、狂犬病毒);丝状病毒科(filoviridae)(例如埃博拉(ebola)病毒)、副粘病毒科(paramyxoviridae)(例如副流感病毒、腮腺炎病毒、麻疹病毒、呼吸道合胞病毒、metaneumovirus);正粘病毒科(orthomyxoviridae)(例如,流感病毒);布尼亚病毒科(bungaviridae)(例如汉坦病毒(hataanvirus)、bunga病毒、白蛉病毒(phleoboviruses)和nairo病毒);砂粒病毒科(arenaviridae)(出血热病毒);呼肠孤病毒科(reoviridae)(例如呼肠孤病毒、环状病毒和轮状病毒);传染性法氏囊病毒属双rna病毒科(bimaviridae);肝去氧核糖核酸病毒科(hepadnaviridae)(乙型肝炎病毒);细小病毒科(parvoviridae)(细小病毒);乳多空病毒科(papovaviridae)(乳头状瘤病毒、多瘤病毒);腺病毒科(adenoviridae)(多数腺病毒)、疱疹病毒科(herpeviridae)(单纯疱疹病毒(hsv)1和2、水痘带状疱疹病毒、巨细胞病毒(cmv)、疱疹病毒);痘病毒科(poxyiridae)(天花病毒、vacv、痘病毒);和虹膜病毒科(iridoviridae)(例如,非洲猪瘟病毒);和未分类的病毒(例如,海绵状脑病的致病物、丁型肝炎的致病物(被认为是乙型肝炎病毒的缺陷型卫星病毒)、非甲、非乙型肝炎的致病物(1类=肠道传播的;2类=肠胃外传播的(即丙型肝炎));和星状病毒。在一些实施方案中,病原性感染是细菌病原体。已知是受试者病原性的细菌包括,但不限于病原性巴斯德氏菌属(pasteurella)物种(例如,多杀巴斯德氏菌(pasteurellamultocida))、葡萄球菌属(staphylococci)物种(例如,金黄色葡萄球菌(staphylococcusaureus))、链球菌属(streptococcus)物种(例如,酿脓链球菌(streptococcuspyogenes)(a组链球菌)、无乳链球菌(streptococcusagalactiae)(b组链球菌)、链球菌属(绿色组(viridansgroup))、粪链球菌(streptococcusfaecalis)、牛链球菌(streptococcusbovis)、链球菌属(厌氧种(anaerobicsps.))、肺炎链球菌(streptococcuspneumoniae))、奈瑟氏球菌属(neisseria)物种(例如,淋病奈瑟氏球菌(neisseriagonorrhoeae)、脑膜炎奈瑟氏球菌(neisseriameningitides))、埃希氏菌属(escherichia)物种(例如,肠毒性大肠杆菌(e.coli)(etec)、致肠病性大肠杆菌(epec)、肠出血性大肠杆菌(ehec)、和肠侵染性大肠杆菌(eiec))、博德特氏菌属(bordetella)物种、弯曲杆菌属(campylobacter)物种、军团菌属(legionella)物种(例如,侵肺军团菌(legionellapneumophila))、假单胞菌属(pseudomonas)物种、志贺氏菌属(shigella)物种、弧菌属(vibrio)物种、耶尔森氏菌属(yersinia)物种、沙门氏菌属(salmonella)物种、嗜血菌属(haemophilus)物种(例如,流感嗜血菌(haemophilusinfluenzae))、布鲁氏菌属(brucella)物种、弗朗西丝氏菌属(francisella)物种、拟杆菌属(bacterioides)物种、梭菌属(clostridia)物种(例如,艰难梭菌(clostridiumdifficile)、产气荚膜梭菌(clostridiumperfringens)、破伤风梭菌(clostridiumtetani))、分枝杆菌属(mycobacteria)物种(例如结核分枝杆菌(m.tuberculosis)、鸟分枝杆菌(m.avium)、胞内分枝杆菌(m.intracellulare)、堪萨斯分枝杆菌(m.kansaii)、戈登分枝杆菌(m.gordonae))、幽门螺杆菌(helicobacterpyloris)、布氏疏螺旋体(boreliaburgdorferi)、单核细胞增生利斯特氏菌(listeriamonocytogenes)、沙眼衣原体(chlamydiatrachomatis)、肠球菌属(enterococcus)物种、炭疽芽孢杆菌(bacillusanthracis)、白喉棒杆菌(corynebacteriumdiphtheriae)、猪红斑丹毒丝菌(erysipelothrixrhusiopathiae)、产气肠杆菌(enterobacteraerogenes)、肺炎克雷伯氏菌(klebsiellapneumoniae)、具核梭杆菌(fusobacteriumnucleatum)、念珠状链杆菌(streptobacillusmoniliformis)、彻白密螺旋体(treponemapalladium)、极细密螺旋体(treponemapertenue)、钩端螺旋体属(leptospira)、立克次氏体(rickettsia)、和以色列放线菌(actinomycesisraeli)。在本发明的其他实施方案中,病原性感染是真核病原体,例如病原性真菌和寄生虫。已知是病原性的真菌至少在一定程度上包括,但不限于新型隐球菌(cryptococcusneoformans)、夹膜组织胞浆菌(histoplasmacapsulatum)、粗球孢子菌(coccidioidesimmitis)、皮炎芽生菌(blastomycesdermatitidis)、白念珠菌(candidaalbicans)、光滑念珠菌(candidaglabrata)、烟曲霉(aspergillusfumigate)、黄曲霉(aspergillusflavus)和申克孢子丝菌(sporothrixschenckii)。可以衍生出异源抗原的其他真核病原体包括,但不限于病原性原生动物、蠕虫(helminth)、疟原虫(plasmodium),例如恶性疟原虫(plasmodiumfalciparum)、三日疟原虫(plasmodiummalariae)、卵形疟原虫(plasmodiumovale)、和间日疟原虫(plasmodiumvivax);鼠弓形体(toxoplasmagondii);布氏锥虫(trypanosomabrucei)、克氏锥虫(trypanosomacruzi);埃及血吸虫(schistosomahaematobium)、曼氏裂体吸虫(schistosomamansoni)、日本裂体吸虫(schistosomajaponicum);杜氏利什曼原虫(leishmaniadonovani);肠贾第虫(giardiaintestinalis);小球隐孢子虫(cryptosporidiumparvum);等。可能与降低的或受损的th1免疫应答相关的其他疾病还包括任何恶性或恶变前病症、增殖性或过度增殖性病症、或由于增殖能力或身体任何细胞或组织行为方面的功能性或其他干扰或异常而引起的或衍生的或相关的任何疾病。可以用本发明的多肽复合物和组合物治疗的非限制性癌症包括乳癌、结肠癌、肺癌和前列腺癌、血液和淋巴系统的癌症(包括霍奇金病、白血病、淋巴瘤、多发性骨髓瘤、和瓦尔登斯特伦氏病)、皮肤癌(包括恶性黑色素瘤)、消化道癌症(包括头颈癌、食道癌、胃癌、胰腺癌、肝癌、结肠直肠癌、肛门癌)、生殖器和泌尿系统癌症(包括肾癌、膀胱癌、睾丸癌、前列腺癌)、女性癌症(包括乳癌、卵巢癌、妇科癌症和绒毛膜癌)以及脑、骨良性肿瘤、鼻咽癌、腹膜后癌、甲状腺癌和软组织肿瘤。8.th1免疫状态生物标记物及其用途本发明还部分基于确定pd-l2在iec-相互作用细胞(包括apc,例如树突细胞)上的表达,该种表达与th1相关疾病的严重程度呈负相关,pd-l2是建立th1免疫的必要条件。因此,本发明人已经确定pd-l2是受试者中上调和/或增强的th1免疫应答的可靠指示物。他们还发现了在th1免疫应答期间调节的其他生物标记物。纳入这些额外的生物标记物增加了本文所教导的诊断和预后测定的诊断能力和可靠性。基于这些确定,提出pd-l2(任选与其他th1免疫状态生物标记物组合)指示受试者的th1免疫状态,并且用于追踪患有th1相关疾病的受试者中th1免疫状态的发展。因此,作为本发明多肽复合物和嵌合多肽的伴随诊断,本发明还提供了用于鉴定受试者th1免疫状态或用于为患有th1相关疾病的受试者提供预后的方法、装置、组合物和试剂盒。8.1th1免疫状态生物标记物本发明人已经确定某些表面标记物存在于iec-相互作用细胞上,包括例如树突细胞的apc,其在th1免疫应答期间在人和小鼠中特异性表达。本文提供的结果提供了明确的证据,即独特的生物相关生物标记物谱以极高的准确度预测受试者的th1免疫状态。总体而言,这些发现提供了令人信服的证据,证明本文所公开的iec-相互作用细胞表面标记物(特别是pd-l2)可以作为用于确定th1免疫状态的生物标记物,并且可以潜在地用作对受试者的分类治疗决策的有用诊断,其中所述受试者患有与不希望的th1免疫状态相关的疾病。在这方面,提出基于这些生物标记物的本文公开的方法、装置、组合物和试剂盒可用于定点照护的诊断,而允许快速且廉价地确定th1免疫状态,因此可显著节省医疗系统的成本,这是因为具有不希望的th1免疫应答的受试者可暴露于适于在必要时增强或消除受试者中th1免疫应答的治疗剂。使用本文描述的方法,已经鉴定了一些生物标记物,其对于确定受试者的th1免疫状态特别有用。这些生物标记物称为“th1免疫状态生物标记物”。如本文所用,术语“th1免疫状态生物标记物”是指受试者的生物标记物,通常是受试者免疫系统的生物标记物,其作为th1免疫应答的一部分而被改变、或其表达水平被改变。th1免疫状态生物标记物是基因的适当表达产物(本文也可互换地称为“th1免疫应答生物标记物基因”),包括多核苷酸和多肽表达产物。如本文所用,th1免疫状态生物标记物基因的多核苷酸表达产物本文被称为“th1免疫状态生物标记物多核苷酸”。th1免疫应答生物标记物基因的多肽表达产物本文被称为“th1免疫状态生物标记物多肽”。适当地,本发明的至少一种th1免疫状态生物标记物包括pd-l2。天然人pd-l2氨基酸序列如seqidno:1所示,并由核酸序列编码:可任选地用于本发明方法中的另一种th1免疫状态生物标记物是pd-l1。天然人pd-l1氨基酸序列是:并且由核酸序列编码:在上述th1免疫状态生物标记物中,已发现pd-l2多肽本身具有强的诊断性能,用于检测th1免疫状态(例如,使用facs分析测量pd-l2+iec-相互作用细胞(如apc)的百分比而测量的)。因此,在具体的实施方案中,pd-l2生物标记物可以单独使用或与其他th1免疫状态生物标记物组合用于确定指示物。适当地,在这些实施方案中,生物标记物值是针对pd-l2生物标记物和任选另一个th1免疫状态生物标记物(例如,pd-l1)所测量或推导的,以确定指示物。本发明人还确定,当与pd-l2生物标记物组合使用时,其他th1免疫状态生物标记物具有强的诊断性能。在有利的实施方案中,已鉴定出可用于确定指示物的th1免疫状态生物标记物的对。因此,在这种类型的代表性示例中,并且如下面详细描述的,确定指示物与th1免疫状态生物标记物的比率相关,比率可用于确定受试者的th1免疫状态。因此,本文公开作为th1免疫应答生物标记物的特异性蛋白产物,其提供用于确定受试者的th1免疫状态的手段。通过分析它们在受试者或从受试者获得的样品中的水平,评估这些th1免疫状态生物标记物,提供测量或推导的生物标记物值,用于确定可用于评估受试者中th1免疫状态的指示物。8.2样品制备通常,在th1免疫状态生物标记物检测或定量之前,加工样品。例如,可以在分析之前从样品中提取、分离和/或纯化蛋白和/或核酸。各种蛋白、dna和/或mrna提取和纯化技术是本领域技术人员熟知的。加工可包括离心、超速离心、乙醇沉淀、过滤、分馏、重悬浮、稀释、浓缩等。在一些实施方案中,上文和其他地方所教导的方法提供了来自原始样品(例如,生物流体如血液、血清等)的分析(例如,蛋白生物标记物的定量),无需加工或有限加工。此外,可以在th1免疫状态生物标记物检测或定量之前加工样品,以纯化或富集样品的特定部分或感兴趣的细胞类型。例如,可以富集样品中的iec-相互作用细胞,例如apc或肿瘤细胞,或apc的特定亚组(例如,树突细胞、巨噬细胞、单核细胞、b细胞或其组合)。在优选的实施方案中,th1免疫状态生物标记物检测或定量之前,富集样品中的iec-相互作用的细胞,例如apc(例如,树突细胞,包括cd11c+树突细胞)和肿瘤细胞。用于富集特定细胞类型的生物样品的方法是本领域熟知的。例如,可以使用例如ficoll-hypaque或用于细胞分离的蔗糖梯度溶液,通过差异梯度分离来分离树突细胞,然后对剩余的污染红细胞进行氯化铵或低渗裂解(“cellbiology:alaboratoryhandbook”,volumesi-iiicellis,j.e.,ed.(1994);“currentprotocolsinimmunology”volumesi-iiicoliganj.e.,ed.(1994);stites等人(编))。样品制备方法可以包括步骤:在合适的缓冲液中均化样品、去除污染物和/或测定抑制剂、添加th1免疫状态生物标记物捕获试剂(例如,与可特异性结合靶标th1免疫状态生物标记物的部分连接的磁珠)、在促进靶标生物标记物与捕获试剂结合的条件下孵育以生成靶标生物标记物:捕获试剂的复合物、并在靶标生物标记物的释放条件下孵育靶标生物标记物:捕获的复合物。在一些实施方案中,通过向溶液中加入多个th1免疫状态生物标记物捕获试剂(例如,特异于所需生物标记物),在每轮分离中分离多个th1免疫状态生物标记物。例如,在说明性实施方案中,生物标记物是核酸,多个th1免疫状态生物标记物捕获试剂各自包含特异于不同靶标th1免疫状态生物标记物的寡核苷酸,将所述捕获试剂加入到样品中用于分离多个th1免疫状态生物标记物。预期该方法包括多个实验设计,其在捕获步骤的数目和在每个捕获步骤中捕获的靶标th1免疫状态生物标记物的数量方面都有所变化。在一些实施方案中,捕获试剂是优先(例如,特异性地和选择性地)与待分离、纯化、检测和/或定量的特定生物标记物相互作用的分子、部分、物质或组合物。具有与特定th1免疫状态生物标记物的所需结合亲和力和/或特异性的任何捕获试剂均可用于本技术。例如,捕获试剂可以是大分子例如肽、蛋白(例如,抗体或受体)、寡核苷酸、核酸(例如,能够与th1免疫状态生物标记物杂交的核酸)、维生素、寡糖、碳水化合物、脂质、或小分子或其复合物。作为说明性和非限制性示例,抗生物素蛋白靶标捕获试剂可用于分离和纯化包含生物素部分的靶标,抗体可用于分离和纯化包含适当抗原或表位的靶标,并且寡核苷酸可用于分离和纯化互补的寡核苷酸。能够结合或特异性结合靶标th1免疫状态生物标记物的任何核酸(包括单链和双链核酸)可用作捕获试剂。此类核酸的示例包括dna、rna、适体、肽核酸、以及对糖、磷酸或核苷碱基的其他修饰。因此,存在许多捕获靶标的策略,因此本领域技术人员已知许多类型的捕获试剂。此外,th1免疫状态生物标记物捕获试剂可以包括定位、浓缩、聚集等捕获试剂的功能,当被捕获试剂捕获(例如结合、杂交等)时(例如,当形成靶标:捕获试剂的复合物时),从而提供分离和纯化靶标th1免疫状态生物标记物的方式。例如,在一些实施方案中,捕获试剂与th1免疫状态生物标记物相互作用的部分(例如,多肽)与允许由用户在宏观尺度上操作的固体支持物(例如,珠、表面、树脂、柱等)连接。通常,固体支持物允许使用机械手段从非均相溶液中分离和纯化靶标:捕获试剂复合物。例如,当与珠连接时,通过从非均相溶液中除去珠(例如通过物理运动)而实现分离。在珠是磁性或顺磁性的实施方案中,磁场用于实现捕获试剂(因此和靶标th1免疫状态生物标记物)与非均相溶液的物理分离。8.3th1免疫状态生物标记物多肽的评估为了获得生物标记物值,可以使用本领域已知的任何合适的技术来定量或检测th1免疫状态生物标记物。在具体的实施方案中,使用确定个体th1免疫状态生物标记物的水平、丰度或量的试剂来定量th1免疫状态生物标记物。这种类型的非限制性试剂包括用于基于蛋白和基于核酸的测定的试剂。通过证明蛋白的存在、或通过生物标记物的一种或多种已知功能特性,在蛋白表达水平上评估th1免疫状态生物标记物表达。例如,用于pd-l2-特异性蛋白检测的抗pd-l2抗体描述于美国专利号7,709,214;美国专利申请ser.号2009/296,392;和欧洲专利号1537878,其全部内容通过引用并入本文。抗体结合天然和变性的pd-l2蛋白,并且可以由本领域中的几个公知的测定法来检测,包括酶联免疫吸附测定(elisa)、放射免疫测定(ria)、发光免疫测定、蛋白印迹分析、免疫荧光测定、免疫组化和荧光活化细胞分选(facs)分析。elisa和ria遵循用于检测特异性抗原的类似原理。作为说明性的示例,pd-l2可以通过放射性标记(通常用125i)的pd-l2特异性抗体使用ria进行测量。在elisa测定中,pd-l2特异性抗体与酶化学连接。将pd-l2特异性捕获抗体固定在固体支持物上。然后将未标记的样品,例如来自生物样品的蛋白提取物与固定化抗体在非特异性结合被阻断的条件下孵育,并通过洗涤除去未结合的抗体和/或蛋白。通过第二pd-l2特异性标记的抗体检测结合的pd-l2。通过测量放射性直接在ria中测量抗体结合,而在elisa中,通过将无色底物转化为有色反应产物的反应来检测结合,该有色反应产物作为连接酶活性的函数。因此可以通过分光光度法容易地检测变化(janewayc.a.等人(1997).“immunobiology”第三版增补currentbiologyltd.,garlandpublishinginc.;“cellbiology:alaboratoryhandbook”,卷i-iiicellis,j.e编(1994);“currentprotocolsinimmunology”卷i-iiicoliganj.e.编(1994);stites等人(编))。因此,两种测定都提供了生物样品中pd-l2蛋白含量的定量方法。还可以通过发光免疫测定法检测蛋白生物标记物表达。与elisa和ria非常相似,在发光免疫测定中,将待测试的生物样品/蛋白提取物固定在固体支持物上,并用特异性标记、标记的抗pd-l2抗体进行探测。反过来,标记是发光的,并且结合时发光,作为特异性识别的指示。发光标记包括在通过电磁辐射、电化学激发或化学活化激活时发光的物质,并且可包括荧光和磷光物质、闪烁体和化学发光物质。标记可以是催化反应系统的一部分,如酶、酶片段、酶底物、酶抑制剂、辅酶或催化剂;色原体系的一部分,如荧光团、染料、化学发光剂、发光剂或敏化剂;非磁性或磁性的可分散颗粒、固体支持物、脂质体、配体、受体、半抗原放射性同位素等(美国专利号6,410,696、美国专利号4,652,533和欧洲专利申请号0,345,776),并提供用于检测pd-l2蛋白表达的额外高灵敏度方法。蛋白印迹分析是评估生物样品中th1免疫状态生物标记物多肽含量的另一种方法。来自iec-相互作用细胞(如apc(例如,树突细胞)或肿瘤细胞)的生物样品的蛋白提取物在变性电离环境中溶解,并将等分试样应用于聚丙烯酰胺凝胶基质。当蛋白向阳极迁移时,基于分子尺寸性质分离蛋白。然后将抗原转移到硝酸纤维素膜、pvdf或尼龙膜上,然后进行膜封闭以使非特异性结合最小化。用直接与可检测部分偶联的抗体探测膜,或随后用含有可检测部分的二抗探测膜。通常,辣根过氧化物酶或碱性磷酸酶与抗体偶联,发色或发光底物用于显现活性(harlowe.等人,(1998)immunoblotting.inantibodies:alaboratorymanual,pp.471-510cshlaboratory,coldspringharbor,n.y和bronsteini.等人(1992)biotechniques12:748-753)。与定量整个样品中蛋白生物标记物含量的ria、elisa、发光免疫测定和免疫印迹不同,免疫荧光/免疫细胞化学尽管在定量方面进行妥协,仍可按照细胞特异性方式用于检测蛋白。如上所述,可以通过本领域已知的方法分离或富集iec-相互作用细胞,例如apc(例如,树突细胞)或肿瘤细胞。iec-相互作用细胞的分离或富集是指其中增加iec-相互作用细胞百分比的过程(相对于富集程序之前样品中的百分比)。纯化是富集的一个示例。在某些实施方案中,相对于富集程序之前的样品,富集样品中作为细胞百分比的iec-相互作用细胞(如apc(例如,树突细胞)或肿瘤细胞)的数目增加至少25-、50-、75-、100-、150-、200-、250-、300-、350-倍,适当地增加100-200倍。在具体的实施方案中,在iec-相互作用细胞上表面标记物的抗体可以附着在固体支持物上以允许分离。分离步骤可以包括使用抗体磁珠(例如,miltenyitm珠)的磁性分离、亲和色谱、使用附着于固体基质的抗体进行“淘选”、或任何其它方便的技术(如激光捕获显微切割)。在具体的实施方案中,iec-相互作用细胞是树突细胞,适当地其使用特异于cd11c抗体进行富集,这种抗体与磁珠缀合,并且磁性细胞分离装置用于分离cd11c+细胞。提供特别准确的分离的其他技术包括facs。细胞一旦沉积在玻片上,它们可以被固定,并用标记的抗原结合分子(如标记抗体)进行探测,以细胞特异性方式来检测th1免疫状态生物标记物。特异于th1免疫状态生物标记物的抗体,例如抗pd-l2抗体,可以直接缀合至荧光标记物,包括荧光素、fitc、罗丹明、德克萨斯红、cy3、cy5、cy7和其他荧光标记物,并在配备适当滤镜的荧光显微镜下观察。抗体也可以与酶缀合,在加入适当的底物后开始反应,在检测到pd-l2蛋白的细胞上提供有色沉淀。然后可以通过标准光学显微镜观察玻片。或者,pd-l2的特异性一抗可以进一步与缀合有可检测部分的二抗结合。可由此来评估细胞表面表达,并且可以添加细胞透化溶液(例如triton-x和皂苷)来促进细胞质内的试剂渗透(“cellbiology:alaboratoryhandbook”,卷1-111cellis,je编(1994);“currentprotocolsinimmunology”卷i-iiicoliganje编(1994);stites等人(编)“basicandclinicalimmunology”(第8版),appleton&lange,norwalk,conn.(1994);mishell和shiigi(编)“selectedmethodsincellularimmunology”,w.h.freemanandco.,newyork(1980)。免疫组织化学与免疫荧光或免疫细胞化学非常相似,然而原则上组织标本用pd-l2抗体进行探测,例如与细胞悬浮液不同。固定活组织检查标本并加工,任选地包埋在石蜡中,如果需要则切片,提供随后用乙酰肝素酶特异性抗体探测的细胞或组织切片。或者,冷冻组织可以在低温恒温器上切片,随后进行抗体探测,避免固定诱导的抗原掩蔽。如免疫荧光或免疫细胞化学中的抗体与可检测部分(荧光、或酶连接的)偶联,并且通过针对免疫荧光所述的方法用于探测组织切片,并且根据所用的检测方法随后通过荧光或共聚焦显微镜观察。如果在反应产物显色后使用酶促的可检测部分,则可通过标准光学显微镜来观察反应产物沉淀物的可视化(“cellbiology:alaboratoryhandbook”,卷1-111cellis,je编(1994);“currentprotocolsinimmunology”卷i-iiicoliganje编(1994);stites等人(编)“basicandclinicalimmunology”(第8版),appleton&lange,norwalk,conn.(1994);mishell和shiigi(编)“selectedmethodsincellularimmunology”,w.h.freemanandco.,newyork(1980))。在具体的实施方案中,facs分析用于评估th1免疫状态生物标记物的表达(例如,pd-l2和任选的pd-l1的表达)。美国专利号4,172,227;4,347,935;4,661,913;4,667,830;5,093,234;5,094,940和5,144,224中提供facs设备和方法的一般描述。将细胞引入facs机器中并通过管道输送到facs池中,它们作为单个细胞通过其中。激光束指向facs池,通过光电二极管收集前向激光散射,侧向激光散射通过透镜指向pmt管,指向pmt1。特定的过滤器将来自侧向散射的荧光直接引导至其他pmt管以进行多变量分析。侧向激光散射是细胞大小和粒度的反映,并且可以用于鉴定混合样品中的细胞群。可以通过激光激发和通过pmt管收集来检测用荧光抗-pd-l2抗体标记的细胞,其可以通过大小和粒度鉴定细胞类型,或通过掺入额外的细胞表面标记物进行鉴定,例如以上公开的。通常,facs分析用于确定特定蛋白的细胞表面表达(例如,pd-l2和任选pd-l1的表达),因此特异性抗体可用于探测抗原呈递细胞群中(例如,pd-l2和任选pd-l1在树突细胞表面上的表达)细胞表面生物标记物表达的检测。表达表面pd-l2蛋白和任选pd-l1的特异性抗原呈递细胞亚型(例如,cd11c+树突细胞)可以通过大小和粒度特征来确定,或者通过与其他细胞表面标记物蛋白的共染色来确定。在具体的实施方案中,使用允许同时检测和/或定量大量蛋白的蛋白捕获阵列。例如,过滤膜上的低密度蛋白阵列,如通用蛋白阵列系统(ge,2000nucleicacidsres.28(2):e3)允许使用标准elisa技术和扫描电荷耦合器件(ccd)检测器成像排列的抗原。还开发了免疫传感器阵列,其能够同时检测临床分析物。现在可以使用蛋白阵列来检测体液中的蛋白表达谱,例如在健康或患病受试者、以及在药物治疗前和治疗后受试者的血清中。示例性蛋白捕获阵列包括包含空间寻址的抗原结合分子的阵列(通常被称为抗体阵列),其可促进定义蛋白组或亚蛋白组的许多蛋白的广泛平行分析。抗体阵列已被证明具有特异性和可接受背景的所要求特性,并且一些是商购可得的(例如,bdbiosciences、clontech、biorad和sigma)。用于制备抗体阵列的多种方法已被报道(参见,例如,lopez等,2003j.chromatogr.b787:19-27;cahill,2000trendsinbiotechnology7:47-51;美国专利申请公布2002/0055186;美国专利申请公布2003/0003599;pct公布wo03/062444;pct公布wo03/077851;pct公布wo02/59601;pct公布wo02/39120;pct公布wo01/79849;pct公布wo99/39210)。这样阵列的抗原结合分子可识别由细胞或细胞群表达的蛋白的至少一个子集,其说明性示例包括生长因子受体、激素受体、神经递质受体、儿茶酚胺受体、氨基酸衍生物受体、细胞因子受体、细胞外基质的受体、抗体、凝集素、细胞因子、丝氨酸蛋白酶抑制剂、蛋白酶、激酶、磷酸酶、ras样gtp酶、水解酶、类固醇激素受体、转录因子、热休克转录因子、dna结合蛋白、锌指蛋白、亮氨酸拉链蛋白、同源异型域蛋白、细胞内信号转导调节因子和效应因子、凋亡相关因子、dna合成因子、dna修复因子、dna重组因子和细胞表面抗原。单独空间上不同的蛋白捕获剂通常被附着至通常是平面或波形的支撑物表面。常见的物理支撑物包括玻片、硅、微孔、硝酸纤维素或pvdf膜和磁珠以及其他微珠。只要它们的编码是为了用于鉴定,悬液中的颗粒也可用作阵列的基础;系统包括微球的颜色编码(例如,可购自luminex、bio-rad和nanomicsbiosystems)和半导体纳米晶体(例如,可购自quantumdots的qdotstm),以及珠的条形码(可购自smartbeads的ultraplextm)和多金属微米棒(购自surromed的nanobarcodestm颗粒)。珠还可被组装成在半导体芯片上的平面阵列(例如,购自leapstechnology和bioarraysolutions)。当使用颗粒时,单独的蛋白捕获剂通常被附着至单独的颗粒,以提供阵列的空间限定或间隔。颗粒然后可在例如微量滴定板的孔中或在单独的试管中单独地但以区室化的方式并行被测定。在操作中,将任选地片段化以形成肽片段的蛋白样品(参见,例如,美国专利申请公布2002/0055186),在适合于蛋白或肽结合的条件下递送至蛋白捕获阵列,并且该阵列被洗涤以从该阵列去除样品的未结合的或非特异性结合的组分。接着,使用适合的检测系统来检测结合至阵列的每个特征的蛋白或肽的存在或量。结合至阵列的特征的蛋白的量可相对于结合至阵列的第二特征的第二蛋白的量来确定。在某些实施方案中,样品中第二蛋白的量已经是已知的或已知是不变的。在具体的实施方案中,th1免疫状态生物标记物是靶标多肽,使用至少一种与靶标多肽免疫相互作用的抗原结合分子测量其水平。在这些实施方案中,将测量的靶标多肽水平归一化至参考多肽的水平。适当地,抗原结合分子固定在固体或半固体支持物上。在这种类型的说明性示例中,抗原结合分子形成抗原结合分子空间阵列的一部分。在一些实施方案中,通过免疫测定法(例如,使用elisa)测量与靶标多肽结合的抗原结合分子的水平。证明在样品内不存在或存在生物标记物活性,是区分表达特异性th1免疫状态生物标记物的iec-相互作用细胞群和不表达特异性th1免疫状态生物标记物的细胞群的另外方法。8.4评价pd-l2生物标记物的聚集本发明人还确定了pd-l2在iec-相互作用细胞的细胞表面上的聚集指示着正常或升高的th1免疫应答。因此,在一些实施方案中,th1免疫状态生物标记物的生物标记物值指示pd-l2的水平或丰度,如通过分析iec-相互作用细胞(如apc(例如,树突细胞)或肿瘤细胞)的细胞表面上pd-l2聚集所确定的。有许多广泛可用的测定法用于检测抗原呈递细胞(例如,树突细胞)的细胞表面上的pd-l2的聚集。例如,可以标记pd-l2配体和/或pd-l2-特异性抗体,并且检测这些标记以显现pd-l2的聚集。在这种类型的测定的一个示例中,使包含pd-l2的树突细胞或肿瘤细胞与pd-l2-特异性抗体和与pd-l2-特异性抗体结合的荧光标记的二抗接触。使用共聚焦扫描激光显微镜,可以检测从二抗发出的荧光,以识别pd-l2的位置(vansteensel等人,1995.jcellsci108:3003-3011)。在另一个示例中,细胞表面上包含pd-l2的细胞与细胞表面pd-l2的标记配体接触,并通过超分辨率显微镜分析细胞表面pd-l2聚集,例如kaufmann等人(2011.jmicrosc.242(1):46-54)、huber等人(2011.plosone.7(9):e44776)、wang等人(2014.biochimbiophysacta.1838(4):1191-1198)和sams等人(2014.jbiomedopt.19(1):011021)所描述的。或者,通过原位邻近测定法分析细胞表面pd-l2聚集,例如bellucci等人(2014.methodsmolbiol.1174:397-405)、barros等人(2014.breastcancerrestreat.144(2):273-85)和pacchiana等人(2014.histochemcellbiol.142(5):593-60)所描述的。在其他实施方案中,fret和frap显微术可用于分析pd-l2聚集,例如wallrabe等人(2003.biophysj.85(1):559-571)、wallrabe等人(2003.jbiomedopt.8(3):339-346)和deheus等人(2013.methodscellbiol.117:305-321)所述。分析pd-l2聚集的其他方法包括:图像相关光谱法,例如petersen等人(1998.faradaydiscuss.(111):289-305)、kozer等人(2013.molbiosyst.9(7):1849-1863)和ciccotosto等人(2013.biophysj.104(5):1056-1064)所述;电场分析,例如giugni等人(1987.jcellbiol.104(5):1291-1297)和zhang等人(2011.plosone.6(10):e26805)所述;电子显微镜,例如plowman等人(2005.procnatlacadsciusa.102(43):15500-15505)和d'amico等人(2008.micron.39(1):1-6)所述;电子冷冻断层摄影术,例如gold等人(2014.natcommun.5:4129)所述;纳米颗粒(np)免疫标记与等离子体耦合显微镜(pcm)的组合,例如wang等人(2012.nanolett.12(6):3231-3237)和rong等人(2012.plosone.7(3):e34175)所述;酶介导的放射源激活(emars)分析,例如miyagawa-yamaguchi等人(2014.plosone.9(3):e93054)和kotani等人(2008.procnatlacadsciusa.105(21):7405-7409)所述;和量子点分析,例如li等人(2010.biophysj.98(11):2554-2563)所述。已知许多具有pd-l2特异性的配体,其可用于聚集分析。这些中的许多也可用作根据本发明的治疗剂。例如,预期任何结合pd-l2多肽的合适抗体可用于实施本发明。以上列出了此类抗体的非限制性示例。在具体的实施方案中,抗体包含免疫球蛋白的fc区。或者,或另外,抗体是多价的(例如,二价)抗体。任何pd-l2配体适用于本发明的这些实施方案,包括以下类别的配体:蛋白、小有机分子、碳水化合物(包括多糖)、多核苷酸、脂质等。此类配体的代表性示例包括pd-1多肽、半乳糖凝集素-9多肽和排斥性指导分子b(rgmb)。8.5评估th1免疫状态生物标记物核酸在一些实施方案中,通过确定iec-相互作用细胞(例如apc(如树突细胞)或肿瘤细胞)中的生物标记物核酸转录物水平来监测生物标记物表达。可以通过许多标准技术从生物样品中提取rna(参见currentprotocolsinmolecularbiology”卷i-iiiausubel,r.m编(1994);ausubel等人“currentprotocolsinmolecularbiology”,johnwileyandsons,baltimore,md.(1989))。基于胍的细胞裂解方法能够进行rna分离,随后是氯化铯步骤梯度用于从其他细胞大分子中分离rna,然后进行rna沉淀和重悬浮,这是较早的不太常用的rna分离方法(glisin,ve.等人(1973)biochemistry13:2633)。或者,可以一步法分离rna(美国专利号4,843,155和puissant,c和houdebinel.m(1990)biotechniques8:148-149)。单步骤程序包括使用异硫氰酸胍进行rna提取,随后进行苯酚/氯仿/异戊醇提取,促进总rna与其他细胞蛋白和dna的分离。可以使用基于上述原理的市售单步制剂,包括例如使用trizol试剂(lifetechnologies,gaithersburg,md)。th1免疫状态生物标记物rna/基因表达可以通过一些其他标准技术来监测,说明性示例包括northern印迹和斑点印迹分析、引物延伸、rna酶保护、rt-pcr、原位杂交、和芯片杂交。特异性th1免疫状态生物标记物rna序列可以通过标记探针与如上提取的印迹rna制剂进行杂交而容易地检测。在northern印迹分析中,对分级的rna进行变性琼脂糖凝胶电泳,这防止rna出现可能抑制基于大小的分离的二级结构。然后通过毛细管转移将rna转移到尼龙或硝酸纤维素膜支持物上,并且可以用与生物标记物序列互补的标记寡核苷酸探针进行探测(alwine,等人(1977)proc.natl.acad.sci.usa74:5350-5354和currentprotocolsinmolecularbiology”卷i-iiiausubel,r.m.编(1994);ausubel等人“currentprotocolsinmolecularbiology”,johnwileyandsons,baltimore,md.(1989))。或者,可以将未分级的rna固定在尼龙或硝酸纤维素膜上,并通过slot/dot印迹分析类似地探测生物标记物-特异性表达。rna的slot/dot印迹可以通过手工制备、或者使用歧管(manifold)装置进行构建,其通过光密度扫描促进比较杂交信号(chomczynskip.(1992)anal.biochem.201:134-139)。引物延伸是另一种可以完成rna定量的方法。通过使用酶逆转录酶延伸引物,引物延伸为绘制特定rna的5'末端提供了额外的益处。在这种情况下,引物是与生物标记物mrna一部分互补的寡核苷酸(或限制性片段)。引物末端进行标记,并允许与模板生物标记物mrna杂交。杂交后,通过加入逆转录酶延伸引物,并将未标记的脱氧核苷酸掺入到与模板生物标记物mrna互补的单链dna中。然后在测序凝胶上分析dna,延伸引物的长度用于绘制mrna的5'位置,并且延伸产物的产量反映样品中rna的丰度(jones等人,(1985)cell42:559-572,以及mierendorfr.c和pfeffer,d.(1987)methodsenzymol.152:563-566)。rna酶保护测定法提供了高度灵敏的定量生物标记物rna的方法,即使在低丰度时也是如此。在保护测定中,产生具有高特异性活性的、与生物标记物rna互补的核糖核苷酸探针的序列特异性杂交,并与样品rna杂交。然后用核糖核酸酶处理杂交反应物以除去游离探针,使退火探针的完整片段与样品rna中的同源生物标记序列杂交。然后通过在测序凝胶上电泳分析片段,此时可观察适当大小的探针片段(zinnk.等人(1983)cell34:865-879和meltons.a.,等人(1984).nucl.acidsres.12:7035-7056)。rt-pcr是可以分析生物标记物表达的另一种方式。rt-pcr使用与生物标记物mrna互补的脱氧核苷酸引物通过利用逆转录酶从rna样品中制备cdna。一旦产生cdna,通过加入脱氧核苷酸和在高温下起作用的dna聚合酶,通过聚合酶链反应扩增cdna。通过引物退火的重复循环,掺入脱氧核苷酸促进cdna延伸,随后进行链变性,发生所需序列的扩增,产生可通过琼脂糖凝胶电泳检测的适当大小的片段。最佳逆转录、杂交和扩增条件将根据所用引物和靶标的序列组成和长度以及操作者选择的实验方法而变化。可以使用各种指导来选择合适的引物序列和杂交条件(参见,例如sambrook等人1989,molecularcloning,laboratorymanual,(卷1-3)coldspringharborpress,n.y.;以及ausubel等人1989,currentprotocolsinmolecularbiology,greenpublishingassociatesandwileyinterscience,n.y.)。原位杂交提供可用于检测和定位细胞/组织特异性生物标记物rna表达。标记的反义rna探针与固定在显微镜玻片上单独的细胞中或在加工的组织切片中的mrna杂交(insituhybridization:medicalapplications(eds.g.r.coulton和j.debelleroche)kluweracademicpublishers,boston(1992);insituhybridization:inneurobiology;advancesinmethodology(eds.j.h.eberwine,k.l.valentino和j.d.barchas)oxforduniversitypressinc.,英国(1994);以及insituhybridization:apracticalapproach(ed.d.g.wilkinson)oxforduniversitypressinc.,英国(1992))。已经开发了许多非同位素系统来观察标记的dna探针,包括:a)基于荧光的直接检测方法,b)使用地高辛和生物素标记的dna探针与荧光检测方法相结合,和c)使用地高辛和生物素标记的dna探针与抗体-酶检测方法相结合。当荧光标记的反义rna探针与细胞rna杂交时,可以使用荧光显微镜直接观察杂交的探针。核酸探针的直接荧光染料标记消除了对多层检测程序的需要(例如,基于抗体的系统),其允许快速处理并且还减少非特异性背景信号,因此提供通用的且高度灵敏的手段来鉴定生物标记物基因表达。芯片杂交利用附着于固体基质上的生物标记物特异性寡核苷酸,固体基质可以由颗粒状固相组成,例如设计为微阵列的尼龙过滤器、玻片或硅片(schena等人(1995)science270:467-470)。微阵列是本领域已知的并且由表面组成,在这种表面上与基因产物(例如cdna)序列对应的探针可以特异性地杂交或结合在已知位置以检测生物标记物基因表达。杂交复合物的定量是本领域熟知的,并且可以通过几种方法中的任何一种来实现。这些方法通常基于标记或标记物的检测,例如本领域标准使用的任何放射性、荧光、生物或酶标签或标记。标记可以应用于寡核苷酸探针或源自生物样品的rna。通常,适当地与校准曲线一起实现mrna定量,以便能够准确地确定mrna。此外,定量源自生物样品的转录物优选通过与正常样品的比较来实现,这种样品的特征在于所检查的转录物的表达模式正常。8.6推导生物标记物值生物标记物值可以是测量的生物标记物值,其是针对受试者直接测量的生物标记物的值,或者可以是“推导的”生物标记物值,其是源自一个或多个测量的生物标记物值的值,例如通过将函数应用于一个或多个测量的生物标记物值。如本文所使用的,已应用函数的生物标记物被称为“推导的生物标记物”。可以以本领域公知的多种方式中的任何一种来确定生物标记物值。例如,生物标记物值确定的综合描述可以在国际专利公开号wo2015/117204中找到,其全部内容通过引用并入本文。在一个示例中,确定生物标记物值的方法可以包括测量生物标记物值,例如通过对受试者或从受试者获得的样品进行测试。然而,更典型地,确定生物标记物值的步骤包括使电子处理装置接收或以其他方式获得先前已经测量或推导的生物标记物值。这可以包括例如从例如远程数据库的数据存储中检索生物标记物值、获得已经使用输入设备等手动输入的生物标记物值。适当地,指示物可以使用多个生物标记物值的组合来确定,指示物至少部分地指示th1免疫状态。假设使用电子处理装置执行这种方法,任选地显示或以其他方式向用户提供指示物的指示。在一些实施方案中,组合生物标记物值,例如通过加上、乘以、减去或除以生物标记物值来确定指示物值。执行这种步骤使得多个生物标记物值可以组合成单个指示物值,提供更有用和简单的机制以允许指示物得到解释,并因此用于确定受试者的th1免疫状态。应当理解,在上下文中,在上述方法中使用的生物标记物可以限定th1免疫状态的生物标记物谱,其包括最少数目的生物标记物(例如,至少一个生物标记物),同时保持足够的性能使得生物标记物谱可用于临床相关的确定。最大限度地减少所用生物标记物的数目可以最大限度地降低与进行诊断或预后测试相关的成本,并且在多肽生物标记物的情况下,允许使用相对简单的技术进行测试,例如荧光活化的细胞分选(facs)和免疫组织化学,并允许在临床环境中快速进行测试。在这方面,由本文描述的方法提供的指示可以是指示物值的图形或字母数字表示。然而可选地,这种指示可以是指示物值与预定阈值或范围的比较结果,或者可以是th1免疫状态的指示。此外,产生单个指示物值允许临床医生或其他医疗操作者容易地解释测试结果,使得测试可用于临床环境中的可靠诊断。仅作为说明,适当地确定指示物的方法包括确定至少一个生物标记物值,其中生物标记物值是针对受试者的至少一个th1免疫状态生物标记物测量的或推导的值,并且至少部分地指示取自受试者的样品中th1免疫状态生物标记物的浓度或丰度,并且其中至少一个th1免疫状态生物标记物包括iec-相互作用细胞(包括apc(例如,树突细胞)和肿瘤细胞)的pd-l2。适当地,th1免疫状态生物标记物谱还包含iec-相互作用细胞(例如apc(例如,树突细胞)或肿瘤细胞)的pd-l1作为th1免疫状态生物标记物。生物标记物值通常用于确定指示物,用于确定受试者的th1免疫状态。在一些实施方案中,指示物是一对th1免疫状态生物标记物(例如,pd-l2和pd-l1)浓度比率的指示。因此,如果生物标记物值表示th1免疫状态生物标记物的浓度,则推导的生物标记物值通常(尽管不绝对)基于生物标记物值的比率。然后,如本领域通常公知的并且如下面更详细描述的,通过使用推导的生物标记物值作为指示物值、或通过执行附加处理(例如将推导的生物标记物值与参考值进行比较等),使用推导的生物标记物值来确定指示物。使用组合函数来组合推导的生物标记物值,例如加性模型;线性模型;支持向量机;神经网络模型;随机森林模型;回归模型;遗传算法;退火算法;加权和;近邻模型;和概率模型。在一些实施方案中,生物标记物值是针对pd-l2和pd-l1测量的或推导的,并且通过组合生物标记物值来确定指示物。在一些实施方案中,将指示物与指示物参考进行比较,其中根据比较结果确定th1免疫状态。指示物参考可以推导自参考群体中个体数目确定的指示物。参考群体通常包括具有不同特征的个体,例如不同性别和/或种族的多个个体,基于不同的特征定义不同的群体,将受试者的指示物与来自具有相似特征的个体的指示物参考进行比较。参考群体还可以包括多个健康个体、已知具有增强的th1免疫状态的多个个体、已知具有降低的或缺乏th1免疫状态的多个个体、显示癌症(适当地,转移性癌症)临床症状的多个个体、或显示病原性感染(例如,疟疾)临床症状的多个个体。在具体的实施方案中,使用至少一个电子处理装置(例如适当地编程的计算机系统等)来执行本发明的确定指示物的方法。在这种情况下,通过从测量或其他定量装置接收这种数据、或者通过从数据库等中进行检索,电子处理装置通常获得至少一个测量的生物标记物值。然后,处理装置通过任何合适的方式确定指示物,例如通过计算指示第一th1免疫状态生物标记物和第二th1免疫状态生物标记物浓度的比率的值。然后,处理装置可以生成指示物的表示,例如通过生成指示物的符号或字母数字指示、指示物与一个或多个指示物参考比较的图形指示、或者受试者th1免疫状态的字母数字指示。本发明的确定指示物的方法通常包括从受试者获得样品,所述受试者通常具有th1相关疾病(例如,病原性感染或癌症)的至少一种临床指征,其中所述样品包括一种或多种th1免疫状态生物标记物(例如,pd-l2和任选pd-l1),并定量或以其他方式评估样品内至少一种(例如,1、2、3、4、5、6、7、8、9、10或更多)th1免疫状态生物标记物,以确定生物标记物值。这可以使用任何合适的技术来实现,并且取决于th1免疫状态生物标记物的性质。适当地,个体测量的或推导的th1免疫状态生物标记物值对应于各th1免疫状态生物标记物的水平、丰度或量,或对应于应用至这种水平或量的函数。例如,在本发明确定指示物的方法的一些实施方案中,如果使用多个th1免疫状态生物标记物的指示物基于多肽浓度的比率,则这种过程通常包括通过本领域已知的任何方法(包括免疫荧光、或通过功能测定)来定量多肽。在一些实施方案中,通过确定一个或更多个th1免疫状态生物标记物值建立受试者的th1免疫状态,其中个体th1免疫状态生物标记物值指示着受试者中或获自受试者的样品中测量的或推导的th1免疫状态生物标记的值。这些生物标记物被称为“样品th1免疫状态生物标记物”。根据本发明,样品th1免疫状态生物标记物对应于参考th1免疫状态生物标记物(本文也称为“相应th1免疫状态生物标记物”)。“相应th1免疫状态生物标记物”是指th1免疫状态生物标记物,其在结构和/或功能上类似于参考th1免疫状态生物标记物,例如seqidno:1(pd-l2)和seqidno:56(pd-l1)所示。代表性的相应th1免疫状态生物标记物包括参考th1免疫应答生物标记物基因的等位基因变体(相同基因座)、同源物(不同基因座)和直向同源物(不同生物)的表达产物。参考th1免疫状态生物标记物基因和编码的th1免疫状态生物标记物多肽的核酸变体可含有核苷酸取代、缺失、颠换和/或插入。变化可以发生在编码区和非编码区中的任一个或两者中。这些变化可以产生保守和非保守氨基酸取代(与编码产物相比)。对于核苷酸序列,由于遗传密码的简并性,保守变体包括编码参考th1免疫状态多肽的氨基酸序列的那些序列。相应的th1免疫状态生物标记物包括与参考th1免疫状态生物标记物多肽的氨基酸序列显示出基本上序列相似性或同一性的氨基酸序列。通常,对应于参考氨基酸序列的氨基酸序列,与选自seqidno:1至9中任一个的参考氨基酸序列将显示至少约50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、97、88、89、90、91、92、93、94、95、96、97、98或99%序列相似性或同一性。在一些实施方案中,序列之间的序列相似性或序列同一性的计算如下进行:为了确定两个氨基酸序列或两个核酸序列的百分比同一性,出于最佳比较的目的将序列进行比对(例如,可以在第一和第二氨基酸或核酸序列中的一个或两个中引入空位以便最佳比对,为了比较目的可以忽略非同源序列)。在一些实施方案中,为比较目的而比对的参考序列的长度为参考序列长度的至少30%,通常至少40%,更通常至少50%、60%,甚至更通常至少70%、80%、90%、100%。然后比较相应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当第一序列中的位置被第二序列中相应位置的相同氨基酸残基或核苷酸占据时,则分子在该位置是相同的。对于氨基酸序列比较,当第一序列中的位置被第二序列中相应位置的相同或相似的氨基酸残基(即保守取代)占据时,则分子在该位置是相似的。两个序列之间的百分比同一性是各个位置上序列共有的相同氨基酸残基数目的函数,考虑空位的数目和每个空位的长度,需要引入空位以便获得两个序列的最佳比对。相比之下,两个序列之间的百分比相似性是各个位置上序列共有的相同和相似氨基酸残基数目的函数,考虑空位的数目和每个空位的长度,需要引入空位以便获得两个序列的最佳比对。可以使用数学算法完成序列的比较和序列之间的百分比同一性或百分比相似性的确定。在某些实施方案中,使用blossum62阵列或pam250阵列,16、14、12、10、8、6或4的空位权重,以及1、2、3、4、5或6的长度权重,采用needleman和wünsch(1970,j.mol.biol.48:444-453)算法确定氨基酸序列之间的百分比同一性或相似性,所述算法已被纳入gcg软件包中的gap程序(可从http://www.gcg.com获得)。在具体的实施方案中,使用nwsgapdna.cmp阵列,40、50、60、70或80的空位权重,以及1、2、3、4、5或6的长度权重,使用gcg软件包中的gap程序(可从http://www.gcg.com获得)确定核苷酸序列之间的同一性百分比。非限制性参数组(除非另有说明,否则应使用的参数)包括具有12的空位罚分,4的空位延伸罚分和5的移码空位罚分的blossum62评分阵列。在一些实施方案中,氨基酸或核苷酸序列之间的百分比同一性或相似性可使用e.meyers和w.miller的算法确定(1989,cabios,4:11-17),其已并入align程序中(版本2.0),使用pam120权重残基表,空位长度罚分为12,空位罚分为4。本文描述的核酸和蛋白序列可以用作“查询序列”以对公共数据库进行搜索,例如以鉴定其他家族成员或相关序列。可以使用altschul等人(1990,jmolbiol.,215:403-10)的nblast和xblast程序(版本2.0)进行这样的搜索。采用nblast程序,评分=100,字长=12进行blast核苷酸搜索,以获得与本发明53010核酸分子同源的核苷酸序列。可以用xblast程序,评分=50,字长=3进行blast蛋白搜索,以获得与本发明的蛋白分子同源的氨基酸序列。为了获得用于比较目的的空位比对,利用空位blast,如altschul等人(1997,nucleicacidsres,25:3389-3402)所述。当使用blast和空位blast程序时,可以使用相应程序(例如,xblast和nblast)的默认参数。相应的th1免疫状态生物标记物多核苷酸还包括在下述严格条件下与参考th1免疫状态生物标记物多核苷酸或其互补物杂交的核酸序列。如本文所用,术语“在低严格、中等严格、高严格或非常高严格条件下杂交”描述了杂交和洗涤的条件。本文所用“杂交”表示互补核苷酸序列的配对以产生dna-dna杂合体或dna-rna杂合体。互补碱基序列是通过碱基配对规则相关的那些序列。在dna中,a与t配对,c与g配对。在rna中,u与a配对,c与g配对。在这方面,本文所用的术语“匹配”和“错配”是指在互补核酸链中配对核苷酸的杂交潜力。匹配的核苷酸有效杂交,例如上述经典的a-t和g-c碱基对。错配是不能有效杂交的核苷酸的其他组合。可以在ausubel等人(1998,同上)第6.3.1-6.3.6节中找到进行杂交反应的指导。在这种参考文献中描述了水性和非水性方法,并且可以使用任一种。本文提及低严格条件包括并包含至少约1%v/v至至少约15%v/v甲酰胺和至少约1m至至少约2m盐,用于在42℃下杂交,以及至少约1m至至少约2m盐用于在42℃下洗涤。低严格条件还可包括1%牛血清白蛋白(bsa)、1mmedta、0.5mnahpo4(ph7.2)、7%sds在65℃下杂交,以及(i)2×ssc、0.1%sds;或(ii)0.5%bsa、1mmedta、40mmnahpo4(ph7.2)、5%sds在室温下洗涤。低严格条件的一个实施方案包括在约45℃下在6×氯化钠/柠檬酸钠(ssc)中杂交,然后在0.2×ssc、0.1%sds中在至少50℃洗涤两次(对于低严格条件,洗涤的温度可以增加到55℃)。中等严格条件包括并包含至少约16%v/v至至少约30%v/v甲酰胺和至少约0.5m至至少约0.9m盐,用于在42℃下杂交,并且至少约0.1m至至少约0.2m盐在55℃下洗涤。中等严格条件还可包括1%牛血清白蛋白(bsa)、1mmedta、0.5mnahpo4(ph7.2),7%sds用于在65℃杂交,以及(i)2×ssc、0.1%sds;或(ii)0.5%bsa、1mmedta、40mmnahpo4(ph7.2)、5%sds,用于在60-65℃下洗涤。中等严格条件的一个实施方案包括在约45℃下在6×ssc中杂交,然后在60℃下在0.2×ssc、0.1%sds中进行一次或多次洗涤。高严格条件包括并包含至少约31%v/v至至少约50%v/v甲酰胺和约0.01m至约0.15m盐用于在42℃下杂交,和约0.01m至约0.02m盐用于在55℃下洗涤。高严格条件也可包括1%bsa、1mmedta、0.5mnahpo4(ph7.2)、7%sds用于65℃杂交,和(i)0.2×ssc、0.1%sds;或(ii)0.5%bsa、1mmedta、40mmnahpo4(ph7.2)、1%sds,用于在超过65℃的温度下洗涤。高严格条件的一个实施方案包括在约45℃下在6×ssc中杂交,然后在0.2×ssc、0.1%sds中在65℃进行一次或多次洗涤。在某些实施方案中,相应的th1免疫状态生物标记物多核苷酸是在非常高严格条件下与公开的核苷酸序列(例如,seqidno:3或seqidno:4)杂交的多核苷酸。非常高严格条件的一个实施方案包括在0.5m磷酸钠、7%sds中65℃下杂交,然后在0.2×ssc、1%sds在65℃洗涤一次或多次。其他严格条件是本领域熟知的,并且技术人员将认识到可以操纵各种因素以优化杂交的特异性。优化最终洗涤的严格性可用于确保高度杂交。有关详细的示例,参见ausubel等人,见上文第2.10.1至2.10.16页以及sambrook等人(1989,同上)第1.101至1.104节。9.试剂盒检测和定量本发明的th1免疫状态生物标记物所需的所有必需试剂可以在试剂盒中组装在一起。在一些实施方案中,试剂盒包含允许定量至少一种th1免疫状态生物标记物的试剂。在一些实施方案中,所述试剂盒包含:(i)允许定量第一th1免疫状态生物标记物(例如,确定丰度或水平)的试剂;和(ii)允许定量第二th1免疫状态生物标记物(例如,确定丰度或水平)的试剂。在一些实施方案中,试剂盒还包含(iii)任选允许定量第三th1免疫状态生物标记物(例如,确定丰度或水平)的试剂;和(iv)任选允许定量第四th1免疫状态生物标记物(例如,确定丰度或水平)的试剂。适当地,th1免疫状态生物标记物是pd-l2和pd-l1中的一种或两种。在本发明的上下文中,“试剂盒”应理解为意指含有实施本发明方法所必需的不同试剂的产品,将其进行包装以允许其运输和储存。适用于包装这种试剂盒组成的材料包括水晶、塑料(聚乙烯、聚丙烯、聚碳酸酯等)、瓶子、小瓶、纸、信封等。另外,本发明的试剂盒可以包含用于同时、顺序或单独使用试剂盒所含不同组成的说明书。说明书可以是印刷材料的形式,或者是能够存储说明书的电子支持的形式,使得它们可以被受试者读取,例如电子存储介质(磁盘、磁带等)、光学介质(cd-rom、dvd)等。或者,此外,介质可以包含提供说明书的互联网地址。允许定量th1免疫状态生物标记物的试剂包括允许定量th1免疫状态生物标记物的化合物或材料、或化合物或材料的组。在具体的实施方案中,化合物、材料或化合物或材料的组允许确定多肽(即pd-l2多肽)的水平或丰度。试剂盒还可任选地包括用于检测标记的适当试剂、阳性和阴性对照、洗涤溶液、印迹膜、微量滴定板、稀释缓冲液等。例如,基于蛋白的检测试剂盒可包括(i)th1免疫状态生物标记物多肽(例如,pd-l2多肽和任选pd-l1多肽,其可用作阳性对照),(ii)特异性结合th1免疫状态生物标记物多肽的抗体。或者,基于核酸的检测试剂盒可包括(i)th1免疫状态生物标记物多核苷酸(例如,pd-l2多核苷酸和任选pd-l1多核苷酸,其可用作阳性对照),(ii)特异性与th1免疫状态生物标记物多核苷酸杂交的引物或探针。还包括适合于扩增核酸的酶,包括各种聚合酶(逆转录酶、taq、测序酶tm、dna连接酶等,这取决于所用的核酸扩增技术)、脱氧核苷酸和缓冲液,以提供用于扩增的必要反应混合物。此类试剂盒通常还将以合适的方式包含用于每种单独试剂和酶以及每种引物或探针的不同容器。在具体的实施方案中,试剂盒还包括上文和本文其他地方广泛描述的免疫调节剂。试剂盒还可以具有(例如,一种或多种)各种装置和用于进行本文所述测定之一的(例如,一种或多种)试剂;和/或使用这种试剂盒来定量th1免疫状态生物标记物基因表达的印刷说明书。可任选地与可检测标记结合的本文描述的试剂可以呈现为微流体卡、芯片或室、微阵列或试剂盒的形式,其适于与实施例或下文中描述的测定法一起使用,例如本文所述rt-pcr或qpcr技术。10.诊断方法指示物还可用于确定受试者患有与不希望的th1免疫应答状态相关的疾病的的可能性。在这种情况下,这通常通过将指示物与至少一个指示物参考进行比较来实现,指示物参考指示着疾病,并根据比较结果确定可能性。可用于根据本发明诊断和治疗的th1相关疾病的非限制性示例包括如本文所述的感染性疾病(特别是病毒感染)和增殖性疾病(例如,转移性癌症)。在这种类型的实施方案中,至少一个指示物参考是针对参考群体确定的指示物的分布。例如,如果受试者出现病原性感染的临床症状(例如,肝炎病毒、真菌感染如曲霉菌、人免疫缺陷病毒(hiv)、疟疾、伤寒、霍乱、疱疹病毒、衣原体和hpv),那么参考群体由具有相同或相似疾病的个体组成,并且将用于比较受试者的指示物。在一些实施方案中,使用一个以上的个体的参考群体,来确定受试者患有这种疾病的可能性。例如,第一参考群体由先前诊断并已知具有感兴趣疾病的个体组成,第二参考群体由诊断为具有健康状况的个体组成。在其他实施方案中,th1相关疾病是增殖性或过度增殖性病症,包括任何恶性、或恶变前病症、或由于增殖能力或身体任何细胞或组织行为方面的功能性或其他干扰或异常而引起的或衍生的或相关的任何疾病。因此,本文描述的方法可用于诊断癌症,包括评估癌症是否是转移性癌症的可能性。为了使本发明易于理解并付诸实践,现在将通过以下非限制性实施例的方式描述特别优选的实施方案。实施例实施例1dc上的pd-l2表达与人疟疾严重程度负相关为了确定pd-l1和pd-l2是否影响疟疾免疫,用1800个恶性疟原虫(p.falciparum)感染的红细胞(prbc)感染7名疟疾初始的健康人志愿者,并且在攻击前和攻击后7天检查他们的血液。鉴于它们在发病机理中的重要作用(wykes和good,natrevmicrobial6,864-867,2008),并且因为dc上pd-l1和pd-l2可以下调t细胞的免疫应答(brown等人,j.immunol.170:1257-1266,2003;freeman等人,j.exp.med.192:1027-1034,2000),本发明人研究了由cd11c表达定义的dc。在所有7名志愿者中,90%的dc在感染前表达pd-l1,并且在感染的第7天表达该配体的dc的百分比没有显著变化(图1a)。相反,虽然80%的dc在感染前也表达pd-l2,但7个个体中的5个在感染后第7天显示出显著降低(17-57%)的pd-l2+dc百分比(图1b)。值得注意的是,在感染后第7天,寄生虫血症水平与dc上pd-l2对pd-l1表达的百分比比率之间观察到显著的负相关(图1c)。总体而言,与通常认为pd-l2作为免疫抑制剂的作用相反,在用恶性疟原虫感染后,在具有较低寄生虫血症的个体中,观察到与之相关的更高频率的表达pd-l2的dc。材料和方法人体研究进行临床试验的方法(mccarthy等人,plosone.6:e21914,2011)(clinicaltrials.gov标识符:nct02389348)和用于定量寄生虫血症的pcr方法(rockett等人,malar.j.10:48,2011)在别处有详细描述。每位参与者都给出知情同意。八名健康志愿者中的七名(n=4名男性;n=3名女性)年龄为19-55岁(中位年龄24岁(四分位范围,21-37岁))参与研究,以评估实验性抗疟疾疗法oz439和dsm265的有效性,分别同意参与嵌套在临床试验中的该子研究。该研究得到了qimrberghofer医学研究所(qimr)人研究伦理委员会的批准。志愿者通过静脉注射接受在2.0ml盐水中的约1800个恶性疟原虫prbc。第七天(指定开始治疗日),参与者被收入研究单位,并在收集血液用于研究后施用研究性抗疟疾药物治疗。实施例2dc上的pd-l2表达与小鼠疟疾严重程度负相关为了理解这些数据的生物学相关性,本发明人接下来研究了四种疟疾小鼠模型。他们选择了四种不同的疟原虫物种/株来感染小鼠,每种都显示出独特的生物学和病原性。当用非致死性约氏疟原虫17xnl株或夏氏疟原虫感染wt小鼠时,每1-3天检查血液中的寄生虫,感染以不同的速率进行,但两组在约30天内清除了感染(图2a)。相反,用约氏疟原虫ym株或柏氏鼠疟原虫anka感染的wt小鼠显示出严重但不同的疾病过程(图2b;根据表3和4监测)。与约氏疟原虫ym株感染相比,柏氏鼠疟原虫的寄生虫血症较低,因为柏氏鼠疟原虫感染的rbc从血液中隐退到深部组织(包括脑),导致致死性脑病。然而,当临床评分≥4时,所有约氏疟原虫ym株和柏氏鼠疟原虫感染的小鼠必须在10天内安乐死(表3和4)。在来自脾脏的dc上检查pd-l1和pd-l2的表面表达,已显示其是小鼠中寄生虫杀死和调节寄生虫特异性免疫应答的主要部位(yadava等人,proc.natl.acad.sci.usa,93:4595-4599,1996)。在初始小鼠的脾脏中大约70%的cd11c+dc表达pdl1,并且这种百分比在柏氏鼠疟原虫和夏氏疟原虫感染的小鼠中增加,但在致死或非致死性约氏疟原虫感染期间没有增加(图3a)。所有四种疟疾感染后,与来自初始小鼠的dc相比,表达pd-l1的dc确实显示pd-l1i的表面表达水平(mfi)增加,非致死性夏氏疟原虫感染的小鼠显示出最大的增加(图3b和4a-f)。相反,来自初始小鼠<5%的脾dc表达pd-l2。这与主要表达pd-l2的人血dc不同,这很可能反映了它们与血液和脾脏的不同来源。此外,pd-l2+dc的百分比在所有疟疾感染期间增加,在非致死性疟疾的小鼠中发现比致死性疟疾的小鼠中显著更大的百分比(图3c和4a-e)。与来自初始小鼠的dc相比,在用除了柏氏鼠疟原虫寄生虫之外的所有寄生虫感染的小鼠中,pd-l2表达dc上的pd-l2染色的mfi也增加(图3d和4a-f)。最后,来自致死性和非致死性约氏疟原虫疟疾的cd11c+dc在pd-l1和pd-l2mrna水平方面显示出类似的增加(图4g),表明图3c中注意到的这些寄生虫之间的pd-l2差异取决于转录后调节或蛋白定位。值得注意的是,来自致死性和非致死性约氏疟原虫感染的dc在pd-l1和pd-l2表达以及mrna方面具有相同的表面水平,但在pd-l2+和非pd-l1+dc的百分比中不同。总的来说,来自所有感染的结果与假设一致,即pd-l2+dc的更高百分比与有利的疾病结果相关。材料和方法小鼠研究从动物资源中心(澳大利亚珀斯)获得8-12周龄的特异性无病原体c57bl/6j(wt)雌性小鼠。将小鼠圈养在qimr动物研究设施中,并且所有程序由qimr动物伦理委员会批准和监测。根据《澳大利亚科学目的动物护理和使用操作规范》(澳大利亚国家健康与医学研究委员会),根据qimr动物伦理批准号a0209-622m进行工作。通过rikenbrc,c57bl/6背景上的pd-1敲除(ko)(pdcd1-/-)小鼠由t.honjo博士友情提供(nishimura等人,science.291:319-322,2001)。在这些研究中使用c57bl/6j背景上的pd-l2ko(liang等人,eur.j.immunol.36:58-64,2006)、pd-l1ko(liang等人,eur.j.immunol.36:58-64,2006)和pd-1ko小鼠,通过pcr测试和/或流式细胞术确认基因被删除了。使用相同的寄生虫,基于先前使用相似测定的研究,来估计样品大小。对于具有多个组的实验,首先感染所有小鼠,然后随机分配到治疗组中。没有采用盲法。寄生虫感染和监测用新鲜地获自先前感染的c57bl/6j小鼠的105约氏疟原虫17xnl株、105夏氏疟原虫as株、104约氏疟原虫ym株、或104柏氏鼠疟原虫anka株寄生的红细胞(prbc)静脉内感染3-6只wt小鼠的组群。这些寄生虫剂量先前显示出在大约相同的时间内产生明显的寄生虫血症。每1-2天制备尾尖血膜,使用quickdip改良的wright-giemsa染色(thermofisherscientific)进行染色并检查寄生虫血症,持续长达60天。在寄生虫血症>1%期间,通过计数至少300个rbc,并且计数在其他时间20个视野约10,000个细胞,来评估prbc的百分比。几个图中显示的平均百分比寄生虫血症是来自组中各个小鼠总rbc的平均百分比prbc。每天监测小鼠的贫血和疾病的身体症状,包括姿势(弓背)、缺乏活动和皮毛纹理。如果它们显示出如下表3和4中所述的显著窘迫迹象,则对小鼠实施安乐死。表3标准0级1级2级体重减轻<10%10至25%姿势正常仅在静息时弓背(hunching)弓背严重,影响活动活动正常轻微至中度降低静止不动,除非受到刺激毛发纹理正常轻微至中度褶皱严重褶皱/外观不良血红蛋白正常<50g/l<20g/l约氏疟原虫ym株的症状包括贫血性呼吸窘迫、血尿和并发症(如昏迷和惊厥),但从未患脑疟疾。实验期间,每天通过上述标准监测小鼠的窘迫,以确定研究中描述的治疗是否导致小鼠窘迫到应被安乐死的程度。通过这些评估标准,如果累积评分达到3以上,或者如果体重减轻超过25%,则对窘迫小鼠实施安乐死。表4症状评分感染后的天数毛发褶皱15弓背15步态摇摆16肢体瘫痪16抽搐16-7昏迷16-7柏氏鼠疟原虫引起致死性脑病,并且在感染后第7天症状通常是明显的。评估是累积的,累积评分=4的小鼠被安乐死。值得注意的是,皱褶的毛发和弓背是一般的临床症状,而(斜体显示的)其他症状是脑疟疾的症状。流式细胞术加工的血液或脾细胞的单细胞悬浮液,用如下所示荧光团-缀合的抗体组合进行标记。fixableviability染料efluor780(ebioscience)用于从分析中排除死细胞。通过流式细胞术预先测试每种抗体的系列稀释,以确定主要测定的最佳浓度。抗cd16/32(克隆2.4g2,bd)用于阻断非特异性fc结合。固定和透化细胞后,用bdpharmingentranscriptionfactorbuffer套装标记星号表示的细胞内标记物。使用bdlsrfortessa流式细胞仪和bdfacsdiva软件进行数据采集。使用fcsexpress(denovosoftware)或flowjo(treestar)进行数据分析。表5实施例3pd-l2是存活和控制寄生虫所必需的为了确定pd-l2对控制疟疾寄生虫的贡献,本发明人接下来检查了与wt小鼠相比,pd-l2ko小鼠中约氏疟原虫17xnl株感染的结果(liang等人,eur.j.immunol.36:58-64,2006)(在c57bl/6j背景上)。所有wt小鼠在27天内清除感染(图5a)。然而,在第13天之后,pd-l2ko小鼠具有比wt小鼠显著更高的寄生虫血症,并且所有这些小鼠死亡或由于临床评分≥4(图6b)在第19天需要被执行安乐死(图5a和图6a)。因此,pd-l2表达是寄生虫控制以及从约氏疟原虫17xnl株感染中存活所必需的。为了证实观察,即pd-l2是从约氏疟原虫17xnl株感染中存活所必需的,当发现寄生虫在血液中可检测到时,发明人接下来用单克隆抗体阻断pd-l2。对于该实验,wt小鼠用约氏疟原虫17xnl株感染并在感染后4天给予抗pd-l2或对照大鼠igg,并且每3-4天进行施用直至感染后14-18天。所有接受大鼠igg的wt小鼠在32天内存活并清除感染(图5b和图6c)。相比之下,尽管在抗pd-l2和对照抗体治疗组中寄生虫的控制程度相似(图5b和图6c),但由于症状严重,100%的给予pd-l2阻断抗体的感染小鼠死亡或在第19天被安乐死(图6d)。这与pd-l2ko小鼠形成对比,pd-l2ko小鼠在第13天后显示出显著更高的寄生虫血症(图5a),表明抗体没有完全抑制功能,或者在阻断之前,4天的pd-l2功能部分改善了免疫。为了进一步探索pd-l2在防止另一种非致死性感染中的作用,如针对约氏疟原虫17xnl株的实验,用非致死性夏氏疟原虫疟疾感染wt小鼠并用抗pd-l2或大鼠igg治疗(图5c和图6e)。在急性感染期间(第8天;注意对数标度),来自两组的小鼠均存活,但pd-l2的阻断显著增加了寄生虫血症,导致慢性感染期(>21天)的寄生虫血症普遍较高并且将寄生虫清除延迟4天(箭头表示在大鼠igg处理的小鼠中寄生虫清除;图5c)。总体而言,这些保护/存活研究表明,pd-l2表达是更好地控制非致死性疟疾和从约氏疟原虫17xnl株疟疾中存活所必需的。实施例4pd-l2改善小鼠中的寄生虫特异性cd4+t细胞应答本发明人接下来关注了解,为什么当pd-l2被阻断时小鼠不能从非致死性约氏疟原虫17xnl株的感染中存活。因此,他们重复上述阻断实验并在第7天和第14天收集脾脏以通过多种免疫测定进行评估。首先,检测cd4+t细胞tbet(一种th1cd4+t细胞的效应功能所需的转录因子)的表达,已知它们可以介导对疟疾的保护作用(kumar和miller,immunollett,25:109-114,1990;stephens和langhorne,plospathog,6:e1001208,2010;以及su和stevenson,jimmunol,168:1348-1355,2002)。还评估t细胞的cd62l(在初始t细胞上发现的标记物)表达,还区分了中枢记忆(cd62lhi)和效应记忆(cd62llo)t细胞(图7a)。与初始小鼠(第0天;图8a)相比,在给予大鼠igg的对照小鼠中,而非pd-l2阻断的小鼠中(图8b;p>0.05),第7天每个脾脏中表达tbet的cd62lhicd4+t细胞的数目显著增加(图8b;p<0.0095)。到第14天,对照小鼠每脾脏分别比给予抗-pd-l2抗体的小鼠具有高2.2倍和3倍的表达tbet的cd62lhi和cd62llocd4+t细胞(图8c)。类似地,通过对培养物中寄生虫抗原msp119应答的测量,第14天对照小鼠中分泌ifn-γ的寄生虫特异性cd4+t细胞数目比pd-l2阻断的小鼠高>5倍(图8d)。体外edu摄取测定证实,对照小鼠具有更高数目的寄生虫特异性cd4+t细胞,其在对寄生虫抗原的应答中增殖(图8e)。然而,pd-l2阻断不显著影响血清ifn-γ的水平(图8f)。相反,到第14天,pd-l2阻断的小鼠比对照小鼠具有多两倍的血清il-10(图8g)。与对照治疗的小鼠相比,该结果与用pd-l2阻断所观察到的每个脾脏中调节性t细胞(treg)数目的显著增加相关(图8h)。在用约氏疟原虫17xnl株感染的pd-l2ko小鼠进行的研究中还发现,与感染的wt小鼠相比,在第14天每个脾脏显示显著更少数目的表达tbet且分泌ifn-γ的寄生虫特异性cd4+t细胞(图7b和c)。最后,与感染的wt小鼠相比,在感染的pd-l2ko小鼠或给予抗pd-l2阻断性抗体的感染小鼠中,在第14天每个脾脏中分泌ifn-γ的寄生虫特异性cd8+t细胞没有显著减少(图7d)。总之,数据显示pd-l2表达对于抗约氏疟原虫17xnl株疟疾的有效th1cd4+t细胞应答是必需的。鉴于dc上pd-l2与pd-l1表达的较高比率与较低的寄生虫血症相关,并且pd-l2的阻断导致th1应答降低,因此假设pd-l2可能抑制pd-l1功能,pd-l1被报道认为抑制th1应答(liang等人,eur.j.immunol.36:58-64,2006)。此外,pd-l2阻断导致感染约氏疟原虫17xnl株而非夏氏疟原虫疟疾的小鼠死亡。在比对中,相较于夏氏疟原虫疟疾(horne-debets等人cell.reports.5:1204-1213,2013),先前显示在约氏疟原虫17xnl株的急性期(butler等人,nat.immunol.13:188-195,2012)pd-l1/pd-1介导的免疫抑制更强。因此,我们得出结论,pd-l2介导的对pd-l1/pd-1介导的免疫抑制的抑制,可以解释两种感染之间pd-l2阻断的不同结果。实施例5pd-l1和pd-l2在dc上的共表达对免疫的确定作用本发明人接下来进行dc转移研究以确定dc上的pd-l1表达是否导致疟疾的致死性。为此,wt和pd-l1ko小鼠用致死性约氏疟原虫ym株疟疾感染,在感染后第7天分离dc(图9a和eb)并转移至初始小鼠,然后用致死性约氏疟原虫ym株疟疾进行感染。由于临床评分≥4,10天内100%给予了来自wt小鼠的dc的小鼠必须被安乐死,所有给予了来自pd-l1ko小鼠的dc的小鼠存活(图9c)并清除感染(图9d和9e)。这项转移研究表明,dc上的pd-l1导致死亡,因为小鼠被给予了具有丰富pd-l1但pd-l2很少的dc(参见图3a、c和图4d),而不能存活,而所有给予pd-l1kodc的小鼠存活。然后用致死性约氏疟原虫ym株感染wt和pd-1ko小鼠以证实pd-1途径是约氏疟原虫ym株疟疾致死性的原因。由于临床评分≥4,第10天必须对100%的wt进行安乐死,所有pd-1ko小鼠均存活(图9f)并清除感染(图9g和9h),证实pd-1/pd-l1途径驱动约氏疟原虫ym株感染的致死性。总体而言,这些研究表明pd-1和pd-l1介导了疟疾的致死性。鉴于pd-l2表达与从疟疾中存活相关,发明人接下来研究了dc上pd-l2与pd-l1共表达如何调节免疫。之前的研究表明,dc上的pd-l1与cd8+otit细胞上的pd-1之间的相互作用导致配体诱导的t细胞受体(tcr)下调(karwacz等人,embo.mol.med.3:581-592,2011)。进行实验以研究dc上pd-l2与pd-l1共表达是否可以抑制pd-l1介导的tcr下调和诱导型t细胞共刺激物(icos)表达。为此,从感染的小鼠(1:5细胞)培养纯化的dc和t细胞,用抗体阻断pd-1、pd-l1或pd-l2功能,并在36小时后检测t细胞的cd3高表达、tcr组分和高icos表达,其可以指示t细胞活化(图4i-4n)。在dc:t细胞培养物中,用抗pd-1抗体阻断pd-1信号转导至t细胞,显著增加cd3和icos的表达,表明pd-1信号下调这些分子在t细胞上的表达(图4k和4n)。当用抗体阻断pd-l1信号,仅使pd-l2起作用时,t细胞具有显著增加的icos和cd3水平(图4l和4n)。相反,当阻断pd-l2,使pd-l1功能完整时,cd3和icos显著丧失(图4m和4n)。总之,这些发现表明,在来自约氏疟原虫17xnl株感染小鼠的细胞中,dc上的pd-l1表达可能抑制t细胞活化,而pd-l2似乎促进cd3和icos表达。材料和方法dc转移研究cd11c+dc获自用104约氏疟原虫ym株(致死)prbc感染的wt和pd-l1ko小鼠的脾脏。感染后4天,每天用250μg嘧霉胺治疗小鼠,持续4天以清除感染。在第7天,使用dynaldc富集试剂盒消化脾脏并富集dc。在automac上运行样品以除去残留的dynal标记细胞和疟原虫色素。通过用抗cd11cmacs珠标记dc并在automacs上分离,获得高度纯化的dc。然后将约1.5×107dc静脉内输注至初始小鼠。将小鼠静息15小时以上之后,用致死剂量的约氏疟原虫ym株(104prbc)使它们感染。当监测停止时,跟踪小鼠48天。dc-t细胞培养用105约氏疟原虫17xnl株prbc感染小鼠,并在感染后第14天,消化脾脏并使用cd90.2macs珠分离总t细胞,以最小化对tcr的任何影响。然后使用dynaldc富集试剂盒从剩余的脾细胞中分离dc。在至少一式三份孔中,用约2×105个dc培养大约106个t细胞。对照或阻断性抗pd-1(rmp1-14)、抗pd-l1(10f.9g2)或抗pd-l2(ty25)抗体以20μg/ml的浓度添加至培养物中。培养36小时后,洗涤细胞,并进行标记用于流式细胞术。在活cd4+cd62llopd-1+t细胞上评估cd3和icos表达。实施例6转移性癌症患者的dc上pd-l2的表达为了提供额外的概念验证数据,比较来自患有良性病变或转移性黑色素瘤的患者的血液dc。在患有转移性疾病的患者中观察到pd-l2+dc的显著丧失(参见图10)。虽然健康志愿者%pd-l2:%pd-l1的比率为约0.9,但在转移性黑色素瘤期间该比率下降至0.4至0.8之间。有趣的是,在患有局部病变(即良性肿瘤)的患者中,%pd-l2:%pd-l1比率增加至0.9至1.3之间。基于全身性疟疾和癌症的发现,似乎pd-l2,但不是pd-l1预测th1免疫应答相关系统性疾病的严重程度。总体而言,预测pd-l2水平在自身免疫疾病期间增加,其驱动破坏性免疫效应细胞的扩增。具有较高比例的局部病变的患者反映了这一点。实施例7pd-l2多聚化指示th1免疫状态本发明人假设多聚化可溶性pd-l2(spd-l2)将竞争pd-l1以结合th1细胞上的pd-1,从而降低pd-l1对t细胞功能的抑制作用。为了测试这一点,产生含有与人iggfc部分融合的小鼠pd-l2细胞外结构域的质粒构建体,并通过geneart(lifetechnologies;德国)转染到哺乳动物细胞中。使用蛋白g柱从培养物上清液中纯化可溶性二聚化pd-l2ig蛋白(pd-l2)。该蛋白显示具有<0.2eu/ml内毒素。根据制造商的说明,通过带有ez-连接的-磺基-nhs生物素的生物素化二聚体pd-l2使pd-l2多聚化,通过试剂盒所测量的,获得每pd-l2二聚体2-5个生物素分子,以测量生物素化水平(pierce,us)。通过使蛋白通过pd-10柱除去过量的生物素。将生物素化的pd-l2与链霉亲和素(cedarlane,us)以4:1摩尔比混合,产生多聚化pd-l2嵌合多肽,其中大部分为八聚体形式。通过蛋白测定法测试每批链霉亲和素,因为小瓶中提供的量超过购买量。针对每批链霉亲和素进行了比率优化,因为每批具有不同的活性(例如,6:1)。用低百分比天然sds-page凝胶进行的蛋白印迹研究证实,蛋白多聚化为具约300-400kda条带的八聚体。接下来,用致死性约氏疟原虫ym株或柏氏鼠疟原虫感染野生型小鼠,并在寄生虫血症可测量后第3天,然后在感染后第5天和第7天施用pd-l2。用约氏疟原虫ym株感染并用对照人igg(对照ig)治疗的所有野生型小鼠死亡或必须在10天内安乐死(图11a-c)。类似地,二聚化pd-l2不提供任何对增加的寄生虫血症的保护作用(图11d)。相反,用pd-l2治疗的92%的约氏疟原虫ym株感染的小鼠(n=12)存活,并在25天内以较少的症状清除感染(图11a-e)。将所有存活小鼠静息至第150天,连同新的年龄匹配的初始对照小鼠(对照ig-r)一起,用相同剂量的致死性约氏疟原虫ym株疟疾再次攻击(不施用额外的pd-l2;图11a)。先前用pd-l2治疗的所有小鼠在没有症状的情况下从再感染中存活,并且8只小鼠中只有4只显示任何寄生虫血症,如图11b中的对数标度所示。在再感染后20天内,80%的这些经spd-l2治疗的再感染小鼠完全清除了感染,因为从这些小鼠向初始小鼠转移200μl血液并未转移感染(图11f)。相比之下,第二组年龄匹配的对照小鼠死于感染,证实了用于再感染的寄生虫的致死性(图116c)。总之,在用约氏疟原虫ym株感染后,多聚化pd-l2可以克服pd-l1介导的致死率。同样地,100%感染柏氏鼠疟原虫的对照小鼠在8天内发展出实验性脑疟疾的症状(ecm)(图11g),并在第10天死于感染(图11h)。用spd-l2治疗的柏氏鼠疟原虫感染的小鼠只有22%发生脑疟疾,如ecm评分所见(图11g)。此外,存活小鼠控制感染约20天(图11h和i),死于最后一剂pd-l2后的13天。额外的剂量没有改善存活(数据未显示)。总之,施用多聚化pd-l2显著改善了从致死性感染中的存活,并降低了临床症状的严重程度,尤其是对于脑疟疾。实施例8十二聚化pd-l2增强对肿瘤的免疫应答设计可溶性嵌合pd-l2多肽,其自组装成十二聚体。该嵌合多肽含有与人iggfc部分融合的小鼠pd-l2细胞外结构域、以及c-末端α-尾部(小鼠pd-l2-fc-atp),并具有以下氨基酸序列:大写和下划线字体的序列代表小鼠pd-l2信号肽的氨基酸序列;小写字体的序列对应于小鼠pd-l2胞外域的氨基酸序列;斜体小写字体的序列代表小鼠pd-l2跨膜结构域部分的氨基酸序列;大写字体的序列对应于人igg1的fc多肽的氨基酸序列;以及粗体大写字体的序列代表iga分子α尾部(αtp)的氨基酸序列。表达编码嵌合多肽的dna序列的构建体由geneart(lifetechnologies;德国)转染到专属哺乳动物细胞中,并使用蛋白g柱从培养上清液中纯化大部分可溶性十二聚化pd-l2-ig蛋白(spd-l2),然后fplc分馏以排除蛋白的二聚体形式。该蛋白显示具有<0.2eu/ml内毒素。接下来,建立的b16.f0和b16.f10黑色素瘤细胞系在实验室中生长,并且在c57bl/6小鼠中皮下分别植入5×105或1×105个细胞。为了确定spd-l2对晚期黑色素瘤的作用,当b16.f0肿瘤在约第9天达到100mm3体积时,在第9、11和13天给予小鼠200μg人igg或spd-l2,并且每1-2天监测肿瘤尺寸。出于伦理原因,如果肿瘤>1000mm3或显示任何溃疡或不适症状,则小鼠被安乐死。该研究的结果如图12所示,清楚地表明spd-l2增强对晚期黑色素瘤的免疫应答,并对晚期黑色素瘤产生保护作用。还研究了spd-l2对早期肿瘤的作用。在这些实验中,肿瘤达到约50mm3体积时,在约第3天左右植入b16.f10细胞,并且在第3、9和15天用200μg人igg或spd-l2治疗小鼠。该研究的结果(参见图13)显示spd-l2提供针对黑色素瘤的早期保护。本文引用的每篇专利、专利申请和出版物的公开内容通过引用整体并入本文。任何参考文献的引用不应被解释为承认这样的参考可用作本申请的“现有技术”。在整个说明书中,目的是描述本发明的优选实施方案,而不是将本发明限制于任何一个实施方案或具体的特征集合。因此,本领域技术人员将理解,根据本公开内容,在不脱离本发明范围的情况下,可以对示例的具体实施方案进行各种修改和改变。所有这些修改和改变都包括在所附权利要求的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1