一种编码rhFGF‑6的核酸片段、表达载体、宿主细胞、生产方法及应用与流程
本发明涉及生物医药领域,具体而言,涉及一种编码rhfgf-6的核酸片段、表达载体、宿主细胞、生产方法及应用。
背景技术:
成纤维细胞生长因子-6(fibroblastgrowthfactor-6,fgf-6)是fgf家族成员之一,属fgf4亚家族(fgf4、fgf5、fgf6)。人fgf-6基因定位于人类染色体12p13,共有约15kb的三个外显子,其编码的蛋白由208个氨基酸残基组成单链多肽,n端有约37个氨基酸残基的疏水信号肽序列,成熟蛋白有171个氨基酸(38-208氨基酸残基),其理论分子质量为19kda,等电点约为9.73。人fgf-6与鼠的氨基酸序列具有93.3%的高度同源性。哺乳动物fgf-6位点上的比较基因组学显示出人类、大鼠和小鼠fgf-6启动子是高度保守的。在结构上,fgf-6与fgf基因家族的其它成员是非常相似的,尤其与fgf-4(70%)、fgf-5(49%)具有高度的序列同源性。体内外的研究表明,fgf-6在分化发育、骨生成、肿瘤形成和其他细胞发育过程中也发挥着重要的作用。
先天性心脏病是指在胚胎发育时期由于心脏发育障碍而导致心脏形态、功能异常的疾病。pax-8基因在调节心脏发育和心肌细胞凋亡的中有着重要作用,而pax-8基因敲除小鼠的心脏中发现fgf-6的表达显著上调,表明fgf-6是pax-8的下游基因而受到其调控。lins等将携带fgf-6基因的重组真核表达载体转染至大鼠h9c2心肌细胞中,使其得到有效过表达,测得心肌细胞的增殖能力变强,能抵抗由血清饥饿引起的细胞凋亡。(zhangj,etal.chinesejournalofpathophysiology,2009,25(7):1292-1297;gaoz,plamedicaljournal,2009,34(9):1082-1084;huangx,zhejiangx,zhejiang.medicine,2010(11):1591-1593;lins,etal.journalofwenzhoumedicalcollege,2013,43(1):9-14.)
grass等研究发现fgf-6和tgfβ-2可以协同刺激软骨结节的形成,诱导hmsc的定向分化与增殖,以应用到软骨组织修复中。bosettim等研究发现fgf-6可能是一个重要的调节骨生成和骨重构的因子,其在成骨细胞和破骨细胞中的活性证明了这一点,并推测fgf-6是通过rankl激活map激酶的信号传导途径,随后激活破骨细胞,完成骨生成。(hunzikereb,etal.oars,2002,10(6):432-463;dozinb,etal.matrixbiol,2002,21(5):449-459;jiangy,nature,2002,418(6893):41-49;grasss,development,1996,122(1):141-150;bosettim,jcellphysiol,2010,225(2):466-471.)
通常采用微生物发酵的方式生产rhfgf-6(recombinanthumanfgf-6,重组人fgf-6),但是现有技术中微生物发酵表达rhfgf-6的表达量以及所表达的rhfgf-6的活性都很低,难以满足规模化应用的需求。
技术实现要素:
本发明的目的之一在于提供一种编码rhfgf-6的核酸片段,其核苷酸序列如seqidno.1所示。该核酸片段消除了不利于表达的二级结构,并且不改变fgf-6的氨基酸序列。
本发明的目的之二在于提供一种包含上述编码rhfgf-6的核酸片段的表达载体,将该表达载体转化进入宿主细胞,得到重组菌,培养该重组菌,用诱导剂进行诱导表达,能高表达rhfgf-6。
本发明的目的之三在于提供一种包含上述表达载体的宿主细胞,培养该宿主细胞,用诱导剂进行诱导表达,能高表达rhfgf-6。
本发明的目的之四在于提供一种运用包含上述核酸片段的宿主细胞生产rhfgf-6的方法,应用该方法生产的rhfgf-6表达量高,活性高。
本发明的目的之五在于提供rhfgf-6在制备促进肌肉组织再生、促进骨生成、修复心肌损伤、促进创伤愈合或促进血管再生的药物中的应用。
本发明解决其技术问题是采用以下技术方案来实现的。
一种编码rhfgf-6的核酸片段,其核苷酸序列如seqidno.1所示。
一种表达载体,其包含上述的编码rhfgf-6的核酸片段。
含有上述的表达载体的宿主细胞。
一种生产rhfgf-6的方法,其包括将上述的编码rhfgf-6的核酸片段转化至宿主细胞,得到重组菌,培养该重组菌,用诱导剂进行诱导表达,得到蛋白样品,蛋白样品经纯化处理后,得到纯净的rhfgf-6。
本发明实施例的一种编码rhfgf-6的核酸片段、表达载体、宿主细胞、生产方法及应用的有益效果是:本发明提供的编码rhfgf-6的核酸片段根据fgf-6的天然序列(如seqidno.2所示)优化而得,在天然序列的基础上去除了37个信号肽,消除了不利于表达的二级结构,但是不改变fgf-6的氨基酸序列,将此核酸片段构建到载体构成重组表达载体,再将重组表达载体转化进入宿主细胞,得到重组菌,培养该重组菌,用诱导剂进行诱导表达,能够高表达rhfgf-6,并且表达的rhfgf-6具有促进肌肉组织再生、促进骨生成、修复心肌损伤、促进创伤愈合或促进血管再生的活性。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为实施例2中提供的pet3a-rhfgf-6的重组表达载体图;
图2为实施例2中提供的pet3a-rhfgf-6重组载体酶切鉴定图;
图3为实施例2中提供的rhfgf-6诱导表达的westernblot鉴定以及sds-page分析图;
图4为实施例3中阳离子交换柱层析及肝素亲和柱层析的sds-page图;
图5为实施例3中纯化后的rhfgf-6的hplc分析图;
图6为实施例6中mtt法测定rhfgf-6促进细胞增殖活性的验证图;
图7为实施例7中不同浓度rhfgf-6对氧化损伤模型的保护作用的验证图;
图8为实施例7中各组促增殖相关蛋白的westernblot及灰度值分析图;
图9为实施例7中各组凋亡相关蛋白的westernblot及灰度值分析图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的一种编码rhfgf-6的核酸片段、表达载体、宿主细胞、生产方法及应用进行具体说明。
发明人优化了天然的fgf-6序列(如seqidno.2所示),去掉了37个信号肽,得到了优化后的核酸片段序列(如seqidno.1所示),该序列消除了不利于表达的二级结构,并且不改变fgf-6的氨基酸序列。
本发明提供了含有上述编码rhfgf-6的核酸片段的表达载体,将该表达载体转化进入宿主细胞,得到重组菌,培养该重组菌,用诱导剂进行诱导表达,能高表达rhfgf-6。
优选的,该表达载体为原核表达载体。
优选的,该原核表达载体为pet3a、pet3c、pet14b或pet28a中的任意一种。
更优选的,该原核表达载体为pet3a。
本发明提供了含有上述表达载体的宿主细胞,培养该宿主细胞,用诱导剂进行诱导表达,能高表达rhfgf-6。
优选的,该宿主细胞选自大肠杆菌bl21、c41或rosetta中的任意一种。
更优选的,该宿主细胞为bl21(de3)plyss。
本发明提供了一种生产rhfgf-6的方法,其将上述的核酸片段转化至宿主细胞,得到重组菌,培养该重组菌,用诱导剂进行诱导表达,得到蛋白样品,蛋白样品经纯化处理后,得到纯净的rhfgf-6。具体包括如下步骤:
(1)将上述核酸片段构建到上述表达载体,得到重组表达载体。
(2)将上述重组表达载体转化进入上述宿主细胞,得到重组菌。
(3)培养上述重组菌,用诱导剂进行诱导表达,得到蛋白样品,蛋白样品经纯化处理后,得到纯净的rhfgf-6。
具体地,培养重组菌包括:将重组菌以1:50-100(v:v)的比例接种至lb培养基中进行活化培养,培养至a600达到0.8-1.0,得到活化培养液;然后按1:10-20(v:v)的比例将活化培养液接种至含有磷酸盐缓冲对的lb培养基中进行扩大培养,培养至a600达到3-5,得到扩大培养液;再按1:10-20(v:v)的比例将扩大培养液接种至含有罐内培养基的发酵罐中,并加入无机盐及生长因子,以温度37℃、ph值6.8-7.0、调节搅拌转数和通气量以及流加碳源保持do>25%,至a600达到20-25(对数生长中期);加入诱导剂进行诱导表达。
诱导剂可选用iptg(异丙基-β-d-硫代半乳糖苷)或乳糖。
优选的,所用诱导剂为乳糖,并且乳糖的终浓度为28-32mm。
iptg是外源蛋白高效表达的诱导剂,但其价格昂贵且对人体有潜在毒性,而乳糖廉价易得且无毒,这对于重组外源蛋白的工程化生产具有重要意义。本发明中,乳糖诱导外源蛋白表达量与iptg诱导效果相当,但其产物量则大大超过iptg诱导,外源蛋白的可溶性表达量也有所增加。
优选的,诱导表达的条件为:ph7.0-7.2,33-35℃下,诱导表达4h-6h。
具体地,变性处理以及纯化包括如下步骤:
(1)菌体的收集以及破碎
诱导表达结束后,低温高速离心收集菌体,-20℃冻存备用。将菌体室温融化后,以1:20-40(g:ml)比例充分悬浮于细胞裂解缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,1mmpmsf,5mmdtt,ph7.5),进行高压均质。镜检下可见视野范围内无完整大肠杆菌后,低温高速离心,弃上清,收集沉淀。
(2)包涵体清洗
取上述沉淀,加入10-20倍(g:ml)量清洗缓冲液1(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,0.5%去氧胆酸钠,ph7.3)室温充分搅拌洗涤后低温高速离心,弃上清,收集沉淀。再加入10-20倍(g:ml)量清洗缓冲液2(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,ph7.3)室温充分搅拌洗涤后,低温高速离心,弃上清,收集沉淀。再加入10-20倍(g:ml)量清洗缓冲液3(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,2m脲,ph7.3),室温充分搅拌洗涤后,低温高速离心,弃上清,收集沉淀即为包涵体。
(3)包涵体变性
称取适量包涵体,加入10-20倍(g:ml)量变性缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,8m脲,ph7.3),充分悬浮,并在磁力搅拌条件下低温溶解过夜后,低温高速离心去除未溶物,即得包涵体的变性溶液。
(4)包涵体的纯化
包涵体的纯化包括复性后纯化、纯化后复性以及柱上复性三种方法。
其中,包涵体的复性包括稀释复性和透析复性两种方法,具体地:
(a)稀释复性:取包涵体变性溶液,在4℃磁力搅拌条件下,缓慢滴入10-40倍(v:v)体积复性缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,ph7.3),复性过程18h-24h。复性完毕,低温高速离心去除沉淀或采用中空纤维超滤装置进行初步分离,所采用的截留分子量为10kd。
(b)透析复性:取包涵体变性溶液,装入截留分子量为7kd的透析袋中,在低温磁力搅拌条件下,放入20-50倍(v:v)复性缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,5mmdtt,ph7.3),复性液中还可添加氧化/还原型谷胱甘肽、精氨酸或甘油。8h-12h小时更换复性液,共3-4次。复性完毕,低温高速离心去除沉淀或采用中空纤维超滤装置进行初步分离,所采用的截留分子量为10kd。
复性后纯化,即将变性后的包涵体溶液经上述复性方法复性后,先后经过阳离子交换层析以及肝素亲和层析纯化,得到纯净的rhfgf-6。
纯化后复性,即将变性后的包涵体溶液经阳离子交换层析,经上述复性方法复性后,最后再进行肝素亲和层析,得到纯净的rhfgf-6。
柱上复性,即将变性后的包涵体溶液先经阳离子交换层析柱上复性及纯化,再经肝素亲和层析纯化,得到纯净的rhfgf-6。
上述三种方法中,阳离子交换层析所用的填料为cm或sp阳离子交换填料,肝素亲和层析所用的填料为heparinsepharose亲和层析填料。
本发明还提供了采用上述方法制备的rhfgf-6的生物学活性检测方法。
首先,用mtt比色法检测了rhfgf-6对小鼠胚胎成纤维细(nih3t3)、小鼠成肌细胞(c2c12)以及大鼠心肌细胞(h9c2)的增殖的影响。结果显示,rhfgf-6具有良好的促进成纤维细胞及成肌细胞增殖的活性,但对正常心肌细胞增殖活性不明显。然后,用mtt比色法以及免疫印迹分析(westernblot)检测了rhfgf-6对双氧水导致的心肌细胞损伤的修复作用。结果显示,rhfgf-6具有良好的修复心肌细胞损伤的作用。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例中提供一种编码rhfgf-6的核酸片段。
该核酸片段的核苷酸序列如seqidno.1所示。该序列由人fgf-6的天然序列(如seqidno.2所示)根据大肠杆菌偏好性进行密码子优化,去除了37个信号肽,消除了不利于表达的二级结构,但不改变fgf-6的氨基酸序列。
将本实施例提供的核酸片段构建到表达载体,并将此重组表达载体转化到宿主细胞,得到重组菌,培养该重组菌,用诱导剂进行诱导表达,能获得高表达rhfgf-6。
实施例2
本实施例提供一种生产rhfgf-6的方法,包括如下步骤:
2.1构建重组表达载体
合成rhfgf-6基因,在编码rhfgf-6的核酸片段(seqidno.1)的5’端与3’端分引入起始密码子和终止密码子,并引入特异性酶切位点ndeⅰ和bamhⅰ。
37℃下用ndeⅰ和bamhⅰ双酶切分别处理表达载体pet3a和rhfgf-6基因,酶切4h。
回收相应的酶切片段,用t4dna连接酶16℃连接过夜,构建重组表达载体。pet3a-rhfgf-6重组表达载体图如图1所示。
2.2重组表达载体的转化及鉴定
将重组表达载体pet3a-fgf-6转化进入宿主细胞:大肠杆菌bl21(de3)plyss中,在含有载体抗性的lb平板上挑选阳性克隆,并进行质粒双酶切(酶切位点是ndeⅰ和bamhⅰ)鉴定。
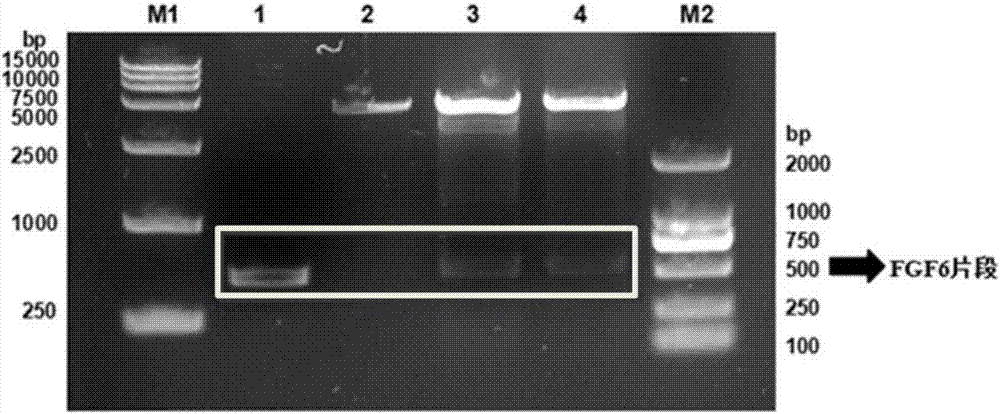
鉴定结果如图2所示(图中,m1为dnamarkerdl15000;1为fgf6cdna;2为pet-3a空载体;3、4分别为pet-3a-fgf6重组表达载体;m2为dnamarkerdl2000)。重组表达载体经酶切后,在500bp附近出现条带,表明编码rhfgf-6的核酸片段正确插入载体中。
对克隆序列进行正向、逆向序列分析测定,测定结果证实克隆序列与设计序列完全一致。即本步骤中成功构建了pet3a-rhfgf-6重组表达载体,并将其转化进入宿主细胞bl21(de3)plyss中,得到重组菌pet3a-rhfgf-6/bl21(de3)plyss。
2.3培养重组菌(pet3a-rhfgf-6/bl21(de3)plyss),诱导表达rhfgf-6
2.3.1活化培养
将pet3a-rhfgf-6/bl21(de3)plyss重组菌以1:100(v:v)的比例接种至lb培养基(包括:10g/l胰蛋白胨,5g/l酵母粉,10g/l氯化钠)中进行活化培养,培养至a600达到1.0,得到活化培养液。
2.3.2扩大培养
按1:20(v/v)的比例将活化培养液接种至含有磷酸盐缓冲对的lb培养基(包括:23g/l胰蛋白胨,17g/l酵母粉,3.5g/l磷酸氢二钾,1.2g/l磷酸二氢钾,4g/l氯化钠,2g/l葡萄糖)中进行扩大培养,培养至a600达到5,得到扩大培养液。
2.3.3罐内培养
按1:20(v/v)的比例将扩大培养液接种至含有罐内培养基(包括:23g/l胰蛋白胨,17g/l酵母粉,3.5g/l磷酸氢二钾,1.2g/l磷酸二氢钾,4g/l氯化铵,1g/l硫酸镁,0.02g/l氯化钙,0.01g/l维生素b1,5g/l葡萄糖以及适量微量元素)的发酵罐中,并加入无机盐及生长因子,温度37℃、ph值7.0、调节搅拌转数和通气量以及加碳源保持do>25%,至a600达到25(对数生长中期)。
2.3.4诱导培养
加入乳糖作为诱导剂,保持终浓度为28mm进行诱导,加入后温度控制在33℃、ph值7.1、并通过调节搅拌转数和通气量以及加碳源、氮源及磷酸盐缓冲溶液保持do>25%,诱导培养3h-6h。
培养重组菌全过程中,每小时取样测a600值,并在诱导前进行镜检。诱导后每小时留样进行sds-page检测以及westernblot鉴定。
sds-page检测以及westernblot鉴定结果如图3所示。其中,图3-a为westernblot鉴定图(1、2、3、4、5的样品分别取自诱导前、诱导3h、4h、5h、6h的培养液),图3-b为sds-page检测分析图(1、2、3、4、5的样品分别取自诱导前、诱导3h、4h、5h、6h的培养液,m为蛋白质分子量标准品)。
由图3-a和图3-b可知,加入乳糖诱导前,重组菌不表达rhfgf-6,诱导后rhfgf-6表达量持续增长,且诱导后6h的rhfgf-6产量及表达量最多。
2.4菌体的收集及破碎
2.4.1菌体的收集
于4℃,9000r/min离心10min收集菌体,收集的菌体-20℃冻存备用。
2.4.2菌体的破碎
将室温冻融的菌体以1:40(g:ml)比例充分悬浮于细胞裂解缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,1mmpmsf,5mmdtt,ph7.5),进行高压均质。以300bar循环1次,再以800bar均质2次,镜检在可见视野范围内无完整大肠杆菌后,4℃,9000r/min离心40min,弃上清,收集沉淀。
2.5包涵体的清洗及变性
2.5.1包涵体的清洗
取上述沉淀,加入20倍(g:ml)量清洗缓冲液1(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,0.5%去氧胆酸钠,ph7.3),室温充分搅拌洗涤2h后,4℃,9000r/min离心30min,弃上清,收集沉淀。再加入20倍(g:ml)量清洗缓冲液2(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,ph7.3),室温充分搅拌洗涤2h后,4℃,9000r/min离心30min,弃上清,收集沉淀。再加入20倍(g:ml)量清洗缓冲液3(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,2m脲,ph7.3),室温充分搅拌洗涤2h后,4℃,9000r/min离心30min,弃上清,收集沉淀即为包涵体。
2.5.2包涵体的变性
称取适量包涵体,加入20倍量(g:ml)变性缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,8m脲,ph7.3),充分悬浮,并在磁力搅拌条件下4℃溶解过夜。4℃,9000r/min离心30min,去除未溶物,即得包涵体的变性溶液。
2.6包涵体的复性
取上述包涵体的变性溶液,先经过阳离子交柱换层析柱上复性及纯化,再经过肝素亲和柱层析纯化,得到rhfgf-6。
2.6.1阳离子交换柱层析
阳离子交换柱层析的层析介质选用cm或sp阳离子交换层析填料。具体地:
用5个柱体积的平衡液(20mmpb,2mmedta-2na,8m脲,0.1mnacl,ph7.3)平衡层析柱至基线稳定。
将包涵体的变性溶液上样。
用5个柱体积的平衡液平衡层析柱至基线稳定。
用100%-0%(v/v)的平衡液以及0%-100%(v/v)的复性液(20mmpb,2mmedta-2na,0.1mnacl,ph7.3)进行梯度复性。此过程中,开始阶段,平衡液输出100%,复性液输出0%;随后进行梯度洗脱,平衡液输出逐渐减少最终为0%,复性液输出逐渐增加最终为100%,此过程需要12h以上。
复性完成后,用5个柱体积洗脱液(20mmpb,2mmedta-2na,0.6mnacl,ph7.3)清洗层析柱,收取蛋白峰,测定蛋白含量,并进行sds-page检测其纯度。
2.6.2肝素亲和柱层析
肝素亲和柱层析的层析介质选用heparinsepharose亲和层析填料。具体地:
用5个柱体积的平衡液(20mmpb,2mmedta-2na,0.6mnacl,ph7.3)平衡层析柱至基线稳定。
将经阳离子交换柱层析收集的蛋白洗脱液上样。
用5个柱体积的平衡液平衡层析柱至基线稳定。
用5个柱体积洗脱液1(20mmpb,2mmedta-2na,1.2mnacl,ph7.3)清洗层析柱,去除杂蛋白。
用5个柱体积洗脱液2(20mmpb,2mmedta-2na,2.0mnacl,ph7.3)清洗层析柱收取蛋白峰,测定蛋白含量,并进行sds-page检测其纯度。
实施例3
本实施例提供一种生产rhfgf-6的方法,包括如下步骤:
构建表达载体、重组表达载体的转化及鉴定、培养重组菌,诱导表达rhfgf-6、菌体的收集及破碎、包涵体的清洗及变性与实施例2中提供的步骤与方法基本相同,其区别在于,本实施例中诱导培养的条件为:乳糖浓度保持30mm,温度为34℃,ph7.0。除此之外,本实施例提供的生产rhfgf-6的方法还包括:
3.1包涵体的复性
取包涵体变性溶液,装入截留分子量为7kd的透析袋中,在4℃磁力搅拌条件下,放入50倍(v:v)复性缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,5mmdtt,ph7.3),复性液中还可添加氧化/还原型谷胱甘肽、精氨酸、甘油等。12h更换复性液,共4次,得到包涵体复性溶液。复性完毕,离心去除沉淀或采用中空纤维超滤装置进行初步分离,所采用的截留分子量为10kd。
3.2阳离子交换柱层析
阳离子交换柱层析的层析介质选用cm或sp阳离子交换层析填料。具体地:
用5个柱体积的平衡液(20mmpb,2mmedta-2na,0.1mnacl,ph7.3)平衡层析柱至基线稳定。
将包涵体复性溶液上样。
用5个柱体积的平衡液平衡层析柱至基线稳定。
用5个柱体积洗脱液(20mmpb,2mmedta-2na,0.6mnacl,ph7.3)清洗层析柱,收取蛋白峰,测定蛋白含量,并进行sds-page检测其纯度。
3.3肝素亲和柱层析
所用材料以及方法均同实施例2中肝素亲和层析部分。
经阳离子柱层析的rhfgf-6以及肝素亲和柱层析后的rhfgf-6的sds-page检测图如图4所示。图4-a(1、2、3的样品分别取自变性上清、上样穿出液、目的蛋白洗脱峰,m为marker)为经阳离子柱层析的rhfgf-6的sds-page检测图。变性上清中,含有杂蛋白较多,上样穿出液中没有目的蛋白条带,表明目的蛋白与层析介质结合,目的蛋白洗脱峰的目的条带明显,说明目的蛋白rhfgf-6被洗脱下来。图4-b(1、2、3、4的样品分别取自复性后上清、上样穿出液、杂质峰、目的蛋白洗脱峰,m为marker)为经肝素亲和柱层析的rhfgf-6的sds-page检测图,只有1和4有目的条带,并且4没有杂蛋白条带,说明rhfgf-6被高度纯化。
对纯化后的rhfgf-6进行高效液相检测,具体操作如下:
色谱柱采用十八烷基硅烷键合硅胶为填充剂,理论板数应不低于2000;柱温25±1℃、恒温器4±1℃;以a相(0.1%tfa-水溶液:量取1.0ml三氟乙酸加水至1000ml,充分混匀)、b相(0.1%tfa-乙腈溶液:量取1.0ml三氟乙酸加入色谱纯乙腈至1000ml,充分混匀)为流动相,在室温条件下,进行梯度洗脱(10-100%b相),流速1ml/min。样品浓度为1mg/ml,上样量应不低于10μg,在波长280nm处检测。
检测结果如图5所示。样品经过此两步纯化,即离子交换柱层析、肝素亲和柱层析,纯度提高至95%以上。
实施例4
本实施例提供一种生产rhfgf-6的方法,包括如下步骤:
构建表达载体、重组表达载体的转化及鉴定、培养重组菌,诱导表达rhfgf-6、菌体的收集及破碎、包涵体的清洗及变性与实施例2中提供的步骤与方法基本相同,其区别在于,本实施例中诱导培养的条件为:乳糖浓度保持32mm,温度为35℃,ph7.2。除此之外,本实施例提供的生产rhfgf-6的方法还包括:
4.1阳离子交换柱层析
阳离子交换柱层析的层析介质选用cm或sp阳离子交换层析填料。具体地:
用5个柱体积的平衡液(20mmpb,2mmedta-2na,8m脲,0.1mnacl,ph7.3)平衡层析柱至基线稳定。
将包涵体变性溶液上样。
用5个柱体积的平衡液平衡层析柱至基线稳定。
用5个柱体积洗脱液(20mmpb,2mmedta-2na,8m脲,0.3mnacl,ph7.3)清洗层析柱,收取蛋白峰,测定蛋白含量,并进行sds-page检测其纯度。
4.2复性
取经阳离子交换柱层析的蛋白溶液,在4℃磁力搅拌条件下,缓慢滴入40倍体积(v:v)复性缓冲液(20mmpb,2mmedta-2na,0.1mnacl,1%tritonx-100,ph7.3),复性24h,得到复性溶液。复性完毕,离心去除沉淀或采用中空纤维超滤装置进行初步分离,所采用的截留分子量为10kd。
4.3肝素亲和柱层析
对复性溶液进行肝素亲和柱层析。所用材料以及方法均同实施例2中肝素亲和层析部分。
实施例5
本实施例提供一种优化的表达载体与宿主细胞的组合。
按照实施例2中2.1的方法,将实施例1提供的核酸片段,分别构建到载体pet3a、pet3c、pet14b、pet28a中,得到重组载体pet3a-rhfgf-6、pet3c-rhfgf-6、pet14b-rhfgf-6、pet28a-rhfgf-6。并将这些重组载体分别转化进入宿主细胞:大肠杆菌c41(de3)plyss、rosetta(de3)或rosetta(de3)plyss、bl21(de3)、bl21(de3)plyss,得到一系列重组菌。
按照实施例2中的方法培养这些重组菌,在相同条件诱导表达rhfgf-6,并进行sds-page检测以及westernblot鉴定。
结果表明,将核酸片段构建到载体pet3a,并且将重组表达载体pet3a-rhfgf-6转化进入大肠杆菌bl21(de3)plyss时,得到重组菌pet3a-rhfgf-6/bl21(de3)plyss,rhfgf-6的表达量最高,占菌体总蛋白量20.1%。相同条件下,pet3a-rhfgf-6/bl21(de3)、pet3a-rhfgf-6/c41(de3)plyss、pet3a-rhfgf-6/rosetta(de3、pet3a-rhfgf-6/rosetta(de3)plyss中rhfgf-6的表达量占菌体总蛋白量的比例分别为18.2%、15.4%、10.1%及11.8%。
由此可见,将本发明提供的编码rhfgf-6的核酸片段构建到表达载体pet3a得到重组表达载体pet3a-rhfgf-6,将此重组表达载体转入进入宿主细胞大肠杆菌bl21(de3)plyss得到重组菌pet3a-rhfgf-6/bl21(de3)plyss,培养该重组菌,用浓度为28-32mm的乳糖诱导表达rhfgf-6,可使表达的rhfgf-6的含量占菌体总蛋白含量的20.1%。
实施例6
本实施例提供了rhfgf-6在促进细胞增殖中的应用。分别考察了rhfgf-6对nih3t3、c2c12、h9c2的增殖的影响。其包括如下步骤:
6.1细胞传代培养
维持培养液:含10%(v/v)胎牛血清(fbs)、1%(v/v)双抗(青霉素-链霉素)的dmem。
用维持培养液分别培养上述三种细胞。取对数生长期的细胞,用胰酶消化计数后,按8×103/孔的细胞铺板到96孔板,每孔加入100μl维持培养液,于37℃、5%co2的培养箱中培养24h。
6.2饥饿培养
用含0.5%fbs(其余成分同维持培养液)的饥饿培养基继续培养24h。
6.3mtt试验
加入不同浓度(2、4、8、16、32、64、128、256ng/ml)的rhfgf-6蛋白到96孔板中,并且分别设置阴性对照孔和阳性对照孔,其中阴性对照孔分别加入相同梯度浓度的pbs,阳性对照孔分别加入相同梯度浓度的afgf(酸性成纤维细胞生长因子)或bfgf(碱性成纤维细胞生长因子)。加入后继续培养48h后每孔加入25μl的mtt(5mg/ml),再培养4h,吸掉孔中的液体,每孔加入150μldmso,震荡15min,使结晶物充分溶解,用酶联免疫检测仪在490nm下测定各孔吸光度。
rhfgf-6促进细胞增殖的结果如图6所示。图6-a为rhfgf-6对nih3t3增殖活性的影响图(a、b、c、d分别为不同浓度的rhfgf-6、afgf、bfgf、pbs对nih3t3增殖活性的影响曲线),图6-b为rhfgf-6对h9c2增殖活性的影响图(a、b、c、d分别为不同浓度的rhfgf-6、afgf、bfgf、pbs对h9c2增殖活性的影响曲线),图6-c(a、b、c分别为不同浓度的rhfgf-6、afgf(对照品)、pbs对c2c12增殖活性的影响曲线)为rhfgf-6对c2c12增殖活性的影响图。
mtt比色法是一种检测细胞存活和生长的方法。活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt还原为水不溶性的蓝紫色结晶甲瓒(formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(dmso)能溶解细胞中的甲瓒,用酶联免疫检测仪在490nm波长处测定其光吸光度值,可间接反映活细胞数量,吸光度值越高,活细胞数越多。
rhfgf-6对正常h9c2细胞无明显促增殖活性,对nih3t3以及c2c12细胞的促进作用呈剂量依赖性。rhfgf-6浓度在1.5ng/ml-25ng/ml时,对c2c12细胞具有显著的促增殖作用,并呈线性相关。
实施例7
本实施例提供rhfgf-6在双氧水导致的心肌细胞损伤的修复中的应用。其包括如下步骤:
7.1细胞传代培养
维持培养液:含10%(v/v)胎牛血清(fbs)、1%(v/v)双抗(青霉素-链霉素)的dmem。
用维持培养液培养h9c2。取对数生长期的h9c2,用胰酶消化计数后,按8×103/孔的细胞铺板到96孔板,每孔加入100μl维持培养液,于37℃、5%co2的培养箱中培养24h。
7.2制备h9c2氧化损伤模型
取对数生长期的h9c2细胞,按1×104/孔的细胞铺板到96孔板,每孔加入100μl维持培养液,于37℃、5%co2的培养箱中培养24h后,用含0.5%fbs的饥饿培养基继续培养24h。将双氧水按终浓度为0μm、10μm、20μm、50μm、100μm、200μm、400μm加入到96孔板中,继续培养12h后,利用mtt法测定各孔吸光度。根据如下公式计算存活率:
存活率(%)=(双氧水处理组吸光度-空白对照组吸光度)/(正常对照组吸光度-空白对照组吸光度)×100%
7.3不同浓度的rhfgf-6蛋白对氧化损伤模型的保护作用
将rhfgf-6、afgf和bfgf按终浓度为25ng/ml、50ng/ml、100ng/ml、200ng/ml加入到96孔板中,培养2h后加入终浓度为200μm的双氧水继续培养12h,利用mtt法测定各孔吸光度。根据上述公式计算存活率。
7.4氧化损伤模型中ldh活性和mda含量的检测
取对数生长期的h9c2细胞,按2×105/孔的细胞铺板到6孔板上,每孔加入2ml维持培养液,于37℃、5%co2的培养箱中培养24h后,用含0.5%fbs的饥饿培养基继续培养24h。将rhfgf-6、afgf和bfgf按终浓度为25ng/ml、50ng/ml、100ng/ml、200ng/ml加入到6孔板中,培养2h后加入200μm的双氧水继续培养12h。将每组细胞按照ldh试剂盒(购自南京建成生物技术有限公司,货号:a020-2)和mda试剂盒(购自南京建成生物技术有限公司,货号:a003-4)说明书进行活性和含量的测定。
7.5蛋白提取及westernblot分析
h9c2细胞先用rhfgf-6按终浓度为50ng/ml、100ng/ml、200ng/ml培养2h后,加入200μm的双氧水继续培养12h。取出h9c2细胞,吸出原有细胞培养液,用pbs冲洗三次。6孔板每孔加入200μl细胞裂解液,吹打数下。将细胞裂解液铺匀,冰上放置30min。然后12000g,4℃,离心30min,取上清液。取一部分上清液用bca法测定总蛋白浓度,剩余分装后置于-80℃备用。利用westernblot方法研究不同浓度的rhfgf-6对氧化损伤的h9c2细胞的保护作用。所用抗体为兔抗人erk、p-erk、p38mapk、p-p38mapk、caspase-3、bcl-2、bax、和β-actin(内参)一抗(1:800)及抗兔二抗(1:8000)。对各组蛋白灰度扫描后,按如下公式进行灰度值分析:
相对灰度值=(样品灰度值-背景灰度值)/(内参灰度值-背景灰度值)
rhfgf-6对氧化损伤模型的修复如图7-9所示。图中,##表示:与control(对照组)组比较,p﹤0.01;*表示:与氧化损伤模型组比较,p﹤0.05,**表示:与氧化损伤模型组比较,p﹤0.01。
图7-a为mtt比色法检测rhfgf-6对氧化损伤模型的增殖促进结果图,rhfgf-6对氧化损伤模型组的细胞增殖能力有明显的促进作用,0-200ng/ml范围内,浓度越高,rhfgf-6促进氧化损伤模型增殖作用越强。图7-b为rhfgf-6对氧化损伤模型的乳酸脱氢酶(lactatedehydrogenase,ldh)活性影响图。氧化损伤模型中ldh活性明显较正常细胞偏高,rhfgf-6可降低氧化损伤模型的ldh的活性,0-200ng/ml内,rhfgf-6浓度越高,降低ldh活性的作用越强。图7-c为rhfgf-6对氧化损伤模型中总丙二醛(malondialdehyde,mda)含量的影响图。氧化损伤模型中mda的含量明显高于正常细胞,rhfgf-6可降低氧化损伤模型的mda的含量,0-200ng/ml内,rhfgf-6浓度越大,降低mda含量的作用越强。
erk1/2以及p38mapk蛋白的磷酸化水平是rhfgf-6介导的促增殖作用的相关指标;caspase3、bax、bcl-2是细胞凋亡的关键指标。图8-a为rhfgf-6对氧化损伤模型中磷酸化的erk1/2的表达水平的影响图。氧化损伤模型中磷酸化的erk1/2的表达水平明显低于正常细胞,rhfgf-6可提高磷酸化的erk1/2的表达水平,0-200ng/ml内,浓度越高,提高磷酸化的erk1/2的表达水平的能力越强;图8-b为rhfgf-6对氧化损伤模型中磷酸化的p38mapk的表达水平的影响图。氧化损伤模型中磷酸化的p38mapk的表达水平明显低于正常细胞,rhfgf-6可提高磷酸化的p38mapk的表达水平,0-200ng/ml内,浓度越高,提高磷酸化的p38mapk的表达水平的能力越强。即rhfgf-6对心肌细胞损伤具有保护作用并且这种保护作用呈剂量依赖性。
图9-a为rhfgf-6对氧化损伤模型中caspase-3的表达水平的影响图。氧化损伤模型中caspase-3的表达水平明显高于正常细胞,rhfgf-6可降低caspase-3的表达水平,0-200ng/ml内,浓度越高,降低caspase-3的表达水平的能力越强。图9-b为rhfgf-6对氧化损伤模型中bax的表达水平的影响图。氧化损伤模型中bax的表达水平明显高于正常细胞,rhfgf-6可降低bax的表达水平,0-200ng/ml内,浓度越高,降低bax的表达水平的能力越强。图9-c为rhfgf-6对氧化损伤模型中bcl-2是的表达水平的影响图。氧化损伤模型中bcl-2的表达水平明显低于正常细胞,rhfgf-6可提高bcl-2的表达水平,0-200ng/ml内,浓度越高,提高bcl-2的表达水平的能力越强。进一步表明rhfgf-6具有保护和修复受损心肌细胞的功能。
综上所述,本发明提供的编码rhfgf-6的核酸片段根据fgf-6的天然序列优化而得,在天然序列的基础上去除了37个信号肽,消除了不利于表达的二级结构,但是不改变fgf-6的氨基酸序列,将此核酸片段构建到载体构成重组表达载体,再将重组表达载体转化进入宿主细胞,得到重组菌,培养该重组菌,能够高表达rhfgf-6,并且表达的rhfgf-6具有促进肌肉组织再生、促进骨生成、修复心肌损伤、促进创伤愈合、促进血管再生的活性。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
sequencelisting
<110>温州医科大学
<120>一种编码rhfgf-6的核酸片段、表达载体、宿主细胞、生产方法及应用
<160>2
<170>patentinversion3.5
<210>1
<211>522
<212>dna
<213>人工序列
<400>1
atgagtccggccggtacccgcgcaaataataccctgctggatagccgtggctggggtacc60
ctgttaagccgtagccgtgcaggtctggccggtgaaattgccggcgtgaattgggaaagc120
ggttacctggttggcatcaaacgtcagcgccgtctgtactgcaatgtgggcattggcttc180
catctgcaggtgctgccggatggtcgcattagcggcacccatgaagagaacccgtatagc240
ctgctggaaatcagcaccgtggaacgcggcgttgtgagcctgtttggtgtgcgcagcgcc300
ctgtttgtggccatgaacagcaaaggccgcctgtatgccaccccgagctttcaagaagaa360
tgcaaattccgcgagacactgctgccgaacaattacaacgcctacgagagcgacctgtat420
cagggtacctatatcgccctgagcaagtatggtcgcgtgaaacgtggcagcaaagtgagc480
ccgattatgaccgtgacccactttctgccgcgcatttaataa522
<210>2
<211>522
<212>dna
<213>智人(homosapiens)
<400>2
atgtcgcctgcaggcacccgtgccaacaacacgctgctggactcgaggggctggggcacc60
ctgctgtccaggtctcgcgcggggctagctggagagattgccggggtgaactgggaaagt120
ggctatttggtggggatcaagcggcagcggaggctctactgcaacgtgggcatcggcttt180
cacctccaggtgctccccgacggccggatcagcgggacccacgaggagaacccctacagc240
ctgctggaaatttccactgtggagcgaggcgtggtgagtctctttggagtgagaagtgcc300
ctcttcgttgccatgaacagtaaaggaagattgtacgcaacgcccagcttccaagaagaa360
tgcaagttcagagaaaccctcctgcccaacaattacaatgcctacgagtcagacttgtac420
caagggacctacattgccctgagcaaatacggacgggtaaagcggggcagcaaggtgtcc480
ccgatcatgactgtcactcatttccttcccaggatctaatga522
- 还没有人留言评论。精彩留言会获得点赞!