提高骨形成蛋白产量的方法与流程
本申请是申请号为200980117930.2的中国专利申请的分案申请,原申请是申请日为2009年4月16日的国际申请pct/us2009/040789的中国国家阶段申请。本申请要求在2008年4月17日提交的美国临时申请no.61/045,643的较早申请日的权益,该申请通过引用整体并入本文。本发明涉及重组蛋白生产的领域。具体而言,本发明涉及生产肽生长因子(包括骨形成蛋白(bmps))的方法。
背景技术:
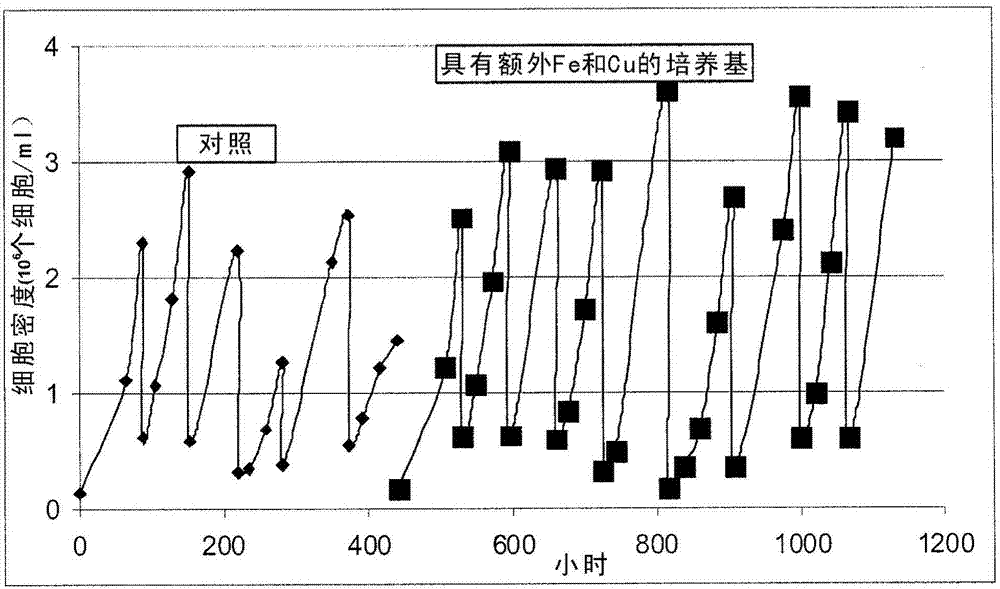
:转化生长因子β(tgf-β)超家族的成员具有生理学上重要的生长调控和形态发生特性(kingsleyetal.,genesdev.8:133-146(1994);hoodlessetal.,curr.topicsmicrobiol.immunol.228:235-272(1998))。骨形成蛋白(bmps)是生长和分化因子的tgf-β超家族的成员(rosenetal.,principlesofbonebiology2:919-928(2002))。bmps存在的最初证据中的一些是:当将bmps植入肌肉时去矿物质的骨能够诱导新的骨的能力(uristetal.,science150:893-99(1965))。随后从去矿物质骨以生物化学方式纯化了bmps(wangetal.,pnas85:9484-9488(1988)),并通过经放射标记的寡核苷酸的杂交进行克隆,所述经放射标记的寡核苷酸是从经纯化的蛋白的肽片段来设计的(wozneyetal.,science242:1528-1534(1988))。克隆的bmps已被重组表达并保留了其功能。bmps典型地是通过重组产生的,由于困难、缺乏纯度和低产量,也可从天然来源(例如骨)中用生物化学方法纯化。已知bmp-2和相关的蛋白bmp-4、bmp-5、bmp-6、bmp-7(也称为op-1)、bmp-8(也称为op-2)、bmp-9和bmp-10能介导骨和软骨组织的生长和修复。bmp-2通常在临床上用于治疗开放性和不愈合性骨折、脊柱融合(作为infusetm医疗设备的一部分)和用于口腔矫正适应症。这种重要治疗的可利用性和成本部分由其生产中使用的哺乳动物细胞培养物的效价(titer)决定。但是,以“实验室规模”产生合适细胞效价的培养条件不能扩大到满足对这些蛋白的不断增加的需求来说必要的大制造规模。因此,人们需要下述方法,所述方法用于通过在生产中提高细胞效价来产生重组蛋白(例如bmp-2),并且所述方法适用于制造规模中。技术实现要素:本发明提供了以制造规模通过支持高的宿主细胞效价来产生重组蛋白的方法,所述方法得到蛋白产量的增加。本发明部分基于下述发现:以制造规模通过分批重新进料工艺,补充有痕量金属的成分明确的培养基能支持(support)在生物反应器系统中培养的cho细胞的较高收获细胞效价。没有补充金属的情况下,相同的培养基能支持小的(实验室规模)生物反应器中的生长,但“扩大”到制造规模的生物反应器时却失败了。当培养基中的吡哆醛(pyridoxal)被吡哆素(pyridoxine)代替时,效价一致性(consistency)被进一步改善。从而,在一个方面,本发明提供了重组蛋白表达的方法,所述方法包括以下步骤:在成分明确的培养基中培养包含编码感兴趣的蛋白的核酸的合适的宿主细胞,所述培养基中铁以至少大约2.25μm的浓度存在,并且若存在吡哆醛,其占培养基中维生素b6的摩尔浓度的少于大约55%;以及,回收感兴趣的蛋白。在一些实施方式中,铁以至少大约5μm的浓度存在。所述培养基还包含浓度为至少大约10nm的铜和浓度为至少大约2μm的锌。在一些实施方式中,若吡哆醛存在于培养基中,其以小于大约15μm的浓度存在。在一些特别的实施方式中,若存在吡哆醛,其以小于大约15μm的浓度存在,并且,占所述培养基中维生素b6的摩尔浓度的少于大约55%。在一些实施方式中,若吡哆醛存在于培养基中,其或者以小于大约15μm的浓度存在,或者占培养基中维生素b6的摩尔浓度的少于大约55%。在一些实施方式中,所述宿主细胞是哺乳动物细胞,例如cho细胞。在某些实施方式中,感兴趣的蛋白是tgf-β超家族的成员,例如bmp,例如bmp-2。在某些实施方式中,培养基含有总浓度为至少大约15μm的维生素b6。在一些实施方式中,若吡哆醛存在于培养基中,其占培养基中维生素b6的总摩尔浓度的至多大约55%。在一些更特别的实施方式中,维生素b6具有小于大约1.2的吡哆醛与吡哆素的比率。在一些还更特别的实施方式中,培养基中不含吡哆醛。在一个特别的实施方式中,本发明提供了生产bmp-2的方法,其包括以下步骤:在下述培养基中培养包含编码bmp-2蛋白的dna分子的合适的宿主细胞,所述的培养基包含浓度为至少大约2.5μm的铁和浓度为至少大约15μm的维生素b6,并且其中若存在吡哆醛,吡哆醛占培养基中维生素b6的摩尔浓度的少于大约55%;以及,然后回收bmp-2蛋白。在一些实施方式中,培养基还含有总浓度为至少大约20mm的氨基酸。培养基可含有浓度为至少大约0.5mm的l-胱氨酸。在一些特别的实施方式中,培养基还含有浓度至多大约0.3mm的l-谷氨酸。在某些实施方式中,培养基还含有浓度为至少大约10mg/l的聚阴离子化合物(例如右旋糖酐硫酸酯(dextransulfate))。在一些实施方式中,培养基可具有大约260至380mosm之间的初始渗透压。在某些实施方式中,本发明的方法适于培养生长于分批重新进料工艺中的细胞。在一些特别的实施方式中,细胞生长于容量为至少大约3l的经搅拌的釜生物反应器中。在一些还更特别的实施方式中,培养温度保持基本恒定。在一些实施方式中,本发明的方法使用支持至少大约4.0x106个细胞/ml的收获细胞密度的培养基。因此,在一个方面,本发明提供了生产bmp-2的工艺或方法,其包括以下步骤:在下述培养基中培养包含编码bmp-2蛋白的dna分子的cho细胞,所述培养基包含浓度为至少大约2.5μm的铁、总浓度为至少大约20mm的氨基酸、浓度为至少0.5mm的l-胱氨酸、浓度为至少大约10mg/l的右旋糖酐硫酸酯和浓度为至少大约15μm的维生素b6,并且其中若存在吡哆醛,吡哆醛占培养基中维生素b6的摩尔浓度的少于大约55%;以及,然后回收bmp-2蛋白。在一些特别的实施方式中,培养基还包括浓度为至少大约10nm的铜。在一些还更特别的实施方式中,培养基还包括浓度为至少大约0.2μm的锌。在一些实施方式中,本发明提供了生产bmp-2的方法,所述方法包括以下步骤:在下述培养基中培养包含编码bmp-2蛋白的dna分子的合适的宿主细胞,所述培养基包含浓度为至少大约2.5μm的铁和浓度为至少大约15μm的维生素b6,并且其中若存在吡哆醛,吡哆醛占培养基中维生素b6的摩尔浓度的少于大约55%;以及,然后回收bmp-2蛋白。在一些实施方式中,本发明的任何方法还可包括纯化或分离感兴趣的蛋白(例如bmp-2)的步骤。在一些实施方式中,经纯化或分离的蛋白可被配制例如作为药物。在一些特别的实施方式中,纯化包括一种或多种柱色谱纯化,例如丁基琼脂糖凝胶(butylsepharose)柱纯化。在另一方面,本发明提供了通过本发明的任何方法生产的产品。在一些实施方式中,所述产品可用于治疗患有骨组织缺陷、损伤、疾病或病症的患者(例如哺乳动物,例如人类),或用于制备用于治疗患有骨组织缺陷、损伤、疾病或病症的患者(例如哺乳动物,例如人类)的药剂,所述治疗通过例如促进骨生长、产生、康复或修复来实现。在另一方面,本发明提供了基本如本文所述的细胞培养基。在一些特别的实施方式中,细胞培养基表3和4中描述的那些基本相似。附图说明图1是在3l和160l生物反应器中、分批重新进料工艺中细胞密度随时间的图。图2是在160l生物反应器中、分批重新进料工艺中,针对有和没有补充铁和铜的培养基中生长的细胞而言,细胞密度随时间的图。图3是在160l生物反应器中、在分批重新进料工艺中,针对补充有铁和铜的培养基中生长的细胞而言,活细胞密度随时间的图。图4是一系列柱状图,其显示了生长于具有不同培养基和不同金属浓度的培养瓶中的细胞的生长速度。图5是一系列柱状图,其显示了生长于具有不同培养基和不同铁浓度的培养皿中的细胞生长速度。图6是在2500l生物反应器中、在分批重新进料工艺中根据本发明的方法生长的细胞生收获细胞密度随时间的图。虚线表示较早工艺的平均收获密度。图7是针对图6中描述的培养物的rhbmp-2收获效价随时间的图。虚线表示较早工艺中的平均rhbmp-2标准化收获效价。具体实施方式示例性实施方式已发现:可通过在下述培养基中培养表达bmp-2的细胞,以制造规模获得恒定的、高密度的培养物,所述培养基补充有铁、铜和锌,还含有右旋糖酐硫酸酯,其中,维生素b6以至少15μm的浓度存在于培养基中,并且,维生素b6中吡哆醛与吡哆素的比率小于1.2。培养基适用于本发明方法中的培养基典型地含有支持培养的细胞生长所需的营养物,包括维生素、矿物质、脂肪酸、氨基酸、碳源(例如右旋糖(dextrose)),以及任选地,生长因子,包括例如,胰岛素和转铁蛋白,或抗生素。在一些实施方式中,培养基包括基础培养基例如dulbecco’smodifiedeagle’s培养基(dmem)、ham’sf-12、roswellparkmemorialinstitute(rpmi)培养基或其组合。在某些实施方式中,培养基是化学成分明确的培养基,即其是无血清的。应当理解:除非另有指明,本申请中培养基中的组分的浓度是起始浓度,即:在被用于培养细胞之前,新鲜培养基中该组分的浓度。如本领域中所已知的,一些特别的组分的浓度会随着细胞经历代谢过程或通过自发化学反应而改变。在一些实施方式中,培养基包含浓度为至少大约2.25、5、5.5、8、10、12、14、15、20、25、30μm或更多的铁。在一些更特别的实施方式中,铁以大约5μm的浓度存在。在一些还更特别的实施方式中,铁以大约5.5μm的浓度存在。在一些实施方式中,铁以大约5.5至15μm之间的浓度存在。应当理解:对本申请中描述一些参数的所有数值范围而言,例如“至少”、“少于/小于”或“超过”,本说明书也必然描述了提到的值的限度内的任何范围。培养基可含有其它金属,包括铜和锌。铜可以以至少大约5、10、12、15、30、50、75、100、150、200、250nm或更高的浓度存在。在一些特别的实施方式中,铜以至少大约10nm的浓度存在。在一些还更特别的实施方式中,铜以至少大约74μm的浓度存在。培养基还可含有浓度为至少大约0.1、0.2、0.5、1.0、2.0、3.0、4.0、4.2、4.5、4.8、5.0μm或更多的锌。在一些特别的实施方式中,锌以大约4.2μm的浓度存在。在一些实施方式中,培养基包含如上文所描述的铁和铜,例如,铁以至少大约2.25、5、5.5、8、10、12、14、15、20、25、30μm的浓度存在,铜以至少大约5、10、12、15、30、50、75、100、150、200、250nm的浓度存在。在某些实施方式中,培养基含有如上文所述的铁、铜和锌。因此,在一些实施方式中,培养基包含浓度在大约2.5μm至15μm之间的铁、浓度在大约10nm至150nm之间的铜和浓度在大约2.1μm至8.4μm之间的锌。在一些更特别的实施中,培养基包含浓度为至少大约5μm的铁、浓度为至少大约10nm的铜和浓度为至少大约2μm的锌。用于本发明方法中的培养基在例如分批重新进料培养期间支持持续的高收获细胞密度。在一些实施方式中,用于本发明方法中的培养基支持为至少大约1.0x106、1.5x106、2.0x106、2.5x106、3.0x106、3.5x106、4.0x106、4.1x106、4.2x106、4.3x106、4.5x106、4.8x106、5.0x106、5.5x106、6.0x106、6.5x106、7.0x106、7.5x106、8.0x106、8.5x106、9.0x106、9.5x106个细胞/ml或更高的收获密度。在一些更特别的实施方式中,培养基支持为大约4.0x106个细胞/ml到7.0x106个细胞/ml的收获密度。在某些实施方式中,为获得这些收获密度,以小于大约0.037x106、0.075x106、0.15x106、0.3x106、0.6x106、1.2x106或2.4x106个细胞/ml或更高的密度接种细胞。在一些特别的实施方式中,以小于大约0.6x106个细胞/ml的密度接种细胞。在一些实施方式中,培养基包含维生素b6,已知其以适于在细胞培养物中使用的若干种形式存在,包括吡哆素、吡哆醛、吡哆胺、吡哆素5’-磷酸酯、吡哆醛5’-磷酸酯、吡哆胺5’-磷酸酯及其组合。在一些实施方式中,培养基包含选自吡哆素、吡哆胺、吡哆素5’-磷酸酯、吡哆胺5’-磷酸酯及其组合的至少一种维生素b6。在一些实施方式中,维生素b6以至少大约5、10、15、20、25、30、35、40、45、50μm或更高的总浓度存在于培养基中。在一些特别的实施方式中,维生素b6以至少大约10μm的浓度存在。在一些还更特别实施方式中,维生素b6以大约30μm的浓度存在。在某些实施方式中,若存在吡哆醛,吡哆醛占培养基中维生素b6的摩尔浓度的不超过大约55、50、40、30、20、10、5、1、0.1%。在一些实施方式中,若培养基中存在吡哆醛,吡哆醛以小于大约20、15、10、8、6、5、4、3、2、1μm的浓度存在。在一些实施方式中,培养基具有0至1.2之间的吡哆醛与吡哆素的比率。在一些更特别的实施方式中,培养基中吡哆醛与吡哆素的比率为小于1.2,例如小于大约1.1、1.0、0.9、0.7、0.5、0.4、0.3或0.1。在一些还更特别的实施方式中,培养基基本上不含吡哆醛。用于本发明方法中的培养基典型地提供氨基酸,以支持培养的细胞生长以及感兴趣的蛋白的产生。在一些实施方式中,氨基酸可以以确定的比例存在于培养基中,例如,如在表3或4中描述的。已知在本领域中,蛋白制备物的水解产物(例如蛋白胨、细菌蛋白胨、胰蛋白胨、酪蛋白水解产物或大豆蛋白胨(soytonesoy)水解产物)可用作为氨基酸来源。在一些实施方式中,含有确定比例的氨基酸的培养基可被补充未明确成分的蛋白水解产物。或者,在一些实施方式中,未明确成分的水解产物作为氨基酸的主要来源供应。在一些特别的实施方式中,水解产物是氨基酸的主要来源时,可根据需要,用一种或多种特别的氨基酸来补充培养基。在一些实施方式中,培养基具有至少大约15、20、25、30、35、40mm或更高的总氨基酸浓度。在一些特别的实施方式中,培养基中总氨基酸含量为至少大约20mm。在一些还更特别的实施方式中,总氨基酸浓度为大约30mm。可对氨基酸的比例和各氨基酸的浓度加以调整,以适应宿主细胞的代谢需要(这取决于例如细胞的生长速度、细胞的代谢情况、产生的重组蛋白中氨基酸的比例),或用于改进产生的重组蛋白的品质。例如,在cho细胞中产生的、作为与半胱氨酰化的或游离巯基二聚体的可解缔二聚体rhbmp-2的部分受培养基中的l-胱氨酸和l-谷氨酸的浓度影响,例如公开于美国专利no.5,830,761中的。从而,在一些实施方式中,培养基包含浓度为至少大约0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.05、1.1、1.2、1.3、1.4、1.5、2.0、2.5、3.0、3.5、4.0mm或更高的l-胱氨酸。例如,在一些特别的实施方式中,培养基包含浓度为大约0.2-4.0mm的l-胱氨酸。在一些更特别的实施方式中,培养基包含浓度为大约0.5-4.0mm的l-胱氨酸。在一些还更特别的实施方式中,培养基包含浓度为大约0.7-3.0mm的l-胱氨酸。在一些实施方式中,l-谷氨酸以至少大约0.023、0.05、0.1、0.2、0.3、0.4、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0mm或更高的浓度存在于培养基中。在一些特别的实施方式中,培养基包含浓度为至少大约0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.05、1.1、1.2、1.3、1.4、1.5、2.0、2.5、3.0、3.5、4.0mm或更高的l-胱氨酸和浓度为至多大约0.023、0.05、0.1、0.2、0.3、0.4、0.5、1.0、1.5、2.0、2.5、3.0mm的l-谷氨酸。在一些更特别的实施方式中,l-胱氨酸以至少大约0.5mm的浓度存在于培养基中,并且,l-谷氨酸以至多大约0.3mm的浓度存在于培养基中。在一些还更特别的实施方式中,l-胱氨酸以大约0.7-3.0mm的浓度存在于培养基中,以及l-谷氨酸以至多大约0.2mm的浓度存在于培养基中的。培养基还可包含聚阴离子剂。理论上但不依赖于理论,聚阴离子剂与细胞的细胞表面上的基元(moieties)竞争结合分泌的重组蛋白上的肝素分子样结合结构域,例如,成熟的(经蛋白水解切割的)hbmp-2单体或二聚体的n端。当分泌的蛋白结合至细胞表面时,溶液中蛋白的产率会下降。通过与细胞表面上的这些元件竞争,聚阴离子剂增加了培养基中游离蛋白(非细胞联结的)的含量。聚阴离子剂的例子包括肝素、肝素硫酸盐、戊聚糖硫酸盐、右旋糖酐、右旋糖酐硫酸酯、透明质酸、软骨素、软骨素硫酸酯、皮肤素硫酸酯(dermatansulfate)、角质素硫酸酯、己糖醇-己糖胺聚糖硫酸酯(hexuronal-hexosaminoglycansulfate)、肌醇六硫酸酯(inositolhexasulfate)和蔗糖八硫酸酯。在某些实施方式中,聚阴离子剂能够以微摩尔级或纳摩尔级的亲和力与成熟hbmp-2单体的n端结合。在一些实施方式中,聚阴离子剂是磺化的天然聚合物,例如葡胺聚糖(gag)或其衍生物,其中聚合物中至少大约1%、5%、10%、12%、15%、18%、20%、25%、30%、50%或更多是磺化的。在一些实施方式中,聚阴离子剂以至少大约1、5、10、20、50、75、100、200、400、600、800、1,000mg/l或更高的浓度存在。在一些特别的实施方式中,聚阴离子剂是右旋糖酐硫酸酯。在一些更特别的实施方式中,右旋糖酐硫酸酯具有大约5,000至500,000g/摩尔之间的分子量。在一些还更特别的实施方式中,右旋糖酐具有大约7,000g/摩尔的分子量,在一些实施方式中,右旋糖酐以至少大约10mg/l的浓度存在。在一些更特别的实施方式中,右旋糖酐以大约400mg/l的浓度存在。在美国专利nos.5,318,898和5,516,654中有对在培养基中使用右旋糖酐硫酸酯以生产rhbmp-2的进一步描述。可操纵培养基,以保持培养基的某些参数,例如ph、溶解o2或渗透压。在一些实施方式中,培养基被保持为特定的渗透压范围。在其它一些实施方式中,调节培养基至特定的起始渗透压。在一些特别的实施方式中,培养基的起始渗透压在大约260-380mosm之间。在一些更特别的实施方式中,起始渗透压在大约280至360mosm之间。在某些实施方式中,培养基包含浓度为至少大约2.5μm的铁、浓度为至少大约10nm的铜、总浓度为至少大约20mm的氨基酸、浓度为至少大约10mg/l的右旋糖酐硫酸酯和浓度为至少大约15μm的维生素b6,其中维生素b6具有小于大约1.2的吡哆醛与吡哆素的比率。在一些更特别的实施方式中,培养基还包含浓度为至少大约0.2μm的锌,在一些非常特别的实施方式中,用于本发明的培养基被描述在表3和表4中,即培养基a1、a2、b1或b2。在一些还更特别的实施方式中,培养基是b2。在某些实施方式中,培养基与b2基本相似。“基本相似”表示:培养基中不存在与表4中培养基b2相比浓度差异超过大约0.1、0.2、0.5、1.0、1.5、2.0、2.5或3.0倍(即增加或减少)的组分。在一些实施方式中,使用未明确组分的培养基是可接受的,并且培养基可补充有可多至大约0.1、0.5、1、5、10%或更多的胎牛血清(fbs)。但是,即使血清广泛用于哺乳动物细胞培养物,但存在与其使用相关的若干问题,如在freshneycultureofanimalcells,johnwiley&sons,newyork,91-99(1994)中讨论的。例如,血清包含许多未鉴定的组分,因此化学上是不明确的。事实上,血清的组成随批次而变化,难于使其标准化。此外,血清可含有生长抑制因子,这导致生长不理想。最后,血清可含有病毒或其它病原体,使得生产和批准许可都更为困难。从而,在本发明的方法中优选使用无血清的培养基。蛋白本发明提供的方法可用于生产多种蛋白。在某些实施方式中,蛋白是生长因子。在一些特别的实施方式中,生长因子是tgf-β超家族的成员。在一些更特别的实施方式中,tgf-β家族成员是骨形成蛋白(bmp)。bmps是高度同源的蛋白质族,可基于进一步更高的同源性水平将其其分入亚组。一些重要的亚组包括:bmp-2和bmp-4;bmp-5、bmp-6和bmp-7;以及bmp-12、bmp-13和mp-52。具体而言,bmps共享蛋白的羧基端区域中半胱氨酸残基的鉴定模式,这是bmp活性所必需的。在某些实施方式中,通过本发明的方法产生的蛋白质是选自bmp-2、bmp-4、bmp-5、bmp-6、bmp-7、bmp-8、bmp-9、bmp-10、bmp-11、bmp-12、bmp-13、bmp-14、bmp-15、bmp-16、bmp-17、bmp-18和mp-52(包括其组合和其异源二聚体)的bmp。典型地,bmp指二硫化物连接的二聚分子。在某些实施方式中,bmp可以是单体。在一些实施方式中,提到bmp包括在氨基酸水平上与已知的bmp的成熟(缺少前结构域(prodomain))区域的序列具有至少大约70%、80%、90%、95%、96%、97%、98%、99%、99.9%或更高同一性并且保留有生物活性(例如骨、软骨或韧带/腱样组织形成活性)的序列。在一些实施方式中,bmp可包含1、2、3、4、5、6、7、8、9、10、15、20、25或更多个较之已知bmp序列而言的氨基酸取代。bmps在本领域中是已知的,其已从多种物种(包括哺乳动物(例如人类、猫、鸡、黑猩猩、牛、狗、山羊、马、短尾猿、小鼠、猪、兔、大鼠和绵羊))中鉴定出来。对bmps的描述,包括例如,蛋白和核酸序列以及生产方法,可在下述公开文献中找到:bmp-2、bmp-3、bmp-4、bmp-5、bmp-6和bmp-7(公开于例如美国专利nos.5,013,649、5,116,738、5,106,748、5,187,076和5,141,905中),bmp-8(公开于pctwo91/18098中),bmp-9(公开于pctwo93/00432中),bmp-10(公开于pctwo94/26893中),bmp-11(公开于pctwo94/26892中),bmp-12和bmp-13(公开于pctwo95/16035中),bmp-15(公开于美国专利no.5,635,372中),bmp-16(公开于美国专利no.6,331,612中),mp-52(公开于pctwo93/16099中)以及bmp-17和bmp-18(公开于美国专利no.6,027,917中)。应当理解:提到这些蛋白质也意味着包括变体、等位基因变体、bmps的片段和突变体bmps,包括但不限于缺失突变体、插入突变体和取代突变体。具体而言,应当理解:提到任何具体的bmp包括n端截短片段,其中,已从成熟蛋白的n端移除了至少1、3、5、7、9、10、11、12、13、15、18、20、22、25、30、35或更多个残基。在本发明的一些特别的实施方式中,bmp是bmp-2。在一些实施方式中,bmp-2是人类bmp-2(hbmp-2)。在一些还更特别的实施方式中,hbmp-2是成熟的hbmp-2(即ncbi检录号np_001191中的q283-r396),其具有骨和/或软骨形成活性。在一些特别的实施方式中,hbmp-2在氨基酸水平上与成熟的hbmp-2(ncbi检录号np_001191中的q283-r396)至少大约88、89、90、92、94、95、96、98、99、99.9%相同。从而,在一些实施方式中,成熟的hbmp-2可含有1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸取代。在一些实施方式中,产生的bmp-2是二聚的。在一些实施方式中,产生的bmp-2是单体性的。在某些实施方式中,bmp-2具有较之二聚体蛋白的至少一个亚基的n端的至少1、3、5、7、9、10、11、12、13或更多个残基的n端截短。针对bmp-2活性的检验是本领域中已知的,其被公开于例如美国专利no.5,013,649中。已在很多物种中鉴定了bmp-2。见例如表1,其列出了针对来自若干物种的bmp-2的nationalcenterforbiotechnologyinformation(ncbi)entrezgeneid。这些geneids可用于回溯公众可获得的被注释的mrna或蛋白序列,例如,在ncbi全球网址入口,其可在下述统一资源定位符(url)中找到:http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene。作为阐述,人类bmp-2的geneid可用于回溯下述参考序列:nm_001200.2(mrna)和np_001191.1(蛋白)。小鼠的情况类似,可回溯的bmp-2参考序列包括nm_007553.2(mrna)和np_031579.2(蛋白)。在本申请中提到的所有与geneid相关的信息,包括,例如染色体座、染色体序列、功能注释、等位基因变体和参考mrna和蛋白序列,都通过引用整体并入本文。所有参考序列也通过引用整体并入本文,这包括片段的注释特征,例如mrnas的外显子边界或蛋白的结构特征,例如界定蛋白质的成熟区域。表1物种geneid物种geneid人类650牛615037小鼠12156猪494462鸡378779黑猩猩458090大鼠29373狗477162蛙548717短尾猿718330绵羊443173兔100009349分离和用途已知在本领域中,骨形成蛋白例如bmp-2可用作为基于蛋白的治疗剂。因此,本发明的方法还可包括对从培养基中回收的蛋白进行纯化或分离的步骤。可通过本领域中已知的多种方法来纯化bmp-2。在一些特别的实施方式中,纯化包括一种或多种柱色谱纯化,例如,丁基琼脂糖凝胶树脂纯化。在一些更特别的实施方式中,丁基琼脂糖凝胶柱包括将丁胺偶联至经cnbr活化的琼脂糖上的树脂,例如琼脂糖凝胶4b。在一些实施方式中,纯化还可包括在肝素样树脂(例如cellufinetm硫酸酯树脂)上进行的柱纯化步骤。例如,可将含有bmp-2的来自培养细胞的条件培养基应用至含有肝素样树脂的柱,从该柱获得含有bmp-2的洗脱液,然后将洗脱液应用至第二柱(例如丁基琼脂糖凝胶柱)。还可进行额外的纯化,例如国际公开文件no.wo99/31120中所述的,特别其中3-7页所述的,该文件通过引用并入本文。一旦经纯化,本发明的方法的产品还可被进一步配制,例如作为药物。关于用于bmps的药物载体的一般性综述参见例如,seehermanandwozneycytokinegrowthfactorrev.16(3):329-45(2005)或美国专利no.5,385,887。本发明的方法的产品可用于治疗骨组织缺陷、损伤、疾病或病症或用于制备用于治疗骨组织缺陷、损伤、疾病或病症的药剂,这可通过例如促进骨生长、产生、康复或修复来实现。细胞多种细胞可用于通过本发明提供的方法生产重组蛋白。可经重组dna转化以表达感兴趣的蛋白(例如bmp)的任何细胞可用于本发明的方法。细胞可以来自多种物种,包括线虫类、蠕虫类、昆虫类、两栖类或哺乳动物(例如人类、灵长类动物、绵羊、牛、猪、马、猫科动物、犬科动物或啮齿动物来源)。在一些特别的实施方式中,细胞来自人类或啮齿动物。在一些更特别的实施方式中,细胞来自仓鼠。适于在本发明的方法中的细胞系是本领域中公知的,并且是可广泛获得的。可从保藏机构获得多种合适的细胞系,例如americatypeculturecollection(atcc),manassas,va。本发明的合适的细胞系包括cos细胞、cho细胞、bhk细胞、balb/c3t3细胞、frhl-2细胞、sp2/0细胞、nso细胞、tm4细胞、cv1细胞、mdck细胞、brl细胞、vero-76细胞、hela细胞、mdck细胞、hepg2细胞或293细胞。在一些特别的实施方式中,细胞是cos细胞、cho细胞、bhk细胞、balb/c3t3细胞或293细胞。在一些更特别的实施方式中,细胞是cho细胞。cho细胞可经修饰,以增加细胞效价和/或蛋白产率。在一些实施方式中,cho细胞可具有降低的二氢叶酸还原酶基因(dhfr;小鼠geneid13361)表达或二氢叶酸还原酶基因不表达,例如cho细胞可以是针对dhf的减效的(降低的功能)、无效的(无功能的)或显性失活的(空的,并且抑制酶的功能形式)等位基因来说杂合或纯合的,并且感兴趣的蛋白可被共转染进包含功能性dhfr基因的构建体中。生物反应器及条件可通过本领域已知的任何方法来培养用于本发明方法中的细胞,例如描述于warnockandal-rubeibiotech.appl.biochem.45:1-12(2006)中的。典型地,细胞在生物反应器中生长。生物反应器可以是任何尺寸的。在一些实施方式中,所述的生物反应器至少大约1l、3l、20l、40l、80l、100l、160l、1,900l、2,500l、12,000l、20,000l、40,000l或更大。生物反应器可支持细胞以悬浮形式生长(即非锚定依赖性生长)或锚定至底物上生长。锚定依赖性生长可包括例如使用微载体,以例如提供大的表面积与体积的比率。在本发明的一些特别的实施方式中,细胞可以以悬浮形式生长,即没有锚定表面。锚定依赖性生长的形式是本领域中公知的,其包括在例如经搅拌的釜生物反应器和气升式生物反应器中生长。在一些特别的实施方式中,生物反应器是经搅拌的釜生物反应器。进而,可通过本领域已知的多种方,来培养特定的生物反应器中生长的细胞,包括分批重新进料(下文中有进一步描述,还见drapeauetal.,cytotechnology15(1-3):103-9(1994))、流加式(见例如美国专利nos.5,672,502;6,924,124或7,332,303)或灌注(利用细胞保留装置,由此当新鲜培养基加入时废料可从生物反应器中被移除,见例如美国专利nos.4,814,278或6,607,910)培养方法。在一些特别的实施方式中,通过分批重新进料工艺培养细胞。在一些更特别的实施方式中,在基本恒定的温度下培养细胞。在一些实施方式中,合适的培养温度可选择自大约31、32、33、34、35、36、37、38、39、40、41或42℃。在一些实施方式中,基本恒定的温度可以是窄的温度范围,例如35-39℃或36-38℃。在一些更特别的实施方式中,在大约37℃的恒定温度下培养细胞。生物反应器可保持培养基的多种生理参数,例如,氧合(oxygenation)(溶解的o2)、ph、渗透压、温度、光照和特殊营养物(例如葡萄糖或氨基酸)的浓度。在某些实施方式中,生物反应器监控并保持温度、ph和溶解的o2含量。在一些实施方式中,葡萄糖分批进料。例如,通过分批重新进料在生物反应器中培养细胞。在一些特别的实施方式中,总培养物(即细胞和培养基)的一部分被定期移除(例如收获)并用新鲜培养基替换。在一些实施方式中,总培养基的至少大约10、25、50、75、80、85、90、95、99%或更多被定期移除并用新鲜培养基替换。在一些更特别的实施方式中,总培养基的至少大约75%被移除并被替换。在一些特别的实施方式中,大约每6、12、18、24、30、36、42或48小时或每1、2、3、4、5、6、7、8、9、10天或每更多天移除细胞培养基的一部分。在一些更特别的实施方式中,每3天移除并替换培养基的一部分。在其它一些实施方式中,大约每1、2、3、4、5、6、7、8、9、10或更多个细胞分裂周期,移除并替换总培养物的一部分。“细胞分裂周期”表示在指数生长期间(即在富培养基中,在没有例如接触抑制的情况下)培养的细胞的平均倍增时间。在某些实施方式中,可通过限制或控制由细胞的乳酸盐/酯生产来提高细胞效价和/或蛋白产率。可通过以受限方式限制向培养细胞进料葡萄糖,来控制乳酸盐/酯生产,例如,如2005年3月31日公开的美国专利公开no.2005/0070013所述(还见美国专利no.7,429,491)。应当理解:对本文引用的所有专利、申请、geneids、参考序列或其它参考文献而言,为了所有目的以及为了提到的其主张,通过引用将它们整体并入本文。当通过引用并入的文献和本申请之间存在任何矛盾时,以本申请为准。实施例实施例1:在rhbmp-2生产期间的规模扩大问题在bmp-2生产工艺的开发期间,用在1,900升生物反应器中共表达rhbmp-2和二氢叶酸还原酶(dhfr)的cho细胞(本文中称为emc-g5细胞)的高细胞密度培养物,观察规模扩大的问题。以0.60x106个细胞/ml(3天的批次)或以0.30x106个细胞/ml(4天的批次)接种高细胞密度培养物。在分批重新进料工艺的第一次传代期间,最终细胞密度通常达到3.0x106个细胞/ml,但是之后传代的最终细胞密度逐渐下降。例如,三次传代将导致产生分别为3.0x106、1.6x106和1.0x106个细胞/ml的收获细胞密度。这种下降的生长速度导致培养基中bmp-2蛋白的量较低,并且整体生产力低于期望。在3升的规模下,下降的生长速度没有重现。使用160公升的生物反应器作为模型来研究该问题。在160l的生物反应器中观察到了下降的收获细胞密度,如图1中所示。其它实验也显示出相同的困难。在一次试验中,第一次高密度传代达到了2.99x106个细胞/ml的最终细胞密度,然而第二次传代仅达到2.28x106个细胞/ml。在具有预传代的对照条件下再次接种反应器,继而第一和第二次高密度传代分别达到2.65x106个细胞/ml和1.49x106个细胞/ml的最终细胞密度。两项对照实验均显示出规模扩大的问题,其中第一次高接种传代达到高的最终密度,但是后续传代的生长速度显著地下降。bmp-2效价和比生产力数据显示出相似的趋势。在生长培养基中添加痕量元素d(“痕量d”)消除了培养基中的生产规模扩大问题。痕量d由3μm铁、3μm锌和0.03μm铜构成。用痕量元素d时,高的接种批次(3天和4天)持续地达到3.0x106个细胞/ml或更高的收获密度。高的生长速度和比生产力也得以保持。这表明痕量d正面影响细胞生长特性。在有或没有补充铁和铜的培养基中的细胞生长实验的结果如图2所示。为了试图发现痕量d的哪种组分是最重要的,测试了仅补充有铜的培养基(未示出)。在第一个高接种批次达到超过3.0x106个细胞/ml之后,随后的两个批次显示出下降的生长速度,这与对照批次(没有痕量d)的表现相似。三次高接种传代中下降的生长速度表明仅有铜对改进规模扩大问题来说是无效的。实施例2:右旋糖酐硫酸酯消除色谱异常在这些痕量金属评估期间,在来自之前的高密度培养物中产生的rhbmp-2的尺寸排除色谱(cex)的第二个峰上观察到异常的肩峰。发现:培养基中低水平的右旋糖酐硫酸酯(用10mg/l代替200mg/l)导致产生用磷酸盐孵育之后的高得多的肩峰百分比(分别为:大约12%对大约4%)。右旋糖酐硫酸酯剂量应答实验表明:细胞培养基中更高水平的右旋糖酐硫酸酯以剂量依赖方式降低了观察到的肩峰的量。右旋糖酐硫酸酯之前已显示能在bmp-2生产期间增加蛋白产率。见例如美国专利nos.5,318,898和5,516,654。实施例3.1:在补充金属的培养基中降低的细胞效价当培养基中铁和铜浓度富集时,偶尔观察到细胞生长不稳定,即使是在实验室规模的生物反应器中也如此。见图3。假定:另外的金属可与其它培养基组分相互作用并导致不稳定的培养物生长。在组织培养瓶中的预备实验中(图4),以0.08x106个细胞/ml的密度接种细胞,并使其生长4天。补充有单独的铜或锌的培养基a1(140)支持了与未经补充的培养基相当的生长速度,而痕量d补充(另外的铁、铜和锌)则导致较低的生长速度。当培养基a1仅补充有铁时,细胞还显示出生长速度的剂量依赖性减少。与在补充有铁的培养基a1中生长的细胞相似,在培养基b1(248)中生长的细胞显示出降低的生长速度。实施例3.2:吡哆醛-铁的相互作用导致降低的生长速度在进一步的研究中,将引起生长速度缺陷的培养基a1与没有引起生长速度缺陷的培养基a2相比较。注意到培养基a1主要含有吡哆醛,而培养基a2仅含有吡哆素。在不同的铁浓度以及有和没有吡哆醛的培养基a1和培养基a2中培养bmp-2emcg5细胞。培养基a1和a2的铁和维生素b6的含量被概括于表2中。表2在保持于37℃及7%co2的孵育器中的组织培养皿中,对细胞培养3天。以0.15x106个细胞/ml下接种细胞,并在3天结束时收获。用casy计数器对第三天的细胞加以计数,获得最终细胞密度(单位为106个细胞/ml)。接着通过下式计算生长速度:生长速度(u)=ln(最终细胞密度/起始细胞密度)/培养时间(小时)。结果见图5中所示。已发现:吡哆醛而不是吡哆素,是与铁相互作用的组分,其导致不持续的培养物性能。吡哆素是吡哆醛的前体。它们在培养基中可与维生素b6互换,并作为用于转氨作用、脱羧基作用和去氨基作用的辅助因子。对于大多数的细胞培养工艺而言,培养基含有吡哆素、吡哆醛或二者均含并没有差异。但是,某些浓度下的吡哆醛与增加的量的铁相互作用,并对rhbmp-2生产工艺造成负面影响。如图5所示,培养基a1引起相对于培养基a2的生长速度缺陷,另外的铁会使得这种缺陷加剧。当补充有吡哆醛时,培养基a2以铁剂量依赖方式引起生长速度缺陷。从而,培养基中较高的铁浓度和较高的吡哆醛浓度或比例的组合导致不稳定的和并非最佳的培养物生长。实施例4:细胞密度和蛋白效价的强烈增大在进一步的培养基修饰(产生了培养基b2)(从培养基中除去吡哆醛)之后,细胞生长和bmp-2生产力得以持续,并且,相对于较早的工艺而言,在小规模生物反应器和商业规模的生物反应器中显示出生产力的两倍增加。见图6和图7。从而,在本申请中描述的对培养基的修饰消除了在将重组蛋白生产扩大到商业规模期间的出现的生长缺陷,导致高品质重组蛋白的产率大幅增加。在工业上用来产生重组人类骨形成蛋白2(rhbmp-2)的细胞系是共表达bmp-2和dhfr的中国仓鼠卵巢(cho)系,其在本文中被称为emc-g5。在以0.6x106个细胞/ml的目标细胞密度接种的2,500升工作体积的生物反应器中培养细胞。细胞被培养于培养基b2(见表4)中。培养物的温度保持为37℃。在传代的最初若干小时令培养物的ph下降至设定值7.10,并通过添加滴定剂来保持。培养基b2的初始ph是~7.30。以每种接种细胞密度,对培养物进行每3天2次和每4天2次的连续传代。根据来自血气分析仪(bga)的测量数据即时校准ph探测器。使用显微镜,通过手动计数来测定细胞密度和存活率,使用台盼蓝排除(trypanblueexclusion)来测定存活率。通过离心来收获每次传代后来自所有培养物的条件培养基,接着对其加以过滤。表3和4显示了在这些研究中使用的培养基配方。表3组分培养基a1培养基a2氨基酸mmmmala0.2000.100精氨酸2.5200.550天冬酰胺0.8000.450天冬氨酸0.2000.250cyshcl,h2o0.4000.400胱氨酸2hcl1.4001.400谷氨酸0.2000.100谷氨酰胺8.0008.000甘氨酸0.4000.100hishclh2o0.2200.175异亮氨酸0.8000.450亮氨酸0.8000.650赖氨酸hcl0.8000.500甲硫氨酸0.2000.200苯丙氨酸0.4000.250脯氨酸0.6000.300丝氨酸2.0002.000苏氨酸0.8000.400色氨酸0.0800.080酪氨酸2na0.4000.200l-缬氨酸0.8000.400表3续表4表4续在本文公开的本发明的描述和实践的基础上,本发明的其它实施方式对本领域的技术人员而言是显而易见的。说明书和实施例仅被考虑为示例性的,本发明的真实范围和宗旨将由随后的权利要求书指出。以下内容对应于母案申请中的原始权利要求书,现作为说明书的一部分并入此处:1.生产bmp-2的方法,所述方法包括以下步骤:i)在下述培养基中培养包含编码bmp-2的dna分子的合适的宿主细胞,所述的培养基包含浓度为至少大约2.25μm的铁、聚阴离子化合物,并且若存在吡哆醛,所述吡哆醛占所述培养基中维生素b6的摩尔浓度的少于大约55%;并ii)回收感兴趣的蛋白,其中在具有大于大约3l的容量的生物反应器中培养所述宿主细胞。2.根据项1的方法,其中所述铁的浓度为至少大约5μm。3.根据项1的方法,其中所述培养基能支持至少大约2x106个细胞/ml的收获密度。4.根据项1的方法,其中所述培养基中还包含选自由吡哆素、吡哆胺、吡哆素5’-磷酸酯、吡哆胺5’-磷酸酯构成的组的至少一种维生素b6。5.根据项4的方法,其中所述培养基具有至少大约15μm的总的维生素b6浓度。6.根据项4的方法,其中所述培养基具有小于1.2的吡哆醛与吡哆素的比率。7.根据项6的方法,其中吡哆醛与吡哆素的所述比率小于0.4。8.根据项1的方法,其中所述培养基还包含浓度为至少大约10nm的铜。9.根据项1的方法,其中所述培养基还包含浓度为至少大约0.2μm的锌。10.根据项1的方法,其中所述聚阴离子化合物是右旋糖酐硫酸酯。11.根据项10的方法,其中所述右旋糖酐硫酸酯以至少大约10mg/l的浓度存在。12.根据项10的方法,其中所述右旋糖酐硫酸酯以至少大约100mg/l的浓度存在。13.根据项11的方法,其中所述右旋糖酐硫酸酯具有大约5,000至500,000g/摩尔之间的分子量。14.根据项13的方法,其中所述右旋糖酐硫酸酯具有大约7,000g/摩尔的分子量。15.根据项1的方法,其中所述培养基还包含总浓度为至少大约20mm的氨基酸。16.根据项15的方法,其中所述培养基包含浓度为至少大约0.5mm的l-胱氨酸。17.根据项16的方法,其中所述培养基包含浓度为至多大约0.3mm的l-谷氨酸。18.根据项1的方法,其中所述的培养基具有大约260至360mosm之间的初始渗透压。19.根据项1的方法,其中所述bmp-2是哺乳动物bmp-2。20.根据项19的方法,其中所述哺乳动物bmp-2是人类bmp-2(hbmp-2)。21.根据项20的方法,其中所述人类bmp-2是重组的(rhbmp-2)。22.根据项1的方法,其中所述合适的宿主细胞选自由cos细胞、cho细胞、bhk细胞、balb/c3t3细胞或293细胞构成的组。23.根据项22的方法,其中所述合适的宿主细胞是cho细胞。24.根据项23的方法,其中所述cho细胞具有降低的dhfr基因表达。25.根据项1的方法,其中所述在具有至少大约160l的容量的生物反应器中培养合适的宿主细胞。26.根据项25的方法,其中所述生物反应器具有至少大约500l的容量。27.根据项26的方法,其中所述生物反应器具有至少大约2,500l的容量。28.根据项27的方法,其中所述生物反应器具有至少大约12,000l的容量。29.根据项27的方法,其中通过分批重新进料、补料分批或灌注法来培养所述宿主细胞。30.根据项29的方法,其中通过分批重新进料来培养所述宿主细胞。31.根据项30的方法,其中在基本恒定的温度下培养所述宿主细胞。32.根据项31的方法,其中所述温度为大约36-38℃。33.根据项1的方法,还包括在丁基琼脂糖凝胶树脂上纯化所述bmp-2的步骤。34.根据项33的方法,其中所述纯化还包括下述步骤:将含有所述bmp-2的条件培养基应用至肝素样树脂,获得含有所述bmp-2的流出液,并将所述流出液应用至丁基琼脂糖凝胶树脂。35.生产bmp-2的方法,所述方法包括以下步骤:i)在下述培养基中培养包含编码bmp-2蛋白的dna分子的合适的宿主细胞,所述培养基包含浓度为至少大约2.5μm的铁、聚阴离子化合物和浓度为至少大约15μm的维生素b6,并且若存在吡哆醛,所述吡哆醛占所述培养基中维生素b6的摩尔浓度的少于大约55%;并ii)回收bmp-2蛋白,其中在具有大于大约3l的容量的生物反应器中培养所述宿主细胞。36.根据项35的方法,其中所述培养基还包含浓度为至少大约10nm的铜。37.根据项35的方法,其中所述培养基还包含浓度为至少大约0.2μm的锌。38.根据项35的方法,其中所述宿主细胞是cho细胞。39.根据项35的方法,其中所述bmp-2是rhbmp-2。40.根据项35的方法,其中所述聚阴离子化合物是浓度为至少大约10mg/l的右旋糖酐硫酸酯。41.根据项35的方法,其中所述培养基包含总浓度为至少大约20mm的氨基酸。42.根据项41的方法,其中所述培养基包含浓度为至少大约0.5mm的l-胱氨酸。43.根据项42的方法,其中所述培养基还包含浓度为至多大约0.3mm的l-谷氨酸。44.根据项35的方法,其中所述培养基具有在大约260至360mosm之间的初始渗透压。45.生产bmp-2的方法,所述方法包括以下步骤:i)在分批重新进料工艺中,在下述培养基中培养包含编码bmp-2蛋白的dna分子的cho细胞,所述培养基包含浓度为至少大约2.5μm的铁、浓度为至少大约10nm的铜、总浓度为至少大约20mm的氨基酸、浓度为至少大约0.5mm的l-胱氨酸、浓度为至少大约10mg/l的右旋糖酐硫酸酯和浓度为至少大约15μm的维生素b6,并且若存在吡哆醛,所述吡哆醛占所述培养基中维生素b6的摩尔浓度的少于大约55%;并ii)回收bmp-2蛋白,其中在具有至少大约160l的容量的生物反应器中培养所述宿主细胞。46.根据项45的方法,其中所述培养基还包含浓度为至少大约0.2μm的锌。47.生产bmp-2的方法,所述方法包括以下步骤:i)在下述培养基中培养包含编码bmp-2的dna分子的合适的宿主细胞,所述培养基包含浓度为至少大约2.25μm的铁、聚阴离子化合物,并且若存在吡哆醛,所述吡哆醛以小于大约15μm的浓度存在;并ii)回收需要的蛋白,其中在具有大于大约3l的容量的生物反应器中培养所述宿主细胞。48.根据项1到31或35到47中任何一项的方法,还包括纯化所述bmp-2的步骤。49.根据项48的方法,还包括将经纯化的bmp-2配制为药物的步骤。50.通过项1到49中的任何一项的方法生产的产品。51.含项50的产品的药物制剂。52.项50的产品用于制备用于治疗骨组织缺陷、损伤、疾病或病症的患者的药剂的用途。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1