一种循环肿瘤细胞阴性富集方法与流程
本发明涉及分子生物学领域,特别涉及一种循环肿瘤细胞阴性富集方法。
背景技术:
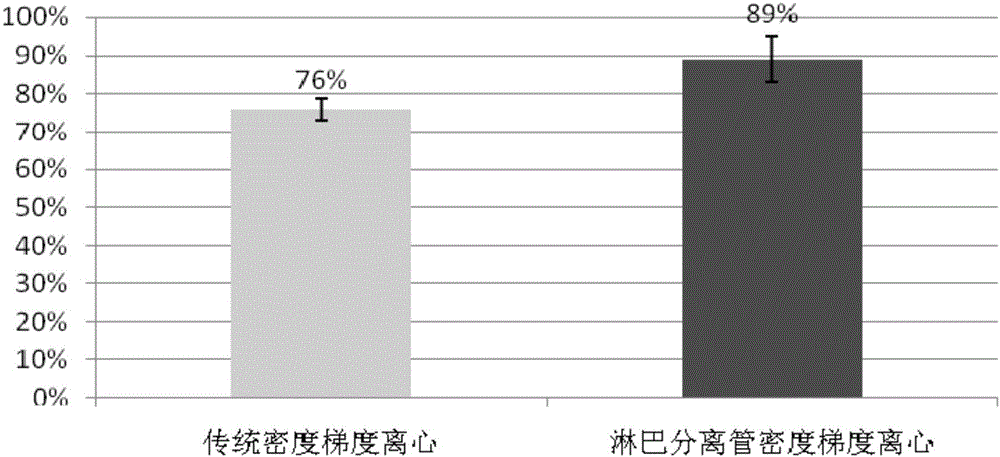
:循环肿瘤细胞(circulatingtumorcells,CTC)是指自发或因诊疗操作由实体瘤或转移灶释放进入外周血循环的肿瘤细胞,是恶性肿瘤患者出现远处转移的主要原因。据统计,转移是超过90%的肿瘤患者的死亡原因。近年来,随着一些基础学科相关技术的不断改进,CTC检测作为一种新型的非侵入性诊断工具,相比传统组织活检具有无创、可多次获取、可实时监测等优势,因此检测CTC被形象地称为“液体活检”,具有重要的临床研究及应用价值,已成为临床研究的热点。已有大量临床研究已经证实:通过对循环肿瘤细胞的检测,可有效地进行对多种肿瘤进行早期诊断、预后判断、监测术后复发、个体化治疗、化疗药物的快速评估、耐药性的监测等。近10年的大量临床研究表明,检测CTC数量有助于结肠癌、肝癌、乳腺癌、前列腺癌患者的预后评估;当CTC出现上皮间质转换(EMT)、过表达上皮细胞粘附分子(EpCAM)时,往往提示肿瘤患者预后不佳,临床研究发现,早期发现的癌症患者,90%可以治愈。但是,由于常规检测技术的局限性,早期发现癌症的人群只占少数,我国早期(Ⅰ期)癌症病人约占总体病人数5%-10%,70%的病人都属于晚期发现,这类病人5年生存率仅10%~30%。世界卫生组织早在2006年就指出癌症的防治三原则:早发现、早诊断、早治疗,可见,尽早发现是癌症防治的关键。但是在肿瘤的常规检测手段中,例如CT或核磁共振检查,对小于5毫米的肿瘤诊断比较困难,如胰腺癌、肺癌往往发现确诊以后都是中晚期的。现在发现,很多肿瘤在1毫米的情况下已经可以在血液里查到循环肿瘤细胞(circulatingtumorcells,CTC)。因此,早期发现微转移不仅对肿瘤复发和预后的判断有重要意义,而且对指导临床治疗也有很大价值。而目前临床肿瘤的发现和诊断仍高度依赖于影像学及血清肿瘤标志物的检查,难以早期发现肿瘤的转移或复发,也难以及时反映疗效。因此,现有肿瘤常规筛查、诊断方法不能满足临床需求,临床迫切需要安全、准确性高、操作方便的癌症筛查、诊断新方法。血液中循环肿瘤细胞以较低的数量存在于血液中,一般需要富集后才能有效检测和分析。血液中的细胞种类繁多,要绝对准确地鉴定血液中的肿瘤细胞,并不容易。CTC在肿瘤患者外周血中极为稀少,约1~10个/mL,而正常成人外周血中所有血细胞浓度为109/mL,白细胞的浓度是4~10×106/mL。远低于血液中其他类型细胞数量的稀缺性使得CTC在血液检测中极具挑战性。CTC检测一般包括CTC富集和CTC鉴定两个部分,通常要通过富集的步骤以去除大部分正常细胞,然后再鉴定得到的细胞的确是CTC。CTC的富集方法主要分为物理方法和生物化学方法两大类。CTC的鉴定主要通过细胞形态学或核酸分子水平进行分析鉴定。CTC的富集方法主要分为物理方法和生物化学方法两大类。物理法基于肿瘤细胞与正常细胞物理性质,如大小、变形性、密度、介电性等的差异,利用外力场比如磁场,流体场,电场等的作用进行分离捕获。生物化学法通常依赖于细胞膜表面的抗原与偶联在分离介质上的抗体相结合,达到分离捕获的目的。现阶段应用于CTC的富集技术主要包括:基于细胞密度的离心法、基于细胞体积的滤膜过滤法(isolationbysizeofepithelialtumourcells,ISET)、免疫磁珠法(magneticactivatedcellsorting,MACS)、CTC-Chip微流控芯片技术等。现有密度梯度离心法特异性低、敏感性低、回收率低、稳定性低,不仅容易造成肿瘤细胞丢失,且依赖于肿瘤细胞的特性、离心的时间、温度等多种因素,作为单一的CTC分离手段未来发展潜力十分有限。ISET法虽然操作简便、价格低廉、通量高,可同时大批量处理样本,耗时较短,但存在缺乏特异性、肿瘤细胞被漏检(≦8um)的可能,同样不可能成为未来的发展趋势与潮流。CTC当前循环肿瘤细胞富集应用最广发的是阳性富集的方法,包括免疫磁珠法阳性富集、微流控芯片法阳性富集。微流控芯片应用于稀有细胞分选的不足主要表现在耗时长、效果差、细胞活性受损三个方面。此外,通量和纯度在大多数芯片中往往是互相制约的两个指标,通量上升则意味着纯度下降,反之亦然,如何兼顾两者是微流控分选技术发展的又一挑战。最后,考虑到捕获到的细胞可能含有不同的亚型,或是同一类细胞的不同生长阶段,后续的表型分析对临床诊断具有重要意义,这对捕获细胞的活性提出了较高的要求。但是,微通道中微结构的挤压,高剪切流的流场,外加的电场、声场等都会对细胞的活性造成一定的损伤,对后续分析造成困扰。申请号为201110161224.7的中国专利公开了一种定量分析循环肿瘤细胞的试剂及试剂盒,通过设计适宜检测循环肿瘤细胞的探针,从而可配合流式细胞技术,获得循环肿瘤细胞的测定结果。免疫磁珠法是目前应用最为广泛的CTC分离方法,主要是指阳性富集法,具有简便易行、分离纯度高的优点,但回收率低、存在漏检的缺陷也非常明显。目前,大量的免疫磁珠法CTC研究根据肿瘤的上皮抗原进行分离,并且认为EpCAM是目前最优的肿瘤生物标记物,但有研究表明大多数恶性肿瘤的CTC会丢失EpCAM抗原。这就意味着这种方法有可能会漏检具有侵害性的CTC。事实上,研究发现134种组织类型不同的肿瘤细胞只有70%表达EpCAM,但存在表达强度不一的差异性。目前,尚没有一种100%特异性的肿瘤生物标记物。但循环肿瘤细胞阳性富集方法存在着CTC特异性标志物缺乏、单克隆抗体筛选困难、回收率低、存在漏检(抗体无法识别的肿瘤细胞被忽略)等缺点,影响检测结果。由于CTC缺乏特异性的标志物,目前普遍采用EpCAM(上皮细胞粘附分子)磁珠标记并分离CTC,基于这一原理发展起来的CellSearch等仪器已经投入市场运作。然而,该方法无法检出低表达和不表达EpCAM的CTC。已有研究指出,基于这一原理分离CTC将低估其数量并丢失具有高转移及增殖潜力的CTC亚群。一个典型的例子就是,发生上皮-间质转化(EMT)的CTC低表达或不表达EpCAM亚群因为具有高的迁移力而被认为是造成转移的最主要原因之一。与免疫磁珠阳性富集方法相比,CTC免疫磁珠阴性富集方法具有更多的优势。该技术利用结合有CD45单克隆抗体的免疫磁珠特异性结合白细胞表面的CD45抗原(白细胞共同抗原),对白细胞进行磁性标记,通过外加磁场去除白细胞,从而可以不依赖CTC表面标记物,把CTC所有亚群、全部类型富集出来。CTC免疫磁珠阴性富集技术在分离出全部类型的CTC上具有技术优势,同时由于不依赖于CTC表面标记物,预期可用于所有类型实体瘤的CTC富集。因此,开发不依赖于CTC表面标记物的分离方法是一个具有巨大前景的技术方向。另一方面,阴性富集策略的免疫磁珠法通过有效去除CD45+的白细胞或CD61+的巨噬细胞、血小板等外周血其他细胞而间接富集稀有上皮细胞,某种程度上克服了EMT导致的EpCAM阳性富集策略的缺陷。此外,通过阴性富集策略得到的循环肿瘤细胞还具有没有经过任何标记、高细胞活性等优势。综上所述,现经报道的多种CTC分离方法虽然各自具有独特的检测优势,但仍暴露出一些问题,如循环肿瘤细胞回收率不高(70%-80%)、不能获得有活性的CTC、生物标记物选择困难、分离技术复杂等。技术实现要素:本发明所要解决的技术问题是:提供一种循环肿瘤细胞阴性富集方法,解决现有循环肿瘤细胞分离方法存在的循环肿瘤细胞回收率不高、不能获得有活性的循环肿瘤细胞,生物标记物选择困难、分离技术复杂的问题。为了解决上述技术问题,本发明采用的技术方案为:一种循环肿瘤细胞阴性富集方法,包括以下步骤:S1:将密度梯度分离液(Ficollpagueplus,GEHealth)和肿瘤患者血样在淋巴细胞分离管中混合,加入洗涤缓冲液,进行第一次离心;S2:将经过第一次离心的淋巴细胞分离管中挡板上层溶液转移至第一离心管中,进行第二次离心,吸去上清,加入红细胞裂解液,静置;S3:将经过静置后的第一离心管进行第三次离心,吸去上清,加入磁珠孵育缓冲液,再加入阴性富集免疫磁珠,混匀,孵育20-40min,所述阴性富集免疫磁珠结合有靶向白细胞表面广谱标记物CD45;S4:将上述经过孵育后的第一离心管放置在磁力架上静置,将上清液全部转移至第二离心管中,用洗涤缓冲液冲洗第二离心管;S5:将上述第二离心管进行第四次离心,吸去第二离心管上清液,在第二离心管中加入细胞固定液重悬后涂于载玻片上,过夜干燥,得到干燥的循环肿瘤细胞。本发明的有益效果在于:本发明公开的循环肿瘤细胞阴性富集方法,采用淋巴细胞分离管基础上的密度梯度离心对血样进行前处理,简化了白细胞分离操作步骤,缩短了循环肿瘤细胞的富集时间,整个操作在2.5h内即可完成;经处理后留下的白细胞数量相当于血样原始白细胞数量的30-50%,对留下的白细胞采用自制阴性富集免疫磁珠CD45标记白细胞并去除,减少了免疫磁珠的用量,大大节约了循环肿瘤细胞阴性富集的成本;本发明采用淋巴细胞分离管对血样进行前处理,并对循环肿瘤细胞阴性富集方法进行改良,有效提高了富集操作稳定性,循环肿瘤细胞的回收率达到85%以上;本发明还具有高灵敏度的优点,可以在数量极少的样品中稳定检出循环肿瘤细胞。附图说明图1为本发明具体实施方式的一种循环肿瘤细胞阴性富集方法与传统密度梯度离心法制得的循环肿瘤细胞的富集回收率柱状图;图2为本发明具体实施方式的一种循环肿瘤细胞阴性富集方法对不同类型肿瘤细胞的富集回收率柱状图;图3为本发明具体实施方式的一种循环肿瘤细胞阴性富集方法富集的SKOV3细胞后免疫荧光鉴定结果图;图4为本发明具体实施方式的一种循环肿瘤细胞阴性富集方法对不同数量NCI-H226循环肿瘤细胞的平均回收率柱状图;图5为本发明具体实施方式的一种循环肿瘤细胞阴性富集方法对不同数量NCI-H226循环肿瘤细胞的回收率线性回归图。具体实施方式为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。本发明涉及的缩略语和关键术语定义:CTC:循环肿瘤细胞;CD45:白细胞表面共同抗原;CK-FITC:异硫氰酸荧光素偶联细胞角蛋白抗体;CD45-PE:藻红蛋白蛋白偶联CD45抗体;DAPI:4',6-二脒基-2-苯基吲哚。本发明最关键的构思在于:采用淋巴细胞分离管基础上的密度梯度离心对血样进行前处理,简化了白细胞分离操作步骤,缩短了循环肿瘤细胞的富集时间,对留下的白细胞采用自制阴性富集免疫磁珠CD45标记白细胞并去除,减少了免疫磁珠的用量,大大节约了循环肿瘤细胞阴性富集的成本。一种循环肿瘤细胞阴性富集方法,包括以下步骤:S1:将密度梯度分离液(Ficollpagueplus,GEHealth)和肿瘤患者血样在淋巴细胞分离管中混合,加入洗涤缓冲液,进行第一次离心;S2:将经过第一次离心的淋巴细胞分离管中挡板上层溶液转移至第一离心管中,进行第二次离心,吸去上清,加入红细胞裂解液,静置;S3:将经过静置后的第一离心管进行第三次离心,吸去上清,加入磁珠孵育缓冲液,再加入阴性富集免疫磁珠,混匀,孵育20-40min,所述阴性富集免疫磁珠结合有靶向白细胞表面广谱标记物CD45;S4:将上述经过孵育后的第一离心管放置在磁力架上静置,将上清液全部转移至第二离心管中,用洗涤缓冲液冲洗第二离心管;S5:将上述第二离心管进行第四次离心,吸去第二离心管上清液,在第二离心管中加入细胞固定液重悬后涂于载玻片上,过夜干燥,得到干燥的循环肿瘤细胞。本发明的循环肿瘤细胞阴性富集原理:本发明公开了一种循环肿瘤细胞的检测方法,主要步骤包括利用密度梯度离心去除红细胞及大量中性粒细胞,通过红细胞裂解,进一步去除残余红细胞,将得到的白细胞与自制阴性富集免疫磁珠(靶向白细胞表面广谱标记物CD45)进行孵育,经磁场吸附去除白细胞,收集未与磁珠结合的上清部分,离心后涂片,空气干燥制片,制得干燥的循环肿瘤细胞。上述循环肿瘤细胞阴性富集方法,采用淋巴细胞分离管基础上的密度梯度离心对血样进行前处理,简化了白细胞分离操作步骤,缩短了循环肿瘤细胞的富集时间,整个操作在2.5h内即可完成;留下的白细胞数量相当于血样原始白细胞数量的30-50%,对留下的白细胞采用自制阴性富集免疫磁珠CD45标记白细胞并去除,减少了免疫磁珠的用量,大大节约了循环肿瘤细胞阴性富集的成本;本发明采用淋巴细胞分离管对血样进行前处理,并对循环肿瘤细胞阴性富集方法进行改良,有效提高了富集操作稳定性,循环肿瘤细胞的回收率达到85%以上;本发明还具有高灵敏度的优点,可以在数量极少的样品中稳定检出循环肿瘤细胞。进一步的,所述S1具体为:在淋巴细胞分离管中加入密度梯度分离液,瞬时离心使密度梯度分离液全部离心到管底;在装有密度梯度分离液的淋巴细胞分离管中加入3mL的肿瘤患者血样,并加入大于3mL的洗涤缓冲液,进行第一次离心,所述第一次离心的条件为25℃、800g/15min。进一步的,所述S2具体为:将上述经过第一次离心的淋巴细胞分离管中挡板上层溶液转移至第一离心管中,进行第二次离心,所述第二次离心的条件为25℃、300g/10min,吸去上清,加入5mL的红细胞裂解液,静置5min。进一步的,所述S3具体为:将经过静置后的第一离心管进行第三次离心,所述第三次离心的条件为25℃、300g/10min,吸去上清,加入5mL磁珠孵育缓冲液,再加入200uL阴性富集免疫磁珠,吹打混匀,于4℃低速垂直混匀,孵育30min,所述阴性富集免疫磁珠结合有靶向白细胞表面广谱标记物CD45。进一步的,所述S4具体为:将上述经过孵育后的第一离心管放置在磁力架上静置5min,将上清液全部转移至第二离心管中,用洗涤缓冲液冲洗第二离心管2次。进一步的,所述S5具体为:将上述第二离心管进行第四次离心,吸去上清液至剩余体积为100uL,在第二离心管中加入100uL细胞固定液,重悬后涂于载玻片上,25℃过夜干燥,得到干燥的循环肿瘤细胞,所述第四次离心的条件为25℃、600g/5min。进一步的,所述的循环肿瘤细胞阴性富集方法还包括步骤:S6:利用多色免疫荧光技术对干燥的循环肿瘤细胞进行鉴定并荧光计数。进一步的,所述多色免疫荧光技术采用的染料为CK-FITC、CD45-PE或DAPI。对比实施例1在健康人外周血中掺入一定数量的SiHa细胞,以模拟宫颈癌患者含有循环肿瘤细胞血样,按比例稀释得到2×104的细胞悬液,并在荧光显微镜下精确计数并调整至100个/5uL,将计数后细胞悬液掺入3mL外周血,分别制得含有100个SiHa细胞/3mL的外周血样,以上述血样作为肿瘤患者血样,分别按照以下三种血液前处理方案(A、红细胞裂解;B、密度梯度离心;C、红细胞裂解+密度梯度离心)处理后,分别按照实施例1的步骤进行循环肿瘤细胞阴性富集;对红细胞去除效率、白细胞去除效率进行评价。不同血液前处理方案红细胞去除效率、白细胞去除效率如表1所示。表1.不同血液前处理方案的红细胞去除效率、白细胞去除效率血液前处理方案红细胞去除效率白细胞去除效率红细胞裂解~98~99.5%>99.5%密度梯度离心>99.5%~99.7-99.9%红细胞裂解+密度梯度离心>99.99%~99.7-99.9%由表1看出,采用红细胞裂解+密度梯度离心的前处理方式,红细胞去除效率和白细胞去除效率最高。实施例1一种循环肿瘤细胞阴性富集方法,包括以下步骤:S1:在淋巴细胞分离管中加入密度梯度分离液,瞬时离心使密度梯度分离液全部离心到管底;在装有密度梯度分离液的淋巴细胞分离管中加入3mL的肿瘤患者血样,并加入大于3mL的洗涤缓冲液,进行第一次离心,所述第一次离心的条件为25℃、800g/15min;S2:将上述经过第一次离心的淋巴细胞分离管中挡板上层溶液转移至第一离心管中,进行第二次离心,所述第二次离心的条件为25℃、300g/10min,吸去上清,加入5mL的红细胞裂解液,静置5min;S3:将经过静置后的第一离心管进行第三次离心,所述第三次离心的条件为25℃、300g/10min,吸去上清,加入5mL磁珠孵育缓冲液,再加入200uL阴性富集免疫磁珠,吹打混匀,于4℃低速垂直混匀,孵育30min,所述阴性富集免疫磁珠结合有靶向白细胞表面广谱标记物CD45;S4:将上述经过孵育后的第一离心管放置在磁力架上静置5min,将上清液全部转移至第二离心管中,用洗涤缓冲液冲洗第二离心管2次;S5:将上述第二离心管进行第四次离心,吸去上清液至剩余体积为100uL,在第二离心管中加入100uL细胞固定液重悬后涂于载玻片上,25℃过夜干燥,得到干燥的循环肿瘤细胞,所述第四次离心的条件为25℃、600g/5min;S6:利用多色免疫荧光技术对干燥的循环肿瘤细胞进行鉴定并荧光计数,所述多色免疫荧光技术采用的染料为CK-FITC、CD45-PE或DAPI。实施例2请参照图1,在健康人外周血中掺入一定数量的SiHa细胞,以模拟宫颈癌患者含有循环肿瘤细胞血样,并评价所建立循环肿瘤细胞阴性富集方法对循环肿瘤细胞的富集效率,具体监测步骤如下:1、将培养并消化收获的SiHa细胞用CelltrackerGreen进行绿色荧光预先标记,按比例稀释得到2×104的细胞悬液,并在荧光显微镜下精确计数并调整至100个/5uL;2、将计数后细胞悬液掺入3mL外周血,分别制得含有100个SiHa细胞/3mL的外周血样本;3、对含有100个SiHa细胞/3mL的外周血样本分别按照以下两种方案分别进行循环肿瘤细胞阴性富集;A、传统密度梯度离心法;B、淋巴细胞分离管密度梯度离心(改进方案)4、采用实施例1的循环肿瘤阴性富集方法富集并检测外周血样本,并对循环肿瘤细胞阴性富集方法的富集效率进行评价。从图1看出,采用淋巴细胞分离管密度梯度离心结合循环肿瘤阴性富集方法得到SiHa细胞的回收率达到89%,显著高于传统密度梯度离心法得到SiHa细胞的回收率76%。实施例3请参照图2及图3,在健康人外周血中掺入一定数量的卵巢癌SKOV-3、宫颈癌SiHa细胞、乳腺癌SKBR3细胞,评价本方案涉及的循环肿瘤细胞阴性富集方法是否适用于不同肿瘤类型的循环肿瘤细胞检测,具体检测步骤如下:1、在本实施例中以100个卵巢癌SKOV-3、宫颈癌SiHa细胞、乳腺癌SKBR3细胞掺入健康人外周血的方法,以模拟不同肿瘤患者含有循环肿瘤细胞血样,将培养并消化收获的不同肿瘤类型细胞用CelltrackerGreen进行绿色荧光预先标记,按比例稀释得到不同浓度的细胞悬液,并在荧光显微镜下精确计数。2、将计数后细胞悬液掺入3mL外周血,制得100个不同类型肿瘤细胞/3mL的外周血样本。3、采用实施例1的循环肿瘤阴性富集方法富集并检测外周血样本。从图2看出,采用本发明涉及的循环肿瘤阴性富集方法对不同类型肿瘤细胞的富集回收率均在85%以上。实施例4请参照图4,在健康人外周血中掺入不同数量NCI-H226细胞,以其为血样,采用实施例1的循环肿瘤细胞富集方法评价循环肿瘤细胞富集效率,具体检测步骤如下:1、在本实施例中以非小细胞肺癌NCI-H226细胞掺入健康人外周血的方法,以模拟肺癌患者含有循环肿瘤细胞血样。将培养并消化收获的NCI-H226细胞用CelltrackerGreen进行绿色荧光预先标记,按比例稀释得到不同浓度的细胞悬液,并在荧光显微镜下精确计数。2.将计数后细胞悬液掺入3ml外周血,分别制得含有6、9、15、30、90、300个NCI-H226细胞/3ml的外周血样本。3.采用本发明所公开的循环肿瘤细胞阴性富集试剂盒,利用上述方法富集外周血样本中的循环肿瘤细胞,空气干燥制片后,对CellTracker+的绿色荧光细胞计数,对循环肿瘤细胞阴性富集方法的富集效率、灵敏度进行评价。从图4看出,采用本发明涉及的循环肿瘤细胞阴性富集方法对不用数量的NCI-H226细胞的外周血样本进行循环肿瘤细胞富集的回收率均达到较高的水平,其中,含有9、15、30个NCI-H226细胞/3ml的外周血样本的平均回收率均在85%以上,从图5看出,不同数量循环肿瘤细胞整体富集的整体回收率为77.66%,说明本发明涉及的循环肿瘤细胞富集方法具有较高的灵敏度。综上所述,本发明提供的循环肿瘤细胞阴性富集方法,采用淋巴细胞分离管基础上的密度梯度离心对血样进行前处理,简化了白细胞分离操作步骤,缩短了循环肿瘤细胞的富集时间,整个操作在2.5h内即可完成;留下的白细胞数量相当于血样原始白细胞数量的30-50%,对留下的白细胞采用自制阴性富集免疫磁珠CD45标记白细胞并去除,减少了免疫磁珠的用量,大大节约了循环肿瘤细胞阴性富集的成本;本发明采用淋巴细胞分离管对血样进行前处理,并对循环肿瘤细胞阴性富集方法进行改良,有效提高了富集操作稳定性,循环肿瘤细胞的回收率达到85%以上;本发明还具有高灵敏度的优点,可以在数量极少的样品中稳定检出循环肿瘤细胞。以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的
技术领域:
,均同理包括在本发明的专利保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1