一种肺癌EGFRT790M位点的ddPCR检测优化方法及应用与流程
本发明涉及基因检测领域,特别是涉及一种肺癌egfrt790m位点的ddpcr检测优化方法及应用。
背景技术:
肺癌是最常见的肺原发性恶性肿瘤,绝大多数肺癌起源于支气管粘膜上皮,故亦称支气管肺癌。近50多年来,世界各国特别是工业发达国家,肺癌的发病率和病死率均迅速上升,死于癌病的男性病人中肺癌已居首位。肺癌是全世界发病率和死亡率最高的恶性肿瘤,5年生存率仅为16.8%,每年新确诊肺癌患者达到160万,肺癌同时也是癌症患者死亡的首要病因,每年有140万的人口死于肺癌。2015年美国癌症协会(americancancersociety,acs)预计将有222,200新发肺癌病例,158,040人死于肺癌,约占美国所有癌症死亡的27%。肺癌多在40岁以上发病,发病年龄高峰在60~79岁之间,男女患病率为2.3:1。另外种族、家属史与吸烟对肺癌的发病均有影响。临床上对肺癌有一个简单的分法,将之分为小细胞肺癌(缩写sclc)以及非小细胞肺癌(缩写nsclc)。
小细胞肺癌约占所有肺癌病理类型中的15%,小细胞肺癌肿瘤细胞倍增时间短、进展快,常伴内分泌异常或类癌综合征;由于患者早期即发生血行转移且对放化疗敏感,故小细胞肺癌的治疗以全身化疗为主,联合放疗和手术进行综合治疗。综合治疗是治疗小细胞肺癌成功的关键。非小细胞肺癌约占所有肺癌病理类型中的85%。这两种类型的肺癌的治疗方案是截然不同的。小细胞肺癌患者主要用化学疗法治疗,外科手术治疗对这种类型肺癌患者并不起主要作用。但是,外科手术治疗对非小细胞肺癌患者来说确实一个很重要的治疗手段。目前对于肺癌的检测包括x-射线扫描、ct、pet-ct、核磁共振、穿刺活检等,但是大于70%的患者确诊时已处于癌症晚期。肿瘤的治疗效果与肿瘤的早期发现有很大的关系,越早发现就越有可能治愈。因此研发一种为肺癌早期诊断提供参考信息的检测技术迫在眉睫。
《asco年度报告:2015临床肿瘤学进展》中,液体活检技术被列为肿瘤治疗领域下一个十年趋势之一。循环肿瘤dna(circulatingtumordna,缩写ctdna),作为液体活检的首选已逐渐从科研走向临床。而欧盟批准将ctdna检测用于易瑞沙的伴随诊断则更是标志着ctdna临床应用的大规模实现。循环肿瘤dna指的是由肿瘤细胞释放到血液循环系统中的dna。由于其基本无创,并且能够获得肿瘤的所有突变信息,很好的解决了肿瘤异质性等问题,因此是一类具备广泛应用前景的肿瘤标志物,可用于肿瘤发展及预后状态的无创检测。血浆游离dna(cell-freedna,缩写cfdna)在很早期就被发现,但是其在肿瘤方面的研究却经历了漫长的过程。1948年,科学家第一次报告了人体血液中存在dna循环;1977年,明确提出癌症患者血液中的dna循环。人们又花费17年时间指出,这些dna出现了与癌症有关的突变。但循环dna的首次实际使用来自另一个领域。目前就职于中国香港中文大学的化学病理学家dennislo推断,如果肿瘤涌出携带dna的血液,胎儿也能如此。1997年,他成功论证了怀有男婴的孕妇血液中会携带y染色体。这一发现使得医生可以在孕期初期不干扰胎儿的前提下检查胎儿性别,并能不依靠侵入性试验筛查唐氏综合征等发育性疾病。这也成为妇产诊断学领域的革命性成果。但是存在于外周血液中的游离dna与癌症关系的理解十分缓慢,部分原因是ctdna比胎儿dna更难探测。ctdna在血液中的含量非常少且极为多变。对患有晚期癌症的患者而言,外周血中ctdna的含量相对较高;但一般而言,ctdna仅占总数的1%,甚至少到0.01%。随着肿瘤的疾病进展,ctdna在血液中的含量也随之升高。因此,如果在超早期就能对血液中含有的极微量的ctdna进行捕获测序,为肿瘤早期诊断及相关突变提供参考依据,那么对于癌症的早期发现将是革命性的进步。
ctdna可能比蛋白质生物标识表现得更好。蛋白质被用于临床疾病诊断,并对正在接受治疗的患者进行监控。例如,前列腺特异性抗原是前列腺肿瘤的生物标识,但它却会出现假阳性结果,因为出于其他原因,如机体炎症、甚至饮食等,前列腺特异性抗原在血液中的含量也会升高,导致假阳性结果。但ctdna出现假阳性的几率更低,因为它是由具有癌细胞印记的突变和其他遗传变化定义的。尽管大多数蛋白质生物标识能在血液中存在数周,而ctdna的半衰期不到两个小时,这增加了ctdna检测难度。剑桥团队与约翰斯·霍普金斯团队分别发现,在监测乳癌和肠癌时,与蛋白质生物标识相比,ctdna更加敏感,并且在追踪肿瘤消失、扩散和复发时,ctdna也更准确。另外,完整的循环肿瘤细胞(缩写ctc)也会在血流中移动,剑桥团队与约翰斯·霍普金斯团队还发现,ctdna比ctc更敏感。在实验中,diaz研究小组发现,当ctdna和ctc两者都存在时,ctdna碎片在数量上要超过循环肿瘤细胞,两者的数量比例大概是50:1。而johnshopkins的研究小组进一步发现,凡是血液里发现了ctc的也能发现ctdna,但是发现了ctdna的却不见得一定能发现ctc。
ctdna检测很好的解决了肿瘤的异质性问题。2012年,charlesswanton与同事在英国癌症研究中心伦敦研究所从少量肾脏肿瘤组织中提取dna,以期找到一些不同的变异,但是单一肿瘤的遗传多样性的宽度让他们十分震惊。扩散到其他部位的继发性肿瘤又出现了不同。然而ctdna是来自于肿瘤细胞的碎片dna,携带原位肿瘤和转移灶的基因变异信息。ctdna的检测技术很好的解决了肿瘤的异质性问题。
传统的肺癌治疗方式包括外科手术治疗、放疗和化疗等。外科手术治疗虽然可以切除肿瘤,但是手术过程中可能无法完全切除或引起肿瘤转移,还可能造成器官损伤及身体免疫力降低;化疗是一种全身性的治疗,效果明显和迅速,但是在杀伤肿瘤细胞的同时也可能会把正常细胞一起杀灭,所以,化疗算得上是一种“玉石俱焚”的治疗方法;放疗在某些肿瘤方面可以达到手术切除的效果,但放疗成本高,周期长,并发症也较多。靶向治疗作为一种新兴治疗手段,由于其毒性小,副作用少并且能够大大提升患者生存周期以及生活质量而得到广泛的应用。然而靶向药物的选择依赖于患者的基因分型,靶向药物往往有其对应的靶基因,当该基因发生突变时某条调控细胞增殖分裂的信号通路被持续激活,或者是调控细胞凋亡的信号通路被抑制,当使用相应的靶向药物之后,该通路被阻断,肿瘤细胞被杀死。因此针对肺癌的靶基因以及其驱动基因的检测技术的开发是应用靶向治疗的基础。
现有的肿瘤基因检测优化方法主要包括qpcr、一代测序、fish、ihc等。这些方法检测步骤繁琐,且敏感度低,况且针对fish以及ihc的检测结果还需要有经验的技术人员进行鉴定。
综上所述,现有的肺癌检测优化方法存在如下缺陷与不足:第一,传统检测优化方法主要依靠技术人员的经验进行结果判读,不能直接客观、准确反映检测结果,也不能对dna进行绝对定量;第二,现有的基于肺癌egfrt790m的检测优化方法,通常对样本的cfdna总量和质量要求高,低质量样本检测受限;第三,现有的基于肺癌egfrt790m的检测优化方法检测步骤繁琐,且检测灵敏度低,会存在一定量的假阳性检测结果,尤其是血浆样本中cfdna假阳性检出率更高,因为cfdna主要是来源于胚系起源的良性细胞,ctdna占比相对低很多;第四,有文献资料显示在cfdna提取过程中加入carrierrna并不能促使cfdna提取总量增加,很有可能会使gdna大片段聚沉。
技术实现要素:
有鉴于此,本申请的目的是提供一种肺癌egfrt790m位点的ddpcr检测优化方法及应用。
为了实现上述目的,本申请采用了以下技术方案:
本申请的一方面公开了一种肺癌egfrt790m位点的ddpcr检测优化方法,包括如下步骤:
1)对血浆中cfdna提取优化,提高cfdna纯度,降低cfdna投入量;
2)采用针对肺癌相关的egfrt790m位点设计引物对cfdna进行扩增;
3)采用针对肺癌相关的egfrt790m位点设计的探针对cfdna扩增产物进行检测,对探针荧光信号值进行数据分析,获得准确的egfrt790m位点信息。
本申请的检测优化方法,以ctdna为检测对象,能够实时的反映肺癌egfrt790m的突变情况,检测只需要少量外周血液样品即可,真正实现了无创检测。并且,本申请的检测优化方法,针对肺癌egfrt790m设计了突变型和野生型荧光检测探针,用于检测cfdnapcr扩增产物,能够准确获得egfrt790m的位点信息。本申请中,egfrt790m是肺癌用药相关的靶标基因,egfrt790m突变检测能够辅助医生针对晚期nsclc患者制定靶向治疗方案提供参考依据。
需要说明的是,本申请的肺癌egfrt790m位点的检测优化方法,其检测结果,仅仅用于分析和判断靶标基因的突变信息,并为用药或治疗提供可靠的分析依据。本申请的检测优化方法可以对受检对象的外周血中极其微量的ctdna进行检测,从而为晚期nsclc患者的治疗、个体化精准用药指导以及疗效监测等提供了可靠的分析依据。
还需要说明的是,本申请中,cfdna是指外周血中游离的dna片段,这些片段包括ctdna,并且,如前面提到的,ctdna在其中的含量很低,甚至少到0.01%;因此,本申请提出了优化cfdna提取方法,且利用ddpcr技术和针对egfrt790m位点设计的特异性扩增引物对和突变型、野生型荧光检测探针对cfdna进行pcr扩增、检测,以保障能够有效的检测到极其微量的ctdna低频突变。
优选的,步骤1)中,对cfdna提取进行优化包括,在抽取之后4h内进行分离,外周血在抽提过程中不加入carrierrna,抽提过程中采用两步醇沉纯化法,提高cfdna提取纯度。
优选的,外周血的分离条件为:外周血第一次离心(1600g,10min)后分离为血细胞和血浆(上清液),血细胞储存在-80℃保存;血浆样本进行第二次离心(16000g,10min),取上清液转移至保存管中,置于-80℃保存。
优选的,两步醇沉纯化法为:第一步异丙醇沉淀cfdna、洗去杂质,第二步无水乙醇沉淀、洗去杂质之后洗脱即为所需的cfdna样本。
需要说明的是,本申请的肺癌egfrt790m位点ddpcr检测优化方法,其中另一个关键步骤就在于针对egfrt790m位点设计的突变型检测探针、野生型检测探针以及目的区域扩增的pcr引物对的设计。ctdna在外周血中的含量极低,特别是在复发的nsclc患者的外周血中。因此,如何设计特异性高的pcr扩增引物以及用于检测的荧光探针,以满足超微量ctdna的检测,是直接影响检测效果和检测质量的关键因素。本申请针对egfr20号外显子t790m突变位点上下游特定区域设计特异性高的pcr扩增引物对,针对egfrt790m突变位点上下游特定区域设计了特异性高的突变型荧光检测探针和野生型荧光检测探针,并对pcr循环数和退火温度进行优化,能够在cfdna低投入量的情况下检出egfrt790m低频突变,为晚期nsclc的靶向治疗方案制定提供了重要的参考依据。
还需要说明的是,本申请中微滴乳化、pcr扩增和微滴检测步骤都可以参考ddpcr常规的方法进行,只是,本申请的优选方案中对其中个别步骤进行了特殊限定,这将在后续的技术方案中详细介绍。
优选的,步骤2)中,pcr扩增过程中采用针对egfrt790m位点设计的特异性引物对,并且引物对的序列如seqidno:1和seqidno:2所示,或引物对的序列如seqidno:5和seqidno:6所示,或引物对的序列如seqidno:9和seqidno:10所示。
优选的,步骤3)中,检测过程中根据egfrt790m野生型和突变型位点设计的特异性荧光探针;其中突变型检测探针序列如seqidno:3,或seqidno:7,或seqidno:11所示;野生型检测探针序列如seqidno:4,或seqidno:8,或seqidno:12所示。
需要说明的是,本申请的检测优化方法中egfrt790m位点的选择是因为该位点对egfr-tki治疗方案的选择具有指导意义。egfr激酶结构域是由18-24号外显子组成,而egfr激酶激活突变最常见于18-21号外显子,这些激活突变聚集围绕在egfr酪氨酸激酶的atp结合的口袋周围。19号外显子小片段缺失和21号外显子l858r突变增强了nsclc细胞对第一代和第二代酪氨酸激酶抑制剂(tki)的敏感性。吉非替尼、厄洛替尼和阿法替尼等tki是具有19号外显子缺失和21号l858r突变的大多数晚期肺癌患者的首选治疗方式。egfr20号外显子t790m突变则是常见的第一代和第二代egfr-tki获得性抗性的机制,该突变可以提高atp激酶的亲和力,从而降低抑制剂疗效。azd9291是针对t790m突变的第三代egfr抑制剂,已被批准用于t790m阳性晚期nsclc治疗。
优选的,步骤3)中,检测探针的3’端均具有mgb-nfq修饰,野生型检测探针5’端具有hex荧光基团修饰,突变型检测探针5’端具有fam荧光基团修饰。
需要说明的是,fam和hex属于荧光基团,nfq属于猝灭基团。当fam基团或hex基团与nfq基团在同一序列上时,由于我们设计的探针长度<20bp,两个基团位置相聚很近,此时fam荧光基因或hex荧光基团因为nfq猝灭基团的作用而不产生荧光信号;当荧光探针结合在靶标序列上后,会因为taq酶的扩增作用而被降解,从而导致fam荧光基因或hex荧光基团与nfq猝灭基团分离,荧光信号得以释放,从荧光信号数值可以分析得到检测位点的突变率。
优选的,步骤2)-步骤3)中,pcr扩增、检测体系采用的引物/探针比例是经过优化调整的。
优选的,步骤2)-步骤3)中,pcr扩增、检测的退火温度是根据探针和引物的gc含量确定、优化的。
优选的,数据分析包括荧光阈值确定,检测阈值确定,以及阴、阳性结果判读;荧光阈值的确定包括空白对照组和阴性对照组荧光阈值的确定;检测阈值的确定包括最低检测限的阳性对照组阈值的确定;阴、阳性结果的判读包括依据阴性对照组、最低检测限的阳性对照组以及强阳性对照组的数据分析对检测结果进行分析、判定。
本申请的另一面还公开了本申请的检测优化方法在肺癌检测试剂盒或肺癌检测设备中的应用。
可以理解,本申请的检测优化方法就是针对肺癌egfrt790m位点设计的,因此,完全可以应用于各种肺癌检测试剂盒或检测设备,获得实时、准确的肺癌egfrt790m位点的突变信息,从而为肺癌用药等提供参考依据。
本申请的另一面公开了一种肺癌egfrt790m检测的试剂盒,试剂盒中含有本申请的肺癌egfrt790m位点的突变型和野生型荧光检测探针,以及对目标区域pcr特异性扩增的引物对;并且,试剂盒采用本申请的检测优化方法对待测样品进行检测。
由于采用以上技术方案,本申请的有益效果在于:
本申请的肺癌egfrt790m检测优化方法,以ctdna为检测对象,优化外周血中cfdna的提取,并针对肺癌egfrt790m位点设计了突变型、野生型荧光检测探针和对目标区域pcr特异性扩增引物对,能够准确、实时的反映egfrt790m位点的变异情况。并且,以ctdna为检测对象,只需要少量的外周血即可完成检测,真正实现了无创检测。本申请的检测优化方法针对ctdna中的肺癌egfrt790m位点进行pcr扩增、检测分析,针对晚期nsclc患者提供用药相关的egfrt790m位点突变信息,为肺癌患者个体化精准用药指导、药效评估以及靶向治疗动态监测提供了重要的参考依据。
附图说明
图1是本申请实施例中提取的cfdna的质控检测结果图;
图2是本申请实施例中cfdna样本t790m突变型位点检测一维结果图;
图3是本申请实施例中cfdna样本t790m野生型位点检测一维结果图;
图4是本申请实施例中cfdna样本t790m突变型、野生型位点检测二维结果图;
图5是本申请实施例中cfdna样本突变率统计图。
具体实施方式
21世纪初,随着分子生物学研究的不断深入,可以根据各种分子标志物表达的不同将nsclc进行分子表型分类,并以与肿瘤发生、发展相关的驱动性基因为靶点,研发新的药物,进行有针对性的个体化分子靶向治疗。据美国国家综合癌症网(缩写nccn)nsclc临床指南推荐,肺癌患者在使用egfr-tki之前应进行egfr的基因检测,以选择获益人群。2013年,nccnnsclc临床指南提出tki治疗耐药与特定的获得性egfrt790m突变有关;2016年,nccnnsclc临床指南指出egfrt790m突变的患者,osimertinib可以作为二线治疗的选择之一,推荐级别为2a。目前市场上针对肺癌的基因检测主要是fish、arms、一代测序技术或者是二代高通量测序技术。这些检测手段都存在很多弊端,例如:全基因组或者全外显子组的检测,虽然检测内容丰富,但是成本高,而且检测出来的绝大多数信息与肺癌无关;fish检测结果的准确性高度依赖于检测人员的经验和技能;二代高通量测序检测步骤繁琐,工作量较大,检测周期较长,仅检测1-2个基因位点的突变信息费用较高。因此迫切需要针对肺癌egfrt790m位点检测开发一种快速、便捷、准确、经济的检测技术,以便实现肺癌靶向治疗动态实时监测。
本申请正是在这样的基础上,针对目前市场上的肺癌基因检测优化方法存在的不足或缺陷,创造性的提出了一种实时、无创、精准、快速的肺癌egfrt790m位点的检测优化方法。本申请的检测优化方法以外周血中极其微量的ctdna为检测对象,与传统的通过手术提取病变组织进行检测的方法相比,不仅实现了真正的无创检测,而且在本申请的一种实现方式中,通过微滴乳化技术,降低背景噪声,使得检测优化方法的灵敏度和准确性大幅度提升。
本申请以ctdna为检测对象,ctdna的检测存在很多技术上的壁垒,不仅因为ctdna在血液中的含量很低,而且其半衰期很短,所以难以捕获、检测。虽然这增加了ctdna的检测难度,但是,本申请通过对cfdna提取、纯化及片段大小,荧光检测探针设计,以及对cfdna微滴乳化后再pcr扩增等进行优化,克服了这些技术问题;其半衰期短反而能够实时的反映肺癌的变化情况。
本申请的肺癌egfrt790m的检测优化方法,可为肺癌靶向用药提供关键的靶标突变位点信息,并可根据患者的个体差异性,辅助医生选择合适的治疗药物、制定个体化的治疗方案,延长患者生存时间,提高生活质量。本申请的肺癌egfrt790m检测优化方法也能为肺癌靶向治疗动态监测提供重要的参考依据。本申请的一种实现方式中,乳化微滴生成数能达到20000个,检测结果的灵敏度能达到0.05%。
在目前市场上针对肺癌egfrt790m位点检测设计的产品不多,而且也存在很多缺陷的情况下,本申请提出了基于ctdna的肺癌egfrt790m位点的检测优化方法,能够检测超微量的ctdna,并且,能且仅能够对肺癌egfrt790m位点进行特异性扩增和检测,这样在尽可能减少成本的基础上获得最有效的信息;检测灵敏度可达到0.05%,解决了ctdna含量低、检测难的问题。
本申请中涉及的名词解释如下:
荧光检测探针,是指针对肺癌egfrt790m的野生型位点和突变型位点设计的带有荧光基团、mgb基团和nfq猝灭基团的探针,这些捕获探针确保了t790m的野生型和突变型位点能够被准确的检测,不遗漏,也没有其它基因的干扰,保障了检测的精准。
pcr特异性扩增或pcr扩增,是指利用pcr扩增的方法,对外周血中提取的极其微量的cfdna进行egfrt790m特定目的区域的扩增。
下面通过具体实施例和附图对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。
实施例
本例的检测优化方法主要包括,从血液中提取游离循环dna,利用设计的肺癌egfrt790m的荧光检测探针进行pcr扩增、检测,最后对荧光信号数据进行分析,获得肺癌egfrt790m的变异信息,如图5所示。
本例的检测优化方法主要由三部分组成,提出了一种实时、无创、精准的肺癌egfrt790m位点突变检测技术解决方案。
第一部分,cfdna的提取优化。
第二部分,ctdna肺癌egfrt790m位点的扩增、检测。
第三部分,egfrt790m位点荧光信号数值的分析,检测出与肺癌egfrt790m位点变异信息,配合临床指导用药、靶向治疗效果监测。
第一部分cfdna提取优化。
外周血中的ctdna含量很低,比例约为1/1000,因此保证血浆cfdna提取质量至关重要。本例以来自四川华西医院的编号为lc20161017的肺癌样本为例,cfdna提取方案详细步骤如下:
1.外周血cfdna的提取纯化,通常采用5~10ml全血,本例具体采用3ml全血进行试验,在获得血液的4h内分离血浆,将全血4℃1600g离心10min,收集上清至1.5ml离心管中;再将上清4℃16000g离心10min,收集上清血浆转移至1.5ml离心管中。分离好的血浆最好是立即提取dna,这样是为了保证血浆中dna的完整性。提取血浆中游离dna的试剂盒有很多种,如:qiagen公司的血浆/血清游离dna提取试剂盒、omega公司的血浆游离dna提取试剂盒、重鼎的核酸提取/纯化试剂盒等。本例具体采用核酸提取或纯化(重鼎,zd-yl-midi-40)进行试验,优化提取步骤如下:
(1)取10ml离心管,先加入proteinasek(蛋白酶k)10μl,再加入1ml离心后上层血浆后再加入1ml溶液gh,漩涡混合15sec。37℃温育10min。
(2)加入1ml异丙醇(第一次醇沉),漩涡混合15sec,室温静置20min。将液体移入套有收集管的中量离心柱后离心(10000rpm,1min),取出离心柱后弃去收集管中废液,将离心柱放回收集管中。
(3)向离心柱中加入2.5ml溶液w1a(已加入无水乙醇),离心(10000rpm,2min),取出离心柱后弃去收集管中废液,将离心柱放回。
(4)向离心柱中加入4ml溶液w2(已加入无水乙醇),离心(10000rpm,2min),取出离心柱后弃去收集管中废液,将离心柱放回。
(5)向离心柱中加入1ml无水乙醇,离心(10000rpm,2min)。
(6)将离心柱小心取出(勿让离心柱碰到废液),放入新的15ml离心管中,开盖放置10min,挥发残余乙醇。
(7)向离心柱中加入450μl溶液te,室温静置5min后,离心(10000rpm,3min),再将离心下的te溶液重新加入离心柱中,室温静置2min后,离心(10000rpm,3min),再将离心柱内壁残余的te溶液移至吸附膜中央,离心(10000rpm,3min)(此步洗脱非常重要,能避免cfdna损失);弃去15ml离心管内的中量离心柱,向管内洗脱液中加入1ml溶液bk,混匀;再加入1ml无水乙醇,混匀后室温静置5-10min(第二次醇沉)。
(8)将700μl混匀液移入套有收集管的微量离心柱中,离心(10000rpm,30s),弃废液。
(9)重复步骤8),直至混匀液全部过柱。
(10)12000rpm,空转。
(11)将离心管盖打开,室温静置5min,挥发残留乙醇。
(12)将离心柱取出并放入新的1.5ml离心管中。向柱中加入溶液nfwater(50~60℃预热,提高洗脱效率)5~20μl,室温静置5min,离心(12000rpm,2min);再将离心下的nfwater移至微量吸附柱内,室温静置2min,离心(12000rpm,2min),进行二次洗脱,离心获得的溶液即为提取的cfdna样本。
(13)cfdna质控:采用agilent4200tapestation核酸分析仪检测提取的cfdna的片段大小,采用lifequbit2.0测定提取的cfdna的浓度。
结果显示,lc20161017样本采用1ml血浆,最后提取获得的cfdna浓度为1.1ng/μl;提取的cfdna的片段大小如图1所示,在171bp左右有一个大峰,323bp左右有一个小峰,可见,样本完整性较好,而且没有基因组dna污染。
需要说明的是,如果分离好的血浆不能立即提取dna也可以放置在-80℃冰箱保存,以后再提取dna。
第二部分,ctdna肺癌egfrt790m位点的扩增、检测。
本例的检测采用的egfrt790m目的区域pcr扩增上、下游引物是深圳市海普洛斯生物科技有限公司自主发明设计的。上游引物长度为19bp,下游引物长度为24bp。
本例的检测采用的egfrt790m突变型荧光检测探针和野生型荧光检测探针是深圳市海普洛斯生物科技有限公司自主发明设计的。突变型荧光检测探针从5’端到3’端依序包括fam荧光基团、突变位点结合序列、mgb修饰基团和nfq猝灭基团。这种探针在退火时与egfrt790m突变型位点结合,此时fam荧光基团与nfq猝灭基团因为距离相近,不产生荧光信号。在pcr扩增过程中,探针因为taq酶水解作用分解,fam荧光基团与nfq猝灭基团分离,释放荧光信号。野生型荧光检测探针从5’端到3’端依序包括hex荧光基团、突变位点结合序列、mgb修饰基团和nfq猝灭基团。这种探针在退火时与egfrt790m野生型位点结合,此时hex荧光基团与nfq猝灭基团因为距离相近,不产生荧光信号。在pcr扩增过程中,探针因为taq酶水解作用分解,hex荧光基团与nfq猝灭基团分离,释放荧光信号。因为fam基团和hex基团的所用激发波长不一样,检测系统可以很好的区分两者的荧光信号值,从而计算出野生型微滴数、突变型微滴数以及检测样本egfrt790m突变率。
具体的,本例所使用的荧光检测探针和特异性引物对如下:
突变型荧光检测探针:5’-fam-tgagctgcatgatgagct-mgb-nfq-3’
野生型荧光检测探针:5’-hex-tgagctgcgtgatgagct-mgb-nfq-3’
上游引物:5’-gcctgctgggcatctgcct-3’
下游引物:5’-ctttgtgttcccggacatagtcca-3’
本例的所用的上下游引物和野生型、突变型检测探针均由上海生工公司合成。
1.探针稀释。用h2o(pcrgrade)稀释探针和引物至浓度为100μm(母液),并按照表1配比方式稀释母液,至fam-突变型探针、hex-野生型探针、上下游引物混合体系终浓度为40×,探针与引物工作浓度为20×,将配制好的探针与引物进行分装,于-20℃冰箱避光保存。其具体配制方法为:
(1)20×primers/probes(fam):40×fam-突变型与40×上、下游混合物等体积混合;
(2)20×primers/probes(hex):40×hex野生型与40×上、下游混合物等体积混合。
表1野生型与突变型探针及引物的稀释
2.ddpcr反应体系配制。该阶段在试剂准备区完成,按照表1所示,配制pcr反应体系。将配制好的mix溶液转移至样本制备区,12μl/管进行分装。
表2pcr反应mix的配制
3.添加模板,该阶段在样本制备区完成(反应体系共20μl)。模板添加顺序依次为:空白对照、阴性对照、弱阳性对照、受检样本、强阳性对照。取5个已灭菌的pcr管,每管内分装12μl,做好标记。空白对照组管内加入8μl无菌水,封闭pcr管;阴性对照组管内加入4μl野生型标准品和4μl无菌水,封闭pcr管;弱阳性对照组管内加入4μl弱阳性标准品和4μl无菌水,封闭pcr管;样本检测组管内加入8μl受检样本;强阳性对照组管内加入4μl强阳性标准品和4μl无菌水,封闭pcr管。各体系涡旋仪混合,于掌式离心机离上离心,去除气泡,然后将反应体系转移至ddpcr检测区。
4.ddpcr检测阶段,该阶段在ddpcr检测区完成。
1)取出微滴生成卡,按操作要求组装,在oil加样孔中加入油,70μl/孔;在sample加样孔中加入20μl反应体系。由于微滴生成时,oil孔与sample孔不能为空,故空白的oil孔加入70μl油,sample孔用25μl水代替。盖上胶垫,将两侧小孔钩牢固定,平稳放置于微滴生成仪内,完成一次微滴生成操作。
2)用移液枪将生成的微滴缓慢吸取(约40μl),全部转移至96孔pcr板孔内;吸取和加入微滴时需缓慢进行,小心操作,防止产生气泡,操作控制在5s/孔。
3)用预热好的px1热封仪对其进行封膜(红线朝上),推荐的运行程序为:180℃,5s,无需颠倒方向二次封膜。需要注意的是px1热封仪应提前开启进行预热;96孔板正确摆放,膜的红线标记应朝上;热封温度很高,不能用手试探温度,防止灼伤。
4)封膜后的96孔板于梯度扩增仪(t100thermalcycler)进行pcr扩增,扩增条件如表3所示。封好膜之后应该在30分钟内进行pcr反应,或者放于4℃冰箱4小时之内进行pcr;96孔板对应仪器的反应孔,不可错位。
表3pcr反应条件
5)提前打开ddpcr微滴读取仪电源,预热30min以上。
6)打开quantasoft软件,正式检测之前点击窗口右上角“flushsystem”,清洗仪器(每次检测之前进行一次flush,每周进行一次prime)。从梯度pcr仪中取出96孔板,转移至微滴读取仪内,固定时px1膜上的红线方向在上,将96孔板与底座进行嵌合。点击绿盖上的按钮,关闭盖子;选定反应孔后设置参数,在setup选项为supermix,选择ddpcrsupermixforprobes(nodutp)选项,后点击“run”,按照探针模式选择fam/hex或fam/vic,点击“ok”,保存目标文件,检测开始。
7)微滴读取结束后,保存数据,先关闭软件,然后关闭仪器。
8)实验结束后将实验产生废弃物拿出检测区,于废弃物间统一处理。
第三部分,egfrt790m位点荧光信号数值的分析,检测出与肺癌egfrt790m位点变异信息。
1.打开quantasoft软件,导入样本检测数据,选择analyze模块开始对数据进行分析。
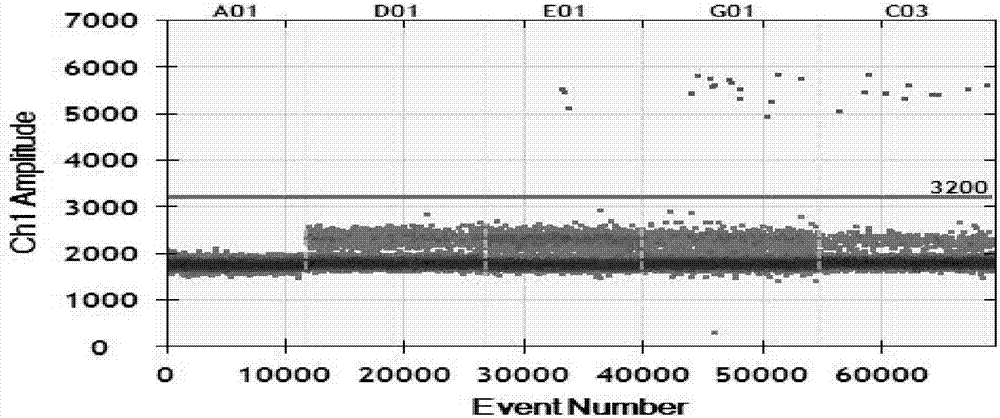
2.首先需要确认所有样本类型的微滴生成数要在10000左右,只有在这个范围内检出的数据的cv值能控制在1.6%以内。然后选择1damplitude,确定突变型探针和野生型探针的荧光阈值,以空白对照组和野生型对照组划定突变型探针和野生型探针的阈值。图2、图3说明本申请设计的探针特异性很好,能明显区分出野生型微滴和突变型微滴。a01通道是空白对照,以水为模板;d01是野生型对照组,是以野生型标准品为模板;e01是弱阳性对照组,是以t790m突变率为0.1%的标准品为模板;g01是强阳性对照组,是以t790m突变率为1%的标准品为模板;c03受检样本组,是以lc20161017的cfdna为模板。从图2、图3可知,以a01,d01为参照,突变型探针的荧光阈值划定为3200,野生型探针的荧光阈值划定为2600。
3.图4是lc20161017样本的2damplitude分析图,左上角蓝色点表示突变型微滴数,右下角绿色点表示野生型微滴数。
4.quantasoft软件会根据泊松分布计算每个样本20μl反应体系所含的模板拷贝数。利用fam拷贝数/(fam拷贝数+hex拷贝数)可计算出t790m突变率。图5显示了a01,d01,e01,g01和c03突变率。分析流程是以a01和d01的突变率划定基线,该基线以上的突变为真阳性突变;然后以弱阳性的突变率划定检测下限,在该检测限以上的突变率为可信突变率;强阳性突变率的检出说明本次检测操作正常无误。图5可以看出,a01和d01没有检出突变率,因此以0为基线,e01检出说明本次检测的检测下限为0.1%,高于0.1%的突变率都是可信的,g01检出说明本次检测操作无误,c03检出说明该受检样本突变率为2.5%,准确可信。
本例对肺癌病人lc20161017样本的ctdna进行检测,模板投入量为8.8ng,检测结果显示,该患者egfr20号外显子t790m发生了egfr-tki耐药突变,突变率为2.5%,突变检测结果见图5。患者在此次基因检测之前已经服用一代egfr-tki易瑞沙2年,并出现疾病进展,通过检测结果,建议该病人换用三代egfr-tki(azd9291、hm61713),该患者服用azd9291一个月后,影像学资料显示肿瘤明显缩小。可见,通过本例的检测,能够为患者提供准确的用药信息,提高治疗效果。
本例的肺癌egfrt790m检测优化方法,以ctdna为检测对象,具有灵敏度高的优势,可以从微量的cfdna中检测出ctdna。采用本例的肺癌egfrt790m检测优化方法,抽取5-10ml外周血液,通过对ctdna的检测分析,动态评估癌症发展变化,制定精准医疗方案,整个检测过程无创伤,对病患没有任何负面影响;并且,本例的检测优化方法,可以准确的检测出靶向药物相关的egfrt790m基因,这为个体化精准用药指导提供了重要的参考依据。
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 通过map2k4基因检测肺癌易感性的试剂盒及其用途的制作方法
- 一种通过cyp1a1基因检测肺癌易感性的试剂盒的制作方法
- 一种通过ercc2基因检测肺癌易感性的试剂盒的制作方法
- 一种通过xrcc1基因检测肺癌易感性的试剂盒的制作方法
- 通过ERCC2等基因的SNPs检测肺癌易感性的试剂盒的制作方法
- 通过XRCC1等基因的SNPs检测肺癌易感性的试剂盒的制作方法
- 通过CYP1A1等基因的SNPs检测肺癌易感性的试剂盒的制作方法
- 一种通过ercc2、cyp1a1和xrcc1基因检测肺癌易感性的试剂盒的制作方法
- 一种fish检测肺癌基因扩增的方法及试剂盒的制作方法
- 一种检测肺癌相关的cyp2a13抗性基因的方法及其抗性基因的制作方法
- 一种基于稀有细胞检测alk基因状态的方法及相关试剂盒的制作方法
- 检测肺癌kif5b-ret融合基因的引物、试剂盒及其使用方法
- 基因药物治疗流感或肺癌简易两用便携式定量雾化装置的制造方法
- 检测kras基因热点突变位点的引物、试剂盒及其pcr方法
- 检测c-kit基因d816v突变位点的引物、试剂盒及其pcr方法
- 检测ret基因m918t位点突变的引物、试剂盒及其pcr方法
- 检测braf基因v600e突变位点的引物、试剂盒及其pcr方法
- 一次性检测肺癌多重基因的引物、探针、检测体系和试剂盒的制作方法
- 一次性检测肺癌多重基因的引物、探针、检测体系和试剂盒的制作方法
- 基因药物治疗流感或肺癌简易两用便携式定量雾化装置的制造方法