检测茄匍柄霉菌的引物对及其应用的制作方法
本发明涉及生物
技术领域:
中,检测茄匍柄霉菌的引物对及其应用。
背景技术:
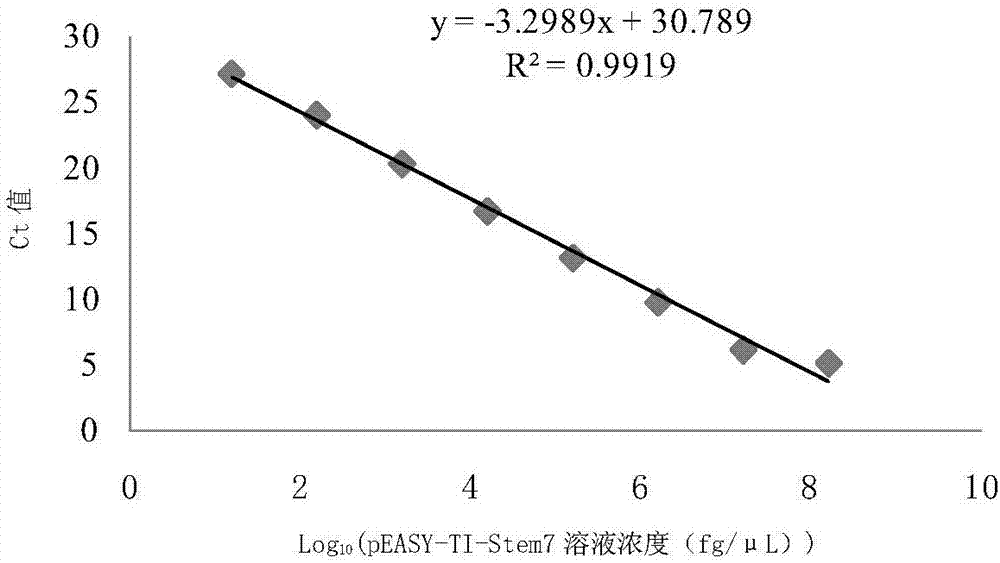
:番茄(lycopersiconesculentummill),是茄科番茄属一年或多年生草本植物,原产南美洲,是世界上广泛栽培的蔬菜作物,我国南北方广泛栽培。番茄病害种类复杂,主要包括各类真菌病害、细菌病害和病毒病,其中真菌病害种类比较多,早疫病、晚疫病、灰霉病、叶霉病等均是生产中比较常见的番茄病害,而对于番茄灰叶斑病发生的报道比较少见。番茄灰叶斑病在世界范围内均有发生,在温暖潮湿地区发生严重。美国、以色列、新西兰等地均报道过由匍柄霉菌引起的番茄叶斑病,给当地番茄生产造成了巨大的经济损失。近年来随着进口番茄品种在国内的大面积推广,番茄灰叶斑病发生越来越重。2002年,在山东鱼台种植的日光温室番茄中,病棚率达到了43%,且到了第二年病棚率达到90%以上,番茄减产率达到20%左右,危害严重的棚室减产80%以上。番茄灰叶斑病由匍柄属真菌(stemphylium)引起,该病在幼叶及老叶上均可出现。发病初期叶面布满圆形或不规则形小点,病斑中央浅褐色,周围深褐色,后期易破裂穿孔。叶片边缘也可以发病,沿叶缘呈不规则形病斑,随着扩展,病斑连城片状,深褐色,随叶片变干,斑点渐褪为灰白至灰褐色,症状变化很快,危害严重时导致全株叶片变黄。匍柄属真菌(stemphylium)是丝状分生孢子一类常见真菌,可以引起多种植物的病害,到目前为止,世界上已经报道的大约150种,我国记载40种以上。引起我国番茄灰叶斑病的主要是匍柄属真菌的两个种,茄匍柄霉菌(stemphyliumsolani)和番茄匍柄霉菌(stemphyliumlycopersici),近几年调查研究发现,茄匍柄霉菌成为危害番茄的主要种,其菌丝分枝、分隔,灰褐色,分生孢子梗分化不明显,单生或2-3根束生,圆柱状,褐色,光滑。分生孢子顶生,多单生,倒棍棒状,褐色,光滑,砖格状分隔,一般有1-5个横隔,数个纵隔膜,在分生孢子中间隔膜处缢缩。常用的番茄灰叶斑病鉴定检测方法主要是形态鉴定法,通过镜检的方式,观察分生孢子的形态,确定病害危害的种类,这个结果比较准确,但也还存在一些问题,在病害发生初期,显症之前,并没有产孢,通过传统的镜检方式无法准确判断病害的种类,而此时是药剂防治的一个关键时期,这个时期用药,能起到事半功倍的效果。目前急需一种可以快速茄匍柄霉菌尤其可以在感染病原菌初期检测茄匍柄霉菌的方法。技术实现要素:本发明所要解决的技术问题是如何检测茄匍柄霉菌(stemphyliumsolani)。为解决上述技术问题,本发明首先提供了可以用于检测或辅助检测茄匍柄霉菌或检测或辅助检测茄匍柄霉菌所致病害引物对,所述引物对由名称分别为stem-g7f和stem-g7r的单链dna组成;所述stem-g7f为核苷酸序列是序列表中seqidno.1的单链dna;所述stem-g7r为核苷酸序列是序列表中seqidno.2的单链dna。所stem-g7f和所述stem-g7r的摩尔比可为1:1。所stem-g7f和所述stem-g7可独立包装,也可包装在一起。为解决上述技术问题,本发明还提供了可以用于检测或辅助检测茄匍柄霉菌或检测或辅助检测茄匍柄霉菌所致病害的系统,所述系统包括所述引物对。上述系统还可包括进行荧光定量pcr所需的试剂和/或仪器。所述进行荧光定量pcr所需的试剂可为天根生化科技(北京)有限公司的2×sybrmix。所述进行荧光定量pcr所需的仪器可为real-timepcr仪,如appliedbiosystems7500realtimepcrsystem(美国,abi)。上述系统可由所述引物对与所述进行荧光定量pcr所需的试剂和/或仪器组成。所述系统可为包括相关试剂的试剂或试剂盒。为解决上述技术问题,本发明还提供了所述引物对的下述任一应用:x1、在制备检测或辅助检测茄匍柄霉菌产品中的应用;x2、在制备检测或辅助检测茄匍柄霉菌所致病害产品中的应用。x3、在检测或辅助检测茄匍柄霉菌中的应用;x4、在检测或辅助检测茄匍柄霉菌所致病害中的应用。为解决上述技术问题,本发明还提供了所述系统的下述任一应用:x1、在制备检测或辅助检测茄匍柄霉菌产品中的应用;x2、在制备检测或辅助检测茄匍柄霉菌所致病害产品中的应用。x3、在检测或辅助检测茄匍柄霉菌中的应用;x4、在检测或辅助检测茄匍柄霉菌所致病害中的应用。所述产品可为试剂或试剂盒。为解决上述技术问题,本发明还提供了所述引物对的制备方法,所述方法包括:将所述引物对的两条单链dna分别进行包装。为解决上述技术问题,本发明还提供了检测或辅助检测茄匍柄霉菌的方法,所述方法包括:以待测样品的基因组dna为模板,用所述引物对进行荧光定量pcr,根据荧光定量pcr反应体系中物质的变化确定所述待测样品是否含有茄匍柄霉菌或是否为茄匍柄霉菌。所述荧光定量pcr反应体系中物质的变化可通过扩增曲线确定:所述荧光定量pcr反应体系的扩增曲线为s型扩增曲线,所述待测样品含有或候选含有茄匍柄霉菌或为或候选为茄匍柄霉菌;所述荧光定量pcr反应体系的扩增曲线非s型扩增曲线,所述待测样品不含有或候选不含有茄匍柄霉菌或非或候选非茄匍柄霉菌。所述荧光定量pcr反应体系中物质的变化也可通过检测反应产物的大小确定:所述荧光定量pcr反应产物含有150bp的dna片段,所述待测样品含有或候选含有茄匍柄霉菌或为或候选为茄匍柄霉菌;所述荧光定量pcr反应产物不含有150bp的dna片段,所述待测样品不含有或候选不含有茄匍柄霉菌或非或候选非茄匍柄霉菌。所述反应产物的大小可通过电泳检测。所述150bp的dna片段可体现在100-200bp间有一条带。为解决上述技术问题,本发明还提供了检测或辅助检测茄匍柄霉菌所致病害的方法,所述方法包括:以待测样品的基因组dna为模板,用所述引物对进行荧光定量pcr,根据荧光定量pcr反应体系中物质的变化确定所述待测样品的病害是否为茄匍柄霉菌所致病害。所述荧光定量pcr反应体系中物质的变化可通过扩增曲线确定:所述荧光定量pcr反应体系的扩增曲线为s型扩增曲线,所述待测样品的病害为或候选为茄匍柄霉菌所致病害;所述荧光定量pcr反应体系的扩增曲线非s型扩增曲线,所述待测样品的病害不为或候选不为茄匍柄霉菌所致病害。所述荧光定量pcr反应体系中物质的变化也可通过检测反应产物的大小确定:所述荧光定量pcr反应产物含有150bp的dna片段,所述待测样品的病害为或候选为茄匍柄霉菌所致病害;所述荧光定量pcr反应产物不含有150bp的dna片段,所述待测样品的病害不为或候选不为茄匍柄霉菌所致病害。所述反应产物的大小可通过电泳检测。所述150bp的dna片段可体现在100-200bp间有一条带。上文中,所述引物对的两条链在所述荧光定量pcr反应体系中的浓度均可为0.2μm。所述荧光定量pcr反应的退火温度可为60℃。所述退火条件具体可为60℃退火32s。所述荧光定量pcr反应的反应条件可为:95℃预变性15min,95℃变性10s,60℃退火32s,40个循环。本发明的检测茄匍柄霉菌引物对特异性好、鉴定快速:环境中,尤其是日光温室内,微生物种类繁多,茄匍柄霉菌在侵染番茄的初期并未产孢,这就给前期预警监测增加了难度。而且茄匍柄霉菌在人工离体培养条件下很难产孢,这也增加了分离鉴定的难度。本发明的引物对克服了显微观察和分离培养等传统植物病理学耗时长且无法实现预警监测的缺点。与传统pcr检测技术相比,利用本发明的引物对进行荧光定量pcr检测茄匍柄霉菌的灵敏度提高了1000倍,达4.285×102fg·μl-1,而且可以实现准确定量。用本发明的引物对进行荧光定量pcr可以在病害发生初期,未显症之前进行定量检测,同时因较传统pcr方法灵敏度有了较大提高,可以应用于田间土壤带菌检测及种子带菌检测。附图说明图1为引物对的特异性检测结果。其中,n为阴性对照,1-9分别为茄匍柄霉菌(yqz11020901)、灰霉病菌(hg09021201)、核盘菌(hg09021301)、链格孢菌(fq15051201)、茄链格孢菌(qz08092301)、茄链格孢菌(jgfq15080715)、瓜链格孢菌(hg09042301)、辣椒刺盘孢菌(lj10013001)和多主棒孢菌(sd21),m为dna分子量标准。图2为利用重组质粒构建实时荧光定量pcr的标准曲线。图3为构建标准曲线过程的溶解曲线。图4为构建标准曲线过程的扩增曲线。图5为普通pcr灵敏度检测结果。图6为real-timepcr灵敏度检测结果。图7为茄匍柄霉菌接种的番茄叶片在不同接种时间的表型。图8为实施例1的引物对和引物对stem-g0的扩增曲线。其中,stem-g7表示实施例1的引物对。图9为实施例1的引物对和引物对stem-g0的溶解曲线。其中,stem-g7表示实施例1的引物对。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中的2×taqpcrmastermix为北京博迈德生物技术有限公司产品,2×sybrmix为天根生化科技(北京)有限公司产品。实施例1、检测茄匍柄霉菌的引物对的制备本发明所提供的检测茄匍柄霉菌的引物对由名称分别为stem-g7f和stem-g7r的单链dna组成,stem-g7f为核苷酸序列是序列表中seqidno.1的单链dna;stem-g7r为核苷酸序列是序列表中seqidno.2的单链dna。该引物对中的两条单链dna均独立包装,stem-g7f和stem-g7r的摩尔比为1:1。实施例2、检测茄匍柄霉菌的引物对的特异性检测供试菌株为:1株茄匍柄霉菌株、1株灰葡萄孢菌、1株疫霉菌、2株链格孢菌、3株茄链格孢和1株多主棒孢(表1),供试菌株保存于中国农业科学院蔬菜花卉研究所蔬菜病害综合防治课题组。表1供试菌株信息序号编号拉丁学名中文名称1yqz11020901stemphyliumsolani茄匍柄霉菌2hg09021201botrytiscinerea灰霉病菌3hg09021301sclerotiniasclerotiotum核盘菌4fq15051201alternariaalternata链格孢菌5qz08092301alternariasolani茄链格孢菌6jgfq15080715alternariasolani茄链格孢菌7hg09042301alternariacucumerina瓜链格孢菌8lj10013001colletotrichumcapsici辣椒刺盘孢菌9sd21corynesporacassiicola多主棒孢菌表1中,编号为yqz11020901的茄匍柄霉菌(stemphyliumsolani)记载在文献(xieetal.,firstreportofstemphyliumsolanicausingleafspotonwildeggplantinchina,can.j.plantpathol.,2016,vol.38,no.4,517–521)中;编号为hg09021201的灰霉病菌(botrytiscinerea)记载在文献(唐明等,啶酰菌胺对黄瓜灰霉病防治效果的综合评价,中国蔬菜,2016(2):51-55)中;编号为hg09021301的核盘菌(sclerotiniasclerotiotum)、编号为qz08092301的茄链格孢菌(alternariasolani)、编号为lj10013001的辣椒刺盘孢菌(colletotrichumcapsici)、编号为hg09042301的瓜链格孢菌(alternariacucumerina)和编号为sd21的多主棒孢菌(corynesporacassiicola)均记载在文献(高苇等,黄瓜棒孢叶斑病的dot-elisa检测技术研究,植物保护,2013,39(6):69-73)中。2、特异性检测提取步骤1的各供试菌株的基因组dna,对各菌株基因组dna利用实施例1的引物对分别进行普通pcr和real-timepcr扩增,检测引物的特异性,均利用去离子水替换基因组dna作为阴性对照。1、普通pcr反应普通pcr反应体系:普通pcr反应程序:94℃预变性3min;94℃变性30s,60℃退火30s,72℃延伸30s,共35个循环;72℃补充延伸5min。pcr产物经2%琼脂糖凝胶电泳检测后,凝胶成像系统分析结果。2、real-timepcr反应real-timepcr反应体系:real-timepcr反应条件:95℃预变性15min,95℃变性10s,60℃退火32s,40个循环,系统自动生成溶解曲线。real-timepcr反应利用在appliedbiosystems7500realtimepcrsystem(美国,abi)进行。通过融解曲线峰值是否单一排除二聚体引起的非特异性扩增,将扩增产物进行电泳检测,判断是否为目的判断。real-timepcr反应结果均只有茄匍柄霉菌能扩增出约150bp的条带,且没有二聚体,其它菌株与阴性对照均没有扩增得到目的产物(图1),普通pcr反应也得到了相同的结果。real-timepcr反应结果显示,只有以茄匍柄霉菌的基因组dna为模板进行real-timepcr反应时有s型扩增曲线,其它菌株与阴性对照均没有s型扩增曲线,表明,该引物对能特异性检测茄匍柄霉菌。在利用实施例1的引物对进行real-timepcr反应检测待测样品时,可通过其扩增曲线确定待测样本是否含有茄匍柄霉菌或是否为茄匍柄霉菌,也可通过检测real-timepcr反应产物确定待测样本是否含有茄匍柄霉菌或是否为茄匍柄霉菌:如real-timepcr反应得到的曲线为s型扩增曲线,或real-timepcr反应产物含有150bp的目的条带,则待测产物含有茄匍柄霉菌或为茄匍柄霉菌;如real-timepcr反应得到的曲线非s型扩增曲线,或real-timepcr反应产物不含有150bp的目的条带,则待测产物不含有茄匍柄霉菌或不为茄匍柄霉菌。实施例3、检测茄匍柄霉菌的引物对的标准曲线重组质粒的构建:以实施例2的茄匍柄霉菌的基因组dna为模板,利用实施例1的引物对进行pcr扩增,将得到的序列正确的pcr产物与peasy-ticloningvector(北京全氏金生物技术有限公司,目录号ct101-02)连接,得到重组质粒,将该重组质粒命名为peasy-ti-stem7。将peasy-ti-stem7溶于去离子水中得到质粒浓度为1.57×102ng/μl(3.7×1010拷贝/μl)的peasy-ti-stem7溶液,将该peasy-ti-stem7溶液进行10倍梯度稀释,分别得到peasy-ti-stem7浓度为1.57×101ng/μl(3.7×109拷贝/μl)、1.57×100ng/μl(3.7×108拷贝/μl)、1.57×10-1ng/μl(3.7×107拷贝/μl)、1.57×10-2ng/μl(3.7×106拷贝/μl)、1.57×10-3ng/μl(3.7×105拷贝/μl)、1.57×10-4ng/μl(3.7×104拷贝/μl)、1.57×10-5ng/μl(3.7×103拷贝/μl)和1.57×10-6μg/μl(3.7×102拷贝/μl)的peasy-ti-stem7溶液。按照实施例2步骤2的反应体系,将菌株基因组dna分别替换为上述各peasy-ti-stem7溶液,按照实施例2步骤2的反应条件进行real-timepcr,均设置三个重复。以模板浓度的对数值为横坐标,以real-timepcr的ct值为纵坐标,构建real-timepcr标准曲线为:y=30.789-3.2989x,相关系数(r2)为0.9919,荧光定量pcr系统自动生成的扩增效率为100.974%(图2),并且溶解曲线为单峰(图3),没有二聚体等非特异性扩增(图4)。实施例4、检测茄匍柄霉菌的引物对的灵敏度的检测将菌株编号为yqz11020901的茄匍柄霉菌基因组dna溶于去离子水中得到dna浓度为4.285×108fg·μl-1(1.12×1010拷贝/μl的基因组dna溶液,将该dna溶液进行10倍梯度稀释,分别得到基因组dna浓度为4.285×107fg·μl-1(1.12×109基因组dna拷贝/μl)、4.285×106fg·μl-1(1.12×108基因组dna拷贝/μl)、4.285×105fg·μl-1(1.12×107基因组dna拷贝/μl)、4.285×104fg·μl-1(1.12×106基因组dna拷贝/μl)、4.285×103fg·μl-1(1.12×105基因组dna拷贝/μl)、4.285×102fg·μl-1(1.12×104基因组dna拷贝/μl)、4.285×101fg·μl-1(1.12×103基因组dna拷贝/μl)、4.285×100fg·μl-1(1.12×102基因组dna拷贝/μl)和4.285×10-1fg·μl-1(1.12×101基因组dna拷贝/μl)的基因组dna溶液。按照实施例2步骤2的反应体系,将菌株基因组dna分别替换为上述各茄匍柄霉菌的基因组dna溶液,按照实施例2步骤2的反应条件进行real-timepcr检测实施例1的引物对的灵敏度,利用琼脂糖凝胶电泳检测pcr产物,利用去离子水作为阴性对照。按照实施例2步骤1的反应体系,将菌株基因组dna分别替换为上述各茄匍柄霉菌的基因组dna溶液,按照实施例2步骤1的反应条件进行普通pcr检测实施例1的引物对的灵敏度,利用去离子水作为阴性对照。目的基因和内参基因的标准曲线相关系数r2大于0.99,pcr扩增效率e在0.9~1.05之间,且两者的扩增效率相差不超过5%。结果显示,在进行普通pcr扩增时,茄匍柄霉菌基因组dna溶液的浓度在4.285×105fg·μl-1及其以上时均有目的条带,而茄匍柄霉菌基因组dna的浓度在小于4.285×105fg·μl-1时及阴性对照均无目的条带(图5),表明,普通pcr扩增的实施例1的引物对的灵敏度为4.285×105fg·μl-1;在进行real-timepcr时,茄匍柄霉菌基因组dna溶液的浓度在4.285×102fg·μl-1及其以上时均有扩增曲线,而茄匍柄霉菌基因组dna溶液的浓度在小于4.285×105fg·μl-1时及阴性对照均无扩增曲线(图6),表明,real-timepcr的实施例1的引物对的灵敏度为4.285×102fg·μl-1。图5和图6中,1-10分别为茄匍柄霉菌基因组dna浓度为4.285×108fg·μl-1、4.285×107fg·μl-1、4.285×106fg·μl-1、4.285×105fg·μl-1、4.285×104fg·μl-1、4.285×103fg·μl-1、4.285×102fg·μl-1、4.285×101fg·μl-1、4.285×100fg·μl-1和4.285×10-1fg·μl-1的茄匍柄霉菌基因组dna溶液的结果,n为阴性对照,m为dna分子量标准。实施例5、茄匍柄霉菌接种的番茄叶片real-timepcr检测将低温4℃保存菌株编号为yqz11020901的茄匍柄霉菌菌株采用pda平板活化,转接至pd液体培养基,28℃培养7d后,用豆浆机打碎菌丝后,用喷菌悬液法接种番茄叶片接种3-4叶期的番茄植株,保温保湿,分别于接种6h、12h、24h、48h、72h、96h、108h时间段对番茄叶片进行拍照取样(图7)。提取各番茄叶片基因组dna(浓度均为86.7ng/μl)后,按照实施例2步骤2的反应体系,将菌株基因组dna分别替换为上述各各番茄叶片基因组dna,按照实施例2步骤2的反应条件进行real-timepcr,利用去离子水作为阴性对照。结果表明,茄匍柄霉菌接种番茄叶片6h即可在番茄叶片中检测到茄匍柄霉菌,且菌量随着时间的增加不断增加;茄匍柄霉菌接种番茄叶片108h时,整个叶片感染茄匍柄霉菌,根据实施例3的标准曲线计算此时番茄叶片得到的基因组dna中茄匍柄霉菌的基因组dna含量为1.16×10-3ng/μl。表2茄匍柄霉菌含量在活体植株上动态变化对比例1、不同引物对检测茄匍柄霉菌的比较利用实施例1的引物对以及引物对stem-g0分别对菌株编号为yqz11020901的茄匍柄霉菌的基因组dna进行real-timepcr,反应体系与反应条件均同实施例2步骤2。stem-g0的引物序列见表3,利用去离子水作为阴性对照。表3stem-g0的引物序列结果显示,实施例1的引物对阳性扩增良好,阴性对照没有扩增,且溶解曲线单一峰值,没有引物二聚体;引物对stem-g0阳性扩增良好,阴性对照后期有扩增,溶解曲线为双峰,有引物二聚体(图8和图9),说明实施例1的引物对在检测茄匍柄霉菌时的效果好于stem-g0。<110>中国农业科学院蔬菜花卉研究所<120>检测茄匍柄霉菌的引物对及其应用<160>2<170>patentinversion3.5<210>1<211>25<212>dna<213>人工序列<220><223><400>1agacaatcttcccgaaaatccgctg25<210>2<211>25<212>dna<213>人工序列<220><223><400>2ccttgatctcacccttgaactggcc25当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1