以碘化铵为硝基源一锅合成α,β‑不饱和硝基烯烃衍生物的方法与流程
本发明涉及一种α,β-不饱和硝基烯烃衍生物的合成方法,特别涉及一种烯类化合物在含四芳基卟啉铁(iii)、碘化铵和叔丁基过氧化氢的乙腈溶液体系中一锅反应,高产率高选择性合成反式α,β-不饱和硝基烯烃衍生物的方法,属于有机合成领域。
背景技术:
α,β-不饱和硝基烯烃是一类具有生物活性的化合物。例如,不饱和的硝基脂肪酸是一类新的内源性抗炎介质;不饱和硝基油酸能防止鼠肾缺血和再灌注损伤。同时α,β-不饱和硝基烯烃是一类重要的药物及有机中间体化合物,很容易转化成多种不同的化合物,在很多领域都有着重要的作用。例如,β-硝基苯乙烯是用于制备几种苯乙胺和杀真菌的中间体(《化学文摘》(chemicalabstracts),vol.118,no.38576k)。α,β-不饱和硝基烯烃还被广泛用于一些反应中的michael受体,如醛、酮与硝基烯烃的不对称michael反应,吲哚、吡咯与硝基烯烃的立体选择性的friedel-crafts烷基化反应;硝基烯烃与硝基烷烃之间的不对称michael加成;硝基烯烃的不对称生物还原等等。
因此,基于硝基烯烃的重要性,硝基烯烃衍生物的合成方法数十年前就被研究者们关注。早在数十年前就已经报道了以硝基化合物作为硝基源用于合成硝基烯烃的经典方案。如较早报道的亨利反应,是在碱性条件下,将醛或酮与硝基烷烃进行缩合反应得到硝基烯烃衍生物(如反应1),但是亨利反应存在反应条件相对苛刻,反应收率相对较低,且产生大量的废碱液等问题。后续报道了一些改进的亨利反应,如硝基甲烷与醛类化合物通过henry缩合可得到β-硝基醇,β-硝基醇再经dcc/cucl或三氟乙酸酐/三乙胺脱水,或者也可以经mscl/et3或p2脱水得到α,β-不饱和硝基烯烃。又如brch2no2与醛在碘化钠的催化下制得1-溴-1-硝基烷-2-醇,1-溴-1-硝基烷-2-醇再经二碘化钐β-消除制得α,β-不饱和硝基烯烃。又如β-硝基醇酰化后在回流的苯溶液中用碳酸钠处理可得到收率不错的α,β-不饱和硝基烯烃,但这些反应需要多步,收率也不是很高。如中国专利(cn106083597a)公开了一种共轭硝基烯烃的合成方法,在二胺存在的条件下,利用脂肪醛与硝基烷烃的硝基进行羟醛缩合反应,反应过程中通过添加酸来进行的共轭硝基烯烃的消去反应(如反应2);该方法通过二胺作为硝基羟醛缩合反应的催化剂,降低副反应生成,提高产物收率,但该反应步骤多,有大量酸性废液产生,污染环境。中国专利(cn104710315a)公开了一种α,β-不饱和硝基烯烃化合物的绿色合成方法(如反应3),其利用功能化离子液体与水作为催化体系,芳香醛和硝基烷烃进行微波加热反应,可以使反应条件温和,提高反应收率;但是该方法利用的离子液体成本高,难以工业化应用。
另外,一些合成α,β-不饱和硝基烯烃的新方法陆续报道。如报道比较早的是用亚硝酸盐和碘将烯烃硝化成α,β-不饱和硝基烯烃及一系改善硝化条件的研究工作[(hassner等人,j.org.chem.,1969,34(9),p.2628-2632.)、(tetr.lett.,1985,26(9),p.1193-1196)、(chemistryletters,1986,p.1747-1748)]。这些反应由于采用了大量的碘,过量碘在后处理过程中相当麻烦,且降低了产物的收率。意大利的萨宝集团公司在中国申请的专利(cn1438977a)公开了以苯乙烯衍生物为原料,过氧化物存在下的无机亚硝酸盐和碘的混合物为硝化试剂合成硝基苯乙烯化合物;该方法由于使用了氧化剂大大减少硝化烯烃过程中碘的使用量,从而在一定程度上提高了产物的收率,简化工艺步骤,但是这些方法都采用亚硝酸盐作为硝化试剂,对环境和人体危害大。目前,还有一些利用含氮氧化物作为硝化试剂,以烯类化合物在金属镍氧化物催化下直接进行硝基化反应,得到硝基烯烃衍生物(如反应4),该方法采用气液反应方式,反应效率低,且会产生有毒气体,产率收率也不高。
反应1:
反应2:
反应3:
反应4:
技术实现要素:
针对现有技术中合成α,β-不饱和硝基烯烃的方法存在的缺陷,本发明的目的是在于提供一种在温和反应条件下高产率合成具有高e立体选择性的α,β-不饱和硝基烯烃的方法。
为了实现上述技术目的,本发明提供了一种以碘化铵为硝基源一锅合成α,β-不饱和硝基烯烃衍生物的方法,该方法是将式1结构烯类化合物在含四芳基卟啉铁(iii)、碘化铵和叔丁基过氧化氢的乙腈溶液体系中一锅反应,生成式2结构α,β-不饱和硝基烯烃衍生物;
其中,
r、r1和r2独立选自氢、芳烃基、脂肪烃基、杂环基或含取代基的脂肪烃基,且r、r1和r2不同时为芳烃基或氢;或者,r和r2为脂肪环烃基或含芳环的脂肪环烃基。所述芳烃基优选为苯基、取代苯基或萘基;所述脂肪烃基优选为c1~c12烷烃基;所述杂环基优选为吡啶基或噻吩基;所述含取代基的脂肪烃基优选为含有取代基的c1~c12的烷烃基,取代基为常见的非烷烃取代基,如卤素、羟基、氨基硝基等等;所述脂肪环烃基优选为c6~c8脂肪环烃基;所述含芳环的脂肪环烃基优选为c12~c14含苯环的脂肪环烃基。
较优选的取代苯基具有式3结构:
其中,
r3和r4独立选自氢、烷基、烷氧基、卤代烷基、卤素、乙酰氧基或烯基,且r3和r4不同时为氢。
进一步优选的取代苯基为对甲基苯基、对甲氧基苯基、对异丁基苯基、对氯甲基苯基、对氟苯基、对溴苯基、对氯苯基、对乙酰氧基、间甲基苯基、间溴苯基、邻氯苯基、邻溴苯基、2,5-二甲基苯基或2-乙烯基苯基。
最优选的烯类化合物为:
本发明的烯类化合物进行硝基化反应,烯烃上的取代基可以是饱和或不饱和的脂肪烃基、也可以是芳烃基、杂环基等,但是具有不同取代基的烯烃进行硝化的效率呈现明显的规律变化。以含有一个取代的烯烃为例,芳基乙烯、杂环乙烯和烷基乙烯的硝化效率依次降低。而芳基乙烯进行硝化反应时,苯环上的取代基对硝化反应效率影响不是很明显,如具有给电子基团的苯环(-ch3、-och3、-tbu、-ch2cl)和具有吸电子基团的苯环(-f、-cl、-br和ch3coo-)硝化反应可以顺利进行,可以得到相近的硝化效率。含有两个取代基的烯烃,如1,1-二苯基乙烯、环烯和甲基苯乙烯等也可以得到可观的硝化效率,但是大量实验表明三苯乙烯不会被硝化。
优选的方案,反应条件为:在空气或保护气氛条件下,反应温度为100℃~130℃,反应时间为3~9h。最佳的反应温度为115~125℃,反应时间为5~7h。
优选的方案,烯类化合物、卤化铵盐和叔丁基过氧化氢的摩尔比为1:(1~2):(4~8)。进一步优选的方案,烯类化合物、卤化铵盐和叔丁基过氧化氢的摩尔比为1:(1.5~2):(6~8)。
本发明的技术方案中,碘化铵盐是作为硝基源,碘化铵在过氧化物叔丁基过氧化氢的氧化作用下生成硝基自由基,为α,β-不饱和硝基烯烃衍生物提供硝基取代基。大量实验表明,采用溴化铵和氯化铵虽然也可以实现对烯烃的硝化反应,但是硝化效率很低,其它季铵盐,如碳酸铵、醋酸铵等都无法作为硝基源使用,而采用碘化铵作为硝基源时,硝化效率可以达到80%以上。
本发明的技术方案,溶剂的极性对烯烃的硝化也具有一定的影响,如在乙腈中硝化反应可以顺利进行,而采用水、dmf、dec、甲苯等作为反应溶剂,得不到α,β-不饱和硝基烯烃衍生物或者收率相当低,乙醇作为溶剂虽然可以实硝化反应,但是产率并不理想。乙腈是本发明方法中最佳的反应溶剂,反应效果相对其它反应溶剂要高出很多。
优选的方案,所述四芳基卟啉铁(iii)为四苯基卟啉氯化铁(如tppfecl)和/或双(四苯基卟啉)铁(iii)((tppfe)2o)。四芳基卟啉铁(iii)烯类的硝基化反应具有特殊的催化活性,而其他三价铁盐、二价铁盐对该反应均不具备催化作用,且其他四芳基金属卟啉化合物也均不具备催化活性,如四芳基金属卟啉铜、四芳基金属卟啉钴等。四芳基卟啉铁(iii)也可以是四苯基卟啉氯化铁的衍生物,其苯环上可以含取代基,如常规的氨基、硝基、烷基、烷氧基、卤素等。
较优选的方案,所述四芳基卟啉氯化铁的用量为烯类化合物摩尔量的1~15%。更优选为4~6%。催化剂用量增加或减少,硝化反应效果明显降低。
本发明由烯烃化合物合成α,β-不饱和硝基烯烃衍生物的反应机理如下,以nh4i、tbhp、tppfecl的乙腈溶液为反应体系,通过式1烯类化合物为底物合成式2结构α,β-不饱和硝基烯烃衍生物,以此为例对反应机理进行具体说明:首先,tbhp在一定温度条件下分解生成氧及羟基等自由基,季铵阳离子被氧自由基氧化成二氧化氮自由基,二氧化氮自由基在tppfecl催化介质转移作用下对烯类化合物进行自由基加成反应,得到活泼中间体a,中间体a捕获羟基自由基,得到中间体b,中间体b进行顺式消除,得到高e式立体选择的α,β-不饱和硝基烯烃衍生物。反应过程中tppfecl主要起到转移自由基作用,可以形成非稳定中间体,但最终还是以tppfecl存在,起到催化作用。反应机理方程式如下:
本发明通过以下反应对本发明的烯类化合物硝化反应的机理进行了验证,说明该反应机理的合理性,以苯乙烯硝化反应为例进行说明。在苯乙烯的硝化反应过程中添加tempo或bht自由基捕获剂(反应1),发现几乎得不到反应产物,说明该反应涉及到自由基反应机理。接下来,采用中间体2-硝基-1-羟基乙基苯(b)在nh4i和tbhp及tppfecl混合体系中或在不含tppfecl的nh4i和tbhp混合体系中反应(反应2),均能得到目标产物,说明催化剂对消除反应几乎不受影响。同时设计了逐步反应实验,第一步反应是在没有底物烯烃的情况下,nh4i和tbhp在tppfecl催化剂条件下(a)与不用tppfecl催化剂条件下(b)混合30分钟,然后分别加入tempo,通过gc-ms可以检测到两个反应均有tempo-硝基自由基类似物生成,说明tppfecl催化剂的作用并不是催化自由基生成(如反应3(a)和(b));第二步反应是在(反应3(a))反应生成的含有tempo-硝基自由基类似物混合物分成两份,一份中加入苯乙烯底物和tppfecl催化剂(d),另一份加苯乙烯底物,但不加催化剂(c),加热搅拌反应6小时,结果在加入了催化剂fetppcl的反应中可以获得产率较高的硝基苯乙烯2a(反应4(c)和(d)),说明tppfecl催化剂主要是起到催化硝基自由基与苯乙烯反应的作用。
相对现有技术,本发明的技术方案带来的有益技术效果:
1)本发明的技术方案首次采用含四芳基卟啉铁(iii)、碘化铵和叔丁基过氧化氢反应体系对烯类化合物进行硝化反应,实现了烯类化合物一锅反应生成α,β-不饱和硝基烯烃,相对现有技术,大大简化了工艺步骤,有利于工业化生产。
2)本发明的技术方案首次采用无机卤化铵盐作为烯烃类化合物的直接硝基源,相比现有技术中的含氮氧化物、亚硝酸盐及有机硝类化合物,具有成本低、安全、环保等优点。
3)本发明的技术方案首次利用四芳基卟啉铁(iii)作为烯类化合物的硝化反应催化试剂,能够在温和条件下实现各种烯烃类化合物的硝基化反应,且获得较高的产率及高立体选择性。
4)本发明的技术方案实现了α,β-不饱和硝基烯烃衍生物的一锅法合成,且目标产物易于分离提纯,简化了工艺步骤,有利于工业化生产。
附图说明
【图1】为实施例1的目标产物的核磁氢谱图;
【图2】为实施例1的目标产物的核磁碳谱图;
【图3】为实施例2的目标产物的核磁氢谱图;
【图4】为实施例2的目标产物的核磁碳谱图;
【图5】为实施例20的目标产物的核磁氢谱图;
【图6】为实施例20的目标产物的核磁碳谱图;
【图7】为实施例22的目标产物的核磁氢谱图;
【图8】为实施例22的目标产物的核磁碳谱图;
【图9】为实施例27的目标产物的核磁氢谱图;
【图10】为实施例27的目标产物的核磁碳谱图。
具体实施方式
以下实施旨在进一步说明本发明内容,而不是限制本发明权利要求的保护范围。
以下实施例中采用的所有溶剂、金属卟啉、氧化剂、铵盐和烯烃都是从商业来源购买的。
所有的目标化合物采用gc-ms和nmr(1h和13c)光谱数据表征。
nmr型号为brukerav400mhz,相对位移采用ppm表示,以三甲基硅烷的相对位移ppm=0为基准。
氘代溶剂中残留氯仿的1h相对位移ppm=7.26,13c相对位移ppm=77.00。
gc-ms型号为shimadzugc-ms(qp-2010),采用的检测器为fid检测器。
所有的硝化反应在带有螺纹端的密封管(25ml)中进行。
除非另有说明,所有液体试剂中都加入分子筛除水保存。
以下实施例中的目标产物的收率均按立体选择性为e式结构的目标产物进行计算,反应的立体选择性几乎为100%。
实施例1~21
实施例1~21均按以下反应方程式反应:
具体操作步骤为:将烯烃(0.5mmol),nh4i(1.5当量,0.75mmol,108mg),tbhp(70%的h2o,6.0当量,3.0mmol,384mg),tppfecl(苯乙烯摩尔量的3~5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和tppfecl,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
实施例1
烯烃:
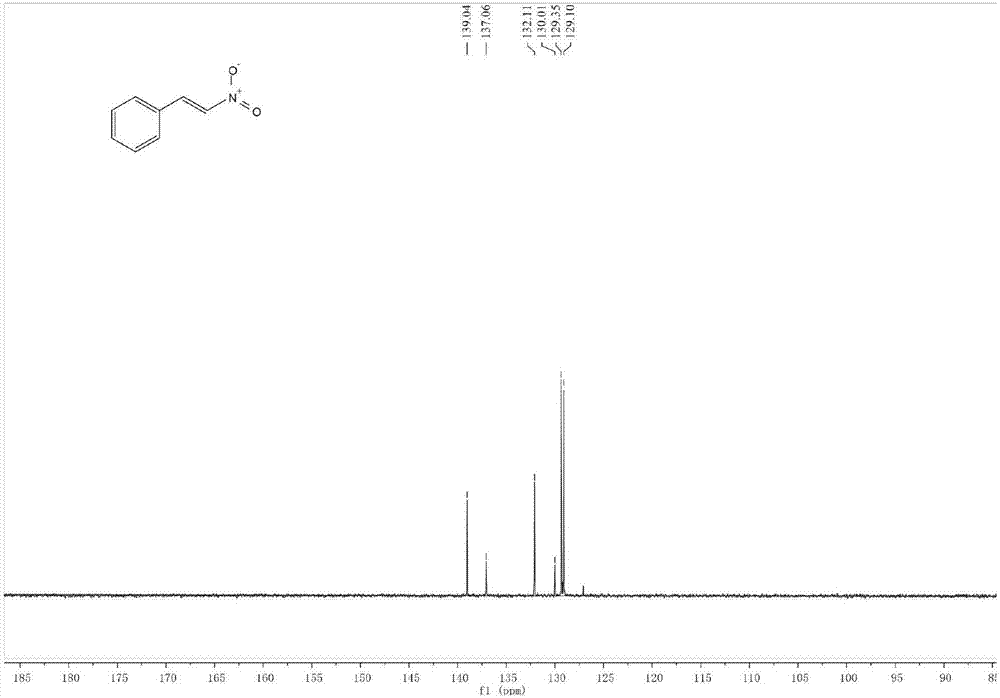
yellowsolid:82%(61mg).1hnmr(400mhz,cdcl3)δ8.01(d,j=13.7hz,1h),7.63–7.53(m,3h),7.47(tdd,j=8.5,5.2,3.6hz,3h).13cnmr(101mhz,cdcl3)δ139.04,137.06,132.11,130.01,129.35,129.10.gc-ms(m/z):149.+.
实施例2
烯烃:
yellowsolid:77%(63mg).1hnmr(400mhz,cdcl3)δ7.96(d,j=13.6hz,1h),7.55(d,j=13.6hz,1h),7.43(d,j=8.1hz,2h),7.25(d,j=8.2hz,2h),2.40(s,3h).13cnmr(101mhz,cdcl3)δ143.04,139.08,136.17,130.06,129.12,127.17,21.56.gc-ms(m/z):163.
实施例3
烯烃:
yellowsolid:73%(65mg).1hnmr(400mhz,cdcl3)δ7.97(d,j=13.6hz,1h),7.51(dd,j=11.2,5.8hz,3h),6.96(d,j=8.8hz,2h),3.87(s,3h).13cnmr(101mhz,cdcl3)δ162.93,139.00,135.03,131.14,122.54,114.98,55.51.gc-ms(m/z):179.
实施例4
烯烃:
yellowsolid;isolatedyield:58%(60mg).1hnmr(400mhz,cdcl3)δ7.99(d,j=13.6hz,1h),7.58(d,j=13.6hz,1h),7.48(d,j=2.0hz,4h),1.34(s,9h).13cnmr(101mhz,cdcl3)δ156.08,138.98,136.32,129.03,127.17,126.35,35.05,30.94.gc-ms(m/z):203.
实施例5
烯烃:
yellowsolid:70%(69mg).1hnmr(400mhz,cdcl3)δ7.98(d,j=13.7hz,1h),7.56(dd,j=16.0,10.9hz,3h),7.47(d,j=8.2hz,2h),4.60(s,2h).13cnmr(101mhz,cdcl3)δ141.45,138.16,137.40,129.98,129.41(d,j=3.1hz),45.22.gc-ms(m/z):197.
实施例6
烯烃:
yellowsolid:65%(54mg).1hnmr(400mhz,cdcl3)δ7.98(d,j=13.7hz,1h),7.55(t,j=12.0hz,3h),7.15(t,j=8.0hz,2h).13cnmr(101mhz,cdcl3)δ164.92,137.81,136.83,131.26(d,j=8.9hz),126.29(d,j=3.6hz),116.78(d,j=22.2hz)..gc-ms(m/z):167.
实施例7
烯烃:
yellowsolid:56%(51mg).1hnmr(400mhz,cdcl3)δ7.95(d,j=13.7hz,1h),7.56(d,j=13.7hz,1h),7.51–7.46(m,2h),7.45–7.37(m,2h).13cnmr(101mhz,cdcl3)δ138.21,137.63,137.33,130.22,129.66,128.45.gc-ms(m/z):183.
实施例8
烯烃:
yellowsolid:58%(67mg).1hnmr(400mhz,cdcl3)δ7.95(d,j=13.7hz,1h),7.58(t,j=10.4hz,3h),7.42(d,j=8.5hz,2h).13cnmr(101mhz,cdcl3)δ137.75,137.47,132.74,130.36,128.94,126.78.gc-ms(m/z):228。
实施例9
烯烃:
yellowsolid:61%(63mg).1hnmr(400mhz,cdcl3)δ7.98(d,j=13.7hz,1h),7.56(dd,j=11.1,7.8hz,3h),7.20(d,j=8.6hz,2h),2.32(s,3h).13cnmr(101mhz,cdcl3)δ168.84,153.45,137.96,137.07,130.37127.60,122.71,21.08.gc-ms(m/z):207。
实施例10
烯烃:
yellowsolid:53%(49mg).1hnmr(400mhz,cdcl3)δ8.40(d,j=13.7hz,1h),7.62–7.56(m,2h),7.50(dd,j=8.0,1.2hz,1h),7.43(td,j=7.8,1.6hz,1h),7.34(t,j=8.1hz,1h).13cnmr(101mhz,cdcl3)δ138.81,136.01,135.08,132.81,130.72,128.57,128.49,127.45.gc-ms(m/z):183.
实施例11
烯烃:
yellowsolid:47%(54mg).1hnmr(400mhz,cdcl3)δ8.38(d,j=13.6hz,1h),7.68(dd,j=7.8,1.3hz,1h),7.57(dd,j=7.6,1.7hz,1h),7.53(d,j=13.6hz,1h),7.41–7.31(m,2h).13cnmr(101mhz,cdcl3)δ138.79,137.54,133.96,132.90(,130.29,128.43,128.05,126.29.gc-ms(m/z):228
实施例12
烯烃:
yellowsolid:55%(45mg).1hnmr(400mhz,cdcl3)δ7.97(d,j=13.7hz,1h),7.57(d,j=13.7hz,1h),7.40–7.28(m,4h),2.40(s,3h).13cnmr(101mhz,cdcl3)δ139.20,139.17,136.86,132.96,129.93,129.65,129.20,126.31,21.18.gc-ms(m/z):163.
实施例13
烯烃:
yellowsolid:45%(51mg).1hnmr(400mhz,cdcl3)δ7.90(d,j=13.7hz,1h),7.67(t,j=1.7hz,1h),7.60(dd,j=8.0,2.7hz,1h),7.55(d,j=13.7hz,1h),7.47(d,j=7.8hz,1h),7.32(t,j=7.9hz,1h).13cnmr(101mhz,cdcl3)δ137.94,137.22,134.73,131.95,131.55,130.75,127.57,123.28.gc-ms(m/z):228
实施例14
烯烃:
yellowsolid:74%(82mg).1hnmr(400mhz,cdcl3)δ8.26(d,j=13.6hz,1h),7.50(d,j=13.6hz,1h),7.32(s,1h),7.22–7.14(m,2h),2.42(s,3h),2.34(s,3h).13cnmr(101mhz,cdcl3)δ137.22,136.77,136.21,136.17,132.79,131.17,128.57,127.69,20.72,19.28.gc-ms(m/z):163.
实施例15
烯烃:
yellowsolid:44%(43mg).1hnmr(400mhz,cdcl3)δ8.13(d,j=13.6hz,1h),7.98(s,1h),7.87(dd,j=8.2,6.0hz,3h),7.68(d,j=13.6hz,1h),7.62–7.51(m,3h).13cnmr(101mhz,cdcl3)δ139.14,137.05,134.83,133.06,132.22,129.28,128.77,128.33,127.88,127.46,127.21,123.24.gc-ms(m/z):199.
实施例16
烯烃:
yellowsolid:34%(30mg).1hnmr(400mhz,cdcl3)δ8.13(d,j=13.6hz,1h),7.98(s,1h),7.87(dd,j=8.2,6.0hz,3h),7.68(d,j=13.6hz,1h),7.62–7.51(m,3h).13cnmr(101mhz,cdcl3)δ139.14,137.05,134.83,133.06,132.22,129.28,128.77,128.33,127.88,127.46,127.21,123.24.gc-ms(m/z):175.
实施例17
烯烃:
brownishyellowsolid:28%(21mg).1hnmr(400mhz,cdcl3)δ8.66(s,1h),7.95(dd,j=38.3,13.1hz,2h),7.78(t,j=7.6hz,1h),7.58–7.29(m,2h).13cnmr(101mhz,cdcl3)δ150.59,149.31,140.63,137.13,137.10,126.27,125.67.gc-ms(m/z):150.
实施例18
烯烃:
yellowishgraysolid:22%(17mg).1hnmr(400mhz,cdcl3)δ8.74(s,2h),7.92(d,j=13.7hz,1h),7.65(d,j=13.1hz,1h),7.40(s,2h).13cnmr(101mhz,cdcl3)δ150.99,140.32,137.38,136.06,122.31.gc-ms(m/z):150.
实施例19
烯烃:
yellowsolid:37%(29mg).1hnmr(400mhz,cdcl3)δ8.15(d,j=13.4hz,1h),7.56(d,j=5.0hz,1h),7.47(t,j=8.9hz,2h),7.15(dd,j=5.1,3.7hz,1h).13cnmr(101mhz,cdcl3)δ135.31,134.61,133.72,132.06,131.59,128.85.gc-ms(m/z):155.
实施例20
烯烃:
orangeliquid:22%(17mg).1hnmr(400mhz,cdcl3)δ7.33–7.23(m,1h),6.99(d,j=13.4hz,1h),2.27(d,j=7.2hz,2h),1.34(s,2h),1.30–1.28(m,2h),1.16(d,j=9.6hz,2h),0.90(s,4h).13cnmr(101mhz,cdcl3)δ142.71,139.41,77.00,31.27,28.60,28.30,27.53,22.32,13.84.gc-ms(m/z):157.
实施例21
烯烃:
yellowliquid:30%(84mg).1hnmr(400mhz,cdcl3)δ7.24–7.18(m,1h),6.93(dt,j=13.4,1.5hz,1h),2.21(ddd,j=14.9,7.4,1.5hz,2h),1.21(s,18h),0.83(t,j=6.8hz,3h).13cnmr(101mhz,cdcl3)δ142.81,139.52,31.87,29.59,29.58,29.54,29.41,29.30,29.22,29.05,28.42,27.68,22.65,14.08.gc-ms(m/z):241.
实施例22~28
实施例22~28均按以下反应方程式反应:
具体操作步骤为:将烯烃(0.5mmol),nh4i(1.5当量,0.75mmol,108mg),tbhp(70%的h2o,6.0当量,3.0mmol,384mg),tppfecl(3~5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和tppfecl,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
实施例22
烯烃:
yellowsolid:49%(40mg).1hnmr(400mhz,cdcl3)δ7.48–7.43(m,5h),7.31(d,j=1.3hz,1h),2.65(d,j=1.3hz,3h).13cnmr(101mhz,cdcl3)δ149.96,138.27,136.31,130.34,129.01,126.81,18.57.gc-ms(m/z):163.
实施例23
烯烃:
yellowsolid:42%(47mg).1hnmr(400mhz,cdcl3)δ7.49–7.31(m,7h),7.30–7.22(m,2h),7.22–7.16(m,2h).13cnmr(101mhz,cdcl3)δ150.37,136.96,135.45,134.30,130.82,129.21,128.82,128.79,128.70,128.40.gc-ms(m/z):225.
实施例24
烯烃:
yellowsolid:38%(31mg).1hnmr(400mhz,cdcl3)δ8.27(s,1h),7.57–7.50(m,3h),7.41–7.32(m,3h),7.27(dd,j=13.5,5.6hz,2h),7.13(d,j=7.6hz,2h).13cnmr(101mhz,cdcl3)δ149.59,134.79,131.34,131.16,130.72,130.52,130.02,129.87,129.19,128.68.gc-ms(m/z):225.
实施例25
烯烃:
yellowsolid:38%(31mg).1hnmr(400mhz,cdcl3)δ8.08(s,1h),7.48–7.40(m,5h),2.45(d,j=0.8hz,3h).13cnmr(101mhz,cdcl3)δ147.64,133.44,132.31,129.88,129.84,128.81,13.92.gc-ms(m/z):163.
实施例26
烯烃:
yellowliquid:38%(34mg).1hnmr(400mhz,cdcl3)δ7.81(s,1h),7.32(ddd,j=11.0,8.3,3.9hz,2h),7.27–7.17(m,2h),3.03(dd,j=12.7,5.0hz,2h),2.94(dd,j=12.7,5.4hz,2h).13cnmr(101mhz,cdcl3)δ147.87,136.36,131.54,131.21,130.12,130.09,127.87,127.28,27.87,22.32.gc-ms(m/z):175.
实施例27
烯烃:
orangeliquid:35%(22mg).1hnmr(400mhz,cdcl3)δ7.30(ddd,j=5.7,4.1,1.5hz,1h),2.59–2.51(m,2h),2.35–2.28(m,2h),1.79–1.72(m,2h),1.61(dtd,j=9.2,6.0,2.9hz,2h).13cnmr(101mhz,cdcl3)δ149.64,134.25,24.71,23.83,21.71,20.59.gc-ms(m/z):127。
实施例28
烯烃:
orangeliquid:22%(17mg).1hnmr(400mhz,cdcl3)δ7.35(t,j=5.7hz,1h),5.57(s,2h),3.03(t,j=6.3hz,2h),2.68–2.55(m,2h),2.55–2.42(m,4h).13cnmr(101mhz,cdcl3)δ151.52,135.18,128.62,127.64,27.04,26.66,26.29,25.63.gc-ms(m/z):153。
对比实验组1:
对照实施例1~12均按以下反应方程式反应:
具体操作步骤为:将苯乙烯(0.5mmol),nh4i(1.5当量,0.75mmol,108mg),tbhp(70%的h2o,6.0当量,3.0mmol,384mg),催化剂(苯乙烯摩尔量的0~15%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和催化剂,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
表1不同催化剂及用量对应的目标产物的收率
从表1中可以看出,在标准反应条件下,四苯基卟啉氯化铁和双铁四苯基卟啉反应具有较好的催化作用,可以获得满意的收率,特别是四苯基卟啉氯化铁的产率高达82%。而采用其它的无机二价铁盐或三价铁盐都几乎得不到目标产物。另外,四苯基卟啉氯化铁催化剂的用量不宜过量使用,催化剂过量,产物收率明显降低,而不加催化剂,明显得不到目标产物,只能找到氧化产物。
对比实验组2:
对照实施例13~21均按以下反应方程式反应:
具体操作步骤为:将苯乙烯(0.5mmol),nh4x(1.5当量,0.75mmol),tbhp(70%的h2o,6.0当量,3.0mmol,384mg),tppfecl(苯乙烯摩尔量的5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和催化剂,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
表2不同季铵盐对应的目标产物的收率
从表2中可以看出,采用卤素季铵盐可以实现苯乙烯的硝基化反应,除此以外其他的季铵盐以及氨水等都无法作为苯乙烯硝化反应的硝基源。此外从表2中还可以看出,碘化铵相对溴化铵及氯化铵具有更好的收率,碘化铵最适合作为苯乙烯硝基化试剂。
对比实验组3:
对照实施例22~31均按以下反应方程式反应:
具体操作步骤为:将苯乙烯(0.5mmol),nh4i(1.5当量,0.75mmol,108mg),氧化剂(6.0当量,3.0mmol),tppfecl(苯乙烯摩尔量的5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和催化剂,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
表3不同氧化剂对应的目标产物的收率
从表3中可以看出,仅tbhp可以氧化碘化铵,实现苯乙烯的硝基化,且反应不受气氛影响,在空气中及在保护气氛下都能获得较好的收率。而其他常见的氧化剂如双氧水、过硫酸钾及二叔丁基过氧化物等无机有机过氧化物均难以实现苯乙烯的硝基化反应。
对比实验组4:
对照实施例32~41均按以下反应方程式反应:
具体操作步骤为:将苯乙烯(0.5mmol),nh4i(1~2当量),氧化剂(4~7当量),tppfecl(苯乙烯摩尔量的5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和催化剂,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
表4不同nh4i和tbhp比例对应的目标产物的收率
从表4中可以看出nh4i和tbhp的与底物苯乙烯的反应比例,对产物的收率有较大的影响,nh4i与苯乙烯的摩尔比例要达到1.5以上,同时,tbhp与nh4i的比例要达到4以上,才能达到最佳的反应效果,而在其它比例范围内反应,虽然能顺利得到目标产物,但是收率受到限制。
对比实验组5:
对照实施例42~51均按以下反应方程式反应:
具体操作步骤为:将烯烃(0.5mmol),nh4i(1.5当量,0.75mmol,108mg),tbhp(70%的h2o,6.0当量,3.0mmol,384mg),tppfecl(3~5%)和溶剂(0~2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和tppfecl,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
表5不同溶剂及用量对应的目标产物的收率
对比实验组6:
对照实施例52~59均按以下反应方程式反应:
具体操作步骤为:将烯烃(0.5mmol,50.2mg),nh4i(1.5当量,0.75mmol,108mg),tbhp(70%的h2o,6.0当量,3.0mmol,384mg),tppfecl(3~5%)和溶剂(2ml)加入到密封管中。首先加入乙腈,然后加入烯烃,nh4i和tppfecl,最后加入tbhp。将反应在120℃下剧烈搅拌6小时,并通过tlc监测。反应完成后,将混合物冷却至室温,然后过滤并用乙酸乙酯(ea)洗涤。最后,用旋转蒸发器浓缩滤液,用石油醚(pe)/乙酸乙酯(ea)作为洗脱剂,采用硅胶(200-300目筛)进行柱色谱纯化。
表6不同溶剂及用量反应气氛对应的目标产物的收率
从表6中可以看出,只有在铵盐存在条件下才能获得目标化合物,环境气氛或溶剂不参与提供n源。
- 还没有人留言评论。精彩留言会获得点赞!