晶体管及其制造方法与流程
本申请是申请日为2012年5月24日,申请号为201280025694.3,发明名称为“晶体管及其制造方法”的申请的分案申请。
发明技术领域
本发明大体上涉及有机半导体层制剂、包含所述制剂的层、用于制备所述制剂和层的方法及包含所述制剂的电子装置,且本发明最适用于有机薄膜晶体管(otft)。
发明背景
有机半导体由于其能够实现低成本柔性电子装置的潜力而成为深入研究及开发的对象。其已广泛用于有机场效应晶体管及整合多个装置的电路中。预期otft将成为显示器技术领域中的重要技术,在显示器技术领域中otft的低制造成本、柔性且重量轻将导致otft在一些情况下可置换其基于硅的对应物。然而,在改进有机半导体材料性能领域及装置制造中需要显著改进。
otft装置需要满足包括以下的有挑战性的性能属性组合的有机半导体材料:高电荷载流子迁移率以及高电、机械及热稳定性。尽管可获得各种各样的高电荷载流子迁移率材料,但这些材料通常为非聚合有机分子,其在加工后产生易碎层,从而限制装置的柔性(参见n.madhavan,organicchemistryseminarabstracts2001-2002semesterii,universityofillinoisaturbanachampaign,2002,第49-56页,http://www.scs.uiuc.edu/chemgradprogram/chem/435/s02-madhavan.pdf)。
另一方面,可获得各种各样的具有优良柔性及韧性的非晶形及结晶半导体聚合物;但这些聚合物具有不利的低电荷载流子迁移率(llchua等人,nature,2005年3月,第434卷,第194-198页)。曾提议使用多并苯(polyacene),尤其取代的可溶性并五苯分子作为半导体。这些化合物及许多使用这些化合物的电子装置先前已公开于美国专利申请2003/0116755、ep1729357及美国专利6,690,029中。
期望改进半导体层的稳定性及完整性且wo2005/055248中已公开通过使用非聚合可溶性并五苯半导体分子及电容率εr至多为3.3的聚合物粘合剂来实现此目的。wo2005/055248在关于顶门极晶体管的测试中报告2种组合物未显示电荷迁移率,5种组合物显示电荷迁移率高于1.0cm2/vs且9种组合物的迁移率介于0与1.0cm2/vs范围之间。所报告的最佳结果为迁移率为1.44,标准差为0.35。此外,该申请中的所有22个实施例均为顶门极otft配置。我们发现在底门极有机薄膜晶体管情况下电荷载流子迁移率实质上降低;wo2005/055248并未解决底门极晶体管问题。wo2007/078993中尝试使用并五苯半导体分子及电容率超过3.3的粘合剂;所报告的最佳电荷迁移率为2×10-2cm2/vs。这似乎印证了先前关于粘合剂的电容率应低于3.3的教导。
沉积半导体层例如多并苯半导体/聚合物粘合剂制剂的最简单方式为使半导体及聚合物溶解于合适溶剂中,沉积配制的材料且蒸发溶剂。取代的可溶性并五苯已描述于上述说明书中且其合适粘合剂已公开于wo2005/055248中。wo2005/055248a、wo2007/078993及us2007/0158646中公开许多有用的粘合剂。
薄膜晶体管的一个重要方面为其在阵列中的性能应尽可能一致。若在制造晶体管时晶体管的性能存在广泛变化,则这将引起终端使用装置性能的变化。例如,若显示器应用中使用非均匀晶体管底板,则显示器中的像素将不均匀且具有不可接受的品质。性能不一致问题通常极显著地随晶体管尺寸减小而增加,因为晶体管尺寸减小涉及源极与漏极之间的通道长度的缩短。多年来电子元件尺寸减小已成为电子设备发展的一致及一贯特征且问题越来越严重。
本发明的一目标为提供在电子装置中具有大体上优良的性能一致性同时具有优良电荷迁移率的组合的半导体组合物。
发明描述
本发明包含其中源极及漏极由半导体组合物桥联的有机薄膜晶体管,该半导体组合物包含可溶性多并苯半导体及聚合半导体粘合剂,该粘合剂在1000hz下的电容率大于3.4,优选地为至少3.5且适宜地为至少3.7,例如至少4.1,且在纯态下的电荷迁移率大于10-7cm2v-1s-1,更优选地大于10-6cm2v-1s-1,例如大于10-5cm2v-1s-1。
优选的半导体聚合物为式(i)的聚合物,其可为均聚物或共聚物。共聚物为由两种或更多种不同单体制备的那些聚合物且包括三元共聚物、四元共聚物及类似物。单体可结合以形成无规共聚物、嵌段共聚物(blockcopolymer)或嵌段共聚物(segmentedcopolymer)以及任何种类的其它结构布置。
rx独立地为氢、优选地具有1至10个碳原子的烷基、优选地具有1至10个碳原子的烷氧基、卤素、硝基或ry;其中各ry独立地为氰基(cn)或包括至少一个cn基团的有机基团,条件为三芳基胺聚合物中的至少一个重复单元且优选地至少30%的重复单元包括ry基团且指数(j+k+l)的总和至少为1。聚合物中应存在足够的ry基团以确保其在1000hz下的电容率大于3.4。应了解,式1的第一部分中的所有重复单元中的rx基团可以不相同。
rz在每次出现时独立地为烷基且意图不仅包括纯开链饱和烃烷基取代基,诸如甲基、乙基、丙基、叔丁基及类似基团,而且包括具有本领域中已知的诸如羟基、烷氧基、烷基磺酰基、卤素原子、氰基、硝基、氨基、羧基等其它取代基的烷基取代基。因此,“烷基”包括醚基、卤烷基等。优选的rz基团包括c1-c20烃基且更优选地为c1-c5烷基,更优选地为甲基。
聚合物的不同单元中可选择rx及ry的定义范围内的不同选项。
a在每次出现时独立地为氢、卤素或任何合适封端基团,包括wo1999/32537中描述的封端基团,
j及l在每次出现时独立地为0至4,
k在每次出现时独立地为0至5,更优选地至少10%的单体单元中的指数(j+k+l)的总和(不同单体单元之间的指数的总和可以不同)至少为1。
a为聚三芳基胺化合物中式(ii)的单体单元的数目,若该化合物为均聚物,则聚合物将具有100%的式(ii)的单体。共聚物优选地包含5%-100%的式(ii)的单体,更优选地10%-80%的式(ii)的单体,还更优选地30%-70%的式(ii)的单体,
b为聚三芳基胺化合物中式(iii)的单体的单体单元的数目,在一些情况下b将等于0,
x为卤素,例如br或i,但更优选地为cl。
*(星号)-表示卤素原子或合适的离去基团。
ra及rb各自独立地表示氢原子、取代的或未被取代的具有6至50个碳原子的芳族烃环状基团、取代的或未被取代的具有5至50个碳原子的芳族杂环基团、取代的或未被取代的具有1至50个碳原子的烷基、取代的或未被取代的具有3至50个碳原子的环烷基、取代的或未被取代的具有1至50个原子的烷氧基、取代的或未被取代的具有6至50个碳原子的芳烷基、取代的或未被取代的具有5至50个碳原子的芳氧基、取代的或未被取代的具有5至50个碳原子的芳硫基、取代的或未被取代的具有1至50个碳原子的烷氧基羰基、取代的或未被取代的具有1至50个碳原子的甲硅烷基、羧基、卤素原子、氰基、硝基或羟基。
对于某些实施方案,半导体聚合物包括可被交联的基团,且由此在交联及图案化时,使得当在半导体层上溶液涂布各层时,半导体层不易于溶解。
在包含芴(iv)的重复单元、螺二芴(v)的重复单元和/或茚并芴(vi)的重复单元的共聚物的情况下,相同定义适用于rx、ry、a、j、k、l、a、b、n及x;此外,基团ra及rb彼此独立地选自h、任选地取代的烷基、烷芳基、芳烷基、烷氧基或聚烷氧基。
由式(i)表示的聚三芳基胺聚合物优选地包含由式(ii)及(iii)表示的重复单元,其中至少一些重复单元被氰基或包含氰基的基团或烷氧基取代。
在本发明的另一实施方案中,半导体聚合物中的重复单元包括由式(iv)表示的芴型重复单元、由式(v)表示的螺二芴重复单元和/或由式(vi)表示的茚并芴重复单元。可能的本发明的共聚物任选地包括由式(vii)、(viii)及(ix)表示的重复单元。
用于有机半导体层的合适半导体聚合物包括为总聚合物提供相对高介电常数的部分,这些部分可相同或不同。高介电常数组分可任选地部分位于式(ii)、(iv)、(v)和/或(vi)的重复单元中。本发明包括包含重复单元(ii)、(iii)、(iv)、(v)及(vi)的任何组合的共聚物,条件为至少一种重复单元包括至少一个ry基团且分子中存在的这些基团的总数足以产生所需电容率。
聚合物优选地具有氰基取代且在氰基直接取代至芳环上的情况下,氰基应位于2位和/或6位,优选地位于2位。该氰基取代优选地在“侧链”芳环(即不直接包含于聚合物链中的芳环)上进行。还优选的是氰基不应直接取代至芳环上,而应经由连接基团间接连接;其可取代于聚三芳基胺单元中的任何芳环上;更优选地取代于侧链环上。
在最优选的情况下,rx为在侧链芳环与氰基之间具有连接基团的基团。连接基团可为烷基、被至少一个额外氰基取代的取代的烷基(例如-ch2cn、-cr2-cn)。连接基团可为亚苯基,其可例如被额外cn基团取代;适宜地rx可为式-c6h4cn、-c6h4-ch2cn或-c6h4-(cr2)cn的基团。
在另一优选的情况下,由式(i)表示的聚合物优选地具有直接取代至芳环上的烷氧基取代基。这些取代基应位于2位、4位和/或6位。更优选的是该烷氧基取代在侧链芳环上进行。若还存在氰基,则优选的是氰基位于2位。
如本文中所用,术语“有机基团”意指碳原子、烃基(具有除碳及氢以外的任选元素,诸如氰基、氧、氮、硫、硅及卤素),其分类为脂族基、环状基团或脂族基与环状基团的组合(例如烷芳基及芳烷基)。术语脂族基意指饱和或不饱和直链或支链烃基。该术语用于涵盖例如烷基、烯基及炔基。术语“烷基”意指饱和直链或支链烃基,包括例如甲基、乙基、异丙基、叔丁基、己基、庚基、2-乙基己基及类似基团。术语“烯基”意指具有一个或多个碳-碳双键的不饱和直链或支链烃基,诸如乙烯基。术语“炔基”意指具有一个或多个碳-碳三键的不饱和直链或支链烃基。术语“环状基团”意指闭环烃基,其可分类为脂环基、芳族基或杂环基。术语“脂环基”意指性质与脂族基的性质类似的环烃。术语“芳族基”或芳基意指单核或多核芳烃基团,在其范围内包括烷芳基或芳烷基。术语“杂环基”意指环中的一个或多个原子为除碳以外的元素(例如氮、氧、硫等)的闭环烃。
在本发明的一个实施方案中,聚合物(i)中的rx优选地为氰基;适宜地,两个这样的基团可存在于侧链芳环(即不位于共轭聚合物主链中的芳环)的2位及6位。若重复单元中仅存在1个氰基,则该氰基优选地位于侧链芳环的2位(参见实施例1)。
在另一优选的情况下,rx为式(i)的聚合物中的侧链芳环上的甲氧基,在此情况下,甲氧基更优选地取代于侧链芳环上的2位及4位且k至少为2(参见实施例2)。
聚合物的数均分子量适宜地在1000至500,000范围内,例如5000至100,000。
优选的重复单元由式(iia)表示
其中一个或多个基团d独立地为cn基团或包含由连接基团连接至芳环的cn基团的基团和/或d为烷氧基。
下表提供连接基团的一些实例,
在另一优选的情况下,聚三芳基胺单元的侧链芳环构成如由式(iib)、(iic)及(iid)表示的芴、螺二芴或茚并芴结构的芳环中的一个。在式(iib)至(iid)中,基团rx及ry具有与上文所述相同的定义。
在另一优选的情况下,聚三芳基胺单元的“主链”芳环构成如由式(iie)、(iif)及(iig)表示的芴、螺二芴或茚并芴结构的芳环中的一个。在式(iie)至(iig)中,基团rx、ry及rz具有与上文所述相同的定义。
还提供装置、方法及优选的聚合物的特定实施方案。
例如,特别优选的装置包括有机薄膜晶体管或晶体管阵列、嵌入式电容器及集成电路。装置优选地包括有机半导体层,该有机半导体层合并有介电常数大于3.4的半导体聚合物及多并苯有机半导体。
有机半导体层包括可形成于基材上的层;其可为玻璃、聚(萘二甲酸乙二醇酯)(pen)、聚(对苯二甲酸乙二醇酯)(pet)或聚酰亚胺。术语层与印刷电子工业中常用的术语“膜”同义。
可制得具有以下特征的本发明的高介电常数半导体聚合物:可由溶液涂布、高玻璃化转变温度(高于100℃)、可在空气中进行加工及与柔性基材相容。
任选可交联和/或光可图案化聚合物;当可交联基团并入半导体聚合物中时,可使用本领域技术人员熟知的各种技术对半导体聚合物进行光图案化。光图案化描述于第wo97/15173号申请中。
与本发明的半导体聚合物组合使用的合适多并苯半导体描述于申请wo2005/055248、wo2007/082584、wo2008/107089及wo2009/155106中且其中的定义适用于本发明中包括的多并苯化合物。多并苯半导体的合适合成方法描述于这些申请中。
本发明的优选的多并苯为具有式(a)的那些多并苯:
其中各r基团可相同或不同,独立地表示氢;任选地取代的c1-c40二价碳基或烃基;任选地取代的c1-c40烷氧基;任选地取代的c6-c40芳氧基;任选地取代的c7-c40烷基芳氧基;任选地取代的c2-c40烷氧基羰基;任选地取代的c7-c40芳氧基羰基;氰基(-cn);氨基甲酰基(-c(=o)nh2);卤甲酰基(-c(=o)-x,其中x表示卤素原子);甲酰基(-c(=o)-h);异氰基;异氰酸酯基;硫氰酸酯基或硫异氰酸酯基;任选地取代的氨基;羟基;硝基;cf3基团;卤基(cl、br、f);或任选地取代的甲硅烷基;及
其中各对r2及r3和/或r8及r9可独立地桥联以形成c4-c40饱和或不饱和环,该饱和或不饱和环可插入有氧原子、硫原子或由式-n(r3)-(其中r3为氢原子或任选地取代的烃基)所示的基团,或可任选地被取代;且其中多并苯骨架中的一个或多个碳原子可任选地被选自n、p、as、o、s、se及te的杂原子取代;且其中任何两个或更多个位于多并苯的相邻环位置上的取代基r1-r12可独立地一起任选地构成稠合至该多并苯的另一个任选地插入有o、s或-n(r3)(其中r3如上文所定义)的c4-c40饱和或不饱和环或芳环系统;且其中
式a中的k加l可为0、1、2、3或4。
二价碳基或烃基优选地应被三取代的甲硅烷基取代。取代的二价碳基优选地为三取代的甲硅烷基乙炔基。
并苯环(若并苯环数为奇数,则其优选地为中心并苯环,或若并苯环数为偶数,则其为两个中心并苯环中的一个)优选地应被两个三取代的甲硅烷基乙炔基取代。若并苯环数为3,则末端并苯基团的取代基r(上式中显示为r2、r3、r9及r10)适宜地被桥联以形成c4-c8饱和或不饱和环,优选地5元不饱和环,其各包含氮或硫杂原子。
尤其优选的是式(a2)的化合物
其中并五苯上的6位及13位均被三烷基甲硅烷基乙炔基取代,其中甲硅烷基被3个由rf表示的烷基取代,该3个烷基可相同或不同且优选地具有1至4个且优选地2个或3个碳原子。
r1、r4、r8及r11为c1至c6烃基或烃氧基,其优选地为c1至c6烷基或烷氧基,其优选地相同,例如为甲基、乙基、丙基、异丙基或丁基。
在一个实施方案中,当r1、r4、r8、r11为甲基时,rf为乙基。
在另一实施方案中,当r1、r4、r8、r11为甲基时,rf为异丙基。
在另一优选的实施方案中,r1、r4、r8、r11为c1至c6烷氧基,例如甲氧基、乙氧基、丙氧基、丁氧基等。
当r1、r4、r8、r11为甲氧基时,rf优选地为乙基或异丙基。
在另一实施方案中,r1、r4、r8、r11为芳氧基且rf个别地为具有1至4个且优选地2个或3个碳原子的烷基。
在本发明的另一实施方案中,优选的化合物由式(a3)表示;
其中并五苯上的6位及13位均被三烷基甲硅烷基乙炔基取代,其中烷基由rf表示,这些烷基可相同或不同且优选地具有1至4个且优选地2个或3个碳原子。
r2、r3、r9、r10为c1至c6烃基,其优选地为相同烷基,例如甲基、乙基、丙基、异丙基或丁基;
在一个实施方案中,当r2、r3、r9、r10为甲基时,rf为乙基。
在另一实施方案中,当r2、r3、r9、r10为甲基时,rf为异丙基。
可选择地,r2、r3、r9、r10可为c1至c6烷氧基,例如甲氧基、乙氧基、丙氧基、丁氧基等。
当r2、r3、r9、r10为甲氧基时,rf为乙基或异丙基。
在另一实施方案中,r2、r3、r9、r10为芳氧基。在本发明的另一实施方案中,优选的化合物由式(b1)表示;
其中对于具有式(b1)的化合物:
各rg基团独立地包含(i)支链或无支链、取代的或未被取代的烷基,(ii)取代的或未被取代的环烷基或(iii)取代的或未被取代的环烷基亚烷基;
各rh独立地包含(i)支链或无支链、取代的或未被取代的烯基,(ii)取代的或未被取代的环烷基或(iii)取代的或未被取代的环烷基亚烷基;
rp包含(i)氢,(ii)支链或无支链、取代的或未被取代的炔基,(iii)取代的或未被取代的环烷基,(iv)取代的或未被取代的环烷基亚烷基,(v)取代的芳基,(vi)取代的或未被取代的芳基亚烷基,(vii)乙酰基,(viii)取代的或未被取代的杂环,该环中包含o、n、s及se中的至少一个:
x=1或2;
y=1或2;
z=1或2;
(x+y+z)=3;
x表示c1至c20烃基,其优选地为相同烷基,更优选地为甲基;或x为c1-c20烷氧基,更优选地为甲氧基。
在本发明的另一实施方案中,优选的化合物由式(b2)表示;与式(b1)中相同的定义适用于rg、rh、rp、x、y、z及x。
示例性式(b1)及(b2)的化合物表示如下;
式b1的化合物的最优选的实例包括:
1,4,8,11-四甲基-双(烯丙基二异丙基甲硅烷基乙炔基)并五苯;1,4,8,11-四甲基-双(异丙烯基二异丙基甲硅烷基乙炔基)并五苯;1,4,8,11-四甲基-双(二异丙烯基异丙基甲硅烷基乙炔基)并五苯;1,4,8,11-四甲基-双(环丙基二异丙基甲硅烷基乙炔基)并五苯;1,4,8,11-四甲基-双(环丁基二异丙基甲硅烷基乙炔基)并五苯;1,4,8,11-四甲基-双(环戊基二异丙基甲硅烷基乙炔基)并五苯及相应的1,4,8,11-四甲氧基取代的化合物。
式b2的化合物的最优选的实例包括:
2,3,9,10-四甲基-双(烯丙基二异丙基甲硅烷基乙炔基)并五苯;2,3,9,10-四甲基-双(异丙烯基二异丙基甲硅烷基乙炔基)并五苯;2,3,9,10-四甲基-双(二异丙烯基异丙基甲硅烷基乙炔基)并五苯;2,3,9,10-四甲基-双(环丙基二异丙基甲硅烷基乙炔基)并五苯;2,3,9,10-四甲基-双(环丁基二异丙基甲硅烷基乙炔基)并五苯;2,3,9,10-四甲基-双(环戊基二异丙基甲硅烷基乙炔基)并五苯及相应的2,3,9,10-四甲氧基取代的化合物。
在本发明的另一实施方案中,优选的化合物由式(c)表示;
其中
y1及y2中的一个表示-ch=或=ch-且另一个表示-x'-,
y3及y4中的一个表示-ch=或=ch-且另一个表示-x'-,
x为-o-、-s-、-se-或-nr″'-,
rs为具有1至20个,优选地1至8个c原子的环状、直链或支链烷基或烷氧基,或具有2至30个c原子的芳基,其全部任选地被氟化或全氟化,且sir3优选地为三烷基甲硅烷基,
rt为h、f、cl、br、i、cn、具有1至20个(优选地1至8个)c原子且任选地氟化或全氟化的直链或支链烷基或烷氧基、任选地氟化或全氟化的具有6至30个碳原子的芳基,优选地为c6f5,或co2r″,其中r″为h、任选地氟化的具有1至20个碳原子的烷基或任选地氟化的具有2至30个(优选地5至20个)碳原子的芳基,
r"'为h或具有1至10个碳原子的环状、直链或支链烷基,优选地为h,
m为0或1,
n为0或1。
特别优选的式(c)的多并苯包括:
粘合剂与半导体的比率适宜地为20:1至1:20,优选地为10:1至1:10且更优选地为5:1至1:5(以重量计)。
有机半导体制剂适宜地使用溶液涂布技术沉积。这些技术的实例包括旋涂、滴涂(dropcasting)、浸涂、喷墨印刷、喷嘴喷射印刷、喷涂、网板印刷、平版印刷、凸版印刷、凹版印刷及转移印刷(transferprinting)。适合与本发明的半导体聚合物一起使用的溶剂包括适用于通过任何上述方法涂布的任何溶剂。
用于溶液涂布有机半导体层的有用溶剂的实例包括但不限于烃,尤其为芳族烃、酮溶剂、醇、醚、酯及氯化溶剂。更特别有用的溶剂为诸如苯甲醚、甲苯、萘满、环己酮、环戊酮、甲基乙基酮、甲基异丁基酮、二甲基甲酰胺、二甲亚砜、二甲基乙酰胺、乙酸丁酯、乙酸1-甲氧基-2-丙酯、乳酸乙酯、4-二甲基氨基吡啶以及二氯苯及溴苯的溶剂。
本申请提供了以下项目:
项目1.一种半导体组合物,其包含可溶性多并苯半导体及聚合半导体粘合剂,所述粘合剂在1000hz下的电容率大于3.4。
项目2.根据项目1所述的半导体组合物,其中当在纯态下测量时,所述半导体粘合剂的电荷迁移率大于10-7cm2/vs且更优选地大于10-6cm2/vs。
项目3.根据项目1或2所述的组合物,其中所述粘合剂包含三芳基胺重复单元。
项目4.根据项目1或2所述的半导体组合物,其包含具有以下结构的均聚物或共聚物
rx独立地为氢、优选地具有1至10个碳原子的烷基、优选地具有1至10个碳原子的烷氧基、卤素、硝基或ry;其中各ry独立地为氰基(cn)或包括至少一个cn基团的有机基团,条件为三芳基胺聚合物中的至少一个重复单元且优选地至少30%的所述重复单元包括ry基团且指数(j+k+l)的总和至少为1,所述聚合物中存在足够的ry基团以确保其在1000hz下的电容率大于3.4,上式的第一部分中的所有所述重复单元中的rx基团可以不相同,rz在每次出现时独立地为烷基且意图不仅包括纯开链饱和烃烷基取代基,诸如甲基、乙基、丙基、叔丁基及类似基团,而且包括具有本领域中已知的诸如羟基、烷氧基、烷基磺酰基、卤素原子、氰基、硝基、氨基、羧基等其它取代基的烷基取代基,包括醚基、卤烷基,但优选的rz基团包括c1-c20烃基,且更优选地为c1-c5烷基,更优选地为甲基,所述聚合物的不同单元中可选择rx及ry的定义范围内的不同选项,a在每次出现时独立地为氢、卤素或任何合适封端基团,包括wo1999/32537中描述的封端基团,j及l在每次出现时独立地为0至4,k在每次出现时独立地为0至5,更优选地至少10%的单体单元中的指数(j+k+l)的总和至少为1,不同所述单体单元之间的所述指数的总和可以不同,a为所述聚三芳基胺化合物中式(ii)的单体单元的数目(显示于本项目的式的左侧),若所述聚三芳基胺化合物为均聚物,则所述聚合物将具有100%的式(ii)的单体,b为所述聚三芳基胺化合物中式(iii)的单体(显示于本项目的式的右侧)的单体单元的数目,在一些情况下,b将等于0,x为卤素,例如br或i,但更优选地为cl,*(星号)表示卤素原子或合适的离去基团,所述共聚物优选地包含5%-100%的式(ii)的单体,更优选地10%-80%的式(ii)的单体,还更优选地30%-70%的式(ii)的单体。
项目5.根据项目4所述的组合物,其中所述聚合物具有直接取代于芳环上的2、4和/或6位的烷氧基取代基。
项目6.根据项目4所述的组合物,其中氰基借助于连接基团连接至所述芳环。
项目7.根据项目4所述的组合物,其中烷氧基和/或氰基取代是在侧链芳环上进行。
项目8.根据项目3、4、5或6所述的组合物,其中若所述重复单元中存在1个氰基,则所述氰基位于所述侧链芳环的2位,且若存在两个氰基,则所述氰基位于所述侧链芳环的2位及6位。
项目9.根据项目4所述的组合物,其中甲氧基存在于所述侧链芳环的2位、4位上。
项目10.根据项目1或2所述的组合物,其包含可被取代的三芳基胺基团及可被取代的芴、螺二芴或茚并芴基团。
项目11.根据项目1、2或3所述的组合物,其具有以下式:
rx独立地为氢、优选地具有1至10个碳原子的烷基、优选地具有1至10个碳原子的烷氧基、卤素、硝基或ry;其中各ry独立地为氰基(cn)或包括至少一个cn基团的有机基团,条件为三芳基胺聚合物中的至少一个重复单元且优选地至少30%的所述重复单元包括ry基团且指数(j+k+l)的总和至少为1,所述聚合物中应存在足够的ry基团以确保其在1000hz下的电容率大于3.4,式(ixb)的第一部分中的所有所述重复单元中的rx基团可以不相同,rz在每次出现时独立地为烷基且意图不仅包括纯开链饱和烃烷基取代基,诸如甲基、乙基、丙基、叔丁基及类似基团,而且包括具有本领域中已知的诸如羟基、烷氧基、烷基磺酰基、卤素原子、氰基、硝基、氨基、羧基等其它取代基的烷基取代基,因此,“烷基”包括醚基、卤烷基等,优选的rz基团包括c1-c20烃基,且更优选地为c1-c5烷基,更优选地为甲基,所述聚合物的不同单元中可选择rx及ry的定义范围内的不同选项,a在每次出现时独立地为氢、卤素或任何合适封端基团,包括wo1999/32537中描述的封端基团,j及l在每次出现时独立地为0至4,k在每次出现时独立地为0至5,更优选地至少10%的单体单元中的指数(j+k+l)的总和至少为1,不同所述单体单元之间的所述指数的总和可以不同,a为所述聚三芳基胺化合物中式(ii)的单体单元的数目,若所述聚三芳基胺化合物为均聚物,则所述聚合物将具有100%的式(ii)的单体,所述共聚物优选地包含5%-100%的式(ii)的单体(显示于本项目的式的左侧),更优选地10%-80%的式(ii)的单体且还更优选地30%-70%的式(ii)的单体,b为所述聚三芳基胺化合物中式(iii)的单体(显示于本项目的式的右侧)的单体单元的数目,在一些情况下,b将等于0,x为卤素,例如br或i,但更优选地为cl,*(星号)表示卤素原子或合适的离去基团,ra及rb各自独立地表示氢原子、取代的或未被取代的具有6至50个碳原子的芳族烃环状基团、取代的或未被取代的具有5至50个碳原子的芳族杂环基团、取代的或未被取代的具有1至50个碳原子的烷基、取代的或未被取代的具有3至50个碳原子的环烷基、取代的或未被取代的具有1至50个碳原子的烷氧基、取代的或未被取代的具有6至50个碳原子的芳烷基、取代的或未被取代的具有5至50个碳原子的芳氧基、取代的或未被取代的具有5至50个碳原子的芳硫基、取代的或未被取代的具有1至50个碳原子的烷氧基羰基、取代的或未被取代的具有1至50个碳原子的甲硅烷基、羧基、卤素原子、氰基、硝基或羟基。
项目12.根据任一前述项目所述的组合物,其中所述粘合剂为所制备的包含三种或更多种不同单体单元的共聚物或共聚物混合物。
项目13.根据项目1或2所述的组合物,其中所述粘合剂包含三芳基胺基团,其中至少一个芳基还形成另一结构的一部分,该另一结构包含至少一个其它芳环,且为聚合链的一部分,或其中不形成所述聚合链的一部分的芳基形成另一结构的一部分,该另一结构包含至少一个其它芳环。
项目14.根据任一前述项目所述的组合物,其中所述多并苯半导体为线性多并苯且包含3至7个并苯环。
项目15.根据项目13所述的组合物,其中所述多并苯半导体具有五个并苯环。
项目16.根据项目13或14所述的组合物,其中所述多并苯半导体被两个甲硅烷基乙炔基取代。
项目17.根据项目15所述的组合物,其中所述甲硅烷基乙炔基位于6位、13位。
项目18.根据项目1或2所述的组合物,其中所述多并苯半导体为其中中心环为苯环而末端环为5元杂环,且在中心苯环上被两个甲硅烷基乙炔基取代的多并苯。
项目19.根据项目15、16或17所述的组合物,其中所述甲硅烷基乙炔基在各si原子上被3个有机基团取代。
项目20.根据项目18所述的组合物,其中所述有机基团为乙基或丙基,优选地为异丙基。
项目21.一种有机薄膜晶体管,其中源极及漏极由根据任一前述项目的半导体组合物桥联。
项目22.一种制造有机薄膜晶体管的方法,其包括通过溶液涂布来沉积根据任一前述项目的有机半导体组合物。
项目23.一种根据任一前述项目的半导体组合物的溶液,其是用于项目21所述的方法中。
附图说明
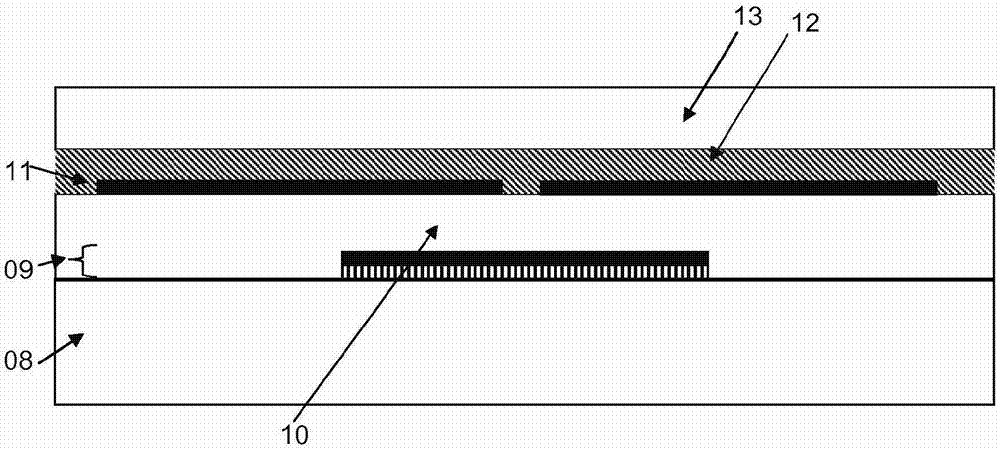
图1显示了制备在涂覆有su8层的玻璃集基材的otft的图。其中层1—玻璃基材,层2—底部接触垫,层3—su8(2002;阴性环氧型阴性近紫外线光致抗蚀剂材料,由microcheminc.供应),层4—源极、漏极,层5—osc层,层06—介电层,层07—门电极。
图2显示了制备在玻璃基材上的底门极otft的图。其中层08—玻璃基材,层09—门电极,层10—门极介电质,层11—源极/漏极,层12—osc层,层13—钝化层。
图3显示了使用1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯及50:50无规共聚物(4)的tg100μm通道长度otft的转移特征。漏极电压为-2v。
图4显示了使用1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯及30:70无规共聚物(5)的tg100μm通道长度otft的转移特征。漏极电压为-2v。
图5显示了使用1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯及2,4-二meo聚合物(2)的bg100μm通道长度otft的转移特征。漏极电压为2v。
测量聚合物的电容率εr的方法
通过根据下文详细描述的方法制造电容器来测量实施例1至17中半导体聚合物的电容率。
使用溅涂以及标准光刻法及湿式蚀刻技术制备50nm钛底部接触垫。接着使用旋涂机由溶液涂布所关心的半导体聚合物,以获得通常大于500nm的膜厚度。用于溶解材料的溶剂显示于下文中。接着使用遮蔽罩蒸发(shadowmaskevaporation)沉积约50nm铝制顶部接触垫。使用经校准的设定为1000hz频率的agilentprecisionlcr计e4980a测量电容。使用dektak表面轮廓仪进行膜厚度测量且与taylorhobsontalysurfcci白光干涉仪交叉相关。发现两种技术对所研究的所有膜在+/-3%范围内达成一致。使用装配有影像分析软件的zeiss立体显微镜测量顶部接触垫与底部接触垫的重叠面积(即形成的电容器的面积)。接着使用这些值,使用以下方程式计算电容率:
方程式1:电容率的计算。
其中,
εr为聚三芳基胺类似物的电容率
c为测量的电容器的电容
d为聚三芳基胺类似物膜的厚度
a为电容器面积且εo为自由空间的电容率(值为8.854×10-12f/m的常数)。
所用的电容器阵列含有64个电容器,面积分别为0.11cm2及0.06cm2(每种尺寸各32个)。计算各阵列的电容率值的标准差,其包括电容、膜厚度及面积测量组合的标准差。此外,在可能情况下在两种不同膜厚度下测试各半导体聚合物以确认电容率值不随膜厚度而变化。
电容率数据
使用上述方法获得表1(a)中包括的数据。
表1(a):针对各聚合物制造及测量的电容器阵列的细节
a配制于萘满中的5重量%聚合物,300rpm下涂布,20秒
b配制于萘满中的5重量%聚合物,500rpm下涂布,20秒
c配制于邻二氯苯中的5重量%聚合物,300rpm下涂布,20秒
d配制于邻二氯苯中的10重量%聚合物,300rpm下涂布,20秒
e配制于二氯甲烷中的3重量%聚合物,300rpm下涂布,20秒
f配制于二氯甲烷中的2重量%聚合物,300rpm下涂布,20秒
g使用金制顶部及底部接触物及面积为0.24cm2的电容器制备
h配制于甲苯中的10重量%聚合物,700rpm下涂布,20秒
i使用金制顶部及底部接触物及面积为0.15cm2的电容器制备
j配制于萘满中的10重量%聚合物,500rpm下涂布,20秒
k使用金制顶部及底部接触物及面积为0.11cm2及0.06cm2的电容器制备
l配制于甲苯中的10重量%聚合物,500rpm下涂布,20秒
m配制于50/50体积thf/环己酮中的5重量%聚合物,300rpm下涂布,20秒
n配制于50/50体积thf/环己酮中的5重量%聚合物,500rpm下涂布,20秒
o配制于甲苯中的5重量%聚合物,300rpm下涂布,20秒
p配制于甲苯中的5重量%聚合物,500rpm下涂布,20秒
q配制于邻二氯苯中的5重量%聚合物,500rpm下涂布,20秒
r配制于溴苯中的5重量%聚合物,300rpm下涂布,20秒
s配制于溴苯中的5重量%聚合物,500rpm下涂布,20秒
t配制于甲苯中的5重量%聚合物,450rpm下涂布,20秒
u配制于苯乙醚中的3重量%聚合物,100rpm下涂布,20秒
v配制于苯乙醚中的3重量%聚合物,200rpm下涂布,20秒
w配制于萘满中的7重量%聚合物,300rpm下涂布,20秒
x配制于萘满中的7重量%聚合物,500rpm下涂布,20秒
y配制于甲苯中的5重量%聚合物,400rpm下涂布,20秒
表1(b):各聚合物的tft迁移率及聚合物制剂细节
使用玻璃基材制造呈顶门极配置的otft(参见图1)。制造方法如下所述。
基于玻璃的otft装置
通过在deconex(3%于水中)中超声处理20分钟接着在超纯水中冲洗来清洗4″正方形玻璃基材(例如corningeagle2000)且使用压缩空气干燥。在玻璃上溅涂源极金属及漏极金属(50nmau于5nmti上)。使用标准光刻法及湿式化学蚀刻图案化源极-漏极(sd)电极。光刻掩模上的晶体管sd图案由电极组成,其中通道长度在4μm、10μm、30μm及100μm范围内且通道宽度为0.5mm、3mm及15mm。图案经阵列化以在4"正方形基材上产生各通道长度36个晶体管。在检查所蚀刻的图案后,化学剥离光致抗蚀剂材料且使用复式显微镜测量sd通道长度。接着使用50sccm氩/50sccm氧等离子体及250wrf功率对基材进行等离子体处理(pe100型,explasmaetchinc.),处理时间为60秒。在旋涂osc溶液之前,将10mm五氟苯硫醇溶液经1分钟施加于电极表面,接着进行旋涂且在2-丙醇中冲洗,接着在加热板上在100℃下干燥。使用设定为1000rpm的sussrc12旋转器将有机半导体(osc)制剂旋涂于sd电极上,接着在加热板上在100℃下烘烤60秒。在1500rpm下旋涂2份cytopctl809m(asahiglass)与1份fc43溶剂(acrosorganics)的溶液且将样品在加热板上在100℃下烘烤60秒。通过在热蒸发器系统中经由遮蔽罩蒸发金来界定门电极。
otft表征
使用wentworthpegasus300s半自动探针台联合keithleys4200半导体参数分析器测试otft。这允许在各基材上进行统计上显著次数的otft装置测量。keithley系统根据如下显示的方程式(方程式2)计算线性迁移率
其中l为晶体管长度,w为晶体管宽度且ci为每单位面积的电容率。除非另有说明,否则vds设定为-2v。所报告的迁移率值为各晶体管的5个最高点累计的平均值。迁移率值的标准差报告为平均值百分比且所测量的装置数也说明于结果列表中。
制造有机薄膜晶体管(otft)及表征迁移率(μ,cm2/vs)的方法
本发明中提供与申请wo2007/078993中的图1至4中所描述的顶门极otft及底门极otft类似的顶门极otft及底门极otft。
使用基于玻璃或塑料的基材制造呈顶门极及底门极配置的otft。制造方法如下所述。
在聚萘二甲酸乙二醇酯(pen)基材上制备otft
将pen基材(商品名teonexq65fa,来自dupontteijinfilms)层压于基于玻璃的载体上以供使用双侧压敏性粘合剂加工。在塑料上溅涂源极金属及漏极金属(50nmau于5nmti上)。使用标准光刻法及湿式化学蚀刻图案化源极-漏极(sd)电极。光刻掩模上的晶体管sd图案由电极组成,其中通道长度在4μm、10μm、30μm及100μm范围内且通道宽度为0.5mm、3mm及15mm。图案经阵列化以在4"正方形基材上产生25个具有各通道长度的晶体管。在检查所蚀刻的图案后,化学剥离光致抗蚀剂材料且使用复式显微镜测量sd通道长度。在旋涂osc溶液之前,将10mm五氟苯硫醇溶液经1分钟施加于电极表面,接着进行旋涂且在2-丙醇中冲洗,接着在加热板上干燥。使用设定为1500rpm的sussrc12旋转器将有机半导体(osc)制剂旋涂于sd电极上,接着在加热板上在100℃下烘烤60秒。在1500rpm下旋涂2份cytopctl809m(asahiglass)与1份fc43溶剂(acrosorganics)的溶液且将样品在加热板上在100℃下烘烤60秒。通过在热蒸发器系统中经由遮蔽罩蒸发金来界定门电极。
基于玻璃的otft装置
通过在deconex(3%于水中)中超声处理20分钟接着在超纯水中冲洗来清洗4"正方形玻璃基材(例如corningeagle2000)且使用压缩空气干燥。接着使用与pen基材相同的方式(省略层压步骤)加工基材以图案化sd电极(au/ti)。接着使用50sccm氩/50sccm氧等离子体及250wrf功率对基材进行等离子体处理(pe100型,购自plasmaetchinc.),处理时间为60秒。接着与上述pen方法相同地进行硫醇处理。接着使用10mm苯基乙基三氯硅烷的甲苯溶液处理基材。将此沉积于基材上且静置以使其在1分钟时间内形成自组装单层。使用在1000rpm下20秒的旋转条件移除过量溶液。接着,用甲苯冲洗基材,静置1分钟,随后使用相同旋转条件旋转除去过量溶剂,接着用甲苯进行最终洗涤。接着将基材放置于预热的加热板上于110℃下保持1分钟。该方法的剩余阶段(osc及介电质涂布与门极沉积)与上述pen方法相同。
具有su8平坦化层的基于玻璃的otft装置(玻璃/su8)(参见图1)
通过在deconex(3%于水中)中超声处理20分钟接着在超纯水中冲洗来清洗4"正方形玻璃基材(层01)(例如corningeagle2000)且使用压缩空气干燥。接着在基材上相继溅涂ti(5nm)层及au(50nm)层。通过对所沉积的ti/au层进行光刻法与湿式化学蚀刻的组合在玻璃表面上图案化底部接触垫(层02)。通过uv闪光曝光随后浸没于抗蚀剂显影剂中来移除剩余抗蚀剂层。接着使用100sccm浓度的氧等离子体、150mtorr的室压力及200w的rf功率在oxfordplasmalab800plusrie系统中清洗基材5分钟。
接着用4ml1.5:1环戊酮:su8(2002;阴性环氧型阴性近紫外线光致抗蚀剂材料,由microcheminc.提供)溶液经由在2200rpm下旋涂来涂布基材。旋涂后,首先将基材放置于加热板上95℃下1分钟,接着进行uv闪光曝光,在95℃下曝光后烘烤2分钟,最终在115℃下烘烤10分钟。所测量的su8(层03)的最终厚度测量为0.5微米。
在制备su8底层后,用50nmau溅涂基材(无ti层),接着使用与前述底部接触垫相同的光刻法与湿式蚀刻技术的组合制备源极及漏极(层04)。在通过uv闪光曝光及旋转显影自源极及漏极接触点移除残余光刻抗蚀剂后,在光学显微镜下检查基材且测量基材的若干区域中的通道长度特征。
在进行otft制造前,在oxfordplasmalab800plus系统中以rie模式再次处理基材,此次处理是借助于浓度分别为50sccm及5sccm的ar/o2等离子体、200mtorr的室压力、200w的rf功率进行1分钟。
在旋涂osc溶液之前,将10mm五氟苯硫醇溶液经1分钟施加于电极表面,接着进行旋涂且在2-丙醇中冲洗,接着在加热板上干燥。除非另有说明,否则使用设定为1500rpm的sussrc12旋转器将osc制剂旋涂于sd电极上历时1分钟,接着在加热板上在100℃下烘烤60秒(层05)。在1000rpm下旋涂2份cytop809m(asahiglass)与1份fc43溶剂(acrosorganics)的溶液20秒且将样品在加热板上在100℃下烘烤60秒(层06)。
接着用50nmau溅涂基材且如前所述用光刻法及湿式蚀刻的组合图案化门电极(层07)。
通过喷墨印刷的基于玻璃的otft装置(玻璃/喷墨)(参见图2)
通过在deconex(3%于水中)中超声处理20分钟接着在超纯水中冲洗来清洗4"正方形玻璃基材(例如corningeagle2000)且使用压缩空气干燥。接着使用与先前基于玻璃的装置相同的方式加工基材以图案化sd电极(au/ti)(层02)。在sd电极步骤后形成排形图案(bankpattern)以精确界定印刷区域。用4mlsu8(2002;阴性环氧型阴性近紫外线光致抗蚀剂材料,由microcheminc.提供)经由在2500rpm下旋涂来涂布基材。旋涂后,首先将基材放置于加热板上在95℃下1分钟,接着用光刻掩模曝露于uv,接着在95℃下曝光后烘烤2分钟。使用su8显影剂(micropositecsolvent,chestechltd.,uk)进行图案显影且将经图案化的基材在115℃下烤硬4.5分钟。su8(层0.3)的厚度测量为1.2微米。将10mm五氟苯硫醇溶液经1分钟施加于电极表面,接着进行旋涂且在2-丙醇中冲洗,接着在加热板上在110℃下干燥1分钟。通过喷墨印刷加工osc。使用按需滴墨型喷墨印刷机(dmp2000,fujifilmdimatix,usa)及10pl标称滴体积滤筒(dmc-11610,fujifilmdimatix,usa)。喷墨印刷后,将基材在加热板上在100℃下干燥1分钟。该方法的剩余阶段(介电质涂布与门极沉积)与上述pen或玻璃方法相同。
具有su8门极介电质的底门极、底接触otft装置
通过在deconex(3%于水中)中超声处理20分钟接着在超纯水中冲洗来清洗4"正方形玻璃基材(层01)且使用压缩空气干燥。接着在基材上相继溅涂ti(5nm)层及au(50nm)层。通过对所沉积的ti/au层进行光刻法与湿式化学蚀刻的组合在玻璃表面上图案化门电极(层02)。通过uv闪光曝光随后浸没于抗蚀剂显影剂中来剥离剩余抗蚀剂。接着使用100sccm浓度的氧等离子体、150mtorr的室压力及200w的rf功率在oxfordplasmalab800plusrie系统中清洗基材5分钟。
接着用4ml1.5:1环戊酮:su8(2002;阴性环氧型阴性近紫外线光致抗蚀剂材料,由microcheminc.提供)溶液经由在2200rpm下旋涂来涂布基材。旋涂后,首先将基材放置于加热板上在95℃下1分钟,接着进行uv整片曝光,曝光后在60℃下烘烤1分钟,接着在95℃下烘烤1分钟。接着对层进行显影,且最终在230℃下烘烤1小时。所测量的最终su8(层03)厚度测量为450nm。
在制备su8底层后,用50nmau溅涂基材,接着使用如先前关于门电极所描述的光刻法与湿式蚀刻技术的组合来制备源极及漏极(层04)。通过uv闪光曝光及旋转显影自源极接触点及漏极接触点移除残余光刻抗蚀剂。
在旋涂osc溶液前,使基材电极在50sccmo2及50sccmar浓度、200mtorr室压力、250wrf功率的plasmaetchpe100等离子体室中调节1分钟。将10mm4-氟硫酚的2-丙醇溶液经1分钟施加于源极/漏极表面,接着进行旋涂且在2-丙醇中冲洗,接着在加热板上干燥。
使用sussrc12旋转器以1500rpm最终旋转1分钟来旋涂osc制剂,接着在加热板上在100℃下烘烤60秒(层05)。
通过在1000rpm下旋涂1份cytop809m(asahiglass)与2份fc43溶剂(acrosorganics)的溶液20秒来形成钝化层(层06)且在加热板上在100℃下烘烤60秒。
制备实施例1至11
使用由jeol提供的仪器,尤其是ecx300型及ecx400型采集nmr数据。
除非另有说明,否则所用的所有溶剂均为hplc级。
除非另有说明,否则使用
本文实施例中所用的数均分子量(mn)是通过凝胶渗透色谱法使用hewlettpackard1100hplc系统在254nm下进行uv探测而测定,液相色谱法数据是使用针对聚苯乙烯标准物校准的cirrusgpc-multi探测器软件(由varian提供,13个点,分子量范围162-113300)处理的。
此外,为方便起见,本文中的聚合物实施例是由重复单元中芳环上的取代基鉴别(例如2位具有氰基取代的聚三芳基胺称为2-氰基-聚三芳基胺聚合物)。实施例1至5均是通过使相应的二卤取代的单体聚合而合成,本发明中未使用wo1999/32537中定义的封端剂。wo1999/32537中描述的聚合方法同样适用于制备本发明的聚合物。
比较实施例(i)至(iv)
如上文所描述制造并测试被制造并表征为比较实施例(i)至(iv)的otft阵列。比较实施例中测试的制剂包括小分子半导体,然而这些制剂不含任何半导体粘合剂。
比较实施例(i):无半导体粘合剂的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯(tmtes);tgotft
将来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以0.5重量%总固体含量配制于萘满中。根据上文关于pen基材所显示的方法将此制剂涂布为otft装置中的osc层,不同之处在于osc在500rpm下涂布35秒。
此制剂的tft性能显示于下表(i)中:
比较实施例(ii):无半导体粘合剂的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯(tmtes);bgotft
将来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以0.5重量%总固体含量配制于萘满中。根据上文关于具有su8门极介电质的底门极、底接触otft装置显示的方法将此制剂涂布为osc层,不同之处在于不使用等离子体处理;所用硫醇为ipa中的10mm五氟苯硫醇且osc的涂布速率为500rpm,35秒。
此制剂的tft性能显示于下表(ii)中:
比较实施例(iii):无半导体粘合剂的6,13-双-三异丙基甲硅烷基乙炔基并五苯(tips);tgotft
将来自由式(a)表示的化合物系列的6,13-双-三异丙基甲硅烷基乙炔基并五苯以1重量%总固体含量配制于萘满中。根据上文关于pen基材所显示的方法将此制剂涂布为otft装置中的osc层,不同之处在于osc在750rpm下涂布60秒。
此制剂的tft性能显示于下表(iii)中:
比较实施例(iv):无半导体粘合剂的2,8-二氟-5,11-三乙基甲硅烷基乙炔基双噻吩蒽(anthradithiophene)(dif-tesadt);tgotft
将来自由式(c)表示的化合物系列((c1)异构体与c2异构体的混合物)的2,8-二氟-5,11-三乙基甲硅烷基乙炔基双噻吩蒽以2重量%总固体含量配制于萘满中。根据上文关于pen基材所显示的方法将此制剂涂布为otft装置中的osc层,不同之处在于osc在750rpm下涂布60秒。
此制剂的tft性能显示于下表(iv)中:
实施例(1):合成2-氰基-ptaa聚合物(1)
1(a)合成2-氰基单体
将250mln-甲基吡咯烷酮(gpr级,sigmaaldrich)装入装配有磁性搅拌器、温度计、冷凝器及氩气入口的500毫升(ml)3颈圆底烧瓶,接着脱气15分钟。将24.2克(g)2-氟苯甲腈(fluorochem)、23.8g双(4-氯苯基)胺(实施例3)及30.4g氟化铯(alfa-aesar)添加至容器中且加热至175℃保持18小时,随后冷却至室温。将混合物倾入水(1800ml)中,用甲苯萃取。将有机相干燥(硫酸镁)(mgso4)且浓缩得到棕色固体。将此物质在甲醇中浆化以产生棕褐色固体,通过自甲醇中再结晶和炭来进一步纯化产生呈棕褐色固体状的产物。产量:21g。1hnmr(400mhz,cdcl3):δ7.6(1h,m,arh),7.5(1h,m,arh),7.3-7.15(6h,m,arh),6.9(4h,m,arh)。
合成2-氰基-ptaa均聚物
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器(claisenadaptor)及隔膜入口。用氩气吹扫装置。将200ml无水n,n-二甲基乙酰胺(sigmaaldrich)经由套管针装入容器且用氩气脱气15分钟。将三苯基膦(7.78g,sigmaaldrich)、2,2'-联吡啶(368毫克(mg),sigmaaldrich)、锌(11.38g,alfaaesar)及氯化镍(ii)(253mg,sigmaaldrich)添加至容器中。将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将单体(19.95g)添加至容器中。添加无水甲苯(29ml,sigmaaldrich)且在70-80℃下搅拌反应物19小时,随后冷却至室温。反应物经硅藻土过滤,用n,n-二甲基乙酰胺(50ml)洗脱。将滤液逐滴添加至一份经搅拌的甲醇(1.5升(l))中。搅拌悬浮液1小时,通过真空过滤收集且用甲醇洗涤。将滤饼溶解于二氯甲烷(500ml)中且用1m氢氧化钠水溶液(250ml)洗涤,用水(3×250ml)洗涤3次,干燥(硫酸钠)(naso4)且浓缩得到橙色固体。通过将产物在50℃下溶解于120ml四氢呋喃中且用60ml甲苯稀释来制备此物质的溶液。将此溶液经硅胶过滤,用四氢呋喃:甲苯的2:1混合物(800ml)洗脱。浓缩合并的滤液得到黄色固体。将物质溶解于四氢呋喃(180ml)中且装入装配有磁性搅拌器及冷凝器的500ml圆底烧瓶。添加活性炭(1.8g)且将混合物加热至60℃保持35分钟。将混合物在布氏漏斗(buchnerfunnel)中经滤纸过滤,用四氢呋喃洗涤。碳筛选总共重复3次,将第3次处理物经玻璃烧结漏斗过滤。浓缩滤液得到橙黄色固体。制备此物质于四氢呋喃(100ml)中的溶液且逐滴添加至一份经搅拌的甲醇(400ml)中。搅拌悬浮液1小时,通过真空过滤收集,用甲醇洗涤且干燥至恒重以得到呈黄色固体状的产物。接着使用120mllc四氢呋喃及400ml甲醇重复此沉淀以得到呈黄色粉末状的产物。产量:12.72g。mn=2514g/mol。n=9.4。多分散性=2.0。
聚合物(1)的介电常数为3.8。
制剂1(a)
在这些实施例中,聚合物与半导体的比率是以重量份计。
将聚合物1与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以4:1比率以2重量%总固体负载量配制于萘满中且根据上文关于pen基材装置显示的方法涂布为otft装置中的osc层。
此制剂的tft性能显示于下表2(a)中:
制剂1(b)
将聚合物1与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以2:1比率以2重量%总固体负载量配制于溴苯中且根据上文关于玻璃基材装置显示的方法涂布为otft装置中的osc层。
此制剂的tft性能显示于下表2(b)中
应注意,对制剂1(a)及1(b)的研究为使用这些新颖制剂及方法进行的首次研究且因此应指出,其可靠性低于随后在较多经验优势下进行的研究。
实施例1c
将聚合物1与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:1比率以1重量%总固体含量配制于溴苯中。根据上文关于pen基材显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒。
此制剂的tft性能显示于下表2c中:
实施例(2):合成2,4-二甲氧基-ptaa聚合物(2)
2(a):合成2,4-二甲氧基-ptaa单体
将875ml甲苯装入装配有磁性搅拌器、温度计、氩气入口及冷凝器的2升(l)3颈圆底烧瓶,脱气15分钟。将5.12g乙酸钯(ii)(preciousmetalsonline)及13.19g4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(alfa-aesar)装入容器。将混合物在搅拌下加热至50℃且一旦内部温度达到50℃,即冷却至室温。在室温下搅拌混合物1小时。添加2,4-二甲氧基苯胺(35g,alfa-aesar)、4-氯碘苯(119.70g,apolloscientific)及叔丁醇钠(48.25g,alfa-aesar)且将反应物加热至95℃保持18小时。将反应物冷却至室温且经二氧化硅垫过滤。浓缩滤液得到棕色固体。使此物质自异丙醇/丙酮中再结晶。冷却后,通过真空过滤收集固体且用冷异丙醇/丙酮洗涤3次。使固体进一步自二氯甲烷/甲醇中再结晶以得到呈棕色固体状的产物。产量:30.95g。1hnmr(300mhz,cdcl3):δ7.1(4h,m,arh),6.8(4h,m,arh)3.8(3h,s,arome),3.6(3h,s,arome)。
合成2,4-二甲氧基-ptaa聚合物(2)
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。将150ml无水n,n-二甲基乙酰胺(sigmaaldrich)经由套管针装入容器且用氩气脱气15分钟。将三苯基膦(5.36g,sigmaaldrich)、2,2'-联吡啶(250mg,sigmaaldrich)、锌(8.1g,alfa-aesar)及氯化镍(ii)(150mg,sigmaaldrich)添加至容器中且将内含物加热至70-80℃。溶液变为红棕色且向混合物中添加少量碘晶体。在此温度下搅拌反应物1小时,随后添加单体(15g)及无水甲苯(24ml,sigmaaldrich)。在70-80℃下搅拌反应物19小时。使反应物冷却至室温且经硅藻土垫过滤,用n,n-二甲基乙酰胺洗脱。将滤液逐滴添加至一份经搅拌的甲醇(1250ml)中。搅拌悬浮液1小时,随后通过真空过滤收集。将固体溶解于二氯甲烷(250ml)中且用1m盐酸水溶液(200ml)、水(2×200ml)洗涤,干燥(硫酸钠)且浓缩得到橙黄色固体。将此物质溶解于四氢呋喃(200ml)中且经硅胶过滤,用四氢呋喃洗脱。合并滤液且浓缩得到橙色固体。将该物质溶解于四氢呋喃(250ml)中且装入装配有磁性搅拌器及冷凝器的500ml圆底烧瓶。添加活性炭(1.14g)且将混合物加热至60℃保持30分钟。将混合物在布氏漏斗中经滤纸过滤且用四氢呋喃洗涤。碳筛选总共重复3次,将第3次处理物经玻璃烧结漏斗过滤。浓缩滤液得到橙黄色固体。将此物质于四氢呋喃(64ml)中的溶液逐滴添加至一份经搅拌的甲醇(320ml)中。搅拌悬浮液45分钟,随后通过真空过滤收集,用甲醇洗涤且干燥。使用四氢呋喃(95ml)及甲醇(475ml)重复此沉淀程序以得到黄色固体。接着在甲醇(350ml)中搅拌此固体2小时且过滤。使用四氢呋喃(60ml)及甲醇(300ml)进行最终沉淀,在干燥后得到呈黄色固体状的产物。产量:6.3g。mn=3471g/mol。n=11.5。多分散性=2.6。
聚合物(2)的介电常数为3.9。
实施例2a
将聚合物2与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以2:1比率以2重量%总固体负载量配制于溴苯中且根据上文关于玻璃基材装置显示的方法涂布为otft装置中的osc层。
此制剂的tft性能显示于下表3(a)中:
实施例2b
将聚合物2与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以2:1比率以2重量%总固体含量配制于溴苯中。根据上文关于pen基材装置显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于在硫醇处理前使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒。
此制剂的tft性能显示于下表3(b)中:
实施例2c
将聚合物2与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以2:1比率以2重量%总固体含量配制于溴苯中。根据上文关于pen基材装置显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于用于功函数改变的硫醇为4-氟硫酚且使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒。
此制剂的tft性能显示于下表3(c)中:
实施例2d
通过以下方法制备底门极晶体管。
将聚合物2与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:2比率以1重量%总固体含量配制于溴苯中。根据上文关于具有su8门极介电质的底门极、底接触otft装置显示的方法将此聚合物涂布为osc层。
此制剂的tft性能显示于下表3(d)中:
实施例2e
将聚合物2与来自由式(a)表示的化合物系列的6,13-三异丙基甲硅烷基乙炔基并五苯以1:1比率以1重量%总固体含量配制于溴苯中。根据上文关于pen基材显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于用于功函数改变的硫醇为4-氟硫酚且使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒。
此制剂的tft性能显示于下表3e中:
实施例3:合成4-异丙基氰基聚三芳基胺均聚物(3)
3(a):合成中间化合物,4-碘苯基乙腈
在氩气下,将1.22g碘化铜(sigmaaldrich)、25g4-溴苯基乙腈(apolloscientific)及38.37g碘化钠(sigmaaldrich)装入装配有磁性搅拌器的圆底烧瓶。将圆底烧瓶抽空且回填氩气3次。添加n,n'-二甲基乙二胺(1.38ml,sigmaaldrich)及25ml二噁烷且将混合物加热至110℃保持2小时(h)。使反应物冷却至室温(rt)且添加125ml30%氨水。接着将混合物倾于500ml水上且用二氯甲烷(dcm)萃取3次且合并的有机物经mgso4干燥。在减压下移除溶剂以得到呈棕色油状的标题化合物,其在静置时固化。产量:29.97g。1hnmr(400mhz,cdcl3),δ7.71(2h,d,ar-h),7.08(2h,d,ar-h),3.66(2h,s,ch2)。
3(b):合成中间化合物,2-(4-碘苯基)-2-甲基丙腈
在氩气下,将含15.82g叔丁醇钠(alfa-aesar)的25ml四氢呋喃(thf,univar)装入装配有温度计、氩气入口及搅拌棒的三颈圆底烧瓶且冷却至0℃。接着添加n-甲基吡咯烷酮(nmp)(25ml)。制备10g4-碘苯基乙腈及10.2ml碘甲烷(sigmaaldrich)于22mlthf:nmp(1:1,体积:体积(v/v))中的溶液且将此溶液以保持温度低于10℃的速率添加至冷却的反应混合物中。添加完成后,使反应物升温至室温且搅拌2小时。相继添加3m盐酸水溶液(hcl)(120ml)及120ml甲苯,分离各相且用120ml甲苯萃取水层2次以上。合并的有机层用饱和碳酸氢钠水溶液(120ml)、盐水(120ml)、硫代硫酸钠水溶液(120ml)洗涤且经mgso4干燥。在减压下移除溶剂得到呈棕色油状的粗产物。通过柱色谱法在乙酸乙酯/庚烷混合物中纯化得到呈淡黄色油状的标题化合物。产量:4.55g。1hnmr(400mhz,cdcl3),δ7.71(2h,d,ar-h),7.23(2h,d,ar-h),1.70(6h,s,ch3)。
3(c):合成中间化合物,双(4-氯苯基)胺
将6.6l无水甲苯(sigmaaldrich)装入装配有顶置式搅拌器、温度探针、氩气入口及冷凝器的10l夹套式容器,接着脱气15分钟。将7.46g乙酸钯(ii)(preciousmetalsonline)及20.64g外消旋2,2'-双(二苯基膦基)-1,1'-联萘(alfa-aesar)添加至容器中,且将内含物在搅拌下加热至50℃,一旦内部温度达到50℃即冷却至室温且搅拌1小时。将4-氯苯胺(443.98g,alfa-aesar)、4-氯碘苯(794.49g,apolloscientific)及叔丁醇钠(318.63g,alfa-aesar)装入容器且将内含物加热至回流保持2小时,此后hplc分析表明无起始物质剩余。使反应物冷却至室温且相继用水(3.3l)、2m盐酸水溶液(3.3l)、水(3.3l)及盐水(3.3l)洗涤。干燥(硫酸钠)有机相且浓缩得到棕色固体。此固体于6:1甲醇:水(总体积6.53l)中再结晶以得到呈浅棕色固体状的产物。产量:362g。1hnmr(400mhz,cdcl3):δ7.22-7.20(4h,m,arh),6.96-6.94(4h,m,arh),5.62(1h,s,ar2nh)。
3(d):合成2-(4-(双(4-氯苯基)氨基)苯基)-2-甲基丙腈;也称为4-异丙基氰基-ptaa单体
将乙酸钯(261mg,preciousmetalsonline)及(+/-)2,2'-双(二苯基膦基)-1,1'-联萘(723mg,alfa-aesar)添加至400ml脱气的甲苯中,接着在氩气下经30分钟加热至45℃。冷却溶液且经10分钟添加2-(4-碘苯基)-2-甲基丙腈(28.6g)、双-(4-氯苯基)胺(25.12g)及叔丁醇钠(11.15g)。添加完成后,将反应混合物加热至回流保持20小时。冷却反应混合物,经二氧化硅塞过滤且在减压下移除溶剂。通过柱色谱法使用etoac/庚烷混合物进行纯化得到呈黄色固体状的产物。接着将产物于甲醇(150ml)中回流且趁热过滤得到乳白色固体。还自滤液收集固体且使合并的固体自57ml工业用甲醇变性酒精(ims):etoac(1:2,v/v)中再结晶,过滤且用ims(30ml)洗涤得到乳白色固体。产量:10.5g。1hnmr(400mhz,cdcl3)δ7.31(2h,d,ar-h),7.21(4h,d,ar-h),6.97-7.02(6h,m,ar-h),1.71(6h,s,2×ch3)。
合成4-异丙基氰基-ptaa均聚物(3)
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。将150ml无水n,n-二甲基乙酰胺(sigmaaldrich)经由套管针装入容器且用氩气脱气15分钟。将三苯基膦(3.53g,sigmaaldrich)、2,2'-联吡啶(169mg,sigmaaldrich)、锌(5.37g,alfa-aesar)及氯化镍(ii)(99mg,sigmaaldrich)添加至容器中且将内含物加热至70-80℃。溶液变为红棕色且向混合物中添加少量碘晶体。在此温度下搅拌反应物1小时,随后添加单体(10.8g)及无水甲苯(18ml,sigmaaldrich)。在70-80℃下搅拌反应物18小时。使反应物冷却至室温,引起混合物缓慢胶凝。一旦处于室温下,混合物即完全胶凝。过滤此物质,且将收集的固体溶解于二氯甲烷(500ml)中且经硅藻土过滤,用二氯甲烷(2×500ml)洗脱。浓缩滤液得到潮湿残余物,将其在甲醇(500ml)中捣碎且过滤得到黄色固体。在超声处理下将此固体溶解于二氯甲烷(500ml)中且用1m氢氧化钠水溶液(250ml)及水(3×250ml)洗涤,随后干燥(硫酸钠)且浓缩得到黄色固体。制备此物质于二氯甲烷(100ml)中的溶液(需要扩展超声处理)且经二氧化硅垫过滤,用二氯甲烷洗脱。浓缩滤液得到黄色固体。将此物质溶解于二氯甲烷(50ml)中(需要扩展超声处理)且缓慢添加至一份经搅拌的甲醇(250ml)中。搅拌悬浮液2小时,随后进行过滤,用滤液及甲醇洗涤且干燥至恒重以得到呈黄色固体状的产物。产量:3.11g。
聚合物(3)的介电常数为5.9。
实施例4:聚合物(4),50:504-异丙基氰基-ptaa:2,4-二甲基-ptaa共聚物
合成2,4-二甲基ptaa单体
将4.5l甲苯装入装配有顶置式搅拌器、温度探针、氩气入口及冷凝器的10l夹套式容器,脱气15分钟。将5.56g乙酸钯(ii)(preciousmetalsonline)及15.47g外消旋2,2'-双(二苯基膦基)-1,1'-联萘(alfa-aesar)装入容器。将混合物在搅拌下加热至50℃且一旦内部温度达到50℃,即冷却至室温。在室温下搅拌混合物1小时。添加2,4-二甲基苯胺(300.03g,alfa-aesar)、4-氯碘苯(1306.51g,apolloscientific)及叔丁醇钠(523.87g,alfa-aesar)且在回流下加热反应物24小时,此后hplc分析表明完全反应。使反应物冷却至室温且用水(2×4l)洗涤2次且有机相经硅藻土过滤,得到第二分离物(split),分离该第二分离物。接着浓缩有机物得到棕色固体(935.5g)。将838.46g此物质在装配有顶置式搅拌器、温度探针、氩气入口及冷凝器的6l夹套式容器中自3:1工业用甲醇变性酒精(ims):乙酸乙酯(4450ml)中再结晶。使悬浮液冷却至0℃保持1小时,接着通过真空过滤收集固体且用冷的3:1ims:乙酸乙酯(3×840ml)洗涤3次。将固体干燥过夜得到呈灰色固体状的产物。产量:699g。1hnmr(300mhz,cdcl3):δ7.16-6.86(11h,m,arh),2.35(3h,s,arme),1.99(3h,s,arme)。
合成50:502,4-二甲基:4-异丙基氰基ptaa共聚物(4)
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。将200ml无水n,n-二甲基乙酰胺(sigmaaldrich)经由套管针装入容器且用氩气脱气15分钟。将三苯基膦(6.5g,sigmaaldrich)、2,2'-联吡啶(0.29g,sigmaaldrich)、锌(9.52g,alfa-aesar)及氯化镍(ii)(0.19g,sigmaaldrich)添加至容器中。将内含物加热至70-80℃。添加少量碘晶体以促进催化剂形成,溶液变为红棕色。在此温度下再搅拌混合物1小时。将2,4-二甲基单体(8.12g)及4-异丙基氰基单体(9g)添加至容器中,接着添加无水甲苯(27.5ml,sigmaaldrich)。在70-80℃下搅拌反应物20小时,随后冷却至室温。通过真空过滤收集固体且在50℃下再溶解于甲苯中。冷却混合物且通过过滤移除过量锌。滤液用1m氢氧化钠水溶液(250ml)、水(250ml)及10%氯化钠水溶液(250ml)洗涤,随后干燥(硫酸钠)且浓缩得到黄色固体。将此物质溶解于甲苯(100ml)中且经二氧化硅过滤,用甲苯洗脱。浓缩滤液得到黄色固体。将该物质溶解于甲苯(250ml)中且装入装配有磁性搅拌器及冷凝器的500ml圆底烧瓶。添加活性炭(0.4g)且将混合物加热至50℃保持30分钟。将混合物在布氏漏斗中经滤纸过滤且用甲苯洗涤。碳筛选总共重复3次,将第3次处理物经玻璃烧结漏斗过滤。浓缩滤液得到黄色固体。制备此物质于四氢呋喃(80ml)中的溶液,将其逐滴添加至一份经搅拌的甲醇(400ml)中。搅拌所得悬浮液1小时,随后通过真空过滤收集,用甲醇洗涤且干燥至恒重以得到呈黄色粉末状的产物。产量:2.6g。mn=15091g/mol。n=26。多分散性=1.2。
聚合物(4)的介电常数为4.1。
实施例4a
将聚合物4与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以4:1比率以2重量%总固体含量配制于萘满中。根据上文关于pen基材装置显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于在硫醇处理前使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用10sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒。
此制剂的otft性能显示于下表5(a)中:
实施例4b
将聚合物4与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以4:1比率以2重量%总固体负载量配制于萘满中且根据上文关于玻璃/su8基材装置显示的方法涂布为otft装置中的osc层。
此制剂的otft性能显示于下表5(b)中:
实施例4(c)
将聚合物4与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:1比率以0.5重量%总固体含量配制于萘满中且以喷墨印刷方式喷射至排形图案中形成osc层,尺寸为100μm×100μm。所测量的晶体管的通道宽度及长度为100μm及7μm。
此制剂的otft性能显示于下表5(c)中:
实施例4(d)
将聚合物4与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:2比率以1重量%总固体含量配制于萘满中。根据上文关于具有su8门极介电质的底门极、底接触otft装置显示的方法将此聚合物涂布为osc层,不同之处在于用于改变功函数的sam为ipa中的10mm五氟苯硫酚且在osc涂布前不进行表面等离子体处理。
此制剂的tft性能显示于下表5(d)中:
实施例(5):聚合物(5)30:704-异丙基氰基-ptaa:2,4-二甲基ptaa共聚物
5(a):合成4-碘苯基乙腈
将氰化钾(33.23g,sigma-aldrich)及4-碘苄基溴(101g,apolloscientific)于3:1ims/水(1l)中的混合物加热至回流保持2小时,接着冷却至室温。在真空中移除有机物且水性物质用etoac(2×750ml)萃取。合并的有机物用盐水(300ml)洗涤,干燥(硫酸镁)且在真空中浓缩得到呈油状的产物,其在静置时固化。产量:78.4g。1hnmr(400mhz,cdcl3):δ7.71(2h,d,arh),7.08(2h,d,arh)3.66(2h,s,arch2cn)。
5(b):合成2-(4-碘苯基)-2-甲基丙腈
在氩气下,将nmp(197ml,sigma-aldrich)添加至叔丁醇钠(124.0g,alfa-aesar)于thf(197ml,univar)中的悬浮液中。使混合物冷却至0℃且逐滴添加碘甲烷(87.9ml,sigma-aldrich)及4-碘苯基乙腈(78.4g)于nmp/thf的50:50混合物(173ml)中的溶液中同时保持内部温度低于10℃。使混合物升温至室温且搅拌过夜。添加2mhcl(930ml)及甲苯(930ml),接着分离水层且用甲苯(2×465ml)萃取。合并的有机物用饱和碳酸氢钠(930ml)、盐水(930ml)、2m硫代硫酸钠(930ml)洗涤,干燥(硫酸镁)且在真空中浓缩得到黄色/橙色固体。通过柱色谱法用etoac/庚烷混合物洗脱进行纯化得到呈淡黄色油状的标题化合物。产量:4.55g,1hnmr(400mhz,cdcl3):δ7.71(2h,d,ar-h),7.23(2h,d,ar-h),1.70(6h,s,ch3)。
5(c):2-(4-(双(4-氯苯基)氨基)苯基)-2-甲基丙腈:4-异丙基-氰基-ptaa单体
将乙酸钯(261mg,preciousmetalsonline)及(±)2,2'-双(二苯基膦基)-1,1'-联萘(binap)(723mg,alfa-aesar)添加至400ml脱气的甲苯中,接着在氩气下经30分钟加热至45℃。冷却溶液且经10分钟添加2-(4-碘苯基)-2-甲基丙腈(28.6g)、双-(4-氯苯基)胺(25.12g)及叔丁醇钠(11.15g)。添加完成后,将反应混合物加热至回流保持20小时。冷却反应混合物,经二氧化硅塞过滤且在减压下移除溶剂。通过柱色谱法使用etoac/庚烷混合物进行纯化得到呈黄色固体状的产物。接着将产物于甲醇(150ml)中回流且趁热过滤得到乳白色固体。还自滤液收集固体且使合并的固体自乙腈中再结晶,用乙腈(×2)洗涤固体。产量:10.5g。1hnmr(400mhz,cdcl3)δ7.31(2h,d,ar-h),7.21(4h,d,ar-h),6.97-7.02(6h,m,ar-h),1.71(6h,s,2×ch3)。
合成30:704-异丙基氰基-ptaa:2,4-二甲基ptaa共聚物
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。装入n,n-二甲基乙酰胺(278.5ml,sigmaaldrich)且脱气15分钟。将三苯基膦(10.74g,aldrich)、2,2'-联吡啶(500mg,sigmaaldrich)、锌(15.85g,alfa-aesar)及氯化镍(ii)(300mg,aldrich)添加至容器中。将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将2,4-二甲基(18.87g)及4-异丙基氰基(8.99g)单体添加至容器中。添加无水甲苯(45ml,sigmaaldrich)。在70-80℃下搅拌反应物19小时,随后冷却至室温。过滤反应物,用n,n-二甲基乙酰胺洗涤固体。将滤饼溶解于甲苯(500ml)中且经硅藻土过滤。滤液用1m氢氧化钠溶液(250ml)、水(250ml)及10%氯化钠溶液(250ml)洗涤,干燥(硫酸钠)且浓缩得到黄色固体。将此物质溶解于甲苯(250ml)中且经二氧化硅过滤,用甲苯洗脱。还用四氢呋喃冲洗二氧化硅以自二氧化硅垫移除所有产物。合并产物部分且浓缩得到黄色固体(14.5g)。将此物质溶解于甲苯(500ml)中且用炭处理。接着浓缩滤液得到黄色固体。将此物质溶解于四氢呋喃(80ml)中且在搅拌下逐滴添加至甲醇(400ml)中。搅拌1小时后,通过过滤收集所得悬浮液得到淡黄色粉末。产量:9.9g。mn=9694g/mol。n=34。多分散性=1.9。
聚合物(5)的介电常数为3.7。
实施例5(a)
将聚合物5与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以2:1比率以1.2重量%总固体含量配制于萘满中。根据上文关于pen基材装置显示的方法将此聚合物涂布为otft装置中的osc层。
此制剂的otft性能显示于下表6(a)中:
实施例5(b)
将聚合物5与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:1比率以0.5重量%总固体含量配制于萘满中且以喷墨印刷方式喷射至排形图案中形成osc层,尺寸为100μm×100μm。所测量的晶体管的通道宽度及长度为100μm及7μm。
此制剂的otft性能显示于下表6(b)中:
实施例5(c)
将聚合物5与来自由式(a)表示的化合物系列的6,13-双-三异丙基甲硅烷基乙炔基并五苯以1:1比率以4重量%总固体含量配制于萘满中。根据上文关于pen基材显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒且osc在2000rpm下涂布。
此制剂的tft性能显示于下表6(c)中:
实施例5(d)
将聚合物5与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:2比率以1重量%总固体含量配制于萘满中。根据上文关于具有su8门极介电质的底门极、底接触otft装置显示的方法将此聚合物涂布为osc层,不同之处在于用于改变功函数的sam为ipa中的10mm五氟苯硫酚。
此制剂的tft性能显示于下表6(d)中:
实施例6:聚合物(6),2,4-二甲氧基苯基-ptaa均聚物
合成2,4-二甲氧基苯基单体
在氩气下,将四(三苯基膦)钯(0)(pd(pph3)4)(6.62g,peakdalemolecular)添加至4-溴-n,n-双(4-氯苯基)苯胺(实施例7a(i))(75g)、2,4-二甲氧基硼酸(38.2g,alfa-aesar)及碳酸钠(64.7g)于四氢呋喃(1120ml)及h2o(750ml)中的混合物中且将混合物加热至回流过夜。分离有机物,水层用乙酸乙酯(×2)萃取且干燥合并的有机物且浓缩得到黑色固体。使固体吸附于二氧化硅上且用乙酸乙酯/庚烷混合物进行柱洗脱以得到绿色/棕色固体。添加甲醇且搅拌混合物20分钟,接着过滤且用甲醇(×2)洗涤。添加甲醇,将混合物加热至40℃且逐份添加二氯甲烷直至所有固体溶解。搅拌溶液10分钟,在冰浴中冷却1小时,接着过滤固体,用50:50甲醇/二氯甲烷(×2)洗涤且干燥得到呈浅绿色/棕色固体状的产物。产量:40.8g。1hnmr(400mhz,cdcl3):δ7.40(2h,d,arh),7.19-7.25(5h,m,arh),7.00-7.05(6h,m,arh),6.55(2h,m,arh),3.84(3h,s,ome),3.81(3h,s,ome)。
合成2,4-二甲氧基苯基-ptaa聚合物
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。装入n,n-二甲基乙酰胺(150ml,sigmaaldrich)且脱气15分钟。将三苯基膦(4.54g,sigmaaldrich)、2,2'-联吡啶(210mg,sigma-aldrich)、锌(6.71g,alfa-aesar)及氯化镍(ii)(130mg,sigmaaldrich)添加至容器中且将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将单体(15g)及无水甲苯(24ml,sigma-aldrich)相继添加至容器中。搅拌反应物15小时,随后冷却至室温。过滤反应物,用n,n-二甲基乙酰胺洗涤固体。将滤饼溶解于二氯甲烷(500ml)中且经硅藻土过滤。滤液用1m盐酸(250ml)、水(250ml)及10%盐水溶液(250ml)洗涤,干燥(硫酸钠)且浓缩得到黄色固体。将此物质溶解于二氯甲烷(500ml)中且经二氧化硅过滤,用二氯甲烷洗脱。合并产物部分且浓缩得到黄色固体。将此物质溶解于氯仿(250ml)中且用炭处理。接着浓缩滤液得到黄色固体。将此物质溶解于氯仿(150ml)中且逐滴添加至一份经搅拌的甲醇(750ml)中。搅拌所得悬浮液1小时,随后通过过滤进行收集得到淡黄色粉末。产量:6.67g。mn=3368g/mol。n=8.8。多分散性=2.4。
聚合物(6)的介电常数为3.5。
实施例7:聚合物(7),50:504-异丙基氰基苯基-ptaa:2,4-二甲基ptaa共聚物
7(a):合成4-异丙基氰基丙基-ptaa单体
(i)4-溴-n,n-双(4-氯苯基)苯胺
用氩气吹扫装配有冷凝器、温度计及氩气入口的5l三颈平底烧瓶。接着将甲苯(1.4l)、双(4-氯苯基)胺、实施例3(c)的化合物(40g)、4-溴碘苯(52.3g,apolloscientific)、三(二亚苄基丙酮)二钯(0)pd2-(dba)3)(461mg,acros)、(±)-2,2'-双(二苯基膦基)-1,1'-联萘(1.05g,alfa-aesar)及叔丁醇钠(35.5g,alfa-aesar)装入烧瓶中。将所得黑色溶液加热至100℃保持48小时,接着冷却且经硅藻土垫过滤,用甲苯洗涤。浓缩滤液至约一半体积,随后用水(1l)、饱和盐水(1l)洗涤,经mgso4干燥且浓缩为绿色油状物。通过干式快速柱色谱法用乙酸乙酯/庚烷混合物洗脱,接着自乙腈中再结晶来进行纯化,得到目标化合物。产量:32g,灰白色固体。1hnmr(400mhz,cdcl3):δ7.35(2h,m,ar-h),7.20(4h,m,ar-h),6.98(4h,m,ar-h),6.92(2h,m,ar-h)。
(ii)4-(双(4-氯苯基)氨基)苯基)硼酸
在三颈圆底烧瓶上装配温度计、氩气入口及压力平衡滴液漏斗。将无水2-甲基四氢呋喃(1.1l)及4-溴-n,n-双(4-氯苯基)苯胺(60.9g)装入烧瓶中,随后冷却至-78℃。逐滴添加正丁基锂(于己烷中的1.95m溶液,95.4ml)且在-78℃下搅拌溶液1小时。接着经由注射器逐滴添加硼酸三甲酯(26ml,sigma-aldrich)且在-78℃下搅拌反应物1.5小时,接着升温至室温过夜。将1m盐酸(630ml)逐份添加至反应混合物中,分离各层且有机物用水(600ml)、盐水(600ml)洗涤,经mgso4干燥且浓缩得到淡黄色固体。将固体于庚烷中浆化且在室温下搅拌1小时。滤出固体且用庚烷洗涤,随后在真空下干燥得到淡黄色粉末。产量:39.3g。1hnmr(400mhz,cdcl3):δ8.02(2h,m,ar-h),7.27(4h,m,ar-h),7.05(6h,m,ar-h)。
(iii)2-(4'-(双(4-氯苯基)氨基)-[1,1'-联苯]-4-基)-2-甲基丙腈
将(4-(双(4-氯苯基)氨基)苯基)硼酸(39.3g)、2-(4-碘苯基)-2-甲基丙腈、来自实施例5(c)的化合物(27.1g)及四氢呋喃(591ml)装入装配有氩气入口及冷凝器的2l平底烧瓶中。将碳酸钠(33.9g)溶解于水(393ml)中且将其添加至四氢呋喃混合物中。接着将反应混合物加热至75℃保持16小时。添加乙酸乙酯(200ml)及水(200ml)且将混合物经硅藻土垫过滤。分离各层,有机层用盐水(600ml)洗涤,经mgso4干燥且浓缩。通过快速柱色谱法用乙酸乙酯/庚烷混合物洗脱纯化所得物质。将部分浓缩成稠浆料且滤出固体,用庚烷洗涤且在真空下干燥得到灰白色固体。产量:27g。1hnmr(400mhz,cdcl3):δ7.56-7.42(6h,m,ar-h),7.21(4h,m,ar-h),7.15-7.02(6h,m,ar-h),1.77(6h,s,ch3)。
异丙基氰基苯基-ptaa:2,4-二甲基-ptaa50:50共聚物
在250ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。装入n,n-二甲基乙酰胺(128ml,sigmaaldrich)且脱气15分钟。将三苯基膦(4.17g,sigmaaldrich)、2,2'-联吡啶(191mg,sigma-aldrich)、锌(6.16g,alfa-aesar)及氯化镍(ii)(120mg,sigmaaldrich)添加至容器中。将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将2,4-二甲基单体(5.8g)及2-(4'-(双(4-氯苯基)氨基)-[1,1'-联苯]-4-基)-2-甲基丙腈(7.0g)添加至反应物中,接着添加无水甲苯(21ml,sigmaaldrich)且在此温度下搅拌反应物16小时。冷却反应物且滤出固体,用n,n-二甲基乙酰胺洗涤。添加甲苯(600ml)且将混合物加热至50℃,接着经硅藻土垫过滤。将剩余固体溶解于二氯甲烷(500ml)中,升温至40℃,接着经硅藻土垫过滤。将甲苯滤液浓缩成黏性固体,添加二氯甲烷(500ml)且与先前二氯甲烷滤液合并。合并的有机物用1m氢氧化钠水溶液(800ml)、水(800ml)、10%盐水(800ml)洗涤,经mgso4干燥且浓缩。将所得固体溶解于二氯甲烷(250ml)中且通过二氧化硅垫,用二氯甲烷洗涤。将合并的部分浓缩为固体,将其溶解于四氢呋喃(400ml)中且用炭处理且浓缩得到黄色固体。将固体溶解于四氢呋喃(100ml)中且逐滴添加至甲醇(500ml)中,过滤且在真空下干燥得到目标化合物。产量:4.85g。mn=7139g/mol。n=10.8。多分散性=1.6。
聚合物(7)的介电常数为4.0。
实施例7(a)
将聚合物7与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:2比率以1.2重量%总固体含量配制于溴苯中。根据上文关于pen基材装置显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒且osc涂布转速为2000rpm,60秒。
此制剂的tft性能显示于下表8(a)中:
实施例7(b)
将聚合物7与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以1:2比率以1重量%总固体含量配制于萘满中。根据上文关于具有su8门极介电质的底门极、底接触otft装置显示的方法将此聚合物涂布为osc层,不同之处在于用于改变功函数的sam为ipa中的10mm五氟苯硫酚。
此制剂的tft性能显示于下表8(d)中:
实施例8:聚合物(8),4-环己基氰基-ptaa均聚物
合成4-环己基氰基ptaa寡聚物
1-(4-碘苯基)环己烷甲腈
在氩气下,将n-甲基吡咯烷酮(nmp)(197ml,sigma-aldrich)添加至叔丁醇钠(124.0g,alfa-aesar)于四氢呋喃(thf)(197ml,univar)中的悬浮液中。使混合物冷却至0℃且逐滴添加1,5-二溴戊烷(87.9ml,sigma-aldrich)及4-碘苯基乙腈(78.4g)于nmp/thf的50:50混合物(173ml)中的溶液中同时保持内部温度低于10℃。使混合物升温至室温且搅拌过夜。添加2m盐酸(930ml)及甲苯(930ml),接着分离水层且用甲苯(2×465ml)萃取。合并的有机物用饱和碳酸氢钠(930ml)、盐水(930ml)、2m硫代硫酸钠(930ml)洗涤,干燥(硫酸镁)且在真空中浓缩得到黄色/橙色固体。添加二氯甲烷且过滤固体且用二氯甲烷洗涤得到呈白色固体状的产物。产量:22.55g。1hnmr(400mhz,cdcl3):δ7.70-7.72(2h,m,arh),7.22-7.25(2h,m,arh),2.10-2.13(2h,m,-ch2-),1.67-1.89(7h,m,-ch-),1.22-1.32(1h,m,-ch-)。
1-(4-(双(4-氯苯基)氨基)苯基)环己烷甲腈-4-环己基-氰基ptaa单体
将乙酸钯(179mg)及(±)-2,2'-双(二苯基膦基)-1,1'-联萘(496mg)于甲苯(338ml)中的溶液加热至50℃,接着冷却至室温。添加1-(4-碘苯基)环己烷甲腈(22.55g)、双(4-氯苯基)胺(17.26g)及叔丁醇钠(7.66g)且加热混合物至回流过夜。使混合物冷却至室温,经二氧化硅垫过滤,接着在真空中浓缩得到油状物。通过柱色谱法用乙酸乙酯/庚烷混合物洗脱,接着自ipa中再结晶来进行纯化,得到呈白色固体状的产物。产量:12.5g。1hnmr(400mhz,cdcl3):δ7.31-7.35(2h,m,arh),7.19-7.23(4h,m,arh),6.97-7.04(4h,m,arh),2.14-2.17(2h,m-ch2-),1.68-1.86(7h,m,-ch2-),1.20-1.32(1h,m,-ch-)。
合成4-环己基氰基ptaa寡聚物
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。装入n,n-二甲基乙酰胺(125ml,sigma-aldrich)且脱气15分钟。将三苯基膦(4.04g,sigma-aldrich)、2,2'-联吡啶(200mg,sigma-aldrich)、锌(6.00g,alfa-aesar)及氯化镍(ii)(120mg,sigma-aldrich)添加至容器中且将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将4-环己基氰基单体(12.5g)及无水甲苯(20ml,sigma-aldrich)相继添加至容器中且搅拌反应物19小时,随后冷却至室温。过滤反应物,用n,n-二甲基乙酰胺洗涤固体。将滤饼溶解于二氯甲烷(250ml)中且经硅藻土过滤。滤液用1m氢氧化钠(250ml)、水(250ml)及10%氯化钠溶液(250ml)洗涤,干燥(硫酸钠)且浓缩得到黄色固体。将此物质溶解于二氯甲烷(250ml)中且经二氧化硅过滤,用二氯甲烷洗脱。合并产物部分且浓缩得到灰白色固体(8g)。将固体溶解于氯仿(250ml)中且用炭处理3次(3×0.8g炭)。接着浓缩滤液得到灰白色固体。将此物质溶解于氯仿(125ml)中且逐滴添加至一份经搅拌的甲醇(625ml)中。搅拌所得悬浮液1小时,随后通过过滤收集得到灰白色粉末。产量:6.5g。由于不可溶性,未获得gpc数据。
聚合物(8)的介电常数为4.1。
实施例9:聚合物(9),30:70聚-9,9-二辛基芴:iprcn-taa共聚物
合成30:70聚-9,9-二辛基芴:iprcn-taa共聚物
2-(4-(二苯基氨基)苯基)-2-甲基丙腈
将乙酸钯(ii)(3.01g)及4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(7.76g,manchesterorganics)溶解于甲苯(550ml)中且使溶液脱气。添加二苯胺(22.7g,alfa-aesar)、叔丁醇钠(28.4g)及2-(4-碘苯基)-2-甲基丙腈(40g)且将溶液加热至90℃保持18小时。冷却反应物,经硅藻土垫过滤,用水、盐水洗涤,干燥(mgso4)且浓缩。通过快速柱色谱法用乙酸乙酯:庚烷混合物洗脱纯化残余物得到油状物。将庚烷添加至油状物中且过滤所得固体得到呈白色固体状的产物。产量:17.5g。1hnmr(400mhz,cdcl3);7.22-7.32(9h,m),7.00-7.10(6h,m),1.71(6h,s)。
2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈
将2-(4-(二苯基氨基)苯基)-2-甲基丙腈(7.5g)溶解于乙酸乙酯(128ml)中。逐份添加n-溴丁二酰亚胺(8.55g,apolloscientific),随后在室温下搅拌反应物18小时。反应混合物用水、碳酸钠、盐水洗涤,干燥(mgso4)且浓缩。将庚烷添加至残余物中且滤出所得固体得到呈灰色固体状的产物。产量:6.4g。1hnmr(400mhz,cdcl3);7.30(6h,m),7.04(2h,d),6.93(4h,d),1.71(6h,s)。
2-(4-(双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)氨基)苯基)-2-甲基丙腈-iprcntaa二硼酸酯单体
将含2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈(5g)、乙酸钾(3.65g,alfa-aesar)及双频哪醇合二硼(5.94g,allychem)的二噁烷(150ml)装入圆底烧瓶。用氩气使混合物脱气15分钟,接着添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(389mg,peakdale)且将反应混合物加热至100℃保持18小时。浓缩混合物且将残余物溶解于dcm中且经硅藻土垫过滤,用dcm洗涤。有机层用水、盐水洗涤,干燥(mgso4)且浓缩至二氧化硅上。通过干式快速柱色谱法用庚烷/乙酸乙酯混合物洗脱进行纯化得到白色固体,使其自thf/mecn中再结晶以得到呈白色固体状的目标化合物。产量:2.97g。1hnmr(400mhz,cdcl3);7.69(4h,m),7.31(2h,m)7.09(2h,m),7.04(4h,m),1.72(6h,s),1.32(24h,s)。
30:70聚-9,9-二辛基芴:iprcn-taa共聚物
将2,7-二溴-9,9-二辛基-9h-芴(1.69g,sigma-aldrich)、2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈(967mg)、2-(4-(双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)氨基)苯基)-2-甲基丙腈(2.90g)、磷酸钾(4.36g,alfa-aesar)及aliquat336(2滴,alfa-aesar)溶解于甲苯(22ml)、二噁烷(22ml)及水(11ml)的混合物中。使溶液脱气15分钟,随后添加三(二亚苄基丙酮)二钯(0)(24mg,acros)及三(邻甲苯基)膦(47mg,sigma-aldrich)且加热至90℃保持17小时。将反应混合物倾于甲醇(280ml)上且过滤所得沉淀物,溶解于甲苯(250ml)中,用1nnaoh、盐水、水洗涤,干燥(mgso4)且浓缩。将残余物溶解于甲苯(80ml)中且通过二氧化硅垫,用甲苯、甲苯/thf及thf洗涤。浓缩滤液且用炭处理(3×0.33g)。浓缩滤液且将固体溶解于thf(60ml)中且逐滴添加至甲醇(300ml)中。过滤固体得到呈黄色固体状的目标化合物。产量:2.46g。mn=9731g/mol,n=13.9,多分散性=1.8。
聚合物(9)的介电常数为4.6。
实施例9(a)
将聚合物9与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以2:1比率以1.2重量%总固体含量配制于萘满中。根据上文关于玻璃/su8基材装置显示的方法将此聚合物涂布为otft装置中的osc层,不同之处在于所用硫醇为4-氟硫酚且使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒。
此制剂的tft性能显示于下表10(a)中:
实施例10:聚合物(10),30:70聚-四辛基-茚并芴:4-iprcn-taa共聚物
30:70聚-四辛基-茚并芴:iprcn-taa共聚物
2',5'-二甲基-1,1':4',1″-三联苯
将1,4-二溴-2,5-二甲基苯(166.3g,sigma-aldrich)、苯基硼酸(157.25g,apolloscientific)、碳酸钾(401.2g,sigma-aldrich)、溴化四-正丁基铵(375.0g,alfa-aesar)及乙酸钯(ii)(2.74g)在水(1570ml)中混合在一起且加热至70℃保持18小时。反应物用水(1500ml)稀释,搅拌10分钟且通过真空过滤收集固体。固体用水(2×300ml)洗涤且干燥得到呈灰色固体状的产物。产量:180.9g。1hnmr(400mhz,cdcl3);7.39(10h,m),7.16(2h,s),2.28(6h,s)。
[1,1':4',1″-三联苯]-2',5'-二甲酸
将2',5'-二甲基-1,1':4',1″-三联苯(180.9g)溶解于吡啶(4296ml)中,添加水(405ml)且将反应混合物加热至90℃。小心添加高锰酸钾(kmno4)(516g,sigma-aldrich)且持续回流。每隔30分钟再添加kmno4(235g)及水(677ml),持续2小时。一旦完成添加,即持续回流18小时。将反应混合物经硅藻土垫趁热过滤,用沸水(3×2000ml)洗涤滤饼。浓缩滤液以移除大部分吡啶,随后用浓盐酸调节至约ph1。通过真空过滤收集固体,用水(2×1400ml)洗涤且干燥得到乳白色固体。接着将固体于乙酸乙酯(840ml)中回流,冷却,通过真空过滤收集且用乙酸乙酯(2×233ml)洗涤得到呈乳白色固体状的产物。产量:183.8g。
茚并[1,2-b]芴-6,12-二酮
将[1,1':4',1″-三联苯]-2',5'-二甲酸(183.85g)逐份添加至硫酸(1804ml,fisherscientific)中且搅拌2小时。将反应混合物倾于冰-水混合物(5900ml)上且搅拌10分钟。通过真空过滤收集固体且用水(2×831ml)洗涤。接着在甲醇(1663ml)中搅拌固体1小时,通过真空过滤收集固体,用水(2×831ml)洗涤且干燥得到呈紫色固体状的产物。产量:148.2g。1hnmr(400mhz,cdcl3);7.81(2h,m),7.68(2h,m),7.57(4h,m),7.34(2h,m)。
6,12-二氢茚并[1,2-b]芴
在氩气下将氢氧化钾(163.7g)、二乙二醇(1412ml,alfa-aesar)及茚并[1,2-b]芴-6,12-二酮(28.23g)装入合适容器。添加水合肼(152ml,alfa-aesar)且将反应物加热至170℃保持18小时。将反应混合物缓慢添加至冰(2kg)与浓盐酸(1l)的混合物中且搅拌所得浆料10分钟。通过真空过滤收集固体,用水(3×500ml)洗涤且干燥得到呈灰色固体状的产物。产量:24.49g。1hnmr(400mhz,cdcl3);7.95(2h,m),7.80(2h,m),7.54(2h,m),7.39(2h,m),7.30(2h,m)。
6,6,12,12-四辛基-6,12-二氢茚并[1,2-b]芴
将6,12-二氢茚并[1,2-b]芴(24.03g)溶解于dmso(372.4ml,sigma-aldrich)中且添加叔丁醇钠(56.18g),随后加热至80℃。逐滴添加辛基溴(110.6g,fluorochem)同时保持温度低于90℃。冷却反应物,溶解于庚烷(2400ml)中,用水(3×746ml)洗涤,干燥(na2so4)且浓缩得到黑色固体。将固体于甲醇(480ml)中回流10分钟,冷却至室温且通过真空过滤收集。固体用甲醇(2×480ml)洗涤且干燥得到呈黑色固体状的产物。产量:82.56g。1hnmr(400mhz,cdcl3);7.74(2h,m),7.60(2h,m),7.32(6h,m),2.00(8h,m),1.05(40h,m),0.80(12h,m),0.60(8h,m)。
2,8-二溴-6,6,12,12-四辛基-6,12-二氢茚并[1,2-b]芴
在氩气下,在合适容器中,将6,6,12,12-四辛基-6,12-二氢茚并[1,2-b]芴(60.24g)及碘(33.6mg,alfa-aesar)溶解于dcm(143ml)中。添加含碳酸钠(23.98g)的水(85.7ml)且使混合物冷却至-5℃。添加溴(32.04g,sigma-aldrich)于dcm(57ml)中的溶液同时保持温度低于5℃。接着使反应物升温至室温且搅拌16小时。混合物用dcm(285ml)稀释,用20%硫代硫酸钠(143ml)、水(2×143ml)洗涤,干燥(na2so4)且浓缩得到黄色固体。自丙酮中再结晶得到呈白色固体状的产物。产量:68.54g。1hnmr(400mhz,cdcl3);7.57(4h,m),7.47(4h,m),1.97(8h,m),1.09(40h,m),0.80(12h,m),0.60(8h,brm)。
2-(4-(双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)氨基)苯基)-2-甲基丙腈-iprcn-taa二硼酸酯单体
将含2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈(5g)、乙酸钾(3.65g)及双频哪醇合二硼(5.94g)的二噁烷(150ml)装入圆底烧瓶。用氩气使溶液脱气15分钟。添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(389mg)且将反应混合物加热至100℃保持18小时。浓缩混合物且将残余物溶解于dcm中且经硅藻土垫过滤,用dcm洗涤。有机层用水、盐水洗涤,干燥(mgso4)且浓缩至二氧化硅上。通过干式快速柱色谱法用庚烷/乙酸乙酯混合物洗脱进行纯化得到白色固体,使其自thf/mecn中再结晶以得到呈白色固体状的目标化合物。产量:2.84g。1hnmr(400mhz,cdcl3);7.69(4h,m),7.31(2h,m)7.09(2h,m),7.04(4h,m),1.72(6h,s),1.32(24h,s)。
30:70聚-四辛基茚并芴:iprcntaa共聚物
将2,8-二溴-6,6,12,12-四辛基-6,12-二氢茚并[1,2-b]芴(2.60g)、2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈(947mg)、2-(4-(双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)氨基)苯基)-2-甲基丙腈(2.84g)、磷酸钾(4.27g)及aliquat336(2滴)溶解于甲苯(32ml)、二噁烷(16ml)及水(16ml)的混合物中。使溶液脱气15分钟,随后添加三(二亚苄基丙酮)二钯(0)(23mg)及三(邻甲苯基)膦(46mg)且加热至90℃保持17小时。将反应混合物倾于甲醇(320ml)上且过滤所得沉淀物,溶解于甲苯(200ml)中,用1nnaoh、盐水、水洗涤,干燥(mgso4)且浓缩。将残余物溶解于甲苯(150ml)中且通过二氧化硅垫,用甲苯、甲苯/thf及thf彻底洗涤。浓缩滤液且用炭处理(3×0.53g)。浓缩滤液且将固体溶解于thf(70ml)中且逐滴添加至甲醇(350ml)中。过滤固体得到呈黄色固体状的目标化合物。产量:3.3g。mn=11341g/mol,n=11.2,多分散性=1.9。
聚合物(10)的介电常数为4.2。
实施例10(a)
将聚合物10与来自由式(a2)表示的化合物系列的1,4,8,11-四甲基-双-三乙基甲硅烷基乙炔基并五苯以2:1比率以2重量%总固体含量配制于溴苯中。这与pen基材装置相同,不同之处在于使用等离子体清洗方法活化表面(pe100型,购自plasmaetchinc.),使用50sccm氧、50sccm氩及250wrf等离子体功率,处理时间为65秒。
此制剂的tft性能显示于下表11(a)中:
实施例11:聚合物(9),30:70异丙基氰基-ptaa:2,4-二甲基ptaa双芳基封端共聚物
2,4-二甲基-n,n-二苯基苯胺
使甲苯(735ml)脱气10分钟,接着添加二苯胺(15g)、4-碘二甲苯5(21.6g,alfa-aesar)及叔丁醇钠(10.65g),随后再脱气5分钟。添加三(二亚苄基丙酮)二钯(0)(812mg)及三-叔丁基膦(1.08ml)且将混合物加热至95℃保持3.5小时。冷却反应物,用水(750ml)猝灭,搅拌10分钟,接着经硅藻土过滤。分离有机层,用盐水(2×500ml)洗涤,干燥(mgso4)且浓缩得到棕色油状物。将油状物再溶解于甲苯中且通过二氧化硅塞。浓缩滤液得到呈棕色油状的标题化合物。1hnmr(400mhz,cdcl3):δ7.16-7.23(4h,m,arh),6.86-7.05(9h,m,arh),2.33(3h,s,ch3),2.00(3h,s,ch3)。
n,n-双(4-溴苯基)-2,4-二甲基苯胺
将nbs(31.55g)添加至2,4-二甲基-n,n-二苯基苯胺6(24.23g)于etoac(410ml)中的溶液中。将混合物经5分钟缓慢温热且再搅拌1小时直至溶液再次冷却。混合物用水(250ml)、na2co3(2×375ml)、盐水(250ml)洗涤,干燥(mgso4)且浓缩得到深棕色固体。自thf/mecn中再结晶以得到呈灰色固体状的标题化合物。1hnmr(400mhz,cdcl3):δ7.22-7.30(4h,m,arh),7.05(1h,d,arh),7.00(1h,dd,arh),6.95(1h,d,arh),2.33(3h,s,ch3),1.97(3h,s,ch3)。
2,4-二甲基-n,n-双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)苯胺
使n,n-双(4-溴苯基)-2,4-二甲基苯胺7(10g)、双(频哪醇合)二硼(12.96g,allychem)及乙酸钾(7.97g,alfa-aesar)于二噁烷(250ml)中的混合物脱气10分钟,接着添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)与二氯甲烷的络合物(947mg)且将混合物加热至100℃过夜。浓缩混合物且将残余物溶解于dcm(300ml)中且通过硅藻土塞。滤液用水(2×200ml)洗涤,干燥(mgso4)且浓缩得到深棕色固体。通过柱色谱法用etoac/庚烷混合物洗脱,接着自thf/mecn中再结晶来进行纯化,得到呈白色固体状的标题化合物。1hnmr(400mhz,cdcl3):δ7.62-7.64(4h,m,arh),6.92-7.05(7h,m,arh),2.34(3h,s,ch3),1.95(3h,s,ch3),1.29(24h,s,ch3)。
合成30:704-异丙基氰基-ptaa:2,4-二甲基-ptaa共聚物11a
11(a):合成2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈
(i)2-(4-(二苯基氨基)苯基)-2-甲基丙腈
将乙酸钯(ii)(3.01g,preciousmetalsonline)及4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(7.76g,manchesterorganics)溶解于甲苯(550ml)中且使溶液脱气。添加二苯胺(22.7g,alfa-aesar)、叔丁醇钠(28.4g,alfa-aesar)及2-(4-碘苯基)-2-甲基丙腈(40g)且将溶液加热至90℃保持18小时。冷却反应物,经硅藻土垫过滤,用水、盐水洗涤,干燥(mgso4)且浓缩。通过快速柱色谱法用乙酸乙酯:庚烷混合物洗脱纯化残余物得到油状物。将庚烷添加至油状物中且过滤所得固体得到呈白色固体状的产物。产量:17.5g。1hnmr(400mhz,cdcl3);7.22-7.32(9h,m),7.00-7.10(6h,m),1.71(6h,s)。
(ii)2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈
将2-(4-(二苯基氨基)苯基)-2-甲基丙腈(7.5g)溶解于乙酸乙酯(128ml)中。逐份添加n-溴丁二酰亚胺(nbs)(8.55g,apolloscientific),随后在室温下搅拌反应物18小时。反应混合物用水、碳酸钠、盐水洗涤,干燥(mgso4)且浓缩。将庚烷添加至残余物中且滤出所得固体得到呈灰色固体状的产物。产物:6.4g。1hnmr(400mhz,cdcl3);7.30(6h,m),7.04(2h,d),6.93(4h,d),1.71(6h,s)。
11(b):合成2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈
(i)2,4-二甲基-n,n-二苯基苯胺
使甲苯(735ml)脱气10分钟,接着添加二苯胺(15g,alfaaesar)、4-碘二甲苯(21.6g,alfa-aesar)及叔丁醇钠(10.65g,alfaaesar),随后再脱气5分钟。添加pd2(dba)3(812mg,acros)及三-叔丁基膦(1.08ml,alfaaesar)且将混合物加热至95℃保持3.5小时。冷却反应物,用水(750ml)猝灭,搅拌10分钟,接着经硅藻土过滤。分离有机层,用盐水(2×500ml)洗涤,干燥(mgso4)且浓缩得到棕色油状物。产量:24.46g。将油状物再溶解于甲苯中且通过二氧化硅塞。浓缩滤液得到呈棕色油状的标题化合物。1hnmr(400mhz,cdcl3):δ7.16-7.23(4h,m,arh),6.86-7.05(9h,m,arh),2.33(3h,s,ch3),2.00(3h,s,ch3)。
(ii)n,n-双(4-溴苯基)-2,4-二甲基苯胺
将nbs(31.55g,apolloscientific)添加至2,4-二甲基-n,n-二苯基苯胺(24.23g)于etoac(410ml)中的溶液中。将混合物经5分钟缓慢温热且再搅拌1小时直至溶液再次冷却。混合物用水(250ml)、na2co3(2×375ml)、盐水(250ml)洗涤,干燥(mgso4)且浓缩得到深棕色固体。自thf/mecn中再结晶以得到呈灰色固体状的标题化合物。产量:27.70g。1hnmr(400mhz,cdcl3):δ7.22-7.30(4h,m,arh),7.05(1h,d,arh),7.00(1h,dd,arh),6.95(1h,d,arh),2.33(3h,s,ch3),1.97(3h,s,ch3)。
11(c):合成2,4-二甲基-n,n-双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)苯胺
使n,n-双(4-溴苯基)-2,4-二甲基苯胺7(10g)、双(频哪醇合)二硼(12.96g,allychem)及乙酸钾(7.97g,alfa-aesar)于二噁烷(250ml)中的混合物脱气10分钟,接着添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)与二氯甲烷的络合物(947mg,peakdalemolecular)且将混合物加热至100℃过夜。浓缩混合物且将残余物溶解于dcm(300ml)中且通过硅藻土塞。滤液用水(2×200ml)洗涤,干燥(mgso4)且浓缩得到深棕色固体。通过柱色谱法用etoac/庚烷混合物洗脱,接着自thf/mecn中再结晶来进行纯化,得到呈白色固体状的标题化合物。产量:5.60g。1hnmr(400mhz,cdcl3):δ7.62-7.64(4h,m,arh),6.92-7.05(7h,m,arh),2.34(3h,s,ch3),1.95(3h,s,ch3),1.29(24h,s,ch3)。
合成30:704-异丙基氰基-ptaa:2,4-二甲基-ptaa共聚物11a
将2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈(实施例11a(ii))(537.4mg)、n,n-双(4-溴苯基)-2,4-二甲基苯胺(实施例11b(ii))(328.5mg)及2,4-二甲基-n,n-双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)苯胺(实施例11(c))(1.01g)添加至甲苯:二噁烷:水(9.3ml:4.6ml:4.6ml)的混合物中,接着添加磷酸钾(1.61g,alfa-aesar)及aliquat336(4滴,alfaaesar)。使混合物脱气10分钟,接着添加pd2(dba)3(8.8mg,acros)及三(邻甲苯基)膦(17.4mg,sigma-aldrich)且将混合物加热至90℃直至达到所需mn。通过每小时对反应物进行取样且进行gpc分析来测定mn。此时,通过添加溴苯(1.5g,sigmaaldrich)且在90℃下加热混合物过夜来取代频哪醇硼(pinacolatoboron)部分。冷却混合物,倾入meoh(92.5ml)且过滤沉淀物且溶解于甲苯(100ml)中。溶液用1mnaoh(92.5ml)、水(92.5ml)、盐水(92.5ml)洗涤,干燥(硫酸镁)且浓缩得到橙色固体。将固体溶解于甲苯(10ml)中且经二氧化硅塞过滤,用thf:甲苯(50:50)洗脱。浓缩滤液至橙色固体,将该固体溶解于thf(10ml)中且逐滴添加至meoh(50ml)中。搅拌悬浮液15分钟,接着过滤得到黄色固体,将该固体溶解于甲苯中,用炭(3×80mg)处理且浓缩滤液。将固体溶解于thf(10ml)中且逐滴添加至meoh(50ml)中。过滤所得固体且干燥得到呈黄色固体状的标题化合物。产量:620mg。mn=3900g/mol。n=13.8。多分散性=2.3。
合成30:704-异丙基氰基-ptaa:2,4-二甲基-ptaa
使甲苯(170ml)脱气10分钟,接着添加2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈(2.70g)、n,n-双(4-溴苯基)-2,4-二甲基苯胺(1.66g)及2,4-二甲基-n,n-双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)苯胺(5.01g),接着添加(ph3p)4pd(27.7mg,peakdalemolecular)及1mna2co3(95ml)。将混合物加热至95℃直至达到所需mn。通过对反应物进行取样且进行gpc分析来测定mn。此时,通过添加溴苯(7.5g,sigmaaldrich)且在95℃下加热混合物过夜来取代频哪醇硼部分。接着冷却混合物且倾至甲醇(1325ml)中。通过过滤收集所得悬浮液,溶解于甲苯(250ml)中且经硅藻土过滤。滤液用1mnaoh(250ml)、水(250ml)、盐水(250ml)洗涤,干燥(mgso4)且浓缩得到黄色固体。为移除溴化物部分,将此固体溶解于已脱气的甲苯(170ml)中且向其中添加1mna2co3(95ml)、(ph3p)4pd(27.7mg,peakdalemolecular)及苯基硼酸(5.81g,apolloscientific)。将此物质加热至95℃过夜。重复上述处理,浓缩至150ml。经二氧化硅过滤,用50:50甲苯:thf混合物洗脱。滤液浓缩为棕色固体,将该固体溶解于甲苯(100ml)中,用炭(3×500mg)处理且浓缩滤液。将固体溶解于thf(50ml)中且在meoh(250ml)中沉淀。过滤所得悬浮液得到呈灰色固体状的标题化合物。产量:4.0g。mn=1992g/mol。n=7.0。多分散性=3.4。
聚合物9的介电常数为3.6。
可选择的方法
使甲苯(34ml)脱气10分钟,接着添加2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈(537.4mg)、n,n-双(4-溴苯基)-2,4-二甲基苯胺(328.7mg)及2,4-二甲基-n,n-双(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)苯基)苯胺(1.00g),接着添加(ph3p)4pd(5.7mg,peakdalemolecular)及1mna2co3(19ml)。将混合物加热至95℃保持12小时,通过添加溴苯(1.5g,sigmaaldrich)且在95℃下加热混合物过夜来取代频哪醇硼部分。接着通过添加苯基硼酸(1.16g,apolloscientific)且加热混合物过夜来取代溴化物部分。如上文所述进行纯化得到呈灰色固体状的产物。产量:825mg。mn=2300g/mol。n=8.1。多分散性=3.1。
比较实施例(12),合成2,4-二甲基-ptaa聚合物
合成2,4-二甲基聚三芳基胺聚合物(12)
在1l三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。使用套管针将500ml无水n,n-二甲基乙酰胺(sigmaaldrich)装入容器且溶液用氩气脱气15分钟。添加三苯基膦(19.65g,sigmaaldrich)、2,2'-联吡啶(0.92g,sigmaaldrich)、锌(29.65g,alfa-aesar)及氯化镍(ii)(0.51g,sigmaaldrich)且将反应物加热至70-80℃,此时混合物颜色变为红棕色。20分钟后,添加少量碘晶体且在70-80℃下再搅拌混合物40分钟。相继添加2,4-二甲基ptaa单体(49.88g,参见实施例4)及无水甲苯(75ml,aldrich)。在70-80℃下搅拌反应物19小时。使反应物冷却至室温且过滤。固体用滤液洗涤,随后转移回容器中且在50℃下溶解于甲苯(500ml)中。使混合物冷却至室温且通过缓慢添加浓盐酸(80ml)来猝灭过量锌。分离各层且有机相用10%氯化钠水溶液(3×250ml)洗涤。接着干燥(硫酸钠)有机相且经硅藻土垫过滤。浓缩滤液得到黄色固体。将此固体溶解于甲苯(200ml)中且经硅胶垫(100g)过滤,用甲苯洗脱直至根据tlc板上的uv光点不再发现产物。合并滤液且浓缩得到黄色固体。制备此固体于150ml四氢呋喃中的溶液,接着经1小时添加至一份经搅拌的甲醇(750ml)中。搅拌悬浮液1小时,随后过滤,用甲醇(2×100ml)洗涤且干燥得到黄色粉末。产量:25.78g。mn=3263g/mol,n=12.0,多分散性=1.7。
加氢脱氯法
将11.22g2,4-二甲基聚三芳基胺聚合物及500ml甲苯(fisherscientific)装入装配有磁性搅拌器的1l高压釜中。向其添加10%钯/碳(5.6g,sigmaaldrich)于水(90ml)中的浆料。向该经搅拌的溶液中添加三乙胺(17ml,alfa-aesar)且反应混合物在300psi/50℃下氢化72小时。冷却且排气后,混合物经硅藻土过滤,用甲苯洗脱。滤液用水(4×500ml)洗涤,干燥(硫酸钠)且浓缩得到黄色固体。将此物质溶解于甲苯(100ml)中且经二氧化硅垫过滤,用甲苯洗脱直至根据tlc板上的uv光点不再发现产物。接着浓缩滤液得到黄色固体。将该产物于甲苯(250ml)中的溶液及活性炭(1.2g)装入500ml圆底烧瓶。将混合物加热至60℃保持30分钟,接着经布氏漏斗热过滤,用最少量甲苯洗涤。重复此碳筛选过程2次以上,将第3次处理物经玻璃烧结漏斗过滤。浓缩滤液得到深黄色固体。制备此物质于四氢呋喃(60ml)中的溶液且缓慢添加至一份经搅拌的甲醇(300ml)中。搅拌所得悬浮液1小时,通过真空过滤收集,用甲醇(3×50ml)洗涤且干燥得到呈淡黄色粉末状的产物。产量:9.75g。mn=3138g/mol。n=11.6。多分散性=1.8。氯含量=19ppm。
2,4-二甲基ptaa聚合物(6)的介电常数为3.0。
使用与实施例1至11中所描述相同的方法合成比较实施例聚合物(13)及(14),即3-甲氧基-ptaa均聚物(13)及2,4-二氟-ptaa均聚物(14);相应的ptaa聚合物的电容率列于表1中。
比较实施例15:聚合物(15)3,5-双三氟甲基聚三芳基胺均聚物
合成3,5-双(三氟甲基)ptaa聚合物
合成3,5-双(三氟甲基)单体
将甲苯(1.125l)装入装配有机械搅拌器、温度计、冷凝器及氩气入口的2l3颈圆底烧瓶,将乙酸钯(494.4mg,preciousmetals)及(±)-2,2'-双(二苯基膦基)-1,1'-联萘(1.37g,alfa-aesar)添加至容器中且将内含物加热至50℃,接着一达到50℃即冷却至室温且搅拌1小时。将3,5-双(三氟甲基)碘苯(75g,maybridge)、双(4-氯苯基)苯胺(52.5g)及叔丁醇钠(23.28g,alfa-aesar)添加至容器中,加热至110℃保持8小时。冷却反应物且添加水(750ml)。过滤混合物且分离各层。有机相用水洗涤,经硅藻土垫过滤且浓缩。通过使用庚烷作为洗脱剂进行色谱法,接着自甲醇中再结晶两次来纯化粗产物。产量:35g。1hnmr(400mhz,cdcl3):δ7.31-7.29(7h,m,arh),7.04-7.02(3h,m,arh)。
合成3,5-双(三氟甲基)ptaa寡聚物(15)
在1l三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。装入n,n-二甲基乙酰胺(250ml,sigma-aldrich)且脱气15分钟。将三苯基膦(7.58g,sigma-aldrich)、2,2'-联吡啶(346.2mg,sigma-aldrich)、锌(11.17g,alfa-aesar)及氯化镍(ii)(216.7mg,sigma-aldrich)添加至容器中。将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将3,5-双(三氟甲基)单体(24.98g)添加至容器中。添加无水甲苯(41ml,sigma-aldrich)且搅拌反应物19小时,随后冷却至室温。过滤反应物,用n,n-二甲基乙酰胺(100ml)洗涤固体。将滤饼溶解于四氢呋喃(300ml)中,经硅藻土垫过滤且浓缩。将此物质溶解于四氢呋喃(250ml)中且经二氧化硅过滤,用四氢呋喃洗脱。合并产物部分且浓缩得到黄色固体。将此物质溶解于2-甲基四氢呋喃(230ml)中,用1m氢氧化钠溶液(200ml)、水(200ml)、10%氯化钠溶液(200ml)及水(200ml)洗涤,随后浓缩得到黄色固体(8.5g)。将此物质溶解于四氢呋喃(50ml)中且用炭处理3次(3×0.85g炭),接着进行浓缩。将此物质溶解于四氢呋喃(60ml)中且逐滴添加至一份经搅拌的甲醇(300ml)中。搅拌所得悬浮液1小时,随后通过过滤收集且干燥。产量:7.5g。mn=5350g/mol。n=14.1。多分散性=1.3。
聚合物(11)的介电常数为2.8。
比较实施例16:聚合物(16),2-甲氧基主链单体
合成2-甲氧基主链单体
(a)合成4-氯-2-甲氧基苯胺
将5-氯-2-硝基茴香醚(1.0g,sigma-aldrich)、甲酸铵(3.36g,alfa-aesar)及10%碳/铂(100mg)于meoh(10ml)中的混合物加热至回流保持45分钟,接着冷却至室温且经硅藻土过滤,用meoh洗涤。浓缩滤液且将残余物溶解于etoac及水中。干燥(mgso4)有机物且浓缩得到棕色油状物。使该物质吸附于二氧化硅上且用乙酸乙酯/庚烷混合物进行柱洗脱得到呈棕色油状的产物。产量:0.7g。1hnmr(400mhz,cdcl3):δ6.72-6.78(2h,m,arh),6.58-6.62(1h,m,arh),3.83(3h,s,ome)。
(b)合成4-氯-n-(4-氯苯基)-2-甲氧基苯胺
将乙酸钯(ii)(949mg,preciousmetalsonline)及(+/-)-2,2'-双(二苯基膦基)-1,1'-联萘(2.63g,alfa-aesar)于甲苯(1000ml)中的溶液在氩气下加热至50℃,接着冷却至室温。添加4-氯-2-甲氧基苯胺(66.6g)、4-碘氯苯(105.81g,apolloscientific)及叔丁醇钠(44.68g,alfa-aesar)且将混合物加热至回流保持90分钟。使混合物冷却至室温,用水(500ml)猝灭,接着分离有机物,干燥(mgso4)且浓缩。使残余物吸附于二氧化硅上且用乙酸乙酯/庚烷混合物进行柱洗脱以得到呈深橙色油状的产物,其在静置时固化。产量:97.86g。1hnmr(400mhz,cdcl3):δ7.18-7.23(2h,m,arh),7.12(1h,d,arh),7.00-7.05(2h,m,arh),6.82-6.85(2h,m,arh),6.00(1h,brs,nh),3.87(3h,s,ome)。
(c)合成4-氯-n-(4-氯苯基)-2-甲氧基-n-苯基苯胺-2-meo-主链ptaa单体
将乙酸钯(ii)(3.84g,preciousmetalsonline)及4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(9.91g,manchesterorganics)溶解于甲苯(690ml)中且在室温下氩气下搅拌1小时。添加4-氯-n-(4-氯苯基)-2-甲氧基苯胺(45.9g)、碘苯(47.9ml,sigma-aldrich)及叔丁醇钠(42.78g,alfaaesar)且将混合物加热至85℃过夜。使混合物冷却至室温,用水(690ml)猝灭且经硅藻土过滤。分离有机物,干燥(mgso4)且浓缩得到黑色油状物。使该物质吸附于二氧化硅上且用乙酸乙酯/庚烷混合物进行柱洗脱以得到棕色油状物。添加meoh且使混合物冷却至0℃且搅拌1小时。过滤固体且自dcm/meoh中再结晶以得到呈白色固体状的产物。产量:14.5g。1hnmr(400mhz,cdcl3):δ7.18-7.23(2h,m,arh),7.10-7.15(2h,m,arh),7.05(1h,d,arh),6.89-6.99(5h,m,arh),6.84-6.88(2h,m,arh),3.63(3h,s,ome)。
合成2-甲氧基主链ptaa聚合物16
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。装入n,n-二甲基乙酰胺(150ml,sigma-aldrich)且脱气15分钟。将三苯基膦(5.75g,sigma-aldrich)、2,2'-联吡啶(263.1mg,sigma-aldrich)、锌(8.48g,alfa-aesar)及氯化镍(ii)(163.8mg,sigma-aldrich)添加至容器中且将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将单体(14.5g)及无水甲苯(24ml,sigma-aldrich)相继添加至容器中且搅拌混合物过夜,随后冷却至室温。过滤反应物且将滤液逐滴添加至meoh(1150ml)中。过滤固体,用meoh洗涤且干燥,随后再溶解于甲苯(750ml)中。溶液用1m盐酸(250ml)、水(250ml)、10%盐水(250ml)洗涤,干燥(mgso4)且浓缩得到黄色固体。将此物质溶解于甲苯中且通过二氧化硅垫,相继用甲苯及50:50甲苯:thf洗脱。浓缩滤液,接着再溶解于甲苯中且用炭(3×1.24g)处理。接着浓缩滤液得到黄色固体。将此物质溶解于thf(250ml)中且逐滴添加至一份经搅拌的甲醇(1250ml)中。搅拌所得悬浮液30分钟,随后通过过滤收集得到淡黄色粉末。产量:8.93g。mn=3221g/mol。n=11.8。多分散性=2.4。
聚合物(16)的介电常数为3.3。
比较实施例17:聚合物(17)4-苯氧基-ptaa均聚物
合成4-苯氧基单体
将300毫升(ml)甲苯装入装配有磁性搅拌器、温度计、冷凝器及氩气入口的1升(l)3颈圆底烧瓶,将乙酸钯(250毫克(mg),preciousmetals)及(±)-2,2'-双(二苯基膦基)-1,1'-联萘(0.69克(g),alfa-aesar)添加至容器中且将内含物加热至50℃,接着一达到50℃即冷却至室温且搅拌1小时。将4-苯氧基苯胺(20.02g,alfa-aesar)、4-氯碘苯(59.96g,apolloscientific)及叔丁醇钠(22.83g,alfa-aesar)添加至容器中,加热至110℃保持54小时。冷却反应物且添加水(200ml)。过滤混合物且分离各层。有机相用水洗涤,经硅藻土垫过滤,经硫酸钠干燥且浓缩。通过使用含2%乙酸乙酯的庚烷作为洗脱剂进行自动色谱法,接着通过二氧化硅垫使用庚烷移除杂质,接着使用含10%乙酸乙酯的庚烷进行自动色谱法来纯化粗产物。合并产物部分且进行浓缩。产量:29g。1hnmr(400mhz,cdcl3):δ7.5-6.9(17h,m,arh)。
合成4-苯氧基ptaa寡聚物
在500ml三颈圆底烧瓶上装配顶置式搅拌器、温度计、空气冷凝器、克莱森转接器及隔膜入口。用氩气吹扫装置。装入n,n-二甲基乙酰胺(130ml,aldrich)且脱气15分钟。将三苯基膦(1.50g,aldrich)、2,2'-联吡啶(69.8mg,aldrich)、锌(2.24g,alfa-aesar)及氯化镍(ii)(42.4mg,aldrich)添加至容器中。将内含物加热至70-80℃,此时混合物颜色变为红棕色。添加少量碘晶体且搅拌反应物1小时。将单体(13g)及无水甲苯(45.5ml,sigma-aldrich)相继添加至容器中。3小时后,添加另外的氯化镍(ii)(42.8mg)且搅拌反应物15小时,随后冷却至室温。反应物经硅藻土过滤,用n,n-二甲基乙酰胺(50ml)洗脱。固体开始在滤液中沉淀,通过过滤收集固体。测量滤液(350ml)且逐滴添加至一份经搅拌的甲醇(1750ml)中。搅拌悬浮液1小时,通过真空过滤收集且用甲醇洗涤。将固体与由硅藻土过滤收集的固体合并且溶解于四氢呋喃(250ml)中,用10%氯化钠溶液(200ml)洗涤3次且浓缩得到黄色固体。将此物质溶解于四氢呋喃(250ml)中且经二氧化硅过滤,用四氢呋喃洗脱。合并产物部分且浓缩得到黄色固体(15g)。将此物质溶解于四氢呋喃(250ml)中且用炭处理3次(3×1.5g炭)。浓缩滤液。将此物质溶解于四氢呋喃(120ml)中且逐滴添加至一份经搅拌的甲醇(120ml)中。搅拌所得悬浮液1小时,随后通过过滤收集且干燥。产量:8.6g。mn=2047g/mol。n=6.1。多分散性=2.1。
聚合物(17)的介电常数为2.7。
比较实施例(18):合成50:502,4-二甲基三芳基胺-二辛基-芴共聚物(18)
(a)合成2-(4-(双(4-溴苯基)氨基)苯基)-2-甲基丙腈
(i)2,4-二甲基-n,n-二苯基苯胺
使甲苯(735ml)脱气10分钟,接着添加二苯胺(15g,alfa-aesar)、4-碘二甲苯(21.6g,alfa-aesar)及叔丁醇钠(10.65g,alfa-aesar),随后再脱气5分钟。添加pd2(dba)3(812mg,acros)及三-叔丁基膦(1.08ml,alfa-aesar)且将混合物加热至95℃保持3.5小时。冷却反应物,用水(750ml)猝灭,搅拌10分钟,接着经硅藻土过滤。分离有机层,用盐水(2×500ml)洗涤,干燥(mgso4)且浓缩得到棕色油状物。将油状物再溶解于甲苯中且通过二氧化硅塞。浓缩滤液得到呈棕色油状的标题化合物。产量:24.46g。1hnmr(400mhz,cdcl3):δ7.16-7.23(4h,m,arh),6.86-7.05(9h,m,arh),2.33(3h,s,ch3),2.00(3h,s,ch3)。
(ii)n,n-双(4-溴苯基)-2,4-二甲基苯胺
将nbs(31.55g,apolloscientific)添加至2,4-二甲基-n,n-二苯基苯胺(24.23g)于etoac(410ml)中的溶液中。将混合物经5分钟缓慢温热且再搅拌1小时直至溶液再次冷却。混合物用水(250ml)、na2co3(2×375ml)、盐水(250ml)洗涤,干燥(mgso4)且浓缩得到深棕色固体。自thf/mecn中再结晶以得到呈灰色固体状的标题化合物。产量:27.70g。1hnmr(400mhz,cdcl3):δ7.22-7.30(4h,m,arh),7.05(1h,d,arh),7.00(1h,dd,arh),6.95(1h,d,arh),2.33(3h,s,ch3),1.97(3h,s,ch3)。
(b)合成2,2'-(9,9-二辛基-9h-芴-2,7-二基)双(4,4,5,5-四甲基-1,3,2-二氧硼戊环)
将含2,7-二溴-9,9-二辛基-9h-芴(10g,sigma-aldrich)、乙酸钾(6.26g,alfa-aesar)及双(频哪醇合)二硼(10.19g,allychem)的二噁烷(300ml)装入圆底烧瓶中。使混合物脱气15分钟,接着添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(745mg,peakdale)且将反应混合物加热至100℃保持18小时。浓缩混合物且将残余物溶解于dcm中且经硅藻土垫过滤,用dcm洗涤。有机层用水、盐水洗涤,干燥(mgso4)且浓缩至二氧化硅上。通过干式快速柱色谱法用庚烷/乙酸乙酯混合物洗脱进行纯化得到淡黄色固体,使其自thf/mecn中再结晶以得到呈黄色固体状的目标化合物。产量:7.89g。1hnmr(400mhz,cdcl3);7.80(2h,m),7.72(4h,m),2.00(4h,m),1.38(24h,s),0.95-1.25(20h,m),0.78(6h,m),0.48-0.60(4h,brm)。
合成50:50聚-9,9-二辛基芴:2,4-二-metaa共聚物
在甲苯(77ml)、二噁烷(77ml)及水(38.5ml)的混合物中搅拌n,n-双(4-溴苯基)-2,4-二甲基苯胺(7.37g)、2,2'-(9,9-二辛基-9h-芴-2,7-二基)双(4,4,5,5-四甲基-1,3,2-二氧硼戊环)(10.99g)、磷酸钾(14.97g,alfa-aesar)及aliquat336(56滴,alfa-aesar)且脱气。添加三-(邻甲苯基)膦(161mg,sigma-aldrich)及三(二亚苄基丙酮)钯(0)(81mg,acros)且将反应物加热至100℃保持18小时。将反应混合物倾于甲醇(960ml)上,通过过滤收集所得固体且用1mhcl(500ml)、饱和碳酸氢盐(500ml)、水(500ml)及丙酮(500ml)洗涤。将固体溶解于甲苯:thf中且经二氧化硅垫过滤且浓缩滤液得到黄色塑料。将此物质溶解于thf(250ml)中且用甲醇(1250ml)使其沉淀。通过过滤收集固体得到呈黄色粉末状的目标化合物。产量:10.5g。mn=14885,n=22.6,多分散性=2.0。
聚合物(18)的介电常数为2.7。
比较实施例(19):合成50:504-仲丁基-三芳基胺-四辛基茚并芴共聚物(19)
4-溴-n-(4-溴苯基)-n-[4-(仲丁基)苯基]苯胺
将乙酸钯(ii)(2.26g,preciousmetalsonline)及4,5-双(二苯基膦基)-9,9-二甲基氧杂蒽(5.97g,alfa-aesar)溶解于甲苯(100ml)中且脱气,随后在室温下搅拌1小时。添加4-(仲丁基)苯胺(tci,15.3g)、4-碘溴苯(apolloscientific,62.2g)及叔丁醇钠(21.8g,alfa-aesar)且用甲苯洗涤(113ml)。接着将反应混合物加热至回流保持18小时。使反应物冷却至室温,用水(200ml)稀释且经硅藻土垫过滤。有机层用水(2×200ml)洗涤,干燥(na2so4)且浓缩。通过快速柱色谱法用乙酸乙酯:庚烷混合物洗脱,接着相继自甲醇:乙酸乙酯及乙腈:thf中再结晶来进行纯化得到呈白色固体状的目标化合物。产量:29g。1hnmr(400mhz,cdcl3):7.32(4h,m),7.09(2h,m),6.92(6h,m),2.54(1h,m),1.56(2h,m),1.21(3h,m),0.83(3h,m)。
2,2'-(6,6,12,12-四辛基-6,12-二氢茚并[1,2-b]芴-2,8-二基)双(4,4,5,5-四甲基-1,3,2-二氧硼戊环)
将含2,8-二溴-6,6,12,12-四辛基-6,12-二氢茚并[1,2-b]芴(8.84g,sigma-aldrich)、乙酸钾(3.53g,alfa-aesar)及双(频哪醇合)二硼(5.74g,allychem)的二噁烷(220ml)装入圆底烧瓶。使混合物脱气15分钟,接着添加[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)(419mg,peakdale)且将反应混合物加热至100℃保持18小时。浓缩混合物且将残余物溶解于dcm/水(2:1)中且经硅藻土垫过滤,用dcm洗涤。有机层用盐水洗涤,干燥(mgso4)且浓缩至二氧化硅上。通过干式快速柱色谱法用庚烷/乙酸乙酯混合物洗脱进行纯化得到淡黄色固体,使其自thf/mecn中再结晶以得到呈黄色固体状的目标化合物。产量:5.92g。1hnmr(400mhz,cdcl3);7.83(2h,m),7.73(4h,m),7.62(2h,s),1.91-2.12(8h,brm),1.39(24h,s),0.91-1.22(40h,brm),0.79(12h,m),0.50-0.70(8h,brm)。
50:50聚-9,9-二辛基茚并芴:仲丁基taa共聚物
在甲苯(17.5ml)、二噁烷(8.8ml)及水(8.8ml)的混合物中搅拌4-溴-n-(4-溴苯基)-n-(4-(仲丁基)苯基)苯胺(1.13g)、2,2'-(6,6,12,12-四辛基-6,12-二氢茚并[1,2-b]芴-2,8-二基)双(4,4,5,5-四甲基-1,3,2-二氧硼戊环)(2.35g)、磷酸钾(2.09g,alfa-aesar)及aliquat336(4滴,alfa-aesar)且脱气。添加三(二亚苄基丙酮)钯(0)(11mg,acros)及三-(邻甲苯基)膦(22mg,sigma-aldrich)且将反应物加热至100℃保持18小时。接着将反应混合物倾于甲醇(175ml)上且通过过滤收集所得沉淀物。固体用1mhcl(175ml)、饱和碳酸氢盐(175ml)、水(175ml)及丙酮(175ml)洗涤。将固体溶解于甲苯中且通过二氧化硅垫,用甲苯彻底洗涤。接着用炭(3×232mg)处理固体,浓缩滤液,溶解于thf(25ml)中且用甲醇(125ml)使其沉淀。过滤固体得到呈黄色固体状的目标化合物。产量:1.91g。mn=14146,n=14.1,多分散性=2.0。
聚合物(19)的介电常数为2.6。
- 还没有人留言评论。精彩留言会获得点赞!