吡啶酮和氮杂吡啶酮化合物及使用方法与流程
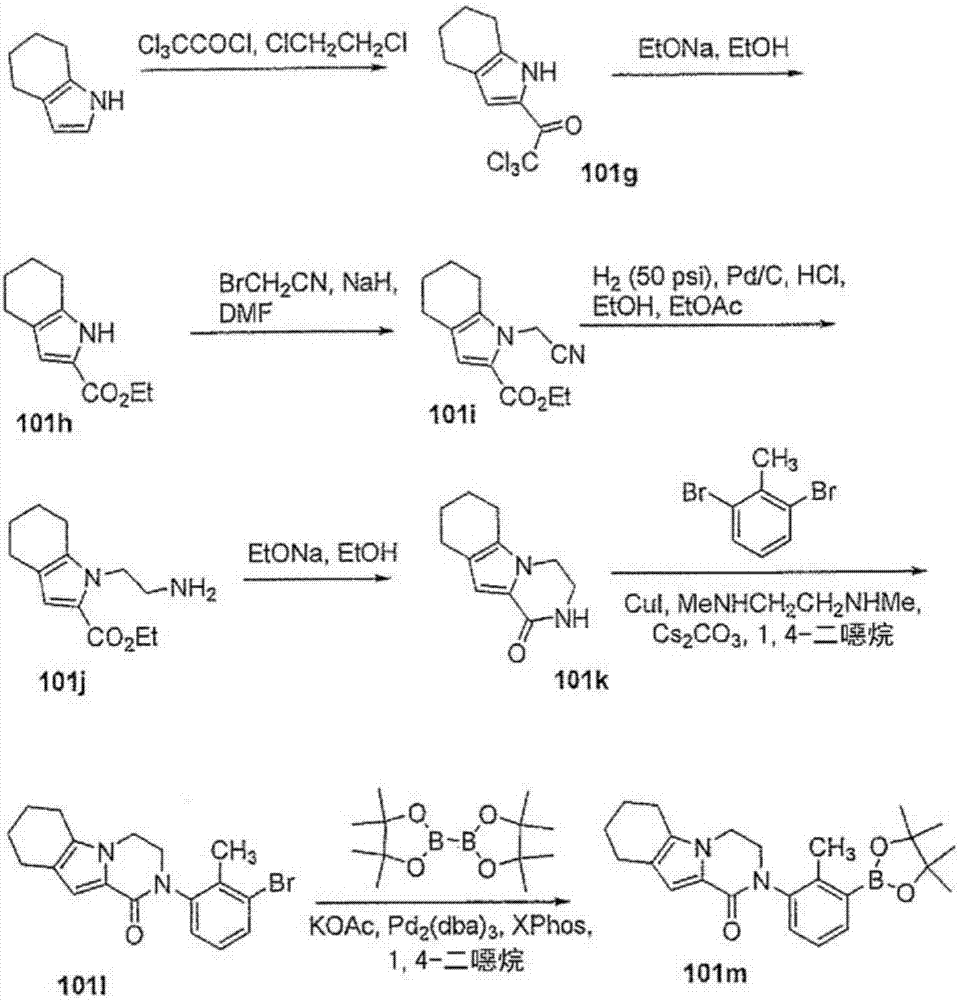
本申请是2011年5月6日提交的发明名称为“吡啶酮和氮杂吡啶酮化合物及使用方法”的中国专利申请201180033536.8的分案申请。本发明概括地涉及用于治疗包括炎症、免疫性病症和癌症在内的由bruton酪氨酸激酶(btk)介导的病症的化合物,更具体地涉及抑制btk活性的化合物。本发明还涉及利用所述化合物在体外、原位及体内诊断或治疗哺乳动物细胞或相关病理状态的方法。
背景技术:
:蛋白激酶是最大的人类酶家族,包括超过500种蛋白质。bruton酪氨酸激酶(btk)是酪氨酸激酶中的tec家族的成员,并且是早期b细胞发育及成熟b细胞活化、信号转导和存活的调节剂。经b细胞受体(bcr)的b细胞信号转导能产生广泛的生物学输出信号(biologicaloutput),而所述信号转而取决于b细胞的发育阶段。bcr信号的强度和持续时间必须被精确地调节。异常的bcr介导的信号转导能造成失调的b细胞活化和/或形成导致多种自身免疫疾病和/或炎性疾病的致病性自身抗体。人体内btk的突变导致x连锁无丙种球蛋白血症(xla)。这种疾病与b细胞成熟受损、免疫球蛋白产生减少、不依赖t细胞的免疫应答受损以及在bcr刺激时持续的钙信号的显著减弱有关。btk在变态反应性疾病和/或自身免疫疾病和/或炎性疾病中起作用的证据已经在btk-缺陷小鼠模型中得到确定。例如,在系统性红斑狼疮(sle)的标准鼠类临床前模型中,已经表明btk缺陷引起疾病进展的明显改善。而且,btk缺陷小鼠还能抵抗形成胶原诱发性关节炎并能对葡萄球菌诱发性关节炎更不易感。大量的证据支持b细胞和体液免疫系统在自身免疫疾病和/或炎性疾病的发病机制中的作用。已开发的为了耗竭b细胞的蛋白质系治疗剂(诸如rituxan)代表治疗许多自身免疫疾病和/或炎性疾病的方法。由于btk在b细胞活化中的作用,btk抑制剂可以被用作b细胞介导的致病性活动(例如产生自身抗体)的抑制剂。btk也在破骨细胞、肥大细胞和单核细胞中表达,并且显示其对于这些细胞的功能很重要。例如,小鼠btk缺陷与ige介导的肥大细胞活化受损(显著减少tnf-α及其它炎性细胞因子的释放)有关,并且人btk缺陷与激活的单核细胞产生tnf-α大大减少有关。因此,抑制btk活性可以用于治疗变态反应性病症和/或自身免疫疾病和/或炎性疾病,例如:sle、类风湿性关节炎、多血管炎、特发性血小板减少性紫癜(itp)、重症肌无力、变应性鼻炎和哮喘。此外,据报道,btk在凋亡中起作用;因此,抑制btk活性可用于癌症以及治疗b细胞淋巴瘤和白血病。而且,考虑到btk在破骨细胞功能方面的作用,抑制btk活性可用于治疗骨病例如骨质疏松。技术实现要素:本发明概括地涉及具有bruton酪氨酸激酶(btk)调节活性的式i的化合物。式i的化合物具有以下结构:包括其立体异构体、互变异构体或药学可接受的盐。各种取代基的定义如下。本发明的一方面是药物组合物,其包含式i化合物以及药学可接受的载体、助流剂、稀释剂或赋形剂。所述药物组合物还可包含另一治疗剂。本发明的另一方面是制备药物组合物的方法,其包括将式i化合物与药学可接受的载体混合。本发明包括治疗疾病或病症的方法,所述方法包括向患有疾病或病症的患者给药治疗有效量的式i化合物,所述疾病或病症选自免疫性病症、癌症、心血管疾病、病毒感染、炎症、代谢/内分泌功能障碍和神经病,并由bruton酪氨酸激酶介导。本发明包括用于治疗由bruton酪氨酸激酶介导的病症的药盒,其包含:a)包含式i化合物的第一药物组合物;和b)使用说明书。本发明包括式i化合物,其用作药物并且用于治疗疾病或病症,所述疾病或病症选自免疫性病症、癌症、心血管疾病、病毒感染、炎症、代谢/内分泌功能障碍和神经病,并由bruton酪氨酸激酶介导。本发明包括式i化合物在制备用于治疗免疫性病症、癌症、心血管疾病、病毒感染、炎症、代谢/内分泌功能障碍和神经病的药物中的用途,并且其中所述药物调节bruton酪氨酸激酶。本发明包括制备式i化合物的方法。附图简述图1显示从3-硝基吡唑-5-羧酸制备包括6-氯-4-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)哒嗪-3(2h)-酮101f在内的6-氯,4-氨基哒嗪酮化合物的示例性合成路线。图2显示从4,5,6,7-四氢-1h-吲哚制备包括2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101m在内的三环酰胺-苯基硼酸酯化合物的示例性合成路线。图3显示从4,5,6,7-四氢苯并[b]噻吩-2-羧酸制备包括2-溴-6-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯104h在内的三环酰胺-苯基溴化物化合物的示例性合成路线。图4显示从3-甲基环戊-2-烯酮制备包括6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-酮105i在内的三环酰胺-苯基溴化物化合物的另一示例性合成路线。图5显示从5,6,7,8-四氢中氮茚-2-羧酸制备包括2-(1-氧代-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯118f在内的作为硼酸酯的三环1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮化合物的示例性合成路线。图6显示从1,3-二溴-5-氟-2-碘苯制备中间体2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯198d的示例性合成路线。图7显示制备中间体4-氟-2-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯198g的示例性合成路线。图8显示制备中间体5-氟-2-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯210e的示例性合成路线。图9显示制备中间体5-[5-氟-2-(乙酰氧基甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮212c的示例性合成路线。具体实施方式现详细描述本发明的某些实施方案,其实例在随附结构和分子式中说明。虽然结合列举的实施方案来描述本发明,但是应理解本发明并不限于那些实施方案。相反,本发明意在涵盖可包括在本发明的由权利要求书限定的范围内的所有替代方案、修改和等效。本领域技术人员会认识到,与本文中所述的那些相似或等同的许多方法和材料可用于实施本发明。本发明绝不限于所述的方法和材料。在所引的文献、专利及相似的材料中的一者或多者与本申请(包括但不限于定义的术语、术语用法、所述的技术等)不同或矛盾的情况下,以本申请为准。定义术语“烷基”用于本文中是指具有1-12个碳原子(c1-c12)的饱和的直链或支链一价烃基,其中所述烷基可任选地独立地被下述一种或多种取代基取代。在另一个实施方案中,烷基具有1-8个碳原子(c1-c8),或者1-6个碳原子(c1-c6)。烷基的实例包括但不限于:甲基(me,-ch3)、乙基(et、-ch2ch3)、1-丙基(n-pr、正丙基、-ch2ch2ch3)、2-丙基(i-pr、异丙基、-ch(ch3)2)、1-丁基(n-bu、正丁基、-ch2ch2ch2ch3)、2-甲基-1-丙基(i-bu、异丁基、-ch2ch(ch3)2)、2-丁基(s-bu、仲丁基、-ch(ch3)ch2ch3)、2-甲基-2-丙基(t-bu、叔丁基、-c(ch3)3)、1-戊基(正戊基、-ch2ch2ch2ch2ch3)、2-戊基(-ch(ch3)ch2ch2ch3)、3-戊基(-ch(ch2ch3)2)、2-甲基-2-丁基(-c(ch3)2ch2ch3)、3-甲基-2-丁基(-ch(ch3)ch(ch3)2)、3-甲基-1-丁基(-ch2ch2ch(ch3)2)、2-甲基-1-丁基(-ch2ch(ch3)ch2ch3)、1-己基(-ch2ch2ch2ch2ch2ch3)、2-己基(-ch(ch3)ch2ch2ch2ch3)、3-己基(-ch(ch2ch3)(ch2ch2ch3))、2-甲基-2-戊基(-c(ch3)2ch2ch2ch3)、3-甲基-2-戊基(-ch(ch3)ch(ch3)ch2ch3)、4-甲基-2-戊基(-ch(ch3)ch2ch(ch3)2)、3-甲基-3-戊基(-c(ch3)(ch2ch3)2)、2-甲基-3-戊基(-ch(ch2ch3)ch(ch3)2)、2,3-二甲基-2-丁基(-c(ch3)2ch(ch3)2)、3,3-二甲基-2-丁基(-ch(ch3)c(ch3)3、1-庚基、1-辛基等。术语“亚烷基”用于本文中是指具有1-12个碳原子(c1-c12)的饱和直链或支链二价烃基,其中所述亚烷基可任选地独立地被下述一种或多种取代基取代。在另一个实施方案中,亚烷基具有1-8个碳原子(c1-c8),或者1-6个碳原子(c1-c6)。亚烷基的实例包括但不限于亚甲基(-ch2-)、亚乙基(-ch2ch2-)、亚丙基(-ch2ch2ch2-)等。术语“碳环(carbocycle)”、“碳环基”、“碳环(carbocyclicring)”和“环烷基”是指具有3-12个碳原子(c3-c12)的单环形式的、或具有7-12个碳原子的双环形式的一价非芳香性饱和或部分不饱和的环。具有7–12个原子的双环碳环可排列成例如双环[4,5]、[5,5]、[5,6]或[6,6]系统,具有9或10个环原子的双环碳环可排列成双环[5,6]或[6,6]系统或者可排列成桥环系统,例如双环[2.2.1]庚烷、双环[2.2.2]辛烷和双环[3.2.2]壬烷。单环碳环的实例包括但不限于:环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、1-环己-1-烯基、1-环己-2-烯基、1-环己-3-烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基等。“芳基”是指通过从母体芳香性环系统的单个碳原子除去一个氢原子而得的具有6-20个碳原子(c6-c20)的一价芳香性烃基。一些芳基在示例结构中表示为“ar”。芳基包括包含与饱和的、部分不饱和的环或芳香性碳环稠合的芳香环的双环基团。典型的芳基包括但不限于由苯(苯基)、取代苯、萘、蒽、联苯基、茚基、茚满基、1,2-二氢萘、1,2,3,4-四氢萘基等得到的基团。芳基任选地独立地被本文所述的一种或多种取代基取代。“亚芳基”是指通过从母体芳香性环系统的两个碳原子除去两个氢原子而得的具有6-20个碳原子(c6-c20)的二价芳香性烃基。一些亚芳基在示例结构中表示为“ar”。亚芳基包括包含与饱和的、部分不饱和的环或芳香性碳环稠合的芳香环的双环基团。典型的亚芳基包括但不限于由苯(亚苯基)、取代苯、萘、蒽、亚联苯基、亚茚基、亚茚满基、1,2-二氢萘、1,2,3,4-四氢萘基等得到的基团。亚芳基任选地被取代。术语“杂环(heterocycle)”、“杂环基”和“杂环(heterocyclicring)”在本文中可互换使用,并且是指具有3–约20个环原子、其中至少一个环原子是选自氮、氧、磷、硫和硅的杂原子且其余环原子是c的饱和或部分不饱和的(即在环内具有一个或多个双键和/或三键)碳环基团,其中一个或多个环原子任选地独立地被下述一个或多个取代基取代。杂环可以是具有3–7个环成员(2-6个碳原子和1–4个选自n、o、p和s的杂原子)的单环,或者具有7–10个环成员(4-9个碳原子和1–6个选自n、o、p和s的杂原子)的双环,例如:双环[4,5]、[5,5]、[5,6]或[6,6]系统。杂环在paquette,leoa.;“principlesofmodernheterocyclicchemistry”(w.a.benjamin,newyork,1968),特别是第1、3、4、6、7和9章;“thechemistryofheterocycliccompounds,aseriesofmonographs”(johnwiley&sons,newyork,1950发行),特别是第13、14、16、19和28卷;和j.am.chem.soc.(1960)82:5566中有述。“杂环基”还包括其中杂环基与饱和的、部分不饱和的环或者芳香性碳环或杂环稠合的基团。杂环的实例包括但不限于:吗啉-4-基、哌啶-1-基、哌啶酮基、氧代哌嗪基、哌嗪基、哌嗪-4-基-2-酮、哌嗪-4-基-3-酮、吡咯烷-1-基、硫代吗啉-4-基、s-二氧代硫代吗啉-4-基、氮杂环辛烷-1-基、氮杂环丁烷-1-基、八氢吡啶并[1,2-a]吡嗪-2-基、[1,4]二氮杂环庚烷-1-基、吡咯烷基、四氢呋喃基、二氢呋喃基、四氢噻吩基、四氢吡喃基、二氢吡喃基、四氢噻喃基、哌啶子基、吗啉代、硫代吗啉代、噻噁烷基、哌嗪基、高哌嗪基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、高哌啶基、氧杂环庚烷基、硫杂环庚烷基、氧氮杂基、二氮杂基、硫氮杂基、2-吡咯啉基、3-吡咯啉基、吲哚啉基、2h-吡喃基、4h-吡喃基、二噁烷基、1,3-二氧戊环基、吡唑啉基、二噻烷基、二硫杂环戊烷基、二氢吡喃基、二氢噻吩基、二氢呋喃基、吡唑烷基、咪唑啉基、咪唑烷基、3-氮杂双环[3.1.0]己基、3-氮杂双环[4.1.0]庚基、氮杂双环[2.2.2]己基、3h-吲哚基、喹嗪基和n-吡啶基脲。螺环基团也包括在此定义的范围内。其中2个环原子被氧代(=o)基团替代的杂环基的实例是嘧啶酮基和1,1-二氧代硫代吗啉基。本文中的杂环基团任选地独立地被本文所述的一个或多个取代基取代。术语“杂芳基”是指5元、6元或7元环的一价芳香性基团,还包括具有5-20个原子的稠合环系统(至少其一是芳香性的),所述5元、6元或7元环的一价芳香性基团和所述稠合环系统含有一个或多个独立地选自氮、氧和硫的杂原子。杂芳基的实例是:吡啶基(包括例如2-羟基吡啶基)、咪唑基、咪唑并吡啶基、嘧啶基(包括例如4-羟基嘧啶基)、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁二唑基、噁唑基、异噻唑基、吡咯基、喹啉基、异喹啉基、四氢异喹啉基、吲哚基、苯并咪唑基、苯并呋喃基、噌啉基、吲唑基、中氮茚基、酞嗪基、哒嗪基、三嗪基、异吲哚基、蝶啶基、嘌呤基、噁二唑基、三唑基、噻二唑基、噻二唑基、呋咱基、苯并呋咱基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、萘啶基和呋喃并吡啶基。杂芳基任选地独立地被本文所述的一种或多种取代基取代。在可能的情况下,所述杂环或杂芳基可以是碳键合的(碳连接的)或氮键合的(氮连接)。作为示例而非限制,碳键合的杂环或杂芳基是在以下位置成键:吡啶的2、3、4、5或6位,哒嗪的3、4、5或6位,嘧啶的2、4、5或6位,吡嗪的2、3、5或6位,呋喃、四氢呋喃、噻吩(thiofuran)、噻吩(thiophene)、吡咯或四氢吡咯的2、3、4或5位,噁唑、咪唑或噻唑的2、4或5位,异噁唑、吡唑或异噻唑的3、4或5位,氮丙啶的2或3位,氮杂环丁烷的2、3或4位,喹啉的2、3、4、5、6、7或8位,或者异喹啉的1、3、4、5、6、7或8位。作为示例而非限制,氮键合的杂环或杂芳基是在以下位置成键:氮丙啶、氮杂环丁烷、吡咯、吡咯烷、2-吡咯啉、3-吡咯啉、咪唑、咪唑烷、2-咪唑啉、3-咪唑啉、吡唑、吡唑啉、2-吡唑啉、3-吡唑啉、哌啶、哌嗪、吲哚、吲哚啉、1h-吲唑的1位,异吲哚或异吲哚啉的2位,吗啉的4位,以及咔唑或β-咔啉的9位。术语“治疗(treat)”和“治疗(treatment)”是指治疗性的处置,其目的是减缓(减轻)不期望的生理学变化或病症,例如关节炎或癌症的形成或扩散。出于本发明的目的,有益或期望的临床结果包括但不限于,缓解症状、缩小疾病的范围、稳定疾病状态(即不恶化)、延迟或减缓疾病进展、改善或缓和疾病状态,以及缓解(无论部分或完全地缓解),无论是可检测的还是不可检测的。“治疗”还可以指与若不接受治疗时的预期存活时间相比延长存活时间。需要治疗的那些包括具有病患或病症的那些。短语“治疗有效量的”是指(i)治疗本文所述的特定的疾病、病况或病症,(ii)减轻、改善或消除所述特定的疾病、病况或病症的一种或多种症状,或者(iii)预防或延迟所述特定的疾病、病况或病症的一种或多种症状的发作的本发明的化合物的量。在癌症的情况中,药物的治疗有效量可以减少癌细胞数量;缩小肿瘤尺寸;抑制(即,在一定程度上减缓而且优选终止)癌细胞侵润进入周围器官中;抑制(即,在一定程度上减缓而且优选终止)肿瘤转移;在一定程度上抑制肿瘤生长;和/或在一定程度上缓解与癌症相关的一种或多种症状。只要药物可防止现存的癌细胞生长和/或杀死现存的癌细胞,它就可以是抑制细胞生长的和/或细胞毒性的。对于癌症治疗,可通过例如评估疾病进展的时间(ttp)和/或测定应答率(rr)来量度效力。“炎性病症”用于本文中可以是指其中过度或失调的炎性反应造成过度的炎性症状、宿主组织损伤或者组织功能丧失的任何疾病、病症或综合征。“炎性病症”也指由白细胞流入和/或中性白细胞趋化介导的病理学状态。“炎症”用于本文中是指由组织的损伤或破坏引发的局部保护性反应,其起到破坏、稀释或屏蔽(隔离)有害物质和受伤组织的作用。炎症明显与白细胞流入和/或中性白细胞趋化相关。炎症可起因于致病生物体和病毒导致的感染,以及诸如外伤或者在心肌梗塞或中风之后再灌注、对外来抗原的免疫反应和自身免疫性反应之类的非感染性途径。因此,顺应式i化合物治疗的炎性病症包括与特异性防御系统的反应以及非特异性防御系统的反应相关的病症。“特异性防御系统”是指对特异性抗原的存在做出反应的免疫系统的组成部分。由特异性防御系统的应答所致的炎症的实例包括对外来抗原的常规应答、自身免疫疾病和由t细胞介导的迟发型超敏反应。特异性防御系统的炎性反应的其它实例还有慢性炎性疾病、对实体移植的组织和器官例如肾移植和骨髓移植的排斥,以及移植物抗宿主疾病(gvhd)。术语“非特异性防御系统”用于本文中是指由不能够免疫记忆的白细胞(例如粒细胞和巨噬细胞)介导的炎性病症。至少部分起因于非特异性防御系统的反应的炎症的实例包括与诸如以下的病症相关的炎症:成人(急性)呼吸窘迫综合征(ards)或者多器官损伤综合征;再灌注损伤;急性肾小球肾炎;反应性关节炎;伴有急性炎性部分的皮肤病;急性化脓性脑膜炎或其它中枢神经系统炎性病症例如中风;热损伤;炎性肠疾病;粒细胞输血相关综合征;和细胞因子引发的中毒。“自身免疫疾病”用于本文中是指其中组织损伤与由体液或细胞介导的对身体自身组成部分的反应相关的任一类病症。“变态反应性疾病”用于本文中是指由变态反应产生的任何症状、组织损伤或组织功能丧失。“关节炎性疾病”用于本文中是指以可归因于各种病因学的关节炎性损伤为特征的任何疾病。“皮炎”用于本文中是指以可归因于各种病因学的皮肤炎症为特征的一大类疾病中的任一种。“移植排斥”用于本文中是指以移植的组织和周围组织功能丧失、疼痛、肿胀、白细胞增多和血小板减少为特征的针对移植的组织例如器官或细胞(例如骨髓)的任何免疫反应。本发明的治疗方法包括用于治疗与炎性细胞激活相关的病症的方法。“炎性细胞激活”是指通过增生性细胞反应的刺激物(包括但不限于细胞因子、抗原或自身抗体)、可溶性介质(包括但不限于细胞因子、氧自由基、酶、前列腺素或血管活性胺)的产生、或者在炎性细胞(包括但不限于单核细胞、巨噬细胞、t淋巴细胞、b淋巴细胞、粒细胞(即多形核白细胞例如中性粒细胞、嗜碱性粒细胞和嗜酸性粒细胞)、肥大细胞、树突细胞、langerhans细胞和内皮细胞)中新的或增量的介质(包括但不限于主要的组织相容性抗原或细胞粘附分子)的细胞表面表达来诱导。本领域技术人员可理解,在这些细胞中的这些表型中的一种或组合的激活可促进炎性病症的引发、永久化或恶化。术语“nsaid”是“"非甾体抗炎药”的首字母缩略词,是具有止痛、退烧(降低身体的高温并且缓解疼痛而不损及知觉)并且在较高剂量下具有抗炎效力(减轻炎症)的治疗剂。术语“非甾体”用来将这些药物与具有相似的降低类二十烷酸、抗炎作用的甾类相区分。作为镇痛药,nsaid的不寻常之处在于它们是非麻醉性的。nsaid包括阿司匹林、布洛芬和萘普生。nsaid通常指定用于治疗其中伴有疼痛和炎症的急性或慢性病症。nsaid一般指定用于在症状上缓解以下病症:类风湿性关节炎、骨性关节炎、炎性关节病(例如强直性脊柱炎、银屑病关节炎、莱特尔综合征、急性痛风、痛经、转移性骨痛、头痛和偏头痛、术后疼痛、因炎症和组织损伤所致的轻度至中度疼痛、发热、肠梗阻和肾绞痛。大多数nsaid用作环氧合酶的非选择性抑制剂,抑制环氧合酶-1(cox-1)和环氧合酶-2(cox-2)同功酶。环氧合酶催化由花生四烯酸(其本身通过磷脂酶a2由细胞磷脂双层而得)形成前列腺素和血栓素。前列腺素尤其在炎症过程中用作信使分子。cox-2抑制剂包括塞来考昔、依托考昔、芦米考昔、帕瑞考昔、罗非考昔、罗非考昔和伐地考昔。术语“癌症”是指或描述哺乳动物中以细胞生长失调为典型特征的生理状况。“肿瘤”包括一种或多种癌细胞。癌症的实例包括但不限于:癌、淋巴瘤、母细胞瘤、肉瘤和白血病或淋巴恶性肿瘤。此类癌症的更具体的实例包括鳞状细胞癌(例如上皮鳞状细胞癌)、包括小细胞肺癌、非小细胞肺癌(“nsclc”)、肺腺瘤和肺鳞癌在内的肺癌、腹膜癌、肝细胞癌、包括胃肠癌在内的胃癌、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、直肠癌、结直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌、前列腺癌、外阴癌、甲状腺癌、肝癌、肛门癌、阴茎癌,以及头颈癌。“化疗剂”是用于治疗癌症的化合物,无论作用机制如何。化疗剂的类别包括但不限于:烷化剂、抗代谢物、纺锤体毒素植物生物碱、细胞毒性/抗肿瘤抗生素、拓扑异构酶抑制剂、抗体、光敏剂和激酶抑制剂。化疗剂包括用于“靶向治疗”和常规化疗中的化合物。化疗剂的实例包括:厄洛替尼(genentech/osipharm.)、多西他赛(sanofi-aventis)、5-fu(氟尿嘧啶,5-氟尿嘧啶,cas号51-21-8)、吉西他滨(lilly)、pd-0325901(cas号391210-10-9,pfizer)、顺铂(顺-二胺,二氯化铂(ii),cas号15663-27-1)、卡铂(cas号41575-94-4)、紫杉醇(bristol-myerssquibboncology,princeton,n.j.)、曲司珠单抗(genentech)、替莫唑胺(4-甲基-5-氧代-2,3,4,6,8-五氮杂双环[4.3.0]壬-2,7,9-三烯-9-甲酰胺,cas号85622-93-1,scheringplough)、他莫昔芬((z)-2-[4-(1,2-二苯基丁-1-烯基)苯氧基]-n,n-二甲基乙胺,)和多柔比星()、akti-1/2、hppd和雷帕霉素。化疗剂的更多实例包括:奥沙利铂(sanofi)、硼替佐米(millenniumpharm.)、sutent(su11248,pfizer)、来曲唑(novartis)、伊马替尼甲磺酸盐(novartis)、xl-518(mek抑制剂,exelixis,wo2007/044515)、arry-886(mek抑制剂,azd6244,arraybiopharma,astrazeneca)、sf-1126(pi3k抑制剂,semaforepharmaceuticals)、bez-235(pi3k抑制剂,novartis)、xl-147(pi3k抑制剂,exelixis)、ptk787/zk222584(novartis)、氟维司群(astrazeneca)、亚叶酸钙(亚叶酸)、雷帕霉素(西罗莫司,wyeth)、拉帕替尼(gsk572016,glaxosmithkline)、氯那法尼(sarasartm,sch66336,scheringplough)、索拉非尼(bay43-9006,bayerlabs)、吉非替尼(astrazeneca)、伊立替康(cpt-11,pfizer)、替吡法尼(tipifarnib)(zarnestratm,johnson&johnson)、abraxanetm(cremophor-free)、紫杉醇的白蛋白工程化纳米颗粒制剂(americanpharmaceuticalpartners,schaumberg,il)、凡德他尼(rinn,zd6474,astrazeneca)、苯丁酸氮芥(chloranmbucil)、ag1478、ag1571(su5271;sugen)、坦罗莫司(wyeth)、帕唑帕尼(glaxosmithkline)、坎磷酰胺(telik)、塞替派和环磷酰胺();烷基磺酸酯例如白消安、英丙舒凡和哌泊舒凡;氮丙啶例如苯佐替派(benzodopa)、卡波醌、美妥替哌(meturedopa)和乌瑞替派(uredopa);乙烯亚胺和甲基三聚氰胺类(methylamelamine)包括六甲蜜胺、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺;己酸配质(acetogenin)(特别是布拉它辛(bullatacin)和布拉它辛酮(bullatacinone));喜树碱(包括合成类似物托泊替康);苔藓抑素;海绵多烯酮类;cc-1065(包括它的阿多来新、卡折来新和比折来新合成类似物);隐藻素(特别是隐藻素1和隐藻素8);多拉司他汀;duocarmycin(包括合成类似物,kw-2189和cb1-tm1);艾榴素(eleutherobin);pancratistatin;sarcodictyin;海绵素;氮芥例如苯丁酸氮芥、萘氮芥、氯磷酰胺(chlorophosphamide)、雌莫司汀、异环磷酰胺、氮芥、盐酸氧氮芥、美法仑、新氮芥、苯芥胆甾醇、泼尼莫司汀、曲磷胺、尿嘧啶氮芥;亚硝基脲类例如卡莫司汀、氯脲菌素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀(ranimnustine);抗生素类例如烯二炔抗生素类(例如刺孢霉素、刺孢霉素γ1i、刺孢霉素ωi1(angewchem.intl.ed.engl.(1994)33:183-186);dynemicin、dynemicina;二膦酸盐类例如氯膦酸盐;埃斯波霉素;以及新制癌菌素发色团和相关的色蛋白烯二炔抗生素发色团)、阿克拉霉素、放线菌素、authramycin、偶氮丝氨酸、博来霉素、放线菌素c、carabicin、去甲柔红霉素、嗜癌霉素、色霉素(chromomycinis)、放线菌素d、柔红霉素、地托比星、6-重氮基-5-氧代-l-正亮氨酸、吗啉代-多柔比星、氰基吗啉代-多柔比星、2-吡咯啉-多柔比星和脱氧多柔比星)、表柔比星、依索比星、伊达比星、奈柔比星、马塞罗霉素、丝裂霉素类例如丝裂霉素c、麦考酚酸、诺拉霉素、橄榄霉素、培洛霉素、泊非霉素、嘌罗霉素、三铁阿霉素、罗多比星、链黑霉素、链佐星、杀结核菌素、乌苯美司、净司他丁、佐柔比星;抗代谢物例如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物例如二甲叶酸、甲氨蝶呤、蝶罗呤、三甲曲沙;嘌呤类似物例如氟达拉滨、6-巯嘌呤、硫咪嘌呤、硫代鸟嘌呤;嘧啶类似物例如安西他滨、阿扎胞苷、6-氮杂尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、去氧氟尿苷、依诺他滨、氟尿苷;雄性激素例如卡普睾酮、丙酸屈他雄酮、环硫雄醇、美雄烷、睾内酯;抗肾上腺类例如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂例如frolinicacid;醋葡醛内酯;丙醛氧基磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;bestrabucil;比生群;依达曲沙;地磷酰胺(defofamine);秋水仙胺;地吖醌;elfornithine;依利醋铵;埃坡霉素;依托格鲁;硝酸镓;羟基脲;香菇多糖;氯尼达明(lonidainine);美坦生类例如美坦生和安丝菌素;米托胍腙;米托蒽醌;莫哌达醇;尼曲吖啶(nitraerine);喷司他丁;蛋氨氮芥;吡柔比星;洛索蒽醌;鬼臼酸;2-乙基酰肼;丙卡巴肼;多糖复合物(jhsnaturalproducts,eugene,or);雷佐生;利索新;西佐喃;锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2’,2”-三氯三乙胺;单端孢霉烯类(特别是t-2毒素、verracurina、杆孢菌素a和蛇形菌素);乌拉坦;长春地辛;达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;gacytosine;阿拉伯糖苷(“ara-c”);环磷酰胺;塞替派;6-硫代鸟嘌呤;巯嘌呤;甲氨蝶呤;铂类似物例如顺铂和卡铂;长春碱;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨诺安托;替尼泊苷;依达曲沙;道诺霉素;氨蝶呤;卡培他滨(roche);伊班膦酸盐;cpt-11;拓扑异构酶抑制剂rfs2000;二氟甲基鸟氨酸(dmfo);类维生素a例如视黄酸;以及上述任一种的药学可接受的盐、酸和衍生物。“化疗剂”的定义还包括:(i)用来调节或抑制激素对肿瘤的作用的抗激素药例如抗雌激素和选择性雌激素受体调节剂(serm),包括例如他莫昔芬(包括他莫昔芬柠檬酸盐)、雷洛昔芬、屈洛昔芬、4-羟基他莫昔芬、曲沃昔芬、雷洛昔芬、ly117018、奥那司酮和(枸橼酸托瑞米芬);(ii)抑制调节肾上腺中的雌激素生成的芳香酶的芳香酶抑制剂,例如4(5)-咪唑、氨鲁米特、(醋酸甲地孕酮)、(依西美坦;pfizer)、福美坦、法罗唑、(伏罗唑)、(来曲唑;novartis)和(阿那罗唑;astrazeneca);(iii)抗雄激素类,例如氟他胺、尼鲁米特、比卡鲁胺、亮丙瑞林和戈舍瑞林;以及曲沙他滨(1,3-二氧戊环胞嘧啶核苷类似物);(iv)蛋白激酶抑制剂,例如mek抑制剂(wo2007/044515);(v)脂质激酶抑制剂;(vi)反义寡核苷酸,特别是抑制与异常的细胞增殖相关的信号转导途径中的基因例如pkc-α、raf和h-ras的表达那些,例如奥利美生(gentainc.);(vii)核酶,例如vegf表达抑制剂(例如)和her2表达抑制剂;(viii)疫苗,例如基因治疗疫苗,例如和ril-2;拓扑异构酶1抑制剂,例如rmrh;(ix)抗血管生成剂,例如贝伐珠单抗(genentech);以及上述任一种的药学可接受的盐、酸和衍生物。“化疗剂”的定义还包括治疗性抗体,例如阿仑珠单抗(campath)、贝伐珠单抗(genentech);西妥昔单抗(imclone);帕木单抗(amgen)、利妥昔单抗(genentech/biogenidec)、培妥珠单抗(omnitargtm,2c4,genentech)、曲司珠单抗(genentech)、托西莫单抗(bexxar,corixia),以及抗体药物缀合物,吉妥珠单抗奥加米星(wyeth)。与本发明的btk抑制剂联用的、作为化疗剂的具有治疗效力的人源化单克隆抗体包括:阿仑珠单抗、阿泊珠单抗、阿塞珠单抗、atlizumab、巴匹珠单抗、贝伐珠单抗、比伐珠单抗美登素(bivatuzumabmertansine)、美坎珠单抗美登素(cantuzumabmertansine)、西利珠单抗、培舍珠单抗、cidfusituzumab、cidtuzumab、达克珠单抗、依库珠单抗、依法珠单抗、依帕珠单抗、厄利珠单抗、泛维珠单抗、芳妥珠单抗、吉妥珠单抗奥加米星、伊珠单抗奥佐米星、伊匹木单抗、拉贝珠单抗、林妥珠单抗、马妥珠单抗、美泊珠单抗、莫维珠单抗、motovizumab、那他珠单抗、尼妥珠单抗、nolovizumab、numavizumab、奥瑞珠单抗、奥马珠单抗、帕利珠单抗、帕考珠单抗、pecfusituzumab、pectuzumab、培妥珠单抗、培克珠单抗、ralivizumab、雷珠单抗、瑞利珠单抗(reslivizumab)、瑞利珠单抗、resyvizumab、罗维珠单抗、卢利珠单抗、西罗珠单抗、西利珠单抗、松妥珠单抗、他珠单抗替塞坦、他度珠单抗、他利珠单抗、替非珠单抗、托珠单抗、托利珠单抗、曲司珠单抗、西莫白介素单抗、tucusituzumab、umavizumab、乌珠单抗,以及维西珠单抗。“代谢物”是特定的化合物或其盐通过体内代谢产生的产物。化合物的代谢物可利用本领域已知的常规技术进行鉴定并且可利用诸如本文中所述的那些试验测定它们的活性。这样的产物可由例如被给药的化合物的氧化、还原、水解、酰胺化、脱酰胺化、酯化、脱脂化、酶解等产生。因此,本发明包括本发明的化合物的代谢物,包括通过包括使本发明的式i化合物与哺乳动物接触足以产生其代谢产物的时间段的方法产生的化合物。术语“包装说明书”用来指治疗性产品的商业包装中通常包含的说明书,其包含关于适应症、用途、剂量、给药、与此类治疗性产品的使用相关的禁忌症和/或警告的信息。术语“手性”是指具有镜像对的不可重叠性的分子,而术语“非手性”是指可在它们的镜像对上重叠的分子。术语“立体异构体”是指具有相同的化学组成但原子或基团的空间排列不同的化合物。“非对映异构体”是指具有两个或多个手性中心并且其分子彼此不互为镜像的立体异构体。非对映异构体具有不同的物理性质,例如熔点、沸点、光谱性质和反应性。非对映异构体的混合物可通过高分辨率的分析方法例如电泳法和色谱法进行分离。“对映异构体”是指化合物的彼此呈不可重叠的镜像的两种立体异构体。本文中所用的立体化学定义和规则一般遵循s.p.parker,ed.,mcgraw-hilldictionaryofchemicalterms(1984)mcgraw-hillbookcompany,newyork;和eliel,e.和wilen,s.,“stereochemistryoforganiccompounds”,johnwiley&sons,inc.,newyork,1994。本发明的化合物可包含非对称的或手性的中心,因此以不同的立体异构体形式存在。本发明的化合物的所有立体异构体形式,包括但不限于其非对映异构体、对映异构体和阻转异构体以及它们的混合物例如外消旋混合物,意在构成本发明的一部分。许多有机化合物以旋光形式存在,即,它们具有使平面偏振光的平面旋转的能力。在表述旋光化合物时,前缀d和l,或者r和s,用来表示分子的手性中心的绝对构型。前缀d和l或者(+)和(-)用来指示化合物使平面偏振光旋转的符号,其中(-)或1是指化合物是左旋的。具有前缀(+)或d的化合物是右旋的。对于特定的化学结构,这些立体异构体是相同的,只是它们彼此互为镜像。特定的立体异构体还可称为对映异构体,并且这样的异构体的混合物常称为对映异构体混合物。对映异构体的50:50混合物称为外消旋混合物或外消旋物,其可在化学反应或过程没有立体选择性或立体专一性的情况下出现。术语“外消旋混合物”和“外消旋物”是指两种对映异构体的等摩尔混合物,不具有旋光性。在一方面,本发明的立体异构体可以占主导的形式存在,例如,大于50%ee(对映体过量),大于80%ee,大于90%ee,大于95%ee,或者大于99%ee。术语“互变异构体”或“互变异构体形式”是指可通过低能垒互相转化的能量不同的结构异构体。例如,质子互变异构体(也称为质子转移互变异构体)包括通过质子迁移互相转化,例如酮-烯醇和亚胺-烯胺异构化。价键互变异构体包括通过一些成键电子的重组互相转化。术语“非对映异构体”是指不是对映异构体的立体异构分子。非对映异构体包括具有相同的分子式但几何结构不同的顺-反异构体和构象异构体。术语“药学可接受的盐”用于本文中是指本发明的化合物的药学可接受的有机或无机盐。示例性的盐包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖质酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和扑酸盐(即1,1’-亚甲基-双(2-羟基-3-萘甲酸盐))。药学可接受的盐可包括诸如乙酸根离子、琥珀酸根离子或其它反荷离子的另一种分子的包合。所述反荷离子可以是使母体化合物上的电荷稳定的任何有机或无机离子。此外,药学可接受的盐在其结构中可具有多于一个带电荷的原子。多个带电荷的原子为药学可接受的盐的部分的情况可具有多个反荷离子。因此,药学可接受的盐可具有一个或多个带电荷的原子和/或一个或多个反荷离子。若本发明的化合物是碱,期望的药学可接受的盐可通过本领域中可利用的任何适合的方法制备,例如,用无机酸例如盐酸、氢溴酸、硫酸、硝酸、甲磺酸、磷酸等或者用有机酸例如乙酸、三氟乙酸、马来酸、琥珀酸、扁桃酸、富马酸、丙二酸、丙酮酸、草酸、乙醇酸、水杨酸、吡喃糖苷基酸例如葡糖醛酸或半乳糖醛酸、α-羟基酸例如柠檬酸或酒石酸、氨基酸例如天冬氨酸或谷氨酸、芳香酸例如苯甲酸或肉桂酸、磺酸例如对甲基苯磺酸或乙磺酸等处理游离的碱。若本发明的化合物是酸,期望的药学可接受的盐可通过任何适合的方法制备,例如,用无机碱或有机碱例如胺(伯胺、仲胺或叔胺)、碱金属氢氧化物或碱土金属氢氧化物等处理游离的酸。适合的盐的示例性实例包括但不限于,得自氨基酸例如甘氨酸和精氨酸、氨、伯胺、仲胺和叔胺以及环胺例如哌啶、吗啉和哌嗪的有机盐,以及得自钠、钙、钾、镁、锰、铁、铜、锌、铝和锂的无机盐。术语“药学可接受的”是指物质或组合物必须与构成制剂的其它组分和/或用其治疗的哺乳动物在化学和/或毒理学上相容。“溶剂化物”是指一个或多个溶剂分子与本发明的化合物的缔合或络合。形成溶剂化物的溶剂的实例包括但不限于水、异丙醇、乙醇、甲醇、dmso、乙酸乙酯、乙酸和乙醇胺。术语“本发明的化合物”包括式i的化合物及其立体异构体、互变异构体、溶剂化物、代谢物和药学可接受的盐及前药。本文中所示的任何分子式或结构,包括式i化合物在内,还意在表示这些化合物的水合物、溶剂化物和多晶型物,及其混合物。本文中所示的任何式或结构,包括式i化合物在内,还意在表示所述化合物的未标记形式和同位素标记的形式。同位素标记的化合物具有本文给出的分子式所示的结构,除了一个或多个原子被具有选定原子质量或质量数的原子替代。本发明的化合物中可包含的同位素的实例包括氢、碳、氮、氧、磷、氟和氯的同位素,例如,但不限于2h(氘,d)、3h(氚)、11c、13c、14c、15n、18f、31p、32p、35s、36cl和125i。各种同位素标记的本发明的化合物,例如,其中包含诸如3h、13c和14c的放射性同位素的那些。这样的同位素标记的化合物可用于代谢研究、反应动力学研究、检测或显像技术,例如正电子发射断层摄影术(pet)或单光子发射断层摄影术(spect),包括药物或底物组织分布测定,或者用于患者的放射性治疗。本发明的氘标记的或取代的治疗性化合物可具有改进的有关分布、代谢和排泄(adme)的dmpk(药物代谢和药物动力学)性质。用较重的同位素例如氘取代可能由于较大的代谢稳定性而提供某些治疗优点,例如,体内半衰期增长,或者剂量要求减小。18f标记的化合物可用于pet或spect研究。本发明的同位素标记的化合物及其前药一般可通过实施路线或实施例中公开的方法和下述制备方法,以易得的同位素标记的试剂替代非同位素标记的试剂进行制备。此外,用较重的同位素特别是氘(即2h或d)取代可由于较大的代谢稳定性而提供某些治疗优点,例如,体内半衰期增长或者剂量要求减小或者治疗指数改进。应理解,在此情况中氘被视为式(i)的化合物中的取代基。可通过同位素富集系数定义这样的较重的同位素特别是氘的浓度。在本发明的化合物中,未明确指明为特定同位素的任何原子意在表示该原子的任何稳定的同位素。除非另外说明,当明确以“h”或“氢”标明某位置时,应理解为该位置具有其天然丰度同位素组成的氢。因此,在本发明的化合物中,明确标明氘(d)的任何原子意在表示氘。吡啶酮和氮杂吡啶酮化合物本发明提供包括式ia-bf在内的式i的吡啶酮和氮杂吡啶酮化合物,包括其立体异构体、互变异构体或药学可接受的盐,及其药物制剂,其有效地用于治疗由btk激酶介导的疾病、病况和/或病症其中:r1是h、d、f、cl、cn、-nh2、-nhch3、-n(ch3)2、-oh、-och3、-och2ch3、-och2ch2oh、选自咪唑基和吡唑基的杂芳基、选自氧杂环丁烷基和氮杂环丁烷基的杂环基,以及c1-c3烷基;r2、r3和r4独立地选自h、d、f、cl、-nh2、-nhch3、-n(ch3)2、-oh、-och3、-och2ch3、-och2ch2oh和c1-c3烷基;r5是任选取代的c6-c20芳基、c3-c12碳环基、c2-c20杂环基、c1-c20杂芳基、-(c6-c20芳基)-(c2-c20杂环基)、-(c1-c20杂芳基)-(c2-c20杂环基)、-(c1-c20杂芳基)-(c1-c6烷基)或-(c1-c20杂芳基)-c(=o)-(c2-c20杂环基);r6是h、f、-nh2、-oh、或者任选取代的c1-c3烷基;x是s、s(=o)、s(=o)2、n、nr6、o或cr7;r7独立地选自h、d、f、cl、-ch3、-ch2ch3、-cn、-ch2f、-chf2、-cf3、-nh2、-oh和-och3;y1和y2独立地选自cr6和n;z1、z2、z3和z4独立地选自c、cr7和n;z5选自-c(r3)2-、-c(=o)-、-n(r6)-、-c(r3)2c(r3)2-、-c(r3)2c(=o)-、-cr3=cr3-、-cr3=n-、-n(r6)c(r3)2-、-n(r6)c(r3)2c(r3)2-和-oc(r3)2c(r3)2-;z1和z2或者x和z1中的一对形成五元、六元或七元芳基环、碳环基环、杂环基环或杂芳基环,其中x不是s、s(=o)或s(=o)2;其中烷基、碳环基、杂环基、芳基和杂芳基任选地被独立选自d、f、cl、br、i、-ch3、-ch2ch3、-ch2ch(ch3)2、-ch2oh、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-cn、-ch2f、-chf2、-cf3、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-con(ch3)2、-c(ch3)2conh2、-no2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、=o、-oh、-och3、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-ch2och3、-s(o)2ch3、环丙基、氮杂环丁烷基、1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、氧杂环丁烷基和吗啉代中的一个或多个基团取代。在一方面中,式i化合物是3-氨基-5-苯基吡啶-2(1h)-酮ia(其中y1和y2是cr6)、4-氨基-6-苯基哒嗪-3(2h)-酮ib(其中y1是n并且y2是cr6),以及3-氨基-5-苯基吡嗪-2(1h)-酮ic(其中y1是cr6并且y2是n)。式i化合物的示例性实施方案包括式ia-ibf的化合物:式i化合物的示例性实施方案包括,其中基团形成以下结构:其中波浪线表示连接点。式i化合物的示例性实施方案包括,其中中心的苯环基是取代的或未被取代的,例如:(i)r1、r2、r3和r4各自是h;(ii)或者r1、r2、r3和r4中的一个或多个是f;(iii)r1选自f、-ch3、-ch2f、-chf2和-cf3;(iv)r1是-ch2oh;(v)r3是f;和(vi)r1是-ch2oh,r2和r4各自是h,并且r3是f。式i化合物的示例性实施方案包括,其中r5是任选取代的选自苯基和萘基的c6-c20芳基。式i化合物的示例性实施方案包括,其中r5是任选取代的选自环丙基、环丁基、环戊基、环己基和环庚基的c3-c12碳环基。式i化合物的示例性实施方案包括,其中r5是任选取代的选自氧杂环丁烷基、氮杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、哌嗪基、吗啉基和四氢吡喃基的c2-c20杂环基。式i化合物的示例性实施方案包括,其中r5是任选取代的选自吡唑基、吡啶基、嘧啶基、5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基、5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基、6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基和1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基的c1-c20杂芳基。式i化合物的示例性实施方案包括,其中r5选自以下结构:其中波浪线表示连接点。式i化合物的示例性实施方案包括,其中r6是h。式i化合物的示例性实施方案包括,其中y1是cr6并且y2是n。式i化合物的示例性实施方案包括,其中y1是n并且y2是cr6。式i化合物的示例性实施方案包括,其中y1和y2各自是cr6。在式i化合物的结构中,在由x、z1、z2、z3和z4形成的五元环中,每条实线/虚线表示单键或双键,条件是在所述环中的任何两个双键不相邻。本发明的式i化合物可包含不对称中心或手性中心,因而以不同的立体异构体形式存在。本发明化合物的所有立体异构体形式,包括但不限于其非对映异构体、对映异构体和阻转异构体以及它们的混合物例如外消旋混合物,意在构成本发明的一部分。此外,本发明涵盖所有的非对映异构体,包括顺-反(几何)异构体和构象异构体。例如,若式i化合物包含双键或稠合环,则顺式和反式形式以及其混合物被涵盖在本发明的范围内。在本文所示的结构中,若未指明任何具体手性原子的立体化学,则所有的立体异构体被视为并被包含为本发明的化合物。若以表示具体构型的楔形实线或虚线指明立体化学,则如此指明和定义该立体异构体。本发明的化合物可以未溶剂化的形式、以及用药学可接受的溶剂例如水、乙醇等溶剂化的形式存在,并且本发明意在涵盖溶剂化的和未溶剂化的形式。本发明的化合物还可以不同的互变异构体形式存在,并且所有这样的形式都被涵盖在本发明的范围内。术语“互变异构体”或“互变异构体形式”是指通过低能垒可互相转变的能量不同的结构异构体。例如,质子互变异构体(也称为质子转移互变异构体)包括通过质子的迁移互相转化,例如酮-烯醇和亚胺-烯胺异构化。价键互变异构体包括通过一些成键电子的重组互相转化。生物学评价可通过测定每种化合物将活性抑制到预定程度时的浓度而后将结果对比来确定式i化合物作为酶活性(或其它生物活性)的抑制剂的相对效力。通常,优选测定的是在生化测定中抑制50%的活性时的浓度,即,50%抑制浓度或“ic50”。可利用本领域已知的常规技术完成ic50值的测定。一般可通过测量特定酶在一系列浓度的待研究的抑制剂存在下的活性来确定ic50。然后以实验获得的酶活性值对所用的抑制剂浓度作图。将显示50%酶活性(与不存在任何抑制剂时的活性相比)时的抑制剂浓度作为ic50值。类似地,可通过适当地测定活性来确定其它的抑制浓度。例如,在一些情况中可能期望确定90%抑制浓度,即ic90等。通过标准生化btk激酶测定来测试式i化合物(实施例901)。可用来测试式i化合物的标准细胞btk激酶测定的一般方法是ramos细胞btk测定(实施例902)。标准细胞b细胞增殖测定可用来以从balb/c小鼠脾纯化的b细胞测试式i化合物(实施例903)。标准t细胞增殖测定可用来以从balb/c小鼠脾纯化的t细胞测试式i化合物(实施例904)。为了抑制b细胞活性,可以用从8-16周龄的balb/c小鼠脾纯化的全小鼠脾细胞对式i化合物进行cd86抑制测定(实施例905)。为了测定在培养物中存活的b-all细胞的数量,可以对式i化合物对进行b-all细胞存活测定(实施例906)。为了测定化合物抑制由人全血中受具有羊f(ab’)2抗-人igm的交联表面igm激活的b淋巴细胞产生的cd69的能力,可以对式i化合物进行cd69全血测定(实施例907)。按照本发明的方法制备和表征了表1、2和3中示例性的式i化合物,并且测试了它们对btk的抑制,所述示例性的式i化合物其具有以下结构和相应的名称(chemdrawultra,9.0.1版,和chembiodraw,11.0版,cambridgesoftcorp.,cambridgema)。在多于一种名称与式i化合物或中间体相关的情况中,应以化学结构定义该化合物。表1.表2.表3.式i化合物的给药本发明的化合物可通过适合于要治疗的病症的任何途径给药。适合的途径包括口服、肠胃外(包括皮下、肌内、静脉内、动脉内、皮内、鞘内和硬脑膜外)、透皮、直肠、鼻、局部(包括含服和舌下)、阴道、腹膜内、肺内和鼻内。为了局部免疫抑制治疗,可通过损伤区内给药(包括灌注或者在移植前使抑制剂接触移植物)来给药所述化合物。应理解,优选的途径可随着例如接受者的状况而改变。在口服给药所述化合物的情况中,可将其与药学可接受的载体或赋形剂一起制备成丸剂、胶囊剂、片剂等。在通过肠胃外给药所述化合物的情况中,如下所详述的,可将其与药学可接受的肠胃外载体一起以单位剂量可注射形式配制。治疗人类患者的剂量可以为约10mg至约1000mg的式i化合物。典型的剂量可以是约100mg至约300mg的所述化合物。取决于具体化合物的包括吸收、分布、代谢和排泄在内的药物代谢动力学和药效学性质,剂量可以每天一次(qid)、每天两次(bid)或更频繁地给药。此外,毒性因素可影响剂量和给药方案。当口服给药时,可每天或频度较小地吞服丸剂、胶囊或片剂,持续规定的时间段。可持续数个治疗周期地重复所述方案。用式i化合物治疗的方法本发明的式i化合物用于治疗患有起因于与btk激酶相关的异常的细胞生长、功能或行为的疾病或病症的人或动物患者,所述疾病或病症是例如免疫性病症、心血管疾病、病毒感染、炎症、代谢/内分泌障碍或神经病,因此可通过包括向其给药如上定义的本发明的化合物的方法来治疗。患有癌症的人或动物患者还可通过包括向其给药如上定义的本发明的化合物的方法来治疗。由此可改进或改善所述患者的病况。式i化合物可用于在体外、原位或体内诊断或治疗哺乳动物细胞、生物体或相关的病理状态,例如系统性和局部性炎症、免疫炎性疾病例如类风湿性关节炎、免疫抑制、器官移植排斥、变态反应、溃疡性结肠炎、克罗恩病、皮炎、哮喘、系统性红斑狼疮、斯耶格伦综合征、多发性硬化、硬皮病/系统性硬化病、特发性血小板减少性紫癜(itp)、抗中性粒细胞胞质抗体(anca)血管炎、慢性阻塞性肺病(copd)、银屑病,以及总体关节保护效力。本发明的方法还包括治疗疾病例如:关节疾病例如类风湿性关节炎、单关节关节炎、骨性关节炎、痛风性关节炎、脊椎炎;贝切特病;脓毒症、败血症性休克、内毒素性休克、革兰阴性脓毒症、革兰阳性脓毒症和中毒性休克综合征;败血病继发性多器官损伤综合征、外伤或出血;眼病例如变态反应性结膜炎、春季结膜炎、葡萄膜炎以及甲状腺相关的眼病;嗜酸性细胞肉芽肿;肺部或呼吸道病症例如哮喘、慢性支气管炎、变态反应性鼻炎、ards、慢性肺部炎性疾病(例如慢性阻塞性肺病)、矽肺、肺结节病、胸膜炎、肺泡炎、血管炎、肺气肿、肺炎、支气管扩张和肺型氧中毒;心肌、脑或肢端的再灌注损伤;纤维化例如囊性纤维化;瘢痕疙瘩形成或疤痕组织形成;动脉粥样硬化;自身免疫疾病例如系统性红斑狼疮(sle)、自身免疫性甲状腺炎、多发性硬化、糖尿病的一些形式和雷诺综合征;以及移植排斥性病症例如gvhd和同种异体移植物排斥;慢性肾小球肾炎;炎性肠病例如慢性炎性肠病(cibd)、克罗恩病、溃疡性结肠炎和坏死性小肠结肠炎;炎性皮肤病例如接触性皮炎、特应性皮炎、银屑病或风疹;起因于感染的发烧和肌痛;中枢或周围神经系统炎性病症例如脑膜炎、脑炎以及起因于较轻外伤的脑或脊髓损伤;斯耶格伦综合征;涉及白细胞渗出的疾病;酒精性肝炎;细菌性肺炎;抗原-抗体复合物介导的疾病;低血容量性休克;i型糖尿病;急性和迟发性超敏反应;起因于白细胞恶液质和转移的病况;热损伤;粒细胞输血相关的综合征;以及细胞因子诱导的中毒。本发明的方法可用于治疗受到或可能受到再灌注损伤(即,由组织或器官经受一段时间的缺血而后再灌注的情形造成的损伤)的对象。术语“缺血”是指由阻塞动脉血的流入导致的局部组织贫血。短暂缺血而后再灌注特征性地导致中性粒细胞激活并移形经过受影响区域中的血管的内皮。被激活的中性粒细胞的积累转而导致产生反应性氧代谢物,其损害相关组织或器官的组成部分。“再灌注损伤”的这种现象通常与诸如血管中风(包括全脑缺血和病灶缺血)、出血性休克、心肌缺血或梗死形成、器官移植和脑血管痉挛之类的病症相关。举例说明,再灌注损伤发生在心脏搭桥手术结束时或者发生在心脏停博的过程中(当曾被阻止接受血液的心脏开始再灌注时)。据预期,对btk活性的抑制可导致在这样的情形中再灌注损伤的量减小。药物制剂为了将本发明的化合物用于治疗包括人在内的哺乳动物,通常遵照标准药学方法将其制备成药物组合物。根据本发明的此方面,提供药物组合物,其包含本发明的化合物和药学可接受的稀释剂或载体。典型的制剂是通过将本发明的化合物与载体、稀释剂或赋形剂混合进行制备的。适合的载体、稀释剂和赋形剂为本领域技术人员公知,并且包括例如糖类、蜡、水溶性和/或水溶胀性聚合物、亲水性或疏水性材料、明胶、油、溶剂、水等材料。所用的具体的载体、稀释剂或赋形剂取决于应用本发明的化合物的途径和目的。一般根据本领域技术人员公认为施用于哺乳动物是安全(gras)的溶剂来选择溶剂。一般安全的溶剂是无毒性的水性溶剂例如水及其它可溶于或混溶于水中的无毒性溶剂。适合的水性溶剂包括水、乙醇、丙二醇、聚乙二醇(例如peg400、peg300)等,以及其混合物。所述制剂还可包含一种或多种缓冲剂、稳定剂、表面活性剂、湿润剂、润滑剂、乳化剂、助悬剂、防腐剂、抗氧化剂、避光剂、助流剂、加工助剂、着色剂、甜味剂、芳香剂、矫味剂及其它已知的添加剂,以赋予药物(即本发明的化合物或其药物组合物)雅致的外观或者有助于药学产品(即药品)的生产。所述制剂可利用常规的溶解和混合方法进行制备。例如,将大批药物物质(即本发明的化合物或该化合物的稳定形式(例如与环糊精衍生物或其它已知的络合剂形成的络合物))在一种或多种上述赋形剂存在下溶于适合的溶剂中。通常将本发明的化合物制备成药学剂型,以容易地控制药物剂量并且使患者能够顺从处方的治疗方案。施用的药物组合物(或制剂)可以多种方式包装,取决于给药该药物所采用的方法。通常用于分配的制品包括其中放置有适当形式的药物制剂的容器。适合的容器是本领域技术人员公知的,并且包括诸如瓶(塑料和玻璃)、小袋、安瓿、塑料袋、金属筒等之类的材料。所述容器还可包括防感染的装置以防不慎触及包装的内容物。此外,所述容器在其上置有说明该容器的内容物的标签。所述标签还可包括适当的警示。可针对各种给药途径和类型制备本发明化合物的药物制剂。例如,可将具有期望纯度的式i化合物任选地与药学可接受的稀释剂、载体、赋形剂或稳定剂(remington’spharmaceuticalsciences(1980)第16版,osol,a.ed.)混合成冻干制剂、粉碎的散剂或水溶液剂的形式。可通过在环境温度下,在适当的ph下,以期望的纯度与生理学可接受的载体(即在所用的剂量和浓度下对接受者无毒性的载体)一起混合进行制备。所述制备的ph主要取决于具体的用途和化合物的浓度,但是可以是约3-约8。在ph5的乙酸盐缓冲剂中制备是一个适合的实施方案。所述化合物通常可以固体组合物、冻干制剂或水溶液的形式储藏。本发明的药物组合物可以遵循优质医疗规范的方式(即,给药的量、浓度、时间安排、疗程、载体以及途径)进行制备、服用和给药。在此情况中要考虑的因素包括:要治疗的具体病症、要治疗的具体哺乳动物、各个患者的临床状况、病症的起因、药剂的递送部位、给药方法、给药时间安排以及开业医生所知的其它因素。要给药的化合物的“治疗有效量”取决于这些的考虑因素,并且是改善或治疗过度增殖性病症所需的最小量。作为一般的建议,每剂肠胃外给药的抑制剂的初始药学有效量可以是约0.01-100mg/kg,即每天约0.1-20mg/kg患者体重,其中所用化合物的一般初始范围是0.3-15mg/kg/天。可接受的稀释剂、载体、赋形剂和稳定剂是在所用的剂量和浓度下对接受者无毒性的,并且包括缓冲剂例如磷酸盐、柠檬酸盐及其它有机酸;包括抗坏血酸和蛋氨酸在内的抗氧化剂;防腐剂(例如十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苄醇;烷基对羟基苯甲酸酯例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)多肽;蛋白质例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物例如聚乙烯基吡咯烷酮;氨基酸例如甘氨酸、谷氨酸、天冬酰胺、组氨酸、精氨酸或赖氨酸;包括葡萄糖、甘露糖或糊精在内的单糖、二糖以及其它糖类;螯合剂例如edta;糖类例如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐的反荷离子例如钠;金属复合物(例如zn-蛋白复合物);和/或非离子型表面活性剂例如tweentm、pluronicstm或聚乙二醇(peg)。在胶体药物递送系统(例如脂质体、白蛋白微球、微乳、纳米颗粒和纳米胶囊)或者粗乳液(macroemulsion)中,还可将所述活性药学成分分别包封在通过例如凝聚技术或界面聚合制得的微胶囊(例如羟甲基纤维素微胶囊或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)中。这样的技术公开在remington’spharmaceuticalsciences第16版,osol,a.ed.(1980)中。可以制备式i化合物的缓释制剂。缓释制剂的适合的实例包括含有式i化合物的固体疏水性聚合物的半透性基质,所述基质是成型的制品例如膜或微胶囊的形式。缓释基质的实例包括聚酯、水凝胶(例如聚(2-羟基乙基甲基丙烯酸酯)或聚(乙烯醇))、聚乳酸(us3773919)、l-谷氨酸和γ-乙基-l-谷氨酸酯的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物例如luprondepottm(包含乳酸-乙醇酸共聚物和亮丙瑞林乙酸盐的可注射的微球)和聚-d-(-)-3-羟基丁酸。所述制剂包括适合于本文所述的给药途径的那些。所述制剂可以方便地采用单位剂量形式,并且可以通过药剂学领域公知的任何方法进行制备。技术和制剂一般在remington’spharmaceuticalsciences(mackpublishingco.,easton,pa)中查到。这样的方法包括使活性成分与构成一种或多种辅助成分的载体结合的步骤。通常通过使所述活性成分与液体载体、粉碎的固体载体或此二者均匀且紧密地结合而后任选地使产品成型来制备所述制剂。适合于口服给药的式i化合物的制剂可以制成各自含有预定量的式i化合物的分离的单元,例如丸剂、胶囊剂、扁囊剂或片剂。可通过在适合的机器中将自由流动的例如粉末或颗粒形式的活性成分压紧,任选地与粘合剂、润滑剂、惰性稀释剂、防腐剂、表面活性剂或分散剂混合来制备压片剂。可通过在适合的机器中对用惰性液体稀释剂润湿的粉碎的活性成分的混合物进行模塑来制备模制片剂。所述片剂可以任选地被包衣和划痕,并且任选地对其进行配制以从其中缓慢或受控地释放活性成分。可制备片剂、糖锭剂、锭剂、水性或油性混悬剂、可分散的散剂或颗粒剂、乳剂、硬或软胶囊剂例如明胶胶囊、糖浆剂或酏剂用于口服。用于口服的式i化合物的制剂可以按照药物组合物制备领域已知的任何方法进行制备,并且这样的组合物可以包含包括甜味剂、矫味剂、着色剂和防腐剂在内的一种或多种物质以提供可口的制剂。包含与适合于制备片剂的无毒性药学可接受的赋形剂混合的活性成分的片剂是可接受的。这些赋形剂可以是,例如:惰性稀释剂,例如碳酸钙或碳酸钠、乳糖、磷酸钙或磷酸钠;造粒剂和崩解剂例如玉米淀粉或藻酸;粘合剂例如淀粉、明胶或阿拉伯树胶;以及润滑剂例如硬脂酸镁、硬脂酸或滑石。片剂可以是无包衣的,或者可以通过包括微囊化在内的已知技术包衣以延迟在胃肠道内崩解和吸收,由此在较长的时期提供持续的作用。可以单独使用例如延时材料例如单硬脂酸甘油酯或二硬脂酸甘油酯,或者与蜡一起使用。为了治疗眼或其它外部组织例如口和皮肤,所述制剂优选地以局部软膏剂或乳膏剂形式施用,并且包含例如0.075%-20%w/w的量的活性成分。在将活性成分制备成软膏剂时,活性成分可以与石蜡族的或水混溶性的软膏基质一起使用。或者,活性成分可以与水包油乳膏基质一起制备成乳膏剂。若期望,乳膏基质的水相可包含多元醇,即含有两个或多个羟基的醇,例如丙二醇、1,3-丁二醇、甘露醇、山梨糖醇、甘油和聚乙二醇(包括peg400)及其混合物。局部制剂可以适合地包含增强活性成分吸收或渗透过皮肤或其它受感染区域的化合物。这样的皮肤促渗剂的实例包括二甲亚砜和相关的类似物。本发明的乳剂的油相可以已知的方式由已知的成分形成。虽然该相可以仅包含乳化剂,但其适合地包含至少一种乳化剂与脂肪或油、或者与脂肪和油的混合物。优选包含亲水性乳化剂和亲脂性乳化剂作为稳定剂的。还优选包含油和脂肪。总之,所述乳化剂与任选存在的稳定剂一起组成所谓的乳化蜡,并且该蜡与油和脂肪一起组成所谓的乳化软膏基质,所述基质形成乳膏制剂的油性分散相。适合用于本发明的制剂中的乳化剂和乳剂稳定剂包括60、80、鲸蜡硬脂醇、苄醇、肉豆蔻醇和单硬脂酸甘油酯和十二烷基硫酸钠。式i化合物的水性混悬剂包含和适合于制备水性混悬剂的赋形剂混合的活性材料。这样的赋形剂包括:助悬剂例如羧甲基纤维素钠、交联羧甲纤维素、聚维酮、甲基纤维素、羟丙基甲基纤维素、藻酸钠、聚乙烯吡咯烷酮、黄蓍胶和阿拉伯树胶,以及分散剂或湿润剂例如天然存在的磷脂(例如卵磷脂)、烯化氧与脂肪酸的缩合产物(例如聚氧乙烯硬脂酸酯)、环氧乙烷与长链脂肪醇的缩合产物(例如十七乙烯氧基鲸蜡醇)、环氧乙烷与衍生自脂肪酸和脱水己糖醇的偏酯的缩合产物(例如聚氧乙烯脱水山梨糖醇单油酸酯)。水性混悬剂还可包含一种或多种防腐剂(例如对羟基苯甲酸乙酯或对羟基苯甲酸丙酯)、一种或多种着色剂、一种或多种矫味剂以及一种或多种甜味剂(例如蔗糖或糖精)。式i化合物的药物组合物可以是无菌注射剂的形式,例如无菌可注射的水性或油性混悬剂。可按照已知的技术利用上述那些适合的分散剂或湿润剂和助悬剂制备此混悬剂。无菌注射剂还可以是在无毒性的肠胃外可接受的稀释剂或溶剂中的无菌可注射的溶液剂或混悬剂,例如1,3-丁二醇中的溶液剂,或者制备成冻干粉末。可使用的可接受的载体和溶剂包括水、林格氏液和等渗的氯化钠溶液。此外,无菌的不挥发性油通常可用作溶剂或混悬介质。为此目的,可使用任何温和的不挥发性油,包括合成的单酸甘油酯或甘油二酯。此外,脂肪酸例如油酸也可用于制备注射剂。可与载体材料组合以制备单一剂型的活性成分的量可随着要治疗的宿主和具体的给药模式而改变。例如,意在向人类口服给药的延时释放制剂可包含约1-1000mg的活性材料,并与可占总组合物的约5重量%-约95重量%的适当且合宜的量的载体材料混和。可制备药物组合物以容易地测定给药量。例如,预期用于静脉内输注的水溶液剂可包含约3-500μg的活性成分/毫升溶液剂,从而可实现以约30ml/hr的速度输注适合的体积。适合于肠胃外给药的制剂包括:水性和非水性的无菌注射溶液剂,其可包含抗氧化剂、缓冲剂、抑菌剂以及使该制剂与预期接受者的血液等渗的溶质;以及可包含助悬剂和稠化剂的水性和非水性的无菌混悬剂。适合于向眼局部给药的制剂还包括滴眼剂,其中将活性成分溶于或悬浮于适合的载体中,特别是活性成分的水性溶剂。优选地,存在于这样的制剂中的活性成分的浓度为约0.5%-20%w/w,例如约0.5%-10%w/w,例如约1.5%w/w。适合于在口中局部给药的制剂包括:锭剂,其包含在调味基质通常是蔗糖和阿拉伯树胶或黄蓍胶中的活性成分;糖锭剂,其包含在惰性基质例如明胶和甘油或者蔗糖和阿拉伯树胶中的活性成分;以及漱口液,其包含在适合的液体载体中的活性成分。用于直肠给药的制剂可以是栓剂,其包含含有例如可可脂或水杨酸酯的适合的基质。适合于肺内或鼻内给药的制剂的粒度是例如0.1-500微米(包括在0.1-500微米之间以微米增量的范围内的粒度,例如0.5、1、30微米,35微米等),通过经鼻道快速吸入或者通过经口吸入进行给药以达到肺泡囊。适合的制剂包括活性成分的水性或油性溶液剂。适合于喷雾或干粉给药的制剂可按照常规方法进行制备,并且可与其它治疗剂例如上述用于治疗或预防下述病症的化合物一起递送。适合于阴道给药的制剂可以是阴道栓剂、卫生棉塞、乳膏剂、凝胶剂、糊剂、泡沫剂或喷雾剂,其除了活性成分之外还包含本领域已知的适合的载体。所述制剂可包装在单位剂量或多剂量容器中,例如,密封的安瓿和小瓶,并且可在冷冻干燥(冻干)的条件下储藏,为了在使用前立即注射,仅需要加入无菌液体载体例如水。临时注射用的溶液剂和混悬剂由上述种类的无菌的散剂、颗粒剂和片剂制得。优选的单位剂量制剂是包含上文所述的日剂量或单位日分剂量或其适当部分的活性成分的那些。本发明还提供兽医学组合物,其包含至少一种上述活性成分和兽医学载体。兽医学载体是用于给药所述组合物的目的的材料,并且可以是惰性的或兽医学可接受的并且与所述活性成分相容的固体、液体或气体物质。这些兽医学组合物可通过肠胃外、口服或通过任何其它期望的途径给药。组合治疗式i化合物可单独使用,或者与用于治疗本文所述的疾病或病症例如炎症或过度增殖性病症(例如癌症)的其它治疗剂组合使用。在一些实施方案中,在药学组合制剂或者作为组合治疗的给药方案中,将式i化合物与具有抗炎性或抗过度增殖性或者用于治疗炎症、免疫反应性病症或过度增殖性病症(例如癌)的另一治疗性化合物组合。所述另一治疗剂可以是nsaid抗炎药。所述另一治疗剂可以是化疗剂。所述药学组合制剂或给药方法的第二化合物优选地具有与式i化合物互补的活性,从而它们不会不利地相互影响。这样的化合物适合地以对预期目的有效的量组合存在。在一个实施方案中,本发明的组合物包含式i化合物或其立体异构体、互变异构体、溶剂化物、代谢物或药学可接受的盐或前药,以及治疗剂例如nsaid。联合治疗可以同时或依次的方案施用。当依次施用时,该组合可以在两次或多次给药中施用。组合给药包括,使用分开的制剂或者单一药物制剂同时给药,以及以任意顺序相继地给药,其中优选存在两种(或所有)活性剂同时发挥它们的生物活性的时间段。上述同时给药的药物中的任一种的适合的剂量是当前使用的那些,并且由于新鉴定的药物与其它治疗剂或治疗的组合(协同)作用,可以降低。组合治疗可提供“协同作用”并证明是“协同的”,即,活性成分在一起使用时所达到的效果大于分开使用所述化合物时所产生的效果之和。当所述活性成分:(1)在组合的单位剂量制剂中共同配制并同时给药或者递送时;(2)作为分开的制剂交替或平行地递送时;或者(3)通过一些其它方案时,可达到协同效果。当在交替疗法中递送时,当所述化合物例如通过在分开的注射器中分别注射、通过分开的丸剂或胶囊剂、或通过分开的输注依次给药或递送时,可达到协同效果。通常在交替疗法中,相继地,即连续地,给药有效剂量的各活性成分,而在组合治疗中,一起给药有效剂量的两种或多种活性成分。在治疗的一个具体的实施方案中,式i化合物、其立体异构体、互变异构体、溶剂化物、代谢物、药学可接受的盐或前药可以与例如本文所述的那些的其它治疗剂、激素或抗体组合,还可与外科治疗和放疗组合。因此,本发明的组合治疗包括给药至少一种式i化合物、其立体异构体、互变异构体、溶剂化物、代谢物、药学可接受的盐或前药,以及使用至少一种其它癌症治疗方法。为了达到期望的组合治疗效果,选择式i化合物和其它药学活性治疗剂的量以及给药的相对时机。式i化合物的代谢物本文所述的式i化合物的体内代谢产物也在本发明的范围内。这样的产物可由例如被给药的化合物的氧化、还原、水解、酰胺化、脱酰胺化、酯化、脱脂化、酶解等产生。因此,本发明包括式i化合物的代谢物,包括通过使本发明的化合物与哺乳动物接触足以产生其代谢产物的时间的方法制得的化合物。代谢产物通常通过制备本发明的放射性同位素(例如14c或3h)标记的化合物,将其以可检测的剂量(例如大于约0.5mg/kg)向动物例如大鼠、小鼠、天竺鼠、猴或人肠胃外给药,代谢足够的时间(通常约30秒至30小时),然后从尿、血液或其它生物样品分离其转化产物进行鉴定。这些产物易于分离,因为它们是标记的(其它的通过使用能够结合代谢物中存余的表位的抗体进行分离)。代谢物结构以常规方法测定,例如通过ms、lc/ms或nmr分析。通过以与本领域技术人员公知的常规药物代谢研究相同的方式进行代谢物的分析。代谢产物,只要未在体内发现它们,可用于诊断测定中,以治疗性给药本发明的化合物。制品在本发明的另一个实施方案中,提供包含用于治疗上述疾病和病症的材料的制品或“药盒”。在一个实施方案中,所述药盒包括包含式i化合物、其立体异构体、互变异构体、溶剂化物、代谢物、药学可接受的盐或前药的容器。所述药盒还可包括在所述容器上或伴随所述容器的标签或包装说明书。术语“包装说明书”是指治疗产品的商业包装中通常包含的说明书,其包含使用该治疗产品相关的适应征、用法、剂量、给药、禁忌和/或警示的信息。适合的容器包括,例如,瓶、小瓶、注射器、泡罩包装等。所述容器可以由各种材料例如玻璃和塑料制成。所述容器可容纳对治疗病症有效的式i化合物或其制剂,并且可具有无菌入口(例如,所述容器可以是静脉内溶液剂袋或者具有可被皮下注射针刺穿的瓶塞的小瓶)。所述组合物中的至少一种活性成分是式i化合物。标签或包装说明书指明所述组合物用于治疗所选的病症例如癌症。此外,标签或包装说明书可指明要治疗的患者是患有诸如过度增殖性病症、神经变性、心脏肥厚、疼痛、偏头痛或神经外伤性疾病或事件之类病症的患者。在一个实施方案中,标签或包装说明书指明包含式i化合物的组合物可用来治疗起因于异常细胞生长的病症。标签或包装说明书还可指明所述组合物可用来治疗其它病症。替代地,或者额外地,所述制品还可包括第二容器,其包含药学可接受的缓冲剂例如抑菌的注射用水(bwfi)、磷酸盐缓冲盐水、林格氏液和葡萄糖溶液。所述制品还可包括就商业和用户而言令人期望的其它材料,包括其它缓冲剂、稀释剂、填料、针和注射器。所述药盒还可包括给药式i化合物和第二药物制剂(若存在)的说明书。例如,若所述药盒包括含有式i化合物的第一组合物和第二药物制剂,则该药盒还可包括向有此需要的患者同时、相继或分开地给药第一药物组合物和第二药物组合物的说明书。在另一个实施方案中,所述药盒适合于递送式i化合物的固体口服形式例如片剂或胶囊剂。这样的药盒优选地包括多个单位剂量。这样的药盒可包括具有以它们的预期用途定位的剂量的卡片。这样的药盒的一个实例是“泡罩包装”。泡罩包装在包装工业中是公知的并且广泛用于包装药学单位剂量形式。若期望,可以例如指定在治疗时间表中可给药之日的数字、字母或其它标记或者日历插页的形式提供记忆辅助工具。根据一个实施方案,药盒可包括(a)其中容纳有式i化合物的第一容器;并任选地包括(b)其中容纳有第二药物制剂的第二容器,其中所述第二药物制剂包含具有抗过度增殖活性的第二化合物。替代地,或者额外地,所述药盒还可包括第三容器,其包含药学可接受的缓冲剂例如抑菌性注射用水(bwfi)、磷酸盐缓冲盐水、林格氏液和葡萄糖溶液。所述药盒还可包括就商业和用户而言令人期望的其它材料,包括其它缓冲剂、稀释剂、填料、针和注射器。在其中所述药盒包括式i化合物的组合物和另一治疗剂的一些其它实施方案中,所述药盒可包括用于容纳分开的组合物的容器例如分开的瓶或分开的箔包装,但是,分开的组合物还可容纳在单个的未分开的容器中。通常,所述药盒包括给药分开的组分的说明书。所述药盒形式在以下情形中特别有利:在分开的组分优选地以不同的剂型(例如口服和肠胃外)给药或者以不同的间隔给药时,或者在处方医师期望逐步增加组合中的e各个组分的剂量时。式i化合物的制备式i的化合物可通过包括与化学领域中公知的那些方法类似的方法在内的合成路线合成,具体地参见本文中的说明书,以及在comprehensiveheterocyclicchemistryii,katritzky和rees著,elsevier,1997,例如volume3;liebigsannalenderchemie,(9):1910-16,(1985);helveticachimicaacta,41:1052-60,(1958);arzneimittel-forschung,40(12):1328-31,(1990)(分别通过援引明确地加入本文中)中对其它杂环的那些描述。原料一般可从商业来源例如aldrichchemicals(milwaukee,wi)获得,或者利用本领域技术人员公知的方法容易地制得(例如通过在louisf.fieser和maryfieser,reagentsfororganicsynthesis,v。1-23,wiley,n.y.(1967-2006ed.),或者beilsteinshandbuchderorganischenchemie,4,aufl.ed.springer-verlag,berlin,包括附录(也可通过beilstein在线数据库获得)中概述的方法制得。用于合成式i化合物的合成化学转化和保护基团方法(保护和脱保护)以及所需的试剂和中间体是本领域已知的,并且包括,例如,在r.larock,comprehensiveorganictransformations,vchpublishers(1989);t.w.greene和p.g.m.wuts,protectivegroupsinorganicsynthesis,3rded.,johnwileyandsons(1999);和l.paquette,ed.,encyclopediaofreagentsfororganicsynthesis,johnwileyandsons(1995)及其后续版本中所述的那些。式i化合物可单独地或者以包含至少2种例如5-1,000种化合物或者10–100种化合物的化合物库的形式进行制备。式i的化合物库可以按照本领域技术人员已知的方法通过组合的‘分开和混合’方法,或者通过多级平行合成,利用液相或固相化学进行制备。因此,根据本发明的另一方面,提供包含至少2种化合物或其药学可接受的盐的化合物库。附图和实施例提供制备式i化合物的示例性方法。本领域技术人员会理解,其它合成路线可用来合成式i化合物。虽然在附图和实施例中描述和讨论了具体的原料和试剂,但是可容易地替换成其它原料和试剂以提供各种衍生物和/或反应条件。此外,还可参考本公开,利用本领域技术人员公知的常规化学对通过所述方法制得的许多实例化合物进一步进行修饰。在制备式i化合物时,可能需要保护中间体的远端官能团(例如伯胺或仲胺)。对这种保护的需要可随着远端官能团的性质以及制备方法的条件而改变。适合的氨基保护基包括乙酰基、三氟乙酰基、叔丁氧羰基(boc)、苄氧基羰基(cbz)和9-芴基亚甲基氧基羰基(fmoc)。本领域技术人员容易地确定这样保护的必要性。关于保护基的概述及它们的用途,参见t.w.greene,protectivegroupsinorganicsynthesis,johnwiley&sons,newyork,1991。一般制备方法一般方法asuzuki偶联suzuki型偶联反应用来形成碳-碳键,以连接式i化合物和中间体例如a-3的环(suzuki(1991)pureappl.chem.63:419-422;miyaura和suzuki(1979)chem.reviews95(7):2457-2483;suzuki(1999)j.organometal.chem.576:147-168)。suzuki偶联是钯介导的芳基卤例如b-2或b-5与硼酸例如a-1或a-2的交叉偶联反应。例如,可将b-2与约1.5当量的4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)混合,并且溶于约3当量的碳酸钠(1m水溶液)和等体积的乙腈中。加入催化量或更多的低价钯试剂例如双(三苯基膦)二氯化钯(ii)。在一些情况中,用乙酸钾替代碳酸钠来调节水层的ph。然后将反应在微波反应器例如biotageoptimizer(biotage,inc.)中,在压力下加热至约140-150℃持续10-30分钟。用乙酸乙酯或另一种有机溶剂萃取内容物。在蒸发有机层后,可在硅胶上或通过反相hplc纯化硼酸酯a-1。取代基y1、y2、r5和r6是如所定义的那样,或者是其受保护形式或前体。同样,可将溴化物中间体b-5硼酸酯化得到a-2。取代基y1、y2、r1、r2、r3、r4、z1、z2、z3、z4和x是如所定义的那样,或是其被保护形式或前体。b-2和a-2或者a-1和b-5的suzuki偶联产生式i化合物或中间体a-3。将硼酸酯(或硼酸)(1.5eq)a-1或a-2和钯催化剂例如双(三苯基膦)二氯化钯(ii)(0.05eq)加入到卤代中间体(1eq)b-2或b-5在乙腈和1m碳酸钠水溶液(与乙腈等体积)中的混合物中。将反应混合物在微波中加热至约150℃持续约15min。lc/ms指示何时反应完成。将水加入到混合物中,过滤沉淀的产物,然后通过hplc纯化得到产物a-3。取代基r1’、r2’、r4’可以是所定义的r1、r2、r4,或者其被保护的形式或前体。在suzuki偶联步骤中可使用各种钯催化剂。各种低价pd(ii)和pd(0)催化剂可用于suzuki偶联反应,包括pdcl2(pph3)2、pd(t-bu)3、pdcl2dppfch2cl2、pd(pph3)4、pd(oac)/pph3、cl2pd[(pet3)]2、pd(diphos)2、cl2pd(bipy)、[pdcl(ph2pch2pph2)]2、cl2pd[p(o-tol)3]2、pd2(dba)3/p(o-tol)3、pd2(dba)/p(furyl)3、cl2pd[p(furyl)3]2、cl2pd(pmeph2)2、cl2pd[p(4-f-ph)3]2、cl2pd[p(c6f6)3]2、cl2pd[p(2-cooh-ph)(ph)2]2、cl2pd[p(4-cooh-ph)(ph)2]2,以及包封的催化剂pdencattm30、pdencattmtpp30和pd(ii)encattmbinap30(us2004/0254066)。一般方法bbuchwald反应buchwald反应用于氨化6-溴中间体b-1(wolf和buchwald(2004)org.synthcoll.vol。10:423;paul等人(1994)jour.amer.chem.soc。116:5969-5970)。向卤代中间体b-1在dmf中的溶液中加入适合的胺r5-nh2(200mol%)、cs2co3(50mol%)、pd2(dba)3(5mol%)和xantphos(10mol%)。将反应在biotageoptimizer微波反应器中,在压力下加热至约110℃持续约30min。在真空中浓缩所得的溶液得到b-2。可使用其它钯催化剂和膦配体。n-芳基酰胺中间体b-5也可用环酰胺中间体b-3和芳基溴b-4通过buchwald反应进行制备。图1显示从3-硝基吡唑-5-羧酸制备包括6-氯-4-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)哒嗪-3(2h)-酮101f在内的6-氯,4-氨基哒嗪酮化合物的示例性合成路线。图2显示从4,5,6,7-四氢-1h-吲哚制备包括2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101m在内的三环酰胺-苯基硼酸酯化合物化合物的示例性合成路线。图3显示从4,5,6,7-四氢苯并[b]噻吩-2-羧酸制备包括2-溴-6-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯104h在内的三环酰胺-苯基溴化物的示例性合成路线。图4显示从3-甲基环戊-2-烯酮制备包括6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-酮105i在内的三环酰胺-苯基溴化物的另一种示例性合成路线。图5显示从5,6,7,8-四氢中氮茚-2-羧酸制备包括2-(1-氧代-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯118f在内的作为硼酸酯的三环1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮化合物的示例性合成路线。图6显示从1,3-二溴-5-氟-2-碘苯制备中间体2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯198d的示例性合成路线。图7显示制备中间体4-氟-2-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯198g的示例性合成路线。图8显示制备中间体5-氟-2-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯210e的示例性合成路线。图9显示制备中间体5-[5-氟-2-(乙酰氧基甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮212c的示例性合成路线。分离方法在制备式i化合物的方法中,有利的是使反应产物彼此分开和/或从原料分离反应产物。通过本领域的常规技术将各步骤或连续步骤的期望的产物分离和/或纯化至期望的均一度。通常这样的分离包括多相萃取、从溶剂或溶剂混合物结晶、蒸馏、升华或色谱。色谱法可包括许多方法,包括例如:反相和正相;排阻;离子交换;高压、中压和低压液相色谱法和装置;小量级分析;模拟移动床(smb)和制备薄层色谱或厚层色谱,以及小量级薄层技术和快速色谱法。另一类分离方法包括用试剂处理混合物,所选的试剂与期望的产物、未反应的原料、反应副产物等结合或使其成为可分离的。这样的试剂包括吸附剂或吸收剂,例如活性碳、分子筛、离子交换介质等。或者,所述试剂(在碱性材料的情况中可以是酸,在酸性材料的情况中可以是碱)可以是结合剂,例如抗体,结合蛋白,选择性螯合剂例如冠醚,液/液离子交换剂(lix)等。根据相关材料的性质例如在蒸馏和升华中的沸点和分子量、在色谱中存在或不存在极性官能团、在多相萃取中材料在酸性和碱性介质中的稳定性等,选择适合的分离方法。可通过本领域技术人员公知的方法例如通过色谱和/或分级结晶,根据非对映异构体的物理化学差异,将非对映异构体混合物分离成它们单独的非对映异构体。对映异构体可通过与适合的旋光化合物(例如手性助剂如手性醇或mosher酰氯)反应,将对映异构体混合物转化成非对映异构体混合物,分离非对映异构体,将单独的非对映立体异构体转化(例如水解)成相应的纯对映异构体进行分离。此外,本发明的一些化合物可以是阻转异构体(例如取代的联芳基),并且它们被视为本发明的一部分。对映异构体还可利用手性hplc柱进行分离。可利用例如用旋光拆分剂形成非对映异构体的方法拆分外消旋混合物,来获得基本上不含有其立体异构体的单一立体异构体例如对映异构体(eliel,e.和wilen,s.“stereochemistryoforganiccompounds,”johnwiley&sons,inc.,newyork,1994;lochmuller,c.h.,(1975)j.chromatogr.,113(3):283-302)。本发明的手性化合物的外消旋混合物可通过任何适合的方法进行分离和离析,包括:(1)与手性化合物形成非对映异构体盐,和通过分级结晶或其它方法分离,(2)与手性衍生化试剂形成非对映异构体化合物,分离非对映异构体,并转化成纯立体异构体,和(3)在手性条件下直接分离基本上纯的或富集的立体异构体。参见:“drugstereochemistry,analyticalmethodsandpharmacology,”irvingw.wainer,ed.,marceldekker,inc.,newyork(1993)。按照方法(1),通过使对映体纯的手性碱例如番木鳖碱、奎宁、麻黄碱、马钱子碱、α-甲基-β-苯基乙胺(安非他明)等与含有酸性官能团例如羧酸和磺酸的不对称化合物反应形成非对映异构体盐。可通过分级结晶或离子色谱分离非对映异构体盐。为了分离氨基化合物的旋光异构体,加入手性羧酸或磺酸例如樟脑磺酸、酒石酸、扁桃酸或乳酸可形成非对映异构体盐。或者,按照方法(2),使要拆分的底物与手性化合物的一种对映异构体反应形成非对映异构体对(e.和wilen,s.“stereochemistryoforganiccompounds”,johnwiley&sons,inc.,1994,p.322)。可通过使不对称化合物与对映体纯的手性衍生化试剂例如薄荷基衍生物反应,形成非对映异构体化合物,而后分离非对映异构体并水解,产生纯的或富集的对映异构体。测定光学纯度的方法包括:在碱存在下制备外消旋混合物的手性酯,例如薄荷基酯,如(-)薄荷基氯甲酸酯,或者制备mosher酯、α-甲氧基-α-(三氟甲基)苯基乙酸酯(jacobiii.j.org.chem.(1982)47:4165),然后分析1hnmr谱,确定两种阻转异构型对映异构体或非对映异构体的存在。可按照分离阻转异构的萘基-异喹啉的方法(wo96/15111),通过正相和反相色谱分离和离析阻转异构的化合物的稳定的非对映异构体。按照方法(3),可利用手性固定相通过色谱法分离两种对映异构体的外消旋混合物(“chiralliquidchromatograph”(1989)w.j.lough,ed.,chapmanandhall,newyork;okamoto,j.chromatogr.,(1990)513:375-378)。可通过用来区分具有不对称碳原子的其它手性分子的方法例如旋光度和圆二色性,来区分富集的或纯化的对映异构体。实施例实施例1012-(2-甲基-3-(5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4-二氢吡嗪并[1,2-a]吲哚-1(2h)-酮101实施例101a(3-硝基-1h-吡唑-5-基)甲醇101a用氮气吹扫配有机械搅拌器、加料漏斗和氮气入口的3l三颈圆底烧瓶,加入3-硝基吡唑-5-羧酸(28.0g,178mmol)和thf(420ml)并利用冰/丙酮浴冷却至–5℃。以保持内部反应温度低于5℃的速度加入硼烷-thf络合物溶液(1.0m,535ml,535mmol)。在加料完成后,除去冷却浴,并在室温下搅拌反应18h。其后用冰/丙酮浴将反应冷却至–5℃,加入水(70ml)和4n盐酸(70ml)并在回流下搅拌反应1h以破坏硼烷与吡唑络合。将反应冷却至室温,在减压下浓缩至约30ml的体积。加入乙酸乙酯(175ml)并搅拌混合物15min。分离水层并用乙酸乙酯萃取(4×200ml)。用饱和碳酸氢钠水溶液(2×50ml)、盐水(50ml)洗涤合并的有机层,用硫酸钠干燥,通过过滤除去干燥剂,然后在减压下浓缩滤液,以94%收率(24.0g)得到101a,为浅黄色固体:1hnmr(300mhz,dmso-d6)δ13.90(brs,1h),6.87(s,1h),5.58(t,1h,j=5.4hz),4.53(d,2h,j=5.1hz);ms(esi+)m/z144.0(m+h)。实施例101b(1-(2-溴乙基)-3-硝基-1h-吡唑-5-基)甲醇101b用氮气吹扫配有机械搅拌器和温度调节器的1l三颈圆底烧瓶并加入(3-硝基-1h-吡唑-5-基)甲醇101a(25.0g,175mmol)、dmf(250ml)和碳酸铯(70.0g,215mmol),在104℃下加热5min。然后利用冰/丙酮浴将反应混合物冷却至0℃,并逐份加入二溴乙烷(329g,1.75mol)(无放热)。在0℃下搅拌反应1h而后在室温下搅拌4h。其后缓慢加入kh2po4(40g)在水(400ml)中的溶液。将反应混合物在室温下搅拌30min。加入乙酸乙酯(450ml),分离水层,并用乙酸乙酯萃取(2×100ml)。用水(200ml)、盐水(200ml)洗涤合并的有机层,用硫酸钠干燥,然后通过过滤除去干燥剂。在减压下浓缩滤液,以86%收率(37.5g)得到粗品101b,为橙色油状物:1hnmr(300mhz,cdcl3)δ6.85(s,1h),4.82(d,2h,j=5.4hz),4.66(t,2h,j=6.3hz),3.83(t,2h,j=6.3hz);ms(esi+)m/z249.9(m+h)。实施例101c1-(2-溴乙基)-5-(溴甲基)-3-硝基-1h-吡唑101c用氮气吹扫配有磁力搅拌器、氮气入口和回流冷凝管的500ml三颈圆底烧瓶并加入(1-(2-溴乙基)-3-硝基-1h-吡唑-5-基)甲醇101b(37.0g,148mmol)和氯仿(160ml)。用冰/丙酮浴将反应冷却至–5℃并逐份加入三溴化磷(40.0g,148mmol)。除去冷却浴并在回流下搅拌反应2h。其后,将反应冷却至–5℃,加入饱和碳酸氢钠水溶液(250ml)直至ph达到8.5。用乙酸乙酯萃取混合物(3×150ml),用饱和碳酸钠水溶液(2×50ml)、盐水(75ml)洗涤合并的有机层,用硫酸钠干燥,然后通过过滤除去干燥剂。在减压下浓缩滤液得到黄色残余物,将其在温和加热下溶于二氯甲烷(60ml)中。加入己烷(约20ml),溶液变得混浊。加热混合物直至形成固体沉淀,加入二氯甲烷(9ml),溶液变澄清。使溶液冷却至室温,在4h后,通过真空过滤收集所得的结晶。用二氯甲烷:己烷的冰冷的1:2混合物(2×20ml)洗涤滤饼,得到1-(2-溴乙基)-5-(溴甲基)-3-硝基-1h-吡唑(19.7g)。蒸发合并的滤液并再次进行操作,得到额外9.70g的1-(2-溴乙基)-5-(溴甲基)-3-硝基-1h-吡唑。将固体合并并在高真空度下干燥18h,以57%收率(26.0g)得到101c,为白色结晶:mp95–97℃;1hnmr(300mhz,cdcl3)δ6.93(s,1h),4.63(t,2h,j=6.0hz),4.54(s,2h),3.86(t,2h,j=6.0hz)。实施例101d5-甲基-2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪101d向配有磁力搅拌器和氮气入口的1l单颈圆底烧瓶中加入thf(350ml)、101c(10.0g,32.2mmol)、2m甲胺thf溶液(113ml,225mmol)并在室温下搅拌72h。此后,将反应在减压下浓缩至干,然后将所得的固体与乙酸乙酯(75ml)和10%碳酸钾水溶液(75ml)的混合物一起搅拌。分离水层并用乙酸乙酯萃取(2×75ml)。用10%碳酸钾水溶液(75ml)而后用盐水(50ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液,以97%收率(5.70g)得到101d,为黄色固体:1hnmr(300mhz,cdcl3)δ6.62(s,1h),4.28(t,2h,j=5.4hz),3.67(s,2h),2.95(t,2h,j=5.4hz),2.52(s,3h);ms(esi+)m/z183.0(m+h)。实施例101e5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-胺101e用氮气吹扫500mlparr反应瓶并加入10%钯/碳(50%湿度,800mg干重),以及5-甲基-2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪101d(4.00g,2.20mmol)在乙醇(160ml)中的溶液。将瓶连接至parr加氢反应器,抽真空,充入氢气至压力45psi并振摇2h。此后,抽出氢气,并将氮气充入瓶中。加入celite521(1.0g),通过celite521垫过滤混合物。用乙醇(2×75ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干,以99%收率得到101e(3.31g),为橙色固体:1hnmr(300mhz,cdcl3)δ5.34(s,1h),3.98(t,2h,j=5.4hz),3.52(s,3h),2.84(t,2h,j=5.7hz),2.45(s,3h);ms(esi+)m/z153.1(m+h)实施例101f6-氯-4-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)哒嗪-3(2h)-酮101f向配有磁力搅拌器、回流冷凝管和氮气入口的50-ml单颈圆底烧瓶加入1,4-二噁烷(5.0ml)、101e(152mg,1.00mmol)、4-溴-6-氯哒嗪-3(2h)-酮(209mg,1.00mmol)和1mlihmdsthf溶液(5.0ml,5.00mmol)。在持续30min使氮气鼓泡经过所得溶液后,加入xantphos(49mg,0.05mmol)和三(二亚苄基丙酮)二钯(0)(59mg,0.085mmol),并将反应混合物在回流下加热3h。此后,将反应冷却至室温,加入水(10ml)。用2n盐酸将ph调至6.5。通过真空过滤收集所得的沉淀,用水(2×25ml)洗涤,使其吸附在硅胶上并通过快速色谱法纯化,得到74%收率(210mg)的101f,为浅褐色固体:1hnmr(300mhz,dmso-d6)δ12.94(s,1h),9.55(s,1h),7.68(s,1h),5.96(s,1h),4.04(t,1h,j=5.7hz),3.53(s,2h),2.82(t,2h,j=5.7hz),2.36(s,3h);ms(esi+)m/z281.1(m+h)实施例101g2,2,2-三氯-1-(4,5,6,7-四氢-1h-吲哚-2-基)乙酮101g用氮气吹扫配有磁力搅拌器、冷凝管和氮气入口的100ml单颈圆底烧瓶,并加入4,5,6,7-四氢-1h-吲哚(3.00g,24.8mmol)、三氯乙酰氯(13.5g,74.4mmol)和1,2-二氯乙烷(50ml)。在85℃下搅拌溶液2h。其后,在减压下浓缩反应混合物得到100%收率(6.50g)的101g,为黑色半固体:1hnmr(500mhz,dmso-d6)δ11.94(s,1h),7.05(s,1h),2.62(t,2h,j=6.0hz),2.47(t,2h,j=6.0hz),1.80(m,2h),1.65(m,2h);ms(esi+)m/z266.0(m+h)实施例101h4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101h用氮气吹扫配有磁力搅拌器和氮气入口的100ml单颈圆底烧瓶,并加入101g(6.50g,24.8mmol)、乙醇钠(17.0mg,0.25mmol)和乙醇(40ml)。在室温下搅拌溶液1h。其后,在减压下浓缩反应混合物。通过柱色谱纯化残余物得到100%收率(4.80g)的101h,为褐色固体:mp70–72℃;1hnmr(300mhz,cdcl3)δ9.08(s,1h),6.75(s,1h),4.25(q,2h,j=7.2hz),2.65(t,2h,j=6.0hz),2.56(t,2h,j=6.0hz),1.85(m,4h),1.28(t,3h,j=7.2hz);ms(esi+)m/z194.1(m+h)实施例101i1-(氰基甲基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101i用氮气吹扫配有磁力搅拌器和氮气入口的125ml单颈圆底烧瓶,并加入101h(5.76g,29.8mmol)和dmf(50ml)。利用冰浴将溶液冷却至0℃。加入nah(60%在矿物油中的分散体,1.43g,35.8mmol)。在室温下搅拌所得的混合物1h。其后,加入溴乙腈(1.43g,35.8mmol)。将混合物在室温下搅拌14h。其后,在减压下浓缩反应混合物,然后将残余物在乙酸乙酯(150ml)与水(450ml)之间分配。分离有机层,并用乙酸乙酯(3×150ml)萃取水层。用盐水洗涤合并的有机层,用硫酸钠干燥,然后在减压下浓缩。通过柱色谱纯化残余物,得到55%收率(3.80g)的1-(氰基甲基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101i,为黄色半固体:1hnmr(300mhz,cdcl3)δ6.66(s,1h),5.29(s,2h),4.28(q,2h,j=7.2hz),2.62(t,2h,j=6.3hz),2.49(t,2h,j=6.3hz),1.92(m,2h),1.75(m,2h),1.33(t,3h,j=7.2hz);ms(esi+)m/z233.1(m+h)实施例101j1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101j用氮气吹扫200mlparr反应瓶并加入10%钯/碳(50%湿度,1.28g干重)、1-(氰基甲基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101i(3.00g,12.9mmol)、12%盐酸(6.5ml,25mmol)、乙酸乙酯(60ml)和乙醇(40ml)。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi,然后振摇6h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(4.0g),并通过celite521垫过滤混合物。用乙醇(2×20ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干。使残余物在乙酸乙酯(150ml)与10%碳酸钾水溶液(100ml)之间分配。分离有机层,并用乙酸乙酯(3×75ml)萃取水层。用硫酸钠干燥合并的有机层并在减压下浓缩。用乙醇(5ml)使残余物成粉末,得到71%收率(1.71g)的1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101j,为白色固体:mp102–104℃;1hnmr(500mhz,dmso-d6)δ6.61(s,1h),6.22(br,2h),4.15(m,4h),2.77(m,2h),2.59(t,2h,j=6.5hz),2.42(t,2h,j=6.5hz),1.70(m,2h),1.62(m,2h),1.23(t,3h,j=7.0hz);ms(apci+)m/z237.2(m+h)实施例101k1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101k用氮气吹扫配有磁力搅拌器和氮气入口的100ml单颈圆底烧瓶,并加入1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101j(1.80g,7.63mmol)、乙醇钠(1.55g,22.8mmol)和乙醇(50ml)。在55℃下搅拌混合物5h。其后,在减压下浓缩反应混合物,然后使残余物在乙酸乙酯(200ml)和水(100ml)之间分配。分离有机层,并用乙酸乙酯(2×100ml)萃取水层。用盐水洗涤合并的有机层,用硫酸钠干燥,然后在减压下浓缩。通过柱色谱纯化残余物,得到42%收率(605mg)的1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101k,为白色固体:mp207–209℃;1hnmr(500mhz,dmso-d6)δ7.41(s,1h),6.36(s,1h),3.84(t,2h,j=6.0hz),3.42(m,2h),2.51(t,2h,j=6.0hz),2.42(t,2h,j=6.0hz),1.76(m,2h),1.65(m,2h);(apci+)m/z191.3(m+h)实施例101l2-(3-溴-2-甲基苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101l向配有回流冷凝管、磁力搅拌器和氮气入口的50ml三颈圆底烧瓶加入1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101k(560mg,2.95mmol)、2,6-二溴甲苯(1.47g)、碳酸铯(1.92g,5.90mmol)、n,n’-二甲基乙二胺(260mg,2.95mmol)和1,4-二噁烷(25ml)。在持续30min使氮气鼓泡经过所得的悬浮液后,加入铜n,n’-二甲基乙二胺(260mg,2.95mmol),并将反应混合物在105℃(油浴温度)下加热14h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(100ml)和水(20ml)稀释滤液。分离有机层,并用乙酸乙酯(3×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物,得到57%收率(600mg)的2-(3-溴-2-甲基苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101l,为白色固体:mp163–165℃;1hnmr(500mhz,dmso-d6)δ7.57(dd,1h,j=8.0,0.5hz),7.32(d,1h,j=7.5hz),7.21(t,1h,j=8.0hz),6.50(s,1h),4.11(m,3h),3.75(m,1h),2.59(m,2h),2.45(m,2h),2.21(s,3h),1.78(m,2h),1.68(m,2h);(apci+)m/z358.6(m+h)实施例101m2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101m向配有回流冷凝管、磁力搅拌器和氮气入口的50-ml三颈圆底烧瓶加入2-(3-溴-2-甲基苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101l(600mg,1.67mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷(1.70g,6.70mmol)、乙酸钾(656mg,6.68mmol)和1,4-二噁烷(25ml)。在持续30min使氮气鼓泡经过所得的悬浮液后,加入xphos(159mg,0.334mmol)和三(二亚苄基丙酮)二钯(0)(153mg,0.167mmol),并将反应混合物在105℃(油浴温度)下加热14h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(75ml)和水(20ml)稀释滤液。分离有机层,并用乙酸乙酯(3×25ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物,得到109%粗收率(740mg)的2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101m,为黄色油状物:1hnmr(300mhz,cdcl3)δ7.75(dd,1h,j=6.6,2.1hz),7.26(m,2h),6.80(s,1h),4.10(m,3h),3.75(m,1h),2.54(m,4h),2.45(s,3h),1.87(m,2h),1.75(m,2h),1.25(s,12h);ms(apci+)m/z407.7(m+h)向配有回流冷凝管、磁力搅拌器和氮气入口的100ml三颈圆底烧瓶加入2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101m(740mg,1.67mmol)、6-氯-4-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)哒嗪-3(2h)-酮101f(422mg,1.34mmol)、碳酸钠(568mg,5.36mmol)、dmf(5ml)、水(5ml)和1,4-二噁烷(20ml)。在持续30min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(155mg,0.134mmol),并将反应混合物在100℃下加热15h。此后,将混合物冷却至室温并用乙酸乙酯(100ml)和水(30ml)稀释。分离有机层,并用乙酸乙酯(3×25ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。在硅胶上通过柱色谱纯化残余物,得到17%收率(120mg)的101,为灰白色固体:mp195–197℃;1hnmr(500mhz,dmso-d6)δ12.95(s,1h),9.19(s,1h),7.75(s,1h),7.34(m,2h),7.29(m,1h),6.50(s,1h),5.96(s,1h),4.14(m,1h),4.08(m,2h),3.95(m,2h),3.77(m,1h),3.51(s,2h),2.78(t,2h,j=6.0hz),2.60(m,2h),2.46(t,2h,j=6.0hz),2.35(s,3h),2.07(s,3h),1.78(m,2h),1.68(m,2h);ms(esi+)m/z525.2(m+h)实施例1022-(2-甲基-3-(5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮102实施例102a乙基1-(氰基甲基)-1h-吲哚-2-羧酸酯102a用氮气吹扫配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶并加入乙基吲哚-2-羧酸酯(10.0g,52.9mmol)和dmf(100ml)。利用冰浴将溶液冷却至0℃。加入nah(60%在矿物油中的悬浮液,2.54g,63.5mmol)。将所得的混合物在室温下搅拌1h。其后,加入溴乙腈(7.62g,63.5mmol)。在室温下搅拌混合物14h。其后,在减压下浓缩反应混合物,并使残余物在乙酸乙酯(300ml)与水(900ml)之间分配。分离有机层,并用乙酸乙酯(3×300ml)萃取水层。用盐水洗涤合并的有机层,用硫酸钠干燥,然后在减压下浓缩。通过柱色谱纯化残余物,得到66%收率(8.00g)的102a,为灰白色固体:mp65–67℃;1hnmr(300mhz,cdcl3)δ7.72(d,1h,j=8.1),7.44(m,3h),7.25(m,1h),5.62(s,2h),4.42(q,2h,j=7.2hz),1.43(t,3h,j=7.2hz);ms(esi+)m/z229.1(m+h)。实施例102b3,4-二氢吡嗪并[1,2-a]吲哚-1(2h)-酮102b用氮气吹扫500-mlparr反应瓶并加入10%钯/碳(50%湿度,3.47g干重)、102a(8.00g,35.0mmol)、12%盐酸(17.5ml,70mmol)、乙酸乙酯(150ml)和乙醇(100ml)。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi,然后振摇6h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(10.0g),并通过celite521垫过滤混合物。用乙醇(2×50ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干。使残余物在乙酸乙酯(400ml)和10%碳酸钾水溶液(300ml)之间分配。分离有机层,并用乙酸乙酯(3×200ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。用乙醇(5ml)使残余物成粉末,得到70%收率(4.57g)的102b,为灰白色固体:mp228–230℃;1hnmr(300mhz,cdcl3)7.73(d,1h,j=8.1hz),7.34(m,3h),7.18(m,1h),6.75(brs,1h),4.29(t,2h,j=5.4hz),3.84(m,2h);ms(esi+)m/z187.1(m+h)。实施例102c2-(3-溴-2-甲基苯基)-3,4-二氢吡嗪并[1,2-a]吲哚-1(2h)-酮102c向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入102b(1.00g,5.37mmol)、(2.69g,10.7mmol)、碳酸铯(3.49g,10.7mmol)、n,n’-二甲基乙二胺(473mg,5.37mmol)和1,4-二噁烷(45ml)。在持续30min.使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(510mg,2.69mmol),并将反应混合物在105℃(油浴温度)下加热14h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(200ml)和水(40ml)稀释滤液。分离有机层,并用乙酸乙酯(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物得到62%收率(1.18g)的102c,为灰白色固体:mp178–180℃;1hnmr(300mhz,cdcl3)δ7.74(dt,1h,j=8.2,1.0hz),7.58(dd,1h,j=7.8,1.2hz),7.37(m,3h),7.19(m,3h),4.45(m,2h),4.21(m,1h),3.95(m,1h),2.38(s,3h);ms(esi+)m/z355.0(m+h)。实施例102d2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4-二氢吡嗪并[1,2-a]吲哚-1(2h)-酮102d向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入102c(1.18g,3.32mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(929mg,3.65mmol)、乙酸钾(491mg,4.98mmol)和1,4-二噁烷(25ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xphos(317mg,0.664mmol)和三(二亚苄基丙酮)二钯(0)(561mg,0.332mmol),并将反应混合物在105℃(油浴温度)下加热14h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(150ml)和水(40ml)稀释滤液。分离有机层,并用乙酸乙酯(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物得到57%收率(760mg)的102d,为灰白色固体:mp193–195℃;1hnmr(300mhz,cdcl3)δ7.80(dd,1h,j=7.0,1.7hz),7.74(d,1h,j=8.2hz),7.37(m,3h),7.28(m,2h),7.19(m,1h),4.45(m,2h),4.22(m,1h),3.94(m,1h),2.50(s,3h),1.35(s,12h);ms(esi+)m/z403.2(m+h)。向配有回流冷凝管、磁力搅拌器和氮气入口的25ml三颈圆底烧瓶加入102d(760mg,1.89mmol)、101f(379mg,1.35mmol)、碳酸钠(430mg,4.05mmol)、dmf(5ml)、水(2.5ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(437mg,0.378mmol),并将反应混合物在回流下加热14h。此后,将混合物冷却至室温并用乙酸乙酯(100ml)和水(30ml)稀释。分离有机层,并用乙酸乙酯(3×25ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。在硅胶上通过柱色谱纯化残余物得到26%收率(183mg)的102,为灰白色固体:mp188–190℃(dec);1hnmr(300mhz,dmso-d6)δ12.99(s,1h),9.23(s,1h),7.79(s,1h),7.71(d,1h,j=8.1hz),7.61(d,1h,j=7.9hz),7.38(m,4h),7.14(m,2h),5.97(s,1h),4.63(m,1h),4.49(m,1h),4.27(m,1h),4.12(m,3h),3.51(s,2h),2.79(t,2h,j=5.1hz),2.35(s,3h),2.18(s,3h);ms(esi+)m/z521.2(m+h)。实施例1034-{2-甲基-3-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢哒嗪-3-基]苯基}-7-硫杂-4-氮杂三环[6.4.0.02,6]十二-1(8),2(6),9,11-四烯-5-酮103实施例103a3-(溴甲基)苯并[b]噻吩-2-羧酸甲酯103a用氮气吹扫配有磁力搅拌器、氮气入口和回流冷凝管的250-ml单颈圆底烧瓶并加入3-甲基苯并[b]噻吩-2-羧酸甲酯(2.00g,9.70mmol)和苯(20ml)。加入n-溴琥珀酰亚胺(1.72g,9.70mmol)和2,2’-偶氮二异丁腈(160mg,1.00mmol),并使混合物回流2h。此后,将混合物冷却至室温并过滤。用四氯化碳(20ml)洗涤滤饼,然后在减压下浓缩滤液。通过柱色谱纯化所得的残余物得到82%收率(2.27g)的103a,为白色固体:mp101–102℃;1hnmr(500mhz,cdcl3)δ7.97(m,1h),7.86(m,1h),7.51(m,2h),5.22(s,2h),3.97(s,3h)。实施例103b3-((3-溴-2-甲基苯基氨基)甲基)苯并[b]噻吩-2-羧酸103b用氮气吹扫配有磁力搅拌器和回流冷凝管的250-ml单颈圆底烧瓶,并加入103a(2.26g,7.92mmol)、3-溴-2-甲基苯胺(1.77g,9.51mmol)和乙腈(50ml)。加入碳酸铯(7.75g,23.8mmol),并在50℃下搅拌混合物14h。此后,在减压下浓缩反应混合物,并将所得的残余物溶于thf(15ml)、甲醇(15ml)和水(15ml),并用一水合氢氧化锂(1.30g,31.0mmol)处理。在室温下搅拌14h后,在减压下除去溶剂,并用2m盐酸将所得的残余物酸化至ph5。用乙酸乙酯(3×30ml)萃取所得的混合物,合并有机萃取液,并用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到59%收率(1.70g)的103b,为白色固体:mp120–121℃;1hnmr(500mhz,dmso-d6)δ8.30(d,1h,j=12.5hz),7.98(d,1h,j=12.5hz),7.46(m,2h),6.77(m,3h),4.97(s,2h),2.15(s,3h);ms(esi+)m/z378.9(m+h)。实施例103c2-((3-溴-2-甲基苯基)-1h-苯并噻吩并[2,3-c]吡咯-3(2h)-酮103c用氮气吹扫配有磁力搅拌器的250ml单颈圆底烧瓶并加入103b(1.70g,4.51mmol)、三乙胺(914mg,9.00mmol)和无水dmf(25ml)。加入苯并三唑-1-基氧基-三(二甲基氨基)鏻六氟磷酸盐(bop,2.60g,5.90mmol),并将反应在室温下搅拌14h。此后,用水(20ml)稀释反应,并过滤所得的悬浮液。将滤饼溶于二氯甲烷(40ml)中,并用饱和碳酸氢钠水溶液(10ml)、水(10ml)洗涤溶液,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下蒸发溶剂。通过快速色谱法纯化所得的残余物得到78%收率的103c(1.26g),为白色半固体:1hnmr(500mhz,cdcl3)δ7.97(m,1h),7.80(m,1h),7.60(d,1h,j=8.0hz),7.49(m,2h),7.28(d,1h,j=8.0hz),7.16(t,1h,j=8.0hz),4.85(s,2h),2.37(s,3h)。实施例103d2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-1h-苯并噻吩并[2,3-c]吡咯-3(2h)-酮103d用氮气吹扫配有磁力搅拌器和回流冷凝管的250ml单颈圆底烧瓶,并加入103c(1.26g,3.51mmol)、4,4,4',4',-5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(2.23g,8.80mmol)、乙酸钾(1.00g,10.20mmol)和1,4-二噁烷(30ml)。持续30min使氮气流通过所得的悬浮液。加入[1,1′-双(二苯基膦)二茂铁]二氯化钯(ii)(260mg,0.355mmol),并将反应在回流下搅拌3h。此后,将混合物冷却至环境温度,使其在水(25ml)和乙酸乙酯(50ml)之间分配,然后通过celite521垫过滤。分离有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到定量收率(1.84g)的103d,为黄色半固体:1hnmr(500mhz,cdcl3)δ7.97(m,1h),7.80(m,2h),7.47(m,2h),7.35(d,1h,j=7.5hz),7.28(d,1h,j=7.5hz),4.86(s,2h),2.48(s,3h),1.35(s,12h)。实施例103e4-溴-6-氯-2-甲基哒嗪-3(2h)-酮103e用氮气吹扫配有磁力搅拌器的250ml单颈圆底烧瓶,并加入4-溴-6-氯哒嗪-3(2h)-酮(1.00g,4.77mmol)和dmf(15ml)。一次性加入氢化钠(60重量%,在油中,229mg,5.73mmol)。在室温下搅拌10分钟后,加入碘甲烷(1.02g,7.16mmol),并将反应在室温下搅拌1.5h。然后用饱和碳酸氢钠水溶液(10ml)终止反应并将所得的溶液倒入水(150ml)中。然后用乙酸乙酯(250ml)萃取混合物。用硫酸钠干燥有机层。然后通过过滤除去干燥剂,并在减压下浓缩滤液成残余物。经柱色谱纯化得到68%收率(722mg)的103e,为白色固体:mp107–108℃;1hnmr(300mhz,cdcl3)δ7.62(s,1h),3.81(s,3h)。实施例103f6-氯-2-甲基-4-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)哒嗪-3(2h)-酮103f向配有回流冷凝管、磁力搅拌器和氮气入口的250ml三颈圆底烧瓶加入4-溴-6-氯-2-甲基哒嗪-3(2h)-酮103e(1.90g,8.53mmol)、101e(1.18g,7.75mmol)和1,4-二噁烷(40ml)。用氮气吹扫烧瓶并冷却至0℃。加入六甲基二硅烷重氮锂在thf中的1m溶液(39ml,39.0mmol)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xantphos(381mg,0.659mmol)和三(二亚苄基丙酮)二钯(0)(355mg,0.388mmol),并将反应混合物在回流下加热2h。此后,将混合物冷却至室温并用水(10ml)稀释。用2n盐酸将溶液的ph调至7.6。分离有机层,并用乙酸乙酯(3×40ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。在硅胶上通过柱色谱纯化残余物得到76%收率(1.74g)的103f,为灰白色固体:mp184–186℃;1hnmr(300mhz,dmso-d6)δ9.62(s,1h),7.72(s,1h),6.00(s,1h),4.04(t,2h,j=5.1hz),3.65(s,3h),3.53(s,2h),2.82(t,2h,j=5.1hz),2.37(s,3h);ms(esi+)m/z295.1(m+h)。用氮气吹扫配有磁力搅拌器和回流冷凝管的150-ml单颈圆底烧瓶,并加入103d(580mg,1.43mmol)、103f(300mg,1.00mmol)、碳酸钠(320mg,3.00mmol)、1,4-二噁烷(8ml)、dmf(5ml)和水(2.5ml)。用氮气持续30min对此混合物进行脱气。加入四(三苯基膦)钯(120mg,0.103mmol)。在回流下加热14h后,将反应混合物冷却至室温,并在水(40ml)与二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤并在减压下浓缩。通过快速色谱法纯化所得的残余物得到44%收率(240mg)的103,为灰白色固体:mp175–176℃;1hnmr(500mhz,dmso-d6)9.28(s,1h),8.20(m,1h),8.04(s,1h),7.81(s,1h),7.56(m,3h),7.40(m,2h),5.99(s,1h),5.12(s,1h),3.97(t,2h,j=5.5hz),3.76(s,3h),3.51(s,2h),2.79(t,2h,j=8.5hz),2.35(s,3h),2.17(s,3h);ms(esi+)m/z538.2(m+h)。实施例1045-[2-(羟甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮104实施例104an-甲氧基-n-甲基-4,5,6,7-四氢苯并[b]噻吩-2-甲酰胺104a用氮气吹扫配有磁力搅拌器的250-ml单颈圆底烧瓶,加入4,5,6,7-四氢苯并[b]噻吩-2-羧酸(3.00g,16.5mmol)、二氯甲烷(80ml)和dmf(60mg,0.825mmol)并冷却至0℃。向所得的溶液滴加草酰氯(2.31g,18.2mmol)。在此加料完成后,将反应升温至室温并搅拌2h。此后,将反应在减压下浓缩至干。将所得的白色固体溶于二氯甲烷(80ml)中并将溶液冷却至0℃。然后加入三乙胺(5.00g,49.5mmol)和n,o-二甲基羟基胺(1.61g,16.5mmol)。在加料完成后,除去冷却浴,并将反应混合物在室温下搅拌16h。此后,使反应混合物在水(100ml)和乙酸乙酯(200ml)之间分配。分离各层,用乙酸乙酯(100ml)萃取水相。用水(100ml)、而后用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂,并在减压下蒸发溶剂。通过快速色谱法纯化所得的残余物得到88%收率的104a(3.29g),为白色固体:mp36–37℃;1hnmr(500mhz,cdcl3)δ7.79(s,1h),3.76(s,3h),3.34(s,3h),2.78(t,2h,j=6.0hz),2.62(t,2h,j=6.0hz),1.82(m,4h);ms(apci+)m/z226.3(m+h)实施例104b3-氯-1-(4,5,6,7-四氢苯并[b]噻吩-2-基)丙烷-1-酮104b用氮气吹扫配有磁力搅拌器的100-ml单颈圆底烧瓶,并加入104a(2.70g,12.0mmol)和无水thf(45ml),并用丙酮/冰浴将溶液冷却至-10℃。滴加乙烯基溴化镁在thf中的1.0m溶液(13.2ml,13.2mmol),并在0℃下搅拌所得的反应混合物4h。此后,使反应混合物在乙酸乙酯(100ml)和2m盐酸水溶液(40ml)之间分配。分离各层,并用乙酸乙酯(40ml)萃取水相。用水(100ml)、而后用盐水(100ml)洗涤合并的有机萃取液,用硫酸钠干燥,过滤并在减压下浓缩。将所得的残余物溶于二氯甲烷(30ml)中,并加入氯化氢在乙醚中的2m溶液(15ml)。在室温下搅拌1h后,在减压下除去溶剂。通过柱色谱纯化所得的残余物得到29%收率(804mg)的104b,为灰白色固体:mp57–58℃;1hnmr(500mhz,cdcl3)δ7.41(s,1h),3.89(t,2h,j=7.0hz),3.30(t,2h,j=7.0hz),2.81(t,2h,j=6.0hz),2.64(t,2h,j=6.0hz),1.83(m,4h);ms(eci+)m/z229.1(m+h)实施例104c5,6,7,8-四氢-1h-苯并[b]环戊二烯并[d]噻吩-3(2h)-酮104c向配有磁力搅拌器的50-ml单颈圆底烧瓶加入104b(800mg,3.51mmol)和98%硫酸(8ml)。在95℃下搅拌16h后,将反应混合物倒入冰(50g)中,并用乙酸乙酯(3×50ml)萃取所得的悬浮液。合并有机萃取液,用硫酸钠干燥,过滤并在减压下浓缩。通过快速色谱法纯化所得的残余物得到47%收率(320mg)的104c,为灰白色固体:mp75–76℃;1hnmr(500mhz,cdcl3)δ2.89(m,2h),2.87–2.83(m,4h),2.56(t,2h,j=6.5hz),1.84(m,4h)实施例104d5,6,7,8-四氢-1h-苯并[b]环戊二烯并[d]噻吩-3(2h)-酮肟104d向配有机械搅拌器和氮气入口的100ml单颈圆底烧瓶加入羟胺盐酸盐(573mg,8.25mmol)和甲醇(10ml)。利用冰浴将混合物冷却至0℃。加入乙酸钠(677mg,8.25mmol)。在0℃下搅拌混合物30min。此后,加入104c(319mg,1.65mmol),并在室温下搅拌反应16h。此后,浓缩混合物,然后用水(10ml)使所得的残余物成粉末。收集所得的固体,然后在真空烘箱中在45℃下干燥,得到84%收率(287mg)的104d,为灰白色固体:mp173–174℃;1hnmr(500mhz,dmso-d6)δ10.38(s,1h),2.97(m,2h),2.77–2.73(m,4h),2.47(m,2h),1.75(m,4h);ms(apci+)m/z208.3(m+h)实施例104e3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮104e向配有回流冷凝管、磁力搅拌器和氮气入口的50ml单颈圆底烧瓶加入104d(285mg,1.38mmol)和聚磷酸(15g)。在80℃下搅拌16h后,将反应混合物冷却至室温,加入水(30ml)。搅拌所得的混合物30min,然后过滤。用水(20ml)洗涤滤饼,然后在真空烘箱中在45℃下干燥得到75%收率(215mg)的104e,为灰白色固体:mp203℃dec;1hnmr(500mhz,cdcl3)δ5.62(s,1h),3.59(t,2h,j=7.0hz),2.81(t,2h,j=6.0hz),2.72(t,2h,j=7.0hz),2.48(t,2h,j=6.0hz),1.84(m,4h)。ms(apci+)m/z208.3(m+h)实施例104f2-溴-6-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯104f向配有回流冷凝管、磁力搅拌器和氮气入口的100ml三颈圆底烧瓶加入104e(214mg,1.04mmol)、2,6-二溴苄基乙酸酯104g(519mg,2.08mmol)、碳酸铯(678mg,2.08mmol)、n,n’-二甲基乙二胺(92mg,1.04mmol)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(99mg,0.520mmol),并将反应混合物在100℃(油浴温度)下加热16h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(100ml)和水(50ml)稀释滤液。分离有机层,并用乙酸乙酯(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物,得到30%收率(138mg)的2-溴-6-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯104f,为黄色油状物:1hnmr(500mhz,cdcl3)δ7.59(dd,1h,j=7.0,1.5hz),7.30–7.24(m,2h),5.23(m,2h),4.06(m,1h),3.77(m,1h),2.98(m,1h),2.83–2.77(m,3h),2.50(m,2h),2.04(s,3h),1.85(m,4h)实施例1042,6-二溴苄基乙酸酯104g用氮气吹扫配有磁力搅拌器、回流冷凝管和氮气入口的250ml单颈圆底烧瓶,并加入2,6-二溴甲苯(2.50g,10.0mmol)、n-溴琥珀酰亚胺(1.78g,10.0mmol)和四氯化碳(40ml)。将溶液加热至80℃(油浴温度),加入2,2’-偶氮二异丁腈(164mg,1.00mmol)。使所得的混合物回流14h。其后,将混合物冷却至室温并过滤。用四氯化碳(2×20ml)洗涤滤饼。用乙酸乙酯(200ml)稀释滤液,并用水(40ml)、饱和碳酸氢钠水溶液(40ml)和盐水(40ml)洗涤。用硫酸钠干燥有机层,然后在减压下浓缩,得到定量收率(3.28g)的1,3-二溴-2-(溴甲基)苯,为黄色固体:mp77–78℃;1hnmr(300mhz,cdcl3)δ7.55(d,2h,j=8.1hz),7.07(t,1h,j=8.1hz),4.83(s,2h)用氮气吹扫配有磁力搅拌器和氮气入口的250ml单颈圆底烧瓶,并加入1,3-二溴-2-(溴甲基)苯(3.28g,10.0mmol)、乙酸钾(3.93g,40.0mmol)和dmf(100ml)。在室温下搅拌溶液14h。其后,用水(900ml)稀释反应混合物并用乙酸乙酯(3×200ml)萃取。用盐水(100ml)洗涤合并的有机层,用硫酸钠干燥并在减压下浓缩。通过柱色谱纯化残余物,得到88%收率(2.70g)的2,6-二溴苄基乙酸酯104g,为灰白色固体:mp62–65℃;1hnmr(300mhz,cdcl3)δ7.57(d,2h,j=8.0hz),7.07(t,1h,j=7.9hz),5.42(s,2h),2.11(s,3h);ms(esi+)实施例104h1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮104h用氮气吹扫配有磁力搅拌器和温度调节器的100-ml单颈圆底烧瓶,并加入5-溴-1-甲基-3-(嘧啶-4-基氨基)吡啶-2(1h)-酮109b(300mg,1.07mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(534mg,2.14mmol)、乙酸钾(210mg,2.14mmol)和1,4-二噁烷(10ml)。使氮气流持续30min通过所得的悬浮液。然后加入[1,1′-双(二苯基膦)二茂铁]二氯化钯(ii)与二氯甲烷的络合物(pddppfcl2·ch2cl2,39mg,0.054mmol),并在95℃下搅拌反应30min。此后,将混合物冷却至周围环境,在水(40ml)和乙酸乙酯(60ml)之间分配,然后通过celite521垫过滤。分离有机相,用硫酸钠干燥,过滤,然后在减压下浓缩得到粗品104h,为黑色油状物,未经进一步纯化将其直接用于下一步骤。ms(esi+)m/z329.1(m+h)用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入104f(136mg,0.313mmol)、粗品104h(1.07mmol,假定定量收率)、碳酸钠(100mg,0.940mmol)、1,4-二噁烷(5ml)和水(1ml)。用氮气对此混合物进行脱气30min。加入四(三苯基膦)钯混合物(636mg,0.031mmol)。在100℃下加热3h后,将反应冷却至室温,并在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于甲醇(5ml)中,加入碳酸钾(500mg,3.62mmol)。在室温下搅拌2h后,使反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物,得到26%收率(42mg)的104,为白色固体:mp>250℃;1hnmr(500mhz,dmso-d6)δ9.17(s,1h),8.71(d,1h,j=2.5hz),8.64(s,1h),8.29(d,1h,j=6.0hz),7.52(d,1h,j=2.5hz),7.45(t,1h,j=7.5hz),7.36–7.30(m,3h),4.84(t,1h,j=3.5hz),4.36(m,2h),4.03(m,1h),3.87(m,1h),3.60(s,3h),2.96(m,1h),2.85(m,1h),2.77(m,2h),2.58–2.46(m,2h),1.79(m,4h);ms(apci+)m/z514.2(m+h)实施例10510-[2-(羟甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮105实施例105a3,3-二甲基环戊烷酮105a用氮气吹扫配有磁力搅拌器、加料漏斗和氮气入口的1-l三颈圆底烧瓶,并加入乙醚(200ml)和碘化亚铜(i)(54.46g,0.286mol)。将混合物冷却至0℃,将甲基锂(1.6m在乙醚中,357.5ml,0.572mol)在1.5h内滴加到反应混合物中并在0℃下再搅拌2h。其后,在1.5h内滴加3-甲基环戊-2-烯酮(25g,0.260mol)在乙醚(150ml)中的溶液。然后在0℃下搅拌反应混合物2h,然后倒入十水合硫酸钠(300g)中。将所得的混合物搅拌30min。此后,过滤混合物并用乙醚(1000ml)洗涤。浓缩滤液并在减压下蒸馏,得到70%收率(20.5g)的3,3-二甲基环戊烷酮105a,为无色液体:bp50–55℃(在10mmhg下);1hnmr(300mhz,cdcl3)δ2.31(t,2h,j=7.8hz),2.05(s,2h),1.79(t,2h,j=7.8hz);ms(esi+)m/z113.3(m+h)实施例105b5,5-二甲基-5,6-二氢-4h-环戊二烯并[b]噻吩-2-羧酸乙酯105b用氮气吹扫配有磁力搅拌器、回流冷凝管、加料漏斗和氮气入口的500-ml三颈圆底烧瓶,并加入dmf(9.49g,0.100mol)和二氯甲烷(100ml)。将反应混合物冷却至0℃并在30min内将三氯氧磷(14.1g,0.920mol)滴加到反应中。一旦此加料完成,就将反应升温至室温并搅拌1h。此后,在1h内滴加105a(11.2g,0.100mol)在二氯甲烷(100ml)中的溶液。然后将反应在回流下搅拌18h。将反应混合物冷却至室温,然后倒入碎冰(400ml)和乙酸钠(100g,1.22mol)的混合物中。搅拌所得的混合物45min。此后,分离水层并用二氯甲烷(2×500ml)萃取。然后用水(2×200ml),而后用盐水(200ml)洗涤合并的有机层,用硫酸钠干燥。然后通过过滤除去干燥剂,而后浓缩滤液得到粗产物2-氯-4,4-二甲基环戊-1-烯甲醛,将其置于配有机械搅拌器、回流冷凝管和氮气入口的500-ml三颈圆底烧瓶中。然后加入二氯甲烷(200ml)、2-巯基乙酸乙酯(11.0g,0.092mol)和三乙胺(30g,0.207mol)。其后将反应混合物在回流下搅拌6h。此后,将反应冷却至室温并浓缩成浓稠橙色残余物。加入乙醇(200ml)和三乙胺(30.0g,0.207mol)并将反应在回流下加热12h。然后将反应冷却至室温并在减压下浓缩,然后用乙醚(600ml)稀释所得的残余物。用1m盐酸(150ml)、盐水(100ml)洗涤所得的混合物,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱纯化所得的残余物得到34%收率(7.70g)的105b,为无色液体:1hnmr(300mhz,cdcl3)δ7.48(s,1h),4.33(q,2h,j=7.2hz),2.72(s,2h),2.56(s,2h),1.38(t,3h,j=1.8hz),1.17(s,6h);ms(esi+)m/z225.1实施例105c5,5-二甲基-5,6-二氢-4h-环戊二烯并[b]噻吩-2-羧酸105c在配有磁力搅拌器和回流冷凝管的250-ml单颈圆底烧瓶中,将105b(4.00g,17.8mmol)溶于乙醇(50ml)中。加入thf(50ml)、水(50ml)和氢氧化锂(854mg,35.6mmol),并在60℃下搅拌混合物4h。此后将反应冷却至室温并用2m盐酸酸化至ph1.5,然后用乙酸乙酯(2×200ml)萃取。合并有机层,用水(2×100ml),而后用盐水(100ml)洗涤并用硫酸钠干燥。然后通过过滤分离干燥剂。在蒸发所得的滤液后,获得91%收率(3.2g)的105c,为白色固体:mp170–172℃;1hnmr(300mhz,cdcl3)δ12.77(s,1h),7.46(s,1h),2.71(s,2h),2.53(s,2h),1.20(s,6h);ms(esi–)m/z195.0实施例105d5,5-二甲基-5,6-二氢-4h-环戊二烯并[b]噻吩-2-羧酸105d向配有磁力搅拌器、回流冷凝管以及置于冷凝管上的吹泡器的100-ml单颈圆底烧瓶加入105c(2.30g,11.6mmol)、甲苯(25ml)、亚硫酰氯(4.09g,34.9mmol)和dmf(1滴)。将混合物在回流下加热1h,然后在旋转蒸发器上在45℃下在减压下蒸发。用二氯甲烷(20ml)稀释所得的酰氯。在另一个配有磁力搅拌器的250-ml三颈圆底烧瓶中,将n,o-二甲基羟胺盐酸盐(2.26g,23.2mmol)和n,n-二异丙基乙胺(2.97g,23.0mmol)在氮气下溶于无水二氯甲烷(20ml)中,并在冰/水浴中将溶液冷却至0℃。加入酰氯溶液,并将反应混合物在室温下搅拌18h。用水(100ml)、10%柠檬酸溶液(50ml)以及饱和碳酸氢钠水溶液和水的1:1混合物(100ml)萃取反应混合物。用硫酸钠干燥有机层,并在旋转蒸发器上在减压下蒸发,得到93%收率(2.60g)的105d,为浅黄色固体:1hnmr(300mhz,cdcl3)δ7.66(s,1h),3.77(s,3h),3.35(s,3h),2.74(s,2h),2.58(s,2h),1.23(s,6h)实施例105e3-氯-1-(5,5-二甲基-5,6-二氢-4h-环戊二烯并[b]噻吩-2-基)丙烷-1-酮105e用氮气吹扫配有磁力搅拌器的100-ml单颈圆底烧瓶,并加入105d(2.41g,10.0mmol)和无水thf(20ml)。将溶液冷却至-70℃,并在反应温度保持低于-60℃的情况下加入1m乙烯基溴化镁/thf(11ml,11.0mmol)。将反应混合物在-13至-7℃下搅拌2h,然后在30min内升温至室温。将反应再冷却至-70℃,并加入氯化氢在乙醚中的2m溶液(22.5ml,45mmol)。然后将反应在冷藏室中在-10℃下过夜储藏。此后在旋转蒸发器上在减压下蒸发混合物,并将所得的残余物在水(100ml)和醚(100ml)之间分配。用硫酸钠干燥乙醚萃取液,然后在旋转蒸发器上在减压下蒸发得到粗品105e(2.86g,118%),为褐色油状物,纯度约75%(nmr):1hnmr(300mhz,cdcl3)δ7.45(s,1h),3.89(t,2h,j=6.9hz),3.30(t,2h,j=6.9hz),2.75(s,2h),2.59(s,2h),1.24(s,6h)实施例105f6,6-二甲基-1,2,6,7-四氢二环戊二烯并[b,d]噻吩-3(5h)-酮105f向配有磁力搅拌器的100-ml单颈圆底烧瓶加入粗品105e(2.86g,10.0mmol,假定定量收率)和98%硫酸。在90℃油浴中过夜加热反应混合物。将反应混合物置于冰/丙酮浴中,并一次性加入磷酸氢钾(105g,0.603mol)在水(300ml)中的冷溶液(5℃)。将所得的混合物与乙酸乙酯(300ml)一起振摇并过滤。用乙酸乙酯(100ml)洗涤滤饼。分离滤液的乙酸乙酯层,用硫酸钠干燥,然后在旋转蒸发器上在减压下蒸发。通过快速色谱纯化所得的残余物(硅胶,80:20己烷/乙酸乙酯),以两步37%收率(683mg)得到105f,为非结晶的褐色固体:mp60–62℃;1hnmr(500mhz,cdcl3)δ2.92–2.87(m,4h),2.79(s,2h),2.53(s,2h),1.26(s,6h).;ms(esi+)m/z207.0(m+h)实施例105g6,6-二甲基-1,2,6,7-四氢二环戊二烯并[b,d]噻吩-3(5h)-酮105g向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶加入羟胺盐酸盐(688mg,9.90mmol)、乙酸钠(812mg,9.90mmol)和甲醇(10ml),并将混合物在室温下搅拌30min。此后,在室温下滴加105f的溶液(680mg,3.30mmol),并在氮气氛下在室温下搅拌反应14h。因为反应未完成,加入羟胺盐酸盐(1.15g,16.5mmol)和乙酸钠(1.35g,16.5mmol),并继续在室温下搅拌58h。此后,用二氯甲烷(150ml)和水(100ml)稀释混合物,分离各层。用盐水(50ml)洗涤有机层,然后用硫酸钠干燥。通过过滤除去干燥剂,然后浓缩滤液得到定量收率(730mg)的粗品105g,为黄色半固体,未经纯化将其用于下一步:mp122–124℃;主要异构体的1hnmr(500mhz,cdcl3)δ3.13–3.11(m,2h),2.85–2.83(m,2h),2.77(s,2h),2.49(s,2h),1.24(s,6h);ms(esi+)m/z222.0(m+h)实施例105h6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-酮105h向配有回流冷凝管、机械搅拌器和氮气入口的100-ml三颈圆底烧瓶加入105g(700mg,3.16mmol)和聚磷酸(25g)。将反应混合物在氮气氛下在80℃下搅拌13h。此后,将混合物冷却至0℃,并小心地滴加水(50ml)同时保持内部温度在10–45℃。用90:10二氯甲烷/甲醇(100ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(50ml)萃取水层,用饱和碳酸氢钠水溶液(50ml)、盐水(150ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱法纯化所得的残余物(硅胶,95:5二氯甲烷/甲醇),得到90%收率(630mg)的6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-酮105h,为非结晶灰白色固体:mp205–207℃;1hnmr(500mhz,cdcl3)δ5.51(s,1h),3.60–3.56(m,2h),2.76–2.73(m,4h),2.49(s,2h),1.26(s,6h);ms(esi+)m/z222.0(m+h)实施例105i(2-溴-6-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}苯基)甲基乙酸酯105i向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶加入105h(624mg,2.82mmol)、2,6-二溴苄基乙酸酯104g(1.73g,5.65mmol)、碳酸铯(1.84g,5.65mmol)、n,n’-二甲基乙二胺(249mg,2.82mmol)和1,4-二噁烷(15ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(269mg,1.41mmol)。将回流冷凝管连接到烧瓶,然后将反应混合物在90℃下加热14h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(100ml)和水(50ml)稀释滤液,并分离各层。用乙酸乙酯(2×30ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,70:30己烷/乙酸乙酯)得到52%收率(660mg)的105i,为白色固体:mp126–128℃;1hnmr(500mhz,cdcl3)δ7.60(dd,j=7.5,1.5hz,1h),7.29–7.24(m,2h),5.24(s,2h),4.05–3.99(m,1h),3.78–3.74(m,1h),3.06–2.99(m,1h),2.84–2.80(m,1h),2.77(s,2h),2.52(s,2h),2.05(s,3h),1.27(s,6h);ms(esi+)m/z448.0(m+h)向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶加入105i(250mg,0.558mmol)、以上制得的粗品1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮104h(400mg,0.951mmol,在上一步骤中假定定量收率)、碳酸钠(177mg,1.67mmol)、dmf(2ml)、水(2ml)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(129mg,0.112mmol)。将回流冷凝管连接到烧瓶,将反应混合物在100℃下加热12h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,然后用盐水(100ml)洗涤合并的有机层,并用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后将所得的残余物溶于thf(5ml)、水(5ml)和甲醇(5ml)中。加入一水合氢氧化锂(117mg,2.79mmol),并在室温下搅拌混合物2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(50ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2×75ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,90:10二氯甲烷/甲醇)和制备型hplc(70:30水/乙腈)纯化所得的残余物得到14%收率(42mg)的105,为非结晶灰白色固体:mp252–254℃;1hnmr(500mhz,dmso-d6)δ9.18(s,1h),8.71(s,1h),8.64(s,1h),8.30(d,j=6.0hz,1h),7.53(s,1h),7.47(t,j=7.5hz,1h),7.37–7.31(m,3h),4.86–4.85(m,1h),4.40–4.32(m,2h),4.05–4.00(m,1h),3.88–3.84(m,1h),3.60(s,3h),3.05–2.99(m,1h),2.91–2.88(m,1h),2.75(s,2h),2.57–2.53(m,2h),1.23(s,6h);ms(esi+)m/z528.2(m+h)实施例1062-(3-(5-(5-环丙基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮106除了使用113a和136d之外,利用与实施例136e和实施例136相同的方法制备实施例106,得到20mg的106,为白色固体。ms(esi+)m/z525(m+h)。实施例1072-(2-(羟甲基)-3-(1-甲基-5-(5-吗啉代吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮107使用255c和114a作为原料,利用与实施例301相同的方法制备实施例107,得到122mg的107,为白色固体。ms(esi+)m/z622.4(m+h)。实施例1082-(3-(5-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮108实施例108a2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪108a向配有磁力搅拌器的密封管加入1-(2-溴乙基)-5-(溴甲基)-3-硝基-1h-吡唑101c(4g,12.9mmol)、在二噁烷中的0.5m氨溶液(200ml)。将所得的混合物小心地过夜加热至50℃。此后,在减压下浓缩反应混合物,并向残余物添加h2o(50ml)和etoac(50ml)。分离水层,并用etoac(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。在减压下浓缩所得的溶液,得到100%收率(2.1g)的粗品2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪108a。实施例108b1-(2-硝基-6,7-二氢吡唑并[1,5-a]吡嗪-5(4h)-基)乙酮108b向200ml圆底烧瓶加入2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪108a(2.1g,12.9mmol)、三乙胺(5.5ml,38.7mmol)、乙酰氯(1.1ml,15.5mmol)和ch2cl2(100ml)。在室温下过夜搅拌混合物。此后,在减压下浓缩反应混合物,并向残余物添加h2o(50ml)和etoac(50ml)。分离水层,并用etoac(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液。用9:1ch2cl2:meoh(2x50ml)反萃取合并的水萃取液。用硫酸钠干燥合并的有机萃取液。通过柱色谱纯化所得的残余物,用ch2cl2–9:1ch2cl2:meoh的梯度洗脱,得到84%收率(2.3g)的1-(2-硝基-6,7-二氢吡唑并[1,5-a]吡嗪-5(4h)-基)乙酮108b。实施例108c1-(2-氨基-6,7-二氢吡唑并[1,5-a]吡嗪-5(4h)-基)乙酮108c向500-mlparr氢化瓶加入1-(2-硝基-6,7-二氢吡唑并[1,5-a]吡嗪-5(4h)-基)乙酮108b(2.3g,10.9mmol)、10%钯/碳(50%湿度,570mg干重)和乙醇(100ml)。对瓶抽真空,充入氢气至压力50psi并在parr氢化装置上振摇2h。通过celite521垫过滤除去催化剂,并用1:1ch2cl2:meoh(500ml)洗涤。在减压下浓缩所得的溶液,得到95%收率(1.9g)的粗品1-(2-氨基-6,7-二氢吡唑并[1,5-a]吡嗪-5(4h)-基)乙酮108c。实施例108d3-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮108d向配有磁力搅拌器的密封管加入1-(2-氨基-6,7-二氢吡唑并[1,5-a]吡嗪-5(4h)-基)乙酮108c(860mg,4.8mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.8g,6.7mmol)和碳酸铯(3.4g,10.5mmol)及1,4-二噁烷(67ml)。在持续30min使氮气鼓泡经过溶液后,加入xantphos(330mg,0.6mmol)和三(二亚苄基丙酮)二钯(0)(300mg,0.3mmol),并将反应混合物加热至100℃持续16h。此后,加入h2o(50ml)和etoac(50ml)。分离水层并用etoac(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,并用硫酸钠干燥。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:et2o:meoh的梯度洗脱,得到41%收率(720mg)的3-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮108d。实施例108e2-(5-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯108e向配有磁力搅拌器的微波用管加入3-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮108d(120mg,0.3mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(200mg,0.4mmol)、dme(4ml)和1m碳酸钠水溶液(1ml)。在持续15min鼓吹氮气后,加入pd(pph3)4(19mg,0.02mmol)。将混合物在微波中加热至130℃持续15min。此后,加入乙酸乙酯(5ml)和水(5ml)。用etoac(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:et2o:meoh的梯度洗脱,得到33%收率(69mg)的2-(5-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯108e。向配有磁力搅拌器的25ml圆底烧瓶加入2-(5-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯108e(69mg,0.11mmol)、氢氧化锂(8mg,0.3mmol)、thf(1ml)、i-proh(1ml)和水(2ml)。在rt下搅拌混合物2h。此后,加入etoac(3ml)和水(3ml)。用etoac(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–75:18:7ch2cl2:et2o:meoh的梯度洗脱,得到63%收率(40mg)的2-(3-(5-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮108。ms(esi+)m/z582.3(m+h)。实施例1092-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮109实施例109a2-溴-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯109a向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮101k(720mg,3.78mmol)、2,6-二溴苄基乙酸酯104g(2.33g,7.57mmol)、碳酸铯(2.47g,7.57mmol)、n,n’-二甲基乙二胺(333mg,3.78mmol)和1,4-二噁烷(31ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(360mg,1.89mmol),并将反应混合物在105℃(油浴温度)下加热3天。此后,将混合物冷却至室温并过滤。用乙酸乙酯(200ml)和水(40ml)稀释滤液。分离有机层,并用乙酸乙酯(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物,得到31%收率(490mg)的2-溴-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯109a。实施例109b5-溴-1-甲基-3-(嘧啶-4-基氨基)吡啶-2(1h)-酮109b将嘧啶-4-胺(2.0g,21mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(6.2g,23.1mmol)、三(二亚苄基丙酮)二钯(0)(0.96g,1.1mmol)、xantphos(1.03g,1.79mmol)和碳酸铯(7.5g,23mmol)在二噁烷(25ml)中的溶液在密封管中在130℃下加热18小时。用ch2cl2(100ml)稀释混合物,并通过硅藻土垫过滤。在旋转蒸发器上在真空下浓缩溶液。然后将材料溶于最少的ch2cl2(5ml)中并用et2o(80ml)使其成粉末。然后过滤产物,并用et2o(100ml)洗涤,得到2.9g(49%)的109b。实施例109c1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮109c将5-溴-1-甲基-3-(嘧啶-4-基氨基)吡啶-2(1h)-酮109b(600mg,2.13mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(596mg,2.35mmol)、[1,1′-双(二苯基膦)二茂铁]二氯化钯(ii)与二氯甲烷的络合物(174mg,0.213mmol)、乙酸钾(628mg,6.40mmol)在二噁烷(4.5ml)中的溶液密封在微波用管中,并加热至130℃持续10分钟。通过硅藻土垫过滤溶液并浓缩。粗品1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮109c未经纯化用于下一步骤。将109c(粗品,2.13mmol)、109a(300mg,0.719mmol)、四(三苯基膦)钯(0)(83mg,0.0719mmol)和碳酸钠(229mg,2.16mmol)在二噁烷(4.5ml)和水(2.3ml)中的溶液密封在微波用管中并加热至130℃持续10分钟。将有机层与水层分开,并通过硅藻土垫过滤。然后将材料吸附在硅藻土上,然后利用在己烷中的0-100%乙酸乙酯而后转换成在二氯甲烷中的0-15%甲醇,通过硅胶色谱纯化得到105mg(27%)的109。实施例1102-(3-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮110实施例110a2-硝基-6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪110a向配有磁力搅拌器和回流冷凝管的250-ml单颈圆底烧瓶加入101c(3.00g,9.59mmol)和4m氢溴酸水溶液(120ml),并将所得的混合物在回流下加热24h。此后,将反应混合物在减压下浓缩至约6ml体积,并将残余物在2m氢氧化钠水溶液(40ml)中搅拌2h。此后加入二氯甲烷(40ml)并搅拌混合物15min。分离水层,并用二氯甲烷(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液得到62%收率(1.01g)的110a,为白色固体:mp110–112℃;1hnmr(300mhz,cdcl3)6.68(s,1h),4.87(s,2h),4.28(t,2h,j=5.4hz),4.20(t,2h,j=5.1hz);ms(esi+)m/z170.0(m+h)。实施例110b6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-胺110b用氮气吹扫500-mlparr氢化瓶并加入110a(1.01g,5.92mmol)、10%钯/碳(50%湿度,125mg干重)和乙醇(50ml)。对瓶抽真空,充入氢气至压力25psi并在parr氢化装置上振摇2h。然后抽除氢气并将氮气充入瓶中。通过celite521垫过滤除去催化剂,然后在减压下浓缩滤液。通过柱色谱纯化所得的残余物,使用400cc硅胶并用3%甲醇/二氯甲烷洗脱。收集含有110b的级分,在减压下浓缩后得到73%收率(601mg)的110b,为黄色固体:mp74–76℃1hnmr(300mhz,5.37(s,1h),4.72(s,2h),4.07(t,2h,j=5.1hz),3.98(t,2h,j=5.1hz),3.57(brs,2h);ms(esi+)m/z140.4(m+h)。实施例110c5-溴-3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮110c向配有磁力搅拌器、回流冷凝管和氮气入口的50-ml三颈圆底烧瓶加入1,4-二噁烷(20ml)、110b(600mg,4.31mmol)、3,5-二溴-1-甲基吡啶–2(1h)-酮(1.44g,5.40mmol)和碳酸铯(3.08g,9.48mmol)。在持续30min使氮气鼓泡经过所得溶液后,加入xantphos(300mg,0.52mmol)和三(二亚苄基丙酮)二钯(0)(320mg,0.35mmol),并将反应混合物在回流下加热2h。此后将反应冷却至室温,在乙酸乙酯(75ml)和水(75ml)之间分配,然后过滤。分离水层,并用乙酸乙酯(2×25ml)萃取。合并有机层,用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂并在减压下浓缩滤液。通过柱色谱纯化所得的残余物,使用500cc硅胶并用1%甲醇/二氯甲烷洗脱。收集含有110c的级分,在减压下浓缩后,得到31%收率(433mg)的110c,为绿色固体:mp195–197℃;1hnmr(300mhz,cdcl3)7.92(d,1h,j=2.4hz),7.44(s,1h),6.90(d,1h,j=2.4hz),5.65(s,1h),4.80(s,2h),4.13(s,2h),3.61(s,5h);ms(esi+)m/z324.9(m+h)。实施例110d2-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯110d向配有磁力搅拌器的微波用管加入5-溴-3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮110c(130mg,0.4mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(220mg,0.5mmol)、dme(4ml)和1m碳酸钠水溶液(1.2ml)。在持续15min鼓吹n2后,加入pd(pph3)4(23mg,0.02mmol)。将混合物在微波中加热至130℃持续20min。此后,加入etoac(5ml)和水(5ml)。用etoac(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:et2o:meoh的梯度洗脱,得到89%收率(210mg)的110d。向配有磁力搅拌器的25ml圆底烧瓶加入110d(210mg,0.4mmol)、氢氧化锂(45mg,1.1mmol)、thf(3.6ml)、i-proh(3.6ml)和水(7.2ml)。在rt下搅拌混合物3h。此后,加入etoac(10ml)和水(10ml)。用etoac(2x10ml)萃取分离的水层。用盐水(20ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:et2o:meoh的梯度洗脱,得到57%收率(110mg)的110。ms(esi+)m/z541.3(m+h)。实施例1115-[2-(羟甲基)-3-[4-甲基-5-氧代-6-(吡啶-3-基氨基)-4,5-二氢吡嗪-2-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮111实施例111a2-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯111a用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入104f(1.18g,2.72mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷(2.04g,8.16mmol)、乙酸钾(800mg,8.16mmol)和1,4-二噁烷(20ml)。持续30min使氮气流通过所得的悬浮液。然后加入[1,1′-双(二苯基膦)二茂铁]二氯化钯(ii)(398mg,0.544mmol),并在90℃下搅拌反应8h。此后,将混合物冷却至环境温度,在水(25ml)和乙酸乙酯(50ml)之间分配,然后通过celite521垫过滤。分离有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物,得到77%收率(1.01g)的111a,为褐色固体:1hnmr(500mhz,cdcl3)δ7.81(d,1h,j=7.0hz),7.41(t,1h,j=7.0hz),7.37(d,1h,j=7.0hz),5.49(d,1h,j=11.5hz),5.23(d,1h,j=11.5hz),4.01(m,1h),3.76(m,1h),2.96(m,1h),2.81–2.75(m,3h),2.50(m,2h),1.99(s,3h),1.86(m,4h),1.33(s,12h);ms(esi+)m/z482.2(m+h)。实施例111b5-溴-1-甲基-3-(吡啶-3-基氨基)吡嗪-2(1h)-酮111b向配有磁力搅拌器、回流冷凝管和氮气入口的100-ml单颈圆底烧瓶加入thf(15ml)、3,5-二溴-1-甲基吡嗪–2(1h)-酮(1.00g,3.73mmol)、3-氨基吡啶(351mg,3.73mmol)和叔丁醇钠(789mg,8.21mmol)。在持续30min使氮气鼓泡经过所得的溶液后,加入二-μ-溴双(三叔丁基膦)二钯(i)(29mg,0.037mmol),并将反应混合物在室温下搅拌2.5h。此后使反应在乙酸乙酯(50ml)和水(50ml)之间分配,然后过滤。分离水层,并用乙酸乙酯(2×25ml)萃取。合并有机层,用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过柱色谱纯化所得的残余物,得到35%收率(370mg)的111b,为褐色固体:mp>250℃;1hnmr(500mhz,dmso-d6)9.75(s,1h),9.08(d,1h,j=2.5hz),8.32(m,1h),8.24(dd,1h,j=5.0,1.5hz),7.40(s,1h),7.36(dd,1h,j=8.5,4.5hz),3.45(s,3h);ms(apci+)m/z281.0(m+h)。用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入111a(134mg,0.279mmol)、111b(71mg,0.253mmol)、碳酸钠(80mg,0.759mmol)、1,4-二噁烷(5ml)和水(1ml)。用氮气对此混合物持续30min脱气。加入四(三苯基膦)钯(29mg,0.025mmol)。在100℃下加热3h后,将反应混合物冷却至室温,并在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于甲醇(5ml)中,并加入碳酸钾(500mg,3.62mmol)。在室温下搅拌2h后,将反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物,得到38%收率(49mg)的111,为白色固体:mp164–165℃;1hnmr(500mhz,dmso-d6)δ9.54(s,1h),9.14(d,1h,j=2.5hz),8.42(m,1h),8.18(dd,1h,j=4.5,1.5hz),7.54(d,1h,j=8.0hz),7.49–7.46(m,2h),7.34(d,1h,j=8.0hz),7.30(dd,1h,j=8.0,4.5hz),4.81(m,1h),4.49(dd,1h,j=11.0,3.5hz),4.43(dd,1h,j=11.0,6.5hz),4.02(m,1h),3.86(m,1h),3.56(s,3h),2.95(m,1h),2.86(m,1h),2.77(m,2h),2.58–2.46(m,2h),1.79(m,4h);ms(apci+)m/z514.2(m+h)。实施例1122-(2-(羟甲基)-3-(1-甲基-5-(5-甲基-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮112实施例112a5-溴-1-甲基-3-(5-甲基-1h-吡唑-3-基氨基)吡啶-2(1h)-酮112a向磁力搅拌器的250ml密封管加入5-甲基-1h-吡唑-3-胺(0.91g,9.36mmol)、3,5-二溴-1-甲基-1h-吡啶-2-酮(2.1g,7.87mmol)、碳酸铯(7.6g,23.56mmol)和1,4-二噁烷(78ml)。在脱气10分钟后,加入三(二亚苄基丙酮)二钯(0)(0.72g,0.8mmol)和xantphos(0.91g,1.57mmol)。将反应混合物在115℃下加热48小时。然后将混合物冷却至室温并在二氯甲烷(50ml)和水(30ml)之间分配。分离有机相,并用二氯甲烷(3x30ml)萃取水层。用硫酸钠干燥合并的有机相,然后在减压下浓缩。通过快速色谱纯化残余物(硅胶,9:1二氯甲烷/甲醇)得到85%收率(1.88g)的112a,为固体:ms(esi+)m/z285.0(m+h)。向配有磁力搅拌器的10ml微波用小瓶加入2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(181mg,0.39mmol)、112a(85mg,0.3mmol)、1m碳酸钠溶液(1.2ml,1.2mmol)和1,2-二甲氧基乙烷(3ml)。在持续10min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(18mg,0.015mmol)。将反应混合物在微波反应器中在130℃下加热10分钟。然后加入乙酸乙酯(10ml)和水(5ml),并分离各层。用乙酸乙酯(2×10ml)萃取水层,并用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,60:35:5二氯甲烷/乙醚/甲醇),得到100mg112b和112的混合物,为黄色残余物。将残余物溶于thf(1ml)、水(0.5ml)和异丙醇(1ml)的混合物中。加入一水合氢氧化锂(31mg,0.74mmol),并在室温下搅拌混合物2h。此后,用90:10二氯甲烷/甲醇(10ml)和水(5ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2×10ml)萃取水层,用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,60:35:5二氯甲烷/醚/甲醇),得到18%收率(两步,28mg)的2-(2-(羟甲基)-3-(1-甲基-5-(5-甲基-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮112,为白色固体:ms(esi+)m/z499.3(m+h)。实施例1132-(2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮113实施例113a2-溴-6-(1-氧代-3,4,6,7,8,9-六氢-1h-吡嗪并[1,2-a]吲哚-2-基)苄基乙酸酯113a向配有磁力搅拌棒的350-ml密封管加入3,4,6,7,8,9-六氢-2h-吡嗪并[1,2-a]吲哚-1-酮101k(5.0g,0.026mol)、2,6-二溴苄基乙酸酯104g(16.2g,0.052mol)、n,n’-二甲基乙二胺(2.6ml,0.026mol)、cs2co3(17.0g,0.052mol)和1,4-二噁烷(80ml)。在持续30min使氮气流经过所得的悬浮液后,加入cui(2.5g,0.013mol),并将所得的反应混合物在95℃下搅拌16h。然后将混合物冷却至室温,在etoac(50ml)和水(50ml)之间分配,并用etoac(30mlx3)萃取有机相。用水(20mlx2)和盐水(20mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。通过快速色谱法(二氯甲烷:meoh,97:3)纯化粗产物得到35%收率(4.5g)的113a,为白色固体。实施例113b2-{1-甲基-5-[5-(4-甲基哌嗪-1-基)吡啶-2-基氨基]-6-氧代-1,6-二氢吡啶-3-基}-6-(1-氧代-3,4,6,7,8,9-六氢-1h-吡嗪并[1,2-a]吲哚-2-基)苄基乙酸酯113b在配有磁力搅拌棒的10-ml玻璃容器中,加入1-甲基-3-[5-(4-甲基哌嗪-1-基)吡啶-2-基氨基]-5-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-1h-吡啶-2-酮197f(210mg,0.49mmol)、113a(250mg,0.60mmol)、在2nna2co3(2ml)中的pd(pph3)4(50mg,0.043mmol)和1,2-二甲氧基乙烷(5ml)。用塞子密封容器并置于微波腔中。在125℃下搅拌反应混合物7min后,通过快速色谱(二氯甲烷:甲醇,85:15)纯化,得到34%(105mg)的固体2-{1-甲基-5-[5-(4-甲基哌嗪-1-基)吡啶-2-基氨基]-6-氧代-1,6-二氢吡啶-3-基}-6-(1-氧代-3,4,6,7,8,9-六氢-1h-吡嗪并[1,2-a]吲哚-2-基)苄基乙酸酯113b。向配有磁力搅拌棒的100-ml单颈圆底烧瓶加入113b(105mg,0.17mmol)、lioh·h2o(35mg,0.83mmol)、thf(2ml)、异丙醇(2ml)和水(1ml)。在室温下搅拌反应混合物3h后,在二氯甲烷(5ml)和水(5ml)之间分配,并用二氯甲烷(5mlx3)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶解于二氯甲烷(3ml)中。向此溶液加入己烷(10ml),然后过滤所得的沉淀,得到80%收率(79mg)的2-(2-羟甲基-3-{1-甲基-5-[5-(4-甲基哌嗪-1-基)吡啶-2-基氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基)-3,4,6,7,8,9-六氢-2h-吡嗪并[1,2-a]吲哚-1-酮113;ms(esi+)m/z594.3(m+h)。实施例1142-(3-(6-(1-环丙基-1h-吡唑-4-基氨基)-4-甲基-5-氧代-4,5-二氢吡嗪-2-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮114实施例114a2-(2-(乙酰氧基甲基)-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮114a向配有搅拌棒的圆底烧瓶加入2-(3-溴-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮113a(1.96g,4.70mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(1.79g,7.05mmol)、cl2pd(dppf)2·ch2cl2(306.9mg,0.376mmol)、koac(4.77g,18.79mmol)和二噁烷(33.6ml)。在95℃下过夜加热混合物。通过celite过滤所得的混合物,用乙酸乙酯(200ml)洗涤。用水(50ml)洗涤有机相,用mgso4干燥,然后在真空下除去溶剂得到粗产物114a,将其直接用作其它合成的原料。实施例114b5-溴-3-(1-环丙基-1h-吡唑-4-基氨基)-1-甲基吡嗪-2(1h)-酮114b向配有搅拌棒的密封管加入1-环丙基-1h-吡唑-4-胺(600mg,4.87mmol)、3,5-二溴-1-甲基吡嗪-2(1h)-酮(1.96g,7.31mmol)、pd2(dba)3(223.1mg,0.244mmol)、xantphos(225.5mg,0.390mmol)、cs2co3(5.25g,16.08mmol)和二噁烷(12ml)。将管密封并在100℃下过夜加热。将ch2cl2(200ml)加入到所得的混合物,并用水(30mlx3)洗涤ch2cl2溶液。过滤水相中的沉淀,作为纯产物114b。用mgso4干燥有机相,过滤,然后在真空中除去溶剂。将ch2cl2/乙醚(1:2,3ml)加入残余物中并超声处理混合物。过滤沉淀,与从水相过滤的固体合并,然后干燥。得到5-溴-3-(1-环丙基-1h-吡唑-4-基氨基)-1-甲基吡嗪-2(1h)-酮114b,为黄色固体。实施例114c2-(6-(1-环丙基-1h-吡唑-4-基氨基)-4-甲基-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯114c向配有搅拌棒的微波用管加入114b(200mg,0.645mmol)、114a(0.903mmol)、pd(pph3)4、na2co3水溶液(1.0n,2.13ml,2.13mmol)、dme(2.0ml)。使混合物在微波中在135℃下反应15min。加入dcm(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:dcm=5:95)得到2-(6-(1-环丙基-1h-吡唑-4-基氨基)-4-甲基-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯114c,将其直接用于下一步骤。向配有搅拌棒的圆底烧瓶加入114cthf(1.25ml)、i-proh(1.25ml)、h2o(1.25ml)、liohh2o(135mg)。在rt下搅拌所得的混合物1hr。在真空中除去所有的溶剂,经硅胶柱色谱(meoh:dcm=10:90)得到38.6mg2-(3-(6-(1-环丙基-1h-吡唑-4-基氨基)-4-甲基-5-氧代-4,5-二氢吡嗪-2-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮114,为黄色固体。ms(esi+)m/z526.3(m+h)。实施例1155-[5-氟-2-(羟甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮115实施例115b叔丁基(2-溴-4-氟-6-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄氧基)二甲基甲硅烷115b向配有磁力搅拌器的密封管加入104e(1.11g,5.37mmol)、115a(4.24g,10.7mmol)、碳酸铯(3.49g,10.7mmol)、n,n’-二甲基乙二胺(0.47g,5.37mmol)和1,4-二噁烷(45ml)。在脱气10分钟后,加入碘化亚铜(0.51g,2.68mmol),并将反应混合物在105℃下加热2天。加入另一份n,n’-二甲基乙二胺(0.47g,5.37mmol)和碘化亚铜(0.51g,2.68mmol),并将反应混合物在105℃下再加热5小时。此后,将混合物冷却至室温并过滤。用乙酸乙酯(50ml)和水(40ml)稀释滤液。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,乙酸乙酯/己烷)得到40%收率(1.14g)的化合物115b,为黄色固体:ms(esi+)m/z524.1(m+h)。向配有磁力搅拌器的10ml微波用小瓶加入115b(157mg,0.3mmol)、1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮109c(148mg,0.45mmol)、1m碳酸钠溶液(1.2ml,1.2mmol)和1,2-二甲氧基乙烷(3ml)。在持续10min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(18mg,0.015mmol)。将反应混合物在微波反应器中在130℃下加热15分钟。以相同的规模重复反应,并合并反应混合物。加入乙酸乙酯(20ml)和水(10ml),并分离各层。用乙酸乙酯(2×10ml)萃取水层,并用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,60:35:5二氯甲烷/醚/甲醇),得到400mg化合物115c和115的混合物,为黄色残余物。将以上残余物溶于甲醇(5ml)中。加入10-樟脑磺酸(350mg,1.5mmol),并在室温下搅拌混合物1h。此后,用饱和碳酸氢钠碱化混合物。用二氯甲烷(2×10ml)萃取水层,并用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(nh-硅胶,乙酸乙酯/己烷),得到33%收率(88mg)的化合物115,为浅黄色固体:ms(esi+)m/z532.2(m+h)实施例1165-[3-(6-{[1-(2-羟基乙基)-1h-吡唑-4-基]氨基}-4-甲基-5-氧代-4,5-二氢吡嗪-2-基)-2-(羟甲基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮116实施例116a1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-4-硝基-1h-吡唑116a用氮气吹扫配有回流冷凝管和磁力搅拌器的100-ml单颈圆底烧瓶,并加入4-硝基-1h-吡唑(500mg,4.42mmol)、(2-溴乙氧基)(叔丁基)二甲基甲硅烷(2.12g,8.85mmol)、碳酸铯(5.76g,17.7mmol)和无水dmf(5ml)。在70℃下加热1h后,将混合物冷却至室温,然后用二氯甲烷(50ml)和水(30ml)稀释。分离有机层,并用二氯甲烷(2×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物得到92%收率(1.11g)的116a,为白色固体:mp63–64℃;1hnmr(500mhz,cdcl3)δ8.20(s,1h),8.08(s,1h),4.24(t,2h,j=4.5hz),3.95(t,2h,j=4.5hz),0.84(s,9h),-0.04(s,6h)。实施例116b1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-1h-吡唑-4-胺116b用氮气吹扫250-mlparr反应瓶并加入10%钯/碳(50%湿度,150mg干重)和116a(1.11g,4.10mmol)在乙醇(20ml)中的溶液。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi并振摇3h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(1.00g),并通过celite521垫过滤混合物。用乙醇(2×25ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干,得到100%收率的116b(985mg),为橙色油状物:1hnmr(500mhz,cdcl3)7.18(s,1h),7.11(s,1h),4.09(t,2h,j=5.5hz),3.89(t,2h,j=5.5hz),3.25(brs,2h),0.86(s,9h),-0.32(s,6h)。ms(esi+)m/z242.2(m+h)。实施例116c5-溴-3-(1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-1h-吡唑-4-基氨基)-1-甲基吡嗪-2(1h)-酮116c向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入116b(400mg,1.66mmol)、3,5-二溴-1-甲基吡嗪–2(1h)-酮(443mg,1.66mmol)、碳酸铯(1.19g,3.65mmol)和1,4-二噁烷(20ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xantphos(144mg,0.249mmol)和三(二亚苄基丙酮)二钯(0)(152mg,0.166mmol),并将反应混合物在回流下加热4h。此后,将混合物冷却至室温,过滤,并用二氯甲烷(2×20ml)洗涤滤饼。合并滤液,在减压下浓缩,然后通过柱色谱纯化所得的残余物,得到51%收率(353mg)的116c,为黄色固体:mp172–173℃;1hnmr(500mhz,cdcl3)δ8.17(s,1h),8.06(s,1h),7.65(s,1h),6.70(s,1h),4.28(t,2h,j=5.0hz),3.97(t,2h,j=5.5hz),3.51(s,3h),0.85(s,9h),-0.79(s,6h);ms(apci+)m/z428.3(m+h)。用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入116c(150mg,0.312mmol)、111a(133mg,0.312mmol)、碳酸钠(99mg,0.936mmol)、1,4-二噁烷(5ml)和水(1ml)。用氮气对此混合物脱气30min。加入四(三苯基膦)钯(36mg,0.031mmol)。在100℃下加热3h后,将反应混合物冷却至室温,然后在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于甲醇(5ml)中,并加入碳酸钾(500mg,3.62mmol)。在室温下搅拌2h后,将反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物再溶于thf(5ml)中,加入三水合四丁基氟化铵(500mg,1.58mmol)。在室温下搅拌3h后,在减压下除去溶剂,然后用水(10ml)洗涤所得的残余物。通过快速色谱法纯化所得的固体,得到27%收率(47mg)的116,为灰白色固体:mp171–172℃;1hnmr(500mhz,dmso-d6)δ9.56(s,1h),8.16(s,1h),7.75(s,1h),7.58(d,1h,j=8.0hz),7.44(t,1h,j=8.0hz),7.33–7.32(m,2h),4.86(m,1h),4.81(t,1h,j=5.5hz),4.51(dd,1h,j=11.0,6.5hz),4.44(dd,1h,j=11.0,6.5hz),4.06(t,2h,j=5.5hz),4.02(m,1h),3.68(t,2h,j=5.5hz),3.88(m,1h),3.68(q,2h,j=5.5hz),3.52(s,3h),2.98(m,1h),2.86(m,1h),2.77(m,2h),2.58–2.46(m,2h),1.79(m,4h);ms(apci+)m/z547.2(m+h)实施例1172-(2-甲基-3-(5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢哒嗪-3-基)苯基)-2,3,4,9-四氢-1h-吡啶并[3,4-b]吲哚-1-酮117实施例117a9-((2-(三甲基甲硅烷基)乙氧基)甲基)-2,3,4,9-四氢-1h-吡啶并[3,4-b]吲哚-1-酮117a用氮气吹扫配有磁力搅拌器的25-ml单颈圆底烧瓶,并加入无水dmf(4ml)和60%氢化钠/矿物油悬浮液(181mg,4.52mmol)并将反应混合物冷却至0℃。加入1,2,3,4-四氢-1-氧代-β-咔啉(841mg,4.52mmol),并在0℃下搅拌反应15min。此后,加入2-(三甲基甲硅烷基)乙氧基甲基氯化物(829mg,4.97mmol),并在0℃下搅拌反应1h。然后将反应混合物在水(10ml)和乙酸乙酯(20ml)之间分配。分离各层,并用乙酸乙酯(2×10ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物,得到57%收率(818mg)的117a,为无色油状物:1hnmr(500mhz,cdcl3)7.67(d,1h,j=8.0hz),7.65(d,1h,j=8.0hz),7.46(t,1h,j=8.0hz),7.27(t,1h,j=8.0hz),6.14(s,2h),5.72(brs,1h),3.75(t,2h,j=7.0hz),3.66(t,2h,j=8.0hz),3.14(t,2h,j=7.0hz),0.96(t,2h,j=8.0hz),-0.25(s,9h)。实施例117b2-(3-溴-2-甲基苯基)-9-((2-(三甲基甲硅烷基)乙氧基)甲基)-2,3,4,9-四氢-1h-吡啶并[3,4-b]吲哚-1-酮117b向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶加入117a(400mg,1.27mmol)、2,6-二溴甲苯(633mg,2.53mmol)、碳酸铯(828mg,2.54mmol)、n-甲基乙二胺(112mg,1.27mmol)和1,4-二噁烷(20ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(121mg,2.54mmol)。将回流冷凝管连接到烧瓶,并将反应混合物在100℃下加热16h。此后,将混合物冷却至室温并过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物得到41%收率(251mg)的117b,为黄色油状物:1hnmr(500mhz,cdcl3)δ7.71(d,1h,j=8.0hz),7.68(d,1h,j=8.0hz),7.63(d,1h,j=8.0hz),7.47(t,1h,j=8.0hz),7.32–7.28(m,2h),7.21(t,1h,j=8.0hz),6.13(s,2h),4.15(m,1h),3.93(m,1h),3.69(m,2h),3.29(m,2h),2.45(s,3h),0.95(t,2h,j=8.0hz),-0.07(s,9h)。实施例117c2-(2-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-9-((2-(三甲基甲硅烷基)乙氧基)甲基)-2,3,4,9-四氢-1h-吡啶并[3,4-b]吲哚-1-酮117c向配有磁力搅拌器、回流冷凝管和氮气入口的100-ml单颈圆底烧瓶加入117b(250mg,0.515mmol)、4,4,4',4',-5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷(157mg,0.619mmol)、乙酸钾(152mg,1.55mmol)和1,4-二噁烷(5ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入[1,1-双(二苯基膦)二茂铁]二氯化钯(ii)/ch2cl2(38mg,0.052mmol),并将反应混合物在95℃下加热5h。此后,用乙酸乙酯(20ml)和水(20ml)稀释混合物,并分离各层。用乙酸乙酯(50ml)萃取水层,并用盐水(50ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物得到97%收率(242mg)的117c,为无色油状物:1hnmr(500mhz,cdcl3)δ7.85(d,1h,j=8.0hz),7.72(d,1h,j=8.0hz),7.68(d,1h,j=8.0hz),7.46(t,1h,j=8.0hz),7.39–7.28(m,2h),7.21(t,1h,j=8.0hz),6.19(d,1h,j=10.5hz),6.15(d,1h,j=10.5hz),4.16(m,1h),3.97(m,1h),3.68(m,2h),3.29(m,2h),2.45(s,3h),0.95(t,2h,j=8.0hz),1.34(s,12h),-0.07(s,9h)。实施例117d4-溴-6-氯-2-((2-(三甲基甲硅烷基)乙氧基)甲基)哒嗪-3(2h)-酮117d用氮气吹扫配有磁力搅拌器的500-ml单颈圆底烧瓶并加入无水dmf(150ml)和4-溴-6-氯-哒嗪-3(2h)-酮(10.0g,47.8mmol)。将反应混合物冷却至0℃并加入氢化钠。在0℃下搅拌反应20min。此后,加入2-(三甲基甲硅烷基)乙氧基甲基氯化物(11.9g,71.6mmol),除去冷却浴,并在室温下搅拌反应3h。然后用饱和碳酸氢钠水溶液(30ml)终止反应。用乙酸乙酯(2×300ml)萃取混合物。用硫酸钠干燥萃取液,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到56%收率(9.00g)的117d,为黄色油状物:1hnmr(300mhz,cdcl3)δ8.02(s,1h),5.42(s,2h),3.79(t,2h,j=5.4hz),0.96(t,2h,j=5.4hz),0.01(s,9h)。实施例117e6-氯-4-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-2-((2-(三甲基甲硅烷基)乙氧基)甲基)哒嗪-3(2h)-酮117e向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶加入117d(1.12g,3.29mmol)、103e(500mg,3.29mmol)、碳酸铯(3.22g,9.87mmol)和1,4-二噁烷(25ml)。在持续30min使氮气鼓泡经过所得的溶液后,加入xantphos(286mg,0.494mmol)和三(二亚苄基丙酮)二钯(0)(301mg,0.329mmol),并将反应混合物在回流下加热3h。此后,将反应混合物冷却至室温并在水(30ml)和二氯甲烷(60ml)之间分配。分离各层,并用二氯甲烷(60ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下从滤液除去溶剂。通过柱色谱纯化所得的残余物得到72%收率(977mg)的117e,为黄色固体:mp68–69℃;1hnmr(500mhz,cdcl3)δ7.85(s,1h),7.56(s,1h),5.70(s,1h),5.47(s,2h),4.16(t,2h,j=5.5hz),3.73(m,2h),3.63(s,2h),2.94(t,2h,j=5.5hz),2.51(s,3h),0.98(m,2h),0.12(s,9h);ms(esi+)m/z411.2(m+h)。实施例117f2-(2-甲基-3-(5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1-((2-(三甲基甲硅烷基)乙氧基)甲基)-1,6-二氢哒嗪-3-基)苯基)-9-((2-(三甲基甲硅烷基)乙氧基)甲基)-2,3,4,9-四氢-1h-吡啶并[3,4-b]吲哚-1-酮117f向配有磁力搅拌器、回流冷凝管和氮气入口的50-ml单颈圆底烧瓶加入1,4-二噁烷(5ml)、水(1ml)和碳酸钠(143mg,1.35mmol)。在持续30min使氮气鼓泡经过所得的混合物后,加入117c(240mg,0.451mmol)、117e(185mg,0.451mmol)和四(三苯基膦)钯(0)(52mg,0.045mmol),并将反应混合物在100℃下加热3h。此后,将反应冷却至室温并在水(25ml)和二氯甲烷(50ml)之间分配。分离有机层,用盐水(75ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液成黑色油状物,通过快速色谱法纯化得到89%收率(315mg)的117f,为黄色油状物:1hnmr(500mhz,cdcl3)δ7.88(s,1h),7.66(d,1h,j=8.0hz),7.45(m,3h),7.39(t,1h,j=8.0hz),7.34(d,1h,j=8.0hz),7.24(t,2h,j=8.0hz),6.12(d,1h,j=10.5hz),6.05(d,1h,j=10.5hz),5.69(s,1h),5.63(d,1h,j=10.5hz),5.52(d,1h,j=10.5hz),4.09(m,2h),3.88(m,2h),3.75(m,2h),3.68(s,3h),3.59(m,2h),3.26–3.17(m,4h),2.61(m,2h),2.29(s,3h),0.98(t,2h,j=8.0hz),0.85(t,2h,j=8.0hz),-0.01(s,9h),-0.07(s,9h);ms(esi+)m/z781.4(m+h)。用氮气吹扫配有磁力搅拌器的50-ml单颈圆底烧瓶并加入117f(315mg,0.404mmol)、苯甲醚(438mg,4.04mmol)、二氯甲烷(3ml)和三氟乙酸(3ml)。在室温下搅拌2h后,浓缩反应混合物,然后所得的残余物在1m磷酸二氢钾水溶液(10ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×10ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到23%收率(49mg)的117,为白色固体:mp254℃dec;1hnmr(500mhz,dmso-d6)δ12.97(s,1h),11.74(s,1h),9.21(s,1h),7.79(s,1h),7.65(d,1h,j=8.0hz),7.44–7.37(m,3h),7.34(d,1h,j=8.0hz),7.26(t,1h,j=8.0hz),7.08(t,1h,j=8.0hz),5.75(s,1h),4.17(m,1h),3.97(t,2h,j=5.0hz),3.84(m,1h),3.51(s,2h),3.17(m,2h),2.79(t,2h,j=5.0hz),2.35(s,3h),2.18(s,3h);ms(esi+)m/z521.2(m+h)实施例1182-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮118实施例118a5,6,7,8-四氢中氮茚-2-羧酸甲酯118a用氮气吹扫配有磁力搅拌器和氮气入口的500-ml圆底烧瓶,并加入5,6,7,8-四氢中氮茚-2-羧酸(30.4g,184mmol)、dmf(1.00g,13.6mmol)和二氯甲烷(300ml)。用冰浴将溶液冷却至0℃。滴加草酰氯(28.0g,221mmol),然后在30min内将反应混合物升温至室温并搅拌5h。此后,浓缩所得的溶液得到褐色固体。将此固体溶于无水甲醇(400ml)中,并将溶液冷却至0℃。将三乙胺(57g,552mmol)加入到反应混合物,并在室温下再搅拌2h。此后,将反应混合物在减压下浓缩至干。用二氯甲烷(300ml)稀释残余物,并用水(200ml)和饱和碳酸氢钠水溶液(200ml)洗涤。用硫酸钠干燥有机层,过滤,然后在减压下浓缩。用己烷(200ml)使所得的残余物成粉末,得到58%收率(19.1g)的118a,为白色固体:mp72–74℃;1hnmr(300mhz,dmso-d6)δ7.13(s,1h),6.23(s,1h),3.93(t,2h,j=6.0hz),3.77(s,3h),2.75(t,2h,j=6.0hz),1.93(m,2h),1.80(m,2h);(apci+)m/z180.1(m+h)实施例118b3-(氰基甲基)-5,6,7,8-四氢中氮茚-2-羧酸甲酯118b向配有加料漏斗、温度计的500-ml三颈圆底烧瓶加入118a(6.70g,37.4mmol)、碘乙腈(12.5g,74.9mmol)、七水合硫酸亚铁(ii)(5.20g,18.7mmol)和二甲亚砜(250ml)。利用水浴在室温下将过氧化氢(35%,18.2g,187mmol)通过注射泵在1h内滴加至混合物。将七水合硫酸亚铁(ii)(2–3当量)逐份加入到反应混合物以使温度保持在25℃-35℃,直至反应混合物的颜色呈深红色。若tlc显示反应尚未完成,则以相同的方式加入更多的过氧化氢(2-3当量)和更多的七水合硫酸亚铁(ii)(1-2当量)直至反应完成。其后,使反应混合物在饱和碳酸氢钠溶液(200ml)和乙酸乙酯(400ml)之间分配。分离有机层,并用乙酸乙酯(2×100ml)萃取水层。用饱和硫代硫酸钠溶液(50ml)洗涤合并的有机层,用硫酸钠干燥,然后在减压下浓缩。通过柱色谱纯化残余物得到78%收率(6.40g)的118b,为黄色油状物:1hnmr(500mhz,cdcl3)δ6.23(s,1h),4.23(s,2h),3.94(t,2h,j=6.5hz),3.81(s,3h),2.74(t,2h,j=6.5hz),2.00(m,2h),1.83(m,2h);(apci+)m/z219.3(m+h)实施例118c3-(2-氨基乙基)-5,6,7,8-四氢中氮茚-2-羧酸甲酯盐酸盐118c用氧化铂催化剂,在50psi的氢气下,在乙醇和乙酸乙酯中,在氯化氢存在下,在室温下对中间体118b过夜进行氢化,得到118c(380mg,1.74mmol),将其直接用于下一步骤。实施例118d3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮118d用氮气吹扫配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶,并加入3-(2-氨基乙基)-5,6,7,8-四氢中氮茚-2-羧酸甲酯盐酸盐118c(估算1.74mmol,假定定量收率)、乙醇钠(354mg,5.22mmol)和乙醇(20ml)。在55℃下搅拌混合物5h。其后,在减压下浓缩反应混合物并将残余物在乙酸乙酯(200ml)和水(100ml)之间分配。分离有机层,并用乙酸乙酯(2×100ml)萃取水层。用盐水洗涤合并的有机层,用硫酸钠干燥,然后在减压下浓缩。通过柱色谱纯化残余物得到67%收率(220mg)的118d,为白色固体:mp195–197℃;1hnmr(500mhz,dmso-d6)δ6.76(s,1h),5.89(s,1h),3.78(t,2h,j=6.5hz),3.35(m,2h),2.66(m,4h),1.87(m,2h),1.72(m,2h);(apci+)m/z191.3(m+h)实施例118e2-溴-6-(1-氧代-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-2(1h)-基)苄基乙酸酯118e用氮气吹扫配有回流冷凝管、磁力搅拌器的250-ml三颈圆底烧瓶,并加入118d(1.50g,7.89mmol)、2,6-二溴苄基乙酸酯104g(4.80g,15.7mmol)、碳酸铯(5.11g,15.7mmol)、n,n’-二甲基乙二胺(695mg,7.89mmol)和1,4-二噁烷(100ml)。在持续20min使氮气鼓泡经过所得的悬浮液后,加入碘化亚铜(752mg,3.95mmol),并将反应混合物在95℃(油浴温度)下加热12h。然后加入n,n’-二甲基乙二胺(695mg,7.89mmol)和碘化亚铜(752mg,3.95mmol)并在95℃下再加热12h,重复此操作直至大部分118d被转化成118e,约48h。此后,将混合物冷却至室温,然后过滤。用乙酸乙酯(300ml)和水(100ml)稀释滤液。分离有机层,并用乙酸乙酯(3×100ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过快速色谱法纯化残余物得到27%收率(905mg)的118e,为灰白色固体:mp176–178℃;1hnmr(300mhz,dmso-d6)δ7.64(dd,1h,j=7.5,1.8hz),7.37(m,2h),5.99(s,1h),5.00(d,2h,j=6.0hz),4.00(m,1h),3.85(m,2h),3.62(m,1h),2.93(t,2h,j=6.1hz),2.67(t,2h,j=6.1hz),2.00(d,3h,j=6.0hz),1.90(m,2h),1.75(m,2h);ms(esi+)m/z417.0(m+h)实施例118f2-(1-氧代-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯118f向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入118e(1.20g,2.88mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(2.20g,8.65mmol)、乙酸钾(1.13g,11.5mmol)和1,4-二噁烷(50ml)。在持续20min使氮气鼓泡经过所得的悬浮液后,加入[1,1-双(二苯基膦)二茂铁]二氯化钯(ii)(210mg,0.288mmol),并将反应混合物在95℃下加热8h。此后,将混合物冷却至室温,然后过滤。用乙酸乙酯(40ml)洗涤滤饼。用乙酸乙酯(150ml)和水(40ml)稀释滤液。分离有机层,并用乙酸乙酯(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到100%收率(1.35g)的粗品118f,为黄色油状物。向配有磁力搅拌器和回流冷凝管的100-ml三颈圆底烧瓶加入118f(400mg,0.862mmol)、5-溴-1-甲基-3-(嘧啶-4-基氨基)吡啶-2(1h)-酮109b(241mg,0.862mmol)、碳酸钠(365mg,3.45mmol)、水(4ml)和1,4-二噁烷(20ml)。在持续20min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(100mg,0.086mmol),并将反应混合物在100℃下加热2h。此后,将反应混合物冷却至室温,过滤,并用甲醇和二氯甲烷的1:10混合物(30ml)洗涤滤饼。在减压下浓缩滤液得到褐色残余物。向配有磁力搅拌器和回流冷凝管的另一50-ml单颈圆底烧瓶加入以上所得的残余物、thf(5ml)、乙醇(5ml)、水(5ml)和氢氧化锂(83.0mg,3.45mmol)。在50℃下搅拌混合物2h。此后,在减压下浓缩反应混合物。通过快速色谱法纯化所得的残余物得到23%(106mg)收率的118,为灰白色固体:mp173–175℃;1hnmr(500mhz,dmso-d6)δ7.16(s,1h),8.72(s,1h),8.64(s,1h),8.29(d,1h,j=6.0hz),7.55(s,1h),7.45(t,1h,j=7.5hz),7.29(m,3h),6.00(s,1h),4.75(t,1h,j=5.0hz),4.31(d,2h,j=5.0hz),4.00(m,1h),3.96(m,1h),3.81(m,2h),3.60(s,3h),3.00(m,1h),2.91(m,1h),2.71(t,2h,j=5.5hz),1.92(m,2h),1.75(m,2h);ms(esi+)m/z497.2(m+h)实施例1195-[2-(羟甲基)-3-(5-{[5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基]氨基}-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮119实施例119a3-氨基-1-甲基-1h-吡唑-5-羧酸甲酯119a向250mlparr氢化瓶中加入1-甲基-3-硝基-1h-吡唑-5-羧酸甲酯(530mg,2.9mmol),溶于乙酸乙酯(156ml)和乙醇(15ml)中,向其加入10%pd/c(degussa型)(100mg)。将混合物置于parr装置上并用氢气增压至50psi并振摇2.5hr。通过硅藻土垫过滤反应液,并用乙酸乙酯洗涤硅藻土垫。在真空下除去溶剂得到119a,为白色固体(450mg,2.9mmol,定量收率)。实施例119b3-(6-氯-2-甲基-3-氧代-2,3-二氢哒嗪-4-基氨基)-1-甲基-1h-吡唑-5-羧酸甲酯119b向三颈rbf中加入119a(500mg,3.2mmol)、4-溴-6-氯-2-甲基哒嗪-3(2h)-酮(725mg,3.2mmol)、碳酸铯(2.3g,7.0mmol)和xantphos(160mg,8.5mol%)。对烧瓶抽真空并充入氮气3x。加入二噁烷(20ml)并通过鼓吹氮气对混合物脱气25min。然后加入三(二亚苄基丙酮)二钯(0)(150mg,5mol%),并将反应加热至100℃持续6hr。将反应冷却并用etoac(125ml)和饱和nahco3水溶液(50ml)稀释。分离各层并用etoac(2x100ml)萃取。用盐水洗涤有机萃取液3x,用na2so4干燥,过滤,然后在减压下浓缩。通过色谱(isco40g硅胶,etoac/己烷)纯化残余物得到119b。实施例119c6-氯-4-(5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基氨基)-2-甲基哒嗪-3(2h)-酮119c在氮气下向含有119b(500mg,1.7mmol)的100ml圆底烧瓶中加入无水thf(20ml)和无水甲苯(5ml)并搅拌混合物,并将其冷却至-20至-30℃。然后缓慢地加入3.0m甲基溴化镁/乙醚(1.6ml,4.75mmol)。在加料后,使反应缓慢升温至室温并搅拌约3hr,其后用1nhcl终止反应。浓缩除去thf,用乙酸乙酯和水稀释,然后用1mnaoh将ph调至~6-7。分离,并用乙酸乙酯萃取2x,用盐水洗涤,用na2so4干燥,过滤,然后在减压下浓缩。通过色谱(isco24g硅胶,乙酸乙酯/己烷)纯化残余物得到119c。实施例119d2-(5-(5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯119d向微波用小瓶加入119c(150mg,0.50mmol)和111a(240mg,0.50mmol),并加入dme(4ml)而后加入1nna2co3(1.1ml)。在持续5min鼓吹氩气进行脱气后,加入四(三苯基膦)钯(0)(29mg,5mol%),并在微波反应器中将混合物在130℃下加热15min。再另外加入40mg111a,并再加热混合物10min。用乙酸乙酯和水稀释反应液,分离乙酸乙酯层,用盐水洗涤,用na2so4干燥,过滤,然后在减压下浓缩。通过色谱(isco12g硅胶,用甲醇和ch2cl2洗脱)纯化残余物得到119d(170mg,56%收率)。向包含溶于thf(1.5ml)和异丙醇(1.5ml)的119d(170mg,0.28mmol)的小瓶中加入1nlioh/水(1.4ml,1.4mmol)并过夜搅拌混合物,然后通过lc-ms判断反应是否完成。浓缩混合物,然后用乙酸乙酯和水稀释,并加入1nhcl和1nnaoh将ph调至7。分离乙酸乙酯层,用盐水洗涤,用na2so4干燥,过滤,然后在减压下浓缩。用乙酸乙酯使残余物成粉末,然后通过过滤收集固体得到119(98mg,61%收率)。ms(esi+)m/z575.2(m+h)。实施例1205-[5-氟-2-(羟甲基)-3-[4-甲基-5-氧代-6-(1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮120实施例120a6-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯120a将6-氨基-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯(3g,12mmol)、3,5-二溴-1-甲基吡嗪-2(1h)-酮(2.68g,10mmol)和三乙胺(1.5g,15mmol)在ipa(50ml)中的混合物在70℃下加热15h。将混合物冷却至室温。通过过滤收集所得的黄色固体,然后在真空中干燥得到120a,为黄色固体(2.83g,65%)。ms:[m+h]+435。实施例120b4-氟-2-[4-甲基-5-氧代-6-(1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯120b按照实施例150b,使482mg的218b和435mg的120a反应,得到362mg(51%)的120b,为黄色固体。ms:[m+h]+711。按照实施例149,将200mg的120b转化成120,为白色固体(78mg,42%)。1hnmr(500mhz,meod)δ7.72(s,1h),7.58(d,j=8.0,1h),7.39(m,2h),7.21(ss,j=9.5,1h),7.10(d,j=8.5,1h),4.62(d,j=12,1h),4.50(d,j=12,1h),4.11(m,3h),3.98(m,1h),3.64(s,3h),3.28(s,2h),2.95(m,4h),2.85(s,2h),2.60(m,2h),1.9(m,4h)。实施例1215-[2-(羟甲基)-3-(4-甲基-5-氧代-6-{[4-(哌啶-4-基)苯基]氨基}-4,5-二氢吡嗪-2-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮121实施例121a4-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)哌啶-1-羧酸叔丁酯121a除了使用4-(4-氨基苯基)哌啶-1-羧酸叔丁酯(0.83g,3.0mmol)、3,5-二溴-1-甲基吡嗪-2(1h)-酮(0.88g,3.3mmol)、碳酸铯(1.27g,3.9mmol)、三(二亚苄基丙酮)二钯(0)(0.275g,0.3mmol)、xantphos(0.26g,0.45mmol)和1,4-二噁烷(30ml)之外,利用与实施例112a相同的方法合成化合物121a。在100℃下过夜加热反应混合物。后处理并通过快速柱色谱(硅胶,乙酸乙酯/己烷)纯化得到80%收率(1.1g)的固体121a:ms(esi+)m/z465.0(m+h)。实施例121b5-[2-(乙酰氧基甲基)-3-(4-甲基-5-氧代-6-{[4-(哌啶-4-基)苯基]氨基}-4,5-二氢吡嗪-2-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮121b向配有磁力搅拌器的10ml微波用小瓶加入111a(173mg,0.36mmol)、121a(139mg,0.3mmol)、1m碳酸钠溶液(1.2ml,1.2mmol)和1,2-二甲氧基乙烷(3ml)。在持续10min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(18mg,0.015mmol)。将反应混合物在微波反应器中在130℃下加热15分钟。此后,加入乙酸乙酯(15ml)和水(10ml),然后分离各层。用乙酸乙酯(2×20ml)萃取水层,并用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,乙酸乙酯/己烷)得到化合物121b,为黄色油状物(240mg)。将化合物121b溶于二氯甲烷(10ml)中。加入三氟乙酸(0.3ml,3.9mmol),并在室温下搅拌混合物4h。此后,用饱和碳酸氢钠碱化混合物,并用二氯甲烷(2×15ml)萃取水层。用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。浓缩滤液,然后将所得的残余物121c溶于thf(1.5ml)、水(0.8ml)和异丙醇(1.5ml)的混合物中。加入一水合氢氧化锂(56mg,1.32mmol),并在室温下搅拌混合物3h。此后,用90:10二氯甲烷/甲醇(10ml)和水(5ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2×10ml)萃取水层,并用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。通过快速色谱(硅胶,二氯甲烷/甲醇)纯化滤液得到35%收率(3步,63mg)的化合物121,为浅粉色固体:ms(esi+)m/z596.3(m+h)。实施例1225-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[4-(吗啉-4-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮122实施例122a5-溴-1-甲基-3-(4-吗啉代苯基氨基)吡嗪-2(1h)-酮(3-3)122a向配有磁力搅拌器的微波用小瓶加入3,5-二溴-1-甲基吡嗪-2(1h)-酮(1.97g,7.4mmol)、4-吗啉代苯胺(1.97g,11.1mmol)和异丙醇(25ml)。对系统抽真空而后再充入n2。在90℃下加热16h。然后将混合物冷却至室温并在减压下浓缩。通过快速色谱纯化残余物,用5:1石油醚/乙酸乙酯洗脱,得到122a(2.3g,85%)。lcms:[m+h]+365。实施例122b4-甲基-6-(4-吗啉代苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基硼酸122b向配有磁力搅拌器的微波用小瓶加入122a(764mg,2.1mmol)、(pinb)2(2.75g,10mmol)、pd(dppf)cl2(0.1g,0.13mmol)、koac(0.6g,6mmol)和dmf(5ml),对系统抽真空而后再充入n2。然后在105℃下加热反应混合物1h,而后冷却至室温,过滤。在减压下浓缩滤液得到粗品122b,未经进一步纯化使用。lcms:[m+h]+331。实施例122c[4-氟-2-(4-甲基-6-{[4-(吗啉-4-基)苯基]氨基}-5-氧代吡嗪-2-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯122c向25ml小瓶加入(2-溴-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯212a(300mg,0.67mmol)、122b(440mg,1.33mmol),悬浮于1,2-二甲氧基乙烷(15ml)和水(1ml)中。将所得的橙色溶液在biotage微波反应器中保持在130℃的恒温下加热30分钟。反应后,通过反相combi快速色谱纯化残余物用0.3%nh4hco3/1:6水/ch3cn洗脱,得到122c,为褐色固体(200mg,46%)。ms:(m+h)+658。向122c(220mg,0.33mmol)在丙-2-醇(7ml)、四氢呋喃(7ml)和水(2ml)中的溶液加入lioh(804mg,33mmol)。在30℃下搅拌混合物2h。然后在减压下蒸发,通过制备型hplc纯化残余物得到122,为黄色固体(82mg,40%)。ms:(m+h)+616。1hnmr(500mhz,meod)δ1.89(s,5h),2.55-2.63(m,2h),2.94(s,2h),3.11-3.13(t,5h),3.64(s,3h),3.82-3.84(t,4h),3.93-3.98(m,1h),4.07-4.14(m,1h),4.43-4.53(m,2h),6.97-6.99(d,2h),7.18-7.20(d,1h),7.29(s,1h),7.36-7.38(d,1h),7.62-7.64(d,2h)。实施例1235-(3-{5-[(5-环丙基-1h-吡唑-3-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-2-(羟甲基)苯基)-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮123实施例123a1-环丙基-3-硝基-1h-吡唑123a用氮气吹扫配有回流冷凝管和磁力搅拌器的250-ml三颈圆底烧瓶,并加入3-硝基-(1h)吡唑(1.30g,11.5mmol)、环丙基硼酸(1.98g,23.0mmol)、碳酸钠(3.66g,34.5mmol)、2,2’-联吡啶(3.58g,23.0mmol)、二氯乙烷(60ml)和乙酸铜(ii)(2.08g,11.5mmol)。在70℃(油浴温度)下加热反应混合物3h。此后,加入另一份环丙基硼酸(1.98g,23.0mmol),并加热混合物3h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(350ml)和水(40ml)稀释滤液。分离有机层,并用乙酸乙酯(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-100%乙酸乙酯/己烷)得到85%收率(1.49g)的123a,为无色油状物:1hnmr(500mhz,cdcl3)δ7.53(d,1h,j=2.4hz),6.87(d,1h,j=2.5hz),3.71(m,1h),1.25(m,2h),1.12(m,2h);ms(apci+)m/z154.1(m+h)。实施例123b1-环丙基-1h-吡唑-3-胺123b用氮气吹扫250-mlparr反应瓶,并加入10%钯/碳(50%湿度,137mg干重)以及123a(600mg,3.92mmol)在乙醇(70ml)中的溶液。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi并振摇3h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(1.00g),并通过celite521垫过滤混合物。用乙醇(2×25ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干,得到93%收率的123b(450mg),为紫色油状物:1hnmr(300mhz,cdcl3)7.17(d,1h,j=2.4hz),5.55(d,1h,j=2.4hz),3.43(m,1h),2.92(brs,2h),1.01(m,2h),0.93(m,2h);ms(esi+)m/z124.1(m+h)。实施例123c5-溴-3-(1-环丙基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮123c向配有回流冷凝管、磁力搅拌器和氮气入口的250-ml三颈圆底烧瓶加入123b(444mg,3.61mmol)、2,5-二溴-1-甲基吡嗪-6-酮(1.06g,3.97mmol)、碳酸铯(3.52g,10.8mmol)和1,4-二噁烷(45ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xantphos(177mg,0.306mmol)和三(二亚苄基丙酮)二钯(0)(165mg,0.180mmol),并在回流下加热反应混合物3h。此后,将混合物冷却至室温,并用乙酸乙酯(150ml)和水(30ml)稀释。分离有机层,并用乙酸乙酯(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。用甲醇(20ml)使残余物成粉末,得到63%收率(700mg)的123c,为灰白色固体:mp161–163℃;1hnmr(300mhz,dmso-d6)δ8.42(s,1h),8.00(d,1h,j=2.5hz),7.57(d,1h,j=2.4hz),7.38(d,1h,j=2.5hz),6.05(d,1h,j=2.4hz),3.61(m,1h),3.49(s,1h),0.95(m,4h);ms(esi+)m/z309.0(m+h)。向配有回流冷凝管、磁力搅拌器和氮气入口的150-ml单颈圆底烧瓶加入123c(247mg,0.800mmol)、111a(770mg,1.60mmol)、碳酸钠(254mg,2.40mmol)、dmf(5ml)、水(2.5ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(93mg,0.080mmol),并在回流下加热反应混合物14h。此后,将混合物冷却至室温,然后用乙酸乙酯(150ml)和水(30ml)稀释。分离有机层,并用乙酸乙酯(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。将残余物溶于thf(8ml)、甲醇(4ml)和水(4ml)的混合物中。向所得的溶液中加入一水合氢氧化锂(167mg,3.40mmol)。在室温下搅拌混合物2h,然后在真空中浓缩。将残余物在乙酸乙酯(150ml)和水(30ml)之间分配。分离有机层,并用甲醇/二氯甲烷的20%(v/v)溶液(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-10%甲醇/二氯甲烷)得到19%收率(84mg)的123,为灰白色固体:mp200–201℃;1hnmr(500mhz,dmso-d6)δ11.75(s,1h),7.98(s,1h),7.92(s,1h),7.418(t,1h,j=8.0hz),7.31(d,1h,j=7.5hz),7.27(d,1h,j=7.5hz),7.21(s,1h),5.78(s,1h),4.79(m,1h),4.36(m,2h),4.12(m,1h),3.80(m,1h),3.56(s,3h),2.95(m,1h),2.80(m,1h),2.78(s,2h),1.80(m,5h),0.87(m,2h),0.62(m,2h);ms(esi+)m/z542.1(m+h)。实施例1245-[5-氟-2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-3-[(5-甲基-1h-吡唑-3-基)氨基]-1,2-二氢吡啶-2-酮124实施例124a1-甲基-3-(5-甲基-1h-吡唑-3-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮124a向配有磁力搅拌器的微波用小瓶加入5-溴-1-甲基-3-(5-甲基-1h-吡唑-3-基氨基)吡啶-2(1h)-酮112a(2.3g,8.3mmol)、(pinb)2(11g,41mmol)、pd(dppf)cl2(0.4g,0.5mmol)、koac(2.4g,25mmol)和1,4-二噁烷(150ml)。对系统抽真空而后再充入n2。在微波辐射下在100℃下加热反应混合物0.5h。然后,将混合物冷却至室温并过滤。在减压下浓缩滤液,然后通过快速色谱纯化残余物,用5:1石油醚/乙酸乙酯洗脱,得到124a(0.57g,21%)。lcms:[m+h]+331。实施例124b4-氟-2-(1-甲基-5-(5-甲基-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯124b将124a(330mg,1mmol)、2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯197d(434mg,1mmol)、pdcl2(dppf)(82mg,0.1mmol)、2.0mna2co3(2.0当量)在dme(10ml)中的混合物在微波辐射下在120℃下加热0.5h。在真空中蒸发溶剂。在反相combi快速色谱上纯化残余物,得到标题化合物(160mg,29%)。lcms:[m+h]+559将124b(150mg,0.27mmol)和lioh(324mg,14mmol)在异丙醇/thf(1:1,10ml)和水(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物并用乙酸乙酯(10mlx2)萃取残余物。在减压下浓缩合并的乙酸乙酯萃取液,然后通过制备型hplc纯化残余物,得到124(60mg,43%)。lcms:[m+h]+517。1hnmr(500mhz,dmso)δ11.74(s,1h),8.00(m,2h),7.30(m,2h),7.16(dd,j=9.5,1h),6.52(s,1h),5.87(s,1h),4.87(m,1h),4.33(m,2h),4.12(m,3h),3.87(m,1h),3.56(s,3h),2.59(m,2h),2.47(m,2h),2.45(s,3h),1.70(m,4h)。实施例1253-[(5-乙基-1h-吡唑-3-基)氨基]-5-[2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-1,2-二氢吡啶-2-酮125实施例125a5-溴-3-(5-乙基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮125a向配有磁力搅拌棒的350-ml密封管加入3,5-二溴-1-甲基-1h-吡啶-2-酮(3.2g,0.012mol)、5-乙基-1h-吡唑-3-胺(2.0g,0.018mol)、pd2(dba)3(0.55g,0.60mmol)、9,9-二甲基-4,5-双(二苯基膦)氧杂蒽(0.49g,0.00084mol)、cs2co3(7.8g,0.024mol)和1,4-二噁烷(80ml)。在105℃下搅拌反应混合物16h后,冷却至室温,在二氯甲烷(50ml)和水(30ml)之间分配,并用二氯甲烷(30mlx3)萃取有机相。用水(30mlx2)和盐水(20mlx1)洗涤合并的有机相,干燥(na2so4),通过celite垫过滤,然后浓缩所得的滤液。向粗产物加入二氯甲烷(20ml)和乙醚(100ml)。超声处理混合物10min,然后过滤所得的沉淀,得到42%收率(1.5g)的5-溴-3-(5-乙基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮(125a)固体。实施例125b2-(5-(5-乙基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯125b在配有磁力搅拌棒的10-ml玻璃容器中,将125a(116mg,0.39mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(200mg,0.43mmol)、pd(pph3)4(30mg,0.0.26mmol)加入2nna2co3(2ml)和1,2-二甲氧基乙烷(5ml)中。用塞子密封容器并置于微波腔中。在125℃下搅拌反应混合物7min后,经快速色谱法(二氯甲烷:甲醇,85:15)纯化,得到23%(50mg)的固体125b。向配有磁力搅拌棒的25-ml单颈圆底烧瓶加入125b(50mg,0.090mmol)、lioh·h2o(20mg,0.83mmol)、thf(2ml)、异丙醇(2ml)和水(2ml)。在室温下搅拌反应混合物3h后,在二氯甲烷(5ml)和水(5ml)之间分配,并用二氯甲烷(5mlx3)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)中。向此溶液加入己烷(10ml)并过滤所得的沉淀,得到50%收率(23mg)的2-(3-(5-(5-乙基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮125ms(esi+)m/z513.3(m+h)。实施例1262-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮126实施例126a5-溴-1-甲基-3-(4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮126a向配有磁力搅拌器和回流冷凝管的50ml圆底烧瓶加入3-(5-乙酰基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮108d(250mg,0.7mmol)、naoh水溶液(5n,6ml)、乙醇(6ml)。在回流下搅拌混合物30min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩,得到91%收率(200mg)的粗品5-溴-1-甲基-3-(4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮(126a)。实施例126b2-(1-甲基-6-氧代-5-(4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯126b向配有磁力搅拌器的微波用管加入126a(210mg,0.65mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(330mg,0.7mmol)、dme(6ml)和1m碳酸钠水溶液(1.9ml)。在持续15min鼓吹n2后,加入pd(pph3)4(38mg,0.03mmol)。将混合物在微波中加热至135℃持续15min。此后,加入乙酸乙酯(10ml)和水(10ml)。用乙酸乙酯(2x10ml)萃取分离的水层。用盐水(20ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–9:1ch2cl2:meoh的梯度洗脱,得到36%收率(140mg)的126b。向配有磁力搅拌器的25ml圆底烧瓶加入126b(140mg,0.24mmol)、氢氧化锂(50mg,1.2mmol)、thf(1.2ml)、异丙醇(1.2ml)和水(2.4ml)。在rt下搅拌混合物1h。此后加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:et2o:meoh的梯度洗脱,得到33%收率(42mg)的126。ms(esi+)m/z540.3(m+h)。实施例1272-(5-氟-2-(羟甲基)-3-(4-甲基-6-(4-吗啉代苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮127实施例127a4-氟-2-(4-甲基-6-(4-吗啉代苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯127a将4-甲基-6-(4-吗啉代苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基硼酸122b(330mg,1mmol)、2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯197d(434mg,1mmol)、pdcl2(dppf)(82mg,0.1mmol)、2.0mna2co3(1ml,2.0当量)在dme(10ml)中的混合物在微波辐射下在130℃下加热0.5h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物,得到127a(200mg,45%)。lcms:[m+h]+641。将127a(200mg,0.31mmol)和lioh(372mg,16mmol)在iproh/thf(1:1,10ml)和h2o(3ml)中的混合物在30℃下搅拌2h。然后在真空中蒸发混合物,并用乙酸乙酯(10mlx2)萃取残余物。在减压下浓缩合并的萃取液,然后用制备型hplc纯化残余物,得到127(58mg,33%)。lcms:[m+h]+5991hnmr(500mhz,dmso)δ9.13(s,1h),7.81(m,2h),7.43(s,1h),7.34(m,2h),6.89(m,2h),6.52(s,1h),4.85(s,1h),4.14(m,1h),3.72(m,3h),3.56(m,3h),3.07(m,4h),2.63(m,3h),2.47(m,2h),1.75(m,4h)。实施例1282-(3-(5-(5-(3-羟基氮杂环丁烷-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮128实施例128a1-(6-硝基吡啶-3-基)氮杂环丁烷-3-醇128a向配有磁力搅拌器和回流冷凝管的50ml圆底烧瓶加入3-羟基氮杂环丁烷·hcl(2g,18.4mmol)、5-溴-2-硝基吡啶(2.1g,10.2mmol)、二异丙基乙胺(5.4ml,30.7mmol)、四丁基碘化铵(5.7g,15.4mmol)和n,n-二甲基乙酰胺(10ml)。在120℃下搅拌混合物16h。此后冷却混合物并加入乙酸乙酯(25ml)和水(25ml)。用乙酸乙酯(2x10ml)萃取分离的水层。用盐水(20ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用4:1己烷:乙酸乙酯–100乙酸乙酯的梯度洗脱,得到52%收率(1.9g)的128a。实施例128b1-(6-氨基吡啶-3-基)氮杂环丁烷-3-醇128b向500-mlparr氢化瓶加入128a(1.9g,9.6mmol)、10%钯/碳(50%湿度,570mg干重)和乙醇(100ml)。对瓶抽真空,充入氢气至压力50psi并在parr氢化装置上振摇24h。通过celite521垫过滤除去催化剂,用1:1ch2cl2:meoh(500ml)洗涤。通过柱色谱纯化所得的残余物,用100%dcm–100%3:1dcm:meoh的梯度洗脱,得到70%收率(1.1g)的128b。实施例128c5-溴-3-(5-(3-羟基氮杂环丁烷-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮128c向配有磁力搅拌器的密封管加入128b(375mg,2.3mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(848g,3.2mmol)和碳酸铯(1.7g,5mmol)及1,4-二噁烷(24ml)。在持续30min使氮气鼓泡经过溶液后,加入xantphos(160mg,0.3mmol)和三(二亚苄基丙酮)二钯(0)(150mg,0.2mmol),并在100℃下加热反应混合物5天。此后,加入h2o(20ml)和etoac(20ml)。分离水层并用乙酸乙酯(2×20ml)萃取。用盐水(50ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过柱色谱纯化所得的残余物,用ch2cl2–9:1ch2cl2:meoh的梯度洗脱,得到39%收率(430mg)的128c。实施例128d2-(5-(5-(3-羟基氮杂环丁烷-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯128d向配有磁力搅拌器的微波用管加入128c(220mg,0.6mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(350mg,0.8mmol)、dme(7ml)和1m碳酸钠水溶液(1.9ml)。在持续15min鼓吹n2后,加入pd(pph3)4(36mg,0.03mmol)。将混合物在微波中加热至135℃持续15min。此后,加入乙酸乙酯(10ml)和水(10ml)。用乙酸乙酯(2x10ml)萃取分离的水层。用盐水(20ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:乙醚:meoh的梯度洗脱,得到30%收率(110mg)的128d。向配有磁力搅拌器的25ml圆底烧瓶加入128d(110mg,0.2mmol)、氢氧化锂(38mg,0.9mmol)、thf(0.9ml)、异丙醇(0.9ml)和水(1.8ml)。在室温下(rt)搅拌混合物1hr。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:乙醚:meoh的梯度洗脱,得到12%收率(12mg)的128。ms(esi+)m/z567.2(m+h)。实施例1292-(5-氟-2-(羟甲基)-3-(4-甲基-5-氧代-6-(1,2,3,4-四氢异喹啉-6-基氨基)-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮129实施例129a6-(6-(2-(乙酰氧基甲基)-5-氟-3-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苯基)-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯129a将482mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯210d和435mg的6-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯120a、pdcl2(dppf)(1110mg,0.015mmol)、2mna2co3溶液(3ml)在dme(16ml)中的混合物在微波辐射下在120℃下加热0.5h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物,得到129a,为黄色固体(362mg,51%)。ms:[m+h]+711。实施例129b4-氟-2-(4-甲基-5-氧代-6-(1,2,3,4-四氢异喹啉-6-基氨基)-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯129b在室温下向129a(360mg0.51mmol)在dcm(30ml)中的溶液加入3mhcl/二噁烷(8ml)。在室温下搅拌混合物5h。在反应完成后,在减压下除去溶剂得到129b,为黄色固体(310mg,99%)。按照实施例149,将250mg的129b转化成白色固体的129(98mg,42%)。1hnmr(500mhz,meod)δ7.62(s,1h),7.55(dd,j=7.0,1h),7.41(dd,j=9.5,1h),7.38(s,1h),7.20(dd,j=9.5,1h),7.04(d,j=8.5,1h),6.71(s,1h),4.59(d,j=12,1h),4.8(d,j=11.5,1h),4.20(m,3h),4.00(m,3h),3.64(s,3h),3.13(m,2h),2.86(m,2h),2.64(m,2h),2.54(m,2h),1.88(m,2h),1.78(m,2h)。实施例1302-(2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮130实施例130a5-(1-甲基-1,2,3,6-四氢吡啶-4-基)-2-硝基吡啶130a向配有搅拌棒的圆底烧瓶中加入1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1,2,3,6-四氢吡啶(1.50g,6.72mmol)、5-溴-2-硝基吡啶(1.64g,8.07mmol)、pd(pph3)4(388mg,0.336mmol)、na2co3水溶液(1.0n,20.2ml,20.2mmol)、二噁烷(60.6ml)。在100℃下加热反应混合物10hr。将ch2cl2(200ml)加入所得的混合物中,并用水(30mlx3)洗涤。加入ch2cl2(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,干燥mgso4,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:dcm=5:95)得到5-(1-甲基-1,2,3,6-四氢吡啶-4-基)-2-硝基吡啶(130a),为黄色固体。实施例130b5-(1-甲基哌啶-4-基)吡啶-2-胺130b在氢化瓶中,加入130a(1.25g,5.73mmol)、etoh(100ml)、10%pd/c(304mmol,0.286mmol)。在55psi下氢化混合物2hr,通过硅藻土过滤,并用meoh(20ml)洗涤。在真空中除去溶剂,获得为灰白色固体的5-(1-甲基哌啶-4-基)吡啶-2-胺130b(1.13g,100%)。实施例130c5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮130c向配有搅拌棒的圆底烧瓶加入130b(1.08g,5.65mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(2.26g,8.47mmol)、pd2(dba)3(517mg,0.565mmol)、xantphos(523mg,0.903mmol)、cs2co3(6.07g,18.6mmol)和二噁烷(28.3ml)。在100℃下过夜加热反应混合物。将ch2cl2(200ml)加入所得的混合物中,用水(30mlx3)洗涤。加入ch2cl2(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。加入ch2cl2/醚(1:2,5ml),然后超声处理,过滤沉淀,然后干燥。获得为绿色固体的化合物130c,784mg(37%)。实施例130d2-(1-甲基-5-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯130d向配有搅拌棒的微波用管加入130c(250mg,0.663mmol)、2-(2-(羟甲基)-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮114a(338mg,0.729mmol)、pd(pph3)4(38.3mg,0.033mmol)、na2co3水溶液(1.0n,2.19ml,2.19mmol)、dme(2ml)。在微波中在135℃下使混合物反应15min。加入ch2cl2(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:dcm=5:95)得到130d。向配有搅拌棒的圆底烧瓶加入130dthf(1.25ml)、i-proh(1.25ml)、h2o(1.25ml)、liohh2o(135mg)。在rt下搅拌所得的混合物1hr。在真空中除去溶剂,然后将所得的残余物加入ch2cl2(200ml)中,用水(30mlx3)、盐水(30mlx1)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:ch2cl2=10:90)得到130,为灰白色固体,39mg。ms(esi+)m/z593.4(m+h)。实施例1315-(3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-2-(羟甲基)苯基)-1-甲基-3-(1-乙基-1h-吡唑-4-基氨基)吡嗪-2(1h)-酮131实施例131a2-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯131a向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶加入105i(411mg,0.917mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷(698mg,2.75mmol)、乙酸钾(360mg,3.66mmol)和1,4-二噁烷(15ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入pd(dppf)cl2·ch2cl2(35mg,0.047mmol)。将回流冷凝管连接到烧瓶,并在90℃下加热反应混合物14h。此后,加入更多的pd(dppf)cl2·ch2cl2(70mg,0.094mmol),并在90℃下搅拌反应4h。此后,用乙酸乙酯(100ml)和水(75ml)稀释混合物,然后分离各层。用乙酸乙酯(50ml)萃取水层,并用盐水(50ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,70:30己烷/乙酸乙酯),得到82%收率(373mg)的131a,为非结晶灰白色固体:1hnmr(500mhz,cdcl3)δ7.81(dd,j=7.5,1.5hz,1h),7.41(t,j=7.5hz,1h),7.35(dd,j=7.0,1.5hz,1h),5.51(d,j=11.5hz,1h),5.26(d,j=11.5hz,1h),4.03–3.98(m,1h),3.77–3.72(m,1h),3.05–2.98(m,1h),2.82–2.76(m,1h),2.76(s,2h),2.52(s,2h),1.99(s,3h),1.33(s,12h),1.27(s,3h),1.26(s,3h);ms(esi+)m/z496.2(m+h)。实施例131b5-溴-3-(1-乙基-1h-吡唑-4-基氨基)-1-甲基吡嗪-2(1h)-酮131b按照实施例111b,使1-乙基-1h-吡唑-4-胺(500mg,4.50mmol)和3,5-二溴-1-甲基吡嗪–2(1h)-酮(1.33g,4.95mmol)反应,以75%收率(1.01g)得到131b,为灰白色固体:mp237–239℃;1hnmr(300mhz,dmso-d6)δ9.90(s,1h),8.02(s,1h),7.73(s,1h),7.20(s,1h),4.11(q,2h,j=7.5hz),3.41(s,3h),1.34(t,3h,j=7.3hz);ms(esi+)m/z298.0(m+h)。向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶加入131b(200mg,0.670mmol)、硼酸酯131a(365mg,0.737mmol)、碳酸钠(184mg,1.73mmol)、dmf(2ml)、水(2ml)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(134mg,0.116mmol)。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物14h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)混合物稀释,并分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,并用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后将所得的残余物溶于thf(5ml)、水(5ml)和甲醇(5ml)的混合物。加入一水合氢氧化锂(121mg,2.89mmol),并在室温下搅拌混合物2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(50ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2×75ml)萃取水层,并用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,90:10二氯甲烷/甲醇),以26%收率(96mg)得到131,为非结晶黄色固体:mp138–140℃;1hnmr(500mhz,dmso-d6)δ9.56(s,1h),8.16(s,1h),7.73(s,1h),7.56(dd,j=7.5,1.0hz,1h),7.46(t,j=8.0hz,1h),7.34(dd,j=7.5,1.0hz,1h),7.31(s,1h),4.85–4.82(m,1h),4.56–4.53(m,1h),4.47–4.44(m,1h),4.08–4.02(m,3h),3.90–3.86(m,1h),3.52(s,3h),3.03–3.00(m,1h),2.92–2.87(m,1h),2.75(s,2h),2.54(d,j=5.0hz,2h),1.32(t,j=7.5hz,3h),1.23(s,6h);ms(esi+)m/z545.1(m+h)。实施例1322-(2-(羟甲基)-3-(5-(5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮132实施例132a2-(2-(乙酰氧基甲基)-3-(5-(5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮132a按照实施例119d,使119c(150mg,0.50mmol)、113a(257mg,0.55mmol)、1nna2co3(1.1ml)和四(三苯基膦)钯(0)(29mg,5mol%)反应得到132a(160mg,53%收率)。按照实施例132,使132a(160mg,0.27mmol)、1nlioh(1.3ml)、thf(2ml)和异丙醇(2ml)反应得到白色固体132(118mg,78%收率)。ms(esi+)m/z558.3(m+h)。实施例1332-(2-(羟甲基)-3-(6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢哒嗪-3-基)苯基)-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮133实施例133a6-氯-4-(嘧啶-4-基氨基)哒嗪-3(2h)-酮133a向配有机械搅拌器、氮气入口和回流冷凝管的1-l三颈圆底烧瓶加入4-溴-6-氯哒嗪-3(2h)-酮(7.30g,35.0mmol)、2-氨基嘧啶(3.33g,35.0mmol)、碳酸铯(25.0g,76.8mmol)和1,4-二噁烷(345ml)。在持续30分钟使氮气鼓泡经过所得的溶液后,加入xantphos(1.71g,2.96mmol)和三(二亚苄基丙酮)二钯(0)(1.60g,1.74mmol),并在回流下加热反应混合物3h。此后使反应冷却至室温并过滤。用二氯甲烷(3×50ml)和水(3×20ml)洗涤滤饼,然后在真空烘箱中在45℃下过夜干燥,得到棕褐色固体133a(5.54g,71%):mp>300℃;1hnmr(500mhz,dmso–d6)13.28(brs,1h),9.90(brs,1h),8.91(s,1h),8.51(d,1h,j=6.0hz),8.39(s,1h),7.53(dd,1h,j=1.5,6.0hz);ms(esi+)m/z224.1(m+h)。按照实施例119d,由133a(145mg,0.650mmol)和111a(313mg,0.650mmol)以18%收率(60mg)得到粉色固体133:mp150–151℃;1hnmr(500mhz,dmso-d6)δ13.30(s,1h),9.81(s,1h),8.79(s,1h),8.66(s,1h),8.47(s,1h),7.48(m,2h),7.43(m,2h),4.66(m,1h),4.44(m,1h),4.38(m,1h),4.04(m,1h),3.85(m,1h),2.94(m,1h),2.87(m,1h),2.77(m,2h),2.53(m,1h),1.79(m,4h);ms(esi+)m/z501.1(m+h)。实施例1342-(2-(羟甲基)-3-(5-(5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮134实施例134a3-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-1-甲基-1h-吡唑-5-羧酸甲酯134a按照实施例119a,将3,5-二溴-1-甲基吡啶-2(1h)-酮(2.0g,7.5mmol)转化成134a。实施例134b5-溴-3-(5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮134b按照实施例119b,使132a(330mg,0.97mmol)和3.0mmemgbr/乙醚(5.8mmol,1.9ml)在thf(10ml)中反应得到134b(270mg,82%收率)。实施例134c2-(5-(5-(2-羟基丙烷-2-基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯134c按照实施例119,使113b(120mg,0.35mmol)、113a(180mg,0.39mmol)、1nna2co3(0.8ml)和钯四(20mg,5mol%)反应得到134c(85mg,40%收率)。按照实施例119,使134c(80mg,0.13mmol)、1nlioh(0.7ml)、thf(1.5ml)和异丙醇(1.5ml)反应。通过柱色谱(硅胶,meoh/ch2cl2)纯化产物,然后用etoac使其成粉末,得到134(18mg,25%收率)。ms(esi+)m/z557.3(m+h)。实施例1352-(3-(5-(5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮135实施例135a5-环丙基-2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪135a将1-(2-溴乙基)-5-(溴甲基)-3-硝基-1h-吡唑101c(4g,12.9mmol)和环丙胺(7.35g,129mmol)在thf(40ml)中的混合物在30℃下过夜搅拌。在反应完成后,过滤混合物,并用thf(100ml)洗涤固体。在减压下浓缩滤液得到135a(2.68g,99%)。ms:[m+h]+209。实施例135b5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-胺135b将5-环丙基-2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪135a(2.68g,12.9mmol)、fe(3.6g,64.4mmol)和nh4cl(4.1g,77.4mmol)在乙醇(30ml)和水(5ml)中的混合物在回流下加热2h。在反应完成后,过滤混合物。用乙醇(150ml)洗涤固体。在真空中蒸发滤液,然后用甲醇/二氯甲烷(1/7)萃取残余物。用na2so4干燥合并的萃取液,然后蒸发。在反相combi快速色谱上纯化残余物,得到135b(1.8g,75%)。ms:[m+h]+179。实施例135c5-溴-3-(5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮135c将5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-胺135b(1.39g,7.8mmol)、xantphos(450mg,0.78mmol)、pd2dba3(476mg,0.52mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.72g,6.5mmol)和cs2co3(6.3mg,19.5mmol)在1,4-二噁烷(30ml)中的混合物在回流下加热1h。在反应完成后,过滤混合物,并用甲醇(60ml)洗涤固体。在真空中蒸发滤液,然后在反相combi快速色谱上纯化残余物,得到135c(0.84g,30%)。ms:[m+h]+364。实施例135d2-(5-(5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯135d将4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(105mg,0.26mmol)、135c(100mg,0.28mmol)、pdcl2(dppf)(29mg,0.039mmol)、k3po4(100mg)和naoac(50mg)在mecn(10ml)和水(3ml)中的混合物在110℃下加热2h。在真空中蒸发溶剂。在反相combi快速色谱上纯化残余物得到135d(100mg,60%)。ms:[m+h]+640。将135d(100mg,0.16mmol)和lioh水合物(100mg.2.3mmol)在异丙醇(10ml)和水(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(10ml×2)萃取残余物。在减压下浓缩合并的萃取液,然后用制备型hplc纯化残余物得到135(40mg,42%)。ms:[m+h]+598.1hnmr(500mhz,meod)δ7.89(s,1h),7.26(s,1h),7.20(d,j=9.0,2h),6.72(s,1h),5.88(s,1h),4.52-4.44(m,2h),4.22-4.18(m,3h),4.03-3.97(m,3h),3.81(s,2h),3.69(s,3h),3.15-3.13(m,2h),2.67-2.61(m,2h),2.57-2.51(m,2h),1.96-1.87(m,3h),1.81-1.75(m,2h),0.62-0.58(m,2h),0.53-0.49(m,2h)。实施例1365-(3-{5-[(5-环丙基-1h-吡唑-3-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-5-氟-2-(羟甲基)苯基)-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮136实施例136a3-环丙基-3-氧代丙腈136a在-78℃下在n2保护下向ch3cn(0.34ml,6.58mmol)在thf(3ml)中的溶液滴加lda(3.3ml,6.58mmol)。在-78℃下搅拌反应混合物3h。然后加入在thf(2ml)中的环丙烷羧酸乙酯(0.5g,4.38mmol),并使混合物在1h内升温至室温。加入水(2ml),然后在减压下除去溶剂。加入ch2cl2(2ml),用2nhcl将混合物的ph调至5。然后用ch2cl2(5ml×2)萃取,用na2so4干燥,然后浓缩得到黄色油状物136a,未经进一步纯化用于下一步骤。实施例136b3-环丙基-1h-吡唑-5-胺136b向136a(477mg,4.38mmol)在meoh(5ml)中的溶液加入n2h4.h2o(80%)(5ml)。在75℃下加热反应混合物15h。在减压下除去meoh。用ch2cl2(2x8ml)萃取残余物,用na2so4干燥,然后浓缩。通过快速柱色谱纯化残余物,用100:1ch2cl2/meoh洗脱,得到黄色油状物136b(37%,两步)。lcms:(m+h)+124。实施例136c5-氨基-3-环丙基-1h-吡唑-1-羧酸叔丁酯136c向136b(0.25g,2mmol)和k2co3(0.828g,6mmol)在thf(5ml)中的混合物加入在thf(5ml)中的(boc)2o(0.436g,2mmol)。在室温下搅拌反应混合物15h。然后过滤,浓缩。通过快速柱色谱纯化残余物,用6:1石油醚/乙酸乙酯洗脱,得到白色固体136c(240mg,54%)。lcms:(m-boc)+124。实施例136d5-溴-3-(3-环丙基-1h-吡唑-5-基氨基)-1-甲基吡啶-2(1h)-酮136d向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶加入1,4-二噁烷(15ml)、136c(455mg,1.95mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(0.40g,1.5mmol)和碳酸铯(1.22g,3.75mmol)。在持续30分钟使氮气鼓泡经过所得的混合物后,加入xantphos(87mg,0.15mmol)和三(二亚苄基丙酮)二钯(0)(70mg,0.075mmol),并在回流下加热反应混合物15h。此后使反应冷却至室温,在乙酸乙酯(30ml)和水(30ml)之间分配,然后过滤。分离水层并用乙酸乙酯(2x50ml)萃取。合并有机层,用盐水(50ml)洗涤,然后用na2so4干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过快速柱色谱纯化残余物,用50:1ch2cl2/meoh洗脱,得到黄色固体136d(320mg,50%)。lcms:(m+h)+309。1hnmr(500mhz,dmso)δ11.85(s,1h),8.23(s,1h),8.02(d,j=2.5,1h),7.35(d,j=2.5,1h),5.77(d,j=2,1h),3.46(s,3h),1.83(m,1h),0.90(m,2h),0.64(m,2h)实施例136e(2-{5-[(5-环丙基-1h-吡唑-3-基)氨基]-1-甲基-6-氧代吡啶-3-基}-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯136e向25ml密封的小瓶加入(4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-甲基乙酸酯212b(580mg,1.16mmol)、136d(300mg,0.97mmol)、ch3coona(160mg,1.94mmol)、k3po4(410mg,1.94mmol)、pdcl2(dppf)(100mg,0.12mmol)、ch3cn(12ml)和h2o(1ml)。在110℃下加热混合物2小时。蒸发反应混合物,然后通过快速柱色谱纯化残余物,用包含0.5%三乙胺的50:1二氯甲烷/甲醇洗脱,得到黑色固体136e(300mg,52%)。向136e(300mg,0.50mmol)在丙-2-醇(3ml)、四氢呋喃(3ml)和水(3ml)中的溶液中加入lioh(1.0g,25mmol)。在30℃下搅拌混合物2h。然后加入20mlh2o并用ea(30ml×3)萃取。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化,得到白色固体136(200mg,70%)。lcms:(m+h)+5601hnmr(500mhz,dmso)δ7.78(s,1h),7.25(d,j=2.5,1h),7.21(m,2h),5.79(s,1h),4.48(m,2h),4.15(m,1h),4.00(m,1h),3.69(s,3h),3.07(m,1h),2.95(m,1h),2.85(m,2h),2.61(m,2h),1.89(m,5h),0.96(m,2h),0.73(m,2h)。实施例1375-[5-氟-2-(羟甲基)-3-[1-甲基-5-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮137实施例137a5-[5-氟-3-[1-甲基-5-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并-[1,5-a]吡嗪-2-基氨基)-6-氧代吡啶-3-基]苄基乙酸酯]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮137a向25ml密封管加入(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b(990mg,2mmol)、5-溴-1-甲基-3-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮252a(500mg,1.3mmol)、ch3coona(220mg,2.6mmol)、k3po4(700mg,2.6mmol)和pdcl2(dppf)(110mg,0.13mmol),悬浮于ch3cn(25ml)和h2o(1ml)中。在110℃下搅拌混合物2小时。然后蒸发溶剂,通过硅胶柱纯化残余物,用20:1ch2cl2/甲醇洗脱,得到褐色固体137a(300mg,35%)。ms:(m+h)+673。向137a(270mg,0.4mmol)在丙-2-醇(8ml)、四氢呋喃(8ml)和水(1.5ml)中的溶液加入lioh(964mg,40mmol)。在30℃下搅拌混合物2h。然后在减压下蒸发,通过制备型hplc纯化残余物得到黄色固体137(84mg,33%)。ms:(m+h)+631。1hnmr(500mhz,meod)δ1.87(s,4h),2.52-2.56(d,2h),2.83-2.90(d,5h),3.01(s,1h),3.56-3.74(t,6h),3.96-4.01(t,4h),4.44-4.48(t,2h),4.63(s,2h),4.74(s,2h),5.87(s,1h),7.16-7.18(d,2h),7.25(s,1h),7.89(s,1h)。实施例1382-(3-(5-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮138实施例138a1-乙基-4-(6-硝基吡啶-3-基)哌嗪138a向配有搅拌棒的密封管加入5-溴-2-硝基吡啶(3.00g,14.78mmol)、1-乙基哌嗪(5.06g,44.34mmol)、四丁基碘化铵(273mmol,0.739mmol)、k2co3(6.128g,44.34mmol)和dmso(30ml)。将管密封并在90℃下过夜加热。加入水(200ml),然后过滤沉淀得到1.24g黄色固体138a。实施例138b5-(4-乙基哌嗪-1-基)吡啶-2-胺138b在氢化瓶中,加入138a(2.59g,10.96mmol)、etoh(100ml)、10%pd/c(580mg,0.55mmol)。将混合物在下55psi氢化2hr,然后通过硅藻土过滤并用meoh(20ml)洗涤。在真空中除去溶剂得到粉色固体138b(2.51g,82%)。实施例138c5-溴-3-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮138c向配有搅拌棒的圆底烧瓶加入138b(2.52g,12.22mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(4.89g,18.32mmol)、pd2(dba)3(1.12g,1.22mmol)、xantphos(1.13mg,1.96mmol)、cs2co3(13.14g,40.33mmol)和二噁烷(50ml)。在100℃下过夜加热反应混合物。将ch2cl2(200ml)加入到所得的混合物,用水(30mlx3)洗涤。加入ch2cl2(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。加入ch2cl2/乙醚(1:2,5ml),而后进行超声处理,过滤沉淀得到黄色固体138c,2.718g(57%)。实施例138d2-(5-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯138d向配有搅拌棒的微波用管加入138c(250mg,0.637mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(325.5mg,0.701mmol)、pd(pph3)4(36.8mg,0.0319mmol)、na2co3水溶液(1.0n,2.10ml,2.10mmol)、dme(2.0ml)。使混合物在微波中在135℃下反应15min。加入ch2cl2(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:ch2cl2=5:95)得到2-(5-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯138d。向配有搅拌棒的圆底烧瓶加入138d、thf(5.0ml)、i-proh(5.0ml)、h2o(5.0ml)、liohh2o(200mg)。在rt下搅拌所得的混合物2hr。在真空中除去所有的溶剂,然后将所得的残余物加入到ch2cl2(200ml)中,用水(30mlx3)、盐水(30mlx1)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:ch2cl2=10:90)得到60mg灰色固体138。ms(esi+)m/z608.3(m+h)。实施例1393-{[4-(3-羟基-3-甲基氮杂环丁烷-1-基)苯基]氨基}-5-[2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-1,2-二氢吡嗪-2-酮139按照实施例301,将1-(4-氨基苯基)-3-甲基氮杂环丁烷-3-醇转化成99mg白色固体139。ms(esi+)m/z581(m+h)。实施例1402-(3-(6-(1-(2-羟基乙基)-1h-吡唑-4-基氨基)-4-甲基-5-氧代-4,5-二氢吡嗪-2-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮140实施例140a5-溴-3-(1-(2-羟基乙基)-1h-吡唑-4-基氨基)-1-甲基吡嗪-2(1h)-酮140a向配有磁力搅拌器的烧瓶加入1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-1h-吡唑-4-胺116b(1.7g,7.1mmol)、3,5-二溴-1-甲基吡嗪-2(1h)-酮(1.25g,4.7mmol)和ipa(25ml)。对系统抽真空而后再充入n2。在90℃下加热反应混合物6h。然后,将混合物冷却至室温,在减压下浓缩。通过快速色谱纯化残余物,用石油醚/乙酸乙酯洗脱,得到140a(1.7g,78%)。lcms:[m+h]+314。实施例140b2-(6-(1-(2-羟基乙基)-1h-吡唑-4-基氨基)-4-甲基-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯140b将悬浮于ch3cn(30ml)和h2o(2ml)中的140a(595mg,1.9mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(882mg,1.9mmol)、ch3coona(309mg,3.8mmol)、pdcl2(dppf)(153mg,0.19mmol)和k3po4(1g,3.8mmol)的混合物在氩气氛下在110℃下加热15h。在反应后,蒸发ch3cn,然后通过反相combi-快速色谱纯化残余物,用含有0.3%nh4hco3的1:4水/ch3cn洗脱,得到褐色固体140b(477mg,44%)。lcms:[m+h]+572。将140b(410mg,0.72mmol)和lioh(372mg,16mmol)在iproh/thf(1:1,10ml)和h2o(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用etoac(10mlx2)萃取残余物。在减压下浓缩合并的萃取液,然后在制备型hplc上纯化残余物得到140(200mg,54%)。lcms:[m+h]+5301hnmr(500mhz,cdcl3)δ7.71(s,1h),7.68(s,1h),7.49(s,1h),7.36(m,2h),7.27(m,1h),6.92(s,1h),6.78(s,1h),5.29(s,1h),4.43(d,j=12,1h),4.21(m,4h),4.04(m,2h),4.01(m,3h),3.63(s,3h),2.55(dt,j=14.5,4h),1.78(m,4h)。实施例1412-(2-(羟甲基)-3-(1-甲基-5-(5-甲基-4,5,6,7-四氢噻唑并[5,4-c]吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮141实施例141a5-甲基-4,5,6,7-四氢噻唑并[5,4-c]吡啶-2-胺141a将1-甲基-4-哌啶酮(11.3g,100mmol)在2-丙醇(80ml)中的溶液加热至50℃。向此溶液依次加入氰酰胺(4.2g,100mmol)的2-丙醇(25ml)溶液和硫粉(3.2g)。在向其加入催化量的吡咯烷(1.3ml)后,在50℃或高于50℃下搅拌所得的混合物2小时。使反应混合物冷却至室温,然后过夜搅拌。将所得的混合物在冰水浴中冷却至10℃或低于10℃,并在相同的温度下搅拌1小时。通过过滤收集沉淀析出的结晶,并用2-丙醇(20ml)洗涤。在减压下干燥湿的结晶,得到141a(10g,60%)。lcms:[m+h]+1701hnmr(500mhz,dmso)δ6.70(s,2h),3.31(s,2h),2.61(t,j=5.5,2h),2.45(m,,2h),2.33(s,3h)。实施例141b5-溴-1-甲基-3-(5-甲基-4,5,6,7-四氢噻唑并[5,4-c]吡啶-2-基氨基)吡啶-2(1h)-酮141b按照实施例110c,使3g的141a和4g的3,5-二溴-1-甲基吡啶-2(1h)-酮反应得到141b,为黄色固体(2.8g,52%)。lcms:[m+h]+357实施例141c2-(1-甲基-5-(5-甲基-4,5,6,7-四氢噻唑并[5,4-c]吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯141c按照实施例147b,使232mg的114a和178mg的141b反应得到141c,为黄色固体(240mg,80%)。lcms:[m+h]+613按照实施例148,将240mg的141c转化成141,为白色固体(112mg,50%)。lcms:[m+h]+514。实施例1422-(3-(5-(1,5-二甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮142实施例142a5-溴-3-(1,5-二甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮142a用nah/矿物油的60%悬浮液(0.5g,13mmol)处理5-溴-1-甲基-3-(5-甲基-1h-吡唑-3-基氨基)吡啶-2(1h)-酮112a(2.8g,9.9mmol)在无水dmf(10ml)中的溶液,同时在氮气下搅拌。在冒气泡后,再搅拌反应30分钟。此时用mei(0.98g,7mmol)处理反应并在氮气下继续搅拌2小时。缓慢加入水(50ml),过滤混合物,然后浓缩。通过快速色谱纯化残余物,用石油醚/乙酸乙酯洗脱,得到142a(0.7g,24%),未经进一步纯化直接使用。lcms:(m+h)+297。实施例142b2-(5-(1,5-二甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯142b将悬浮于ch3cn(30ml)和h2o(2ml)中的142a(510mg,1.7mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(882mg,1.9mmol)、ch3coona(309mg,3.8mmol)、pdcl2(dppf)(153mg,0.19mmol)和k3po4(1g,3.8mmol)的混合物在氩气氛下在110℃下加热15h。然后蒸发,通过反相combi-快速色谱纯化残余物,用含有0.3%nh4hco3的1:4水/ch3cn洗脱,得到褐色固体142b(200mg,21%)。lcms:[m+h]+555。将142b(210mg,0.38mmol)和lioh(372mg,16mmol)在iproh/thf(1:1,10ml)和水(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用etoac(10mlx2)萃取残余物。在减压下浓缩合并的萃取液,然后在制备型hplc上纯化残余物,得到142(95mg,50%)。lcms:[m+h]+530。1hnmr(500mhz,cdcl3)δ7.88(s,1h),7.43(m,2h),7.38(s,1h),7.30(m,1h),7.21(m,1h),6.84(s,1h),5.71(s,1h),4.58(d,j=11.5,1h),4.38(d,j=11.5,,1h),4.13(m,3h),3.94(m,1h),3.67(s,3h),3.64(s,3h),2.57(m,4h),2.21(s,3h),1.78(m,4h)。实施例1432-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮143实施例143a1-甲基-5-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基硼酸143a向5-溴-1-甲基-3-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮252a(1g,2.64mmol),4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(2g,7.92mmol)在二噁烷(40ml)中的溶液加入pdcl2(dppf)(215mg,0.26mmol)和ch3cook(776mg,7.92mmol)。在氩气氛下在100℃下搅拌混合物6h。在反应后,过滤混合物,然后在真空中蒸发。通过反相combi快速色谱纯化残余物,用含有0.3%nh4hco3的1:3水/ch3cn洗脱,得到白色固体143a(300mg,33%)。ms:(m+h)+346。实施例143b4-氟-2-(1-甲基-5-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯143b向25ml小瓶加入143a(238mg,0.7mmol)、2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯197d(300mg,0.7mmol)、na2co3(147mg,1.4mmol)、pdcl2(dppf)(56mg,0.07mmol),悬浮于dme(15ml)和h2o(1ml)中。将所得的橙色混合物在biotage微波反应器中在130℃下加热30分钟。在反应后,通过反相combi-快速色谱纯化残余物,用含有0.3%nh4hco3的1:7水/ch3cn洗脱,得到褐色固体143b(150mg,33%)。ms:(m+h)+656。向4-氟-2-(1-甲基-5-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯143b(120mg,0.18mmol)在丙-2-醇(5ml)、四氢呋喃(5ml)和水(1.5ml)中的溶液中加入lioh(440mg,18mmol)。在30℃下搅拌混合物2h。然后蒸发反应混合物,通过制备型hplc纯化残余物得到黄色固体143(50mg,45%)。ms:(m+h)+614。1hnmr(500mhz,meod)δ1.79(s,2h),1.90(s,2h),2.54-2.56(t,j=6.5hz,2h),2.63-2.67(m,2h),2.86-2.88(t,j=6hz,2h),3.59(s,2h),3.70(s,3h),3.76-3.79(m,1h),4.00-4.07(m,3h),4.21(s,3h),4.48-4.53(m,2h),4.64-4.67(t,j=6.5hz,2h),4.75-4.78(t,j=7hz,2h),5.90(s,1h),6.72(s,1h),7.20-7.27(m,3h),7.91-7.92(d,1h)。实施例1445-[5-氟-2-(羟甲基)-3-[1-甲基-5-(5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮144实施例144a3-(5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮144a将5-溴-3-(5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]-吡嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮135c(0.9g,2.48mmol)、双(频哪醇)联硼酸酯(1.26g,4.96mmol)、pdcl2(dppf)(272mg,0.37mmol)和koac(486mg,4.96mmol)在1,4-二噁烷(40ml)中的混合物在回流下加热15h。在反应完成后,过滤混合物,并用乙酸乙酯(100ml)洗涤。在真空中蒸发滤液,然后在硅胶柱上纯化残余物,得到144a(407mg,40%)。ms:[m+h]+412。实施例144b5-[5-氟-3-[1-甲基-5-(5-环丙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代吡啶-3-基]苄基乙酸酯]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮144b将144a(300mg,0.73mmol)、(2-溴-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯(212a)(297mg,0.66mmol)、pdcl2(dppf)(73mg,0.1mmol)和2mna2co3溶液(2ml)在dme(8ml)中的混合物在微波辐射下在120℃下加热0.5h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到144b(173mg,40%)。ms:[m+h]+657。将144b(170mg,0.26mmol)和lioh水合物(104mg,2.6mmol)在iproh(15ml)和h2o(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用etoac(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到144(50mg,31%)。ms:[m+h]+615。1hnmr(500mhz,meod)δ7.89(d,j=2.0,1h),7.26(d,j=2.0,1h),7.22-7.18(m,2h),5.89(s,1h),4.52-4.46(m,2h),4.17-4.11(m,1h),4.02-3.97(m,3h),3.82(s,2h),3.69(s,3h),3.16-3.14(m,2h),3.10-3.03(m,1h),2.96-2.90(m,1h),2.87-2.85(m,2h),2.65-2.53(m,2h),1.97-1.85(m,5h),0.62-0.58(m,2h),0.53-0.50(m,2h)实施例1452-(2-(羟甲基)-3-(4-甲基-5-氧代-6-(4-(哌啶-4-基)苯基氨基)-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮145实施例145a4-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)哌啶-1-羧酸叔丁酯145a除了使用4-(4-氨基苯基)哌啶-1-羧酸叔丁酯(0.83g,3.0mmol)、3,5-二溴-1-甲基吡嗪-2(1h)-酮(0.88g,3.3mmol)、碳酸铯(1.27g,3.9mmol)、三(二亚苄基丙酮)二钯(0)(0.275g,0.3mmol)、xantphos(0.26g,0.45mmol)和1,4-二噁烷(30ml)之外,利用与实施例112a相同的方法合成化合物145a。在100℃下过夜加热反应混合物。后处理并通过快速柱色谱纯化(硅胶,乙酸乙酯/己烷)以80%收率(1.1g)得到4-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)-哌啶-1-羧酸叔丁酯固体145a:ms(esi+)m/z465.0(m+h)。实施例145b除了使用2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(162mg,0.35mmol)、4-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)哌啶-1-羧酸叔丁酯145a(135mg,0.3mmol)、1m碳酸钠溶液(1.2ml,1.2mmol)、四(三苯基膦)钯(0)(18mg,0.015mmol)和1,2-二甲氧基乙烷(3ml)之外,利用与实施例121b相同的方法合成化合物混合物145b。经后处理和快速柱色谱(硅胶,乙酸乙酯/己烷)得到黄色油状物145b(120mg)。实施例145c除了使用145b(120mg)、三氟乙酸(0.5ml,6.5mmol)和二氯甲烷(7ml)之外,利用与实施例121c相同的方法合成化合物混合物。后处理,然后浓缩至干,得到黄色油状物化合物145c,未经纯化用于下一步骤。除了使用thf(1ml)、水(0.5ml)和异丙醇(1ml)、化合物145c和一水合氢氧化锂(50mg,1.30mmol)的混合物之外,利用与实施例121相同的方法合成化合物145。经后处理和快速柱色谱(硅胶,二氯甲烷/含20%tea的甲醇)得到黄色固体(68mg),将其从碱性铝柱洗脱(乙酸乙酯)又以15%收率(3步,25mg)得到白色固体145:ms(esi+)m/z579.4(m+h)。实施例1462-(2-(羟甲基)-3-(1-甲基-5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮146实施例146a5-溴-1-甲基-3-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮146a将5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-胺101e(1g,6.6mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.7g,6.6mmol)、xantphos(380mg,0.66mmol)、pd2(dba)3(602mg,0.66mmol)和cs2co3(4g,13.2mmol)在二噁烷(30ml)中的悬浮液在密封管中在氮气下在120℃下加热2h。在反应后,过滤溶剂,然后在真空中蒸发滤液得到黄色固体。用etoac(10ml×3)洗涤黄色固体,得到黄色固体146a(1g,45%),未经进一步纯化使用。ms:(m+h)+338。实施例146b2-(1-甲基-5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯146b向25ml小瓶加入5-溴-1-甲基-3-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮145a(500mg,1.48mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(664mg,1.48mmol)、ch3coona(243mg,2.96mmol)、pdcl2(dppf)(121mg,0.148mmol)和k3po4(790mg,2.96mmol),悬浮于ch3cn(50ml)和h2o(3ml)中。然后在氩气氛下在110℃下加热12h。在反应后,蒸发混合物,然后通过反相combi-快速色谱纯化残余物,用含有0.3%nh4hco3的1:5水/ch3cn洗脱,得到褐色固体146b(200mg,23%)。ms:(m+h)+596。向2-(1-甲基-5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯146b(180mg,0.3mmol)在丙-2-醇(9ml)、四氢呋喃(9ml)和水(3ml)中的溶液加入lioh(726mg,30mmol)。在30℃下搅拌混合物2h。在反应后,蒸发混合物,然后通过制备型hplc纯化残余物得到白色固体146(67mg,41%)。ms:(m+h)+554。1hnmr(500mhz,meod)δ1.80(s,2h),1.90(s,2h),2.49(s,3h),2.54-2.57(t,2h),2.63-2.67(m,2h),2.93-2.96(t,j=5.5hz,2h),3.64(s,2h),3.70(s,3h),4.02-4.06(m,3h),4.18-4.23(m,3h),4.49-4.57(m,2h),5.89(s,1h),6.72(s,1h),7.23(s,1h),7.36-7.38(d,1h),7.41-7.42(d,1h),7.49-7.52(t,1h),7.1(s,1h)。实施例1472-(3-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮147实施例147a6-氯-4-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-2-甲基哒嗪-3(2h)-酮147a将6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-胺110b(0.8g,5.76mmol)、xantophos(360mg,0.623mmol)、pd2dba3(384mg,0.42mmol)、4-溴-6-氯-2-甲基哒嗪-3(2h)-酮103e(1.28g,5.76mmol)和cs2co3(5.05g,17.3mmol)在1,4-二噁烷(40ml)中的混合物在回流下加热2h。在反应完成后,过滤混合物,并用meoh(60ml)洗涤。在真空中蒸发滤液。在反相combi快速色谱上纯化残余物得到147a(1.3g,81%)。ms:[m+h]+282。实施例147b2-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯147b将6-氯-4-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-2-甲基哒嗪-3(2h)-酮147a(400mg,1.42mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(660mg,1.42mmol)、pdcl2(dppf)(155mg,0.21mmol)、k3po4(150mg)和naoac(50mg)在mecn(20ml)和h2o(4ml)中的混合物在密封管中在110℃下加热2h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到147b(273mg,33%)。ms:[m+h]+584。将2-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯147b(410mg,0.7mmol)和lioh水合物(590mg,14mmol)在iproh(20ml)和h2o(4ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到147(120mg,32%)。ms:[m+h]+542。1hnmr(500mhz,dmso)δ9.30(s,1h),7.90(s,1h),7.49-7.46(m,1h),7.41-7.37(m,2h),6.51(s,1h),6.04(s,1h),4.74(s,2h),4.62-4.60(m,1h),4.48-4.45(m,1h),4.39-4.35(m,1h),4.18-4.06(m,3h),4.04-3.95(m,4h),3.90-3.85(m,1h),3.75(s,3h),2.60-2.56(m,2h),2.51-2.45(m,2h),1.82-1.74(m,2h),1.73-1.64(m,2h)。实施例1482-(3-(5-(5-氟吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮148实施例148a5-溴-3-(5-氟吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮148a向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶加入1,4-二噁烷(50ml)、5-氟吡啶-2-胺(0.67g,6mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.34g,5mmol)和碳酸铯(4.89g,15mmol)。在持续30分钟使氮气鼓泡经过所得的溶液后,加入xantphos(576mg,1mmol)和三(二亚苄基丙酮)二钯(0)(460mg,0.5mmol),并在回流下加热反应混合物15h。此后使反应冷却至室温,在乙酸乙酯(100ml)和水(100ml)之间分配,然后过滤。分离水层,并用乙酸乙酯(50ml×2)萃取。合并有机层,并用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。用乙腈(30ml)洗涤残余物,然后过滤得到148a(900mg,61%)。ms:[m+h]+298。实施例148b2-(5-(5-氟吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯148b向密封管加入2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(232mg,0.5mmol)、148a(148mg,0.50mmol)、pd(dppf)cl2(25mg,0.03mmol)、k3po4.3h2o(266mg,1.0mmol)和naoac(82mg,1.0mmol)在ch3cn(18ml)中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后冷却至室温,过滤。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物,用30:1dcm/meoh洗脱,得到黄色固体148b(200mg,72%)。ms:[m+h]+556。在室温下向148b(200mg,0.36mmol)在thf/ipa/h2o(6ml/6ml/2ml)中的溶液中加入lioh(87mg,3.6mmol)同时搅拌。搅拌此混合物0.5h。然后加入20mlh2o,并用乙酸乙酯(30mlx3)萃取。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体148(110mg,59%)。lcms:[m+h]+514。1hnmr(500mhz,dmso)δ8.77(s,1h),8.62(d,j=2.0,1h),8.16(d,j=2.5,1h),7.59(m,,1h),7.47(t,j=7.5,1h),7.39-7.14(m,2h),7.34(m,2h),6.52(s,1h),4.85(s,1h),4.35(d,j=4.0,2h),4.17(m,2h),4.10(m,1h),3.90(m,1h),3.61(s,3h),2.60(m,2h),2.48(m,2h),1.80(t,j=5.5,2h),1.70(m,2h)。实施例1492-(3-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮149实施例149a2-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯149a将2-(乙酰氧基甲基)-5-氟-3-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苯基硼酸210d(150mg,0.38mmol)、5-溴-3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮110c(122mg,0.38mmol)、pdcl2(dppf)(41mg,0.056mmol)、k3po4(100mg)和naoac(50mg)在mecn(10ml)和h2o(3ml)中的混合物在密封管中在110℃下加热2h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到149a(120mg,53%)。ms:[m+h]+601。将149a(120mg,0.2mmol)和lioh水合物(84mg,2mmol)在iproh(10ml)和h2o(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(10ml×2)萃取残余物。在减压下浓缩合并的萃取液,然后在制备型hplc上纯化残余物得到149(60mg,54%)。ms:[m+h]+559。1hnmr(500mhz,meod)δ7.82(s,1h),7.16(s,1h),7.10(d,j=9.0,2h),6.62(s,1h),5.77(s,1h),4.67(s,2h),4.43-4.35(m,2h),4.11-4.07(m,3h),4.00-3.99(m,2h),3.93-3.90(m,3h),3.60(s,3h),2.55-2.52(m,2h),2.46-2.43(m,2h),1.82-1.78(m,2h),1.71-1.67(m,2h)。实施例1505-[5-氟-2-(羟甲基)-3-(1-甲基-6-氧代-5-{4h,6h,7h-吡唑并[3,2-c][1,4]噁嗪-2-基氨基}吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮150实施例150a3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮150a将5-溴-3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮110c(1.3g,4.0mmol)、双(频哪醇)联硼酸酯(2.03g,8mmol)、pdcl2(dppf)(439mg,0.6mmol)和koac(784mg,8.0mmol)在1,4-二噁烷(60ml)中的混合物在回流下加热15h。在反应完成后,过滤混合物,并用etoac(100ml)洗涤。在真空中蒸发滤液,然后在硅胶柱上纯化残余物得到150a(446mg,30%)。ms:[m+h]+373。实施例150b[4-氟-2-(1-甲基-6-氧代-5-{4h,6h,7h-吡唑并[3,2-c][1,4]噁嗪-2-基氨基}吡啶-3-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯150b将150a(260mg,0.70mmol)、(2-溴-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯218a(225mg,0.50mmol)、pdcl2(dppf)(55mg,0.075mmol)、2mna2co3溶液(1.5ml)在dme(8ml)中的混合物在微波辐射下在120℃下加热0.5h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到150b(154mg,50%)。ms:[m+h]+618。将150b(150mg,0.24mmol)和lioh水合物(96mg,2.4mmol)在iproh(15ml)和h2o(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到150(70mg,51%)。ms:[m+h]+576。1hnmr(500mhz,dmso)δ8.22(s,1h),8.00(s,1h),7.32-7.29(m,2h),7.17-7.15(m,1h),5.93(s,1h),4.86-4.85(m,1h),4.71(s,2h),4.36-4.28(m,2h),4.10-3.84(m,7h),3.57(s,3h),3.02-2.92(m,1h),2.90-2.76(m,3h),1.86-1.74(m,4h)。实施例1512-(3-(5-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮151实施例151a2-(5-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯151a在配有磁力搅拌棒的44-ml密封管中,将3-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮155n(60mg,0.18mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(110mg,0.23mmol)、pd(pph3)4(21mg,0.0.18mmol)加入2nna2co3(3ml)、dme(2ml)和二噁烷(3ml)中。在100℃下搅拌反应混合物14h后,在二氯甲烷(5ml)和水(5ml)之间分配,并用二氯甲烷(5mlx3)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。通过快速色谱法纯化粗产物(二氯甲烷:meoh,85:15),得到40%(40mg)的固体2-(5-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯151a。向配有磁力搅拌棒的25-ml单颈圆底烧瓶加入151a(40mg,0.068mmol)、lioh·h2o(20mg,0.48mmol)、thf(2ml)、i-proh(2ml)和水(2ml)。在室温下搅拌反应混合物3h后,在二氯甲烷(5ml)和水(5ml)之间分配,并用二氯甲烷(5mlx3)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)中。向此溶液加入己烷(10ml),然后过滤所得的沉淀得到88%收率(33mg)的151;ms(esi+)m/z551.3(m+h)。实施例1522-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]苯并咪唑-1-酮152实施例152an-(2-羟基乙基)-1h-苯并[d]咪唑-2-甲酰胺152a用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入1h-苯并[d]咪唑-2-羧酸(1.50g,9.26mmol)和亚硫酰氯(10ml)。在回流下加热16h后,将悬浮液冷却至室温并过滤。用甲苯(10ml)洗涤滤饼,然后在真空下在室温下干燥5h。将所得的固体加入配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中,而后加入氯仿(10ml)和2-羟基乙胺(559mg,9.17mmol)。在回流下搅拌16h后,在减压下浓缩反应混合物,用水(20ml)使所得的残余物成粉末,然后在真空烘箱中在45℃下干燥得到73%收率(1.41g)的白色固体152a:mp194–195℃;1hnmr(500mhz,dmso-d6)δ13.13(s,1h),8.74(s,1h),7.71–7.29(m,4h),4.80(s,1h),3.55(dd,2h,j=10.5,5.5hz),3.38(dd,2h,j=10.5,5.5hz);ms(apci+)m/z206.6(m+h)。实施例152b3,4-二氢吡嗪并[1,2-a]苯并咪唑-1-酮152b用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入152a(1.41g,6.84mmol)和dmf(10ml),并将反应混合物冷却至0℃。滴加亚硫酰氯(896mg,7.53mmol)在dmf(5ml)中的溶液。在150℃下加热反应2h。此后,在减压下除去溶剂。将所得的残余物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到52%收率(672mg)的褐色固体152b:mp>250℃;1hnmr(500mhz,dmso-d6)δ8.53(s,1h),7.76(d,1h,j=9.0hz),7.66(d,1h,j=9.0hz),7.40(t,1h,j=9.0hz),7.31(t,1h,j=9.0hz),4.41(t,2h,j=6.0hz),3.71(m,2h);ms(apci+)m/z188.4(m+h)。实施例152c3,4,6,7,8,9-六氢吡嗪并[1,2-a]苯并咪唑-1-酮152c向250-ml不锈钢压力反应器加入10%钯/碳(50%湿度,150mg干重)和152b(670mg,3.58mmol)在乙酸(25ml)中的溶液。对反应器抽真空,充入氢气至压力350psi并在95℃下搅拌16h。此后,抽除氢气,将氮气充入反应器中。加入celite521(1.00g),并通过celite521垫过滤混合物。用乙醇(2×25ml)洗涤滤饼,将合并的滤液在减压下浓缩至干。向所得的残余物加入水(10ml),而后加入碳酸钾将ph调至9。用二氯甲烷(4×20ml)萃取混合物,合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩得到71%收率的白色固体152c(487mg):mp>250℃;1hnmr(500mhz,dmso-d6)7.86(s,1h),3.98(t,2h,j=6.5hz),3.51(m,2h),2.50(m,4h),1.75(m,4h);ms(apci+)m/z192.6(m+h)。实施例152d2-溴-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]苯并咪唑-2-基)苄基乙酸酯152d向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入152c(485mg,2.54mmol)、104g(1.56g,5.08mmol)、碳酸铯(1.66g,5.08mmol)、n,n’-二甲基乙二胺(447mg,5.08mmol)和1,4-二噁烷(20ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(484mg,2.54mmol),并在100℃(油浴温度)下加热反应混合物16h。此后,将混合物冷却至室温,过滤。用乙酸乙酯(100ml)和水(50ml)稀释滤液。分离有机层,并用乙酸乙酯(3×50ml)萃取水层,用硫酸钠干燥合并的有机层,然后在减压下浓缩,通过柱色谱纯化残余物得到黄色油状物,将其溶于二氯甲烷(5ml)中。加入乙酰氯(506mg,2.54mmol)和三乙胺(1.28g,12.7mmol),并在室温下搅拌反应混合物2h。此后,用二氯甲烷(50ml)和饱和碳酸氢钠水溶液(20ml)稀释反应混合物。分离有机层,并用二氯甲烷(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到13%收率(140mg)的黄色油状物152d:1hnmr(500mhz,cdcl3)7.60(d,1h,j=8.0hz),7.27(t,1h,j=8.0hz),7.18(d,1h,j=8.0hz),5.26(d,1h,j=12.0hz),5.14(d,1h,j=12.0hz),4.32(m,1h),4.24(m,1h),4.14(m,1h),3.87(m,1h),2.75(m,2h),2.56(m,2h),2.07(s,3h),1.83(m,4h);ms(apci+)m/z418.8(m+h)。用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入152d(140mg,0.335mmol)、104h(140mg,0.426mmol)、碳酸钠(106mg,1.00mmol)、1,4-二噁烷(5ml)和水(1ml)。用氮气对此混合物脱气30min。加入四(三苯基膦)钯(39mg,0.033mmol)。在100℃下加热5h后,将反应混合物冷却至室温,在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩,将所得的残余物溶于甲醇(5ml)中,加入碳酸钾(500mg,3.62mmol)。在室温下搅拌2h后,使反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩,通过快速色谱法纯化所得的残余物得到9%收率(15mg)的黄色固体152:mp205–206℃;1hnmr(500mhz,dmso-d6)δ9.18(s,1h),8.70(d,1h,j=2.5hz),8.64(m,1h),8.30(d,1h,j=6.0hz),7.51–7.47(m,2h),7.39(d,1h,j=8.0hz),7.35(d,1h,j=8.0hz),7.31(d,1h,j=6.0hz),4.92(t,1h,j=4.5hz),4.36(m,2h),4.27(m,2h),4.19(m,1h),3.97(m,1h),3.61(s,3h),2.63(m,2h),2.52(m,2h),1.87(m,4h);ms(esi+)m/z498.2(m+h)。实施例1532-(2-(羟甲基)-3-(4-甲基-5-氧代-6-(1,2,3,4-四氢异喹啉-6-基氨基)-4,5-二氢吡嗪-2-基)苯基)-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮153实施例153a5-溴-1-甲基-3-(1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮153a用氮气吹扫配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶,并加入120a(1.14g,2.62mmol)、二氯甲烷(10ml)和三氟乙酸(10ml)。在室温下搅拌溶液2h。此后,在减压下浓缩溶液。使残余物在二氯甲烷(100ml)和1m磷酸氢钾水溶液(30ml)之间分配。用甲醇/二氯甲烷20%(v/v)溶液(3×100ml)萃取水层。合并有机萃取液,用盐水(20ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液得到68%收率(600mg)的灰白色固体153a:mp170–171℃;1hnmr(300mhz,dmso-d6)δ9.30(s,1h),7.62(m,2h),7.31(s,1h),6.97(d,1h,j=7.8hz),4.10(brs,1h),3.83(s,2h),3.43(s,3h),2.96(t,2h,j=5.7hz),2.68(t,2h,j=5.7hz);ms(esi+)m/z334.0(m+h)。向配有回流冷凝管、磁力搅拌器和氮气入口的50-ml三颈圆底烧瓶加入153a(168mg,0.500mmol)、111a(289mg,0.600mmol)、碳酸钠(159mg,1.50mmol)、dmf(5ml)、水(2.5ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(58mg,0.050mmol),并在回流下加热反应混合物14h。此后,将混合物冷却至室温,加入甲醇(2ml)、水(2ml)和一水合氢氧化锂(42mg,1.00mmol)。在室温下搅拌混合物4h,然后在真空中浓缩。使残余物在乙酸乙酯(150ml)和水(30ml)之间分配。分离有机层,并用甲醇/二氯甲烷20%(v/v)溶液(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-10%甲醇/二氯甲烷)得到4%收率(12mg)的灰白色固体153:209–210℃dec;1hnmr(500mhz,dmso-d6)δ9.04(s,1h),7.74(s,1h),7.61(d,1h,j=7.4hz),7.53(d,1h,j=8.0hz),7.46(t,1h,j=8.0hz),7.40(s,1h),7.32(d,1h,j=7.4hz),6.90(d,1h,j=8.3hz),4.77(m,1h),4.53(m,1h),4.43(m,1h),4.02(m,1h),3.87(m,1h),3.77(s,2h),3.58(s,3h),2.91(m,4h),2.79(s,2h),2.63(m,2h),1.78(m,4h);ms(esi+)m/z568.1(m+h)。实施例1542-(2-(羟甲基)-3-(6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮154实施例154a5-溴-3-(嘧啶-4-基氨基)吡啶-2(1h)-酮154a向配有回流冷凝管、磁力搅拌器和氮气入口的250-ml三颈圆底烧瓶加入2-氨基嘧啶(376mg,3.95mmol)、3,5-二溴吡啶-2(1h)-酮(1.00g,3.95mmol)、1m六甲基二硅烷重氮锂thf溶液(20ml,20.0mmol)和1,4-二噁烷(25ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xantphos(194mg,0.211mmol)和三(二亚苄基丙酮)二钯(0)(165mg,0.197mmol),并在回流下加热反应混合物3h。此后,将混合物冷却至室温,并用乙酸乙酯(150ml)和水(30ml)稀释。分离有机层,并用乙酸乙酯(3×150ml)萃取水层。用硫酸钠干燥合并的有机萃取液,然后在减压下浓缩。通过快速色谱法纯化残余物,然后用乙酸乙酯(20ml)使其成粉末,得到24%收率(250mg)的灰白色固体154a:mp150–151℃;1hnmr(500mhz,dmso-d6)δ12.03(s,1h),9.27(s,1h),8.54(s,1h),8.20(d,1h,j=6.0hz),7.85(s,1h),6.64(d,1h,j=6.0hz);ms(esi+)m/z268.2(m+h)。向配有回流冷凝管、磁力搅拌器和氮气入口的50-ml三颈圆底烧瓶加入154a(175mg,0.655mmol)、111a(315mg,0.655mmol)、碳酸钠(208mg,2.00mmol)、dmf(2.5ml)、水(1.2ml)和1,4-二噁烷(4ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(76mg,0.065mmol),并在回流下加热反应混合物14h。此后,将混合物冷却至室温,加入甲醇(2ml)、水(2ml)和一水合氢氧化锂(82mg,1.95mmol)。在室温下搅拌混合物2h,然后在真空中浓缩。使残余物在乙酸乙酯(150ml)和水(30ml)之间分配。分离有机层,并用甲醇/二氯甲烷20%(v/v)溶液(3×150ml)萃取水层。用硫酸钠干燥合并的有机萃取液,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-10%甲醇/二氯甲烷)得到5%收率(15mg)的灰白色固体154:mp200–201℃;1hnmr(500mhz,dmso-d6)δ11.99(s,1h),9.34(s,1h),8.57(s,1h),8.21(d,1h,j=6.0hz),8.00(s,1h),7.62(s,1h),7.44(t,1h,j=7.5hz),7.35(d,1h,j=7.0hz),6.70(d,1h,j=5.5hz),5.05(brs,1h),4.28(t,1h,j=11.0hz),4.18(d,1h,j=10.0hz),3.96(m,1h),3.90(m,1h),2.94(m,1h),2.84(m,1h),2.77(m,2h),1.76(m,4h);ms(esi+)m/z500.1(m+h)。实施例1555,5,6,6,7,7-六氘代-2-(2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮155实施例155c4,4,5,5,6,6-六氘代-4,5,6,7-四氢苯并[b]噻吩-2-羧酸乙酯155c利用与实施例105b中所述相同的通用方法使中间体155a(1.53g)与2-巯基乙酸乙酯(1.57g)反应。获得51%收率(1.46g)的澄清油状物中间体155c:1hnmr(500mhz,cdcl3)7.46(s,1h),4.31(q,2h,j=7.5hz),2.77(s,2h),1.35(t,3h,j=7.5hz);ms(esi+)m/z217(m+h)。实施例155d4,4,5,5,6,6-六氘代-4,5,6,7-四氢苯并[b]噻吩-2-羧酸155d利用与实施例105c中所述相同的通用方法使中间体155d(1.34g)皂化。获得94%收率(1.10g)的白色固体中间体155d:mp192–193℃;1hnmr(500mhz,dmso-d6)12.75(brs,1h),7.40(s,1h),2.73(s,2h)。实施例155e4,4,5,5,6,6-六氘代-n-甲氧基-n-甲基-4,5,6,7-四氢苯并[b]噻吩-2-甲酰胺155e用氮气吹扫配有磁力搅拌器的250-ml单颈圆底烧瓶,加入155d(5.67g,30.1mmol)、二氯甲烷(100ml)和dmf(110mg,1.50mmol),并冷却至0℃。向所得的溶液滴加草酰氯(4.21g,33.1mmol)。在完成此加料后,使反应升温至室温并搅拌3h。此后,将反应在减压下浓缩至干。将残余物溶于二氯甲烷(100ml)中,并将所得的溶液冷却至0℃。加入三乙胺(9.15g,90.3mmol)和n,o-二甲基羟胺盐酸盐(3.23g,33.1mmol)。在加料完成后,除去冷却浴,在室温下搅拌反应混合物14h。此后,使反应混合物在水(100ml)和乙酸乙酯(200ml)之间分配。分离各层,并用乙酸乙酯(100ml)萃取水相。用水(100ml),而后用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下蒸发溶剂。通过快速色谱法纯化所得的残余物(硅胶,0%-100%乙酸乙酯/己烷)得到90%收率的白色固体155e(6.29g):mp47–48℃;1hnmr(500mhz,cdcl3)δ7.62(s,1h),3.76(s,3h),3.31(s,3h),2.77(s,2h);ms(esi+)m/z232.1(m+h)。实施例155f1-(4,4,5,5,6,6-六氘代-4,5,6,7-四氢苯并[b]噻吩-2-基)丙-2-烯-1-酮155f用氮气吹扫配有磁力搅拌器的250-ml单颈圆底烧瓶,并加入155e(6.29g,27.2mmol)和无水thf(60ml),并用丙酮/冰浴将所得的溶液冷却至-25℃。滴加乙烯基溴化镁/thf1.0m溶液(32.3ml,32.6mmol),并在0℃下搅拌所得的反应混合物1h。此后,使反应混合物在乙酸乙酯(250ml)和2m盐酸(50ml)之间分配。分离各层,并用乙酸乙酯(40ml)萃取水相。用水(100ml),而后用盐水(100ml)洗涤合并的有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩,得到定量收率的粗品半固体155f(5.39g)。此材料未经进一步纯化用于下一步骤。实施例155g3-氯-1-(4,4,5,5,6,6-六氘代-4,5,6,7-四氢苯并[b]噻吩-2-基)丙烷-1-酮155g用氮气吹扫配有磁力搅拌器的250-ml单颈圆底烧瓶,并加入155f(5.39g,27.2mmol)、二氯甲烷(60ml),并将所得的溶液冷却至0℃。加入氯化氢/乙醚的2m溶液(34ml)。在室温下搅拌3h后,在减压下除去溶剂。通过柱色谱(硅胶,0%-50%乙酸乙酯/己烷)纯化所得的残余物得到定量收率(6.38g)的灰白色固体155g:mp51–53℃;1hnmr(300mhz,cdcl3)δ7.41(s,1h),3.89(t,2h,j=7.0hz),3.30(t,2h,j=7.0hz),2.79(s,2h);ms(esi+)m/z235.1(m+h)。实施例155h6,6,7,7,8,8-六氘代-5,6,7,8-四氢-1h-苯并[b]环戊二烯并[d]噻吩-3(2h)-酮155h向配有磁力搅拌器的250-ml单颈圆底烧瓶加入155g(6.38g,27.2mmol)和98%硫酸(50ml)。在95℃下搅拌14h后,将反应混合物倒入冰(50g)中,并用乙酸乙酯(3×50ml)萃取所得的悬浮液。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物(硅胶,0%-50%乙酸乙酯/己烷)得到56%收率(3.03g)的灰白色固体155h:mp43–44℃;1hnmr(300mhz,cdcl3)δ2.91(m,6h)。实施例155i6,6,7,7,8,8-六氘代-5,6,7,8-四氢-1h-苯并[b]环戊二烯并[d]噻吩-3(2h)-酮肟155i向配有机械搅拌器和氮气入口的250-ml单颈圆底烧瓶加入羟胺盐酸盐(1.59g,22.9mmol)和甲醇(40ml)。利用冰浴将混合物冷却至0℃。加入三水合乙酸钠(3.19g,22.9mmol)。在0℃下搅拌混合物30min。此后,加入155h(3.03g,15.3mmol),并在室温下搅拌反应14h。此后,浓缩混合物,再溶于二氯甲烷(200ml)和水(30ml)中。分离有机层,并用二氯甲烷(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到84%收率(2.72g)的灰白色固体155i:mp174–176℃;1hnmr(300mhz,cdcl3)δ3.12(m,2h),2.82(m,4h);ms(esi+)m/z214.1(m+h)。实施例155j5,5,6,6,7,7-六氘代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮155j向配有回流冷凝管、磁力搅拌器和氮气入口的50-ml单颈圆底烧瓶加入155i(2.72g,12.8mmol)和聚磷酸(150g)。在80℃下搅拌14h后,将反应混合物冷却至室温,加入水(300ml)。搅拌所得的混合物30min,然后过滤。用水(20ml)洗涤滤饼,然后在真空烘箱中在45℃下干燥得到74%收率(2.00g)的灰白色固体155j:mp204–205℃;1hnmr(300mhz,cdcl3)δ5.58(s,1h),3.58(m,2h),2.79(s,2h),2.71(t,2h,j=7.0hz);ms(esi+)m/z214.1(m+h)。实施例155k2-溴-6-(5,5,6,6,7,7-六氘代-1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯155k向配有回流冷凝管、磁力搅拌器和氮气入口的250-ml三颈圆底烧瓶加入155j(1.00g,4.69mmol)、104g(2.89g,9.38mmol)、碳酸铯(4.59g,14.1mmol)、n,n’-二甲基乙二胺(412mg,4.69mmol)和1,4-二噁烷(35ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(447mg,2.35mmol),并在80℃(油浴温度)下加热反应混合物20h。此后,将混合物冷却至室温,然后过滤。用乙酸乙酯(150ml)和水(30ml)稀释滤液。分离有机层,并用乙酸乙酯(3×100ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-40%乙酸乙酯/己烷)得到35%收率(715mg)的灰白色固体155k:mp74–75℃;1hnmr(500mhz,cdcl3)δ7.59(m,1h),7.31(m,2h),5.15(d,1h,j=12.0hz),5.04(d,1h,j=12.0hz),3.99(m,1h),3.65(m,1h),2.81(m,1h),2.74(s,2h),2.06(s,3h);ms(esi+)m/z440.1(m+h)。实施例155l2-(5,5,6,6,7,7-六氘代-1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯155l用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入155k(710mg,1.61mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(819mg,3.22mmol)、乙酸钾(474mg,4.83mmol)和1,4-二噁烷(12ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)(118mg,0.161mmol),并在回流下加热反应混合物2h。此后,将混合物冷却至室温,并用乙酸乙酯(150ml)和水(30ml)稀释。分离有机层,并用乙酸乙酯(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到定量收率的粗品155l(785mg)。此材料未经进一步纯化用于下一步骤。实施例155m3-(6-(6-溴-2-甲基-3-氧代-2,3-二氢吡啶-4-基氨基)吡啶-3-基)氮杂环丁烷-1-羧酸叔丁酯155m向配有磁力搅拌器和回流冷凝管的250-ml单颈圆底烧瓶加入3-(6-氨基吡啶-3-基)氮杂环丁烷-1-羧酸叔丁酯(333mg,1.33mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(350mg,1.33mmol)、碳酸铯(870mg,2.70mmol)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡经过所得的溶液后,加入xantphos(66mg,0.114mmol)和三(二亚苄基丙酮)二钯(0)(61mg,0.066mmol),并在105℃下加热反应混合物3h。此后,将混合物冷却至室温,然后过滤。用二氯甲烷(2×10ml)洗涤滤饼,然后在减压下浓缩合并的滤液。在硅胶上通过柱色谱纯化所得的残余物得到79%收率(460mg)的绿色固体155m:mp134–136℃;1hnmr(500mhz,dmso-d6)δ8.75(s,1h),8.65(s,1h),8.19(s,1h),7.66(dd,1h,j=8.5,2.0hz),7.51(s,1h),7.35(d,1h,j=8.5hz),4.21(t,2h,j=8.0hz),3.81(m,2h),3.51(s,3h),1.40(s,9h);ms(esi+)m/z436.1(m+h)。实施例155n3-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮155n用氮气吹扫配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶,并加入155m(1.20g,2.76mmol)、二氯甲烷(10ml)和三氟乙酸(10ml)。在室温下搅拌溶液2h。此后,在减压下浓缩溶液。使残余物在二氯甲烷(100ml)和1m磷酸氢钾水溶液(30ml)之间分配。用甲醇/二氯甲烷20%(v/v)溶液(3×100ml)萃取水层。合并有机萃取液,用盐水(20ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液得到定量收率(920mg)的灰白色固体155n:mp123–124℃;1hnmr(300mhz,dmso-d6)8.72(s,1h),8.65(d,1h,j=2.3hz),8.19(d,1h,j=2.1hz),7.71(dd,1h,j=8.6,2.2hz),7.51(d,1h,j=2.3hz),7.33(d,1h,j=8.2hz),3.74(m,3h),3.58(m,2h),3.52(s,3h);ms(esi+)m/z335.1(m+h)。实施例155o2-(5-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(5,5,6,6,7,7-六氘代-1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯155o向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入粗品155l(785mg,假定1.61mmol)、155n(450mg,1.34mmol)、碳酸钠(426mg,4.02mmol)、dmf(10ml)、水(5ml)和1,4-二噁烷(16ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(155mg,0.134mmol),并在回流下加热反应混合物14h。使残余物在乙酸乙酯(150ml)和水(30ml)之间分配。分离有机层,并用甲醇/二氯甲烷20%(v/v)溶液(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到粗品155o。此材料未经进一步纯化用于下一步骤。实施例155p2-(3-(5-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-5,5,6,6,7,7-六氘代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮155p向100-ml单颈圆底烧瓶(配有)加入来自前一步骤的粗品155o、thf(8ml)、甲醇(4ml)、水(4ml)和一水合氢氧化锂(420mg,10.0mmol)。在室温下搅拌混合物4h,然后在真空中浓缩。使残余物在乙酸乙酯(150ml)和水(30ml)之间分配。分离有机层,并用甲醇/二氯甲烷的20%(v/v)溶液(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-10%甲醇/二氯甲烷)得到15%收率(140mg)的灰白色固体155p:mp140–142℃;1hnmr(500mhz,dmso-d6)δ8.65(d,1h,j=2.0hz),8.53(s,1h),8.10(d,1h,j=2.4hz),7.67(m,1h),7.45(t,1h,j=8.0hz),7.31(m,4h),4.81(t,1h,j=5.0hz),4.35(m,2h),4.04(m,1h),3.88(m,1h),3.71(m,3h),3.59(s,3h),3.55(m,2h),2.96(m,1h),2.86(m,1h),2.77(s,2h);ms(esi+)m/z574.3(m+h)。用氮气吹扫配有磁力搅拌器的150-ml单颈圆底烧瓶,并加入155p(140mg,0.244mmol)、甲醛/水的37%溶液(26mg,0.317mmol)和甲醇(10ml)。加入氰基硼氢化钠(48mg,0.732mmol)和氯化锌(50mg,0.366mmol)在甲醇(4ml)中的悬浮液,并在室温下搅拌反应16h。此后,在真空中浓缩反应混合物。使残余物在乙酸乙酯(150ml)和水(30ml)之间分配。分离有机层,并用甲醇/二氯甲烷的20%(v/v)溶液(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-10%甲醇/二氯甲烷)得到45%收率(65mg)的白色固体155:mp190–192℃;1hnmr(500mhz,dmso-d6)δ8.65(d,1h,j=2.5hz),8.58(s,1h),8.15(d,1h,j=2.5hz),7.67(dd,1h,j=8.5,2.5hz),7.46(t,1h,j=8.0hz),7.33(m,4h),4.81(t,1h,j=4.0hz),4.35(m,2h),4.02(m,1h),3.85(m,3h),3.64(m,1h),3.59(s,3h),3.42(m,2h),2.98(m,1h),2.87(m,1h),2.76(s,2h),2.47(s,3h);ms(esi+)m/z588.2(m+h)。实施例1562-(3-(5-(5-((3,3-二氟氮杂环丁烷-1-基)甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮156实施例156a5-硝基-1h-吡唑-3-羧酸甲酯156a用氮气吹扫配有磁力搅拌器和回流冷凝管的50-ml单颈圆底烧瓶,并加入5-硝基-1h-吡唑-3-羧酸(0.86g,5.5mmol)和无水甲醇(10ml),并将反应混合物在冰/水冷却浴中冷却至0℃。向所得的溶液滴加亚硫酰氯(1.7g,14.4mmol)。在加料完成后,除去冰浴,然后在回流下加热反应3h。此后,在减压下将反应浓缩至干得到定量收率的白色固体156a(0.94g):ms(esi-)m/z170(m-h)。实施例156b1-甲基-3-硝基-1h-吡唑-5-羧酸甲酯156b用氮气吹扫配有磁力搅拌器的50-ml单颈圆底烧瓶,并加入5-硝基-1h-吡唑-3-羧酸甲酯(156a)(0.94g,5.5mmol)、无水n,n-二甲基甲酰胺(11ml)、碘甲烷(0.85g,6mmol)和碳酸钾(0.83g,6.1mmol)。在室温下搅拌反应16h。此后用水(40ml)稀释反应液,并用二氯甲烷(3×25ml)萃取。用硫酸钠干燥合并的有机萃取液,过滤,然后在减压下浓缩。所得的残余物经快速色谱(硅胶,乙酸乙酯/己烷)得到66%收率(0.67g)的白色固体1-甲基-3-硝基-1h-吡唑-5-羧酸甲酯156b:ms(esi+)m/z186.0(m+h)。还分离出15%收率(0.15g)的区域异构体1-甲基-5-硝基-1h-吡唑-3-羧酸甲酯,为白色固体:ms(esi-)m/z186.0(m+h)。实施例156c(1-甲基-3-硝基-1h-吡唑-5-基)甲醇156c用氮气吹扫配有磁力搅拌器、加料漏斗和氮气入口的100-ml三颈圆底烧瓶,加入156b(0.67g,3.6mmol)、thf(20ml),并用冰浴冷却至0℃。以保持内部反应温度低于5℃的速度滴加2m硼氢化锂溶液(3.6ml,7.2mmol)。在加料完成后,除去冷却浴,然后在室温下搅拌反应3h。用冰浴将反应冷却至0℃,滴加饱和碳酸氢钠水溶液(30ml)。分离各层,并用乙酸乙酯(3×30ml)萃取水层。用盐水(30ml)洗涤合并的有机层,用硫酸钠干燥,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,乙酸乙酯/己烷)得到定量收率(0.56g)的灰白色固体(1-甲基-3-硝基-1h-吡唑-5-基)甲醇(156c):ms(esi+)m/z158.1(m+h)。实施例156d5-(溴甲基)-1-甲基-3-硝基-1h-吡唑156d用氮气吹扫配有磁力搅拌器和回流冷凝管的25-ml圆底烧瓶,并加入156c(0.56g,3.6mmol)和氯仿(10ml)。用冰浴将反应冷却至0℃,然后滴加三溴化磷(0.98g,3.6mmol)。除去冷却浴,然后在回流下搅拌反应3h。此后,使反应冷却至0℃,并用二氯甲烷(25ml)稀释。加入饱和碳酸氢钠水溶液直至ph达到8.5。分离各层,并用二氯甲烷(3×25ml)萃取水层。用盐水(30ml)洗涤合并的有机层,用硫酸钠干燥,然后在减压下浓缩得到定量收率(0.79g)的灰白色固体156d:ms(esi+)m/z222.1(m+h)。实施例156e5-((3,3-二氟氮杂环丁烷-1-基)甲基)-1-甲基-3-硝基-1h-吡唑156e向配有磁力搅拌器的密封管加入dmf(5ml)、5-(溴甲基)-1-甲基-3-硝基-1h-吡唑156d(0.39g,1.78mmol)、3,3-二氟氮杂环丁烷盐酸盐(276mg,2.13mmol)和dipea(0.8ml,4.45mmol)。在65℃下加热反应混合物3-5h。此后将反应在减压下浓缩至干,然后用乙酸乙酯(15ml)和水(15ml)的混合物稀释所得的残余物。分离水层,并用乙酸乙酯(2×15ml)萃取。用硫酸钠干燥合并的有机萃取液,然后在减压下浓缩得到定量收率的黄色油状物156e,未经进一步纯化用于下一步骤。ms(esi+)m/z233.0(m+h)。实施例156f5-((3,3-二氟氮杂环丁烷-1-基)甲基)-1-甲基-1h-吡唑-3-胺156f用氮气吹扫parr反应瓶,并加入10%钯/碳(30%湿度,150mg干重)以及156e(1.78mmol)在乙醇中的溶液(25ml)。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力40psi并振摇2h。此后,抽除氢气,然后通过celite521垫过滤反应混合物。用乙醇(2×25ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干,得到定量收率的黄色油状物156f(360mg):ms(esi+)m/z203.1(m+h)。实施例156g5-溴-3-(5-((3,3-二氟氮杂环丁烷-1-基)甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮156g除了使用156f(360mg,1.78mmol)、3,5-二溴-1-甲基-1h-吡啶-2-酮(0.43g,1.6mmol)、碳酸铯(1.56g,4.8mmol)、三(二亚苄基丙酮)二钯(0)(0.15g,0.16mmol)、xantphos(0.18g,0.32mmol)和1,4-二噁烷(18ml)之外,利用与实施例112a相同的方法合成中间体156g。在115℃下加热反应混合物24小时。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到38%收率(0.23g)的绿色固体156g:ms(esi+)m/z390.1(m+h)。按照实施例121c,除了使用2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(165mg,0.35mmol)、156g(115mg,0.3mmol)、1m碳酸钠溶液(1.2ml,1.2mmol)、四(三苯基膦)钯(0)(18mg,0.015mmol)和1,2-二甲氧基乙烷(3ml)之外。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到黄色油状物(190mg)156h(化合物156及其乙酸酯的混合物)。用thf(2ml)、水(1ml)和异丙醇(2ml)以及一水合氢氧化锂(80mg,1.90mmol)的混合物对混合物(0.3mmol)进行脱保护。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到12%收率(2步,22mg)的白色固体156:ms(esi+)m/z604.4(m+h)。实施例1572-(2-(羟甲基)-3-(5-(5-甲氧基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮157实施例157a5-溴-3-(5-甲氧基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮157a向配有磁力搅拌器的密封管加入5-甲氧基-1h-吡唑-3-胺(1.9g,17mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(4.9g,18mmol)和碳酸铯(12g,37mmol)及1,4-二噁烷(160ml)。在持续30min使氮气鼓泡经过溶液后,加入xantphos(1.1g,2mmol)和三(二亚苄基丙酮)二钯(0)(1.1g,1.2mmol),并将反应混合物加热至100℃持续16小时。此后,加入h2o(50ml)和etoac(50ml)。分离水层,并用etoac(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。将所得的溶液在减压下浓缩至几乎干燥,并且期望的产物从溶液析出。过滤并用et2o(10ml)洗涤得到12%收率(590mg)的粗品157a。实施例157b2-(5-(5-甲氧基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯157b向配有磁力搅拌器的微波用管加入157a(94mg,0.3mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(180mg,0.4mmol)、dme(4ml)和1m碳酸钠水溶液(0.9ml)。在持续15min鼓吹n2后,加入pd(pph3)4(18mg,0.02mmol)。将混合物在微波中加热至130℃持续25min。此后,加入etoac(5ml)和水(5ml)。用etoac(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:et2o:meoh的梯度洗脱,得到19%收率(33mg)的157b。向配有磁力搅拌器的25ml圆底烧瓶加入157b(33mg,0.06mmol)、氢氧化锂(10mg,1.2mmol)、thf(0.3ml)、i-proh(0.3ml)和水(0.6ml)。在rt下搅拌混合物1h。此后,加入etoac(5ml)和水(5ml)。用etoac(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:et2o:meoh的梯度洗脱,得到76%收率(23mg)的157。ms(esi+)m/z515.4(m+h)。实施例1585-[2-(羟甲基)-3-[1-甲基-6-氧代-5-(5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮158实施例158a2-(二苯基亚甲基氨基)-7,8-二氢-1,6-萘啶-6(5h)-羧酸叔丁酯158a向配有搅拌棒的圆底烧瓶加入2-氯-7,8-二氢-1,6-萘啶-6(5h)-羧酸叔丁酯(1.09g,4.05mmol)、二苯基甲胺26(2.20g,12.14mmol)、pd(oac)2(181.6mg,0.809mmol)、binap(503.8mg,0.809mmol)、cs2co3(6.59g,20.23mmol)和甲苯(16ml)。在110℃下加热反应混合物2天。过滤反应混合物,然后在真空中除去溶剂。将残余物158a直接用于下一步骤。实施例158b2-氨基-7,8-二氢-1,6-萘啶-6(5h)-羧酸叔丁酯158b将中间体158a加入到圆底烧瓶。加入meoh(50ml)和nh2ohhcl(1.76g,25.3mmol)。在rt下搅拌所得的混合物5hr。在真空中除去溶剂,然后经硅胶柱(meoh:dcm=10:90)得到黑色油状物158b,851mg(84%,2步)。实施例158c2-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-7,8-二氢-1,6-萘啶-6(5h)-羧酸叔丁酯158c向配有搅拌棒的圆底烧瓶加入158b(851mg,3.41mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.37g,5.12mmol)、pd2(dba)3(312.5mg,0.341mmol)、xantphos(316mg,0.546mmol)、cs2co3(3.67g,11.3mmol)和二噁烷(17ml)。在100℃下过夜加热反应混合物。将dcm(200ml)加入到所得的混合物中,用水(30mlx3)洗涤。加入dcm(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用干燥mgso4,过滤,然后在真空中除去溶剂。加入dcm/乙醚(1:2,5ml),然后超声处理,过滤沉淀得到绿色固体158c,865mg(58%)。实施例158d5-[2-(乙酰氧基甲基)-3-[1-甲基-6-氧代-5-(5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮158d向配有搅拌棒的微波用管加入158c(300mg,0.689mmol)、硼酸酯111a(365mg,0.758mmol)、pd(pph3)4(39.8mg,0.034mmol)、na2co3水溶液(1.0n,2.27ml.2.27mmol)、1,2-二甲氧基乙烷(3.0ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用干燥mgso4,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:二氯甲烷=5:95)得到158d。向配有搅拌棒的圆底烧瓶加入158d、thf(5ml)、异丙醇(5ml)、水(5ml)、lioh一水合物(278mg)。在室温下搅拌所得的混合物1hr。在真空中除去溶剂,然后将所得的残余物加入到二氯甲烷(200ml)中,用水(30mlx3)、盐水(30mlx1)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=10:90)得到黄色固体158(145mg)。ms(esi+)m/z568.3(m+h)。实施例1592-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]咪唑并[4,5-c]吡啶-1-酮159实施例159a3-硝基-4-(哌啶-1-基)吡啶159a用氮气吹扫配有回流冷凝管和磁力搅拌器的500-ml单颈圆底烧瓶,并加入3-硝基-4-氯-吡啶(10.0g,63.3mmol)、哌啶(16.2g,190mmol)和乙醇(200ml)。在70℃下加热2h后,在减压下除去溶剂,然后使残余物在乙酸乙酯(200ml)和10%碳酸钾水溶液(100ml)之间分配。分离有机层,并用乙酸乙酯(2×100ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物得到100%收率(15.2g)的黄色油状物159a:1hnmr(500mhz,cdcl3)δ8.81(s,1h),8.31(d,1h,j=6.0hz),6.86(d,1h,j=6.0hz),3.22(t,4h,j=4.5hz),1.72(m,6h);ms(apci+)m/z208.4(m+h)。实施例159b6,7,8,9-四氢吡啶并[3,4-b]咪唑并[4,5-c]吡啶159b用氮气吹扫配有回流冷凝管和磁力搅拌器的500-ml单颈圆底烧瓶,并加入159a(6.00g,29.0mmol)和亚膦酸三乙酯(200ml)。在110℃下加热24h后,在减压下除去亚膦酸三乙酯,然后使残余物在二氯甲烷(200ml)和水(100ml)之间分配。分离有机层,并用二氯甲烷(2×100ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物得到53%收率(2.66g)的黄色固体159b:mp94–95℃;1hnmr(500mhz,cdcl3)8.98(s,1h),8.37(d,1h,j=6.0hz),7.22(d,1h,j=6.0hz),4.09(t,2h,j=6.0hz),3.11(t,2h,j=6.0hz),2.15(m,2h),2.05(m,2h);ms(apci+)m/z174.1(m+h)。实施例159c6,7,8,9-四氢吡啶并[3,4-b]咪唑并[4,5-c]吡啶2-氧化物159c向配有回流冷凝管和磁力搅拌器的100-ml单颈圆底烧瓶加入159b(2.50g,14.4mmol)和二氯甲烷(50ml),并将反应混合物冷却至0℃。加入3-氯过苯甲酸(4.99g,28.9mmol),并在室温下搅拌混合物1.5h。此后,在减压下除去溶剂,然后通过柱色谱纯化残余物得到83%收率(2.26g)的黄色固体159c:mp178–179℃;1hnmr(500mhz,cdcl3)8.71(s,1h),8.15(d,1h,j=6.0hz),7.19(d,1h,j=6.0hz),4.12(t,2h,j=6.0hz),3.12(t,2h,j=6.0hz),2.18(m,2h),2.05(m,2h);ms(apci+)m/z190.4(m+h)。实施例159d6,7,8,9-四氢吡啶并[3,4-b]咪唑并[4,5-c]吡啶-1-酮159d用氮气吹扫配有回流冷凝管和磁力搅拌器的250-ml单颈圆底烧瓶,并加入159c(2.26g,12.0mmol)和乙酸酐(90ml)。在140℃下加热1.5h后,在减压下除去溶剂,然后通过柱色谱纯化残余物得到62%收率(1.40g)的黄色固体159d:mp>250℃;1hnmr(500mhz,cdcl3)11.3(s,1h),7.24(d,1h,j=7.0hz),6.39(d,1h,j=6.0hz),4.07(t,2h,j=6.0hz),3.11(t,2h,j=6.0hz),2.13(m,2h),2.02(m,2h);ms(apci+)m/z190.7(m+h)。实施例159e3,4,6,7,8,9-六氢吡啶并[3,4-b]咪唑并[4,5-c]吡啶-1-酮159e向250-ml不锈钢压力反应器加入10%钯/碳(50%湿度,250mg干重)和159d(1.07g,5.66mmol)在乙酸中的溶液(50ml)。对反应器抽真空,充入氢气至压力350psi并在85℃下搅拌48h。此后,抽除氢气,并将氮气充入反应器中。加入celite521(1.00g),并通过celite521垫过滤混合物。用乙醇(2×25ml)洗涤滤饼,并将合并的滤液在减压下浓缩至干。向所得的残余物加入水(10ml),然后加入碳酸钾将ph调至9。用二氯甲烷(4×20ml)萃取混合物,合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩得到69%收率的白色固体159e(749mg):mp>250℃;1hnmr(500mhz,cdcl3)5.28(s,1h),3.85(t,2h,j=6.0hz),3.62(m,2h),2.92(t,2h,j=6.0hz),2.81(t,2h,j=6.0hz),2.03(m,2h),1.94(m,2h);ms(apci+)m/z192.7(m+h)。实施例159f2-溴-6-(1-氧代-3,4,6,7,8,9-六氢吡啶并[3,4-b]咪唑并[4,5-c]吡啶-2-基)苄基乙酸酯159f向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶加入159e(745mg,3.90mmol)、104g(2.40g,7.80mmol)、碳酸铯(2.54g,7.80mmol)、碘化亚铜(743mg,3.90mmol)和1-甲基-2-吡咯烷酮(7ml)。在120℃(油浴温度)下加热16h后,将混合物冷却至室温,然后在二氯甲烷(100ml)和水(50ml)之间分配。分离有机层,并用二氯甲烷(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物得到黄色油状物,将其用于二氯甲烷(5ml)中。加入乙酰氯(306mg,3.90mmol)和三乙胺(1.97g,19.5mmol),并在室温下搅拌反应混合物2h。此后,用二氯甲烷(50ml)和饱和碳酸氢钠水溶液(20ml)稀释反应混合物。分离有机层,并用二氯甲烷(3×50ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到6%收率(100mg)的粉色油状物159f:1hnmr(500mhz,cdcl3)7.60(d,1h,j=8.0hz),7.34(t,1h,j=8.0hz),7.16(d,1h,j=8.0hz),5.18(m,2h),4.18(m,1h),4.04(m,1h),3.87(m,1h),3.79(m,1h),3.16(m,1h),3.05(m,1h),2.95(m,2h),2.09–1.99(m,7h);ms(apci+)m/z418.9(m+h)。用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入159f(100mg,0.239mmol)、104h(350mg,1.07mmol)、碳酸钠(183mg,1.72mmol)、1,4-二噁烷(8ml)和水(2ml)。用氮气对此混合物脱气30min。加入四(三苯基膦)钯(66mg,0.057mmol)。在100℃下加热5h后,将反应混合物冷却至室温,然后在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于甲醇(5ml)中,然后加入碳酸钾(500mg,3.62mmol)。在室温下搅拌2h后,使反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到10%收率(12mg)的浅褐色固体159:mp>250℃;1hnmr(500mhz,dmso-d6)δ9.16(s,1h),8.71(d,1h,j=2.0hz),8.64(s,1h),8.29(dd,1h,j=6.0,1.5hz),7.53(s,1h),7.45(td,1h,j=6.0,1.5hz),7.31(m,3h),4.75(m,1h),4.32(m,2h),4.02(m,2h),3.88(m,2h),3.60(s,3h),3.05(m,1h),2.96(m,1h),2.76(t,2h,j=5.5hz),1.95(m,2h),1.86(m,2h);ms(esi+)m/z498.2(m+h)。实施例1603-({4-[(2r)-1,4-二甲基-3-氧代哌嗪-2-基]苯基}氨基)-5-[2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-1,2-二氢吡嗪-2-酮160按照实施例121b,使用2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(167mg,0.36mmol)、5-溴-3-(4-(1,4-二甲基-3-氧代哌嗪-2-基)苯基氨基)-1-甲基吡嗪-2(1h)-酮160a(wo2009/039397;122mg,0.3mmol)、1m碳酸钠溶液(0.9ml,0.9mmol)、四(三苯基膦)钯(0)(18mg,0.015mmol)和1,2-二甲氧基乙烷(3ml)。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到2-(5-(4-(1,4-二甲基-3-氧代哌嗪-2-基)苯基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯160b和160的黄色油状物混合物。用thf(1ml)、水(0.5ml)和异丙醇(1ml)以及一水合氢氧化锂(80mg,1.90mmol)的混合物对混合物(0.3mmol)进行脱保护。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到37%收率的白色固体化合物160(2步,70mg):ms(esi+)m/z622.4(m+h)。实施例1612-(3-(5-(1-(2-羟基乙基)-5-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮161实施例161a5-溴-3-(1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-5-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮161a用nah在矿物油中的60%悬浮液(0.17g,4.3mmol)处理5-溴-1-甲基-3-(5-甲基-1h-吡唑-3-基氨基)吡啶-2(1h)-酮112a(1.08g,3.8mmol)在无水dmf(10ml)中的溶液,同时在氮气下搅拌。在冒气泡后,再搅拌反应30min。此时用(2-溴乙氧基)(叔丁基)二甲基甲硅烷(15-1)(0.908g,3.8mmol)处理反应,继续在氮气下搅拌10小时。在反应后,缓慢加入水(50ml),然后过滤混合物。在减压下浓缩滤液,并通过快速色谱纯化残余物,用石油醚/乙酸乙酯洗脱,得到161a(1g,35%),未经进一步纯化直接使用。lcms:(m+h)+443。实施例161b2-(5-(1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-5-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢-吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯161b将悬浮于ch3cn(30ml)和h2o(2ml)中的161a(750mg,1.7mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(882mg,1.9mmol)、ch3coona(309mg,3.8mmol)、pdcl2(dppf)(153mg,0.19mmol)和k3po4(1g,3.8mmol)的混合物在氩气氛下在110℃下加热12h。在反应后,蒸发混合物,并通过反相combi-快速色谱纯化残余物,用含有0.3%nh4hco3的1:4水/ch3cn洗脱,得到褐色固体161b(210mg,18%)。lcms:[m+h]+699。实施例161c2-(3-(5-(1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-5-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮161c将161b(210mg,0.4mmol)和lioh(372mg,16mmol)在异丙醇/thf(1:1,10ml)和水(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(2x10ml)萃取残余物。在减压下浓缩合并的萃取液,然后在制备型hplc上纯化残余物得到161c。lcms:[m+h]+657将161c、樟脑磺酸(330mg,1.5mmol)在甲醇(30ml)中的溶液在室温下搅拌3h。在反应后,蒸发甲醇,然后通过制备型hplc纯化残余物得到褐色固体161(63mg,29%,2步)。lcms:[m+h]+543。1hnmr(500mhz,dmso)δ7.96(m,1h),7.45(m,1h),7.33(m,2h),7.24(m,1h),6.51(s,1h),5.87(s,1h),4.86(m,1h),4.77(m,1h),4.36(m,2h),4.15(m,3h),3.90(m,3h),3.64(m,2h),3.57(s,3h),2.51(m,2h),2.46(m,2h),2.19(s,3h),1.79(m,4h)。实施例1622-(2-(羟甲基)-3-(1-甲基-5-(2-甲基嘧啶-4-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮162实施例162a2-甲基嘧啶-4-胺162a向由不锈钢制成的内体积为500ml的耐压容器中加入3-甲氧基丙腈(10g,120mmol)、1.1.1-三甲氧基乙烷(39g,324mmol)和40.0g(560mmol,24重量%氨-甲醇溶液)。在130℃下搅拌混合物8小时。在反应完成后,过滤,然后浓缩得到黄色固体。用乙酸乙酯(50ml)洗涤固体,在真空中干燥得到162a(7.8g,60%)。lcms:[m+h]+110实施例162b5-溴-1-甲基-3-(2-甲基嘧啶-4-基氨基)吡啶-2(1h)-酮162b按照实施例148a,使2.0g的162a和4.0g的3,5-二溴-1-甲基-吡啶-2(1h)-酮反应得到黄色固体162b(2.3g,50%)。lcms:[m+h]+3571hnmr(500mhz,dmso)δ9.20(s,1h),8.78(s,1h),8.26(d,j=4.5,1h),7.68(s,1h),7.18(d,j=4.5,1h),3.59(s,3h),2.52(s,3h)。实施例162c2-(1-甲基-5-(2-甲基嘧啶-4-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯162c按照实施例148b,使464mg的2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a和443mg的162b反应得到黄色固体162c(386mg,70%)。lcms:[m+h]+553按照实施例148,使160mg的162c水解得到白色固体162(90mg,60%)。lcms:[m+h]+514。1hnmr(500mhz,dmso)δ9.04(s,1h),8.87(s,1h),8.21(s,1h),7.55(s,1h),7.48(s,1h),7.36(t,j=6.5,1h),7.12(s,1h),6.52(s,h),4.85(s,1h),4.40(s,1h),4.17-4.10(m,3h),3.92(m,1h),3.61(s,3h),2.60(m,2h),2.47(m,2h),2.42(s,3h),1.80(m,2h),1.69(m,2h)。实施例1632-(3-(5-(1-(2-羟基乙基)-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮163实施例163a5-溴-3-(1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮163a将1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-1h-吡唑-3-胺116b(1.2g,5mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.3g,5mmol)、xantphos(300mg,0.5mmol)、pd2(dba)3(460mg,0.5mmol)和cs2co3(4g,2.5mmol)在二噁烷(30ml)中的混合物在密封管中在氮气下在120℃下加热2h。在反应后,过滤混合物,然后在真空中蒸发滤液得到黄色固体,而后用乙酸乙酯(6ml×3)洗涤得到黄色固体163a(0.80g,38%),未经进一步纯化使用。ms:(m+h)+427。实施例163b2-(5-(1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯163b将悬浮于ch3cn(50ml)和水(3ml)中的163a(800mg,1.88mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(1.3g,2.82mmol)、乙酸钠(308mg,3.76mmol)、pdcl2(dppf)(153mg,0.188mmol)和k3po4(1g,3.76mmol)的混合物在氩气氛下在110℃下加热12h。然后蒸发混合物,并通过反相combi-快速色谱纯化残余物,用含有0.3%nh4hco3的1:5水/ch3cn洗脱,得到褐色固体163b(350mg,29%)。ms:(m+h)+685实施例163c2-(3-(5-(1-(2-(叔丁基二甲基甲硅烷基氧基)乙基)-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮163c向163b(460mg,0.67mmol)在丙-2-醇(15ml)、四氢呋喃(15ml)和水(5ml)中的溶液加入lioh一水合物(1.6g,67mmol)。在30℃下搅拌混合物2h。然后蒸发,并通过反相combi快速色谱纯化残余物,用含有0.3%nh4hco3的1:4水/ch3cn洗脱,得到褐色固体163c(300mg,70%)。ms:(m+h)+643将163c(300mg,0.50mmol)、樟脑磺酸(330mg,1.5mmol)在甲醇(30ml)中的溶液在室温下搅拌3h。然后蒸发,并通过制备型hplc纯化残余物得到褐色固体163(140mg,57%)。ms:(m+h)+529。1hnmr(500mhz,meod)δ1.79(s,2h),1.89(s,2h),2.54-2.56(t,j=5.5hz,2h),2.62-2.66(m,2h),3.70(s,3h),3.84-3.86(t,j=5.5hz,2h),4.01-4.02(m,1h),4.09-4.11(t,j=5.5hz,2h),4.17-4.22(m,3h),4.49-4.57(m,2h),6.05-6.06(d,1h),6.71(s,1h),7.22-7.23(d,1h),7.35-7.37(d,1h),7.40-7.42(d,1h),7.48-7.51(m,2h),7.94-7.95(d,1h)。实施例1645-[3-(5-{[5-(氮杂环丁烷-3-基)-1h-吡唑-3-基]氨基}-1-甲基-6-氧代吡啶-3-基)-5-氟-2-(羟甲基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮164实施例164b3-(2-氰基乙酰基)氮杂环丁烷-1-羧酸叔丁酯164b按照实施例136a,将1-叔丁基3-乙基氮杂环丁烷-1,3-二羧酸酯164a转化成黄色油状物164b(粗品)。lcms:(m+h)+424。1hnmr(500mhz,dmso)δ12.1(dd,j=2,1h),8.38(s,1h),8.04(d,j=2.5,1h),7.36(s,j=2.5,1h),6.06(d,j=2.5,1h),4.18(s,2h),3.80(m,1h),3.49(s,3h),1.39(s,9h)。实施例164c3-(5-氨基-1h-吡唑-3-基)氮杂环丁烷-1-羧酸叔丁酯164c按照实施例136b,将164b转化成164c,未经进一步纯化直接用于下一步骤。实施例164d5-氨基-3-(1-(叔丁氧基羰基)氮杂环丁烷-3-基)-1h-吡唑-1-羧酸叔丁酯164d按照实施例136c,将164c转化成164d,26%收率。实施例164e3-(5-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-1h-吡唑-3-基)氮杂环丁烷-1-羧酸叔丁酯164e按照实施例136d,将164d转化成164e,50%收率。实施例164e[2-(5-{[5-(氮杂环丁烷-3-基)-1h-吡唑-3-基]叔丁氧基羰基氨基}-1-甲基-6-氧代吡啶-3-基)-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯164e按照实施例136e,使164d和(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯112b反应得到164e,39%收率。实施例164f[2-(5-{[5-(氮杂环丁烷-3-基)-1h-吡唑-3-基]氨基}-1-甲基-6-氧代吡啶-3-基)-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯164f在室温下向164e(300mg,0.42mmol)在二噁烷(2ml)中的溶液滴加hcl/二噁烷(4m,6ml)。搅拌反应混合物1h。在反应完成后,浓缩得到黑色固体164f(粗产物),未经纯化用于下一步骤。lcms:(m+h)+617按照实施例136,将164f转化成164,20%收率。lcms:(m+h)+575。1hnmr(500mhz,dmso)δ7.78(s,1h),7.28(d,j=1.5,1h),7.223(s,1h),7.21(s,1h),6.21(s,1h),4.50(m,2h),4.14(m,1h),4.00(m,3h),3.90(m,2h),3.71(s,3h),3.09(m,1h),2.96(m,1h),2.86(m,2h),2.60(m,2h),1.88(m,4h)。实施例1652-(3-(5-(5-(氮杂环丁烷-3-基)-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮165实施例165a3-(3-(5-(2-(乙酰氧基甲基)-5-氟-3-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苯基)-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-1h-吡唑-5-基)氮杂环丁烷-1-羧酸叔丁酯165a按照实施例164f,使164e和4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d反应,以20%收率得到165a。lcms:(m+h)+700实施例165b2-(5-(5-(氮杂环丁烷-3-基)-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯165b按照实施例164g,将165a转化成粗品165b,未经进一步纯化直接用于下一步骤。lcms:(m+h)+600按照实施例164,将165b转化成165,40%(2步)。lcms:(m+h)+575。1hnmr(500mhz,dmso)δ7.78(s,1h),7.28(d,j=1.5,1h),7.22(s,1h),7.21(s,1h),6.21(s,1h),4.50(m,2h),4.14(m,1h),4.00(m,3h),3.90(m,2h),3.71(s,3h),3.09(m,1h),2.96(m,1h),2.86(m,2h),2.60(m,2h),1.88(m,4h)。实施例1662-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮166实施例166a2-(5-(2-(乙酰氧基甲基)-3-(1-氧代-3,4,6,7,8,9-六氢-吡嗪并[1,2-a]吲哚-2(1h)-基)苯基)-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-7,8-二氢-1,6-萘啶-6(5h)-羧酸叔丁酯166a向配有搅拌棒的微波用管加入2-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-7,8-二氢-1,6-萘啶-6(5h)-羧酸叔丁酯158c(300mg,mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(352mg,0.758mmol)、pd(pph3)4(39.8mg,0.035mmol)、na2co3水溶液(1.0n,2.27ml,2.27mmol)和1,2-二甲氧基乙烷(3.5ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到166a。向配有搅拌棒的圆底烧瓶加入166a和二氯甲烷(10ml)。将溶液在冰-水浴中冷却至0℃。加入tfa(1ml),并过夜搅拌所得的溶液。在真空中除去所有的挥发物,然后向瓶中加入thf(10ml)、i-proh(10ml)、h2o(10ml)、liohh2o(1.00g)。在rt下搅拌所得的混合物1hr。在真空中除去所有的溶剂,将所得的残余物加入到二氯甲烷(200ml)中,用水(x30ml)、盐水(30ml)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=10:90)得到浅褐色固体166,53mg。ms(esi+)m/z551.3(m+h)。实施例16710-[2-(羟甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮167实施例167a(e)-乙基3-(2-氯-4,4-二甲基环戊-1-烯基)丙烯酸酯167a以下两种方法修改自organicpreparationsandproceduresint.,29(4):471-498。向配有磁力搅拌器和氮气入口的500-ml单颈圆底烧瓶中,将2-氯-4,4-二甲基环戊-1-烯甲醛(38g,240mmol)加入苯(240ml)中。向此溶液加入乙氧基羰基亚甲基三苯基磷(84g,240mmol)。搅拌混合物14h。其后,蒸发溶剂,然后用己烷(2l)使残余物成粉末,从而萃取分离pph3副产物与产物。用硫酸钠干燥有机层,然后在真空中浓缩。通过柱色谱纯化残余物,用100%己烷–1:1己烷/乙酸乙酯梯度,得到37%收率(20g)的167a。实施例167b5,5-二甲基-1,4,5,6-四氢环戊二烯并[b]吡咯-2-羧酸乙酯167b向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶加入167a(17g,74mmol)和dmso(100ml)。向此溶液加入叠氮化钠(9.6g,150mmol)。然后将混合物加热至75℃并搅拌8h。在冷却至rt后,加入h2o(100ml)和ch2cl2(200ml),然后分离有机层。用ch2cl2(50ml)萃取水层。用盐水洗涤合并的有机层,用硫酸钠干燥,然后在真空中浓缩。通过柱色谱纯化残余物,用100%己烷–1:1己烷/乙酸乙酯梯度,得到37%收率(5.7g)的167b。实施例167c1-(氰基甲基)-5,5-二甲基-1,4,5,6-四氢环戊二烯并[b]吡咯-2-羧酸乙酯167c向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶加入167b(6.2g,30mmol)和dmf(57ml)。向此溶液加入nah(在矿物油中的80%悬浮液,1.26g,42.1mmol)。在rt下搅拌所得的混合物90min。其后,加入溴乙腈(2.94ml,42mmol)。搅拌混合物14h。其后,加入水(100ml)和乙酸乙酯(200ml),然后分离有机层。用乙酸乙酯(2x50ml)萃取水层。用盐水洗涤合并的有机层,用硫酸钠干燥,然后在真空中浓缩。通过柱色谱纯化残余物得到95%收率(7g)的167c。实施例167d1-(2-氨基乙基)-5,5-二甲基-1,4,5,6-四氢环戊二烯并[b]吡咯-2-羧酸乙酯盐酸盐167d用氮气吹扫500-mlparr反应瓶,并加入10%钯/碳(50%湿度,2.0g干重)、167c(4.5g,18mmol)、12%盐酸(9.2ml,37mmol)、乙酸乙酯(80ml)和乙醇(52ml)。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi并振摇6h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(10.0g),并通过celite521垫过滤混合物。用乙醇(2×50ml)洗涤滤饼,并将合并的滤液在减压下浓缩至干。粗品残余物167d未经进一步纯化用于下一步骤。实施例167e4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮167e用氮气吹扫配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶,并加入粗品167d(~18mmol)、乙醇钠(6.2g,92mmol)和乙醇(120ml)。在55℃下过夜搅拌混合物。其后,在减压下浓缩反应混合物,然后使残余物在乙酸乙酯(200ml)和水(100ml)之间分配。过滤溶液。用乙酸乙酯(15ml)洗涤固体得到850mg的167e。分离有机层,并用乙酸乙酯(2×100ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩至接近干燥。过滤溶液,并用乙酸乙酯(15ml)洗涤固体(1.44g)。在真空下干燥合并的固体得到61%收率(2.3g)的167e。实施例167f2-溴-6-(9-氧代-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基)苄基乙酸酯167f向配有磁力搅拌器的微波用管加入167e(301mg,1.47mmol)、2,6-二溴苄基乙酸酯104g(1.1g,3.0mmol)、cui(140mg,0.7mmol)、cs2co3(961mg,3.0mmol)、n’,n’,n’,n’-四甲基乙二胺(0.22ml,1.5mmol)和1,2-二甲氧基乙烷(4.1ml)。将混合物在微波中在150℃下加热3h。此后,过滤混合物,并用9:1ch2cl2/meoh(50ml)洗涤所得的固体。用盐水(20ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用己烷–乙酸乙酯的梯度洗脱,得到32%收率(200mg)的167f。实施例167g10-[2-(乙酰氧基甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮167g向配有磁力搅拌器的微波用管加入1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮109c(210mg,0.64mmol)、167f(140mg,0.3mmol)、1,2-二甲氧基乙烷(4ml)和1m碳酸钠水溶液(1ml)。在持续15min鼓吹n2后,加入pd(pph3)4(18mg,0.02mmol)。将混合物在微波中在130℃下加热25min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:乙醚:甲醇的梯度洗脱,得到53%收率(93mg)的167g。向配有磁力搅拌器的25ml圆底烧瓶加入167g(93mg,0.17mmol)、氢氧化锂(35mg,0.8mmol)、thf(0.8ml)、异丙醇(0.8ml)和水(1.7ml)。在rt下搅拌混合物1h。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:乙醚:甲醇的梯度洗脱,得到76%收率(23mg)的167。ms(esi+)m/z511.8(m+h)。实施例1682-(2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基)-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮168实施例168a3-(5-(氮杂环丁烷-3-基)-1h-吡唑-3-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮168a在室温下向3-(3-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-1h-吡唑-5-基)氮杂环丁烷-1-羧酸叔丁酯164e(1g,2.36mmol)在二噁烷(10ml)中的溶液中滴加hcl/二噁烷(4m,20ml)。然后在室温下搅拌反应混合物1h。在反应完成后,浓缩得到黄色固体168a,未经纯化用于下一步骤。lcms:(m+h)+325实施例168b5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基)-1h-吡唑-3-基氨基)吡啶-2(1h)-酮168b在0℃下向3-(5-(氮杂环丁烷-3-基)-1h-吡唑-3-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮168a(粗品,2.36mmol)在甲醇(30ml)和乙酸(5ml)中的溶液中加入ch2o(30重量%h2o溶液)(12g,120mmol),然后在0℃下在1h内以小份量加入nabh4(1.8g,47.2mmol)。在反应完成后,用2nnaoh水溶液将混合物调至ph>7。然后用二氯甲烷(60ml×3)萃取,用na2so4干燥,然后浓缩得到黄色固体,在快速柱色谱上进一步纯化,用含有0.5%三乙胺的50:1二氯甲烷/甲醇洗脱,得到黄色固体168b(50%,2步)。实施例168c2-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基)-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯168c按照实施例136e,使168b和2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a反应得到168c,20%收率。按照实施例136,将168c转化成168,54%收率。lcms:(m+h)+554。1hnmr(500mhz,dmso)δ8.05(s,1h),8.01(s,1h),7.45(t,j=8,1h),7.31(m,2h),7.24(d,j=2.5,1h),6.50(s,1h),6.02(s,1h),4.37(m,2h),4.14(m,3h),3.88(m,1h),3.57(s,3h),3.53(m,2h),3.50(m,2h),3.03(m,2h),2.61(m,2h),2.47(m,3h),2.23(s,3h),1.78(m,2h),1.69(m,2h)。实施例1695-[2-(羟甲基)-3-[1-甲基-6-氧代-5-({4h,6h,7h-吡唑并[3,2-c][1,4]噁嗪-2-基}氨基)-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮169实施例169a{2-[1-乙基-6-氧代-5-({4h,6h,7h-吡唑并[3,2-c][1,4]噁嗪-2-基}氨基)1,6-二氢吡啶-3-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯169a将5-溴-3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮110c(500mg,1.54mmol)、(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯111a(750mg,1.56mmol)、pdcl2(dppf)(170mg,0.23mmol)、k3po4(150mg)和乙酸钠(60mg)在mecn(25ml)和水(5ml)中的混合物在回流下加热2h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物,得到169a(369mg,40%)。ms:[m+h]+600。将169a(440mg,0.73mmol)和lioh水合物(308mg,7.3mmol)在异丙醇(20ml)和h2o(4ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到169(104mg,26%)。ms:[m+h]+558。1hnmr(500mhz,cdcl3)δ7.93(s,1h),7.46-7.39(m,3h),7.31-7.24(m,3h),5.73(s,1h),4.78(s,2h),4.61(d,j=11.5,1h),4.42-4.20(m,2h),4.14-3.98(m,4h),3.90-3.82(m,1h),3.69(s,3h),3.04-2.80(m,4h),2.60-2.46(m,2h),1.94-1.82(m,4h)。实施例1705-[2-(羟甲基)-3-[1-甲基-5-({5-[(吗啉-4-基)羰基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮170实施例170a(6-氨基吡啶-3-基)(吗啉代)甲酮170a向吗啉(9.00g,103mmol)在etoh(400ml)中的溶液加入edci(10.0g,52.2mmol)、hobt(7.00g51.8mmol)和6-氨基烟酸(6.00g,43.4mmol)。在搅拌18h后,过滤所得的悬浮液。用meoh(100ml)和二氯甲烷(100ml)的混合物使固体成粉末,得到白色固体170a(2.7g,30%)。lcms:(m+h)+208实施例170b5-溴-1-甲基-3-(5-(吗啉-4-羰基)吡啶-2-基氨基)吡啶-2(1h)-酮170b按照实施例136e,使170a和3,5-二溴-1-甲基吡啶-2(1h)-酮反应得到21%收率的170b。lcms:(m+h)+394。1hnmr(500mhz,meod)δ8.84(d,j=2.5,1h),8.42(d,j=2,1h),7.72(m,1h),7.42(d,j=2,1h),7.11(d,j=8.5,1h),3.72(m,8h),3.63(s,3h)。实施例170c{2-[1-甲基-5-({5-[(吗啉-4-基)羰基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯170c按照实施例136e,使170b和(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯111a反应得到65%收率的170c。lcms:(m+h)+668按照实施例148,将170c转化成170,71%收率。lcms:(m+h)+626。1hnmr(500mhz,dmso)δ8.95(s,1h),8.72(d,j=2,1h),8.25(d,j=2,1h),7.64(dd,j=8.5,1h),7.45(m,2h),7.35(m,3h),4.85(t,j=4,1h),4.35(m,2h),4.03(m,1h),3.88(m,1h),3.59(m,7h),3.49(m,4h),2.98(m,1h),2.85(m,1h),2.77(m,2h),2.54(m,2h),1.79(m,4h)。实施例1712-(2-(羟甲基)-3-(1-甲基-5-(5-(吗啉-4-羰基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮171实施例171a2-(1-甲基-5-(5-(吗啉-4-羰基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯171a按照实施例136d,使5-溴-1-甲基-3-(5-(吗啉-4-羰基)吡啶-2-基氨基)吡啶-2(1h)-酮170a和2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a反应得到27%收率的171a。lcms:(m+h)+651按照实施例170,将171a转化成171,60%收率。lcms:(m+h)+609。1hnmr(500mhz,dmso)δ8.85(d,j=2,1h),8.32(d,j=1.5,1h),7.71(dd,j=8.5,1h),7.53(m,1h),7.43(m,3h),7.35(m,3h),7.11(d,j=8,1h),6.72(s,1h),4.56(m,2h),4.21(s,3h),4.03(m,1h),3.71(m,11h),2.65(m,2h),2.55(m,2h),1.89(m,2h),1.80(m,1h)。实施例1722-(2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮172实施例172a5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)吡啶-2(1h)-酮172a将3-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮155n(469mg,1.4mmol)、37%甲醛水溶液(4g,50mmol)、nabh3cn(261mg,4.2mmol)和1m氯化锌在1,2-二乙氧基乙烷(4ml,4.2mmol)和甲醇(40ml)中的混合物在室温下搅拌2小时。将混合物加入到水(20ml)中,并用二氯甲烷(50ml×3)萃取。在减压下浓缩有机层。通过柱色谱纯化残余物,用10:1二氯甲烷/甲醇洗脱,得到黄色固体172a(0.3g,83%)。ms:[m+h]+348。实施例172b2-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯172b向密封管加入172a(167mg,0.48mmol)、2-(2-(羟甲基)-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮114a(231mg,0.48mmol)、pd(dppf)cl2(39mg,0.048mmol)和na2co3(101mg,0.96mmol)在n,n-二甲基甲酰胺(18ml)中的混合物。对系统抽真空而后再充入n2。在微波辐射下在150℃下加热反应混合物1h。然后,将混合物冷却至室温,并过滤。在减压下浓缩滤液,通过柱色谱纯化所得的残余物,然后用15:1二氯甲烷/甲醇洗脱,得到褐色固体172b(140mg,50%)。ms:[m+h]+606。向172b(150mg,0.25mol)在thf/乙酸异丙酯/h2o(6ml/6ml/2ml)中的溶液中加入lioh(346mg,14mmol)同时在室温下搅拌。搅拌此混合物2h。然后,加入20ml水,并用乙酸乙酯(60ml×3)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体172(50mg,35%)。ms:[m+h]+565。1hnmr(500mhz,dmso)δ8.66(s,1h),8.54(s,1h),8.10(s,1h),7.65(d,j=8,1h),7.46(m,1h),7.31(m,4h),6.51(s,1h),4.84(s,1h),4.33(m,2h),4.13(m,3h),3.85(m,1h),3.59(s,3h),3.53(m,2h),3.35(m,1h),3.02(m,2h),2.60(m,2h),2.46(m,2h),2.23(s,3h),1.77(m,4h)。实施例17310-[2-(羟甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮173实施例173a10-[2-(乙酰氧基甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮173a在配有磁力搅拌棒的10-ml玻璃容器中,将1-甲基-3-[5-(4-甲基哌嗪-1-基)吡啶-2-基氨基]-5-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-1h-吡啶-2-酮197e(210mg,0.49mmol)、10-[2-(乙酰氧基甲基)-3-溴苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮167f(143mg,0.33mmol)、pd(pph3)4(30mg,0.0.26mmol)加入2nna2co3(2ml)和1,2-二甲氧基乙烷(5ml)中。用塞子密封容器,并置于微波腔中。在125℃下搅拌反应混合物7min后,通过快速色谱法纯化(二氯甲烷:甲醇,85:15)得到26%(50mg)的固体173a。向配有磁力搅拌棒的100-ml单颈圆底烧瓶加入173a(50mg,0.077mmol)、lioh·h2o(20mg,0.83mmol)、thf(2ml)、异丙醇(2ml)和水(2ml)。在室温下搅拌反应混合物3h后,在二氯甲烷(5ml)和水(5ml)之间分配,并用二氯甲烷(3x5ml)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)中。向此溶液加入己烷(10ml),然后过滤所得的沉淀得到75%收率(35mg)的173。ms(esi+)m/z608.4(m+h)。实施例1742-(2-(羟甲基)-3-(4-甲基-5-氧代-6-(1,2,3,4-四氢异喹啉-6-基氨基)-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮174实施例174a6-(6-(2-(乙酰氧基甲基)-3-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苯基)-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯174a向配有搅拌棒的微波用管加入6-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯120a(300mg,0.689mmol)、114a(352mg,0.758mmol)、pd(pph3)4(39.8mg,0.0345mmol)、na2co3水溶液(1.0n,2.27ml,2.27mmol)、1,2-二甲氧基乙烷(3.5ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到174a。向配有搅拌棒的圆底烧瓶加入174a和二氯甲烷(50ml)。将溶液在冰水浴中冷却至0℃。加入tfa(1ml),并过夜搅拌所得的溶液。在真空中除去所有的挥发物,然后向瓶中加入thf(10ml)、异丙醇(10ml)、水(10ml)、lioh一水合物(1.00g)。在rt下搅拌所得的混合物1hr。在真空中除去溶剂,然后将所得的残余物加入到二氯甲烷(200ml)中,用水(330ml)、盐水(30ml)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=10:90)得到28mg黄色固体174。ms(esi+)m/z551.4(m+h)。实施例17510-[2-(羟甲基)-3-(1-甲基-6-氧代-5-{4h,6h,7h-吡唑并[3,2-c][1,4]噁嗪-2-基氨基}-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮175实施例175a3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮175a向配有磁力搅拌器的密封管加入5-溴-3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮(110c)(250mg,0.77mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(290mg,1.2mmol)、乙酸钾(230mg,2.3mmol)和1,4-二噁烷(5.5ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)与ch2cl2的络合物(pdcl2dppf:ch2cl2(1:1),63mg,0.08mmol),并在105℃下搅拌反应90min。此后,将混合物冷却至环境温度,在水(20ml)和乙酸乙酯(20ml)之间分配。用乙酸乙酯(2x10ml)萃取分离的水层。用盐水(30ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。所得的粗品175a未经进一步纯化用于下一步骤。实施例175b10-[2-(乙酰氧基甲基)-3-(1-甲基-6-氧代-5-{4h,6h,7h-吡唑并[3,2-c][1,4]噁嗪-2-基氨基}-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮175b向配有磁力搅拌器的微波用管加入175a(120mg,0.31mmol)、167f(130mg,0.3mmol)、1,2-二甲氧基乙烷(4ml)和1m碳酸钠水溶液(1ml)。在持续15min鼓吹n2后,加入pd(pph3)4(18mg,0.02mmol)。将混合物在微波中在130℃下加热10min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。用ch2cl2–60:35:5ch2cl2:乙醚:甲醇的梯度洗脱通过柱色谱纯化所得的残余物得到74%收率(140mg)的175b向配有磁力搅拌器的25ml圆底烧瓶加入175b(140mg,0.23mmol)、氢氧化锂(49mg,1.2mmol)、thf(1.2ml)、i-proh(1.2ml)和水(2.4ml)。在rt下搅拌混合物90min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5ch2cl2:乙醚:甲醇的梯度洗脱,得到79%收率(100mg)的175。ms(esi+)m/z555.3(m+h)。实施例1762-(2-(羟甲基)-3-(5-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮176实施例176a5-(甲氧基甲基)-1-甲基-3-硝基-1h-吡唑176a向配有磁力搅拌器和回流冷凝管的250-ml单颈圆底烧瓶加入ch3oh(50ml)、5-(溴甲基)-1-甲基-3-硝基-1h-吡唑156d(8.8g,40mmol)和ch3ona(4.3g,80mmol)。在回流下加热反应混合物2h。此后将反应冷却至室温,然后浓缩。使残余物在乙酸乙酯(60ml)和水(60ml)之间分配。分离水层,并用乙酸乙酯(50ml×2)萃取。合并有机层,用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液得到黄色油状物176a(6.1g,90%)。lcms:[m+h]+172。实施例176b5-(甲氧基甲基)-1-甲基-1h-吡唑-3-胺176b向配有磁力搅拌器的250-ml单颈圆底烧瓶加入176a(4g,23mmol)、pd/c(1g)和c2h5oh(100ml)。在室温下将混合物氢化15h。然后过滤,并在减压下浓缩滤液得到黄色油状物176b(3.3g,99%),未经进一步纯化用于下一步骤。ms:[m+h]+142。实施例176c5-溴-3-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮176c按照实施例148a,使1.7g的176b和3.2g的3,5-二溴-1-甲基吡啶-2(1h)-酮反应得到黄色固体176c(2.8g,70%)。ms:[m+h]+327。1hnmr(500mhz,cdcl3)δ7.86(d,j=2.5,1h),7.38(s,1h),6.88(d,j=2.5,1h),5.86(s,1h),4.41(s,2h),3.82(s,3h),3.58(s,3h),3.36(s,3h)。实施例176d2-(5-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯176d按照实施例148b,使557mg的2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a和327mg的5-溴-3-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮176c反应得到黄色固体176d(420mg,72%)。lcms:[m+h]+585按照实施例148,将240mg的176d转化成白色固体176(133mg,60%)。lcms:[m+h]+542。1hnmr(500mhz,cdcl3)δ7.91(d,j=2,1h),7.43(m,3h),7.30(d,j=2,1h),7.23(s,1h),6.85(s,1h),5.96(s,1h),4.60(d,j=6,1h),4.40(m,3h),4.16(m,3h),3.94(m,1h),3.76(s,3h),3.69(s,3h),3.34(s,3h),2.60(m,4h),1.89(m,2h),1.78(m,2h)。实施例1775-[2-(羟甲基)-3-(5-{[5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮177实施例177a[2-(5-{[5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯177a按照实施例176d,使327mg的5-溴-3-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮176b与481mg的111a反应得到黄色固体177a(420mg,70%)。lcms:[m+h]+602按照实施例176,将240mg的177a转化成白色固体177(112mg,50%)。lcms:[m+h]+560。1hnmr(500mhz,cdcl3)δ7.90(s,1h),7.44-7.38(m,3h),7.30-7.24(m,2h),5.94(s,1h),4.62(d,j=11.5,1h),4.37(m,3h),4.26(d,j=10.5,1h),4.05(m,1h),3.87(m,1h),3.75(s,3h),3.68(s,3h),3.34(s,3h),2.85(m,4h),2.54(s,2h),1.89(s,5h)。实施例1782-(5-氟-2-(羟甲基)-3-(5-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮178实施例178a4-氟-2-(5-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯178a向密封管中加入4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(230mg,0.48mmol)、5-溴-3-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮176c(156mg,0.48mmol)、pd(dppf)cl2(39mg,0.048mmol)、na2co3(101mg,0.96mmol)在dmf(18ml)中的混合物。对系统抽真空而后再充入n2。在110℃下加热反应混合物2h。然后,将混合物冷却至室温并过滤。在减压下浓缩滤液,然后通过柱色谱纯化所得的残余物用15:1二氯甲烷/甲醇洗脱,得到褐色固体178a(160mg,53%)。ms:[m+h]+603。向178a(160mg,0.27mol)在thf/ipa/h2o(6ml/6ml/2ml)中的溶液中加入lioh(346mg,14mmol)同时在室温下搅拌。搅拌此混合物2h。然后加入20ml水,并用乙酸乙酯(60ml×3)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体178(60mg,40%)。lcms:[m+h]+561。1hnmr(500mhz,dmso)δ8.16(s,1h),7.99(m,1h),7.32(m,2h),7.18(m,1h),6.52(s,1h),6.11(s,1h),4.89(m,1h),4.38(m,2h),4.31(m,2h),4.17(m,3h),3.90(m,1h),3.64(s,3h),3.57(s,3h),3.26(s,3h),2.63(m,2h),2.51(m,2h),1.70(m,4h)。实施例1795-[2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮179实施例179a[2-(1-甲基-5-{[5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯179a按照实施例176d,使5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)吡啶-2(1h)-酮172a和(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯111a反应得到55%收率的179a。lcms:(m+h)+624按照实施例176,将179a转化成179,42%收率。lcms:(m+h)+582。1hnmr(500mhz,meod)δ8.73(s,1h),8.17(s,1h),7.74(m,1h),7.51(m,1h),7.40(m,3h),7.10(d,j=3.5,1h),4.55(m,2h),4.31(m,2h),4.13(m,1h),4.06(s,3h),3.99(m,1h),3.71(s,3h),3.05(m,1h),2.94(m,6h),2.59(m,2h),1.89(m,4h)。实施例1806-[2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-2-甲基-4-[(5-{[甲基(丙烷-2-基)氨基]甲基}吡啶-2-基)氨基]-2,3-二氢哒嗪-3-酮180实施例180a6-(6-氯-2-甲基-3-氧代-2,3-二氢哒嗪-4-基氨基)烟酸甲酯180a按照实施例186b,使4-溴-6-氯-2-甲基哒嗪-3(2h)-酮103e(4.0g,17.9mmol)、186a(2.7g,17.9mmol)、碳酸铯(12.8g,39.4mmol)和xantphos(880mg,8.5mol%)、二噁烷(120ml)和三(二亚苄基丙酮)二钯(0)(820mg,5mol%)反应得到180a(3.0g,57%收率)。实施例180b6-氯-4-(5-(羟甲基)吡啶-2-基氨基)-2-甲基哒嗪-3(2h)-酮180b按照实施例186c,使180a(3.0g,10.2mmol)、二氯甲烷(100ml)和1.0mdibal-h在二氯甲烷(30.5ml,30.5mmol)中反应得到180b(2.3g,86%收率)。实施例180c(6-(6-氯-2-甲基-3-氧代-2,3-二氢哒嗪-4-基氨基)吡啶-3-基)甲基甲磺酸酯180c在0℃下在二氯甲烷中用二异丙基乙胺和甲磺酰氯处理中间体180b得到180c。实施例180d6-氯-4-(5-((异丙基(甲基)氨基)甲基)吡啶-2-基氨基)-2-甲基哒嗪-3(2h)-酮180d按照实施例186c,使180c和甲基异丙基胺反应得到180d。实施例180e2-(5-(5-((异丙基(甲基)氨基)甲基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯180e按照实施例179a,使180d(125mg,0.39mmol)、114a(215mg,0.47mmol)、1nna2co3(0.86ml)和四(三苯基膦)钯(0)(23mg,5mol%)反应得到180e(150mg,61%收率)。按照实施例179,使180e(150mg,0.24mmol)、1nlioh(1.2ml)、thf(2ml)和异丙醇(2ml)反应,然后通过柱色谱(硅胶,甲醇/二氯甲烷)纯化混合物得到180(105mg,75%收率)。ms(esi+)m/z582.5(m+h)。实施例1815-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮181实施例181a5-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(乙酰氧基甲基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮181a向配有搅拌棒的微波用管中加入5-溴-3-(5-(4-乙基-哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮138c(250mg,0.637mmol)、硼酸酯111a(308mg,0.701mmol)、pd(pph3)4(36.8mg,0.0319mmol)、na2co3水溶液(1.0n,2.10ml,2.10mmol)、1,2-二甲氧基乙烷(3.0ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),并用水(3x30ml)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到181a。向配有搅拌棒的圆底烧瓶中加入181a、thf(5ml)、异丙醇(5ml)、水(5ml)、lioh一水合物(300mg)。在rt下搅拌所得的混合物1hr。在真空中除去所有的溶剂,然后将所得的残余物加入到二氯甲烷(200ml)中,用水(30mlx3)、盐水(30mlx1)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=10:90)得到砖红色固体181,101mg,ms(esi+)m/z625.4(m+h)。实施例1825-(3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-5-氟-2-(羟甲基)苯基)-1-甲基-3-(嘧啶-4-基氨基)吡啶-2(1h)-酮182实施例182a叔丁基(2,6-二溴-4-氟苄氧基)二甲基甲硅烷182a用氮气吹扫配有磁力搅拌器的250-ml单颈圆底烧瓶,并加入197b(5.00g,17.6mmol)、咪唑(6.00g,88.0mmol)和二氯甲烷(125ml)。加入叔丁基二甲基甲硅烷基氯(7.96g,52.8mmol),并在室温下搅拌反应混合物16h。此后,用水(100ml)和二氯甲烷(100ml)稀释反应。分离各层,并用二氯甲烷(100ml)萃取水相。合并有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下蒸发溶剂。通过快速色谱法纯化所得的残余物得到96%收率(6.75g)的无色油状物182a:1hnmr(500mhz,cdcl3)7.30(d,2h,j=8.0hz),4.93(s,2h),0.93(s,9h),0.15(s,6h)。实施例182b2-(3-溴-2-((叔丁基二甲基甲硅烷基氧基)甲基)-5-氟苯基)-6-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-酮182b向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶加入105h(400mg,1.81mmol)、182a(1.44g,3.62mmol)、碳酸铯(1.18g,3.62mmol)、n,n’-二甲基乙二胺(159mg,1.81mmol)和1,4-二噁烷(15ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入碘化亚铜(174mg,0.905mmol)。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物16h。此后,将混合物冷却至室温并过滤。用乙酸乙酯(100ml)和水(50ml)稀释滤液,然后分离各层。用乙酸乙酯(2×30ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物得到57%收率(554mg)的白色固体182b:mp38–39℃;1hnmr(500mhz,cdcl3)δ7.32(dd,1h,j=8.0,2.5hz),7.00(dd,1h,j=8.0,2.5hz),4.74(s,2h),3.93(m,2h),2.98(m,1h),2.80(m,1h),2.77(s,2h),2.52(s,2h),1.28(s,3h),1.27(s,3h),0.89(s,9h),0.11(s,6h)。实施例182c2-((叔丁基二甲基甲硅烷基氧基)甲基)-5-氟苯基-6-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基-酮182c向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶加入182b(554mg,1.03mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(785mg,3.09mmol)、乙酸钾(404mg,4.12mmol)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入pd(dppf)cl2·ch2cl2(75mg,0.103mmol)。将回流冷凝管连接到烧瓶,并在回流下加热反应混合物8h。此后,用乙酸乙酯(100ml)和水(75ml)稀释混合物,然后分离各层。用乙酸乙酯(2x50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物得到91%收率(600mg)的白色固体182c:mp41–42℃;1hnmr(500mhz,cdcl3)δ7.52(dd,1h,j=8.0,2.5hz),7.02(dd,1h,j=8.0,2.5hz),5.14(d,1h,j=10.5hz),5.70(d,1h,j=10.5hz),3.93(m,2h),2.98(m,1h),2.80(m,1h),2.77(s,2h),2.52(s,2h),1.34(s,3h),1.33(s,3h),1.26(s,12h),0.84(s,9h),0.04(s,6h)。用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入182c(300mg,0.513mmol)、109b(111mg,0.394mmol)、碳酸钠(125mg,1.18mmol)、1,4-二噁烷(8ml)和水(2ml)。用氮气对此混合物脱气30min。加入四(三苯基膦)钯(0)(46mg,0.039mmol)。在回流下加热2h后,将反应混合物冷却至室温,然后在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2x50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于thf(3ml)中,加入三水合四丁基氟化铵(372mg,1.18mmol)。在室温下搅拌后2h,使反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到41%收率(88mg)的灰白色固体182:mp>250℃;1hnmr(500mhz,dmso-d6)δ9.22(s,1h),8.72(d,1h,j=2.0hz),8.65(s,1h),8.29(d,1h,j=6.0hz),7.57(d,1h,j=2.0hz),7.34(dd,1h,j=8.5,3.0hz),7.31(d,1h,j=6.0hz),7.29(dd,1h,j=8.5,3.0hz),4.87(m,1h),4.31(m,2h),4.04(m,1h),3.84(m,1h),3.60(s,3h),3.03(m,1h),2.89(m,1h),2.75(s,2h),2.53(m,2h),1.23(s,6h);ms(esi+)m/z546.2(m+h)。实施例1835-(3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-2-(羟甲基)苯基)-1-甲基-3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-3-基氨基)吡啶-2(1h)-酮183按照实施例184,使131a(300mg,0.606mmol)和110c(151mg,0.466mmol)反应得到51%收率(129mg)的灰白色固体183:mp167–168℃;1hnmr(500mhz,dmso-d6)δ8.18(s,1h),7.95(d,1h,j=2.0hz),7.44(t,1h,j=8.0hz),7.33(dd,1h,j=8.0,1.0hz),7.29(dd,1h,j=8.0,1.0hz),7.23(d,1h,j=2.0hz),5.92(s,1h),4.81(m,1h),4.71(s,2h),4.36(m,2h),4.01(m,3h),3.94(m,2h),3.85(m,1h),3.57(s,3h),3.02(m,1h),2.86(m,1h),2.75(m,2h),2.53(m,2h),1.23(s,6h);ms(esi+)m/z572.3(m+h)。实施例1845-(3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-2-(羟甲基)苯基)-1-甲基-3-(吡啶-2-基氨基)吡啶-2(1h)-酮184实施例184a5-溴-1-甲基-3-(吡啶-2-基氨基)吡啶-2(1h)-酮184a向配有磁力搅拌器、氮气入口和回流冷凝管的100-ml单颈圆底烧瓶加入3,5-二溴-1-甲基吡啶-2(1h)-酮(936mg,3.51mmol)、2-氨基吡啶(300mg,3.19mmol)、碳酸铯(3.11g,9.57mmol)和1,4-二噁烷(20ml)。在持续20分钟使氮气鼓泡经过所得的溶液后,加入xantphos(184mg,0.319mmol)和三(二亚苄基丙酮)二钯(0)(146mg,0.160mmol),并在100℃下加热反应混合物3h。此后,将反应冷却至室温,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到42%收率(376mg)的灰白色固体184a:mp153–154℃;1hnmr(300mhz,dmso-d6)8.75(s,1h),8.69(d,1h,j=2.4hz),8.26(dd,1h,j=5.4,1.5hz),7.61(m,1h),7.54(d,1h,j=2.4hz),7.33(d,1h,j=5.4hz),6.86(m,1h),3.45(s,3h)。用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入131a(300mg,0.606mmol)、184a(131mg,0.466mmol)、碳酸钠(148mg,1.40mmol)、1,4-二噁烷(8ml)和水(2ml)。用氮气对此混合物脱气30min。加入四(三苯基膦)钯(54mg,0.047mmol)。在100℃下加热3h后,将反应混合物冷却至室温,然后在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于甲醇(5ml)中,加入碳酸钾(500mg,3.62mmol)。在室温下搅拌2h后,使反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到49%收率(118mg)的白色固体184:mp150–151℃;1hnmr(500mhz,dmso-d6)δ8.66(d,1h,j=2.0hz),8.57(m,1h),8.16(dd,1h,j=5.0,1.0hz),7.57(m,1h),7.45(t,1h,j=8.0hz),7.38(d,1h,j=2.0hz),7.36–7.31(m,2h),7.28(d,1h,j=8.0hz),6.78(dd,1h,j=11.0,5.0hz),4.82(m,1h),4.35(m,2h),4.02(m,1h),3.86(m,1h),3.59(s,3h),3.01(m,1h),2.87(m,1h),2.75(s,2h),2.53(m,2h),1.23(s,6h);ms(esi+)m/z527.2(m+h)。实施例1855-(3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-2-(羟甲基)苯基)-1-甲基-3-(1,5-二甲基-1h-吡唑-4-基氨基)吡啶-2(1h)-酮185利用与对184的制备所述相同的通用方法,使131a(300mg,0.606mmol)与142a(138mg,0.466mmol)反应得到41%收率(104mg)的185,为黄色固体:mp164–165℃;1hnmr(500mhz,dmso-d6)δ7.93–7.92(m,2h),7.44(t,1h,j=7.5hz),7.33(dd,1h,j=7.5,1.0hz),7.29(dd,1h,j=7.5,1.0hz),7.21(d,1h,j=2.0hz),5.88(s,1h),4.83(m,1h),4.36(m,2h),4.02(m,1h),3.87(m,1h),3.57(s,3h),3.56(s,3h),3.03(m,1h),2.86(m,1h),2.75(m,2h),2.53(m,2h),2.17(s,3h),1.23(s,6h);ms(esi+)m/z544.2(m+h)。实施例1862-(2-(羟甲基)-3-(5-(5-((异丙基(甲基)氨基)甲基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮186实施例186a6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)烟酸甲酯186a向300ml密封管中加入3,5-二溴-1-甲基吡啶-2(1h)-酮(4.0g,15.0mmol)、6-氨基烟酸甲酯(2.3g,15.0mmol)、碳酸铯(10.7g,33mmol)和xantphos(740mg,8.5mol%)。对烧瓶抽真空并充入氮气3x。加入二噁烷(100ml),并通过鼓吹氮气对混合物脱气25min。然后加入三(二亚苄基丙酮)二钯(0)(690mg,5mol%),将容器密封,然后在120℃下过夜加热反应。使反应冷却,并用乙酸乙酯(500ml)和饱和nahco3溶液(150ml)稀释,分离各层,并用乙酸乙酯萃取2x。用盐水洗涤有机相3x,用na2so4干燥,过滤,然后在减压下浓缩。通过色谱纯化残余物(isco80g硅胶,乙酸乙酯/己烷)得到186a。实施例186b5-溴-3-(5-(羟甲基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮186b。在烧瓶中,在n2下使186a(500mg,1.5mmol)悬浮于二氯甲烷中,并在干冰/丙酮浴中冷却至-78℃。通过注射器缓慢加入1.0mdibal-h/二氯甲烷(4.4ml,4.4mmol)。在加料完成后,使反应升温至-20℃,此时用冰/水浴替换干冰/丙酮浴,再搅拌反应0.5hr,此时用1nhcl(~5ml)缓慢终止反应。然后用乙酸乙酯稀释反应,搅拌,并在~1hr内升温至室温。用1nnaoh将ph调至~7,加入50ml罗谢尔盐饱和水溶液,加热混合物并在40℃下搅拌1hr在此期间混合物澄清。分离各层,用盐水洗涤有机相,用na2so4干燥,过滤,然后浓缩得到白色固体186b(420mg,90%收率)。实施例186d5-溴-3-(5-((异丙基(甲基)氨基)甲基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮186d在烧瓶中,在n2下使186b(350mg,1.13mmol)悬浮于二氯甲烷(20ml)中,然后加入二异丙基乙胺(0.89ml,5.09mmol),并在冰/水浴中使反应冷却至0℃。加入甲磺酰氯(518mg,0.35ml,4.52mmol),使反应升温至室温并搅拌~1hr。用二氯甲烷稀释反应并加入饱和碳酸氢钠水溶液。分离各层,再用碳酸氢钠洗涤有机相,然后用无水硫酸镁干燥,过滤,然后浓缩得到甲磺酸酯186c,直接用于制备186d,将186c溶于dmf(10ml)中并将溶液转移至耐压烧瓶中,然后加入n-甲基丙烷-2-胺(1.2ml,830mg,11.3mmol),将烧瓶密封,并在80℃下过夜加热。将反应冷却,然后用乙酸乙酯和水稀释,分离各层。用盐水洗涤有机相4x,用na2so4干燥,过滤,然后浓缩得到186d。实施例186f2-(5-(5-((异丙基(甲基)氨基)甲基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯186f步骤1:向耐压烧瓶中加入186d(205mg,0.56mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(213mg,0.84mmol)、乙酸钾(220mg,2.24mmol)和1,1'-双(二苯基膦)二茂铁二氯化钯(ii)二氯甲烷络合物(817mg,0.1mol%)。对烧瓶抽真空并充入n23x,加入二噁烷(5ml),将容器密封,然后在90℃下加热~3hr。使反应冷却,然后用乙酸乙酯稀释,通过celite垫过滤,而后在减压下浓缩得到186e,直接用于下一步骤。步骤2:将186e溶于dme(5ml)中并转移到含有109a(187mg,0.45mmol)、1nna2co3(1.2ml)和四(三苯基膦)钯(0)(32mg,5mol%)的耐压烧瓶中。将烧瓶密封,并在100℃下过夜加热。然后用乙酸乙酯和水稀释反应,分离,用盐水洗涤,用na2so4干燥,过滤,然后在减压下浓缩。通过色谱纯化残余物(isco12g硅胶,用甲醇和ch2cl2洗脱)得到186f(110mg,2步总收率32%)。按照实施例119,使186f(110mg,0.18mmol)、1nlioh(0.88ml)、thf(2ml)和异丙醇(2ml)反应,然后通过柱色谱(isco12g硅胶,甲醇/二氯甲烷)纯化得到186(80mg,77%收率)。ms(esi+)m/z581.4(m+h)。实施例1872-(2-(羟甲基)-3-(5-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮187实施例187a6-氯-4-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-2-甲基哒嗪-3(2h)-酮187a将5-(甲氧基甲基)-1-甲基-1h-吡唑-3-胺176b(600mg,4.26mmol)、xantphos(300mg,0.51mmol)、pd2dba3(310mg,0.34mmol)、4-溴-6-氯-2-甲基哒嗪-3(2h)-酮(103e)(1.22g,5.53mmol)和cs2co3(4.2g,12.8mmol)在1,4-二噁烷(40ml)中的混合物在回流下加热2h。在反应完成后,过滤混合物,然后用甲醇(100ml)洗涤。在真空中蒸发滤液,然后在反相combi快速色谱上纯化残余物得到187a(1.13g,94%)。ms:[m+h]+284。实施例187b2-(5-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢哒嗪-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯187b将6-氯-4-(5-(甲氧基甲基)-1-甲基-1h-吡唑-3-基氨基)-2-甲基哒嗪-3(2h)-酮187a(300mg,1.06mmol)、2-(乙酰氧基甲基)-3-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苯基硼酸114a(500mg,1.3mmol)、pdcl2(dppf)(116mg,0.16mmol)、k3po4(100mg)和naoac(50mg)在mecn(15ml)和水(3ml)中的混合物在回流下加热2h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到187b(310mg,50%)。ms:[m+h]+586。将187b(310mg,0.53mmol)和lioh水合物(222mg,5.3mmol)在异丙醇(20ml)和水(4ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到187(103mg,36%)。ms:[m+h]+544。1hnmr(500mhz,dmso)δ9.25(s,1h),7.89(s,1h),7.50-7.47(m,1h),7.42-7.38(m,2h),6.51(s,1h),6.22(s,1h),4.63-4.60(m,1h),4.48-4.45(m,1h),4.40-4.35(m,3h),4.20-4.05(m,3h),3.90-3.86(m,1h),3.75(s,3h),3.67(s,3h),3.26(s,3h),2.65-2.54(m,2h),2.48-2.42(m,2h),1.84-1.74(m,2h),1.74-1.64(m,2h)。实施例1882-(2-(羟甲基)-3-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮188实施例188a4-(6-硝基吡啶-3-基)哌嗪-1-羧酸叔丁酯188a向5-溴-2-硝基吡啶(30g,148mmol)在dmso(1l)中的溶液中加入k2co3(40g,296mmol)和哌嗪-1-羧酸叔丁酯(28g,148mmol)。在65℃下过夜搅拌混合物。冷却后,将其倒入水(2l)中。收集沉淀析出的固体,然后在真空下干燥。而后用20:1石油醚/乙酸乙酯其后用二氯甲烷洗脱通过快速柱色谱进一步纯化得到黄色固体188a(17g,37%)。ms:[m+h]+309。实施例188b4-(6-氨基吡啶-3-基)哌嗪-1-羧酸叔丁酯188b用氮气吹扫500-ml瓶,并加入188a(3.1g,10mmol)、10%钯/碳(50%湿度,1.0g)和乙醇(100ml)。对其抽真空,充入氢气,并在室温下搅拌16h。然后抽除氢气并将氮气充入瓶中。通过celite垫过滤除去催化剂,然后在减压下浓缩滤液得到188b(2.7g,97%)。ms:[m+h]+279实施例188c4-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)哌嗪-1-羧酸叔丁酯188c向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中加入1,4-二噁烷(50ml)、188b(1.3g,4.7mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.24g,4.7mmol)和碳酸铯(3.8g,12mmol)。在持续30分钟使氮气鼓泡经过所得的混合物后,加入xantphos(272mg,0.47mmol)和三(二亚苄基丙酮)二钯(0)(430mg,0.47mmol),并在回流下加热反应混合物3h。此后使反应冷却至室温,在乙酸乙酯(100ml)和水(100ml)之间分配,然后过滤。分离水层,并用乙酸乙酯(50ml×2)萃取。合并有机层,用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过快速柱色谱纯化残余物,用50:1二氯甲烷/甲醇洗脱,得到188c(1.3g,59%)。ms:[m+h]+464。实施例188d5-溴-1-甲基-3-(5-(哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮188d将188c(3.6g,7.8mmol)和4.0mhcl/二噁烷(10ml)的混合物在室温下搅拌5h。然后在减压下浓缩。用1.0mnaoh水溶液碱化残余物,然后用二氯甲烷萃取。用水洗涤合并的有机层,然后在减压下浓缩得到188d(2.46g,87%)。ms:[m+h]+364。实施例188e5-溴-1-甲基-3-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮188e将188d(2.75g,7.5mmol)、氧杂环丁烷-3-酮(1.6g,22.7mmol)、nabh3cn(4.75g,22.5mmol)和氯化锌(3g,22.7mmol)在甲醇(125ml)中的混合物在50℃下搅拌5小时。将混合物加入到水中并用二氯甲烷萃取3次。在减压下浓缩有机层。通过柱色谱纯化残余物,用25:1二氯甲烷/甲醇洗脱,得到188e(1.92g,61%)。ms:[m+h]+420。1hnmr(500mhz,dmso)δ8.58(d,j=2.5,1h),8.55(s,1h),7.94(d,j=3,1h),7.54(d,j=2.5,1h),7.39(dd,j=3,1h),7.25(d,j=4,1h),4.56(t,j=6.5,2h),4.46(t,j=6.5,2h),3.50(s,3h),3.43(m,1h),3.01(m,4h),2.40(m,4h)。实施例188f2-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯188f按照实施例148b,使464mg的2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a和420mg的188e反应得到黄色固体188f(360mg,54%)。lcms:[m+h]+678按照实施例148,将270mg的188f转化成白色固体188(144mg,54%)。lcms:[m+h]+635。1hnmr(500mhz,cdcl3)δ:8.55(d,j=2.5,1h),7.89(d,j=3,1h),7.80(s,1h),7.47-7.41(m,3h),7.26-7.21(m,2h),6.85(s,1h),6.83(d,j=8.5,1h),4.72-4.65(m,3h),4.59(d,j=10.5,1h),4.43-4.36(m,2h),4.20-4.13(m,3h),3.93-3.89(m,1h),3.59-3.57(m,1h),3.15(s,3h),3.05(m,1h),2.6-2.51(m,7h),1.89(s,2h),1.78(s,2h)。实施例18910-[5-氟-2-(羟甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮189实施例189a2-溴-4-氟-6-(9-氧代-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基)苄基乙酸酯189a在配有磁力搅拌器的密封管中将167e(740mg,3.6mmol)、2,6-二溴-4-氟苄基乙酸酯197c(2.4g,7.2mmol)和碳酸铯(2.6g,7.9mmol)加入1,4-二噁烷(36ml)中。在持续30min使氮气鼓泡经过溶液后,加入xantphos(250mg,0.43mmol)和三(二亚苄基丙酮)二钯(0)(260mg,0.29mmol),并在100℃下加热反应混合物16h。此后,加入h2o(50ml)和乙酸乙酯(50ml)。分离水层,并用乙酸乙酯(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过柱色谱纯化所得的残余物,用100%己烷–100%乙酸乙酯的梯度洗脱,得到56%收率(910mg)的189a。实施例189b10-[5-氟-2-(乙酰氧基甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮189b向配有磁力搅拌器的微波用管加入1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮109c(170mg,0.5mmol)、189a(150mg,0.33mmol)、1,2-二甲氧基乙烷(4ml)和1m碳酸钠水溶液(1ml)。在持续15min鼓吹n2后,加入pd(pph3)4(19mg,0.02mmol)。将混合物在微波中在130℃下加热10min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用ch2cl2–60:35:5二氯甲烷:乙醚:甲醇的梯度洗脱,得到37%收率(71mg)的189b。向配有磁力搅拌器的25ml圆底烧瓶中加入189b(71mg,0.12mmol)、氢氧化锂(26mg,0.6mmol)、thf(0.6ml)、异丙醇(0.6ml)和水(1.2ml)。在rt下搅拌混合物1h。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5ch2cl2:乙醚:甲醇的梯度洗脱通,得到58%收率(38mg)的189。ms(esi+)m/z529.7(m+h)。实施例19010-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮190实施例190a3-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮190a向配有搅拌棒的圆底烧瓶中加入5-溴-3-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮138c(305.6mg,0.696mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(185.4,g,0.730mmol)、pd2(dba)3(63.7mg,0.070mmol)、x-phos(66.3mg,0.139mmol)、koac(102.4mg,1.043mmol)和二噁烷(5ml)。在90℃下加热混合物4hr。通过硅藻土过滤所得的混合物,用乙酸乙酯(200ml)洗涤。用水(50ml)洗涤有机相,用mgso4干燥,然后在真空中除去溶剂得到粗产物190a,直接用于下一步骤。实施例190b10-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(乙酰氧基甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮190b向配有搅拌棒的微波用管中加入溴化物167f(150mg,0.348mmol)、190a(306mg,0.696mmol)、pd(pph3)4(40.2mg,0.0348mmol)、na2co3水溶液(1.0n,1.15ml,1.15mmol)、dme(4ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),并用水(3x30ml)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到190b。向配有搅拌棒的圆底烧瓶加入190b、thf(3ml)、异丙醇(3ml)、水(3ml)、lioh一水合物(200mg)。在rt下搅拌所得的混合物1hr。在真空中除去所有的溶剂,然后将所得的残余物加入到二氯甲烷(200ml)中,用水(3x30ml)、盐水(30ml)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:二氯甲烷=10:90)得到黄色固体190,16mg。ms(esi+)m/z622.5(m+h)。实施例19110-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮191实施例191a10-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮191a向配有磁力搅拌器的微波用管中加入3-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮150a(200mg,0.5mmol)、189a(150mg,0.34mmol)、1,2-二甲氧基乙烷(4ml)和1m碳酸钠水溶液(1ml)。在持续15min鼓吹n2后,加入pd(pph3)4(19mg,0.02mmol)。将混合物在微波中在130℃下加热10min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5ch2cl2:乙醚:甲醇的梯度洗脱,得到59%收率(125mg)的191a。向配有磁力搅拌器的25ml圆底烧瓶中加入191a(130mg,0.2mmol)、氢氧化锂(43mg,1.0mmol)、thf(1ml)、异丙醇(1ml)和水(2ml)。在rt下搅拌混合物30min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物用二氯甲烷–60:35:5ch2cl2:乙醚:甲醇的梯度洗脱,得到59%收率(68mg)的191。ms(esi+)m/z573.4(m+h)。实施例1926-(3-(5-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-2,3-(5,5-二甲基-5,6-二氢-4h-环戊二烯)-5,6-二氢噻吩并[2,3-c]吡啶-7(4h)-酮192向配有磁力搅拌器和回流冷凝管的100-ml三颈圆底烧瓶中加入182c(300mg,0.513mmol)、110c(167mg,0.513mmol)、碳酸钠(218mg,2.05mmol)、水(6ml)和1,4-二噁烷(30ml)。在持续20min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(60.0mg,0.051mmol),然后在100℃下加热反应混合物4h。此后,使反应混合物冷却至室温,过滤,然后用甲醇和二氯甲烷(30ml)的1:10混合物洗涤滤饼。在减压下浓缩滤液得到褐色残余物。向另一个配有磁力搅拌器和回流冷凝管的50-ml单颈圆底烧瓶中加入由此而得的残余物、四丁基氟化铵(1.0m在thf中,2ml,2.00mmol)和thf(6ml)。在室温下搅拌混合物1.5h。此后,在减压下浓缩反应混合物。通过快速色谱法纯化所得的残余物得到36%(110mg)收率的灰白色固体192:mp170–172℃;1hnmr(500mhz,dmso-d6)δ8.21(s,1h),7.99(d,1h,j=2.0hz),7.32(dd,1h,j=9.0,3.0hz),7.28(d,1h,j=2.0hz),7.15(dd,1h,j=9.0,3.0hz),5.93(s,1h),4.86(t,1h,j=5.0hz)实施例1935-(2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊烷二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基))-1-甲基-3-(吡啶-3-基氨基)吡嗪-2(1h)-酮193按照实施例204,使111b(132mg,0.466mmol)和131a(300mg,0.606mmol)反应得到31%收率(75mg)的灰白色固体193:mp135–136℃;1hnmr(500mhz,dmso-d6)δ9.53(s,1h),9.15(d,1h,j=1.9hz),8.42(m,1h),8.17(dd,1h,j=4.5,1.4hz),7.54(dd,1h,j=7.4,1.0hz),7.47(m,2h),7.34(dd,1h,j=8.0,1.5hz),7.30(m,1h),4.82(m,1h),4.46(m,2h),4.01(m,1h),3.86(m,1h),3.56(s,3h),3.02(m,1h),2.88(m,1h),2.75(s,2h),2.54(d,2h,j=6.0hz),1.23(s,6h);ms(esi+)m/z528.2(m+h)。实施例1945-(2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-1-甲基-3-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮194按照实施例204,使197e(176mg,0.466mmol)和131a(300mg,0.606mmol)反应得到褐色残余物。向配有磁力搅拌器的100-ml单颈圆底烧瓶中加入以上粗品残余物、thf(8ml)、甲醇(4ml)、水(4ml)和一水合氢氧化锂(196mg,4.66mmol)。在室温下搅拌混合物2h,然后在真空中浓缩。使残余物在甲醇/二氯甲烷的20%(v/v)溶液(150ml)和水(30ml)之间分配。分离有机层,并用甲醇/二氯甲烷的20%(v/v)溶液(3×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-10%甲醇/二氯甲烷)得到33%收率(95mg)的灰白色固体194:mp142–143℃;1hnmr(500mhz,dmso-d6)δ8.54(d,1h,j=2.5hz),8.33(s,1h),7.85(d,1h,j=3.0hz),7.45(t,1h,j=7.4hz),7.35(m,2h),7.32(m,2h),7.20(d,1h,j=9.3hz),4.84(m,1h),4.32(m,2h),4.03(m,1h),3.85(m,1h),3.58(s,3h),3.03(m,5h),2.87(m,1h),2.75(s,2h),2.53(m,2h),2.43(m,4h),2.20(s,3h),1.23(s,6h);ms(esi+)m/z625.3(m+h)。实施例1955-[2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并-[1,2-a]吲哚-2-基}苯基]-1-甲基-3-({5-[4-(丙烷-2-基)哌嗪-1-基]吡啶-2-基}氨基)-1,2-二氢吡啶-2-酮195按照实施例138,将5-溴-1-甲基-3-(5-(4-(1-甲基乙基)哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮220a转化成75mg的白色固体195。ms(esi+)m/z622(m+h)。实施例19610-(3-{5-[(1,5-二甲基-1h-吡唑-3-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-5-氟-2-(羟甲基)苯基)-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮196实施例196a3-(1,5-二甲基-1h-吡唑-3-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮196a向配有磁力搅拌器的密封管中加入5-溴-3-(1,5-二甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮142a(380mg,1.4mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(690mg,2.7mmol)、乙酸钾(401mg,4.1mmol)和1,4-二噁烷(34ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)和二氯甲烷的络合物(pdcl2dppf:ch2cl2(1:1),110mg,0.14mmol),并在105℃下搅拌反应16h。此后,将混合物冷却至环境温度,在水(20ml)和乙酸乙酯(20ml)之间分配。用乙酸乙酯(2x10ml)萃取分离的水层。用盐水(30ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。所得的粗品196a未经进一步纯化用于下一步骤。实施例196b10-(3-{5-[(1,5-二甲基-1h-吡唑-3-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-5-氟-2-(乙酰氧基甲基)苯基)-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮196b向配有磁力搅拌器的微波用管中加入196a(450mg,1.3mmol)、189a(240mg,0.5mmol)、dme(4ml)和1m碳酸钠水溶液(1.5ml)。在持续15min鼓吹n2后,加入pd(pph3)4(31mg,0.03mmol)。将混合物在微波中在130℃下加热10min。此后,加入etoac(5ml)和水(5ml)。用etoac(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5二氯甲烷:乙醚:甲醇的梯度洗脱,得到83%收率(260mg)的196b。向配有磁力搅拌器的25ml圆底烧瓶中加入196b(260mg,0.5mmol)、氢氧化锂(94mg,2.2mmol)、thf(2ml)、异丙醇(2ml)和水(5ml)。在rt下搅拌混合物30min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。利用biotagekpnh12+m柱,通过柱色谱纯化所得的残余物,用己烷–乙酸乙酯的梯度洗脱,得到46%收率(110mg)的196。ms(esi+)m/z545.4(m+h)。实施例1972-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮197实施例197a2,6-二溴-4-氟苯甲醛197a在30分钟内向1,3-二溴-5-氟-2-碘苯(50g,132mmol)在无水甲苯(300ml)中的冷却至–35℃的溶液中加入异丙基氯化镁溶液(84ml,171mmol,2.0m乙醚溶液)同时保持内部温度低于-25℃。获得澄清的褐色溶液。继续搅拌1.5h。然后在30分钟内加入无水dmf(34ml,436mmol)。使反应混合物的温度增至-19℃。在1h内使反应混合物升温至10℃(室温)并在此温度下搅拌1.5h。用nh4cl饱和水溶液(100ml)终止反应,过滤,然后在减压下蒸发。通过硅胶柱色谱(用石油醚/乙酸乙酯:从50:1至20:1洗脱)纯化残余物得到黄色固体197a(20g,收率54%)。实施例197b2,6-二溴-4-氟苯基)甲醇197b向197a(20g,71mmol)在乙醇(500ml)中的溶液加入nabh4(10g,284mmol)。在室温下(10℃)搅拌混合物4h。tlc显示原料消失。用hcl溶液(150ml,1m)终止反应。在减压下蒸发大部分乙醇。用乙酸乙酯(3×500ml)萃取残余物。合并有机层,用无水na2so4干燥,然后在真空中蒸发。通过硅胶柱色谱(用石油醚/乙酸乙酯:从50:1至20:1洗脱)纯化残余物得到白色固体197b(15g,收率75%)。实施例197c2,6-二溴-4-氟苄基乙酸酯197c向配有磁力搅拌器和氮气入口的500-ml单颈圆底烧瓶中加入197b(23.0g,81.0mmol)、三乙胺(25.0g,247mmol)和无水二氯甲烷(100ml)。加入乙酸酐(10.0g,98.0mmol),并在室温下搅拌此混合物16h。此后,用二氯甲烷(100ml)稀释混合物,并用饱和碳酸氢钠水溶液(100ml)洗涤。分离各层,并用二氯甲烷(2×20ml)萃取水层。合并有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,0%-50%乙酸乙酯/己烷)纯化所得的残余物得到87%收率(23.0g)的白色固体197c。实施例197d2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯197d向配有磁力搅拌器的250-ml单颈圆底烧瓶中加入1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101k(3.8g,20mmol)、197c(20g,60mmol)、xantphos(1.2g,2mmol)、三(二亚苄基丙酮)二钯(0)(1.8g,2mmol)、cs2co3(16g,50mmol)和1,4-二噁烷(120ml)。对系统抽真空而后再充入n2。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物16h。然后冷却至室温并过滤。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物,用5:1石油醚/乙酸乙酯洗脱,得到60%收率(5.2g)的白色固体197d。ms:[m+h]+435。1hnmr(500mhz,dmso)δ7.70(dd,j=3,1h),7.48(dd,j=3,1h),6.52(s,1h),5.01(m,2h),4.18(m,2h),4.02(m,1h),3.73(m,1h),2.60(m,2h),2.45(m,2h),1.98(s,3h),1.77(m,2h),1.68(m,2h)实施例197f1-甲基-3-[5-(4-甲基哌嗪-1-基)-吡啶-2-基氨基]-5-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-1h-吡啶-2-酮197f用氮气吹扫配有磁力搅拌器和温度调节器的1-l单颈圆底烧瓶,并加入按照us2009/0318448制得的197e(10.0g,0.027mol)、双(频哪醇)联硼酸酯(8.06g,0.032mol)、乙酸钾(10.4g,0.11mol)和1,4-二噁烷(200ml)。在持续30min使氮气流经过所得的悬浮液后,加入pd(dppf)cl2ch2cl2(582mg,0.795mmol)。在回流下搅拌所得的反应混合物3h。然后,冷却至室温,在水(400ml)和乙酸乙酯(600ml)之间分配,然后通过celite垫过滤。萃取有机相,用硫酸钠干燥,过滤,然后浓缩。用乙醚(50ml)和己烷(250ml)的混合物使残余物成粉末,然后过滤悬浮液。在真空下在室温下干燥滤饼得到27%收率(3.04g)的褐色固体197f。实施例197g4-氟-2-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯197g在配有磁力搅拌棒的10-ml玻璃容器中加入197f(244mg,0.58mmol)、197d(200mg,0.46mmol)、pd(pph3)4(33mg,0.030mmol)和2nna2co3(1ml)和dme(2ml)。用塞子密封容器,然后置于微波腔中。在125℃下搅拌反应混合物7min后,通过快速色谱法(二氯甲烷:甲醇85:15)纯化得到30%(90mg)的固体197g。向配有磁力搅拌棒的100-ml单颈圆底烧瓶中加入197g(90mg,0.14mmol)、lioh水合物(60mg,1.4mmol)、thf(2ml)、i-proh(2ml)和水(2ml)。在室温下搅拌反应混合物3h后,在二氯甲烷(5ml)和水(5ml)之间分配,然后用二氯甲烷(5mlx3)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)。向此溶液加入己烷(10ml),然后过滤所得的沉淀得到81%收率(69mg)的197。ms(esi+)m/z612.5(m+h)实施例19810-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮198实施例198a2,6-二溴-4-氟苯甲醛198a将1,3-二溴-5-氟-2-碘苯(50g,132mmol)在无水甲苯(300ml)中的溶液冷却至–35°,并向其在30分钟内加入异丙基氯化镁溶液(84ml,171mmol,2.0met2o溶液)同时保持内部温度低于-25°(图6)。获得澄清的褐色溶液。继续搅拌1.5h。然后在30分钟内加入无水dmf(34ml,436mmol)。使反应混合物的温度增至-19°。使反应混合物在1h内升温至10°(室温)并在此温度下搅拌1.5h。用nh4cl饱和水溶液(100ml)终止反应,过滤,然后在减压下蒸发。通过硅胶柱色谱(用石油醚/乙酸乙酯:从50:1至20:1洗脱)纯化残余物得到黄色固体198a(20g,收率54%)。实施例198b2,6-二溴-4-氟苯基)甲醇198b向198a(20g,71mmol)在etoh(500ml)中的溶液中加入nabh4(10g,284mmol)。在室温下(10℃)搅拌混合物4h。tlc显示原料消失。用hcl溶液(150ml,1m)终止反应。在减压下蒸发大部分etoh。用乙酸乙酯(3×500ml)萃取残余物。合并有机层,然后用无水na2so4干燥,在真空中蒸发。通过硅胶柱色谱(用石油醚/乙酸乙酯:从50:1至20:1洗脱)纯化残余物得到白色固体198b(15g,收率75%)。实施例198c2,6-二溴-4-氟苄基乙酸酯198c向配有磁力搅拌器和氮气入口的500-ml单颈圆底烧瓶中加入198b(23.0g,81.0mmol)、三乙胺(25.0g,247mmol)和无水二氯甲烷(100ml)。加入乙酸酐(10.0g,98.0mmol),并在室温下搅拌此混合物16h。此后,用二氯甲烷(100ml)稀释混合物,用饱和碳酸氢钠水溶液(100ml)洗涤。分离各层,并用二氯甲烷(2×20ml)萃取水层。合并有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,0%-50%乙酸乙酯/己烷)纯化所得的残余物得到87%收率(23.0g)的白色固体198c。实施例198d2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯198d向配有磁力搅拌器的250-ml单颈圆底烧瓶中加入1-(2-氨基乙基)-4,5,6,7-四氢-1h-吲哚-2-羧酸乙酯101k(3.8g,20mmol)、198c(20g,60mmol)、xantphos(1.2g,2mmol)、三(二亚苄基丙酮)二钯(0)(1.8g,2mmol)、cs2co3(16g,50mmol)和1,4-二噁烷(120ml)。对系统抽真空而后再充入n2。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物16h。然后冷却至室温并过滤。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物,用5:1pe/ea洗脱,得到60%收率(5.2g)的白色固体198d。ms:[m+h]+435。1hnmr(500mhz,dmso)δ7.70(dd,j=3,1h),7.48(dd,j=3,1h),6.52(s,1h),5.01(m,2h),4.18(m,2h),4.02(m,1h),3.73(m,1h),2.60(m,2h),2.45(m,2h),1.98(s,3h),1.77(m,2h),1.68(m,2h)实施例198e5-溴-1-甲基-3-[5-(4-甲基哌嗪-1-基)-吡啶-2-基氨基]-1h-吡啶-2-酮198e步骤1:1-甲基-4-(6-硝基吡啶-3-基)哌嗪按照us2009/0318448,向5-溴-2-硝基吡啶(2.0g,9.85mmol)在dmso(10ml)中的溶液加入k2co3(2.72g,19.7mmol)和1-甲基哌嗪(1.64ml,14.8mmol)和四丁基碘化铵(36mg)。在120℃下过夜搅拌混合物。使其冷却并用1nhcl酸化。用dcm萃取混合物。用饱和na2co3碱化水层,然后再用dcm萃取。用na2so4干燥合并的有机层,然后浓缩得到褐色固体,用少量水洗涤。在真空下干燥固体得到2.16g的黄色粉末1-甲基-4-(6-硝基吡啶-3-基)哌嗪(99%收率)。lcms:(m+h)+223步骤2:5-(4-甲基哌嗪-1-基)吡啶-2-胺将1-甲基-4-(6-硝基吡啶-3-基)哌嗪(5g,22.5mmol)、nh4cl(12g,225mmol)和fe(5g,5mmol)在etoh/h2o(1:1)(100ml)中的悬浮液在80℃下搅拌3h。tlc显示原料1-甲基-4-(6-硝基吡啶-3-基)哌嗪消失。在celite垫上过滤后,在真空下除去溶剂。将ea和盐水加入混合物中,分离有机层,用na2so4干燥,然后在减压下浓缩得到2.5g的5-(4-甲基哌嗪-1-基)吡啶-2-胺(收率60%)。lcms:(m+h)+193步骤3:将5-(4-甲基哌嗪-1-基)吡啶-2-胺(1g,10.5mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.87g,7mmol)和cs2co3(5g,21mmol)加入密封管中的二噁烷(30ml)中。在持续15分钟使氮气鼓泡经过所得的溶液后,加入xantphos(405mg,0.7mmol)和三(二亚苄基丙酮)二钯(0)(320mg,0.35mmol),然后在100℃下搅拌反应混合物0.5h。在过滤后,用温热的ea洗涤固体,然后浓缩滤液得到黑色固体粗产物。使粗产物从meoh重结晶得到1.26g(64%)的198e。lcms:(m+h)+380。1hnmr(500mhz,dmso)δ8.57(d,j=2.5,1h),8.54(s,1h),7.93(d,j=3,1h),7.44(d,j=2.5,1h),7.38(dd,j=3.5,2h),7.24(d,j=4.5,1h),3.50(s,3h),3.07(m,4h),2.44(m,4h),2.21(s,3h)。实施例198f1-甲基-3-[5-(4-甲基哌嗪-1-基)吡啶-2-基氨基]-5-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-1h-吡啶-2-酮198f用氮气吹扫配有磁力搅拌器和温度调节器的1-l单颈圆底烧瓶,并加入198e(10.0g,0.027mol)、双(频哪醇)联硼酸酯(8.06g,0.032mol)、乙酸钾(10.4g,0.11mol)和1,4-二噁烷(200ml)。在持续30min使氮气流经过所得的悬浮液后,加入pd(dppf)cl2ch2cl2(582mg,0.795mmol)。在回流下搅拌所得的反应混合物3h。然后,冷却至室温,在水(400ml)和乙酸乙酯(600ml)之间分配,而后通过celite垫过滤。萃取有机相,用硫酸钠干燥,过滤,然后浓缩。用乙醚(50ml)和己烷(250ml)的混合物使残余物成粉末,然后过滤悬浮液。在真空下在室温下干燥滤饼得到27%收率(3.04g)的褐色固体198f。实施例198g4-氟-2-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯198g在配有磁力搅拌棒的10-ml玻璃容器中加入198f(244mg,0.58mmol)、198d(200mg,0.46mmol)、pd(pph3)4(33mg,0.030mmol)和2nna2co3(1ml)和dme(2ml)。用塞子密封容器,然后置于微波腔中。在125℃下搅拌反应混合物7min后,通过快速色谱(二氯甲烷:meoh85:15)纯化得到30%(90mg)的固体198g。按照实施例148,将198g转化成75mg的白色固体198。ms(esi+)m/z626.6(m+h)。实施例1995-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[(1-甲基氮杂环丁烷-3-基)氧基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮199实施例199a3-碘氮杂环丁烷-1-羧酸叔丁酯199a用咪唑(4.08g,0.06mol)、pph3(0.6g,0.04mol)和i2(7.62g,0.03mol)处理3-羟基氮杂环丁烷-1-羧酸叔丁酯(25-3)(3.5g,0.02mol)在甲苯(200ml)中的溶液。在100℃下加热混合物1h,然后冷却至室温。然后将其倒入饱和nahco3溶液(30ml)中。通过加入碘破坏过量的pph3直至i2着色保持在有机层中。用5%na2so3溶液洗涤混合物,用na2so4干燥,然后在真空中蒸发。通过硅胶柱纯化残余物得到199a(5.31g,93%)。ms:[m+h]+284。实施例199b3-(6-硝基吡啶-3-基氧基)氮杂环丁烷-1-羧酸叔丁酯199b将199a(2.24g,7.9mmol)、6-硝基吡啶-3-醇(1g,7.2mmol)和cs2co3(2.6g,7.9mmol)在dmf(8ml)中的混合物在密封管中在125℃下过夜加热。过滤混合物,然后用乙酸乙酯(20ml×2)洗涤。在真空中蒸发滤液,然后在反相combi快速色谱上纯化残余物得到199b(1.25g,59%)。ms:[m+h]+296。实施例199c3-(6-氨基吡啶-3-基氧基)氮杂环丁烷-1-羧酸叔丁酯199c用氮气吹扫100-mlparr氢化瓶,并加入199b(1.07g,3.6mmol)、10%钯/碳(50%湿度,0.3g)和甲醇(60ml)。对瓶抽真空,充入氢气至压力25psi,并在parr氢化装置上振摇2h。然后抽除氢气并将氮气充入瓶中。通过celite垫过滤除去催化剂,然后在减压下浓缩滤液得到199c(0.95g,99%)。ms:[m+h]+266。实施例199d3-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基氧基)氮杂环丁烷-1-羧酸叔丁酯199d将199c(950mg,3.6mmol)、xantphos(125mg,0.29mmol)、pd2dba3(260mg,0.29mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.03g,3.9mmol)和cs2co3(1.8g.7.2mmol)在1,4-二噁烷(20ml)中的混合物在回流下加热2h。在反应完成后,过滤混合物,然后用甲醇(100ml)洗涤。在真空中蒸发滤液。在反相combi快速色谱上纯化残余物得到199d(1.46g,91%)。ms:[m+h]+451。实施例199e3-(5-(氮杂环丁烷-3-基氧基)吡啶-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮盐酸盐199e将199d(1.46g,3.2mmol)和hcl/1,4-二噁烷(3.2ml,12.8mmol,4m)在甲醇(20ml)中的混合物在80℃下加热1h。在减压下浓缩混合物得到199e(1.24g,99%)。ms:[m+h]+351。实施例199f5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基氧基)吡啶-2-基氨基)吡啶-2(1h)-酮199f将199e(1.24g,3.2mmol)、hcho溶液(15ml,37%水溶液)、乙酸(1ml)和nabh(oac)3(1.36g,6.4mmol)在甲醇(10ml)中的混合物在室温下搅拌4h。在真空中蒸发溶剂,然后用乙酸乙酯(20ml×3)萃取残余物。用硫酸钠干燥合并的萃取液,然后在减压下浓缩。在反相combi快速色谱上纯化残余物得到199f(940mg,80%)。ms:[m+h]+365。实施例199g{4-氟-2-[1-甲基-5-({5-[(1-甲基氮杂环丁烷-3-基)氧基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯199g将199f(434mg,1.2mmol)、(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b(600mg,1.2mmol)、pdcl2(dppf)(134mg,0.18mmol)、k3po4(150mg)和naoac(100mg)在mecn(8ml)和水(2ml)中的混合物在密封管中在110℃下加热2h。在真空中蒸发溶剂。在反相combi快速色谱上纯化残余物得到199g(320mg,41%)。ms:[m+h]+658。将199g(320mg,0.49mmol)和lioh水合物(409mg,9.8mmol)在异丙醇(20ml)和水(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到199(30mg,10%)。ms:[m+h]+616。1hnmr(500mhz,cdcl3)δ8.52(d,j=2.0,1h),7.82(s,1h),7.75(d,j=2.5,1h),7.48(d,j=2.0,1h),7.16-7.14(m,1h),7.11-7.09(m,1h),6.98-6.96(m,1h),6.79(d,j=9.0,1h),4.76-7.72(m,1h),4.56(d,j=11.5,1h),4.32-4.25(m,1h),4.19-4.07(m,2h),3.97-3.80(m,3h),3.69(s,3h),3.23-3.15(m,2h),3.00-2.81(m,4h),2.59-2.50(m,2h),2.47(s,2h),1.93-1.83(m,4h)。实施例2002-(3-(5-(5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮200实施例200a5-(氮杂环丁烷-1-基甲基)-1-甲基-3-硝基-1h-吡唑200a按照实施例156e,将5-(溴甲基)-1-甲基-3-硝基-1h-吡唑156d(1.76g,8mmol)、氮杂环丁烷(550mg,9.6mmol)、二异丙基乙胺(1.75ml,10mmol)和二氯甲烷(40ml)在室温下搅拌3-5h。经后处理并在减压下浓缩得到黄色油状物5-(氮杂环丁烷-1-基甲基)-1-甲基-3-硝基-1h-吡唑200a(定量),未经进一步纯化用于下一步骤。ms(esi+)m/z197.1(m+h)。实施例200b5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-胺200b按照实施例156f,使10%钯/碳(30%湿度,480mg干重)和200a(1.6g,8mmol)在乙醇(50ml)中的溶液反应。通过celite521垫过滤反应混合物。用乙醇(2x30ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干得到黄色油状物5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-胺200b(定量)。ms(esi+)m/z167.1(m+h)。实施例200c3-(5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮200c按照实施例156g,将200b(350mg,2mmol)、3,5-二溴-1-甲基-1h-吡啶-2-酮(0.54g,2mmol)、碳酸铯(1.3g,4mmol)、三(二亚苄基丙酮)二钯(0)(0.18g,0.2mmol)、xantphos(0.23g,0.4mmol)和1,4-二噁烷(20ml)在100℃下加热8小时。经后处理和快速柱色谱(硅胶,3:1二氯甲烷/甲醇),得到98%收率(0.69g)的黄色固体3-(5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮200c。ms(esi+)m/z354.1(m+h)。实施例200d2-(5-(5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯200d按照实施例121b,将4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(202mg,0.42mmol)、3-(5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮200c(105mg,0.3mmol)、1m碳酸钠溶液(1.2ml,1.2mmol)、四(三苯基膦)钯(0)(18mg,0.015mmol)和1,2-二甲氧基乙烷(3ml)在微波反应器中在130℃下加热10分钟。后处理,然后通过快速色谱(硅胶,3:1二氯甲烷/甲醇)纯化所得的残余物得到180mg化合物200d(定量,包含3%200),黄色残余物:ms(esi+)m/z628.1(m+h)。利用实施例121,用thf(1ml)、水(0.5ml)、异丙醇(1ml)和一水合氢氧化锂(80mg,1.93mmol)对中间体200d(0.3mmol)进行脱保护。后处理,然后通过快速色谱(nh-硅胶,乙酸乙酯/己烷)纯化所得的残余物得到25%收率(2步,45mg)的浅粉色固体200:ms(esi+)m/z586.6(m+h)。实施例2012-(5-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基醇201实施例201b2-(5-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯201b向配有磁力搅拌器的44-ml密封管中加入138e(190mg,0.49mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(200mg,0.79mmol)、乙酸钾(190mg,2.0mmol)和1,4-二噁烷(5ml)。在对混合物脱气30分钟后,加入pd(dppf)cl2·ch2cl2(40mg,0.049mmol)。在105℃下搅拌所得的反应混合物6h。然后,冷却至室温,并通过celite垫过滤。浓缩滤液,然后将硼酸酯(boronolate)粗产物再溶于dme(2ml)中并转移至10-ml微波反应容器中。向此溶液中加入2-溴-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯197d(171mg,0.39mmol)、pd(pph3)4(30mg,0.025mmol)和2nna2co3(2ml)。然后,对反应混合物脱气5分钟,而后置于微波腔中。在125℃下搅拌反应混合物7min后,通过快速色谱(二氯甲烷:meoh85:15)纯化得到46%(120mg)的固体201b。向配有磁力搅拌棒的100-ml单颈圆底烧瓶中加入2-(5-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯201b(120mg,0.18mmol)、lioh·h2o(80mg,1.8mmol)、thf(2ml)、异丙醇(2ml)和水(2ml)。在室温下搅拌反应混合物3h后,在二氯甲烷(5ml)和水(5ml)之间分配,然后用二氯甲烷(3x5ml)萃取有机相。用水(2x5ml)和盐水(5ml)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)中。向此溶液中加入己烷(10ml),然后过滤所得的沉淀得到40%收率(45mg)的201;ms(esi+)m/z626.4(m+h)。实施例2025-[5-氟-2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-3-{[5-(1-甲基吡咯烷-2-基)吡啶-2-基]氨基}-1,2-二氢吡啶-2-酮202实施例202a5-溴-1-甲基-3-(5-(1-甲基吡咯烷-2-基)吡啶-2-基氨基)吡啶-2(1h)-酮202a按照实施例142a,将5-(1-甲基吡咯烷-2-基)吡啶-2-胺(500mg,2mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(0.54g,2mmol)、碳酸铯(1.9g,6mmol)、三(二亚苄基丙酮)二钯(0)(0.18g,0.2mmol)、xantphos(0.23g,0.4mmol)和1,4-二噁烷(20ml)在100℃下加热8小时。经后处理和快速柱色谱(硅胶,9:1二氯甲烷/甲醇)得到82%收率(0.6g)的绿色固体5-溴-1-甲基-3-(5-(1-甲基吡咯烷-2-基)吡啶-2-基氨基)吡啶-2(1h)-酮202a:ms(esi+)m/z365.0(m+h)。按照实施例121b,使4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(338mg,0.7mmol)、202a(181mg,0.5mmol)、1m碳酸钠溶液(2ml,2mmol)、四(三苯基膦)钯(0)(29mg,0.025mmol)和1,2-二甲氧基乙烷(5ml)反应。经后处理和快速柱色谱(硅胶,3:1二氯甲烷/甲醇)得到4-氟-2-(1-甲基-5-(5-(1-甲基吡咯烷-2-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯和202的混合物(200mg),为黄色残余物。除了使用thf(1ml)、水(0.5ml)、异丙醇(1ml)和氢氧化锂一水合物(55mg,1.2mmol)的混合物之外,按照实施例121,对上述残余物脱保护。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到32%收率(60mg)的黄色固体202:ms(esi+)m/z597.4(m+h)。实施例2035-(3-(6,6-二甲基-5,7-二氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-2-(羟甲基)苯基)-1-甲基-3-(嘧啶-4-基氨基)吡啶-2(1h)-酮203向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入105i(226mg,0.506mmol)、109c(200mg,0.610mmol)、碳酸钠(160mg,1.51mmol)、水(2ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(60mg,0.052mmol)。将回流冷凝管连接到烧瓶,然后在100℃下加热反应混合物2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,并用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后将所得的残余物溶于thf(3ml)、水(3ml)和甲醇(3ml)的混合物中。加入一水合氢氧化锂(61mg,1.45mmol),并在室温下搅拌反应2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(50ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2×75ml)萃取水层,并用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,0%-10%甲醇/二氯甲烷)而后用甲醇(10ml)使其成粉末来纯化所得的残余物,得到37%收率(57mg)的非结晶白色固体203:mp170–171℃;1hnmr(500mhz,dmso-d6)δ9.18(s,1h),8.74(d,1h,j=3.5hz),8.65(s,1h),8.29(d,1h,j=10.0hz),7.93(d,1h,j=10.0hz),7.57(d,1h,j=3.5hz),7.43(t,1h,j=13.0hz),7.32(m,2h),7.24(d,1h,j=13.0hz),7.19(d,1h,j=13.0hz),4.83(m,1h),4.38(d,2h,j=6.5hz),3.60(s,3h),2.90(s,2h),2.74(s,2h),1.28(s,6h);ms(esi+)m/z526.2(m+h)。实施例2045-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-1-甲基-3-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)204向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶中加入197e(170mg,0.450mmol)、182c(300mg,0.513mmol)、碳酸钠(143mg,1.35mmol)、水(2ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(52mg,0.045mmol),并在回流下加热反应混合物2h。其后,将混合物冷却至室温,并用二氯甲烷(100ml)和水(30ml)稀释。分离有机层,并用二氯甲烷(3×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到褐色残余物。用氮气吹扫配有磁力搅拌器的100-ml单颈圆底烧瓶,并加入上述粗品残余物、thf(10ml)和1m四丁基氟化铵/thf溶液(4.50mmol,4.5ml)。在室温下搅拌所得的混合物1h。此后,用二氯甲烷(100ml)稀释混合物,并用水(30ml)洗涤。分离有机层,并用二氯甲烷(3×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-10%甲醇/二氯甲烷)得到53%收率(154mg)的灰白色固体204:mp143–145℃;1hnmr(500mhz,dmso-d6)δ8.54(d,1h,j=2.5hz),8.35(s,1h),7.86(d,1h,j=3.0hz),7.34(m,3h),7.21(d,1h,j=8.9hz),7.17(dd,1h,j=9.3,3.0hz),4.85(m,1h),4.32(m,2h),4.04(m,1h),3.85(m,1h),3.58(s,3h),3.03(m,5h),2.87(m,1h),2.75(s,2h),2.53(m,2h),2.43(m,4h),2.20(s,3h),1.23(s,6h);ms(esi+)m/z643.3(m+h)。实施例2052-(5-氟-2-(羟甲基)-3-(1-甲基-5-(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮205实施例205a5-溴-1-甲基-3-(5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮205a使2-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-7,8-二氢-1,6-萘啶-6(5h)-羧酸叔丁酯158c(3.2g,7.4mmol)悬浮于二氯甲烷(20ml)中,滴加饱和氯化氢/二噁烷(20ml)。搅拌反应混合物20分钟,然后在减压下浓缩得到205a,未经进一步纯化用于下一步骤。lc/ms:m/z336(m+h)+实施例205b5-溴-1-甲基-3-(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮205b将205a(2.75g,7.5mmol)、甲醛(37%水溶液,30ml,375mmol)、nabh(oac)3(4.75g,22.5mmol)和乙酸(25ml,150mmol)在甲醇(125ml)中的混合物在室温下搅拌4小时。然后用饱和naoh溶液使混合物处于碱性条件,并用乙酸乙酯萃取。用na2so4干燥有机层,然后在减压下蒸发。通过柱色谱纯化残余物,用4:1乙酸乙酯/甲醇洗脱,得到205b(2.0g,77%)。lc/ms:m/z349(m+h)+实施例205c4-氟-2-(1-甲基-5-(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯205c向配有磁搅拌棒的15ml微波反应用小瓶中加入205b(0.35g,1mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(0.48g,1mmol)、磷酸钾(0.54g,2mmol)、乙酸钠(0.17g,2mmol)、乙腈(10ml)、水(1ml)和1,1'-双(二苯基膦)二茂铁氯化钯(ii)二氯甲烷(0.08g,0.1mmol)。在氩气氛下在110℃下加热混合物2小时。此后,将混合物冷却至室温并过滤。在减压下浓缩滤液,然后通过柱色谱纯化残余物,用40:1dmc/甲醇洗脱,得到205c(0.22g,36%)。lc/ms:m/z625(m+h)+向配有磁力搅拌器的25ml圆底烧瓶中加入化合物4-氟-2-(1-甲基-5-(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯205c(0.2g,0.32mmol)、lioh(2g,48mmol)、thf(5ml)、异丙醇(5ml)和水(2ml)。在室温下搅拌反应混合物30分钟,然后过滤。在减压下浓缩滤液,然后通过制备型hplc纯化残余物得到205(100mg,53%)。lc/ms:m/z583(m+h)+。1hnmr(500mhz,dmso)δ8.79(d,j=2,1h),8.45(s,1h),7.44(d,j=2,1h),7.31(m,2h),7.20(m,1h),7.08(d,j=9,1h),6.52(s,1h),4.89(m,1h),4.34(m,2h),4.17(m,3h),3.89(m,1h),3.59(s,3h),3.38(m,2h),2.75(m,2h),2.62(m,4h),2.51(m,2h),2.33(s,3h),1.70(m,4h)。实施例2062-(2-(羟甲基)-3-(1-甲基-5-(1-(2-(甲基氨基)乙基)-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮206实施例206a2-(2-(3-硝基-1h-吡唑-1-基)乙基)异吲哚啉-1,3-二酮206a用nah在矿物油中60%悬浮液(4.6g,115mmol)处理4-硝基-1h-吡唑(10g,88.5mmol)在无水dmf(250ml)中的溶液同时在氮气下搅拌。在冒气泡后,再搅拌反应30分钟。此时用2-(2-溴乙基)异吲哚啉-1,3-二酮(18-2)(25g,97.3mmol)处理反应并在氮气下继续搅拌3小时。然后缓慢加入水(50ml),而后过滤混合物得到白色固体206a(20g,80%),未经进一步纯化直接使用。lcms:(m+h)+287。实施例206b2-(3-硝基-1h-吡唑-1-基)乙胺206b向206a(2.0g,7.0mmol)在乙醇(30ml)中的溶液中加入水合肼(1ml,21mmol)并在室温下搅拌混合物3小时。蒸发混合物,然后通过硅胶柱纯化残余物,用10:1二氯甲烷/甲醇洗脱,得到白色固体206b(0.8g,80%)。ms:(m+h)+157。实施例206c2-(3-硝基-1h-吡唑-1-基)乙基氨基羧酸叔丁酯206c向206b(18g,115mmol)在二氯甲烷(400ml)中的溶液中加入(boc)2o(50g,230mmol)和三乙胺(35g,346mmol)。在室温下搅拌混合物5小时。然后蒸发,而后用1:1石油醚/乙酸乙酯洗脱通过硅胶柱纯化得到白色固体206c(24g,80%)。ms:(m+h)+257。实施例206d甲基(2-(3-硝基-1h-吡唑-1-基)乙基)氨基羧酸叔丁酯206d向206c(5g,19.5mmol)在thf(40ml)中的溶液中加入nah(938mg,23.4mmol)。在室温下搅拌反应混合物30分钟。加入碘甲烷(1.7ml,25.4mmol),并再搅拌混合物15小时。然后蒸发,并通过硅胶柱纯化,用2:1石油醚/乙酸乙酯洗脱,得到白色固体206d(4.5g,85%)。ms:(m+h)+271。实施例206e2-(3-氨基-1h-吡唑-1-基)乙基(甲基)氨基羧酸叔丁酯206e向206d(4.5g,1.7mmol)在乙醇(40ml)中的溶液中加入fe(4.7g,8.5mmol)和nh4cl(900mg,17mmol)。在室温下搅拌反应混合物4小时。然后蒸发,并通过硅胶柱纯化,用2:1石油醚/乙酸乙酯洗脱,得到褐色固体206e(3.2g,80%)。ms:(m+h)+241。实施例206f2-(3-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-1h-吡唑-1-基)乙基(甲基)氨基羧酸叔丁酯206f将(206e(2g,8.3mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(2.2g,8.3mmol)、xantphos(482mg,0.83mmol)、pd2(dba)3(762mg,0.83mmol)和cs2co3(6.8g,21mmol)在二噁烷(80ml)中的混合物在氮气下在100℃下加热15h。然后过滤,在真空中蒸发,并通过硅胶柱纯化,用1:2石油醚/乙酸乙酯洗脱,得到黄色固体206f(2.7g,77%)。ms:(m+h)+426。实施例206g2-(5-(1-(2-(叔丁氧基羰基(甲基)氨基)乙基)-1h-吡唑-3-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯206g使206f(800mg,1.9mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯(114a)(873mg,1.9mmol)、ch3coona(309mg,3.8mmol)、pdcl2(dppf)(153mg,0.19mmol)和k3po4(1g,3.8mmol)的混合物悬浮于ch3cn(30ml)和h2o(2ml)中,将其在氩气氛下在110℃下加热15h。然后蒸发,通过反相combi快速色谱纯化残余物,用含有0.3%nh4hco3的1:4水/ch3cn洗脱,得到褐色固体206g(800mg,63%)。ms:(m+h)+684实施例206h2-(3-(5-(2-(羟甲基)-3-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苯基)-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-1h-吡唑-1-基)乙基(甲基)氨基羧酸叔丁酯206h向206g(750mg,1.1mmol)在丙-2-醇(15ml)、四氢呋喃(15ml)和水(5ml)中的溶液中加入lioh(2.6g,110mmol)。在30℃下搅拌混合物2h。然后蒸发,通过反相combi-快速色谱纯化残余物,用含有0.3%nh4hco3的1:3水/ch3cn洗脱,得到褐色固体206h(500mg,71%)。ms:(m+h)+642将206h(500mg,0.78mmol)在hcl/乙酸乙酯(5ml)中的溶液在室温下搅拌2h。然后蒸发,而后通过制备型hplc纯化残余物得到褐色固体206(134mg,35%)。ms:(m+h)+542。1hnmr(500mhz,meod)δ1.79(s,2h),1.89(s,2h),2.35(s,3h),2.54-2.56(t,j=6hz,2h),2.63-2.67(m,2h),2.97-2.99(t,j=6hz,2h),3.71(s,3h),4.00-4.03(m,1h),4.14-4.23(m,5h),4.50-4.60(m,2h),6.06-6.07(d,1h),6.71(s,1h),7.23-7.24(d,1h),7.37-7.43(m,2h),7.49-7.52(m,2h),8.01-8.02(d,1h)。实施例2072-(3-(5-(5-(3-羟基-3-甲基氮杂环丁烷-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮207实施例207a3-甲基-1-(6-硝基吡啶-3-基)氮杂环丁烷-3-醇207a将5-溴-2-硝基吡啶(3.28g,16.3mmol)、xantphos(1.13g,1.96mmol)、pd2dba3(1.19g,1.30mmol)、3-甲基氮杂环丁烷-3-醇盐酸盐(2g,16.3mmol)和cs2co3(15.9g.48.9mmol)在1,4-二噁烷(70ml)中的混合物在回流下加热2h。在反应完成后,过滤混合物,并用meoh(100ml)洗涤。在真空中蒸发滤液,然后在反相combi-快速色谱上纯化残余物得到207a(2.5g,71%)。ms:[m+h]+210。实施例207b1-(6-氨基吡啶-3-基)-3-甲基氮杂环丁烷-3-醇207b用氮气吹扫100-mlparr氢化瓶,并加入207a(2.3g,11mmol)、10%钯/碳(50%湿度,1.0g)和甲醇(100ml)。对瓶抽真空,充入氢气至压力25psi并在parr氢化装置上振摇2h。然后抽除氢气并将氮气充入瓶中。通过celite垫过滤除去催化剂,然后在减压下浓缩滤液得到207b(1.85g,92%)。ms:[m+h]+180。实施例207c5-溴-3-(5-(3-羟基-3-甲基氮杂环丁烷-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮207c将207b(1.84g,10.3mmol)、xantphos(714mg,1.24mmol)、pd2dba3(755mg,0.82mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(3.27g,12.3mmol)和cs2co3(10g.30.9mmol)在1,4-二噁烷(50ml)中的混合物在回流下加热2h。在反应完成后,过滤混合物,并用meoh(100ml)洗涤。在真空中蒸发滤液,然后在反相combi快速色谱上纯化残余物得到207c(2.11g,54%)。ms:[m+h]+365。实施例207d2-(5-(5-(3-羟基-3-甲基氮杂环丁烷-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯207d将207c(364mg,1.0mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(510mg,1.1mmol)、pdcl2(dppf)(110mg,0.15mmol)、k3po4(100mg)和naoac(50mg)在mecn(20ml)和水(4ml)中的混合物在回流下加热2h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到207d(267mg,43%)。ms:[m+h]+623。将207d(350mg,0.56mmol)和lioh水合物(236mg,5.6mmol)在iproh(20ml)和水(4ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到207(130mg,40%)。ms:[m+h]+581。1hnmr(500mhz,dmso)δ8.48(s,1h),8.25(s,1h),7.48-7.44(m,2h),7.34-7.28(m,3h),7.17(d,j=8.5,1h),6.89-6.87(m,1h),6.51(s,1h),5.47(s,1h),4.84-4.83(m,1h),4.33(d,j=4.5,2h),4.18-4.06(m,3h),3.90-3.86(m,1h),3.70(d,j=7.5,2h),3.58(s,3h),3.53-3.52(m,2h),2.64-2.54(m,2h),2.47-2.45(m,2h),1.82-1.75(m,2h),1.73-1.65(m,2h),1.43(s,3h)。实施例2082-(3-(5-(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮208实施例208a2-(5-(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯208a按照实施例136e,将5-溴-3-(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1-甲基吡啶-2(1h)-酮和4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d转化成208a,42%收率。lcms:(m+h)+639按照实施例136,将208a转化成208,40%收率。lcms:(m+h)+597。1hnmr(500mhz,dmso)δ8.80(d,j=2,1h),8.45(s,1h),7.45(d,j=2,1h),7.31(m,2h),7.20(dd,j=10,1h),7.07(d,j=9,1h),6.53(s,1h),4.36(s,2h),4.14(m,3h),3.90(m,1h),3.60(s,3h),2.74(m,2h),2.68(m,2h),2.59(m,2h),2.47(m,3h),1.79(m,2h),1.69(m,2h),1.08(t,j=7.5,3h)。实施例2095-[2-(羟甲基)-3-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮209实施例209a{2-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代吡啶-3-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯209a按照实施例148c,使481mg的111a和420mg的5-溴-1-甲基-3-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮188e反应得到黄色固体209a(347mg,50%)。ms:[m+h]+695按照实施例148,将230mg的209a转化成白色固体209(108mg,50%)。ms:[m+h]+653。1hnmr(500mhz,dmso)δ8.56(d,j=2.5,1h),8.37(s,1h),7.86(d,j=3.0,1h),7.45(d,j=7.5,1h),7.36-7.30(m,4h),7.23(d,j=9.0,1h),4.82(s,1h),4.55(t,j=6.5,2h),4.45(t,j=6.0,2h),4.35(s,2h),4.02(m,1h),3.82(m,1h),3.58(s,3h),3.42(m,2h),3.06(t,j=4.5,4h),2.92-2.80(m,2h),2.78(s,2h),2.53(m,1h),2.38(s,4h),1.80(s,4h)。实施例2102-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮210实施例210a5-溴-1-甲基-3-[5-(4-叔丁氧基羰基哌嗪-1-基)-吡啶-2-基胺210a步骤1:4-(6-硝基吡啶-3-基)哌嗪-1-羧酸叔丁酯向5-溴-2-硝基吡啶(30g,148mmol)在dmso(1l)中的溶液中加入k2co3(40g,296mmol)和哌嗪-1-羧酸叔丁酯(28g,148mmol)。在65℃下过夜搅拌混合物。在冷却后,将其倒入水(2l)中。收集析出的固体,然后在真空下干燥。而后通过快速柱色谱纯化,用pe:ea(20:1)其后用dcm洗脱,得到17mg黄色固体4-(6-硝基吡啶-3-基)哌嗪-1-羧酸叔丁酯(37%收率)。ms:[m+h]+309步骤2:4-(6-氨基吡啶-3-基)哌嗪-1-羧酸叔丁酯用氮气吹扫500-ml瓶,并加入4-(6-硝基吡啶-3-基)哌嗪-1-羧酸叔丁酯(3.1g,10mmol)、10%钯/碳(50%湿度,1g)和乙醇(100ml)。对瓶抽真空,充入氢气,并在室温下搅拌16h。然后抽除氢气并将氮气充入瓶中。通过celite垫过滤除去催化剂,然后在减压下浓缩滤液得到4-(6-氨基吡啶-3-基)哌嗪-1-羧酸叔丁酯(2.7g,97%)。ms:[m+h]+279步骤3:向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中加入1,4-二噁烷(50ml)、按照us7456168制得的4-(6-氨基吡啶-3-基)哌嗪-1-羧酸叔丁酯(1.3g,4.7mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.24g,4.7mmol)和碳酸铯(3.8g,12mmol)。在持续30min使氮气鼓泡经过所得的溶液后,加入xantphos(272mg,0.47mmol)和三(二亚苄基丙酮)二钯(0)(430mg,0.47mmol),并在回流下加热反应混合物3h。此后,使反应冷却至室温,在乙酸乙酯(100ml)和水(100ml)之间分配,然后过滤。分离水层,并用乙酸乙酯(2×50ml)萃取。合并有机层,并用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过快速柱色谱纯化残余物,用dcm:meoh(50:1)洗脱,得到210a(1.3g,59%)。ms:[m+h]+464。实施例210b5-溴-1-甲基-3-[5-(哌嗪-1-基)-吡啶-2-基氨基]-1h-吡啶-2-酮210b使化合物210a(3.6g,7.8mmol)悬浮于4.0mhcl/二噁烷(10ml)中。在室温下搅拌反应混合物5h,然后在减压下浓缩。用1.0mnaoh水溶液碱化期望的产物,并用二氯甲烷萃取。用h2o洗涤合并的有机层,然后在减压下浓缩得到2.46g的210b,87%收率。ms:[m+h]+364。实施例210c5-溴-1-甲基-3-[5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基]-1h-吡啶-2-酮210c将210b(2.75g,7.5mmol)、氧杂环丁烷-3-酮(1.6g,22.7mmol)、nabh3cn(4.75g,22.5mmol)和氯化锌(3g,22.7mmol)在甲醇(125ml)中的混合物在50℃下搅拌5小时。将混合物加入到水中,并用二氯甲烷萃取3次。在减压下浓缩有机层。用二氯甲烷:甲醇=25:1洗脱通过柱色谱纯化残余物得到210c(1.92g,61%)。ms:[m+h]+420。1hnmr(500mhz,dmso)δ8.58(d,j=2.5,1h),8.55(s,1h),7.94(d,j=3,1h),7.54(d,j=2.5,1h),7.39(dd,j=3,1h),7.25(d,j=4,1h),4.56(t,j=6.5,2h),4.46(t,j=6.5,2h),3.50(s,3h),3.43(m,1h),3.01(m,4h),2.40(m,4h)。实施例210d2-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯210d向配有磁力搅拌器的250-ml单颈圆底烧瓶中加入197d(3.8g,8.65mmol)、双(频哪醇)联硼酸酯(11g,43.25mmol)、pd(dppf)cl2(0.4g,0.5mmol)、koac(2.5g,26mmol)和1,4-二噁烷(150ml)。对系统抽真空而后再充入n2。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物15h。然后冷却至室温并过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用5:1石油醚/乙酸乙酯洗脱,得到77%收率(3.2g)的黄色固体210d。ms:[m+h]+483。实施例210e5-氟-2-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯210e向密封管中加入210d(337mg,0.7mmol)、210c(294mg,0.7mmol)、pd(dppf)cl2(33mg,0.04mmol)、k3po4.3h2o(372mg,1.4mmol)和naoac(115mg,1.4mmol)在20mlch3cn中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后冷却至室温并过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1dcm/meoh洗脱,得到54%收率(263mg)的黄色固体210e。ms:[m+h]+696。在室温下,向210e(250mg,0.36mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(87mg,3.6mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20ml水,并用乙酸乙酯(30mlx3)萃取。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体210(134mg,57%收率)。lcms:[m+h]+654。1hnmr(500mhz,meod)δ8.53(d,j=2.5,1h),7.93(d,j=3,1h),7.42(dd,j=3,1h),7.34(d,j=2.5,1h),7.23(s,1h),7.21(s,1h),7.03(d,j=4.5,1h),6.72(s,1h),4.73(t,j=2,2h),4.64(t,j=1.5,2h),4.51(m,2h),4.21(s,3h),4.03(m,1h),3.71(s,3h),3.57(m,1h),3.17(t,j=4.5,4h),2.65(m,2h),2.55(m,6h),1.90(m,2h),1.79(m,2h)实施例2115-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮211实施例211a{4-氟-2-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯211a按照实施例148h,使400mg的(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b和336mg的5-溴-1-甲基-3-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮210c反应得到黄色固体211a(319mg,56%)。lcms:(m+h)+713按照实施例148,将270mg的211a转化成白色固体211(120mg,48%)。lcms:[m+h]+671。1hnmr(500mhz,dmso)δ8.56(s,1h),8.39(s,1h),7.87(s,1h),7.38-7.16(m,5h),4.8(s,1h),4.56(t,j=6.52h),4.46(t,j=6.5,2h),4.33(s,1h),4.05(m,1h),3.87(m,1h),3.58(s,3h),3.43(t,j=6,2h),3.06(m,4h),2.88-2.78(m,4h),2.38(t,j=5,1h),1.79(m,4h)。实施例2125-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮212实施例212a2-溴-4-氟-6-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯212a将104e(3g,14.5mmol)、2,6-二溴-4-氟苄基乙酸酯197c(14g,43.5mmol)、xantphos(839mg,1.45mmol)、pd2(dba)3(1.33g,1.45mmol)和cs2co3(9.4g,29mmol)在二噁烷(200ml)中的溶液在氮气下在100℃下加热15h。过滤后,在真空中蒸发滤液,通过快速柱色谱纯化,用乙酸乙酯/石油醚(1:1)洗脱,得到黄色固体212a(5g,收率77%)。lcms:(m+h)+452。1hnmr(500mhz,dmso)δ7.71(dd,j=2.5,1h),7.51(dd,j=3,1h),5.04(m,1h),4.10(m,1h),3.68(m,1h),2.86(m,2h),2.77(m,2h),2.55(m,3h),1.98(s,3h),1.78(m,4h)实施例212b2-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-4-氟-6-(1-氧代-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-2(1h)-基)苄基乙酸酯212b向212a(3g,6.65mmol),4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂环戊硼烷)(10g,40mmol)在二噁烷(160ml)中的溶液中加入pdcl2(dppf)(543mg,0.66mmol)和ch3cook(3.9g,40mmol)。在氩气氛下在100°下搅拌混合物15h。过滤混合物,在真空中蒸发,并通过快速柱色谱纯化,用乙酸乙酯/石油醚(1:2)洗脱,得到黄色固体212b(2.5g,收率76%)。lcms:(m+h)+500实施例212c[4-氟-2-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯212c向25ml密封管中加入212b(990mg,2mmol)、5-溴-1-甲基-3-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮198e(500mg,1.3mmol)、ch3coona(220mg,2.6mmol)、k3po4(700mg,2.6mmol)和pdcl2(dppf)(110mg,0.13mmol),使它们悬浮于ch3cn(25ml)和水(1ml)中。在110℃下加热混合物2小时。蒸发,并通过硅胶柱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到褐色固体212c(500mg,56%)。lcms:[m+h]+670向212c(500mg,0.75mmol)在丙-2-醇(8ml)、四氢呋喃(8ml)和水(1.5ml)中的溶液中加入lioh(964mg,40mmol)。在30℃下搅拌混合物2h。然后,加入20mlh2o,并用乙酸乙酯(3x30ml)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体212(200mg,48%)。lcms:[m+h]+629。1hnmr(500mhz,dmso-d6)δ8.56(d,j=2,1h),8.37(s,1h),7.85(d,j=2.5,1h),7.34(m,3h),7.19(m,2h),4.86(s,1h),4.32(s,2h),4.05(m,1h),3.87(m,1h),3.57(s,3h),3.02(m,4h),2.96(m,1h),2.87(m,1h),2.77(m,2h),2.54(m,1h),2.43(m,4h),2.19(s,3h),1.79(m,4h)。实施例2132-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮213实施例213a4-氟-2-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯213a按照实施例148b,使482mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d和350mg5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)吡啶-2(1h)-酮172a反应得到黄色固体213a(324mg,52%)。ms:[m+h]+625按照对148所述的方法,以220mg的213a为原料,获得白色固体化合物213(82mg,40%)。ms:[m+h]+583。1hnmr(500mhz,cdcl3)δ8.64(d,j=2.0,1h),8.13(d,j=2.5,1h),7.89(s,1h),7.58(m,1h),7.50(d,j=2.5,1h),7.16(dd,j=9.0,1h),6.96(dd,j=8.5,1h),6.86(s,1h),6.83(d,j=8.5,1h),4.55(d,j=11.5,1h),4.40(s,1h),4.30(s,1h),4.16(m,2h),3.91(m,1h),3.72(m,5h),3.60(m,1h),3.14(t,j=7.0,2h),2.59(m,4h),2.38(s,3h),1.90-1.79(m,5h)。实施例2142-(5-氟-2-(羟甲基)-3-(4-甲基-6-(4-(1-(氧杂环丁烷-3-基)哌啶-4-基)苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮214实施例214a5-溴-1-甲基-3-(4-(哌啶-4-基)苯基氨基)吡嗪-2(1h)-酮214a除了使用4-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)哌啶-1-羧酸叔丁酯(121a)(0.53g,1.08mmol)、三氟乙酸(0.9ml,10.8mmol)和二氯甲烷(20ml)之外,利用与121c相同的方法合成化合物214a。经后处理和浓缩得到定量收率的黄色油状物214a(390mg),未经纯化用于下一步骤。实施例214b5-溴-1-甲基-3-(4-(1-(氧杂环丁烷-3-基)哌啶-4-基)苯基氨基)-吡嗪-2(1h)-酮214b用氮气吹扫配有磁力搅拌器的100-ml密封管,并加入214a(390mg,1.08mmol)、氧杂环丁烷-3-酮(800mg,11mmol)和甲醇(10ml)。加入氰基硼氢化钠(208mg,3.3mmol)和氯化锌(225mg,1.65mmol)在甲醇(10ml)中的悬浮液,并在48℃下加热反应12小时。此后,浓缩反应混合物,然后使残余物在乙酸乙酯(50ml)和10%碳酸钾水溶液(10ml)之间分配。用乙酸乙酯(3×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)纯化所得的残余物得到60%收率(270mg)的黄色固体5-溴-1-甲基-3-(4-(1-(氧杂环丁烷-3-基)哌啶-4-基)苯基氨基)吡嗪-2(1h)-酮(214b):ms(esi+)m/z421.2(m+h)。实施例214c4-氟-2-(4-甲基-6-(4-(1-(氧杂环丁烷-3-基)哌啶-4-基)苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯214c按照实施例121b,将4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(217mg,0.45mmol)、214b(158mg,0.375mmol)、1m碳酸钠溶液(1.5ml,1.5mmol)、四(三苯基膦)钯(0)(22mg,0.019mmol)和1,2-二甲氧基乙烷(3.5ml)在微波反应器中在130℃下加热15分钟。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到62%收率(160mg)的褐色油状物214c:ms(esi+)m/z696.1(m+h)。除了使用thf(1ml)、水(0.5ml)和异丙醇(1ml)、214c(160mg,0.23mmol)和一水合氢氧化锂(80mg,2mmol)的混合物之外,利用与121相同的方法合成化合物214。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到34%收率(52mg)的黄色固体214:ms(esi+)m/z653.6(m+h)。实施例21510-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[4-(1-甲基氮杂环丁烷-3-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮215实施例215a10-[5-氟-2-(乙酰氧基甲基)-3-(4-甲基-6-{[4-(1-甲基氮杂环丁烷-3-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮215a向配有磁力搅拌器的44-ml密封管中加入298c(160mg,0.48mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-联-1,3,2-二氧杂环戊硼烷(180mg,0.71mmol)、乙酸钾(188mg,1.9mmol)和1,4-二噁烷(5ml)。在对混合物脱气30分钟后,加入pd(dppf)cl2·ch2cl2(39mg,0.048mmol)。在105℃下搅拌所得的反应混合物4h。然后,冷却至室温并通过celite垫过滤。浓缩滤液,然后将粗品混合物再溶于1,2-二甲氧基乙烷(2ml)中并转移到10-ml微波反应用容器中。向此溶液中加入10-[2-(乙酰氧基-甲基)-3-溴-5-氟苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮189a(172mg,0.38mmol)、pd(pph3)4(30mg,0.024mmol)和2nna2co3(2ml)。然后对反应混合物脱气5分钟并置于微波腔中。在125℃下搅拌反应混合物10min后,通过快速色谱(二氯甲烷:甲醇,3:1)纯化得到20%(49mg)的215a。向配有磁力搅拌棒的25-ml单颈圆底烧瓶中加入215a(49mg,0.077mmol)、lioh·h2o(16mg,0.38mmol)、thf(2ml)、异丙醇(2ml)和水(2ml)。在室温下搅拌反应混合物3h后,使其在二氯甲烷(5ml)和水(5ml)之间分配,并用二氯甲烷(3x5ml)萃取有机相。用水(2x5ml)和盐水(5ml)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)中。向此溶液中加入己烷(10ml),然后过滤所得的沉淀得到74%收率(34mg)的215。ms(esi+)m/z597.5(m+h)。实施例2162-(1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)-6-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)苄基磷酸酯二钠216实施例216a双(2-氰基乙基)2-(1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)-6-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)苄基磷酸酯216a向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶中加入105(850mg,1.61mmol)、1h-四唑(451mg,6.44mmol)和二氯甲烷(20ml)。在室温下加入双(2-氰基乙基)-n.n-二异丙基亚磷酰胺(1.31g,4.83mmol)在二氯甲烷(5ml)中的溶液,并在氮气氛下搅拌反应混合物3h。此后,将反应混合物冷却至0℃,滴加叔丁基过氧化氢在癸烷中的5.5m溶液(2.00ml,11.0mmol),并在氮气氛下在0℃下搅拌反应混合物3h。此后,将混合物在减压下浓缩至5ml的体积,并将所得的悬浮液加载于硅胶柱上,然后用90:10二氯甲烷/甲醇洗脱,得到39%收率(450mg)的白色半固体216a:1hnmr(500mhz,cdcl3)δ8.77(d,j=0.5hz,1h),8.73(d,j=2.0hz,1h),8.36(d,j=5.5hz,1h),8.17(s,1h),7.55(t,j=7.5hz,1h),7.38–7.35(m,2h),7.09(d,j=2.0hz,1h),6.76(dd,j=6.0,1.5hz,1h),5.21–5.14(m,2h),4.15–4.04(m,5h),3.86–3.83(m,1h),3.72(s,3h),3.21–3.18(m,1h),2.90–2.82(m,1h),2.79(d,j=3.5hz,2h),2.63–2.48(m,6h),1.28(s,3h),1.27(s,3h);ms(esi+)m/z714.2(m+h)。实施例216b2-(1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢吡啶-3-基)-6-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)苄基磷酸酯二铵216b向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶中加入216a(450mg,0.631mmol)和乙腈(8ml),然后将混合物冷却至0℃。加入三乙胺(4ml),而后加入双三甲基甲硅烷基三氟乙酰胺(4ml),并在室温下搅拌混合物40h。此后,在减压下浓缩混合物,然后通过快速色谱(硅胶,40:20:40氯仿/甲醇/氨)纯化所得的残余物得到52%收率(210mg)的非结晶黄色固体216b:mp260–262℃d;1hnmr(500mhz,dmso-d6)δ9.12(s,1h),8.66(s,1h),8.62(d,j=2.0hz,1h),8.27(d,j=4.0hz,1h),7.54(s,1h),7.43(t,j=7.5hz,1h),7.32–7.27(m,3h),7.15(brs,2h),4.69(d,j=9.0hz,1h),4.46(d,j=7.0hz,1h),3.87–3.83(m,3h),3.57(s,3h),3.36–3.17(brs,8h),2.77–2.63(m,3h),1.23(s,3h),1.21(s,3h);ms(esi+)m/z608.2(m+hforc29h30n5o6ps)。向配有磁力搅拌器的200-ml单颈圆底烧瓶中加入216b(210mg,0.327mmol)、甲醇(10ml)和水(5ml)。在室温下0.1m氢氧化钠水溶液(6.50ml,0.65mmol),并搅拌混合物30min。此后,在减压下浓缩混合物,然后在真空下在45℃下干燥14h得到92%收率(197mg)的非结晶黄色固体216:mp256–258℃dec;1hnmr(500mhz,dmso-d6/d2o(15:1))δ8.65(s,1h),8.63(d,j=1.5hz,1h),8.28(d,j=6.0hz,1h),8.09(d,j=1.5hz,1h),7.47(t,j=7.5hz,1h),7.38(d,j=7.5hz,1h),7.24(d,j=7.5hz,1h),7.16(d,j=6.0hz,1h),4.72(d,j=9.5hz,1h),4.45(d,j=8.0hz,1h),4.23–4.21(m,1h),3.83–3.78(m,1h),3.71(s,3h),3.48–3.41(m,1h),2.78–2.73(m,3h),2.59–2.49(m,2h),1.23(s,3h),1.22(s,3h);ms(esi+)m/z608.2(m+hforc29h30n5o6ps)。实施例2175-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-3-(5-(4-(2-氟乙基)哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮217实施例217a1-(6-硝基吡啶-3-基)哌嗪217a向配有磁力搅拌器和回流冷凝管的250-ml三颈圆底烧瓶中加入2-硝基-5-溴吡啶(5.00g,24.6mmol)、哌嗪(5.66g,65.7mmol)和乙腈(70ml)。在回流下加热反应混合物20h。此后,将反应混合物冷却至室温,然后在减压下浓缩。用乙酸乙酯(200ml)稀释残余物,然后用饱和碳酸氢钠水溶液(100ml)洗涤。用硫酸钠干燥有机层,过滤,然后在减压下浓缩。用己烷/乙酸乙酯(1:1,30ml)使所得的残余物成粉末,得到41%收率(2.10g)的黄色固体217a:mp113–115℃;1hnmr(500mhz,dmso-d6)δ8.23(d,1h,j=3.5hz),8.13(d,1h,j=9.0hz),7.44(dd,1h,j=9.0,3.5hz),3.41(t,4h,j=5.0hz),2.82(t,4h,j=5.0hz),1.90(s,1h);ms(esi+)m/z209.1(m+h)。实施例217b1-(2-氟乙基)-4-(6-硝基吡啶-3-基)哌嗪217b向配有磁力搅拌器、回流冷凝管和氮气入口的250-ml单颈圆底烧瓶中加入217a(598mg,2.87mmol)、1-溴-2-氟乙烷(1.09g,8.61mmol)、碳酸钾(1.19g,8.61mmol)、thf(10ml)和dmf(10ml)。在氮气氛下在85℃下加热反应混合物14h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,95:5二氯甲烷/甲醇)纯化所得的残余物得到63%收率(460mg)的黄色半固体217b:1hnmr(500mhz,cdcl3)δ8.16(d,j=9.0hz,1h),8.14(d,j=3.0hz,1h),7.21(dd,j=9.0,2.0hz,1h),4.67(t,j=5.0hz,1h),4.57(t,j=5.0hz,1h),3.49(t,j=5.0hz,4h),2.81(t,j=5.0hz,1h),2.75(t,j=5.0hz,1h),2.73(t,j=5.5hz,4h);ms(esi+)m/z255.1(m+h)。实施例217c5-(4-(2-氟乙基)哌嗪-1-基)吡啶-2-胺217c用氮气吹扫250-mlparr反应瓶,并加入10%钯/碳(50%湿度,75mg干重)和217b(455mg,1.79mmol)在乙醇(20ml)中的溶液。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi并振摇3h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(3.50g),然后通过celite521垫过滤混合物。用乙醇(2×50ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干得到定量收率的黄色半固体217c(425mg):1hnmr(500mhz,cdcl3)δ7.75(d,j=3.0hz,1h),7.20(dd,j=9.0,3.0hz,1h),6.51(d,j=8.5hz,1h),4.66(t,j=5.0hz,1h),4.56(t,j=5.0hz,1h),4.35–4.15(brs,2h),3.08(t,j=5.0hz,4h),2.79(t,j=5.0hz,1h),2.74(t,j=4.5hz,1h),2.71(t,j=5.0hz,4h);ms(esi+)m/z225.1(m+h)。实施例217d5-溴-3-(5-(4-(2-氟乙基)哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮217d向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入217c(402mg,1.79mmol)、3,5-二溴-1-甲基-吡啶-2(1h)-酮(478mg,1.79mmol)、碳酸铯(1.75g,5.37mmol)和1,4-二噁烷(15ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xantphos(93mg,0.161mmol)和三(二亚苄基丙酮)二钯(0)(82mg,0.090mmol)。将回流冷凝管连接到烧瓶,然后在100℃下加热反应混合物3h。此后,将混合物冷却至室温,并用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释,然后分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,用盐水洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,95:5二氯甲烷/甲醇)纯化所得的残余物得到62%收率(459mg)的非结晶黄色固体217d:mp141–143℃;1hnmr(500mhz,cdcl3)δ8.57(d,j=2.0hz,1h),7.99(d,j=3.0hz,1h),7.74(s,1h),7.24(d,j=3.0hz,1h),6.93(d,j=2.0hz,1h),6.76(d,j=9.0hz,1h),4.67(t,j=5.0hz,1h),4.57(t,j=5.0hz,1h),3.59(s,3h),3.16(t,j=5.0hz,4h),2.80(t,j=5.0hz,1h),2.75(t,j=5.0hz,1h),2.73(t,j=5.5hz,4h);ms(esi+)m/z410.1(m+h)向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入217d(177mg,0.431mmol)、182c(315mg,0.539mmol)、碳酸钠(100mg,0.862mmol)、水(2ml)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(100mg,0.086mmol)。将回流冷凝管连接到烧瓶,并在90℃下加热反应混合物1h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,将所得的残余物溶于thf的混合物中。加入1.0m四丁基氟化铵/thf溶液(1.10ml,1.10mmol),并在室温下搅拌混合物3h。此后,用90:10二氯甲烷/甲醇(75ml)和水(50ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,95:5二氯甲烷/甲醇)纯化所得的残余物得到25%收率(73mg)的非结晶黄色固体217:mp158–160℃;1hnmr(500mhz,dmso-d6)δ8.55(d,j=2.0hz,1h),8.35(s,1h),7.86(d,j=3.0hz,1h),7.37–7.31(m,3h),7.22(d,j=9.0hz,1h),7.17(dd,j=9.5,3.0hz,1h),4.85(t,j=4.0hz,1h),4.61(t,j=5.0hz,1h),4.51(t,j=5.0hz,1h),4.35–4.30(m,2h),4.08–4.02(m,1h),3.87–3.82(m,1h),3.58(s,3h),3.05–2.99(m,5h),2.91–2.87(m,1h),2.75(s,2h),2.68(t,j=5.0hz,1h),2.62(t,j=4.5hz,1h),2.57–2.53(m,4h),2.52(d,j=4.5hz,2h),1.23(s,6h);ms(esi+)m/z675.3(m+h)。实施例2185-(3-{5-[(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-5-氟-2-(羟甲基)苯基)-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮218实施例218a(2-{5-[(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯218a向25ml密封管中加入(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯(212b)(893mg,1.8mmol)、5-溴-3-(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1-甲基吡啶-2(1h)-酮(500mg,1.4mmol)、ch3coona(226mg,2.75mmol)、k3po4(733mg,2.75mmol)、pdcl2(dppf)(112mg,0.14mmol),使它们悬浮于ch3cn(25ml)和h2o(1ml)中。在110℃下搅拌混合物2小时。在反应后,蒸发溶剂,然后用20:1二氯甲烷/甲醇洗脱通过硅胶柱纯化残余物得到褐色固体218a(400mg,44%)。ms:(m+h)+656。向218a(350mg,0.53mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.28g,53mmol)。在30℃下搅拌混合物2h。在反应后,蒸发混合物,然后通过制备型hplc纯化残余物得到黄色固体218(124mg,38%)。ms:(m+h)+614。1hnmr(500mhz,dmso)δ1.06-1.09(t,j=7.5hz,3h),1.80(s,4h),2.55-2.58(m,2h),2.67-2.68(d,2h),2.74-2.79(d,4h),2.85-2.98(m,2h),3.43(s,2h),3.60(s,3h),3.87-3.89(m,1h),4.05-4.07(m,1h),4.37-4.38(d,2h),4.87-4.89(t,j=4.5hz,1h),7.07-7.09(d,1h),7.19-7.21(m,1h),7.29-7.34(m,2h),7.45-7.46(d,1h),8.46(s,1h),8.79-8.80(d,1h)。实施例2195-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮219实施例219a5-溴-1-甲基-3-(6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮219a将5-溴-1-甲基-3-(5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮盐酸盐205a(800mg,2.16mmol)、氧杂环丁烷-3-酮(778mg,10.8mmol)、nabh3cn(681mg,10.8mmol)和氯化锌(1.47g,10.8mmol)在甲醇(30ml)中的混合物在50℃下搅拌4小时。将混合物加入到h2o(30ml)中,然后用dcm(50ml×3)萃取。在减压下浓缩有机层。通过柱色谱纯化残余物,用10:1乙酸乙酯/甲醇洗脱,得到黄色固体219a(750mg,89%)。ms:[m+h]+391。实施例219b[4-氟-2-(1-甲基-5-{[6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯219b向25ml密封管中加入(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b(512mg,1.0mmol)、219a(400mg,1.0mmol)、ch3coona(168mg,2.0mmol)、k3po4(546mg,2.0mmol)和pdcl2(dppf)(84mg,0.1mmol),使它们悬浮于ch3cn(25ml)和h2o(1ml)中。在110℃下搅拌混合物2小时。在反应后,蒸发混合物,通过柱色谱纯化残余物,用10:1二氯甲烷/甲醇洗脱,得到褐色固体219b(450mg,64%)。ms:(m+h)+684。向219b(400mg,0.58mmol)在丙-2-醇(12ml)、四氢呋喃(12ml)和水(2ml)中的溶液中加入lioh(1.4g,58mmol)。在30℃下搅拌混合物2h。在反应后,蒸发混合物,然后通过制备型hplc纯化残余物得到黄色固体219(213mg,57%)。ms:(m+h)+642。1hnmr(500mhz,dmso)δ1.80(s,4h),2.55-2.58(m,3h),2.77-2.79(d,4h),2.85-2.89(m,1h),2.96-2.98(m,1h),3.36(s,2h),3.60-3.61(d,4h),3.87-3.89(m,1h),4.05-4.07(m,1h),4.37-4.38(d,2h),4.50-4.52(t,j=5hz,2h),4.59-4.62(t,j=6.5hz,2h),4.87-4.90(t,j=4hz,2h),7.08-7.10(d,1h),7.19-7.21(m,1h),7.29-7.34(m,2h),7.45-7.46(d,1h),8.46(s,1h),8.79-8.80(d,1h)。实施例2205-[5-氟-2-(羟甲基)-3-[1-甲基-6-氧代-5-({5-[4-(丙烷-2-基)哌嗪-1-基]吡啶-2-基}氨基)-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮220实施例220a5-溴-3-(5-(4-异丙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮220a将5-溴-1-甲基-3-(5-(哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮188d(1.2g,3.3mmol)和丙酮(1.0g,16.5mmol)在甲醇/乙酸(30ml/3ml)中的混合物在室温下搅拌5分钟,然后加入nabh(oac)3(3.5g,16.5mmol)。在50℃下搅拌混合物2h。将其冷却至室温,并加入h2o(50ml)。用dcm(50ml)萃取混合物3次。在减压下浓缩有机层,通过柱色谱纯化残余物,用25:1dcm/甲醇洗脱,得到220a(2.97g,81%)。ms:[m+h]+406。1hnmr(500mhz,dmso)δ8.58(d,j=3.0,1h),8.53(s,1h),7.92(d,j=3.0,1h),7.44(d,j=2.5,1h),7.37(d,j=2.5,1h),7.25(d,j=8,1h),3.51(s,3h),3.06(t,j=4.5,4h),2.69(s,1h),2.57-2.50(m,4h),1.00(d,j=7,6h)。实施例220b{4-氟-2-[1-甲基-6-氧代-5-({5-[4-(丙烷-2-基)哌嗪-1-基]吡啶-2-基}氨基)-1,6-二氢吡啶-3-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯220b按照对148b所述的方法,以400mg的(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b和340mg5-溴-3-(5-(4-异丙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮220a为原料,获得化合物黄色固体220b(446mg,82%)。ms:[m+h]+699按照对148所述的方法,以200mg的220b为原料,获得白色固体化合物220(70mg,37%)。ms:[m+h]+657。1hnmr(500mhz,dmso)δ8.56(d,j=2.5,1h),8.37(s,1h),7.85(d,j=2.5,1h),7.34(m,3h),7.23(m,2h),4.68(s,1h),4.32(s,2h),4.06(s,1h),3.85(s,1h),3.58(s,3h),3.02(s,4h),2.78(m,4h),2.55(m,7h),1.80(d,j=3.5,4h),1.00(d,j=7,6h)。实施例2215-[5-氟-2-(羟甲基)-3-{4-甲基-6-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮221实施例221a5-溴-1-甲基-3-(1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮221a向6-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯120a(3.6g,8.3mmol)在二噁烷(10ml)中的溶液中滴加氯化氢/二噁烷的饱和溶液(20ml)。搅拌反应混合物20分钟,然后在减压下浓缩得到221a,未经进一步纯化用于下一步骤。lc/ms:m/z336(m+h)+实施例221b5-溴-1-甲基-3-(2-甲基-1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮221b将221a(2.75g,7.5mmol)、甲醛(37%h2o溶液,30ml,375mmol)、nabh(oac)3(4.75g,22.5mmol)和acoh(25ml,150mmol)在甲醇(125ml)中的混合物在室温下搅拌4小时。然后用饱和naoh溶液使混合物处于碱性条件,然后用乙酸乙酯萃取。用na2so4干燥有机层,然后在减压下蒸发。通过柱色谱纯化残余物,用4:1乙酸乙酯/甲醇洗脱,得到221b(0.9g,34.4%)lc/ms:m/z350(m+h)+实施例221c(4-氟-2-{4-甲基-6-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯221c向配有磁力搅拌器的15ml微波用小瓶中加入5-溴-1-甲基-3-(2-甲基-1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮(0.42g,1.2mmol)、212b(0.6g,1.2mmol)、磷酸钾(0.64g,2.4mmol)、乙酸钠(0.2g,2.4mmol)、乙腈(10ml)、水(1ml)和1,1'-双(二苯基膦)二茂铁二氯化钯(ii)二氯甲烷(0.1g,0.12mmol)。在氩气氛下在110℃下加热反应混合物2小时。此后,将混合物冷却至室温,然后过滤。在减压下浓缩滤液,通过柱色谱纯化残余物,用40:1dmc/甲醇洗脱,得到221c(0.667g,86.6%)。lc/ms:m/z642(m+h)+向配有磁力搅拌器的25ml圆底烧瓶中加入221c(0.647g,1.0mmol)、lioh(2.1g,50mmol)、thf(10ml)、异丙醇(10ml)和水(5ml)。在室温下搅拌反应混合物30分钟,然后过滤。在减压下浓缩滤液。通过制备型hplc纯化残余物得到221。lc/ms:m/z600(m+h)+。1hnmr(500mhz,dmso)δ9.13(s,1h),7.80(s,1h),7.62(d,j=8.5,1h),7.51(s,1h),7.39(d,j=10,1h),7.30(d,j=6.5,,1h),6.97(d,j=8.5,1h),4.86(m,1h),44.51(m,3h),4.41(m,1h),4.05(m,1h),3.87(m,1h),3.55(m,6h),2.77(m,3h),2.55(m,3h),2.31(m,3h),1.80(m,4h)。实施例2225-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮222实施例222a5-溴-1-甲基-3-(2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮222a将5-溴-1-甲基-3-(1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮221a(2.75g,7.5mmol)、氧杂环丁烷-3-酮(2.5g,37.5mmol)、nabh3cn(4.75g,22.5mmol)和氯化锌(5g,37.5mmol)在甲醇(125ml)中的混合物在室温下搅拌4小时。过滤混合物,然后在减压下浓缩滤液。通过柱色谱纯化残余物,用20:1dcm/甲醇洗脱,得到222a(0.76g,25.9%)。lc/ms:m/z392(m+h)+实施例222b[4-氟-2-(4-甲基-6-{[2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯222b向配有磁力搅拌器的250ml圆底烧瓶中加入222a(0.31g,0.8mmol)、(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b(0.4g,0.8mmol)、磷酸钾(0.43g,1.6mmol)、乙酸钠(0.13g,1.6mmol)、乙腈(30ml)、水(2ml)和1,1'-双(二苯基膦)二茂铁氯化钯(ii)二氯甲烷(0.07g,0.08mmol)。使反应混合物在氩气氛下过夜回流。此后,将混合物冷却至室温,然后过滤。在减压下浓缩滤液。通过柱色谱纯化残余物,用40:1二氯甲烷/甲醇洗脱,得到222b(0.491g,89.3%)。lc/ms:m/z684(m+h)+向配有磁力搅拌器的25ml圆底烧瓶中加入222b(0.471g,0.69mmol)、lioh(1.45g,34.5mmol)、thf(10ml)、异丙醇(10ml)和水(5ml)。在室温下搅拌反应混合物30分钟,然后过滤。在减压下浓缩滤液。通过制备型hplc纯化残余物得到白色固体222(20mg,11%)。lc/ms:m/z642(m+h)+。1hnmr(500mhz,dmso)δ9.14(s,1h),7.82(s,1h),7.63(d,j=8.5,1h),7.51(s,1h),7.39(d,j=10,1h),7.30(d,j=6.5,,1h),6.97(d,j=8.5,1h),4.86(m,1h),4.84(m,2h),4.51(m,3h),4.41(m,1h),4.05(m,1h),3.87(m,1h),3.55(m,5h),2.88(m,1h),2.77(m,1h),2.53(m,4h),1.80(m,4h),1.23(m,2h)。实施例2235-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮223实施例223a(4-氟-2-{1-甲基-5-[(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯223a按照对136e所述的方法,以5-溴-1-甲基-3-(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮205b和(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b为原料,获得50%收率的化合物223a。按照对化合物136f所述的方法,以223a为原料,获得33%收率的化合物223。lcms:(m+h)+600。1hnmr(500mhz,meod)δ8.87(d,j=2,1h),7.40(d,j=2.5,1h),7.35(d,j=8,1h),7.23(s,1h),7.21(s,1h),6.88(d,j=8,1h),4.56(m,2h),4.16(m,1h),4.01(m,1h),3.72(s,3h),3.57(s,2h),3.05(m,1h),2.95(m,3h),2.84(m,4h),2.59(m,2h),2.49(s,3h),1.90(m,4h)。实施例22410-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(5-{[甲基(丙烷-2-基)氨基]甲基}吡啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮224实施例224a10-[5-氟-2-(乙酰氧基甲基)-3-{1-甲基-5-[(5-{[甲基(丙烷-2-基)氨基]甲基}吡啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮224a按照实施例186f,使186e(365mg,0.64mmol)和189(230mg,0.51mmol)反应得到224a(80mg,20%收率)。按照实施例186,使224a(80mg,0.12mmol)、1nlioh(0.61ml)、thf(2ml)和异丙醇(2ml)反应,然后用etoac使其成粉末,得到224(57mg,76%收率)。ms(esi+)m/z613.6(m+h)。实施例2252-(2-(羟甲基)-3-(1-甲基-5-(5-甲基-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮225利用与对118所述相同的通用方法,使112a(200mg,0.706mmol)和118f(330mg,0.710mmol)反应得到17%收率(60mg)的黄绿色固体225:mp199–200℃;1hnmr(500mhz,dmso-d6)δ11.69(s,1h),7.99(s,1h),7.93(s,1h),7.41(t,1h,j=8.0hz),7.25(d,3h,j=8.5hz),6.00(s,1h),5.86(s,1h),4.69(brs,1h),4.31(m,2h),3.97(m,1h),3.91(m,1h),3.79(m,2h),3.56(s,3h),3.01(m,1h),2.90(m,1h),2.70(m,2h),2.15(s,3h),1.90(m,2h),1.74(m,2h);ms(esi+)m/z499.2(m+h)。实施例2262-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(5,6,7,8-四氢-2,6-萘啶-3-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮226实施例226a7-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-3,4-二氢-2,6-萘啶-2(1h)-羧酸叔丁酯226a向配有磁力搅拌器、氮气入口和回流冷凝管的100-ml三颈圆底烧瓶中加入3,5-二溴-1-甲基吡啶-2(1h)-酮(536mg,2.01mmol)、7-氨基-3,4-二氢-2,6-萘啶-2(1h)-羧酸叔丁酯(500mg,2.01mmol)、碳酸铯(1.44g,4.40mmol)和1,4-二噁烷(30ml)。在持续20分钟使氮气鼓泡经过所得的混合物后,加入xantphos(98.4mg,0.170mmol)和三(二亚苄基丙酮)二钯(0)(91.6mg,0.100mmol),并在100℃下加热反应混合物6h。此后,使反应冷却至室温,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到96%收率(840mg)的黄色固体226a:mp126–128℃;1hnmr(500mhz,cdcl3)8.60(d,1h,j=2.5hz),8.10(s,1h),7.79(s,1h),6.95(d,1h,j=2.5hz),6.55(s,1h),4.53(s,2h),3.64(t,2h,j=5.0hz),3.59(s,3h),2.77(t,2h,j=5.0hz),1.49(s,9h);ms(esi+)m/z435.0(m+h)。实施例226b5-溴-1-甲基-3-(5,6,7,8-四氢-2,6-萘啶-3-基氨基)吡啶-2(1h)-酮226b用氮气吹扫配有磁力搅拌器的50-ml单颈圆底烧瓶,并加入226a(840mg,1.94mmol)和二氯甲烷(12ml)。加入三氟乙酸(6ml)。在室温下搅拌反应2h。此后,在减压下蒸发反应混合物。残余物226b直接用于下一步骤。向配有磁力搅拌器和回流冷凝管的100-ml三颈圆底烧瓶中加入1/2量的如上制得的粗品226b(假定0.898mmol)、118f(416mg,0.898mmol)、碳酸钠(381mg,3.59mmol)、水(4ml)和1,4-二噁烷(20ml)。在持续20min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(104mg,0.090mmol),并在100℃下加热反应混合物4h。此后,使反应混合物冷却至室温,过滤,然后用甲醇和二氯甲烷的1:10混合物(30ml)洗涤滤饼。在减压下浓缩滤液得到褐色残余物。向另一个配有磁力搅拌器和回流冷凝管的50-ml单颈圆底烧瓶中加入如上获得的残余物、thf(10ml)、乙醇(10ml)、水(10ml)和氢氧化锂(86.0mg,3.59mmol)。在50℃下搅拌混合物2h。此后,在减压下浓缩反应混合物。通过快速色谱法纯化所得的残余物得到7.7%(38mg)收率的灰白色固体226:mp197–199℃;1hnmr(500mhz,dmso-d6)δ8.53(d,1h,j=2.0hz),8.23(s,1h),7.90(s,1h),7.43(t,1h,j=7.5hz),7.35(d,1h,j=2.0hz),7.28(s,1h),7.27(s,1h),6.93(s,1h),6.00(s,1h),4.72(t,1h,j=5.0hz),4.32(d,2h,j=5.0hz),3.96(m,1h),3.90(m,1h),3.82(m,2h),3.75(s,2h),3.58(s,3h),3.00(m,1h),2.94(m,1h),2.90(t,2h,j=5.0hz),2.70(m,2h),2.56(m,2h),1.92(m,2h),1.76(m,2h);ms(esi+)m/z551.2(m+h)。实施例2272-(3-(5-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮227向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入155n(312mg,0.931mmol)、118f(472mg,1.12mmol)、碳酸钠(296mg,2.79mmol)、dmf(2ml)、水(2ml)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(215mg,0.186mmol)。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物14h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后将所得的残余物溶于thf(5ml)、水(5ml)和甲醇(5ml)的混合物中。加入一水合氢氧化锂(195mg,4.66mmol),并在室温下搅拌混合物3h。此后,用90:10二氯甲烷/甲醇(100ml)和水(50ml)稀释混合物,并分离各层。用90:10二氯甲烷/甲醇(2x75ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,90:10二氯甲烷/甲醇)纯化所得的残余物,得到7%收率(36mg)的非结晶灰白色固体227:mp227–229℃;1hnmr(500mhz,dmso-d6)8.66(d,j=1.5hz,1h),8.53(s,1h),8.11(s,1h),7.68(d,j=7.0hz,1h),7.44(t,j=8.0hz,1h),7.39(s,1h),7.29(m,3h),6.01(s,1h),4.72(t,j=4.5hz,1h),4.33(s,2h),3.99–3.88(m,3h),3.84–3.75(m,2h),3.59(m,3h),3.51(m,5h),3.02–2.91(m,2h),2.72(t,j=5.5hz,2h),1.92(t,j=5.0hz,2h),1.77–1.73(m,2h);ms(esi+)m/z551.2(m+h)。实施例2282-(2-(羟甲基)-3-(4-甲基-5-氧代-6-(1,2,3,4-四氢异喹啉-7-基氨基)-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮228利用与对226的制备所述相同的通用方法,使153a(400mg,1.19mmol)和118f(718mg,1.55mmol)反应而后水解得到12%收率(88mg)的白色固体228:mp218–220℃;1hnmr(500mhz,dmso-d6)δ9.03(s,1h),7.73(s,1h),7.63(dd,1h,j=7.5,2.0hz),7.52(dd,1h,j=7.5,2.0hz),7.43(t,2h,j=8.0hz),7.25(dd,1h,j=7.5,1.0hz),6.90(d,1h,j=8.0hz),6.00(s,1h),4.71(dd,1h,j=7.0,3.5hz),4.46(m,2h),3.94(m,2h),3.82(m,2h),3.77(s,2h),3.54(s,3h),3.00(m,1h),2.93(m,1h),2.90(t,2h,j=5.0hz),2.70(t,2h,j=6.0hz),2.62(t,2h,j=6.0hz),2.45(m,1h),1.92(m,2h),1.76(m,2h);ms(esi+)m/z551.2(m+h)。实施例2292-(2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基吡咯烷-2-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮229实施例229a5-溴-1-甲基-3-(5-(1-甲基吡咯烷-2-基)吡啶-2-基氨基)吡啶-2(1h)-酮229a利用与226b的所述制备相同的通用方法,使3,5-二溴-1-甲基吡啶-2(1h)-酮(1.51g,5.65mmol)和5-(1-甲基吡咯烷-2-基)-2-氨基吡啶(1.00g,5.65mmol)反应得到81%收率(1.65g)的黄色固体229a:mp143–145℃;1hnmr(300mhz,dmso-d6)δ8.73(s,1h),8.68(d,1h,j=2.4hz),8.15(d,1h,j=2.1hz),7.55(dd,1h,j=8.9,2.1hz),7.52(s,1h),7.30(d,1h,j=8.9hz),3.52(s,3h),3.13(t,1h,j=7.5hz),2.99(t,1h,j=7.5hz),2.19(m,1h),2.10(m,1h),2.05(s,3h),1.79(m,2h),1.71(m,1h);ms(esi+)m/z363.3(m+h)。利用与对226的制备所述相同的通用方法,使229a(500mg,1.38mmol)和118f(705mg,1.52mmol)反应而后水解得到27%收率(215mg)的白色固体229:mp146–148℃;1hnmr(500mhz,dmso-d6)δ8.67(dd,1h,j=2.0hz),8.52(s,1h),8.05(s,1h),7.53(dd,1h,j=8.5,2.5hz),7.44(t,1h,j=8.0hz),7.39(d,1h,j=2.5hz),7.29-7.24(m,3h),6.00(s,1h),4.72(t,1h,j=5.0hz),4.32(d,2h,j=5.0hz),3.99(m,1h),3.90(m,1h),3.81(m,2h),3.58(s,3h),3.11(t,1h,j=8.0hz),3.00(m,1h),2.93(m,2h),2.71(t,2h,j=6.0hz),2.17(q,1h,j=9.0hz),2.06(m,1h),2.03(s,3h),1.92(t,2h,j=6.0hz),1.83-1.72(m,4h),1.59(m,1h);ms(esi+)m/z579.2(m+h)。实施例23010-[3-(5-{[5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮230实施例230a2-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-4-氟-6-(9-氧代-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基)苄基乙酸酯230a按照实施例211d,将2-溴-4-氟-6-(9-氧代-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基)苄基乙酸酯189a(450mg,1.0mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(635mg,2.5mmol)、乙酸钾(393mg,4.0mmol)、双(二苯基膦)二茂铁]二氯化钯(ii)和ch2cl2的络合物(pdcl2dppf:ch2cl2(1:1),66mg,0.08mmol)和1,4-二噁烷(20ml)在100℃下加热5h。使反应混合物冷却至室温,然后通过celite521垫过滤。用乙酸乙酯(2×25ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干,得到黑色油状物化合物230a(定量收率),直接用于下一步骤。ms(esi+)m/z497.3(m+h)。实施例230b10-[3-(5-{[5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(乙酰氧基甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮230b除了使用化合物230a(223mg,0.45mmol)、3-(5-(氮杂环丁烷-1-基甲基)-1-甲基-1h-吡唑-3-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮(200c)(160mg,0.45mmol)、1m碳酸钠溶液(1.5ml,1.5mmol)、四(三苯基膦)钯(0)(26mg,0.022mmol)和1,2-二甲氧基乙烷(4.5ml)之外,利用与121b相同的方法合成实施例230b。在微波反应器中在130℃下加热反应混合物15分钟。经后处理和快速柱色谱(硅胶,9:1二氯甲烷/甲醇)得到43%收率(120mg)的褐色油状物化合物230b:ms(esi+)m/z643.1(m+h)。除了使用thf(1ml)、水(0.5ml)和异丙醇(1ml)的混合物之外,按照与121相同的方法,使化合物230b(120mg,0.2mmol)和一水合氢氧化锂(50mg,1.2mmol)反应。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到30%收率(36mg)的浅绿色化合物230:ms(esi+)m/z600.6(m+h)。实施例2312-(5-氟-2-(羟甲基)-3-(4-甲基-6-(2-甲基异吲哚啉-5-基氨基)-5-氧代-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮231实施例231a5-硝基异吲哚啉231a在0℃下向异吲哚啉(2g,16.8mmol)在98%h2so4(10ml)中的悬浮液滴加浓硝酸(2ml)和98%硫酸(2ml)的混合物。在0℃下搅拌混合物45分钟。然后将所得的黄色溶液倒入冰水中。通过过滤收集白色固体沉淀。用水(20ml×2)洗涤固体,然后在真空中干燥得到白色固体231a(700mg,51%)。ms:[m+h]+165。实施例231b5-硝基异吲哚啉-2-羧酸叔丁酯231b将5-硝基异吲哚啉(600mg,3.66mmol)和(boc)2o(1.6g,7.31mmol)在thf(30ml)中的混合物在室温下搅拌2h。然后在减压下浓缩所得的红色溶液,通过快速色谱纯化残余物,用5:1石油醚/乙酸乙酯洗脱,得到黄色固体231b(750mg,80%)。ms:[m+h]+209。实施例231c5-氨基异吲哚啉-2-羧酸叔丁酯231c向配有磁力搅拌器的100-ml单颈圆底烧瓶中加入5-硝基异吲哚啉-2-羧酸叔丁酯(650mg,2.5mmol)和c2h5oh(50ml)。将此溶液在室温下用pd/c(160mg)氢化15h。然后过滤,在减压下浓缩滤液得到黄色油状物231c(585mg,99%),未经进一步纯化用于下一步骤。ms:[m+h]+179。实施例231d5-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)异吲哚啉-2-羧酸叔丁酯231d按照对129a所述的方法,以600mg的5-氨基异吲哚啉-2-羧酸叔丁酯(231c)和685mg的3,5-二溴-1-甲基吡嗪-2(1h)-酮为原料,获得黄色固体231d(732mg,68%)。ms:[m+h]+421。实施例231e5-溴-3-(异吲哚啉-5-基氨基)-1-甲基吡嗪-2(1h)-酮231e按照对129b所述的方法,以460mg的5-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)异吲哚啉-2-羧酸叔丁酯为原料,获得黄色固体231e(352mg,99%)。ms:[m+h]+321实施例231f5-溴-1-甲基-3-(2-甲基异吲哚啉-5-基氨基)吡嗪-2(1h)-酮231f按照对220a所述的方法,以336mg的5-溴-3-(异吲哚啉-5-基氨基)-1-甲基吡嗪-2(1h)-酮为原料,获得黄色固体化合物231f(237mg,75%)。ms:[m+h]+337。1hnmr(500mhz,cdcl3)δ8.31(s,1h),7.67(s,1h),7.52(t,j=7.0,1h),7.18(d,j=8.0,1h),6.74(s,1h),3.94(s,2h),3.89(s,2h),3.52(s,3h),2.60(s,3h)。实施例231g4-氟-2-(4-甲基-6-(2-甲基异吲哚啉-5-基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯231g按照对化合物148h所述的方法,以400mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d和278mg的5-溴-1-甲基-3-(2-甲基异吲哚啉-5-基氨基)吡嗪-2(1h)-酮231f为原料,获得黄色固体化合物231g(258mg,51%)。ms:[m+h]+611。按照实施例148,将231g转化成白色固体231(116mg,50%)。1hnmr(500mhz,dmso)δ9.23(s,1h),7.90(s,1h),7.73(d,j=8,1h),7.51(s,1h),7.37(dd,j=10.0,1h),7.31(dd,j=10.0,1h),7.13(d,j=8.0,1h),6.53(s,1h),4.88(s,1h),4.50(d,j=8.0,1h),4.50(d,j=11.5,1h),4.40(m,1h),4.13(m,3h),3.89(m,1h),3.78(m,4h),3.52(s,3h),2.59(m,2h),2.48(m,5h),1.79(s,2h),1.70(s,2h)。实施例2325-[5-氟-2-(羟甲基)-3-{4-甲基-6-[(2-甲基-2,3-二氢-1h-异吲哚-5-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮232实施例232a(4-氟-2-{4-甲基-6-[(2-甲基-2,3-二氢-1h-异吲哚-5-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯232a按照对148h所述的方法,以499mg的(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b和335mg的5-溴-1-甲基-3-(2-甲基异吲哚啉-5-基氨基)吡嗪-2(1h)-酮为原料,获得黄色固体化合物232a(320mg,51%)。ms:[m+h]+628。按照对148所述的方法,以300mg的232a为原料,获得白色固体化合物232(117mg,42%)。1hnmr(500mhz,dmso)δ9.23(s,1h),7.90(s,1h),7.72(s,1h),7.51(d,j=8.0,1h),7.36(s,1h),7.31(s,1h),7.13(s,1h),4.85(s,1h),4.50(s,1h),4.40(m,1h),4.05(s,1h),3.87(s,1h),3.78(d,j=6.5,4h),3.56(s,3h),3.33(s,3h),2.97(s,1h),2.87(s,1h),2.79(s,2h),2.50(m,3h),1.80(s,4h)。实施例2335-[3-(5-{[5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮233实施例233a[2-(5-{[5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯233a按照对136e所述的方法,以5-溴-3-(5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮(250a)和(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b为原料,获得67%收率的化合物233a。lcms:(m+h)+597按照对136所述的方法,以233a为原料,获得58%收率的化合物233。lcms:(m+h)+614。1hnmr(500mhz,dmso)δ8.66(d,j=2,1h),8.56(s,1h),8.11(d,j=2,1h),7.65(dd,j=9,1h),7.41(d,j=2,1h),7.33(dd,j=9.5,1h),7.28(d,j=8,1h),7.18(dd,j=9,1h),4.86(t,j=4,1h),4.32(d,j=4.5,2h),4.05(m,1h),3.86(m,1h),3.59(s,3h),3.49(m,3h),2.97(m,3h),2.86(m,1h),2.78(m,2h),2.56(m,1h),2.40(m,2h),1.79(m,4h),0.87(t,j=7,3h)。实施例2342-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮234实施例234a{4-氟-2-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{1-氧代-1h,2h,3h,4h,-6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基}甲基乙酸酯234a向25ml密封管中加入4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯(210d)(500mg,1.0mmol)、5-溴-1-甲基-3-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮(146a)(350mg,1.0mmol)、ch3coona(170mg,2.0mmol)、k3po4(552mg,2.0mmol)、pdcl2(dppf)(85mg,0.1mmol),使它们悬浮于ch3cn(25ml)和h2o(1ml)中。在110℃下加热混合物2小时。然后蒸发,通过硅胶柱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到褐色固体234a(400mg,63%)。ms:(m+h)+614。向234a(400mg,0.65mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.57g,65mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到黄色固体234(119mg,32%)。ms:(m+h)+572。1hnmr(500mhz,meod)δ1.78-1.80(t,2h),1.89-1.90(d,2h),2.49(s,3h),2.54-2.56(t,j=6hz,2h),2.64-2.66(m,2h),2.94-2.96(t,2h),3.64(s,2h),3.67(s,3h),4.04-4.06(m,3h),4.20(s,3h),4.46-4.51(m,2h),5.89(s,1h),6.72(s,1h),7.20-7.22(d,2h),7.26-7.27(d,1h),7.91(s,1h)。实施例2355-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)苯基)-1-甲基-3-(2-甲基异吲哚啉-5-基氨基)吡嗪-2(1h)-酮235向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml三颈圆底烧瓶中加入231e(150mg,0.447mmol)、131a(340mg,0.581mmol)、碳酸钠(142mg,1.34mmol)、水(2ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(52mg,0.045mmol),并在回流下加热反应混合物2h。其后,将混合物冷却至室温,并用二氯甲烷(100ml)和水(30ml)稀释。分离有机层,然后用二氯甲烷(3×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到褐色残余物。用氮气吹扫配有磁力搅拌器的100-ml单颈圆底烧瓶,并加入粗品残余物、thf(10ml)和1m四丁基氟化铵/thf溶液(4.50mmol,4.5ml)。在室温下搅拌所得的混合物2h。此后,用二氯甲烷(100ml)稀释混合物,并用水(30ml)洗涤。分离有机层,并用二氯甲烷(3×30ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱(硅胶,0%-10%甲醇/二氯甲烷)纯化残余物,得到44%收率(120mg)的灰白色固体235:mp218–220℃(dec);1hnmr(500mhz,dmso-d6)δ9.21(s,1h),7.89(d,1h,j=1.0hz),7.70(dd,1h,j=8.1,2.0hz),7.50(s,1h),7.34(dd,1h,j=9.9,3.0hz),7.30(dd,1h,j=9.1,2.5hz),7.13(d,1h,j=8.0hz),4.82(m,1h),4.50(m,1h),4.04(m,1h),4.04(m,1h),3.84(m,1h),3.75(m,4h),3.54(s,3h),3.02(m,1h),2.89(m,1h),2.75(s,2h),2.53(d,2h,j=6.5hz),2.46(s,3h),1.23(s,6h);ms(esi+)m/z600.2(m+h)。实施例2365-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-3-(5-(3-甲基氮杂环丁烷-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮236实施例236a5-(3-甲基氮杂环丁烷-1-基)-2-硝基吡啶236a向配有磁力搅拌器和氮气入口的500-ml单颈圆底烧瓶中加入3-甲基氮杂环丁烷苯磺酸盐(4.02g,17.5mmol)、2-硝基-5-溴吡啶(3.56g,17.5mmol)、碳酸铯(28.5g,87.7mmol)和1,4-二噁烷(50ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xantphos(862mg,1.50mmol)和三(二亚苄基丙酮)二钯(0)(800mg,0.900mmol)。将回流冷凝管连接到烧瓶,并在回流下加热反应混合物3h。此后,将混合物冷却至室温,并用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释,然后分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,用盐水洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色(硅胶,0%-80%乙酸乙酯/己烷)谱纯化所得的残余物,得到69%收率(2.35g)的非结晶黄色固体236a:mp141–143℃;1hnmr(500mhz,cdcl3)δ8.12(d,1h,j=9.0hz),7.60(d,1h,j=2.5hz),6.66(dd,1h,j=9.0,2.5hz),4.23(t,2h,j=8.5hz),3.68(m,2h),2.99(m,1h),1.36(d,3h,j=7.0hz;ms(esi+)m/z194.0(m+h)实施例236b5-(3-甲基氮杂环丁烷-1-基)吡啶-2-胺236b用氮气吹扫250-mlparr反应瓶,并加入10%钯/碳(50%湿度,800mg干重)以及236a(2.58g,13.4mmol)在乙醇(25ml)和乙酸乙酯(25ml)的混合物中的溶液。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi并振摇3h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(3.50g),然后通过celite521垫过滤混合物。用乙醇(2×50ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干,得到定量收率的紫色油状物236b(2.21g):1hnmr(500mhz,dmso-d6)δ7.19(d,1h,j=3.0hz),6.66(dd,1h,j=9.0,3.0hz),6.36(d,1h,j=8.5hz),5.13(brs,2h),3.81(t,2h,j=7.5hz),3.21(t,2h,j=6.5hz),2.70(m,1h),1.18(d,3h,j=7.0hz);ms(esi+)m/z164.1(m+h)。实施例236c5-溴-1-甲基-3-(5-(3-甲基氮杂环丁烷-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮236c利用与121a的所述制备相同的方法,使236b(1.04g,6.40mmol)和3,5-二溴-1-甲基吡啶-2(1h)-酮(1.90g,7.12mmol)反应得到44%收率(980mg)的褐色固体236c:mp135–136℃;1hnmr(500mhz,dmso-d6)δ8.49(d,1h,j=5.5hz),8.42(s,1h),7.50(d,1h,j=4.5hz),7.41(d,1h,j=7.0hz),7.20(d,1h,j=14.5hz),6.85(dd,1h,j=14.5,5.0hz),3.91(m,2h),3.49(s,3h),3.34(m,2h),2.75(m,1h),1.21(d,3h,j=11.5hz;ms(esi+)m/z350.2(m+h)。向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入236c(140mg,0.400mmol)、182c(304mg,0.520mmol)、碳酸钠(130mg,1.23mmol)、水(2ml)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(50mg,0.043mmol)。将回流冷凝管连接到烧瓶,并在回流下加热反应混合物2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2x50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后将所得的残余物溶于thf中。加入1m四丁基氟化铵/thf溶液(1.20ml,1.20mmol),并在室温下搅拌混合物14h。此后,用90:10二氯甲烷/甲醇(75ml)和水(50ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2x50ml)萃取水层,用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,0%-10%二氯甲烷/甲醇)纯化所得的残余物,得到14%收率(35mg)的非结晶褐色固体236:mp170–171℃;1hnmr(500mhz,dmso-d6)δ8.45(d,1h,j=2.5hz),8.22(s,1h),7.31(m,2h),7.15(m,2h),6.83(dd,1h,j=9.0,3.0hz),4.83(t,1h,j=4.5hz),4.32(m,2h),4.05(m,1h),3.88(m,3h),3.02(m,1h),2.89(m,1h),2.75(s,3h),2.54(m,4h);ms(esi+)m/z614.3(m+h)。实施例2376-(3-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-2,3-(5,5-二甲基-5,6-二氢-4h-环戊)-5,6-二氢噻吩并[2,3-c]吡啶-7(4h)-酮237向配有磁力搅拌器和回流冷凝管的100-ml三颈圆底烧瓶中加入210c(160mg,0.382mmol)、182c(300mg,0.512mmol)、碳酸钠(162mg,1.53mmol)、水(6ml)和1,4-二噁烷(30ml)。在持续20min使氮气鼓泡经过所得的悬浮液后,加入四(三苯基膦)钯(0)(44.0mg,0.038mmol),并在100℃下加热反应混合物4h。此后,使反应混合物冷却至室温,过滤,然后用甲醇和二氯甲烷的1:10混合物(30ml)洗涤滤饼。在减压下浓缩滤液得到褐色残余物。向另一个配有磁力搅拌器和回流冷凝管的50-ml单颈圆底烧瓶中加入如上获得的残余物、四丁基氟化铵(1.0mthf溶液,1.54ml,1.54mmol)和thf(10ml)。在室温下搅拌混合物1.5h。此后,在减压下浓缩反应混合物。通过快速色谱法纯化所得的残余物得到24%(86mg)收率的黄色固体237:mp175–177℃;1hnmr(500mhz,dmso-d6)δ8.55(d,1h,j=2.0hz),8.36(s,1h),7.86(d,1h,j=3.0hz),7.35(m,3h),7.22(d,1h,j=9.0hz),7.16(dd,1h,j=9.0,3.0hz),4.85(t,1h,j=5.0hz),4.55(t,2h,j=6.5hz),4.45(t,2h,j=6.0hz),4.32(m,2h),4.04(m,1h),3.86(m,1h),3.58(s,3h),3.44(m,1h),3.06(t,4h,j=4.5hz),3.03(m,1h),2.89(m,1h),2.75(s,2h),2.52(m,2h),2.38(t,4h,j=4.5hz);ms(esi+)m/z685.4(m+h)。实施例23810-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮238实施例238a10-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(乙酰氧基甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮238a向配有搅拌棒的微波用管中加入189a(381.9mg,0.850mmol)、3-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮(201a)(560mg,1.275mmol)、pd(pph3)4(49.1mg,0.043mmol)、na2co3水溶液(1.0n,2.81ml,2.81mmol)、1,2-二甲氧基乙烷(4ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),并用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到238a。向配有搅拌棒的圆底烧瓶中加入238a、thf(5ml)、i-proh(5ml)、h2o(5ml)、liohh2o(200mg)。在rt下搅拌所得的混合物1hr。在真空中除去溶剂,将所得的残余物加入到二氯甲烷(200ml)中,用水(30mlx3)、盐水(30mlx1)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:二氯甲烷/10:90)得到粉色固体23853,143mg.ms(esi+)m/z640.6(m+h)。实施例2395-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-3-(5-(4-异丙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮239利用对236所述相同的方法,使220a(165mg,0.410mmol)和182c(312mg,0.533mmol)反应得到21%收率(57mg)的灰白色固体239:mp191–192℃;1hnmr(500mhz,dmso-d6)δ8.54(d,1h,j=2.0hz),8.34(s,1h),7.85(d,1h,j=3.0hz),7.33(m,3h),7.20(d,1h,j=9.0hz),7.15(dd,1h,j=9.0,3.0hz),4.84(t,1h,j=4.0hz),4.32(m,2h),4.04(m,1h),3.84(m,1h),3.57(s,3h),3.02(m,5h),2.87(m,1h),2.75(brs,2h),2.63(m,1h),2.55(m,6h),1.22(s,6h),0.98(d,6h,j=3.0hz);ms(esi+)m/z671.3(m+h)。实施例2405-(3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-5-氟-2-(羟甲基)苯基)-1-甲基-3-(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮240用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入182c(300mg,0.513mmol)、205b(138mg,0.394mmol)、碳酸钠(125mg,1.18mmol)、1,4-二噁烷(8ml)和水(2ml)。用氮气对此混合物脱气30min。加入四(三苯基膦)钯(46mg,0.039mmol)。在回流下加热2h后,使反应混合物冷却至室温,然后在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2×50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于thf(3ml)中,然后加入三水合四丁基氟化铵(372mg,1.18mmol)。在室温下搅拌2h后,使反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2x20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到22%收率(53mg)的黄色固体240:mp142–143℃;1hnmr(500mhz,dmso-d6)δ8.77(d,1h,j=2.0hz),8.43(s,1h),7.44(d,1h,j=2.0hz),7.31(dd,1h,j=9.5,2.5hz),7.27(d,1h,j=8.0hz),7.19(dd,1h,j=9.5,2.5hz),7.06(d,1h,j=8.0hz),4.86(m,1h),4.38(m,2h),4.04(m,1h),3.84(m,1h),3.59(s,3h),3.38(s,2h),3.03(m,1h),2.89(m,1h),2.75(s,4h),2.62(m,2h),2.53(m,2h),2.34(s,3h),1.23(s,6h);ms(esi+)m/z614.3(m+h)。实施例2415-(3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-5-氟-2-(羟甲基)苯基)-1-甲基-3-(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮241利用与对240的制备所述相同的通用方法,使5-溴-3-(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)-1-甲基吡啶-2(1h)-酮(143mg,0.394mmol)和182c(300mg,0.513mmol)反应得到28%收率(70mg)的黄色固体241:mp134–135℃;1hnmr(500mhz,dmso-d6)δ8.78(d,1h,j=2.0hz),8.43(s,1h),7.44(d,1h,j=2.0hz),7.31(dd,1h,j=9.5,2.5hz),7.28(d,1h,j=8.0hz),7.18(dd,1h,j=9.5,2.5hz),7.06(d,1h,j=8.0hz),4.86(m,1h),4.38(m,2h),4.04(m,1h),3.84(m,1h),3.59(s,3h),3.43(s,2h),3.03(m,1h),2.89(m,1h),2.75(s,4h),2.62(m,2h),2.53(m,2h),2.50(m,2h),1.23(s,6h),1.08(t,3h,j=7.0hz);ms(esi+)m/z614.3(m+h)。实施例2425-[5-氟-2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-3-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-1,2-二氢吡啶-2-酮242实施例242a4-氟-2-(1-甲基-5-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯242a向配有搅拌棒的微波用管中加入5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮(130c)(240mg,0.636mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(336mg,0.763mmol)、pd(pph3)4(37mg,0.0318mmol)、na2co3水溶液(1.0n,2.1ml,2.1mmol)、1,2-二甲氧基乙烷(4.2ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),用水(3x30ml)、盐水(30ml)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到242a。向配有搅拌棒的圆底烧瓶中加入242a、thf(5ml)、i-proh(5ml)、h2o(5ml)、liohh2o(300mg)。在rt下搅拌所得的混合物1hr。在真空中除去所有的溶剂,将所得的残余物加入到二氯甲烷(200ml)中,用水(30mlx3)、盐水(30mlx1)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:二氯甲烷=10:90)得到褐色固体242,56mg。ms(esi+)m/z611.5(m+h)。实施例24310-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基吡咯烷-2-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮243实施例243a10-[5-氟-2-(乙酰氧基甲基)-3-(1-甲基-5-{[5-(1-甲基吡咯烷-2-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮243a除了使用化合物230a(446mg,0.9mmol)、5-溴-1-甲基-3-(5-(1-甲基吡咯烷-2-基)吡啶-2-基氨基)吡啶-2(1h)-酮(229a)(281mg,0.8mmol)、1m碳酸钠溶液(2.7ml,2.7mmol)、四(三苯基膦)钯(0)(47mg,0.040mmol)和1,2-二甲氧基乙烷(6.5ml)之外,利用与121b相同的方法合成实施例243a。在微波反应器中在130℃下加热反应混合物15分钟。经后处理和快速柱色谱(硅胶,9:1二氯甲烷/甲醇)得到67%收率(350mg)的褐色油状物243a:ms(esi+)m/z653.1(m+h)。按照实施例121,除了使用thf(2ml)、水(1ml)和异丙醇(2ml)的混合物、化合物243a(350mg,0.54mmol)和一水合氢氧化锂(150mg,3.5mmol)之外。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到29%收率(95mg)的浅黄色固体化合物243:ms(esi+)m/z611.5(m+h)。实施例24410-[5-氟-2-(羟甲基)-3-[4-甲基-6-({4-[1-(氧杂环丁烷-3-基)哌啶-4-基]苯基}氨基)-5-氧代-4,5-二氢吡嗪-2-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮244实施例244a10-[5-氟-2-(乙酰氧基甲基)-3-[4-甲基-6-({4-[1-(氧杂环丁烷-3-基)哌啶-4-基]苯基}氨基)-5-氧代-4,5-二氢吡嗪-2-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮244a按照实施例121b,除了使用化合物230a(188mg,0.38mmol)、5-溴-1-甲基-3-(4-(1-(氧杂环丁烷-3-基)哌啶-4-基)苯基氨基)吡嗪-2(1h)-酮214b(160mg,0.38mmol)、1m碳酸钠溶液(1.5ml,1.5mmol)、四(三苯基膦)钯(0)(22mg,0.019mmol)和1,2-二甲氧基乙烷(5ml)之外。在微波反应器中在130℃下加热反应混合物15分钟。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到化合物244a和244的黄色油状混合物(270mg)。除了使用thf(2ml)、水(1ml)和异丙醇(2ml)的混合物以及一水合氢氧化锂(85mg,2mmol)之外,利用与121相同的方法对来自244a的混合物(270mg)脱保护。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到63%收率(167mg)的浅黄色固体化合物244:ms(esi+)m/z667.6(m+h)。实施例24510-[5-氟-2-(羟甲基)-3-[1-甲基-6-氧代-5-({5-[4-(丙烷-2-基)哌嗪-1-基]-吡啶-2-基}氨基)-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮245实施例245a10-[5-氟-2-(乙酰氧基甲基)-3-[1-甲基-6-氧代-5-({5-[4-(丙烷-2-基)哌嗪-1-基]-吡啶-2-基}氨基)-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮245a向配有磁力搅拌器的44-ml密封管中加入220a(400mg,1.0mmol)、7(508mg,2.0mmol)、乙酸钾(392mg,4.0mmol)和1,4-二噁烷(10ml)。在对混合物脱气30分钟,加入pd(dppf)cl2·ch2cl2(82mg,0.10mmol)。在105℃下搅拌所得的反应混合物6h。然后,将其冷却至室温,通过celite垫过滤。浓缩滤液,将粗品混合物再溶于dme(2ml)中,然后转移至10-ml微波反应容器中。向此溶液中加入10-[2-(乙酰氧基甲基)-3-溴-5-氟苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮(189a)(270mg,0.60mmol)、pd(pph3)4(50mg,0.050mmol)和2nna2co3(2ml)。然后对反应混合物脱气5分钟并置于微波腔中。在125℃下搅拌反应混合物7min后,通过快速色谱(二氯甲烷:甲醇,85:15)纯化得到49%(150mg)的245a。向配有磁力搅拌棒的100-ml单颈圆底烧瓶中加入245a(150mg,0.22mmol)、lioh·h2o(100mg,2.2mmol)、thf(2ml)、异丙醇(2ml)和水(2ml)。在室温下搅拌反应混合物3h后,使其在二氯甲烷(5ml)和水(5ml)之间分配,然后用二氯甲烷(5mlx3)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)。向此溶液中加入己烷(10ml),然后过滤所得的沉淀得到49%收率(70mg)的245。ms(esi+)m/z654.6(m+h)。实施例24610-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮246实施例246a10-[5-氟-2-(乙酰氧基甲基)-3-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮246a向配有磁力搅拌器的微波用管中加入5-溴-1-甲基-3-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮146a(210mg,0.6mmol)、230a(460mg,0.9mmol)、1,2-二甲氧基乙烷(8ml)和1m碳酸钠水溶液(2ml)。在持续15min鼓吹n2后,加入pd(pph3)4(36mg,0.03mmol)。将混合物在微波中加热至135℃持续15min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5二氯甲烷/乙醚/甲醇的梯度洗脱,得到37%收率(140mg)的246a。向配有磁力搅拌器的25ml圆底烧瓶中加入246a(140mg,0.2mmol)、氢氧化锂(200mg,4.8mmol)、thf(3ml)、异丙醇(3ml)和水(2ml)。在rt下搅拌混合物1h。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。用biotagekpnh12+m柱通过柱色谱纯化所得的残余物,用己烷-乙酸乙酯的梯度洗脱,得到86%收率(120mg)的246。ms(esi+)m/z586.6(m+h)。实施例24710-[5-氟-2-(羟甲基)-3-{4-甲基-6-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮247实施例247a(2-溴-6-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟苯基)甲基乙酸酯247a将4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮(105h)(2g,9.05mmol)、2,6-二溴-4-氟苄基乙酸酯(197c)(8.8g,27.15mmol)、xantphos(524mg,0.9mmol)、pd2(dba)3(828mg,0.9mmol)和cs2co3(5.9g,18mmol)在二噁烷(200ml)中的混合物在氮气下在100℃下加热15h。过滤反应混合物,然后在真空中蒸发滤液。通过硅胶柱纯化残余物,用1:1乙酸乙酯/石油醚洗脱,得到黄色固体247a(3g,71%)。ms:(m+h)+466。实施例247b(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b向247a(3g,6.45mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(9.8g,38.7mmol)在二噁烷(160ml)中的溶液中加入pdcl2(dppf)(525mg,0.65mmol)和ch3cook(3.8g,38.7mmol)。在氩气氛下在100℃下搅拌混合物15h。在反应后,过滤混合物,在真空中蒸发,通过硅胶柱纯化残余物,用1:2乙酸乙酯/石油醚洗脱,得到黄色固体247b(2.5g,76%)。ms:(m+h)+514。实施例247c(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-{4-甲基-6-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}苯基)甲基乙酸酯247c向25ml密封管中加入247b(590mg,1.15mmol)、5-溴-1-甲基-3-(2-甲基-1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮221b(400mg,1.15mmol)、ch3coona(189mg,2.3mmol)、k3po4(611mg,2.3mmol)、pdcl2(dppf)(94mg,0.11mmol),使它们悬浮于ch3cn(25ml)和水(1ml)中。在110℃下加热混合物2小时。蒸发混合物,通过硅胶柱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到褐色固体247c(400mg,53%)。ms:(m+h)+656。向247c(400mg,0.61mmol)在丙-2-醇(8ml)、四氢呋喃(8ml)和水(1.5ml)中的溶液中加入lioh(1.46g,61mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到黄色固体247(124mg,33%)。ms:(m+h)+614。1hnmr(500mhz,meod)δ1.29(s,6h),2.46(s,3h),2.59-2.60(d,2h),2.74-2.76(t,2h),2.81(s,2h),2.93-2.98(m,3h),3.07-3.09(m,1h),3.59(s,2h),3.64(s,3h),3.95-3.97(m,1h),4.01-4.12(m,1h),4.48-4.51(d,1h),4.58-4.61(d,1h),7.03-7.05(d,1h),7.18-7.21(m,1h),7.38-7.41(m,2h),7.52-7.54(d,1h),7.64(s,1h)。实施例24810-(3-{6-[(2-乙基-1,2,3,4-四氢异喹啉-6-基)氨基]-4-甲基-5-氧代-4,5-二氢吡嗪-2-基}-5-氟-2-(羟甲基)苯基)-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮248实施例248a5-溴-3-(2-乙基-1,2,3,4-四氢异喹啉-6-基氨基)-1-甲基吡嗪-2(1h)-酮248a按照对220a所述的方法,以385mg的5-溴-1-甲基-3-(1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮(221a)为原料,获得黄色固体248a(292mg,70%)。ms:[m+h]+364。实施例248b2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-6-{6-[(2-乙基-1,2,3,4-四氢异喹啉-6-基)氨基]-4-甲基-5-氧代-4,5-二氢吡嗪-2-基}-4-氟苯基)甲基乙酸酯248b按照对129a所述的方法,以400mg的(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯(247b)和283mg的5-溴-3-(2-乙基-1,2,3,4-四氢异喹啉-6-基氨基)-1-甲基-吡嗪-2(1h)-酮为原料,获得黄色固体248b(260mg,50%)。按照对148所述的方法,以230mg的248b为原料,获得127mg的白色固体248(59%)。1hnmr(500mhz,dmso)δ9.15(s,1h),7.81(s,1h),7.63(dd,j=8,1h),7.52(s,1h),7.39(dd,j=9.5,1h),7.31(d,j=9.5,1h),6.97(d,j=8.0,1h),4.88(s,1h),4.50(s,1h),4.45(s,1h),4.04(m,1h),3.84(m,1h),3.54(s,3h),3.47(s,2h),3.03(m,1h),2.91(m,1h),2.76(s,3h),2.62-2.45(m,6h),1.23(s,6h),1.08(t,j=7.5,3h)。实施例24910-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮249实施例249a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4-甲基-6-{[2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基)甲基乙酸酯249a按照对148b所述的方法,以247b和305mg的222a为原料,获得277mg的黄色固体249a(51%)。ms:[m+h]+698。按照对化合物148所述的方法,以250mg的249a为原料,获得117mg的白色固体249(50%)。1hnmr(500mhz,dmso)δ9.17(s,1h),7.85(d,j=1.5,1h),7.65(dd,j=8,1h),7.52(s,1h),7.39(dd,j=9.5,1h),7.31(d,j=9.5,1h),6.97(d,j=8.0,1h),4.80(s,1h),4.61(m,2h),4.52(m,1h),4.43(m,1h),4.04(m,1h),3.85(m,1h),3.56(m,4h),3.34(s,2h),3.01-2.57(m,6h),2.53(m,5h),1.23(s,6h)。实施例2502-(3-(5-(5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮250实施例250a5-溴-3-(5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮250a在0℃下向3-(5-(氮杂环丁烷-3-基)吡啶-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮155n(粗品,4.6mmol)在甲醇(50ml)和乙酸(5ml)中的溶液中加入ch3cho(40重量%h2o溶液)(10g,92mmol),然后在1h内分小批地加入nabh(ch3o)3(20g,92mmol)。在反应完成后,用2nnaoh将混合物调至ph>7。然后用dcm(80ml×3)萃取混合物,用na2so4干燥,浓缩得到黄色固体,将其在快速柱色谱上纯化,用含有0.5%et3n的50:1dcm/meoh洗脱,得到黄色固体250a(43%,2步)。lcms:(m+h)+364。1hnmr(500mhz,dmso)δ8.72(s,1h),8.66(d,j=3,1h),8.21(d,j=3,1h),7.68(dd,j=9,1h),7.52(d,j=2.5,1h),7.32(d,j=9,1h),3.54(m,6h),2.99(m,2h),2.42(m,2h),0.89(t,j=7,3h)。实施例250b2-(5-(5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯250b按照实施例136e,以250a和4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d为原料,获得65%收率的250b。lcms:(m+h)+639按照实施例135,以250b为原料,获得63%收率的250。lcms:(m+h)+597。1hnmr(500mhz,dmso)δ8.66(d,j=2,1h),8.56(s,1h),8.11(d,j=1.5,1h),7.66(dd,j=8.5,1h),7.42(d,j=2.5,1h),7.33(dd,j=9.5,1h),7.28(d,j=8.5,1h),7.19(dd,j=9,1h),6.53(s,1h),4.87(t,j=4,1h),4.31(d,j=4.5,2h),4.15(m,3h),3.89(m,1h),3.59(s,3h),3.47(m,3h),2.97(m,2h),2.62(m,3h),2.40(m,3h),1.79(m,2h),1.69(m,2h),0.88(t,j=7,3h)。实施例2515-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)-3-(5-(1-甲基氮杂环丁烷-3-基氧基))-1-甲基吡啶-2(1h)-酮251实施例251a3-(6-硝基吡啶-3-基氧基)氮杂环丁烷-1-羧酸叔丁酯251a向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中加入2-硝基-5-羟基吡啶(2.00g,14.3mmol)、3-碘氮杂环丁烷-1-羧酸叔丁酯(6.06g,21.5mmol)、氢化钠(800mg,20.2mmol)和dmf(30ml)。在110℃下加热反应混合物24h。此后,使反应混合物冷却至室温,然后在减压下浓缩。用乙酸乙酯(200ml)稀释残余物,然后用饱和碳酸氢钠水溶液(100ml)洗涤。用硫酸钠干燥有机层,过滤,然后在减压下浓缩。通过快速色谱法纯化所得的残余物得到95%收率(4.00g)的黄色油状物251a:1hnmr(500mhz,cdcl3)δ8.27(d,1h,j=9.0hz),8.14(d,1h,j=3.0hz),7.26(dd,1h,j=9.0,3.0hz),5.04(m,1h),4.39(m,2h),4.06(m,2h),1.44(s,9h);ms(esi+)m/z196.1(m-boc+h)。实施例251b3-(6-氨基吡啶-3-基氧基)氮杂环丁烷-1-羧酸叔丁酯251b用氮气吹扫250-mlparr反应瓶,并加入氧化铂(200mg)、251a(2.00g,6.78mmol)、乙酸乙酯(30ml)和乙醇(30ml)。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi并振摇20h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(10.0g),然后通过celite521垫过滤混合物。用甲醇(2×50ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干,得到100%收率(2.01g)的白色固体251b:mp83–84℃;1hnmr(500mhz,dmso-d6)δ7.53(d,1h,j=3.0hz),7.04(dd,1h,j=9.0,3.0hz),6.41(d,1h,j=9.0hz),5.32(brs,2h),4.21(t,2h,j=6.5hz),3.75(t,2h,j=6.5hz),3.25(m,1h),1.37(s,9h);ms(esi+)m/z266.2(m+h)。实施例251c3-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基氧基)氮杂环丁烷-1-羧酸叔丁酯251c利用与250a的所述制备相同的方法,使251b(1.01g,3.80mmol)和3,5-二溴-1-甲基吡啶-2(1h)-酮(1.01g,3.80mmol)反应得到81%收率(1.40mg)的褐色固体251c:mp120–121℃;1hnmr(500mhz,dmso-d6)δ8.70(s,1h),8.57(d,1h,j=2.5hz),7.86(d,1h,j=3.0hz),7.48(d,1h,j=2.5hz),7.35(d,1h,j=9.0hz),7.28(m,1h),4.95(m,1h),4.3(m,2h),3.80(m,2h),3.50(s,3h),1.38(s,9h);ms(esi+)m/z452.3(m+h)。实施例251d3-(5-(氮杂环丁烷-3-基氧基)吡啶-2-基氨基)-5-溴-1-甲基吡啶-2(1h)-酮251d向配有磁力搅拌器的250-ml单颈圆底烧瓶中加入251c(1.14g,3.10mmol)、二氯甲烷(10ml)和三氟乙酸(5ml)。在室温下搅拌反应混合物2h。此后,在减压下浓缩混合物。用二氯甲烷(100ml)稀释所得的残余物,然后用饱和碳酸氢钠水溶液(50ml)洗涤。用二氯甲烷(2×50ml)萃取水层,用硫酸钠干燥合并的有机萃取液,过滤,然后浓缩得到92%收率(1.10g)的无色油状物251d。此化合物未经任何纯化直接用于下一步骤:1hnmr(500mhz,dmso-d6)δ8.65(s,1h),8.55(d,1h,j=2.5hz),7.82(d,1h,j=3.0hz),7.48(d,1h,j=2.5hz),7.30(d,1h,j=9.0hz),7.21(m,1h),4.95(t,1h,j=6.0hz),3.76(m,1h),3.48(m,5h);ms(esi+)m/z353.0(m+h)。实施例251e5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基氧基)吡啶-2-基氨基)吡啶-2(1h)-酮251e用氮气吹扫配有磁力搅拌器的250-ml单颈圆底烧瓶,并加入251d(1.10g,2.95mmol)、37%甲醛水溶液(111mg,3.70mmol)和甲醇(15ml)。加入氰基硼氢化钠(540mg,8.60mmol)和氯化锌(600mg,4.40mmol)在甲醇(10ml)中的悬浮液,并在室温下搅拌反应4h。此后,浓缩反应混合物,使残余物在90:10二氯甲烷/甲醇(250ml)和10%碳酸钾水溶液(100ml)之间分配。用90:10二氯甲烷/甲醇(3×150ml)萃取水层。用硫酸钠干燥合并的有机萃取液,过滤,然后在减压下浓缩。通过柱色谱(硅胶,0%-50%甲醇/二氯甲烷)纯化所得的残余物,得到80%收率(830mg)的褐色固体251e:mp100–101℃;1hnmr(500mhz,dmso-d6)δ8.66(s,1h),8.55(d,1h,j=2.5hz),7.86(d,1h,j=3.0hz),7.47(d,1h,j=2.5hz),7.31(d,1h,j=9.0hz),7.24(dd,1h,j=9.5,3.5hz),4.76(m,1h),3.77(t,2h,j=7.5hz),3.50(s,3h),3.03(t,2h,j=7.5hz),2.26(s,3h);ms(esi+)m/z366.0(m+h)。利用与对239的制备所述相同的方法,使251e(145mg,0.400mmol)和182c(304mg,0.520mmol)反应得到15%收率(37mg)的灰白色固体251:mp160–161℃;1hnmr(500mhz,dmso-d6)δ8.53(d,1h,j=2.5hz),8.49(s,1h),7.77(d,1h,j=2.5hz),7.36(d,1h,j=2.0hz),7.32(dd,1h,j=9.0,2.5hz),7.27(d,1h,j=9.0hz),7.22(dd,1h,j=9.0,2.5hz),7.16(dd,1h,j=9.0,2.5hz),4.84(t,1h,j=4.0hz),4.69(m,1h),4.30(m,2h),3.84(m,1h),3.69(m,2h),3.58(s,3h),3.02(m,1h),2.92(m,3h),2.75(m,2h),2.54(m,2h),2.27(s,3h);ms(esi+)m/z630.3(m+h)。实施例25210-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(氧杂环丁烷-3-基)-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮252实施例252a5-溴-1-甲基-3-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮252a按照实施例214b,将5-溴-1-甲基-3-(4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮126a(250mg,0.78mmol)、氧杂环丁烷-3-酮(600mg,8.3mmol)溶于甲醇(8ml)中。加入在甲醇(8ml)中的氰基硼氢化钠(148mg,3mmol)和氯化锌(165mg,1.5mmol),并在48℃下加热反应12小时。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到34%收率(100mg)的浅绿色固体252a:ms(esi+)m/z382.1(m+h)。按照实施例121b,除了使用230a(135mg,0.26mmol)、252a(100mg,0.26mmol)、1m碳酸钠溶液(1ml,1mmol)、四(三苯基膦)钯(0)(15mg,0.013mmol)和1,2-二甲氧基乙烷(2.5ml)之外。在微波反应器中在130℃下加热反应混合物15分钟。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到252b和252的黄色油状混合物(80mg)。除了使用thf(1ml)、水(0.5ml)和异丙醇(1ml)的混合物及一水合氢氧化锂(25mg,0.6mmol)之外,利用与121相同的方法,对此混合物(80mg)脱保护。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到40%收率(30mg)的白色固体252:ms(esi+)m/z628.5(m+h)。实施例2535-[5-氟-2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-3-({5-[(2r)-1-甲基吡咯烷-2-基]吡啶-2-基}氨基)-1,2-二氢吡啶-2-酮253实施例2545-[5-氟-2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-3-({5-[(2s)-1-甲基吡咯烷-2-基]吡啶-2-基}氨基)-1,2-二氢吡啶-2-酮254实施例253和254是外消旋物202的对映异构体。在chiralpakad,4.6x50mm,3μm柱(流动相55%异丙醇(w/0.1%三乙胺)/45%co2,流速5ml/min)上,在40℃下对外消旋混合物202进行手性分离,得到各个对映异构体,其中首先洗脱254,然后洗脱253。实施例253ms(esi+)m/z597.4(m+h)。实施例254ms(esi+)m/z597.4(m+h)。实施例2555-[5-氟-2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-3-{[5-(吗啉-4-基)吡啶-2-基]氨基}-1,2-二氢吡啶-2-酮255实施例255a4-(6-硝基吡啶-3-基)吗啉255a按照对188a所述的方法,以2g的5-溴-2-硝基吡啶和968mg吗啉为原料,获得黄色固体255a(1g,50%)。ms:[m+h]+210。1hnmr(500mhz,cdcl3)δ8.18(d,j=9.0,1h),8.15(d,j=3.0,1h),7.22(dd,j=3.0,1h),3.90(t,j=5.0,4h),3.42(t,j=5.0,4h)。实施例255b5-吗啉代吡啶-2-胺255b按照对188b所述的方法,以1g的4-(6-硝基吡啶-3-基)吗啉为原料,获得黄色固体255b(840mg,98%)。ms:[m+h]+210实施例255c5-溴-1-甲基-3-(5-吗啉代吡啶-2-基氨基)吡啶-2(1h)-酮255c按照对188c所述的方法,以3,5-二溴-1-甲基吡啶-2(1h)-酮(1.15g,4.3mmol)和5-吗啉代吡啶-2-胺(770mg,4.3mmol)为原料,获得黄色固体255c(986mg,63%)。ms:[m+h]+365实施例255d4-氟-2-(1-甲基-5-(5-吗啉代吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯255d按照对148c所述的方法,以400mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d和302mg的5-溴-1-甲基-3-(5-吗啉代吡啶-2-基氨基)吡啶-2(1h)-酮为原料,获得黄色固体255d(281mg,53%)。ms:[m+h]+641按照对148所述的方法,以270mg的4-氟-2-(1-甲基-5-(5-吗啉代吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯为原料,获得白色固体255(103mg,41%)。ms:[m+h]+599。1hnmr(500mhz,dmso)δ8.56(d,j=2.0,1h),8.38(s,1h),7.87(d,j=3.0,1h),7.36-7.32(m,3h),7.25(d,j=9.5,,2h),7.19(d,j=9.0,1h),6.52(s,1h),4.87(s,1h),4.32(d,j=4,2h),4.15(m,3h),3.82(m,1h),3.72(t,j=4.0,1h),3.50(s,3h),3.02(t,j=4.5,3h),2.61(m,2h),2.47(m,2h),1.80(s,2h),1.68(s,2h)。实施例25610-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(吗啉-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮256实施例256a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(1-甲基-5-{[5-(吗啉-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基)甲基乙酸酯256a按照实施例148b,以400mg的(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b和284mg5-溴-1-甲基-3-(5-吗啉代吡啶-2-基氨基)吡啶-2(1h)-酮255c为原料,获得277mg的黄色固体256a(53%)。ms:[m+h]+672按照实施例148,以270mg的256a为原料,获得103mg的白色固体256(41%)。ms:[m+h]+630。1hnmr(500mhz,dmso)δ8.56(d,j=2.0,1h),8.38(s,1h),7.88(d,j=3.0,1h),7.36-7.32(m,3h),7.25(d,j=9.5,,2h),7.19(d,j=9.0,1h),4.85(s,1h),4.32(d,j=4,2h),4.07(m,3h),3.86(m,1h),3.72(t,j=4.0,1h),3.50(s,3h),3.02(t,j=4.5,3h),2.89(m,1h),2.76(s,2h),2.53(m,2h),1.23(s,6h)。实施例25710-[3-(5-{[5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮257实施例257a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-6-(5-{[5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟苯基)甲基乙酸酯257a按照实施例136a,以5-溴-3-(5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮250a和(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b为原料,获得37%收率的化合物257a。按照实施例136,以257a为原料,获得46%收率的化合物257。lcms:(m+h)+628。1hnmr(500mhz,dmso)δ8.66(d,j=2,1h),8.55(s,1h),8.12(d,j=2.5,1h),7.65(dd,j=8.5,1h),7.42(d,j=2,1h),7.33(dd,j=9.5,1h),7.28(d,j=9,1h),7.19(dd,j=9,1h),4.86(t,j=4,1h),4.33(m,2h),4.05(m,1h),3.86(m,1h),3.59(s,3h),3.49(m,3h),3.04(m,1h),2.97(m,2h),2.89(m,1h),2.76(s,2h),2.55(m,2h),2.40(m,2h),1.79(m,4h),1.23(s,6h),0.88(t,j=7,3h)。实施例2582-(5-氟-2-(羟甲基)-3-(1-甲基-5-(2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮258实施例258a6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯258a向100ml圆底烧瓶中加入6-氨基-3,4-二氢异喹啉-2(1h)-羧酸叔丁酯(2g,8mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.8g,6.7mmol)、碳酸铯(4.4g,13.4mmol)、xantphos(0.41g,0.7mmol)、三(二亚苄基丙酮)二钯(0)(0.64g,0.7mmol)和1,4-二噁烷(50ml)。在氩气氛下使反应混合物回流2h。此后,将混合物冷却至室温并过滤。在减压下浓缩滤液。通过柱色谱纯化残余物,用25:1二氯甲烷/甲醇洗脱,得到258a(2.18g,63%)。lc/ms:m/z435(m+h)+实施例258b5-溴-1-甲基-3-(1,2,3,4-四氢异喹啉-6-基氨基)吡啶-2(1h)-酮258b使化合物258a(2.18g,5mmol)悬浮于二噁烷(10ml)中。滴加氯化氢/二噁烷饱和溶液(20ml)。搅拌反应混合物20分钟,然后在减压下浓缩得到258b,未经进一步纯化用于下一步骤。lc/ms:m/z335(m+h)+实施例258c5-溴-1-甲基-3-(2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基氨基)吡啶-2(1h)-酮258c将258b(1.7g,5mmol)、氧杂环丁烷-3-酮(1.8g,25mmol)、nabh3cn(1g,15mmol)和氯化锌(3.4g,25mmol)在甲醇(50ml)中的混合物在室温下搅拌4小时。过滤混合物,然后在减压下浓缩滤液。通过柱色谱纯化残余物,用25:1二氯甲烷/甲醇洗脱,得到258c(1.8g,92%)。lc/ms:m/z391(m+h)+实施例258d4-氟-2-(1-甲基-5-(2-(氧杂环丁烷-3-基)-1,2,3,4-四氢异喹啉-6-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯258d向配有磁力搅拌器的15ml微波反应小瓶中加入258c(0.39g,1mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(0.48g,1mmol)、磷酸钾(0.54g,2mmol)、乙酸钠(0.17g,2mmol)、乙腈(10ml)、水(1ml)和1,1'-双(二苯基膦)二茂铁二氯化钯(ii)二氯甲烷(0.08g,0.1mmol)。在氩气氛下在110℃下加热反应混合物2小时。此后,将混合物冷却至室温并过滤。在减压下浓缩滤液。通过柱色谱纯化残余物,用40:1二氯甲烷/甲醇洗脱,得到258d(0.3g,50%)。lc/ms:m/z666(m+h)+向配有磁力搅拌器的25ml圆底烧瓶中加入258d(0.6g,0.9mmol)、lioh(2g,48mmol)、thf(5ml)、异丙醇(5ml)和水(2ml)。在室温下搅拌反应混合物30分钟并过滤。在减压下浓缩滤液。通过制备型hplc纯化残余物得到258。lc/ms:m/z624(m+h)+。1hnmr(500mhz,dmso)δ7.62(s,1h),7.82(s,1h),7.34(m,3h),7.20(m,1h),7.09(m,2h),6.94(m,1h),4.86(m,1h),4.96(m,1h),4.60(m,2h),4.51(m,2h),4.31(m,2h),4.14(m,3h),3.87(m,1h),3.58(m,4h),3.33(m,3h),2.75(m,2h),2.60(m,3h),2.50(m,3h),1.78(m,4h)。实施例2595-[2-(羟甲基)-3-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮259实施例259a{2-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯259a向25ml密封管中加入(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯111a(571mg,1.2mmol)、5-溴-1-甲基-3-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮146a(400mg,1.2mmol)、ch3coona(195mg,2.4mmol)、k3po4(631mg,2.4mmol)、pdcl2(dppf)(97mg,0.12mmol),使它们悬浮于ch3cn(25ml)和h2o(1ml)中。在110℃下加热混合物2小时。然后蒸发,通过柱色谱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到褐色固体259a(500mg,69%)。ms:(m+h)+613。向259a(500mg,0.82mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.96g,82mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到黄色固体259(159mg,34%)。ms:(m+h)+571。1hnmr(500mhz,dmso)δ1.79(s,4h),2.35(s,2h),2.53-2.55(m,1h),2.76-2.79(m,4h),2.84-2.88(m,1h),2.96-2.98(m,1h),3.48(s,2h),3.57(s,3h),3.87-3.93(m,3h),3.99-4.03(m,1h),4.35(s,2h),4.81(s,1h),5.88(s,1h),7.23-7.24(d,2h),7.29-7.34(m,2h),7.43-7.46(d,1h),7.97-7.98(d,1h),8.10(s,1h)。实施例26010-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮260实施例260a10-[5-氟-2-(乙酰氧基甲基)-3-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮260a向配有搅拌棒的微波用管中加入5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮130c(162mg,0.429mmol)、硼酸酯212b(347mg,0.700mmol)、pd(pph3)4(24.8mg,0.022mmol)、na2co3水溶液(1.0n,1.42ml,1.42mmol)、1,2-二甲氧基乙烷(4.0ml)。使混合物在微波中在130℃下反应15min。加入二氯甲烷(200ml),用水(3x30ml)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到260a。向配有搅拌棒的圆底烧瓶中加入260a、thf(5ml)、i-proh(5ml)、h2o(5ml)、liohh2o(300mg)。在rt下搅拌所得的混合物1hr。在真空中除去所有的溶剂,将所得的残余物加入到二氯甲烷(200ml)中,用水(3x30ml)、盐水(30ml)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(meoh:二氯甲烷=10:90)得到黄色固体的醇260,48mg.ms(esi+)m/z625.5(m+h)。实施例26110-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮261实施例261a10-[5-氟-2-(乙酰氧基甲基)-3-{1-甲基-5-[(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮261a在配有磁力搅拌棒的10-ml微波反应容器中加入5-溴-1-甲基-3-(6-甲基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮205b(150mg,0.43mmol)、10-[2-(乙酰氧基甲基)-3-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-5-氟苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮230a(248mg,0.50mmol)、pd(pph3)4(30mg,0.026mmol)和2nna2co3(2ml)和1,2-二甲氧基乙烷(2ml)。在125℃下搅拌反应混合物10分钟后,通过快速色谱(二氯甲烷:甲醇,3:1)纯化得到36%(100mg)的固体261a。向配有磁力搅拌棒的25-ml单颈圆底烧瓶中加入261a(100mg,0.16mmol)、lioh·h2o(200mg,4.8mmol)、thf(2ml)、异丙醇(2ml)和水(2ml)。在室温下搅拌反应混合物2h后,使其在二氯甲烷(5ml)和水(5ml)之间分配,然后用二氯甲烷(5mlx3)萃取有机相。用水(2x5ml)和盐水(5ml)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)。向此溶液中加入己烷(10ml),然后过滤所得的沉淀得到36%收率(34mg)的261。ms(esi+)m/z597.5(m+h)。实施例26210-[3-(5-{[5-(1-乙基氮杂环丁烷-3-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮262实施例262a和262b按照实施例271a,在步骤1中使用250a(305mg,0.84mmol)并在实施例271b的步骤2中使用189a(302mg,0.67mmol)制备262b。通过柱色谱(isco12g硅胶,0-10%meoh)纯化产物得到期望的产物262b(105mg,19%收率)。按照实施例119,使262a(105mg,0.36mmol)、1nlioh(0.8ml)、thf(2ml)和异丙醇(2ml)反应得到262(85mg,87%收率)。ms(esi+)m/z611.5(m+h)。实施例2632-(5-氟-2-(羟甲基)-3-(5-(2-甲氧基嘧啶-4-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮263实施例263a5-溴-3-(2-甲氧基嘧啶-4-基氨基)-1-甲基吡啶-2(1h)-酮263a按照实施例112a,将2-甲氧基嘧啶-4-胺(0.625g,5mmol)、3,5-二溴-1-甲基-1h-吡啶-2-酮(1.34g,5mmol)、碳酸铯(4.88g,15mmol)、三(二亚苄基丙酮)二钯(0)(0.465g,0.5mmol)、xantphos(0.58g,1mmol)和1,4-二噁烷(50ml)在100℃下加热24小时。将混合物冷却至室温,通过celite521垫过滤。用9:1二氯甲烷/甲醇(2x25ml)洗涤滤饼,然后将合并的滤液浓缩至干。将残余物溶于二氯甲烷中,加入乙醚,然后过滤所得的沉淀得到定量收率(1.57g)的绿色固体263a:ms(esi+)m/z313.1(m+h)。实施例263b4-氟-2-(5-(2-甲氧基嘧啶-4-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯263b按照实施例121b,将263a(158mg、0.5mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(242mg、0.5mmol)、1m碳酸钠溶液(2ml,2mmol)、四(三苯基膦)钯(0)(29mg,0.025mmol)和1,2-二甲氧基乙烷(5ml)在微波反应器中在130℃下加热15分钟。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到98%收率(290mg)的黄色油状物263b:ms(esi+)m/z587.6(m+h)。按照实施例121,使thf(2ml)、水(1ml)和异丙醇(2ml)的混合物、263b(290mg,0.5mmol)和一水合氢氧化锂(105mg,2.5mmol)反应。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到26%收率(70mg)的固体263:ms(esi+)m/z545.1(m+h)。实施例26410-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[1-(氧杂环丁烷-3-基)哌啶-4-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮264实施例264a4-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)哌啶-1-羧酸叔丁酯264a按照实施例112a,将4-(6-氨基吡啶-3-基)哌啶-1-羧酸叔丁酯(1.9g,5.5mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.47g,5.5mmol)、碳酸铯(5.36g,16.5mmol)、三(二亚苄基丙酮)二钯(0)(0.53g,0.55mmol)、xantphos(0.63g,1.1mmol)和1,4-二噁烷(50ml)在100℃下加热8小时。后处理,然后浓缩至干。用乙醚洗涤所得的固体,然后过滤得到56%收率(1.4g)的灰色固体264a:ms(esi+)m/z465.2(m+h)。实施例264b5-溴-1-甲基-3-(5-(哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮264b按照实施例121c,使264a(0.58g,1.25mmol)、三氟乙酸(0.96ml,12.5mmol)和二氯甲烷(20ml)反应。后处理,然后浓缩得到定量收率的黄色油状物264b(454mg),未经纯化用于下一步骤。ms(esi+)m/z365.2(m+h)。实施例264c5-溴-1-甲基-3-(5-(1-(氧杂环丁烷-3-基)哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮264c按照实施例214b,将264b(450mg,1.25mmol)、氧杂环丁烷-3-酮(800mg,11.1mmol)在甲醇(10ml)中混合。加入在甲醇(10ml)中的氰基硼氢化钠(236mg,3.75mmol)和氯化锌(256mg,1.88mmol),并在48℃下加热反应12小时。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到30%收率(160mg)的浅绿色固体264c:ms(esi+)m/z421.1(m+h)。按照实施例121b,将264c(160mg,0.38mmol)、230a(188mg,0.38mmol)、1m碳酸钠溶液(1.5ml,1.5mmol)、四(三苯基膦)钯(0)(22mg,0.019mmol)和1,2-二甲氧基乙烷(3.5ml)在微波反应器中在130℃下加热15分钟。经后处理和快速柱色谱(硅胶,9:1二氯甲烷/甲醇)得到化合物264c和264的黄色油状混合物(110mg)。除了使用thf(1ml)、水(0.5ml)和异丙醇(1ml)的混合物及一水合氢氧化锂(50mg,1.2mmol)之外,利用与121相同的方法对混合物(110mg)脱保护。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到56%收率(60mg)的黄色固体化合物264:ms(esi+)m/z667.6(m+h)。实施例2652-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(1-(氧杂环丁烷-3-基)哌啶-4-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮265实施例265a4-氟-2-(1-甲基-5-(5-(1-(氧杂环丁烷-3-基)哌啶-4-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯265a按照实施例121b,将264c(210mg,0.5mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(242mg,0.5mmol)、1m碳酸钠溶液(2ml,2mmol)、四(三苯基膦)钯(0)(29mg,0.025mmol)和1,2-二甲氧基乙烷(5ml)在微波反应器中在130℃下加热15分钟。经后处理和快速柱色谱(硅胶,9:1二氯甲烷/甲醇)得到69%收率(240mg)的褐色油状物265a:ms(esi+)m/z695.5(m+h)。按照实施例121,使thf(2ml),水(1ml)和异丙醇(2ml)的混合物、265a(240mg,0.35mmol)和一水合氢氧化锂(100mg,2.5mmol)反应。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到30%收率(70mg)的黄色固体265:ms(esi+)m/z653.6(m+h)。实施例26610-[5-氟-2-(羟甲基)-3-{4-甲基-6-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮266实施例266a5-溴-1-甲基-3-(2-甲基-1,2,3,4-四氢异喹啉-6-基氨基)吡啶-2(1h)-酮266a。向配有磁力搅拌器的100ml圆底烧瓶中加入258b(350mg,0.8mmol)、甲醛(37%水溶液,4.1mmol)、nabh3cn(150mg,2.4mmol)、zncl2(170mg,1.2mmol)和甲醇(46ml)。在室温下搅拌混合物16h。此后,在减压下浓缩混合物,和10%k2co3水溶液(25ml)。期望的产物从此混合物中析出,然后过滤。经乙醚(20ml)洗涤得到85%收率(240mg)的266a。实施例266b10-[5-氟-2-(乙酰氧基甲基)-3-{4-甲基-6-[(2-甲基-1,2,3,4-四氢异喹啉-6-基)氨基]-5-氧代-4,5-二氢吡嗪-2-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮266b向配有磁力搅拌器的微波用管中加入266a(240mg,0.7mmol)、210d(460mg,0.9mmol)、1,2-二甲氧基乙烷(8ml)和1m碳酸钠水溶液(2ml)。在持续15min鼓吹n2后,加入pd(pph3)4(40mg,0.03mmol)。将混合物在微波中加热至120℃持续10min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用二氯甲烷–9:1二氯甲烷:甲醇的梯度洗脱,得到27%收率(120mg)的266b。向配有磁力搅拌器的25ml圆底烧瓶中加入266b(120mg,0.2mmol)、氢氧化锂(40mg,0.9mmol)、thf(1ml)、异丙醇(1ml)和水(2ml)。在rt下搅拌混合物30min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。用biotagekpnh12+m柱通过柱色谱纯化所得的残余物,用己烷-乙酸乙酯的梯度洗脱,得到45%收率(50mg)的266。ms(esi+)m/z597.4(m+h)。实施例267:5-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮267实施例267a[4-氟-2-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯267a向密封管中加入5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮130c(400mg,1.0mmol)、(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(534mg,1.0mmol)、pd(dppf)cl2(87mg,0.1mmol)、k3po4.3h2o(569mg,2.0mmol)和naoac(175mg,2.0mmol)在ch3cn(20ml)中的混合物。对系统抽真空而后再充入n2。在110℃下加热反应混合物2h。然后将混合物冷却至室温并过滤。在减压下浓缩滤液,通过柱色谱纯化所得的残余物,用10:1二氯甲烷/甲醇洗脱,得到褐色固体267a(350mg,49%)。ms:[m+h]+670。向267a(100mg,0.15mmol)在丙-2-醇(5ml)、四氢呋喃(5ml)和水(1ml)中的溶液中加入lioh(358mg,15mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到黄色固体267(18mg,19%)。ms:(m+h)+628。1hnmr(500mhz,meod)δ1.83-1.96(m,8h),2.53-2.66(m,8h),2.85(t,2h),2.92-2.97(m,1h),3.04-3.07(m,1h),3.23-3.26(d,2h),3.98-4.01(m,1h),4.12-4.15(m,1h),4.48-4.55(m,2h),7.05(d,1h),7.20-7.23(m,2h),7.39(d,1h),7.55-7.57(m,1h),8.12(s,1h),8.65(s,1h)。实施例2685-{3-[5-({5-[2-(二甲基氨基)乙氧基]吡啶-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-5-氟-2-(羟甲基)苯基}-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮268实施例268an,n-二甲基-2-(6-硝基吡啶-3-基氧基)乙胺268a将6-硝基吡啶-3-醇(0.5g,3.57mmol)、2-氯-n,n-二甲基-乙胺盐酸盐(0.61g,4.29mmol)和cs2co3(2.56g,7.85mmol)在dmf(7ml)中的混合物在密封管中在120℃下搅拌15hr。过滤混合物,用乙酸乙酯和水对滤液后处理。用乙酸乙酯萃取水相。用硫酸钠干燥合并的萃取液,然后在减压下浓缩。在快速柱上纯化残余物得到268a(0.46g,61%)。ms:[m+h]+212。实施例268b5-(2-(二甲基氨基)乙氧基)吡啶-2-胺268b用氮气吹扫100-mlparr氢化瓶,并加入268a(0.92g,4.36mmol)、10%钯/碳(50%湿度,0.2g)和甲醇(30ml)。对瓶抽真空,充入氢气至压力25psi并在parr氢化装置上振摇2h。然后抽除氢气并将氮气充入瓶中。通过celite垫过滤除去催化剂,然后在减压下浓缩滤液得到268b(0.66g,83%)。ms:[m+h]+182。实施例268c5-溴-3-(5-(2-(二甲基氨基)乙氧基)吡啶-2-基氨基)-1-甲基-吡啶-2(1h)-酮268c将268b(570mg,3.15mmol)、xantphos(109mg,0.19mmol)、pd2dba3(230mg,0.25mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(918mg,3.46mmol)和cs2co3(2.05g.6.3mmol)在1,4-二噁烷(20ml)中的混合物在回流下加热2h。在反应完成后,过滤混合物,然后用甲醇(100ml)洗涤。在真空中蒸发滤液。在反相combi快速色谱上纯化残余物得到268c(922mg,80%)。ms:[m+h]+367。实施例268d{2-[5-({5-[2-(二甲基氨基)乙氧基]吡啶-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯268d将268c(360mg,0.99mmol)、(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b(494mg,0.99mmol)、pdcl2(dppf)(86mg,0.12mmol)、k3po4(150mg)和naoac(50mg)在mecn(6ml)和水(2ml)中的混合物在密封管中在110℃下加热2h。在真空中蒸发溶剂。在反相combi快速色谱上纯化残余物得到268d(367mg,60%)。ms:[m+h]+660。将268d(700mg,1.06mmol)和lioh水合物(446mg,10.6mmol)在异丙醇(15ml)和水(5ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(2x20ml)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到268(94mg,14%)。ms:[m+h]+618。1hnmr(500mhz,cdcl3)δ8.54(d,j=2.0,1h),7.95(d,j=3.0,1h),7.80(s,1h),7.48(d,j=2.5,1h),7.23-7.21(m,1h),7.16-7.14(m,1h),6.98-6.96(m,1h),6.81(d,j=9.0,1h),4.57(d,j=11.5,1h),4.30(t,j=10.5,1h),4.20-4.02(m,4h),3.87-3.80(m,1h),3.69(s,3h),3.00-2.84(m,4h),2.75-2.73(m,2h),2.59-2.48(m,2h),2.37(s,6h),1.94-1.83(m,4h)。实施例2695-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮269实施例269a5-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮269a向配有搅拌棒的微波用管中加入5-溴-3-(5-(4-乙基-哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮138c(300mg,0.765mmol)、硼酸酯212b(420.1mg,0.841mmol)、pd(pph3)4(44.2mg,0.038mmol)、na2co3水溶液(1.0n,2.52ml,2.52mmol)、1,2-二甲氧基乙烷(4.0ml)。使混合物在微波中在130℃下反应15min。加入二氯甲烷(200ml),用水(3x30ml)、盐水(30ml)洗涤所得的混合物,用干燥mgso4,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到乙酸酯269a。向配有搅拌棒的圆底烧瓶中加入269a、thf(5ml)、异丙醇(5ml)、水(5ml)、liohh2o(300mg)。在rt下搅拌所得的混合物1hr。在真空中除去溶剂,将所得的残余物加入到二氯甲烷(200ml)中,用水(3x30ml)、盐水(30ml)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=10:90)得到浅褐色固体269,158mg.ms(esi+)m/z643.4(m+h)。实施例2703-(5-((2-(二甲基氨基)乙基)(甲基)氨基)吡啶-2-基氨基)-5-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)苯基)-1-甲基吡啶-2(1h)-酮270实施例270an1,n1,n2-三甲基-n2-(6-硝基吡啶-3-基)乙烷-1,2-二胺270a向配有磁力搅拌器的100-ml圆底烧瓶中加入1e(3.00g,14.8mmol)、n1,n1,n2-三甲基乙烷-1,2-二胺(2.26g,22.2mmol)和n,n-二甲基乙酰胺(10ml)。加入n,n-二异丙基乙胺(3.69g,28.6mmol)和四丁基碘化铵(8.18g,22.8mmol),并在90℃下搅拌反应混合物14h。此后,使反应冷却至室温,然后倒入水(20ml)中。用乙酸乙酯(100ml)萃取所得的混合物。分离有机层,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过柱色谱纯化所得的残余物得到75%收率(2.50g)的黄色油状物270a:1hnmr(300mhz,cdcl3)δ8.15(d,1h,j=9.1hz),7.98(d,1h,j=3.2hz),7.00(dd,1h,j=9.1,3.2hz),3.58(t,1h,j=6.9hz),3.14(s,3h),2.52(t,2h,j=7.1hz),2.29(s,6h);ms(esi+)m/z225.1(m+h)。实施例270bn5-(2-(二甲基氨基)乙基)-n5-甲基吡啶-2,5-二胺270b用氮气吹扫250-mlparr反应瓶,并加入10%钯/碳(50%湿度,1.00g干重)和270a(2.20g,9.80mmol)在乙醇(150ml)中的溶液。将瓶连接到parr加氢反应器,抽真空,充入氢气至压力50psi并振摇3h。此后,抽除氢气,并将氮气充入瓶中。加入celite521(1.00g),然后通过celite521垫过滤混合物。用乙醇(2x25ml)洗涤滤饼,然后将合并的滤液在减压下浓缩至干得到定量收率的紫色油状物270b(1.91g):1hnmr(500mhz,cdcl3)7.67(d,1h,j=2.9hz),7.05(dd,1h,j=8.5,2.9hz),6.48(dd,1h,j=8.9,0.5hz),4.04(brs,2h),3.28(t,2h,j=7.1hz),2.84(s,3h),2.43(t,2h,j=7.4hz),2.26(s,6h);ms(esi+)m/z195.2(m+h)。实施例270c5-溴-3-(5-((2-(二甲基氨基)乙基)(甲基)氨基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮270c向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml双颈圆底烧瓶中加入270b(1.00g,5.20mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.53g,5.72mmol)、碳酸铯(5.09g,15.6mmol)和1,4-二噁烷(52ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入xantphos(257mg,0.442mmol)和三(二亚苄基丙酮)二钯(0)(239mg,0.260mmol),并在回流下加热反应混合物3h。此后,将混合物冷却至室温,并用乙酸乙酯(150ml)和水(30ml)稀释。分离有机层,然后用乙酸乙酯(3x150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。用甲醇(20ml)使残余物成粉末,得到63%收率(700mg)的灰白色固体270c:mp161–163℃;1hnmr(300mhz,dmso-d6)δ8.50(d,1h,j=2.3hz),8.39(s,1h),7.75(d,1h,j=2.4hz),7.40(d,1h,j=2.4hz),7.17(m,2h),3.50(s,3h),3.56(t,2h,j=6.9hz),2.86(s,3h),2.35(t,2h,j=7.1hz),2.16(s,6h);ms(esi+)m/z380.1(m+h)。实施例270d3-(5-((2-(二甲基氨基)乙基)(甲基)氨基)吡啶-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮270d向配有回流冷凝管、磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入270c(500mg,1.32mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二-1,3,2-二氧杂环戊硼烷(668mg,2.63mmol)、乙酸钾(389mg,3.96mmol)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)(97mg,0.132mmol),并在回流下加热反应混合物1h。此后,将混合物冷却至室温,并用乙酸乙酯(150ml)和水(30ml)稀释。分离有机层,然后用乙酸乙酯(3x150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩得到定量收率的粗品270d。残余物未经进一步纯化使用。向配有回流冷凝管、磁力搅拌器和氮气入口的50-ml三颈圆底烧瓶中加入247a(420mg,0.901mmol)、270d(290mg,0.690mmol)、碳酸钠(220mg,2.07mmol)、水(2ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(80mg,0.069mmol),并在回流下加热反应混合物2h。此后,将混合物冷却至室温,并用乙酸乙酯(150ml)和水(30ml)稀释。分离有机层,然后用乙酸乙酯(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。将残余物溶于thf(10ml)、甲醇(10ml)和水(10ml)的混合物中。将一水合氢氧化锂(420mg,10.0mmol)加入到所得的溶液中。在室温下搅拌混合物2h,然后在真空中浓缩。使残余物在乙酸乙酯(150ml)和水(30ml)之间分配。分离有机层,然后用甲醇/二氯甲烷的20%(v/v)溶液(3×150ml)萃取水层。用硫酸钠干燥合并的有机层,然后在减压下浓缩。通过柱色谱纯化残余物(硅胶,0%-20%甲醇/二氯甲烷)得到14%收率(53mg)的灰白色固体270:mp106–107℃;1hnmr(500mhz,dmso-d6)δ8.45(d,1h,j=2.5hz),8.20(s,1h),7.69(d,1h,j=2.5hz),7.32(m,2h),7.17(m,3h),4.84(t,1h,j=4.0hz),4.33(m,2h),4.04(m,1h),3.84(m,1h),3.58(s,3h),3.03(m,1h),2.89(m,1h),2.75(s,2h),2.53(d,2h,j=8.9hz),2.32(t,2h,j=7.2hz),2.14(s,6h),1.23(s,6h);ms(esi+)m/z645.3(m+h)。实施例27110-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮271实施例271a10-[5-氟-2-(乙酰氧基甲基)-3-(1-甲基-5-{[5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮271a向配有磁力搅拌器的微波用管中加入5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基)吡啶-2-基氨基)吡啶-2(1h)-酮(172a)(216mg,0.6mmol)、230a(390mg,0.8mmol)、1,2-二甲氧基乙烷(8ml)和1m碳酸钠水溶液(2ml)。在持续15min鼓吹n2后,加入pd(pph3)4(36mg,0.03mmol)。将混合物在微波中加热至130℃持续15min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用二氯甲烷–9:1二氯甲烷:甲醇的梯度洗脱,得到30%收率(120mg)的271a。向配有磁力搅拌器的25ml圆底烧瓶中加入271a(110mg,0.2mmol)、氢氧化锂(40mg,0.9mmol)、thf(1ml)、异丙醇(1ml)和水(2ml)。在rt下搅拌混合物30min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。用用biotagekpnh12+m柱通过柱色谱纯化所得的残余物,己烷-乙酸乙酯的梯度洗脱,得到88%收率(94mg)的271。ms(esi+)m/z597.4(m+h)。实施例27210-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮272实施例272a10-[3-(5-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(乙酰氧基甲基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮272a向配有搅拌棒的微波用管中加入182b(270mg,0.579mmol)、3-(5-(4-乙基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮201a(382mg,0.868mmol)、pd(pph3)4(34mg,0.029mmol)、na2co3水溶液(1.0n,1.91ml,1.91mmol)、1,2-二甲氧基乙烷(4.0ml)。使混合物在微波中在130℃下反应15min。加入二氯甲烷(200ml),用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到272a。向配有搅拌棒的圆底烧瓶中加入272a、thf(5ml)、异丙醇(5ml)、水(5ml)、liohh2o(300mg)。在rt下搅拌所得的混合物1hr。在真空中除去溶剂,将所得的残余物加入到二氯甲烷(200ml)中,用水(30mlx3)、盐水(30mlx1)洗涤溶液,用干燥mgso4,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=10:90)得到黄色固体272,143mg。ms(esi+)m/z657.6(m+h)。实施例27310-{5-氟-3-[5-({5-[4-(2-氟乙基)哌嗪-1-基]吡啶-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-2-(羟甲基)苯基}-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮273实施例273b10-{5-氟-3-[5-({5-[4-(2-氟乙基)哌嗪-1-基]吡啶-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-2-(乙酰氧基甲基)苯基}-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮273b按照实施例186f,使273a(利用与用来制备270d的那些相类似的条件从217d原位制得)(200mg,0.49mmol)和189a(176mg,0.39mmol)反应得到273b(115mg,33%收率)。按照实施例186,使273b(115mg,0.16mmol)、1nlioh(0.82ml)、thf(3ml)和异丙醇(3ml)反应,然后通过hplc(乙腈/水/tfa)纯化。向残余物中加入乙酸乙酯和饱和碳酸氢钠水溶液,并搅拌混合物~15min。分离各层,并用盐水洗涤有机相,用无水硫酸钠干燥,过滤,然后在真空下浓缩得到273(23mg,22%收率)。ms(esi+)m/z658.5(m+h)。实施例27410-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(吗啉-4-基甲基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮274实施例274a5-溴-1-甲基-3-(5-(吗啉代甲基)吡啶-2-基氨基)吡啶-2(1h)-酮274a按照实施例186d,制备化合物274a。实施例274c10-[5-氟-2-(乙酰氧基甲基)-3-(1-甲基-5-{[5-(吗啉-4-基甲基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮274c按照实施例186e和186f,在步骤1中用274a(300mg,0.79mmol)原位得到274b,然后在步骤2中与189a(284mg,0.63mmol)反应得到274c(250mg,46%收率)。按照实施例119,使274c(250mg,0.36mmol)、1nlioh(1.5ml)、thf(3ml)和异丙醇(3ml)反应,通过柱色谱(isco12g硅胶,0-10%甲醇)纯化,然后用二氯甲烷/乙醚使其成粉末,得到274(89mg,39%收率)。ms(esi+)m/z627.5(m+h)。实施例2752-(2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡啶并[3,4-b]中氮茚-1(2h)-酮275向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入197e(210mg,0.560mmol)、118f(330mg,0.710mmol)、碳酸钠(175mg,1.70mmol)、水(2ml)和1,4-二噁烷(8ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(64mg,0.055mmol)。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后将所得的残余物溶于thf(3ml)、水(3ml)和甲醇(3ml)的混合物中。加入一水合氢氧化锂(100mg,2.40mmol),并在室温下搅拌反应2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(50ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2x75ml)萃取水层,然后用硫酸钠干燥合并的有机萃取液。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱纯化所得的残余物(硅胶,0%-10%甲醇/二氯甲烷),得到8%收率(35mg)的非结晶灰白色固体275:mp180–181℃;1hnmr(500mhz,dmso-d6)δ8.54(d,1h,j=2.5hz),8.31(s,1h),7.84(d,1h,j=2.5hz),7.42(t,1h,j=8.0hz),7.35(m,1h),7.26(d,2h,j=8.0hz),7.19(d,1h,j=9.0hz),6.00(s,1h),4.69(t,1h,j=5.0hz),4.31(d,2h,j=4.5hz),3.99(m,1h),3.95(m,1h),3.88(m,2h),3.57(s,3h),3.05(m,5h),2.90(m,1h),2.70(t,2h,j=6.0hz),2.42(m,5h),2.19(s,3h),1.91(m,2h),2.73(m,2h);ms(esi+)m/z594.3(m+h)。实施例27610-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(5-甲基-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮276实施例276a10-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(5-甲基-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮276a向配有磁力搅拌器的微波用管中加入5-溴-1-甲基-3-(5-甲基-1h-吡唑-3-基氨基)吡啶-2(1h)-酮112a(150mg,0.5mmol)、230a(350mg,0.7mmol)、1,2-二甲氧基乙烷(6.4ml)和1m碳酸钠水溶液(1.6ml)。在持续15min鼓吹n2后,加入pd(pph3)4(31mg,0.03mmol)。将混合物在微波中加热至130℃持续15min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5二氯甲烷:乙醚:甲醇的梯度洗脱,得到16%收率(50mg)的276a。向配有磁力搅拌器的25ml圆底烧瓶中加入276a(50mg,0.1mmol)、氢氧化锂(18mg,0.4mmol)、thf(0.4ml)、异丙醇(0.4ml)和水(1ml)。在rt下搅拌混合物30min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,然后过滤。将混合物在减压下浓缩至接近干燥,此时期望的产物析出,然后过滤。经乙醚(10ml)洗涤得到87%收率(40mg)的276。ms(esi+)m/z531.4(m+h)。实施例2775-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(5-{[甲基(丙烷-2-基)氨基]甲基}吡啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮277实施例277a5-[5-氟-2-(乙酰氧基甲基)-3-{1-甲基-5-[(5-{[甲基(丙烷-2-基)氨基]甲基}吡啶-2-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮277a按照实施例186,在步骤2中使原位制得的186e(270mg,0.74mmol)与212a(267mg,0.59mmol)反应。通过柱色谱纯化(isco12g硅胶,50-100%乙酸乙酯/己烷而后0-15%meoh/ch2cl2)得到277a(270mg,55%收率)。按照实施例119,使277a(270mg,0.41mmol)、1nlioh(2.0ml)、thf(4ml)和异丙醇(4ml)反应,然后用乙醚使其成粉末,得到277(185mg,73%收率)。ms(esi+)m/z616.4(m+h)。实施例27810-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[4-(1-甲基哌啶-4-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮278实施例278a10-[5-氟)-3-(4-甲基-6-{[4-(1-甲基哌啶-4-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苄基乙酸酯]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮278a按照实施例136d,使282c和(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b反应得到62%收率的278a。lcms:(m+h)+684按照实施例136,将278a转化成278,39%收率。lcms:(m+h)+642。1hnmr(500mhz,dmso)δ9.22(s,1h),7.90(s,1h),7.87(s,1h),7.48(s,1h),7.36(dd,j=9.5,1h),7.31(dd,j=9,1h),7.16(s,1h),7.14(s,1h),4.46(m,2h),4.05(m,2h),3.85(m,2h),3.54(s,3h),3.01(m,1h),2.92(m,3h),2.75(s,2h),2.53(m,2h),2.44(m,1h),2.27(s,3h),2.13(m,2h),1.70(m,4h),1.22(s,6h)。实施例27910-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮279实施例279a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6十二-1(8),2(6)-二烯-10-基}-4-氟-6-[1-甲基-5-({5-甲基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基)甲基乙酸酯279a向25ml密封管中加入5-溴-1-甲基-3-(5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮146a(340mg,1.0mmol)、(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(480mg,1.0mmol)、ch3coona(168mg,2.0mmol)、k3po4(546mg,2.0mmol)、pdcl2(dppf)(84mg,0.1mmol),使它们悬浮于ch3cn(25ml)和水(1ml)中。在110℃下加热混合物2小时,蒸发,通过柱色谱纯化残余物,用15:1二氯甲烷/甲醇洗脱,得到褐色固体279a(300mg,46%)。ms:(m+h)+645。向279a(300mg,0.46mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.1g,57mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到白色固体279(99mg,35%)。ms:(m+h)+603。1hnmr(500mhz,meod)δ1.29(d,6h),2.49(s,3h),2.59(d,2h),2.81(s,2h),2.94-2.97(m,3h),3.07-3.14(m,1h),3.64(s,2h),3.70(s,3h),3.97-3.99(m,1h),4.05-4.07(t,2h),4.12-4.15(m,1h),4.47-4.54(m,2h),5.89(s,1h),7.19-7.22(m,2h),7.26(d,1h),7.91(s,1h)。实施例28010-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮280实施例280a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(1-甲基-5-{[6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-二氮杂萘-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基)甲基乙酸酯280a向25ml密封管中加入5-溴-1-甲基-3-(6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮219a(400mg,1.0mmol)、(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(493mg,1.0mmol)、ch3coona(168mg,2.0mmol)、k3po4(546mg,2.0mmol)、pdcl2(dppf)(84mg,0.1mmol),使它们悬浮于ch3cn(25ml)和h2o(1ml)中。在110℃下加热混合物2小时。然后蒸发,通过柱色谱纯化残余物,用20:1二氯甲烷/甲醇(20:1)洗脱,得到褐色固体280a(400mg,56%)。ms:(m+h)+698。向280a(400mg,0.57mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.4g,57mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到白色固体280(52mg,14%)。ms:(m+h)+656。1hnmr(500mhz,meod)δ1.29(d,6h),2.56-2.63(q,2h),2.70-2.72(t,2h),2.81(s,2h),2.93-2.99(m,3h),3.08-3.12(m,1h),3.47(s,2h),3.72-3.74(m,4h),3.96-4.01(m,1h),4.13-4.18(m,1h),4.51-4.60(q,2h),4.68-4.71(t,2h),4.76-4.79(t,2h),6.89(d,1h),7.21-7.23(d,2h),7.34(d,1h),7.40(s,1h),8.78(s,1h)。实施例2815-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[4-(1-甲基哌啶-4-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮281实施例281a[4-氟-2-(4-甲基-6-{[4-(1-甲基哌啶-4-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯281a按照实施例136d,使282c)和(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯212b反应得到73%收率的281a。lcms:(m+h)+670按照实施例136,将281a转化成281,70%收率。lcms:(m+h)+628。1hnmr(500mhz,dmso)δ9.21(s,1h),7.87(s,1h),7.85(s,1h),7.47(s,1h),7.35(dd,j=10,1h),7.30(dd,j=9,1h),7.16(s,1h),7.14(s,1h),4.84(m,1h),4.48(m,1h),4.40(m,1h),3.86(m,1h),3.53(s,3h),2.96(m,1h),2.87(m,4h),2.78(m,2h),2.42(m,2h),2.19(s,3h),1.96(m,2h),1.80(m,4h),1.62(m,5h)。实施例2822-(5-氟-2-(羟甲基)-3-(4-甲基-6-(4-(1-甲基哌啶-4-基)苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮282实施例282a4-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)哌啶-1-羧酸叔丁酯282a将4-(4-氨基苯基)哌啶-1-羧酸叔丁酯(2.5g,9.06mmol)和3,5-二溴-1-甲基吡嗪-2(1h)-酮(2.2g,8.23mmol)在异丙醇(30ml)中的混合物在85℃下加热15h。在反应完成后,过滤,然后用异丙醇洗涤固体得到白色固体282a(2.9g,80%)。lcms:(m+h)+463实施例282b5-溴-1-甲基-3-(4-(哌啶-4-基)苯基氨基)吡嗪-2(1h)-酮282b按照实施例247a,将282a转化成282b,99%收率。实施例282c5-溴-1-甲基-3-(4-(1-甲基哌啶-4-基)苯基氨基)吡嗪-2(1h)-酮282c按照实施例247b,将282b转化成282c,65%收率。实施例282d4-氟-2-(4-甲基-6-(4-(1-甲基哌啶-4-基)苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯282d按照实施例247c,使282c和4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d反应得到41%收率的282d。按照实施例136,将282d转化成282,36%收率。lcms:(m+h)+611。1hnmr(500mhz,dmso)δ9.22(s,1h),7.90(s,1h),7.88(s,1h),7.49(s,1h),7.36(dd,j=9.5,1h),7.30(dd,j=9.5,1h),7.17(s,1h),7.15(s,1h),6.54(s,1h),4.47(m,2h),4.15(m,3h),3.88(m,2h),2.91(m,2h),2.59(m,2h),3.05(m,1h),2.46(m,3h),2.25(s,3h),2.07(m,2h),1.80(m,2h),1.70(m,6h)。实施例2832-(5-氟-2-(羟甲基)-3-(4-甲基-6-(2-甲基-1,2,3,4-四氢异喹啉-6-基氨基)-5-氧代-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮283实施例283a4-氟-2-(4-甲基-6-(2-甲基-1,2,3,4-四氢异喹啉-6-基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯283a按照实施例148b,使290mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d和209mg5-溴-1-甲基-3-(2-甲基-1,2,3,4-四氢异喹啉-6-基氨基)吡嗪-2(1h)-酮221b反应得到黄色固体283a(217mg,58%)。ms:[m+h]+699按照实施例148,将283a转化成白色固体283(84mg,43%)。1hnmr(500mhz,dmso)δ9.15(s,1h),7.82(s,1h),7.65(d,j=8,1h),7.52(s,1h),7.39(dd,j=10,1h),7.31(dd,j=10,1h),6.96(d,j=8.0,1h),6.53(s,1h),4.87(s,1h),4.49(m,1h),4.42(m,1h),4.13(m,3h),3.88(m,1h),3.54(s,3h),3.41(s,2h),3.30(s,1h),2.76(d,j=5.5,6h),2.58(m,5h),23.2(s,3h),1.79(s,2h),1.70(s,2h)。实施例28410-(3-{5-[(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-5-氟-2-(羟甲基)苯基)-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮284在配有磁力搅拌棒的48-ml密封管中加入5-溴-1-甲基-3-(6-乙基-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮(143mg,0.4mmol)、10-[2-(乙酰氧基甲基)-3-(4,4,5,5-四甲基[1,3,2]-二氧杂环戊硼烷-2-基)-5-氟苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮230a(496mg,1.0mmol)、pd(pph3)4(23mg,0.020mmol)和2nna2co3(4ml)和dme(4ml)。在100℃下搅拌反应混合物1h后,通过快速色谱(二氯甲烷:甲醇,3:1)纯化得到7%(18mg)的284ms(esi+)m/z611.5(m+h)。实施例28510-{3-[5-({5-乙基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-5-氟-2-(羟甲基)苯基}-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮285实施例285a5-乙基-2-硝基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪285a向配有磁力搅拌器的密封管中加入1-(2-溴乙基)-5-(溴甲基)-3-硝基-1h-吡唑101c(2.8g,9mmol)和2m乙胺/thf溶液(27ml)。在35℃下过夜加热所得的混合物。此后,在减压下浓缩反应混合物,然后向残余物加入水(50ml)和乙酸乙酯(50ml)。分离水层,然后用乙酸乙酯(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。在减压下浓缩所得的溶液得到100%收率(1.8g)的粗品285a。实施例285b5-乙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-胺285b向500-mlparr氢化瓶中加入285a(1.8g,9mmol)、10%钯/碳(50%湿度,500mg干重)和乙醇(100ml)。对瓶抽真空,充入氢气至压力50psi并在parr氢化装置上振摇1h。通过celite521垫过滤除去催化剂,并用1:1二氯甲烷:甲醇(500ml)洗涤。在减压下浓缩所得的溶液得到71%收率(1.7g)的粗品285b。实施例285c5-溴-3-(5-乙基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-1-甲基吡啶-2(1h)-酮285c向配有磁力搅拌器的密封管中加入285b(1.1g,6.4mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮5(1.7g,6.4mmol)和碳酸铯(4.6g,14mmol)和1,4-二噁烷(64ml)。在持续30min使氮气鼓泡经过溶液后,加入xantphos(440mg,0.8mmol)和三(二亚苄基丙酮)二钯(0)(400mg,0.5mmol),并在100℃下加热反应混合物16h。此后,加入水(50ml)和乙酸乙酯(50ml)。分离水层,然后用乙酸乙酯(2×50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5二氯甲烷:乙醚:甲醇的梯度洗脱,得到28%收率(620mg)的285c。实施例285d10-{3-[5-({5-乙基-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-5-氟-2-(乙酰氧基甲基)苯基}-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮285d向配有磁力搅拌器的微波用管中加入285c(190mg,0.5mmol)、230a(350mg,0.7mmol)、1,2-二甲氧基乙烷(6.4ml)和1m碳酸钠水溶液(1.6ml)。在持续15min鼓吹n2后,加入pd(pph3)4(31mg,0.03mmol)。将混合物在微波中加热至130℃持续15min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。通过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5二氯甲烷:乙醚:甲醇的梯度洗脱,得到35%收率(120mg)的285d。向配有磁力搅拌器的25ml圆底烧瓶中加入285d(120mg,0.2mmol)、氢氧化锂(40mg,1mmol)、thf(1ml)、异丙醇(1ml)和水(2ml)。在rt下搅拌混合物30min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,然后过滤。将混合物在减压下浓缩至接近干燥,此时期望的产物析出,然后过滤。用乙醚(10ml)洗涤得到78%收率(90mg)的285。ms(esi+)m/z600.6(m+h)。实施例2862-(3-(5-(5-((2-(二甲基氨基)乙基)(甲基)氨基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮286按照实施例270,使212a(550mg,1.20mmol)和270d(428mg,1.00mmol)反应得到8%收率(49mg)的灰白色固体286:mp122–123℃;1hnmr(500mhz,dmso-d6)δ8.45(d,1h,j=2.0hz),8.20(s,1h),7.69(d,1h,j=2.4hz),7.31(m,2h),7.17(m,3h),4.83(t,1h,j=4.6hz),4.32(d,2h,j=4.3hz),4.06(m,1h),3.87(m,1h),3.58(s,3h),2.96(m,1h),2.86(m,1h),2.83(s,3h),2.78(m,2h),2.54(m,1h),2.32(t,2h,j=7.0hz),2.14(s,6h),1.80(m,4h);ms(esi+)m/z631.3(m+h)。实施例2875-(5-氟-2-(羟甲基)-3-(6,6-二甲基-3,4,6,7-四氢-5h-环戊二烯并[4,5]噻吩并[2,3-c]吡啶-1(2h)-基)苯基)-1-甲基-3-(5-(1-甲基吡咯烷-3-基)吡啶-2-基氨基)吡啶-2(1h)-酮287实施例287a1-甲基-3-(5-(1-甲基吡咯烷-3-基)吡啶-2-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮287a向配有磁力搅拌器和氮气入口的100-ml单颈圆底烧瓶中加入202a(481mg,1.33mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二-1,3,2-二氧杂环戊硼烷(675mg,2.66mmol)、乙酸钾(392mg,3.99mmol)和1,4-二噁烷(12ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入pd(dppf)cl2(97.0mg,0.133mmol)。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物3h。此后,用乙酸乙酯(100ml)和水(75ml)稀释混合物,然后分离各层。用乙酸乙酯(2×50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液得到定量收率(548mg)的褐色半固体粗品287a。粗品混合物未经进一步纯化用于下一反应:ms(esi+)m/z411.2(m+h)。向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶中加入粗品287a(274mg,0.668mmol,假定定量收率)、247a(420mg,0.865mmol)、碳酸钠(207mg,1.99mmol)、水(2ml)和1,4-二噁烷(10ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入四(三苯基膦)钯(0)(151mg,0.133mmol)。将回流冷凝管连接到烧瓶,然后在90℃下加热反应混合物1h。此后,用90:10二氯甲烷/甲醇(100ml)和水(75ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2×50ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后将所得的残余物溶于thf(5ml)、水(5ml)和甲醇(5ml)中。加入一水合氢氧化锂(47mg,1.12mmol),并在室温下搅拌混合物2h。此后,用90:10二氯甲烷/甲醇(100ml)和水(50ml)稀释混合物,然后分离各层。用90:10二氯甲烷/甲醇(2x75ml)萃取水层,用盐水(100ml)洗涤合并的有机层,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过快速色谱(硅胶,80:20二氯甲烷/甲醇)纯化所得的残余物得到27%收率(110mg)的非结晶灰白色固体287:mp181–183℃;1hnmr(500mhz,dmso-d6)δ8.64(d,j=2.0hz,1h),8.49(s,1h),8.07(d,j=2.5hz,1h),7.54(dd,j=8.5,2.5hz,1h),7.40(d,j=2.0hz,1h),7.34(dd,j=9.0,2.5hz,1h),7.25(d,j=8.5hz,1h),7.19(dd,j=9.5,2.5hz,1h),4.86(t,j=4.0hz,1h),4.34–4.32(m,2h),4.10–4.03(m,1h),3.87–3.83(m,1h),3.59(s,3h),3.25–3.20(m,1h),3.05–2.99(m,1h),2.91–2.87(m,1h),2.81–2.77(m,1h),2.75(s,2h),2.60–2.58(m,2h),2.55–2.50(m,2h),2.49–2.32(m,1h),2.27(s,3h),2.22–2.17(m,1h),1.71–1.67(m,1h),1.23(s,6h);ms(esi+)m/z628.3(m+h)。实施例2882-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基吡咯烷-2-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮288按照实施例286,使212a(450mg,1.04mmol)和287b(328mg,0.810mmol)反应得到26%收率(130mg)的灰白色固体288:mp164–166℃;1hnmr(500mhz,dmso-d6)δ8.67(d,1h,j=2.0hz),8.55(s,1h),8.06(d,1h,j=2.4hz),7.53(dd,1h,j=8.5,2.4hz),7.41(d,1h,j=2.4hz),7.32(dd,1h,j=9.1,2.1hz),7.26(d,1h,j=9.0hz),7.19(dd,1h,j=9.0,2.0hz),4.85(t,1h,j=4.2hz),4.32(m,2h),4.04(m,1h),3.87(m,1h),3.59(s,3h),3.13(m,1h),2.95(m,2h),2.84(m,1h),2.78(m,2h),2.54(m,1h),2.18(q,1h,j=4.0hz),2.04(m,4h),1.80(m,6h),1.58(m,1h);ms(esi+)m/z614.3(m+h)。实施例2892-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-吗啉基吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,5,6,7,8-六氢苯并噻吩并[2,3-c]吡啶-1(2h)-酮289实施例289a1-甲基-3-(5-吗啉基吡啶-2-基氨基)-5-(4,4,5,5-四甲基1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮289a向配有磁力搅拌器和氮气入口的250-ml单颈圆底烧瓶中加入255c(610mg,1.70mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二-1,3,2-二氧杂环戊硼烷(850mg,3.40mmol)、乙酸钾(492mg,5.00mmol)和1,4-二噁烷(20ml)。在持续30min使氮气鼓泡通过所得的悬浮液后,加入pd(dppf)cl2/ch2cl2(122mg,0.200mmol)。将回流冷凝管连接到烧瓶,并在90℃下加热反应混合物2h。此后,用乙酸乙酯(100ml)和水(75ml)稀释混合物,然后分离各层。用乙酸乙酯(50ml)萃取水层,用盐水(50ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。通过过滤除去干燥剂。在减压下浓缩滤液,然后通过用己烷/乙酸乙酯(80:20,25ml)粉末化来纯化所得的残余物得到定量收率(688mg)的褐色固体289a:mp100–101℃;1hnmr(500mhz,dmso-d6)8.45(d,1h,j=1.5hz),8.21(s,1h),7.91(s,1h),7.89(d,1h,j=3.0hz),7.66(d,1h,j=6.5hz),7.14(d,1h,j=9.0hz),3.73(t,4h,j=4.5hz),3.55(s,3h),3.05(t,4h,j=4.5hz),1.29(s,12h);ms(esi+)m/z413.0(m+h)用氮气吹扫配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶,并加入289a(485mg,0.415mmol)、247a(488mg,1.10mmol)、碳酸钠(264mg,2.50mmol)、1,4-二噁烷(8ml)和水(2ml)。用氮气对此混合物脱气30min。加入四(三苯基膦)钯(96mg,0.083mmol)。在100℃下加热2h后,将反应混合物冷却至室温,然后在水(40ml)和二氯甲烷(100ml)之间分配。分离各层,并用二氯甲烷(2x50ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。将所得的残余物溶于甲醇(5ml)中,然后加入碳酸钾(745mg,5.40mmol)。在室温下搅拌1h后,使反应混合物在水(20ml)和二氯甲烷(20ml)之间分配。分离各层,并用二氯甲烷(2×20ml)萃取水相。合并有机萃取液,用硫酸钠干燥,过滤,然后在减压下浓缩。通过快速色谱(硅胶,0%-15%甲醇/二氯甲烷)纯化所得的残余物得到51%收率(130mg)的黄色固体289:mp220–221℃;1hnmr(500mhz,dmso-d6)δ8.55(d,1h,j=2.0hz),8.37(s,1h),7.87(d,1h,j=3.0hz),7.34(m,3h),7.23(d,1h,j=9.0hz),7.16(dd,1h,j=9.5,3.0hz),4.83(t,1h,j=4.0hz),4.32(m,2h),4.05(m,1h),3.86(m,1h),3.71(t,4h,j=4.5hz),3.58(s,3h),3.01(t,4h,j=4.5hz),2.98(m,1h),2.87(m,1h),2.77(m,2h),2.54(m,1h),1.79(m,4h);ms(esi+)m/z616.2(m+h)。实施例29010-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[(2s)-1-甲基吡咯烷-2-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮290实施例29110-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[(2r)-1-甲基吡咯烷-2-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮291化合物290和291是外消旋物243的对映异构体。在chiralpakad,4.6x50mm,3μm柱上(流动相45%异丙醇(w/0.1%三乙胺)/55%co2,流速5ml/min),在40℃下对外消旋混合物243进行手性分离,得到各个对映异构体,其中290首先洗脱:ms(esi+)m/z611.5(m+h),最后洗脱实施例291:ms(esi+)m/z611.5(m+h)。实施例29210-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮292实施例292a10-[5-氟-2-(乙酰氧基甲基)-3-(1-甲基-5-{[6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮292a在配有磁力搅拌棒的10-ml微波反应容器中加入5-溴-1-甲基-3-(6-(氧杂环丁烷-3-基)-5,6,7,8-四氢-1,6-萘啶-2-基氨基)吡啶-2(1h)-酮219a(250mg,0.64mmol)、10-[2-(乙酰氧基甲基)-3-(4,4,5,5-四甲基-[1,3,2]二氧杂环戊硼烷-2-基)-5-氟苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮230a(635mg,1.3mmol)、pd(pph3)4(37mg,0.03mmol)和2nna2co3(2ml)和1,2-二甲氧基乙烷(2ml)。在125℃下搅拌反应混合物10分钟后,通过快速色谱(二氯甲烷:甲醇,3:1)纯化得到12%(50mg)的固体292a。向配有磁力搅拌棒的25-ml单颈圆底烧瓶中加入292a(50mg,0.078mmol)、lioh·h2o(50mg,1.2mmol)、thf(2ml)、i-proh(2ml)和水(2ml)。在室温下搅拌反应混合物2h后,使其在二氯甲烷(5ml)和水(5ml)之间分配,然后用二氯甲烷(5mlx3)萃取有机相。用水(5mlx2)和盐水(5mlx1)洗涤合并的有机相,干燥(na2so4),然后浓缩。将粗产物再溶于二氯甲烷(3ml)中。向此溶液中加入己烷(10ml),然后过滤所得的沉淀得到12%收率(6mg)的292ms(esi+)m/z639.5(m+h)。实施例2932-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基氧基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮293实施例293a4-氟-2-(1-甲基-5-(5-(1-甲基氮杂环丁烷-3-基氧基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯293a将5-溴-1-甲基-3-(5-(1-甲基氮杂环丁烷-3-基氧基)吡啶-2-基氨基)吡啶-2(1h)-酮199f(200mg,0.55mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(270mg,0.56mmol)、pdcl2(dppf)(40mg,0.055mmol)、k3po4(150mg)、naoac(50mg)在mecn(8ml)和水(2ml)中的混合物在密封管中在110℃下加热2h。在真空中蒸发溶剂。在反相combi快速色谱上纯化残余物得到293a(307mg,70%)。ms:[m+h]+641。将293a(287mg,0.45mmol)和lioh水合物(188mg,4.5mmol)在异丙醇(25ml)和水(5ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到293(60mg,25%)。ms:[m+h]+599。1hnmr(500mhz,cdcl3)δ8.51(s,1h),7.81(s,1h),7.74(s,1h),7.48(s,1h),7.16-7.14(m,1h),7.11-7.09(m,1h),6.95-6.93(m,1h),6.86(s,1h),6.79(d,j=9.0,1h),4.76-4.72(m,1h),4.53(d,j=8.5,1h),4.34-4.25(m,2h),4.20-4.13(m,3h),3.95-3.84(m,3h),3.69(s,3h),3.24-3.13(m,2h),2.64-2.52(m,4h),2.46(s,3h),1.93-1.84(m,2h),1.81-1.75(m,2h)。实施例29410-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[4-(1-甲基哌啶-4-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮294实施例294a(2-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}-4-氟-6-(4-甲基-6-{[4-(1-甲基哌啶-4-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基)甲基乙酸酯294a按照实施例150b,使282c和(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯230a反应得到81%收率的294a。lcms:(m+h)+667按照实施例150,将294a转化成294,47%收率。lcms:(m+h)+625。1hnmr(500mhz,dmso)δ9.20(s,1h),7.89(s,1h),7.87(s,1h),7.48(s,1h),7.36(dd,j=10,1h),7.31(dd,j=9.5,1h),7.17(s,1h),7.15(s,1h),6.52(s,1h),4.85(m,1h),4.49(m,1h),4.40(m,1h),4.20(m,2h),4.12(m,1h),3.87(m,1h),3.54(s,3h),2.84(d,j=10.5,1h),2.57(s,2h),2.42(s,2h),2.38(m,1h),2.18(s,3h),1.93(t,j=9,2h),1.66(m,4h),1.22(s,6h)。实施例29510-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮295实施例295a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基)甲基乙酸酯295a向密封管中加入5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮282c(350mg,0.93mmol)、(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(448mg,0.93mmol)、pd(dppf)cl2(76mg,0.09mmol)、k3po4.3h2o(495mg,1.86mmol)和naoac(153mg,1.86mmol)在ch3cn(20ml)中的混合物。对系统抽真空而后再充入n2。在110℃下加热反应混合物2h。将混合物冷却至室温,然后过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用15:1二氯甲烷/甲醇洗脱,得到褐色固体295a(300mg,47%)。ms:[m+h]+684向295a(250mg,0.37mmol)在丙-2-醇(8ml)、四氢呋喃(8ml)和水(1ml)中的溶液中加入lioh(878mg,37mmol)并在30℃下搅拌2h。然后蒸发,通过制备型hplc纯化残余物得到黄色固体295(76mg,32%)。ms:(m+h)+642。1hnmr(500mhz,meod)δ1.29(d,6h),1.94-2.02(m,2h),2.18(d,2h),2.56-2.64(m,2h),2.81(s,2h),2.94-3.03(m,5h),3.08-3.19(m,3h),3.66(d,1h),3.74(s,3h),3.92-3.97(m,1h),4.14-4.19(m,1h),4.50(s,1h),7.21-7.28(m,2h),7.84(s,1h),7.95(d,1h),8.13(s,1h)。实施例29610-{3-[5-({5-[2-(二甲基氨基)乙氧基]吡啶-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-5-氟-2-(羟甲基)苯基}-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮296实施例296a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-6-[5-({5-[2-(二甲基氨基)乙氧基]吡啶-2-基}氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基]-4-氟苯基)甲基乙酸酯296a将5-溴-3-(5-(2-(二甲基氨基)乙氧基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮268c(244mg,0.67mmol)、(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(342mg,0.67mmol)、pdcl2(dppf)(59mg,0.08mmol)、k3po4(150mg)和naoac(50mg)在mecn(6ml)和水(2ml)中的混合物在密封管中在110℃下加热2h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到296a(287mg,60%)。ms:[m+h]+674。将296a(186mg,0.28mmol)和lioh水合物(116mg,2.8mmol)在异丙醇(25ml)和水(5ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液,然后在制备型hplc上纯化残余物得到296(126mg,71%)。ms:[m+h]+632。实施例2972-(3-(5-(5-(2-(二甲基氨基)乙氧基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-5-氟-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮297实施例297a2-(5-(5-(2-(二甲基氨基)乙氧基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-4-氟-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯297a将5-溴-3-(5-(2-(二甲基氨基)乙氧基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮268c(205mg,0.56mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(270mg,0.56mmol)、pdcl2(dppf)(51mg,0.07mmol)、k3po4(100mg)和naoac(40mg)在mecn(6ml)和水(2ml)中的混合物在密封管中在110℃下加热2h。在真空中蒸发溶剂。在反相combi快速色谱上纯化残余物得到297a(206mg,50%)。ms:[m+h]+643。将297a(186mg,0.29mmol)和lioh水合物(122mg,2.9mmol)在异丙醇(15ml)和水(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(20ml×2)萃取残余物。在减压下浓缩合并的萃取液,然后在制备型hplc上纯化残余物得到297(84mg,48%)。ms:[m+h]+601。1hnmr(500mhz,cdcl3)δ8.53(d,j=2.5,1h),7.94(d,j=3.0,1h),7.80(s,1h),7.47(d,j=2.0,1h),7.23-7.21(m,1h),7.16-7.14(m,1h),6.95-6.93(m,1h),6.86(s,1h),6.81(d,j=9.0,1h),4.55(d,j=10.5,1h),4.40-4.26(m,2h),4.22-4.15(m,3h),4.15-4.04(m,2h),3.94-3.86(m,1h),3.69(s,3h),2.75-2.73(m,2h),2.62-2.54(m,4h),2.37(s,6h),1.92-1.86(m,2h),1.82-1.76(m,2h)。实施例29810-[5-氟-2-(羟甲基)-3-(4-甲基-6-{[4-(1-甲基氮杂环丁烷-3-基)苯基]氨基}-5-氧代吡嗪-2-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮298实施例298a3-(4-氨基苯基)氮杂环丁烷-1-羧酸叔丁酯298a将3-碘氮杂环丁烷-1-羧酸叔丁酯(1g,3.53mmol)、4-氨基苯基硼酸(630mg,4.59mmol)、nii2(66mg,0.212mmol)、nahmds(1.94g,10.6mmol)、(1r,2s)-2-氨基环己醇(24mg,0.212mmol)在异丙醇(8ml)中的混合物在微波中在150℃下搅拌2h。然后蒸发,将残余物溶于水和乙酸乙酯中。分离水相,然后用乙酸乙酯萃取。用硫酸钠干燥合并的萃取液,然后在减压下浓缩。用柱色谱纯化残余物得到298a(360mg,40%)。ms:[m+h]+249。实施例298b3-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)氮杂环丁烷-1-羧酸叔丁酯298b将298a(500mg,2.02mmol)、3,5-二溴-1-甲基吡嗪-2(1h)-酮(536mg,2.02mmol)和三乙胺(0.6ml,4.04mmol)在异丙醇(10ml)中的混合物在回流下加热4天。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到298b(690mg,66%)。ms:[m+h]+435。实施例298c3-(4-(氮杂环丁烷-3-基)苯基氨基)-5-溴-1-甲基吡嗪-2(1h)-酮盐酸盐298c将298b(690mg,1.6mmol)和hcl/1,4-二噁烷(8m,8ml)在甲醇(30ml)中的混合物在室温下过夜搅拌。在真空中蒸发混合物,然后在反相combi快速色谱上纯化残余物得到298c(100mg,17%)。ms:[m+h]+335。实施例298d5-溴-1-甲基-3-(4-(1-甲基氮杂环丁烷-3-基)苯基氨基)吡嗪-2(1h)-酮298d将298c(100mg,0.24mmol)、nabh(oac)3(100mg,0.48mmol)、hcho(10ml)和乙酸(1ml)在甲醇(15ml)中的混合物在室温下搅拌4h。在真空中蒸发溶剂,然后用nahco3溶液中和残余物直至达到ph8。用乙酸乙酯萃取混合物。用硫酸钠干燥合并的萃取液,然后在减压下浓缩得到298d(100mg),未经进一步纯化用于下一步骤。ms:[m+h]+349。实施例298e(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4-甲基-6-{[4-(1-甲基氮杂环丁烷-3-基)苯基]氨基}-5-氧代-4,5-二氢吡嗪-2-基)苯基)甲基乙酸酯298e向密封管中加入(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(100mg,0.19mmol)、5-溴-1-甲基-3-(4-(1-甲基氮杂环丁烷-3-基)苯基氨基)吡嗪-2(1h)-酮298d(68mg,0.19mmol)、pdcl2(dppf)(14mg,0.019mmol)、k3po4(60mg)和naoac(30mg)在mecn(5ml)和水(1ml)中的混合物。在110℃下加热2h。在真空中蒸发溶剂,然后在反相combi快速色谱上纯化残余物得到298e(100mg,82%)。ms:[m+h]+656。将298e(100mg,0.16mmol)和lioh水合物(66mg,1.6mmol)在异丙醇(10ml)和水(2ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(2x20ml)萃取残余物。在减压下浓缩合并的萃取液。在制备型hplc上纯化残余物得到298(60mg,63%)。ms:[m+h]+614。1hnmr(500mhz,cdcl3)δ8.29(s,1h),7.72(d,j=7.5,2h),7.55(s,1h),7.45-7.43(m,1h),7.30(s,1h),7.01-6.99(m,1h),4.56(d,j=11.5,1h),4.41-4.30(m,2h),4.10-4.05(m,1h),3.90-3.85(m,1h),3.82-3.72(m,2h),3.64(s,3h),3.22-3.10(m,2h),3.04-2.97(m,1h),2.93-2.88(m,1h),2.79(s,2h),2.57-2.50(m,2h),2.39(s,3h),1.27(s,6h)。实施例29910-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[1-(氧杂环丁烷-3-基)哌啶-4-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮299按照实施例121b,使化合物247b(256mg,0.5mmol)、5-溴-1-甲基-3-(5-(1-(氧杂环丁烷-3-基)哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮264e(210mg,0.5mmol)、1m碳酸钠溶液(2ml,2mmol)、四(三苯基膦)钯(0)(29mg,0.025mmol)和1,2-二甲氧基乙烷(5ml)反应。在微波反应器中在130℃下加热反应混合物15分钟。经后处理和快速柱色谱(硅胶,9:1二氯甲烷/甲醇)得到化合物299a和299的黄色油状混合物。除了使用thf(2ml)、水(1ml)和异丙醇(2ml)的混合物以及一水合氢氧化锂(105mg,2.5mmol)之外,利用与121相同的方法对上述残余物(0.5mmol)脱保护。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到12%收率(40mg)的浅黄色固体299:ms(esi+)m/z684.5(m+h)。实施例30010-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[1-(氧杂环丁烷-3-基)哌啶-4-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮300实施例300a5-溴-3-(2-甲氧基嘧啶-4-基氨基)-1-甲基吡啶-2(1h)-酮300a按照实施例121a,使2-甲氧基嘧啶-4-胺(0.625g,5mmol)、3,5-二溴-1-甲基-1h-吡啶-2-酮(1.34g,5mmol)、碳酸铯(4.88g,15mmol)、三(二亚苄基丙酮)二钯(0)(0.465g,0.5mmol)、xantphos(0.58g,1mmol)和1,4-二噁烷(50ml)反应。在100℃下加热反应混合物24小时,然后冷却至室温,通过celite521垫过滤。用9:1二氯甲烷/甲醇(2x25ml)洗涤滤饼,然后将合并的滤液浓缩至干。将残余物溶于二氯甲烷中,加入乙醚,然后过滤所得的沉淀得到定量收率(1.57g)的绿色固体300a:ms(esi+)m/z313.1(m+h)。实施例300b10-[5-氟-2-(乙酰氧基甲基)-3-[1-甲基-5-({5-[1-(氧杂环丁烷-3-基)哌啶-4-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮300b按照实施例121b,使用300a(242mg,0.5mmol)、230a(210mg,0.5mmol)、1m碳酸钠溶液(2ml,2mmol)、四(三苯基膦)钯(0)(29mg,0.025mmol)和1,2-二甲氧基乙烷(5ml)。在微波反应器中在130℃下加热反应混合物15分钟。经后处理和快速柱色谱(硅胶,60:35:5二氯甲烷/乙醚/甲醇)得到67%收率(200mg)的黄色固体300b:ms(esi+)m/z602.4(m+h)。按照实施例121,使用thf(2ml)、水(1ml)和异丙醇(2ml)的混合物、300b(200mg,0.33mmol)和一水合氢氧化锂(105mg,2.5mmol)。经后处理和快速柱色谱(nh-硅胶,乙酸乙酯/己烷)得到29%收率(55mg)的白色固体化合物300:ms(esi+)m/z559.4(m+h)。实施例3012-(2-(羟甲基)-3-(1-甲基-6-氧代-5-(5-(哌嗪-1-基)吡啶-2-基氨基)-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮301实施例301a4-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)哌嗪-1-羧酸叔丁酯301a向配有搅拌棒的圆底烧瓶中加入4-(6-氨基吡啶-3-基)哌嗪-1-羧酸叔丁酯(2.00g,7.18mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(2.87g,10.77mmol)、pd2(dba)3(657mg,0.718mmol)、xantphos(665mg,1.15mmol)、cs2co3(7.72g,23.7mmol)和二噁烷(40ml)。在100℃下加热反应混合物40hr。加入乙酸乙酯(200ml),用水(30mlx3)、盐水(30mlx1)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。加入二氯甲烷/乙醚(1:2,5ml),然后超声处理,过滤沉淀得到黄色固体301a,1.946g(58%)。实施例301b4-(6-(5-(2-(乙酰氧基甲基)-3-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苯基)-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)哌嗪-1-羧酸叔丁酯301b向配有搅拌棒的微波用管中加入301a(500mg,1.077mmol)、2-(2-(羟甲基)-3-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮114a(546mg,1.292mmol)、pd(pph3)4(62mg,0.054mmol)、na2co3水溶液(1.0n,3.55ml,3.55mmol)、1,2-二甲氧基乙烷(4.3ml)。使混合物在微波中在130℃下反应10min。加入二氯甲烷(200ml),用水(3x30ml)、盐水(30ml)洗涤所得的混合物,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱色谱(甲醇:二氯甲烷=5:95)得到301b。向配有搅拌棒的圆底烧瓶中加入301b、二氯甲烷(10ml)。将溶液在冰水浴中冷却至0℃。加入tfa(1ml),并过夜搅拌所得的溶液。在真空中除去所有的易挥发物,然后向瓶中加入thf(5ml)、异丙醇(5ml)、h2o(5ml)、lioh一水合物(300mg)。在rt下搅拌所得的混合物1hr。在真空中除去所有的溶剂,向所得的残余物中加入二氯甲烷(200ml),用水(3x30ml)、盐水(30ml)洗涤溶液,用mgso4干燥,过滤,然后在真空中除去溶剂。经硅胶柱(甲醇:二氯甲烷=10:90)而后制备型hplc得到黄色固体301,9mg。ms(esi+)m/z580.4(m+h)。实施例30210-(3-{5-[(1-乙基-5-甲基-1h-吡唑-3-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-5-氟-2-(羟甲基)苯基)-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮302实施例302a5-溴-3-(1-乙基-5-甲基-1h-吡唑-3-基氨基)-1-甲基吡啶-2(1h)-酮302a向配有磁力搅拌器的密封管中加入1-乙基-5-甲基-1h-吡唑-3-胺(870mg,7mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.9g,7mmol)和碳酸铯(5g,15mmol)和1,4-二噁烷(69ml)。在持续30min使氮气鼓泡经过溶液后,加入xantphos(480mg,0.8mmol)和三(二亚苄基丙酮)二钯(0)(450mg,0.5mmol),并将反应混合物加热至100℃持续16h。此后,加入水(50ml)和乙酸乙酯(50ml)。分离水层,然后用乙酸乙酯(2x50ml)萃取。用盐水(100ml)洗涤合并的有机萃取液,然后用硫酸钠干燥。将混合物在减压下浓缩至接近干燥,此时期望的产物析出,然后过滤。用乙醚(10ml)洗涤得到40%收率(870mg)的302a。实施例302b10-(3-{5-[(1-乙基-5-甲基-1h-吡唑-3-基)氨基]-1-甲基-6-氧代-1,6-二氢吡啶-3-基}-5-氟-2-(乙酰氧基甲基)苯基)-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮302b向配有磁力搅拌器的微波用管中加入302a(170mg,0.5mmol)、230a(350mg,0.7mmol)、1,2-二甲氧基乙烷(4ml)和1m碳酸钠水溶液(1.6ml)。在持续15min鼓吹n2后,加入pd(pph3)4(31mg,0.03mmol)。将混合物在微波中加热至130℃持续15min。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,过滤,然后在减压下浓缩。洗脱通过柱色谱纯化所得的残余物,用二氯甲烷–60:35:5二氯甲烷:乙醚:甲醇的梯度,得到60%收率(190mg)的302b。向配有磁力搅拌器的25ml圆底烧瓶中加入302b(190mg,0.3mmol)、氢氧化锂(70mg,1.6mmol)、thf(1.6ml)、异丙醇(1.6ml)和水(3.2ml)。在室温下搅拌混合物2h。此后,加入乙酸乙酯(5ml)和水(5ml)。用乙酸乙酯(2x5ml)萃取分离的水层。用盐水(10ml)洗涤合并的有机相,用硫酸钠干燥,然后过滤。将混合物在减压下浓缩至接近干燥,此时期望的产物析出,然后过滤。用乙醚(10ml)洗涤得到51%收率(90mg)的302。ms(esi+)m/z559.4(m+h)。实施例3035-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[1-(氧杂环丁烷-3-基)哌啶-4-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮303按照实施例299,将化合物212b转化成303。ms(esi+)m/z670.3(m+h)。实施例30410-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮304实施例304a(2-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基-6-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}苯基)甲基乙酸酯304a按照实施例211d,将(2-溴-6-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}苯基)甲基乙酸酯167f转化成304a,85%收率。lcms:(m+h)+479。实施例304b(2-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}-6-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基)甲基乙酸酯304b向密封管中加入304a(335mg,0.7mmol)、5-溴-1-甲基-3-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮188e(294mg,0.7mmol)、pd(dppf)cl2(33mg,0.04mmol)、k3po4.3h2o(372mg,1.4mmol)和naoac(115mg,1.4mmol)在ch3cn(20ml)中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体304b(208mg,43%)。ms:[m+h]+696。在室温下,向304b(200mg,0.29mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(70mg,2.9mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20ml水,用乙酸乙酯(3x30ml)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体304(100mg,53%)。lcms:[m+h]+635。1hnmr(500mhz,dmso)δ1.22(s,6h),2.37-2.42(m,6h),2.56(d,j=11.0hz,1h),3.06(d,j=4.5hz,,4h),3.41-3.44(m,2h),3.59(s,3h),3.85-3.90(m,1h),4.08-4.21(m,3h),4.35(d,j=4.5hz,2h),4.45-4.47(m,2h),4.54-4.57(m,2h),4.84-4.86(m,1h),6.45(s,1h),7.22(d,j=9.0hz,1h),7.31-7.47(m,4h),7.86(d,j=3.0hz,1h),8.37(s,1h),8.56(d,j=2.0hz,1h)。实施例3055-[2-(羟甲基)-3-[4-甲基-6-({4-[1-(氧杂环丁烷-3-基)哌啶-4-基]苯基}氨基)-5-氧代-4,5-二氢吡嗪-2-基]苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮305实施例305a{2-[4-甲基-6-({4-[1-(氧杂环丁烷-3-基)哌啶-4-基]苯基}氨基)-5-氧代-4,5-二氢吡嗪-2-基]-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基}甲基乙酸酯305a按照实施例136e,使用5-溴-1-甲基-3-(4-(1-(氧杂环丁烷-3-基)哌啶-4-基)苯基氨基)吡嗪-2(1h)-酮214b和(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯111a得到68%收率的305a。lcms:(m+h)+694按照实施例136,将305a转化成305,51%收率。lcms:(m+h)+652。1hnmr(500mhz,dmso)δ9.18(s,1h),7.88(s,1h),7.86(s,1h),7.52(d,j=7.5,1h),7.46(t,j=7.5,1h),7.38(s,1h),7.17(s,1h),7.32(d,j=7.5,1h),7.15(d,j=8.5,2h),4.78(m,1h),4.52(m,3h),4.43(m,3h),4.01(m,1h),3.87(m,1h),3.54(s,3h),3.37(m,1h),2.96(m,1h),2.86(m,1h),2.78(m,4h),2.43(m,2h),1.82(s,6h),1.72(m,2h),1.60(m,2h)。实施例30610-[2-(羟甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢哒嗪-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮306实施例306b10-[2-(乙酰氧基甲基)-3-[1-甲基-6-氧代-5-(嘧啶-4-基氨基)-1,6-二氢哒嗪-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮306b步骤1:在耐压烧瓶中加入5-氯-1-甲基-3-(嘧啶-4-基氨基)哒嗪-2(1h)-酮(300mg,1.26mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(577mg,2.27mmol)、乙酸钾(247mg,2.32mmol)、x-phos(2-二环己基膦-2′,4′,6′-三异丙基联苯基)(120mg,20mol%)和三(二亚苄基丙酮)二钯(0)(115mg,10mol%)。对烧瓶抽真空并充入n23x,加入二噁烷(12ml),将容器密封,然后加热至90℃持续2hr。使反应冷却,然后用乙酸乙酯稀释,通过celite垫过滤,而后在减压下浓缩得到306a,直接用于下一步骤。步骤2:将306a溶于二噁烷(7ml)中,并转移至包含189a(448mg,1.0mmol)、10%k2co3/水(2.5ml)和双(二叔丁基(4-二甲基氨基苯基)膦)二氯化钯(ii)(45mg,5mol%)的耐压烧瓶中。将烧瓶密封,然后过夜加热至100℃。然后用乙酸乙酯和水稀释反应,分离,用盐水3x洗涤,用na2so4干燥,过滤,然后在减压下浓缩。通过色谱(isco24g硅胶,用50-100%乙酸乙酯/己烷洗脱)纯化残余物得到306b(250mg,2步总收率35%)。按照实施例119,使306b(250mg,0.44mmol)、1nlioh(2.2ml)、thf(4.5ml)和异丙醇(4.5ml)反应。用乙醚使产物粉末化,然后在真空下干燥得到灰白色固体306(185mg,80%收率)。ms(esi+)m/z529.3(m+h)。实施例3072-(2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮307。实施例307a6-氯-2-甲基-4-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)哒嗪-3(2h)-酮307a按照实施例119b,使4-溴-6-氯-2-甲基哒嗪-3(2h)-酮(1.5g,6.7mmol)、5-(4-甲基-哌嗪-1-基)-吡啶-2-基胺(1.3g,6.7mmol)、碳酸铯(4.8g,39.4mmol)和xantphos(330mg,8.5mol%)、二噁烷(50ml)和三(二亚苄基丙酮)二钯(0)(307mg,5mol%)反应。通过柱色谱(isco40g硅胶,50-100%乙酸乙酯/己烷而后0-10%甲醇)纯化得到浅棕褐色固体307a(1.2g,53%)。实施例307c2-(2-(乙酰氧基甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮307c按照实施例306b,将307a(422mg,1.26mmol)转化成硼中间体307b,使其在suzuki条件下与109a(420mg,1.0mmol)偶联。通过柱色谱(isco24g硅胶,50-100%乙酸乙酯/己烷而后0-10%meoh)纯化粗产物,得到307c(285mg,36%收率)。按照实施例119,使307c(285mg,0.45mmol)、1nlioh(2.2ml)、thf(5ml)和异丙醇(5ml)反应,用乙酸乙酯粉末化,然后在真空下干燥,得到浅黄色固体307(115mg,43%收率)。ms(esi+)m/z595.6(m+h)。实施例3085-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基吡咯烷-3-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮308按照实施例270,使硼酸酯212b与溴化物202a反应得到308。ms(esi+)m/z614.3(m+h)。实施例3095-[2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡啶并[3,4-b]中氮茚-2-基}苯基]-1-甲基-3-{4h,6h,7h-吡唑并[3,2-c][1,4]噁嗪-2-基氨基}-1,2-二氢吡啶-2-酮309按照实施例270,使硼酸酯113a与溴化物110c反应得到309。ms(esi+)m/z541.2(m+h)。实施例3103-{[5-(4-乙基哌嗪-1-基)吡啶-2-基]氨基}-5-[2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡啶并[3,4-b]中氮茚-2-基}苯基]-1-甲基-1,2-二氢吡啶-2-酮310按照实施例270,使硼酸酯113a与溴化物138c反应得到310。ms(esi+)m/z608.3(m+h)。实施例31110-[2-(羟甲基)-3-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮311实施例311a(2-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}-6-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基)甲基乙酸酯311a向密封管中加入(2-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯304a(335mg,0.7mmol)、5-溴-1-甲基-3-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮188e(294mg,0.7mmol)、pd(dppf)cl2(33mg,0.04mmol)、k3po4.3h2o(372mg,1.4mmol)和naoac(115mg,1.4mmol)在ch3cn(20ml)中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后将其冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体311a(208mg,43%)。ms:[m+h]+696。在室温下,向311a(200mg,0.29mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(70mg,2.9mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20ml水,用乙酸乙酯(3x30ml)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体311(100mg,53%)。lcms:[m+h]+635。1hnmr(500mhz,dmso)δ1.22(s,6h),2.37-2.42(m,6h),2.56(d,j=11.0hz,1h),3.06(d,j=4.5hz,,4h),3.41-3.44(m,2h),3.59(s,3h),3.85-3.90(m,1h),4.08-4.21(m,3h),4.35(d,j=4.5hz,2h),4.45-4.47(m,2h),4.54-4.57(m,2h),4.84-4.86(m,1h),6.45(s,1h),7.22(d,j=9.0hz,1h),7.31-7.47(m,4h),7.86(d,j=3.0hz,1h),8.37(s,1h),8.56(d,j=2.0hz,1h)。实施例31210-[2-(羟甲基)-3-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮312实施例312a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-6-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基)甲基乙酸酯312a按照实施例136e,将5-溴-1-甲基-3-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮(24-7)和(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-6-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯131a转化成312a,63%收率。lcms:(m+h)+709按照实施例136,将312a转化成312,60%收率。lcms:(m+h)+667。1hnmr(500mhz,meod)δ8.52(s,1h),7.93(m,1h),7.50(m,1h),7.42(m,3h),7.30(s,1h),7.05(m,1h),4.73(t,j=6.5,2h),4.64(t,j=6,2h),4.56(m,2h),4.14(m,1h),3.98(m,1h),3.71(s,3h),3.67(m,1h),3.16(m,4h),3.11(m,1h),2.96(m,1h),2.81(s,2h),2.60(m,2h),2.53(s,4h),1.29(d,j=3,6h)。实施例3135-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(2s)-(1-甲基吡咯烷-2-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮313实施例3145-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(2r)-(1-甲基吡咯烷-2-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮314化合物313和314是外消旋物288的对映异构体。在chiralpakad,4.6x50mm,3mm柱(流动相55%异丙醇(w/0.1%三乙胺)/45%co2,流速5ml/min)上在40℃下对外消旋混合物288进行手性分离,得到各个对映异构体,其中首先洗脱313,最后洗脱314。实施例3155-[2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮315实施例315a[2-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基]甲基乙酸酯315a向密封管中加入5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮130c(400mg,1.06mmol)、(2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯111a(512mg,1.06mmol)、pd(dppf)cl2(87mg,0.1mmol)、k3po4.3h2o(566mg,2.12mmol)和naoac(174mg,2.12mmol)在ch3cn(25ml)中的混合物。对系统抽真空而后再充入n2。在110℃下加热反应混合物2h。然后,将混合物冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用10:1二氯甲烷/甲醇洗脱,得到褐色固体315a(300mg,43%)。ms:[m+h]+652向315a(250mg,0.38mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(1.5ml)中的溶液中加入lioh(922mg,38mmol)。在30℃下搅拌混合物2h。然后蒸发,通过反相combi快速色谱纯化残余物,用含有0.3%nh4hco3的1:4水/ch3cn洗脱,得到白色固体315(37mg,16%)。ms:(m+h)+610。1hnmr(500mhz,meod)δ1.74-1.84(m,4h),1.87-1.95(m,4h),2.13-2.18(t,j=11.5,2h),2.32(s,3h),2.52-2.61(m,3h),2.85-2.87(t,j=4.5,2h),2.92-3.06(m,4h),3.71(s,3h),3.99-4.03(m,1h),4.12-4.17(m,1h),4.52-4.59(m,2h),7.03(d,1h),7.34(d,1h),7.39(d,1h),7.42(d,1h),7.51(d,1h),7.56(d,1h),8.08(s,1h),8.62(s,1h)。实施例3165-[5-氟-2-(羟甲基)-3-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]-1-甲基-3-[(4-(1-甲基氮杂环丁烷-3-基)苯基)氨基)-1,2-二氢吡嗪-2-酮316实施例316a4-氟-2-(4-甲基-6-(4-(1-甲基氮杂环丁烷-3-基)苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯316a向密封管中加入5-溴-1-甲基-3-(4-(1-甲基氮杂环丁烷-3-基)苯基氨基)吡嗪-2(1h)-酮298c(200mg,0.58mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(280mg,0.58mmol)、pd(dppf)cl2(40mg,0.06mmol)、k3po4.3h2o(300mg,1.16mmol)和naoac(100mg,1.16mmol)在ch3cn(20ml)中的混合物。对系统抽真空而后再充入n2。在110℃下加热反应混合物3h。然后,将混合物冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用15:1二氯甲烷/甲醇洗脱,得到褐色固体216a(150mg,42%)。ms:[m+h]+625向316a(130mg,0.21mmol)在丙-2-醇(7ml)、四氢呋喃(7ml)和水(1ml)中的溶液中加入lioh(500mg,21mmol)。在30℃下搅拌混合物2h。蒸发,然后通过制备型hplc纯化残余物得到白色固体316(14mg,12%)。ms:(m+h)+583。1hnmr(500mhz,meod)δ1.77-1.81(m,2h),1.89-1.95(m,2h),2.46(s,3h),2.55(t,j=6,2h),2.60-2.68(m,2h),3.64(s,3h),3.73-3.77(m,1h),3.85(s,2h),4.16-4.27(m,1h),4.46-4.59(m,2h),6.72(s,1h),7.19-7.21(d,1h),7.8-7.30(d,2h),7.31-7.41(dd,2h),7.78(d,2h)。实施例31710-[2-(羟甲基)-3-(1-甲基-5-{[5-(氧杂环丁烷-3-基)-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮317实施例317a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-6-(1-甲基-5-{[5-(氧杂环丁烷-3-基)-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基)甲基乙酸酯317a向密封管中加入5-溴-1-甲基-3-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮252a(275mg,0.7mmol)、(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯131a(356mg,0.7mmol)、pd(dppf)cl2(59mg,0.07mmol)、k3po4.3h2o(317mg,1.4mmol)和naoac(118mg,1.4mmol)在ch3cn(20ml)中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体317a(300mg,61%)。ms:[m+h]+669。在室温下,向317a(300mg,0.5mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(70mg,2.9mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20mlh2o,用乙酸乙酯(3x30ml)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体317(93mg,28%)。ms:[m+h]+627。1hnmr(500mhz,dmso)δ1.24(s,6h),2.65(s,1h),2.75(d,j=8.5hz,4h),2.88-2.91(m,1h),3.00-3.03(m,1h),3.50(s,2h),3.57(s,3h),3.67(t,j=6.0hz,1h),3.84-3.89(m,1h),3.93(t,j=6.0hz,2h),4.00-4.05(m,1h),4.34-4.36(m,2h),4.49(t,j=6.0hz,2h),4.59(t,j=7.0hz,2h),4.83(d,j=5.0hz,1h),5.91(s,1h),7.24(d,j=2.0hz,1h),7.24-7.35(m,2h),7.45(t,j=7.0hz,1h),7.98(d,j=2.0hz,1h),8.13(s,1h)。实施例31810-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(氧杂环丁烷-3-基)-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮318实施例318a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(1-甲基-5-{[5-(氧杂环丁烷-3-基)-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基)甲基乙酸酯318a向密封管中加入(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(300mg,0.584mmol)、5-溴-1-甲基-3-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮252a(222mg,0.584mmol)、pd(dppf)cl2(48mg,0.0584mmol)、k3po4.3h2o(311mg,1.168mmol)和naoac(96mg,1.168mmol)在ch3cn(20ml)中的混合物。对系统抽真空而后再充入n2。在110℃下加热反应混合物2h。然后,将混合物冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体318a(304mg,74%)。ms:[m+h]+687。在室温下向318a(300mg,0.44mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(100mg,4.16mmol)。搅拌混合物0.5h。然后,加入20mlh2o,用乙酸乙酯(30ml×3)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体318(68.7mg,52.3%)。1hnmr(500mhz,dmso)δ8.17(s,1h),7.98(d,j=6hz,1h),7.30(t,2h),7.17(t,1h),5.91(s,1h),4.88(t,1h),4.58(t,2h),4.48(t,2h),4.32(d,1h),4.05(t,1h),4.02(m,3h),3.94(m,2h),3.92(s,1h),3.83(s,1h),3.30(s,1h),3.02(m,1h),2.88(s,4h),2.73(s,2h),1.20(s,6h)实施例3192-(2-(羟甲基)-3-(1-甲基-5-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮319实施例319a[2-(1-甲基-5-{[5-(氧杂环丁烷-3-基)-4h,5h,6h,7h-吡唑并[1,5-a]吡嗪-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{1-氧代-1h,2h,3h,4h,6h,7h,8h,9h-吡嗪并[1,2-a]吲哚-2-基}苯基]甲基乙酸酯319a向密封管中加入5-溴-1-甲基-3-(5-(氧杂环丁烷-3-基)-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-2-基氨基)吡啶-2(1h)-酮252a(265mg,0.7mmol)、2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯114a(320mg,0.7mmol)、pd(dppf)cl2(56mg,0.07mmol)、k3po4.3h2o(367mg,1.4mmol)和naoac(113mg,1.4mmol)在ch3cn(20ml)中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后将其冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体319a(200mg,38%)。ms:[m+h]+638。在室温下,向319a(150mg,0.24mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(70mg,2.9mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20ml水,用乙酸乙酯(3x30ml)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体319(50mg,28%)。ms:[m+h]+596。1hnmr(500mhz,dmso)δ1.23(t,j=7.0hz,2h),1.70-2.08(m,5h),2.74-2.76(m,2h),3.50(s,2h),3.57(s,3h),3.67(s,1h),3.91-3.94(m,3h),4.03-4.16(m,4h),4.35(s,2h),4.48-4.50(m,2h),4.58-4.60(m,2h),4.61(s,1h),5.91(s,1h),6.51(s,1h),7.23(s,1h),7.30-7.34(m,2h),7.44-7.47(m,1h),7.98(d,j=2.0hz,1h),8.12(s,1h)。实施例3202-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮320实施例320an-甲基(1-甲基-3-硝基-1h-吡唑-5-基)甲胺320a在0℃(冰浴)下在搅拌下向menh2(30重量%h2o)(2.5g,20mmol)在丙酮(10ml)中的溶液加入k2co3(415mg,3mmol),然后滴加5-(溴甲基)-1-甲基-3-硝基-1h-吡唑(220mg,1mmol)在丙酮(5ml)中的溶液。然后将反应混合物升温至室温并搅拌3h。除去溶剂,用二氯甲烷(15ml×3)萃取残余物,用na2so4干燥,然后浓缩得到黄色油状物320a(170mg,99%),未经进一步纯化用于下一步骤。lcms:(m+h)+171实施例320bn-甲基-n-((1-甲基-3-硝基-1h-吡唑-5-基)甲基)氧杂环丁烷-3-胺320b在室温下在氮气保护下向320a(170mg,1mmol)在甲醇(4ml)中的混合物中加入zncl2(1mmol/l乙醚溶液)(2ml,2mmol)和氧杂环丁烷-3-酮(150mg,2mmol),然后加入nabh3cn(130mg,2mmol)。使反应混合物升温至50℃并搅拌3h。然后将混合物冷却至室温,除去溶剂。通过快速柱色谱纯化残余物,用50:1二氯甲烷/甲醇洗脱,得到黄色固体320b(180mg,80%,2步)。lcms:(m+h)+227。1hnmr(500mhz,dmso)δ6.99(s,1h),4.52(t,j=6.5,2h),4.42(t,j=6,2h),3.98(s,3h),3.63(m,1h),3.50(s,2h),2.03(s,3h)。实施例320c1-甲基-5-((甲基(氧杂环丁烷-3-基)氨基)甲基)-1h-吡唑-3-胺320c向320b(1.8g,7.96mmol)在乙醇(20ml)和水(20ml)中的溶液中加入nh4cl(3.3g,63.6mmol)和铁粉(1.80g,31.8mmol)。在70℃下加热反应混合物2h。其后,将混合物冷却至室温,然后过滤。蒸发滤液,用二氯甲烷(30ml×3)萃取残余物,na2so4干燥,然后浓缩得到粗产物,将其在快速柱上纯化,用含有0.5%三乙胺的50:1二氯甲烷/甲醇洗脱,得到黄色油状物320c(1.3g,83%)。lcms:(m+h)+197实施例320d5-溴-1-甲基-3-(1-甲基-5-((甲基(氧杂环丁烷-3-基)氨基)甲基)-1h-吡唑-3-基氨基)吡啶-2(1h)-酮320d按照实施例136d,使320c和3,5-二溴-1-甲基吡啶-2(1h)-酮反应得到63%收率的320d。lcms:(m+h)+383。1hnmr(500mhz,dmso)δ8.35(s,1h),7.99(d,j=2.5,1h),7.36(d,j=2.5,1h),5.99(s,1h),4.50(t,j=7,2h),4.40(t,j=6.5,2h),3.77(s,3h),3.57(m,1h),3.49(s,3h),3.35(s,2h),2.01(s,3h)。实施例320e4-氟-2-(1-甲基-5-(1-甲基-5-((甲基(氧杂环丁烷-3-基)氨基)甲基)-1h-吡唑-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯320e按照实施例136e,将210d转化成320e,71%收率。按照实施例136,将320e转化成320,66%收率。lcms:(m+h)+616。1hnmr(500mhz,dmso)δ8.07(s,1h),7.97(s,1h),7.30(m,2h),7.17(d,j=9.5,1h),6.53(s,1h),6.02(s,1h),4.88(m,1h),4.50(t,j=6.5,2h),4.40(t,j=5.5,2h),4.32(s,2h),4.14(m,3h),3.89(m,1h),3.70(s,3h),3.57(m,4h),2.59(m,2h),2.47(m,2h),2.00(s,3h),1.80(m,2h),1.70(m,2h)。实施例32110-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(1-甲基-5-{[甲基(氧杂环丁烷-3-基)氨基]甲基}-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮321实施例321a(2-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}-4-氟-6-{1-甲基-5-[(1-甲基-5-{[甲基(氧杂环丁烷-3-基)氨基]甲基}-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基)甲基乙酸酯321a按照实施例136e,使5-溴-1-甲基-3-(1-甲基-5-((甲基(氧杂环丁烷-3-基)氨基)甲基)-1h-吡唑-3-基氨基)吡啶-2(1h)-酮320d和230a反应得到65%收率的321a。lcms:(m+h)+672按照实施例136,将321a转化成321,59%收率。lcms:(m+h)+630。1hnmr(500mhz,dmso)δ8.07(s,1h),7.97(d,j=2.5,1h),7.33(d,j=2.5,1h),7.31(d,j=3,1h),7.29(d,j=2,1h),7.17(dd,j=9.5,1h),6.51(s,1h),6.02(s,1h),4.89(t,j=4.5,1h),4.50(t,j=6.5,2h),4.40(t,j=6,2h),4.33(d,j=4.5,2h),4.21(m,2h),4.13(m,1h),3.88(m,1h),3.70(s,3h),3.57(m,4h),2.57(s,2h),2.42(s,2h),2.00(s,3h),1.22(s,6h)。实施例32210-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(1-甲基-5-{[甲基(氧杂环丁烷-3-基)氨基]甲基}-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮322实施例322a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-{1-甲基-5-[(1-甲基-5-{[甲基(氧杂环丁烷-3-基)氨基]甲基}-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基)甲基乙酸酯322a向密封管中加入5-溴-1-甲基-3-(1-甲基-5-((甲基(氧杂环丁烷-3-基)氨基)甲基)-1h-吡唑-3-基氨基)吡啶-2(1h)-酮320d(250mg,0.65mmol)、(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-4-氟-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(334mg,0.65mmol)、pd(dppf)cl2(55mg,0.07mmol)、k3po4.3h2o(345mg,1.3mmol)和naoac(105mg,1.3mmol)在ch3cn(20ml)中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后将其冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体322a(300mg,56%)。ms:[m+h]+689。在室温下,向322a(250mg,0.35mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(70mg,2.9mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20ml水,用乙酸乙酯(30mlx3)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体322(94mg,36%)。ms:[m+h]+647。1hnmr(500mhz,dmso)δ1.23(s,6h),2.01(s,3h),2.50-2.52(m,2h),2.76(s,2h),2.88-2.91(m,1h),3.04(s,1h),3.55-3.57(m,4h),3.70(s,3h),3.86(t,j=6.0hz,1h),4.06(d,j=5.5hz,1h),4.33-4.41(m,4h),4.50(t,j=6.5hz,2h),4.88(t,j=5.0hz,1h),6.02(s,1h),7.16-7.18(m,1h),7.29-7.34(m,2h),7.97(d,j=2.5hz,1h),8.07(s,1h)。实施例32310-[2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代吡啶-3-基)苯基]-4,4-二甲基-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-9-酮323实施例323a(2-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}-6-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基)甲基乙酸酯323a向25ml密封管中加入5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮282c(376mg,1.0mmol)、(2-{4,4-二甲基-9-氧代-1,10-二氮杂三环[6.4.0.02,6]十二-2(6),7-二烯-10-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯(478mg,1.0mmol)、ch3coona(168mg,2.0mmol)、k3po4(546mg,2.0mmol)、pdcl2(dppf)(84mg,0.1mmol),使它们悬浮于ch3cn(25ml)和h2o(1ml)中。在110℃下加热混合物2小时。然后蒸发,通过柱色谱纯化残余物,用15:1二氯甲烷/甲醇洗脱,得到褐色固体323a(278mg,43%)。ms:(m+h)+649。向323a(200mg,0.3mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.1g,57mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到白色固体323(41mg,22%)。ms:(m+h)+607。1hnmr(500mhz,dmso)δ8.65(s,1h),8.50(s,1h),8.05(s,1h),7.51(m,2h),7.46(m,3h),7.31(d,j=8.5,1h),6.50(s,1h),4.83(m,1h),4.39(m,2h),4.13(m,1h),3.85(m,1h),3.59(s,3h),3.03(m,1h),2.91(m,3h),2.84(m,2h),2.64(m,1h),2.46(m,1h),2.17(s,3h),1.80(m,2h),1.60(m,4h),1.22(s,6h)。实施例3245-[5-氟-2-(羟甲基)-3-{1-甲基-5-[(1-甲基-5-{[甲基(氧杂环丁烷-3-基)氨基]甲基}-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-6-酮324实施例324a(4-氟-2-{1-甲基-5-[(1-甲基-5-{[甲基(氧杂环丁烷-3-基)氨基]甲基}-1h-吡唑-3-基)氨基]-6-氧代-1,6-二氢吡啶-3-基}-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}苯基)甲基乙酸酯324a向密封管中加入5-溴-1-甲基-3-(1-甲基-5-((甲基(氧杂环丁烷-3-基)氨基)甲基)-1h-吡唑-3-基氨基)吡啶-2(1h)-酮320d(150mg,0.39mmol)、(4-氟-2-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7)-二烯-5-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯247b(195mg,0.39mmol)、pd(dppf)cl2(33mg,0.04mmol)、k3po4.3h2o(207mg,0.78mmol)和naoac(63mg,0.78mmol)在ch3cn(20ml)中的混合物。对系统抽真空并再充入n2。在110℃下加热反应混合物2h。然后将其冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体324a(150mg,56%)。ms:[m+h]+675。在室温下,向324a(150mg,0.22mol)在thf/异丙醇/水(6ml/6ml/2ml)中的溶液中加入lioh(70mg,2.9mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20mlh2o,用乙酸乙酯(3x30ml)萃取。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体324(43mg,31%)。ms:[m+h]+633。1hnmr(500mhz,dmso)δ1.75-1.80(m,4h),2.00(s,4h),2.85(s,4h),2.36(s,1h),2.64(s,1h),2.78(s,2h),2.83-2.89(m,1h),2.94-3.01(m,1h),3.58(s,3h),3.69(s,3h),3.86-3.89(m,1h),4.02-4.07(m,1h),4.32(d,j=3.0hz,2h),4.39(t,j=6.5hz,2h),4.49(t,j=6.5hz,2h),4.85(d,j=4.5hz,1h),6.01(s,1h),7.15-7.18(m,1h),7.28-7.32(m,2h),7.96(d,j=2.0hz,1h),8.06(s,1h)。实施例32510-[2-(羟甲基)-3-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代吡啶-3-基)苯基]-4,4-二甲基-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-9-酮325实施例325a(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6]十二-1(8),2(6)-二烯-10-基}-6-(1-甲基-5-{[5-(1-甲基哌啶-4-基)吡啶-2-基]氨基}-6-氧代吡啶-3-基)苯基)甲基乙酸酯325a向25ml密封管中加入5-溴-1-甲基-3-(5-(1-甲基哌啶-4-基)吡啶-2-基氨基)吡啶-2(1h)-酮282c(376mg,1.0mmol)、(2-{4,4-二甲基-9-氧代-7-硫杂-10-氮杂三环[6.4.0.02,6}]十二-1(8),2(6)-二烯-10-基}-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯131a(495mg,1.0mmol)、ch3coona(168mg,2.0mmol)、k3po4(546mg,2.0mmol)、pdcl2(dppf)(84mg,0.1mmol),使它们悬浮于ch3cn(25ml)和水(1ml)中。在110℃下加热混合物2小时。然后蒸发,通过柱色谱纯化残余物,用50:1二氯甲烷/甲醇洗脱,得到褐色固体325a(278mg,42%)。ms:(m+h)+666。向325a(200mg,0.3mmol)在异丙醇(10ml)和四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.1g,57mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到白色固体325(54mg,29%)。ms:(m+h)+624。1hnmr(500mhz,dmso)δ8.66(s,1h),8.50(s,1h),8.10(s,1h),7.51(m,2h),7.46(m,3h),7.31(d,j=8.5,1h),4.83(m,1h),4.39(m,2h),4.13(m,1h),3.85(m,1h),3.59(s,3h),3.03(m,1h),2.91(m,3h),2.84(m,2h),2.64(m,1h),2.46(m,1h),2.23(s,3h),1.80(m,2h),1.66(m,4h),1.20(s,6h)。实施例3262-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4-二氢吡嗪并[1,2-a]吲哚-1(2h)-酮326实施例326a4-氟-2-(1-氧代-3,4-二氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯326a按照实施例102c和102d,制备326a。实施例326b4-氟-2-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4-二氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯326b按照实施例148h,使478mg的326a和378mg5-溴-1-甲基-3-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮197d反应得到黄色固体326b(324mg,50%)。ms:[m+h]+650按照实施例148,将260mg的326b转化成白色固体326(100mg,41%)。ms:[m+h]+607。1hnmr(500mhz,dmso)δ8.58(d,j=2.0,1h),8.39(s,1h),7.87(d,j=3.0,1h),7.73(d,j=8.0,1h),7.63(d,j=8.0,1h),7.46(dd,j=9.0,1h),7.36(m,3h),7.23(m,2h),7.17(m,2h),4.99(d,j=4.5,1h),4.65(m,1h),4.50(m,1h),4.38(s,2h),4.29(m,1h),4.10(m,1h),3.59(s,3h),3.04(t,j=4.0,4h),4.36(t,j=4.0,4h),2.20(s,3h)。实施例3272-(5-氟-2-(羟甲基)-3-(4-甲基-6-(4-(4-(氧杂环丁烷-3-基)哌嗪-1-基)苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮327实施例327a4-(4-硝基苯基)哌嗪-1-羧酸叔丁酯327a按照实施例188a,使1-氟-4-硝基苯(2.8g,20mmol)和n-boc-哌嗪(11g,60mmol)反应得到黄色固体327a(3g,51%)。ms:[m+h]+308。实施例327b4-(4-氨基苯基)哌嗪-1-羧酸叔丁酯327b按照实施例188b,将327a还原成黄色固体327b(1.35g,99%)。ms:[m+h]+278。实施例327c4-(4-(6-溴-4-甲基-3-氧代-3,4-二氢吡嗪-2-基氨基)苯基)哌嗪-1-羧酸叔丁酯327c按照实施例188c,使327b(2.6g,9.4mmol)和3,5-二溴-1-甲基吡嗪-2(1h)-酮(2.5g,9.4mmol)反应得到黄色固体327c(2.96g,68%)。ms:[m+h]+464。实施例327d5-溴-1-甲基-3-(4-(哌嗪-1-基)苯基氨基)吡嗪-2(1h)-酮327d按照实施例188d,对327c脱保护得到黄色固体327d(1.57g,99%)。ms:[m+h]+364。实施例327e5-溴-1-甲基-3-(4-(4-(氧杂环丁烷-3-基)哌嗪-1-基)苯基-氨基)吡嗪-2(1h)-酮327e按照实施例188e,将1.2g(3mmol)的327d转化成黄色固体327e(943mg,75%)。ms:[m+h]+420。实施例327f4-氟-2-(4-甲基-6-(4-(4-(氧杂环丁烷-3-基)哌嗪-1-基)苯基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯327f按照实施例148h,使300mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d和287mg的327e反应得到黄色固体327f(220mg,51%)。lcms:[m+h]+696按照实施例148,将220mg的327f转化成白色固体327(87mg,42%)。1hnmr(500mhz,dmso)δ9.11(s,1h),7.81(d,j=8.5,1h),7.43(s,1h),7.35(t,j=7.0,1h),7.29(d,j=9.0,1h),6.88(d,j=8.5,2h),6.53(s,1h),4.86(s,1h),4.56(t,j=6.5,2h),4.67(d,t=5.5,3h),4.42(m,1h),4.11(m,3h),3.89(m,1h),3.53(s,3h),3.43(s,1h),3.10(t,j=4.5,4h),2.62(m,2h),2.46(m,2h),2.39(t,j=4.5,4h),1.79(s,2h),1.70(s,2h)。实施例3282-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢哒嗪-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮328实施例328a4-(6-(6-氯-2-甲基-3-氧代-2,3-二氢哒嗪-4-基氨基)吡啶-3-基)哌嗪-1-羧酸叔丁酯328a向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中加入1,4-二噁烷(50ml)、4-(6-氨基吡啶-3-基)哌嗪-1-羧酸叔丁酯188b(2.0g,7.2mmol)、4-溴-6-氯-2-甲基-吡啶-3(2h)-酮(1.6g,7.2mmol)和碳酸铯(4.7g,14.4mmol)。在持续30分钟使氮气鼓泡经过所得的混合物后,加入xantphos(500mg,0.9mmol)和三(二亚苄基丙酮)二钯(0)(450mg,0.45mmol),并在回流下加热反应混合物3h。此后,使反应冷却至室温,在乙酸乙酯(100ml)和水(100ml)之间分配,然后过滤。分离水层,然后用乙酸乙酯(50ml×2)萃取。合并有机层,用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过快速柱色谱纯化残余物,用石油醚/乙酸乙酯洗脱,得到328a(1.4g,43%)。ms:[m+h]+421实施例328b6-氯-2-甲基-4-(5-(哌嗪-1-基)吡啶-2-基氨基)哒嗪-3(2h)-酮盐酸盐328b使中间体328a(1.4g,3.3mmol)悬浮于4.0mhcl/二噁烷(10ml)中。在室温下搅拌反应混合物2h,然后在减压下浓缩得到328b(1.1g,96%)。ms:[m+h]+321。实施例328c6-氯-2-甲基-4-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)哒嗪-3(2h)-酮328c将328b(1.2g,3.5mmol)、氧杂环丁烷-3-酮(0.5g,7.0mmol)、nabh3cn(0.44g,7.0mmol)和氯化锌(0.93g,7.0mmol)在甲醇(125ml)中的混合物在50℃下搅拌3.5小时。将混合物加入到水中,然后用二氯甲烷萃取。合并有机层,然后在减压下浓缩。通过柱色谱纯化残余物,用25:1二氯甲烷/甲醇洗脱,得到328c(0.63g,50%)。ms:[m+h]+377。实施例328d4-氟-2-(1-甲基-5-(5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢哒嗪-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯328d向密封管中加入4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(420mg,0.9mmol)、328c(300mg,0.78mmol)、pd(dppf)cl2(66mg,0.078mmol)、k3po4.3h2o(360mg,1.56mmol)和naoac(130mg,1.56mmol)在ch3cn(20ml)中的混合物。对系统抽真空而后再充入n2。在110℃下加热反应混合物2h。然后,将混合物冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体328d(400mg,72%)。ms:[m+h]+696。在室温下向328d(350mg,0.5mol)在thf/ipa/h2o(6ml/6ml/2ml)中的溶液中加入lioh(600mg,25mmol)同时搅拌。搅拌此混合物0.5h。然后,加入20ml水,用乙酸乙酯(30ml×3)萃取所得的混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到白色固体328(100mg,27%)。1hnmr(500mhz,dmso)δ9.25(s,1h),8.41(s,1h),7.97(d,j=3.5hz,1h),7.39-7.45(m,3h),7.25-7.28(m,1h),6.52(s,2h),4.66(t,j=5.0hz,2h),4.55(t,j=6.5hz,2h),4.41-4.46(m,3h),4.31-4.34(m,1h),4.11-4.18(m,3h),3.85-3.87(m,1h),3.77(s,3h),3.43(t,j=6.5hz,1h),3.12(t,j=5.0hz,4h),2.54-2.63(m,2h),2.46(t,j=6.0hz,2h),2.39(t,j=5.0hz,4h),1.79(t,j=5.5hz,2h),1.69(s,2h)。实施例3295-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7),10,12-四烯-6-酮329实施例329a(2z)-3-(1-苯并噻吩-3-基)丙-2-烯酸329a将苯并[b]噻吩-3-甲醛(4.9g,30mol)、丙二酸(6.6g,60mmol)和哌啶(1ml)在100ml无水吡啶中的悬浮液在110℃下过夜加热。将反应混合物冷却至室温,然后在真空中除去溶剂。将残余物溶于100ml水中,然后加入1n盐酸将此溶液的ph调至约3。过滤所得的悬浮液并收集黄色固体,用水(3x30ml)洗涤,在真空中干燥得到黄色固体329a(5.5g,89%)。ms:[m+h]+205。实施例329b3-(1-苯并噻吩-3-基)丙酸329b将329a(5.5g,27mmol)和10%pd/c(600mg)在1:1甲醇/乙酸乙酯(100ml)中的悬浮液在parr装置中在50psi下过夜氢化。通过celite垫过滤混合物,然后在减压下浓缩滤液得到粗品褐色固体329b(5.0g,90%),未经进一步纯化用于下一步骤。ms:[m+h]+207。1hnmr(500mhz,cdcl3)δ2.81-2.84(t,j=8.5,2h),3.18-3.21(m,2h),7.16(s,1h),7.34-7.41(m,2h),7.74-7.76(d,1h),7.85-7.87(d,1h)。实施例329c3-(1-苯并噻吩-3-基)丙酰氯329c使中间体329b(5.0g,24mmol)在二氯亚砜(15ml)中在100℃下加热4小时。将混合物冷却至室温,然后在真空中蒸发溶剂。将30ml二氯甲烷加入到残余物中,然后在减压下蒸发所得的混合物得到褐色固体329c(5.3g,97%),未经进一步纯化用于下一步骤。ms:[m+h]+225。实施例329d7-硫杂三环[6.4.0.02,6]十二-1(8),2(6),9,11-四烯-5-酮329d向在二氯甲烷(50ml)中的329c(5.0g,22.3mmol)中加入无水三氯化铝(5.9g,44.6mmol)。在室温下过夜搅拌混合物。在真空中蒸发反应溶液,通过柱色谱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到黄色固体329d(2.3g,55%)。ms:[m+h]+189。1hnmr(500mhz,cdcl3)δ3.05-3.07(m,2h),3.21-3.23(m,2h),7.45-7.52(m,2h),7.88-7.91(m,2h)。实施例329en-[(5z)-7-硫杂三环[6.4.0.02,6]十二-1(8),2(6),9,11-四烯-5-亚基]羟胺329e在0℃下向nh2oh.hcl(18.4g,266mmol)在meoh(600ml)中的溶液中缓慢加入ch3coona(21.8g,266mmol)。在0℃下搅拌30min后,加入329d(10g,53mmol)。使反应溶液升温至室温并过夜搅拌。然后在真空中蒸发。将100ml水加入到残余物中,然后用乙酸乙酯(500ml×3)萃取所得的混合物。合并有机层,用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液得到黄色固体329e(10g,92%)。ms:[m+h]+203。实施例329f8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7),10,12-四烯-6-酮329f将329e(5g,25mmol)在ppa(80ml)中的溶液在油浴中在150℃下过夜搅拌。使反应冷却至室温,并用150ml水/冰稀释。通过过滤收集固体,用3x50ml水洗涤,然后在真空烘箱中在减压下干燥得到粗产物,通过柱色谱进一步纯化,用1:1乙酸乙酯/石油醚洗脱,得到黄色固体329f(3g,60%)。ms:[m+h]+204实施例329g(2-溴-4-氟-6-{6-氧代-8-硫杂-5-氮杂三环[7.4.0.02,7]十三-1(9),2(7),10,12-四烯-5-基}苯基)甲基乙酸酯329g将329f(700mg,3.4mmol)、197c(3.35g,10.2mmol)、xantphos(200mg,0.34mmol)、pd2(dba)3(316mg,0.34mmol)和cs2co3(2.25g,6.8mmol)在二噁烷(50ml)中的混合物在氩气氛下在100℃下加热15h。然后过滤,在真空中蒸发。通过柱色谱纯化残余物,用1:3乙酸乙酯/石油醚洗脱,得到白色固体329g(500mg,33%)。ms:[m+h]+448。实施例329h[4-氟-2-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-5氮杂三环[7.4.0.02,7]十三-1(9),2(7),10,12-四烯-5-基}苯基]甲基乙酸酯329h向密封管中加入329g(300mg,0.66mmol)、1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基硼酸197f(690mg,1.32mmol)、pd(dppf)cl2(54mg,0.066mmol)和na2co3(141mg,1.32mmol)在dmf(22ml)中的混合物。对系统抽真空而后再充入n2。在微波中在130℃下加热反应混合物1h。然后,将混合物冷却至室温,过滤。在减压下浓缩滤液,通过柱色谱纯化所得的残余物,用15:1二氯甲烷/甲醇洗脱,得到褐色固体329h(300mg,67%)。ms:[m+h]+667。在室温下,向329h(250mg,0.38mol)在thf/异丙醇/水(10ml/10ml/2ml)中的溶液中加入lioh(90mg,38mmol)同时搅拌。搅拌此混合物2h。然后,加入20ml水,用乙酸乙酯(30mlx3)萃取所得的混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备型hplc进一步纯化得到褐色固体329(37mg,16%)。ms:[m+h]+625。1hnmr(500mhz,meod)δ1.31(s,3h),2.39(s,4h),2.65-2.69(m,4h),3.30-3.33(m,2h),3.68(s,3h),4.11-4.16(m,1h),4.24-4.30(m,1h),4.50-4.56(m,2h),6.99(d,1h),7.20(d,1h),7.22(d,1h),7.30(s,1h),7.36-7.38(m,1h),7.47-7.54(m,2h),7.89-7.95(m,2h),7.97(d,1h),8.53(s,1h)。实施例3302-(5-氟-2-(羟甲基)-3-(1-甲基-5-(6-(4-(氧杂环丁烷-3-基)哌嗪-1-基)哒嗪-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮330实施例330a4-(6-氨基哒嗪-3-基)哌嗪-1-羧酸叔丁酯330a向配有磁力搅拌器的100-ml单颈圆底烧瓶中加入6-氯哒嗪-3-胺(2.58g,20mmol)和n-boc-哌嗪(22.3g,120mmol)。在140℃下加热反应混合物并搅拌2h。然后将其冷却至室温,用乙酸乙酯(100ml)洗涤所得的固体,通过快速色谱纯化所得的残余物,然后用30:1二氯甲烷/甲醇洗脱,得到黄色固体330a(3.5g,60%)。ms:[m+h]+280。实施例330b4-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)哒嗪-3-基)哌嗪-1-羧酸叔丁酯330b按照实施例188c,使3,5-二溴-1-甲基吡啶-2(1h)-酮(536mg,2.0mmol)和330a(558mg,2.0mmol)反应得到黄色固体330b(560mg,60%)。ms:[m+h]+467实施例330c5-溴-1-甲基-3-(6-(哌嗪-1-基)哒嗪-3-基氨基)吡啶-2(1h)-酮330c按照实施例188d,对560mg(1.2mmol)的330b脱保护,得到黄色固体330c(440mg,99%)。ms:[m+h]+367实施例330d5-溴-1-甲基-3-(6-(4-(氧杂环丁烷-3-基)哌嗪-1-基)哒嗪-3-基氨基)吡啶-2(1h)-酮330d按照实施例210a,将400mg(1.1mmol)的330c转化成黄色固体330d(312mg,68%)。ms:[m+h]+421实施例330e4-氟-2-(1-甲基-5-(6-(4-(氧杂环丁烷-3-基)哌嗪-1-基)哒嗪-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯330e按照实施例210a,使207mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(0.43mmol)和180mg的330d(0.43mmol)反应得到黄色固体330e(156mg,51%)。ms:[m+h]+697。按照实施例210,使330e(150mg0.22mmol)水解得到黄色固体330(60mg,42%)。lcms:[m+h]+655。1hnmr(500mhz,cdcl3)δ8.67(d,j=2.5,1h),7.77(s,1h),7.48(d,j=2.0,1h),7.12(dd,j=8.5,1h),6.98(m,3h),6.86(s,1h),4.69(m,4h),4.51(d,j=11,1h),4.20(m,5h),3.86(m,1h),3.71(s,3h),3.56(m,5h),2.60(m,4h),2.47(m,4h),1.90(s,2h),1.80(s,2h)。实施例3312-(5-氟-2-(羟甲基)-3-(4-甲基-6-(6-(4-甲基哌嗪-1-基)吡啶-3-基氨基)-5-氧代-4,5-二氢吡嗪-2-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮331实施例331a5-溴-1-甲基-3-(6-(4-甲基哌嗪-1-基)吡啶-3-基氨基)吡嗪-2(1h)-酮331a将按照us2009/0318448制得的6-(4-甲基哌嗪-1-基)吡啶-3-胺(1g,5.2mmol)、3,5-二溴-1-甲基吡嗪-2(1h)-酮(1.7g,6.2mmol)和异丙醇(20ml)的混合物在回流下搅拌16h。在反应完成后,除去溶剂得到褐色固体331a(500mg,30%)。ms:[m+h]+379。实施例331b4-氟-2-(4-甲基-6-(6-(4-甲基哌嗪-1-基)吡啶-3-基氨基)-5-氧代-4,5-二氢吡嗪-2-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯331b向密封管中加入331a(400mg,1mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(578mg,1.2mmol)、pd(dppf)cl2(82mg,0.1mmol)、k3po4.3h2o(760mg,2mmol)和naoac(164mg,2mmol)在ch3cn(10ml)中的混合物。对系统抽真空而后再充入n2并在110℃下加热反应混合物2h。然后将混合物冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用50:1二氯甲烷/甲醇洗脱,得到黄色固体331b(100mg,14%)。ms:[m+h]+655。向331b(100mg,0.15mmol)在thf/异丙醇/水(2ml/2ml/1ml)中的溶液中加入lioh(15mg,0.75mmol)。在30℃下搅拌反应混合物1h。然后,加入20ml水,用乙酸乙酯(90ml×3)萃取混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过制备hplc纯化得到黄色固体331(42mg,45%)。ms:[m+h]+613。1hnmr(500mhz,dmso)δ9.26(s,1h),8.67(d,j=2.5,1h),8.35(q,j=2.5,1h),7.44(s,1h),7.32(m,2h),6.82-6.80(d,j=9,1h),6.52(s,1h),4.46-4.36(m,2h),4.16-4.09(m,3h),3.88-3.87(m,1h),3.52(s,3h),3.40-3.34(m,5h),2.60-2.57(m,2h),2.51-2.45(m,2h),2.39-2.37(m,4h),2.20(s,3h),1.79-1.69(m,4h)。实施例3322-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基-2-氧代哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮332实施例332a3-氧代哌嗪-1-羧酸叔丁酯332a向配有搅拌棒的100ml干燥单颈圆底烧瓶中加入哌嗪-2-酮(5.0g,50mmol)、无水二氯甲烷(60ml)和et3n(3.2ml,22.5mmol)并在室温下搅拌反应混合物1h。在减压下浓缩有机层得到332a(10g,99%)。实施例332b4-(6-硝基吡啶-3-基)-3-氧代哌嗪-1-羧酸叔丁酯332b向微波用小瓶中加入在30ml无水1,4-二噁烷中的332a(1.5g,7.5mmol)、5-溴-2-硝基吡啶(1.27g,6.25mmol)、二乙酸钯(71.8mg,0.32mmol)、xantphos(278mg,0.48mmol)和cs2co3(2.04g,6.25mmol)。在真空/氩气吹扫三次循环后,在微波辐射下在120℃下加热1.5h。过滤反应混合物,然后在真空中蒸发滤液。通过硅胶柱色谱纯化残余物,用3:1石油醚/乙酸乙酯洗脱,得到黄色固体332b(1.1g,54%)。ms:[m+h]+323。1hnmr(500mhz,cdcl3)δ8.68(d,j=2.5hz,1h),8.31(d,j=9hz,1h),8.15(m,1h),4.33(s,2h),3.91(m,4h)。实施例332c4-(6-氨基吡啶-3-基)-3-氧代哌嗪-1-羧酸叔丁酯332c向332b(1.1g,3.4mmol)在甲醇(20ml)中的溶液中加入pd/c(10%)(250mg)。在真空/h2吹扫三次循环后,在室温下在h2下搅拌混合物10h。过滤混合物,然后在真空中蒸发滤液得到332c(946mg,95%),未经进一步纯化用于下一步骤。ms:[m+h]+293。实施例332d4-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)-3-氧代哌嗪-1-羧酸叔丁酯332d向反应容器中加入在40ml无水1,4-二噁烷中的332c(946mg,3.2mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.11g,4.2mmol)、三(二亚苄基丙酮)二钯(0)(146mg,0.16mmol)、xantphos(185mg,0.32mmol)和cs2co3(2.6g,8.0mmol)。在真空/氩气吹扫三次循环后,在110℃下搅拌4h。过滤反应混合物,然后在真空中蒸发滤液。通过硅胶柱色谱纯化粗品,用50:1二氯甲烷/甲醇洗脱,得到黄色固体332d(706mg,46%)。ms:[m+h]+479。实施例332e1-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)哌嗪-2-酮332e向配有磁力搅拌器和回流冷凝管的50-ml圆底烧瓶中加入hcl/1,4-二噁烷(20ml)和332d(706mg,1.47mmol)。在65℃下搅拌混合物6h。然后在减压下浓缩得到黄色固体332e(500mg,90%)。ms:[m+h]+379。实施例332f1-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)-4-甲基哌嗪-2-酮332f向1-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)哌嗪-2-酮(332e)(500mg,1.32mmol)在甲醇(20ml)中的溶液中加入na(oac)3bh(2.0g,13.2mmol)、甲醛(30%水溶液,8ml)和乙酸(2.7ml,45mmol)。搅拌混合物4h。通过加入naoh(1m)将反应混合物的ph调至11~13。然后用二氯甲烷萃取3次。用无水na2so4干燥合并的有机萃取液,过滤,然后在真空中蒸发。通过硅胶柱纯化残余物,用50:1二氯甲烷/甲醇洗脱,得到灰色固体332f(312mg,60%)。ms:[m+h]+393。1hnmr(500mhz,cdcl3)δ8.61(d,j=2.5hz,1h),8.17(d,j=2.5hz,1h),7.88(s,1h),7.45(dd,j=9hz,1h),6.92(d,j=2.5hz,1h),6.74(d,j=9hz,1h),3.64(m,2h),3.53(s,3h),3.22(s,2h),2.74(m,2h),2.35(s,3h)。实施例332g4-氟-2-(1-甲基-5-(5-(4-甲基-2-氧代哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯332g向反应容器中加入1-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)-4-甲基哌嗪-2-酮(332f)(0.3g,0.76mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(0.37g,0.76mmol)、pdcl2(dppf)(65mg,0.076mmol)、k3po4(325mg,1.53mmol)和naoac(125mg,1.53mmol)在mecn(15ml)和水(1ml)中的混合物。然后持续15min对其鼓吹氩气并在110℃下加热3h。在真空中蒸发溶剂后,在硅胶柱上纯化残余物,用50:1二氯甲烷/甲醇洗脱,得到332g(0.4g,63%)。ms:[m+h]+668。将332g(350mg,0.52mmol)和lioh水合物(1.1g,26mmol)在异丙醇(3ml)、thf(3ml)和水(3ml)中的混合物在30℃下搅拌1h。在真空中蒸发混合物,然后用二氯甲烷(30ml×3)萃取残余物。在减压下浓缩合并的萃取液,在硅胶柱上纯化残余物,用50:1二氯甲烷/甲醇洗脱,得到黄色固体332(120mg,32%)。ms:[m+h]+626。1hnmr(500mhz,cdcl3)δ8.78(d,j=2hz,1h),8.17(d,j=2.5hz,1h),7.58(dd,j=8.5hz,1h),7.42(d,j=2.5hz,1h),7.23(s,1h),7.21(s,1h),7.12(d,j=9hz,1h),6.73(s,1h),4.53(m,2h),4.22(s,2h),4.03(m,1h),3.73(s,4h),3.27(s,2h),2.87(m,2h),2.65(m,1h),2.55(m,2h),2.43(s,3h),1.89(m,2h),1.79(m,2h)。实施例3332-(5-氟-2-(甲氧基甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮333在室温下向2-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮197(200mg,0.33mmol)和k2co3(135mg,0.99mmol)在dmf(30ml)中的溶液中加入碘甲烷(70mg,0.50mmol)在dmf(5ml)中的溶液。搅拌反应混合物1h。然后过滤,通过制备型hplc纯化残余物得到黄色固体333(165mg,80%)。ms:[m+h]+626。1hnmr(500mhz,dmso)δ8.59(d,j=2.0,1h),8.49(s,1h),7.97(d,j=2.0,1h),7.44(s,1h),7.39(s,1h),7.32(m,2h),7.17(m,1h),6.52(s,1h),4.31(s,2h),4.14(m,3h),3.88(s,1h),3.56(s,3h),3.54(s,4h),3.44(s,4h),3.12(s,6h),2.58(m,2h),2.46(s,2h),1.79(s,2h),1.68(s,2h)。实施例334{4-氟-2-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}苯基}甲基乙酸酯334实施例334a3-氯双环[2.2.1]庚-2-烯-2-甲醛334a用氮气吹扫配有磁力搅拌器和回流冷凝管的250-ml三颈圆底烧瓶,并加入无水1,2-二氯乙烷(24ml)和无水dmf(9.12g,125mmol)。将反应混合物冷却至0℃,在5分钟内加入三氯氧磷(15.3g,100mmol),同时使反应温度保持在0-10℃。除去冷却浴,并在室温下搅拌反应30分钟。加入双环[2.2.1]庚烷-2-酮(5.50g,50.0mmol)在1,2-二氯乙烷(10ml)中的溶液,并在80℃下过夜加热所得的混合物。此后,将反应液倒入磷酸氢钾(43.5g,250mmol)在水(200ml)中的溶液中并搅拌15分钟。分离有机层,然后在减压下浓缩。将残余物溶于二氯甲烷(300ml),然后用水(2x50ml)洗涤。用硫酸钠干燥二氯甲烷层,过滤,然后在减压下浓缩。通过柱色谱纯化残余物,用1:100乙酸乙酯/石油醚洗脱,得到黄色油状物334a(2.2g,28%)。ms:[m+h]+157。1hnmr(500mhz,cdcl3)δ9.80(s,1h),3.42(s,1h),3.07(d,j=1.7hz,1h,),1.95-1.77(m,2h),1.67(t,j=8.9hz,1h),1.41-1.17(m,3h)。实施例334b(e)-乙基3-(3-氯双环[2.2.1]庚-2-烯-2-基)丙烯酸酯334b向334a(9.0g,57.7mmol)在二氯甲烷(250ml)中的溶液中加入2-(三苯基-λ5-膦亚甲基)乙酸乙酯(ethyl2-(triphenyl-λ5-phosphanylidene)acetate)(20g,57.7mmol)。在室温下过夜搅拌混合物。在反应后,在真空中蒸发反应溶液。通过柱色谱纯化残余物,用1:100乙酸乙酯/石油醚洗脱,得到黄色油状物334b(6.0g,46%)。ms:[m+h]+227。实施例334c3-氮杂三环[5.2.1.02,6]癸-2(6),4-二烯-4-羧酸乙酯334c向334b(5.0g,22mmol)在dmso(30ml)中的溶液中加入nan3(2.2g,33mmol)并在105℃下加热混合物6小时。将水(13ml)加入到反应混合物中,在冷却至室温后,用二氯甲烷(50ml×3)萃取所得的混合物。干燥(na2so4)有机相,然后蒸发至干。通过柱色谱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到褐色固体334c(2.7g,60%)。ms:[m+h]+206。1hnmr(500mhz,cdcl3)δ11.51(s,1h),6.45(dd,1h),4.14-4.19(m,2h,),3.25(d,2h,),1.79-1.82(m,2h),1.73(d,1h),1.22-1.25(t,j=6.5,3h),0.89-0.91(m,2h)。实施例334d3-(氰基甲基)-3-氮杂三环[5.2.1.02,6]癸-2(6),4-二烯-4-羧酸乙酯334d向334c(3.0g,14.6mmol)在无水dmf(30ml)中的溶液中加入nah(880mg,22mmol)。在室温下搅拌混合物30分钟。加入2-溴乙腈(3.5g,29.3mmol),并在65℃下加热所得的混合物1小时。然后将其冷却至室温并过夜搅拌。在反应后,加入水(30ml),用乙酸乙酯(3x200ml)萃取反应混合物。将有机相蒸发至干。通过柱色谱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到褐色固体334d(2.6g,72%)。ms:[m+h]+245。实施例334e3-(2-氨基乙基)-3-氮杂三环[5.2.1.02,6]癸-2(6),4-二烯-4-羧酸乙酯334e将334d(4.0g,16mmol)和兰尼镍(400mg)在甲醇(60ml)中的悬浮液在parr装置中在50psi下过夜氢化。通过celite垫过滤混合物,然后在减压下浓缩滤液。通过柱色谱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到黄色固体334e(2g,50%)。ms:[m+h]+249。实施例334f3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-7-酮334f向3-(2-氨基乙基)-3-氮杂三环[5.2.1.02,6]癸-2(6),4-二烯-4-羧酸乙酯(334e)(1.8g,7.2mmol)在乙醇(40ml)中的溶液中加入甲醇钠(2.5g,36mmol)。在65℃下加热混合物12小时。然后将其冷却至室温。蒸发溶剂至干。通过柱色谱纯化残余物,用20:1二氯甲烷/甲醇洗脱,得到褐色固体334f(800mg,53%)。ms:[m+h]+203。实施例334g(2-溴-4-氟-6-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}苯基)甲基乙酸酯334g向密封管中加入在二噁烷(25ml)中的334f(800mg,4mmol)和197c(3.8g,12mmol)以及碳酸铯(2.6g,8mmol)。在持续30min使氮气鼓泡经过所得的溶液后,加入xantphos(230mg,0.4mmol)和三(二亚苄基丙酮)二钯(0)(362mg,0.4mmol),并在100℃下加热反应混合物4h。此后,使反应冷却至室温,然后在乙酸乙酯(100ml)和水(100ml)之间分配。分离水层,然后用乙酸乙酯(50ml×3)萃取。合并有机层,用盐水(20ml×3)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过柱色谱纯化残余物,用1:5乙酸乙酯/石油醚洗脱,得到褐色固体334g(1.3g,72%)。ms:[m+h]+447。实施例334h(4-氟-2-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}-6-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯334h向334g(450mg,1.0mmol)和4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(770mg,3.0mmol)在二噁烷(40ml)中的溶液中加入pdcl2(dppf)(82mg,0.1mmol)和ch3cook(593mg,6mmol)。在氩气氛下在100℃下搅拌混合物12h。在反应后,过滤混合物,然后在真空中蒸发。通过柱色谱纯化残余物,用1:4乙酸乙酯/石油醚洗脱,得到褐色固体334h(400mg,80%)。ms:[m+h]+495。实施例334i{4-氟-2-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}苯基}甲基乙酸酯334i向密封管中加入334h(300mg,0.6mmol)、188e(254mg,0.6mmol)、na2co3(129mg,1.2mmol)、pdcl2(dppf)(50mg,0.06mmol),使它们悬浮于dmf(20ml)和h2o(1ml)中。在80℃下搅拌混合物5小时。在反应后,使混合物在乙酸乙酯和水之间分配。用水(2x)洗涤有机相,用硫酸钠干燥,然后浓缩。通过反相combi快速色谱纯化残余物,用含有0.3%nh4hco3的1:5水/ch3cn洗脱,得到褐色固体334i(300mg,70%)。ms:(m+h)+708。在室温下,向334i(280mg,0.4mol)在thf/异丙醇/水(10ml/10ml/2ml)中的溶液中加入lioh(950mg,40mmol)同时搅拌。搅拌此混合物2h。然后,加入20ml水,用乙酸乙酯(3x30ml)萃取所得的混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过反相combi快速柱色谱进一步纯化,用含有0.3%nh4hco3的1:4水/ch3cn洗脱,得到白色固体334(160mg,67%)。ms:[m+h]+666。1hnmr(500mhz,meod)δ8.53(s,1h),7.93(d,1h),7.43(d,1h),7.34(s,1h),7.20-7.22(m,2h),7.04(d,1h),6.67(s1h),4.72-4.75(t,j=6.5,1h),4.63-4.66(t,j=6,2h),4.47-4.56(m,2h),4.21-4.39(m,3h),3.98-4.06(m,1h),3.71(s,3h),3.56-3.60(m,1h),3.48(s,1h),3.17-3.19(t,j=4.5,4h),2.71(s,1h),2.53-2.55(t,j=5,4h),1.88-1.95(m,3h),1.67-1.69(m,1h),1.04-1.17(m,2h)。实施例3352-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(5-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮335实施例335a5-(6-硝基吡啶-3-基)-六氢吡咯并[3,4-c]吡咯-2(1h)-羧酸叔丁酯335a按照实施例188a,使404mg的六氢吡咯并[3,4-c]吡咯-2(1h)-羧酸叔丁酯(2mmol)和566mg5-氟-2-硝基吡啶(1.1mmol)反应得到黄色固体335a(234mg,35%)。ms:[m+h]+335。1hnmr(500mhz,dmso)δ8.18(d,j=9.0,1h),7.87(d,j=3.5,1h),7.06(dd,j=9.0,1h),3.66(s,2h),3.55(s,2h),3.36(s,2h),3.18(s,2h),3.05(s,2h),1.39(s,9h)。实施例335b5-(6-氨基吡啶-3-基)六氢吡咯并[3,4-c]吡咯-2(1h)-羧酸叔丁酯335b按照实施例188b,还原234mg的335a(0.7mmol),得到黄色固体335b(213mg,99%)。ms:[m+h]+305实施例335c5-(6-(5-溴-1-甲基-2-氧代-1,2-二氢吡啶-3-基氨基)吡啶-3-基)六氢吡咯并[3,4-c]吡咯-2(1h)-羧酸叔丁酯335c按照实施例188c,使3,5-二溴-1-甲基吡啶-2(1h)-酮(212mg,0.79mmol)和335b(200mg,0.66mmol)反应得到黄色固体335c(194mg,60%)。ms:[m+h]+492实施例335d5-溴-3-(5-(六氢吡咯并[3,4-c]吡咯-2(1h)-基)吡啶-2-基氨基-1-甲基吡啶-2(1h)-酮335d按照实施例188d,对194mg(0.4mmol)的335c脱保护,得到黄色固体335d(154mg,99%)。ms:[m+h]+392实施例335e5-溴-1-甲基-3-(5-(5-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-基)吡啶-2-基氨基)吡啶-2(1h)-酮335e按照实施例188e,将154mg(0.4mmol)的335d甲基化得到黄色固体335e(119mg,75%)。ms:[m+h]+404。实施例335f4-氟-2-(1-甲基-5-(5-(5-甲基六氢吡咯并[3,4-c]吡咯-2(1h)-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯335f按照实施例148h,使142mg的4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(0.29mmol)和119mg的335e(0.29mmol)反应得到黄色固体335f(100mg,51%)。lcms:[m+h]+680按照实施例148,用100mg的335f(0.15mmol),获得白色固体335(39mg,42%)。1hnmr(500mhz,cdcl3)δ8.45(d,j=2.0,1h),7.70(d,j=2.5,1h),7.67(s,1h),7.42(d,j=2.5,1h),7.17(m,1h),7.04(dd,j=9.0,1h),6.95(dd,j=6.0,1h),6.86(s,1h),6.79(d,j=9.0,1h),4.54(d,j=11.0,1h),4.31(m,1h),4.16(m,3h),3.91(m,1h),3.70(s,3h),3.27(s,2h),3.18(s,2h),2.99(s,2h),2.83(s,2h),2.59(m,4h),2.46(m,2h),2.38(s,3h),1.90(s,2h),1.80(s,2h)。实施例3362-(5-氟-3-(5-(5-(3-(氟甲基)-4-甲基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-2-(羟甲基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮336实施例336a1-叔丁基2-甲基4-苄基哌嗪-1,2-二羧酸酯336a在n2下向配有搅拌棒的100ml干燥圆底烧瓶中加入1-叔丁基2-甲基哌嗪-1,2-二羧酸酯(5g,20.5mmol)、无水乙腈(60ml)、苄溴(2.7ml,22.5mmol)和三乙胺(8.5ml,61.5mmol)。在71℃下加热反应混合物45分钟,然后在减压下浓缩。然后用二氯甲烷将其稀释,用水和盐水洗涤。用na2so4干燥有机层,过滤,然后在减压下浓缩。通过快速柱色谱纯化粗品化合物,用8:1石油醚/乙酸乙酯洗脱,得到336a(4.5g,66%)。ms:[m+h]+335。1hnmr(500mhz,cdcl3)δ7.28(m,5h),4.60(m,1h),3.78(m,4h),3.57(m,1h),3.43(m,1h),3.28(m,2h),2.77(m,1h),2.19(m,1h),2.11(m,1h),1.47(s,5h),1.42(s,4h)。实施例336b(4-苄基-1-甲基哌嗪-2-基)甲醇336b在0℃下向336a(1g,2.99mmol)在100ml无水四氢呋喃中的溶液中缓慢加入氢化铝锂(342mg,8.98mmol)并搅拌混合物30min。然后,使其回流3h,而后将反应混合物逐份倒入冰上。过滤所得的混合物,然后在真空中蒸发滤液。在将100ml盐水加入到残余物中后,用二氯甲烷(100mlx3)萃取。用na2so4干燥合并的有机层,过滤,然后浓缩得到黄色油状物336b(0.60g,91%)。ms:[m+h]+221。实施例336c4-苄基-2-(氟甲基)-1-甲基哌嗪336c在n2下向二乙基氨基三氟化硫(10.8ml,81.8mmol)在二氯甲烷中的冰冷的溶液中滴加336b(9.0g,40.9mmol)/二氯甲烷溶液。在0℃下搅拌黄色溶液1h,而后在室温下搅拌15h。然后用nahco3稀释反应混合物,分离有机层,然后用na2so4干燥。在硅胶柱色谱上纯化粗产物,用50:1二氯甲烷/甲醇洗脱,得到黄色油状物336c(3.0g,33%)。ms:[m+h]+223。1hnmr(500mhz,dmso)δ7.28(m,5h),4.50(m,0.5h),4.43(m,1h),4.35(m,0.5h),3.45(s,2h),2.67(m,2h),2.60(m,1h),2.29(m,1h),2.24(s,3h),2.20(m,1h),2.11(m,1h),1.94(m,1h)。实施例336d2-(氟甲基)-1-甲基哌嗪336d向配有磁力搅拌器的250-ml单颈圆底烧瓶中加入336c(3.0g,13.5mmol)、甲醇(80ml)和pd/c(10%)(300mg)。在25℃下在h2下搅拌反应混合物15h。在反应完成后,过滤,然后浓缩得到黄色油状物336d(1.6g,90%)。实施例336e2-(氟甲基)-1-甲基-4-(6-硝基吡啶-3-基)哌嗪336e向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中加入1,4-二噁烷(50ml)、336d(1.6g,12.1mmol)、5-溴-2-硝基吡啶(3.7g,18.2mmol)和碳酸铯(9.9g,30.2mmol)。在持续30min使氮气鼓泡经过所得的溶液后,加入xantphos(700mg,0.12mmol)和三(二亚苄基丙酮)二钯(0)(550mg,0.06mmol)。在真空/氩气吹扫三次循环后,在回流下加热反应混合物15h。此后,使反应冷却至室温,过滤,然后浓缩得到黑色固体粗产物,通过柱色谱进一步纯化,用100:1二氯甲烷/甲醇洗脱,得到黄色固体336e(2.6g,76%)。ms:[m+h]+255。1hnmr(500mhz,meod)δ8.20(m,2h),7.52(dd,j=9,1h),4.72(m,0.5h),4.64(m,1h),4.56(m,0.5h),4.01(m,1h),3.94(m,1h),3.19(m,1h),3.06(m,1h),3.00(m,1h),2.50(m,2h),2.46(s,3h)。实施例336f5-(3-(氟甲基)-4-甲基哌嗪-1-基)吡啶-2-胺336f向配有磁力搅拌器的250-ml单颈圆底烧瓶中加入336e(2.6g,10.2mmol)、甲醇(50ml)和pd/c(10%)(260mg)。在h2下搅拌反应混合物15h。在反应完成后,过滤,然后浓缩得到黑色油状物336f,未经进一步纯化用于下一步骤。ms:[m+h]+225。实施例336g5-溴-3-(5-(3-(氟甲基)-4-甲基哌嗪-1-基)吡啶-2-基氨基)-1-甲基吡啶-2(1h)-酮336g向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中加入1,4-二噁烷(60ml)、336f(粗品,14.1mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(4.5g,16.9mmol)和碳酸铯(11.5g,35.2mmol)。在持续30min使氮气鼓泡经过所得的溶液后,加入xantphos(820mg,1.41mmol)和三(二亚苄基丙酮)二钯(0)(645mg,0.7mmol)。在真空/氩气吹扫三次循环后,在回流下加热反应混合物15h。使反应冷却至室温,过滤,然后浓缩得到黑色固体,洗脱通过柱色谱纯化,用二氯甲烷/甲醇(100:1至50:1),得到黄色固体336g(3.1g,50%)。ms:[m+h]+410。实施例336h4-氟-2-(5-(5-(3-(氟甲基)-4-甲基哌嗪-1-基)吡啶-2-基氨基)-1-甲基-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯336h向反应容器中加入336g(1g,2.4mmol)、4-氟-2-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苄基乙酸酯210d(1.3g,2.68mmol)、pdcl2(dppf)(190mg,0.24mmol)、k3po4(1g,4.8mmol)和naoac(390mg,4.8mmol)在mecn(15ml)和水(1.5ml)中的混合物。对其持续30min用氮气鼓吹,然后在110℃下加热3h。在真空中蒸发溶剂,在硅胶柱色谱上纯化残余物,用5:1二氯甲烷/甲醇洗脱,得到336h(0.80g,45%)。ms:[m+h]+686。将336h(750mg,1.09mmol)和lioh水合物(2.3g,55mmol)在异丙醇(10ml)、thf(10ml)和水(10ml)中的混合物在30℃下搅拌1h。在真空中蒸发混合物,然后用二氯甲烷(30mlx3)萃取残余物。在减压下浓缩合并的萃取液,在硅胶柱上纯化残余物,用50:1二氯甲烷/甲醇洗脱,得到黄色固体336(700mg,93%)。ms:[m+h]+644。1hnmr(500mhz,meod)δ8.54(d,j=2hz,1h),7.92(d,j=1.5hz,1h),7.42(m,1h),7.33(m,1h),7.22(s,1h),7.20(s,1h),7.02(m,1h),6.72(s,1h),4.46-4.69(m,4h),4.20(s,3h),4.02(m,1h),3.70(s,3h),3.49(d,j=11.5hz,1h),3.42(d,j=11.5hz,1h),2.94(m,1h),2.85(m,1h),2.71(m,1h),2.64(m,2h),2.56(m,4h),2.44(s,3h),1.88(m,2h),1.79,(m,2h)。实施例3376-[5-氟-2-(羟甲基)-3-{1-甲基-6-氧代-5-[(嘧啶-4-基)氨基]-1,6-二氢吡啶-3-基}苯基]-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-7-酮337实施例337a(4-氟-2-{1-甲基-6-氧代-5-[(嘧啶-4-基)氨基]-1,6-二氢-吡啶-3-基}-6-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}苯基)甲基乙酸酯337a向密封管中加入(2-溴-4-氟-6-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}苯基)甲基乙酸酯334g(400mg,0.9mmol)、1-甲基-3-(嘧啶-4-基氨基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2(1h)-酮109c(294mg,0.9mmol)、na2co3(190mg,1.8mmol)和pdcl2(dppf)(73mg,0.09mmol),使它们悬浮于dmf(20ml)和水(1ml)中。在60℃下搅拌混合物6小时。然后使其在水和乙酸乙酯之间分配。用水洗涤有机相,然后蒸发至干。通过柱色谱纯化残余物,用15:1二氯甲烷/甲醇洗脱,得到褐色固体337a(300mg,58%)。ms:[m+h]+569。在室温下,向337a(270mg,0.47mol)在thf/异丙醇/水(10ml/10ml/2ml)中的溶液中加入lioh(1.1g,47mmol)同时搅拌。搅拌此混合物2h。然后,加入20ml水,用乙酸乙酯(30mlx3)萃取所得的混合物。用na2so4干燥合并的有机层,然后浓缩得到黄色固体,通过反相combi快速色谱进一步纯化,用含有0.3%nh4hco3的1:5水/ch3cn洗脱,得到白色固体337(138mg,48%)。ms:[m+h]+527。1hnmr(500mhz,meod)δ8.87(s,1h),8.67(s,1h),8.29(d,1h),7.55(s,1h),7.22-7.24(m,2h),7.10(d,1h),6.68(d,1h),4.48-4.55(m,2h),4.18-4.40(m,3h),3.98-4.06(m,1h),3.72(s,3h),3.45-3.48(m,1h),1.88-1.98(m,3h),1.67-1.69(m,1h),1.30(m,1h),1.12-1.17(m,1h),1.02-1.07(m,1h)。实施例3382-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基-1,4-二氮杂环庚烷-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮338实施例338a1-甲基-4-(6-硝基吡啶-3-基)-1,4-二氮杂环庚烷338a向1-甲基-1,4-二氮杂环庚烷(1g,8.8mmol)在dmso(20ml)中的溶液中加入k2co3(2.4g,18mmol)和5-溴-2-硝基吡啶(51-7)(1.78g,8.8mmol)。在65℃下过夜搅拌混合物。使其冷却至室温,然后倒入水中。收集所得的固体,然后在真空下干燥。通过快速柱色谱进一步纯化固体,用3:1石油醚/乙酸乙酯而后用二氯甲烷洗脱,得到黄色固体338a(800mg,69%)。ms:[m+h]+236。实施例338b1-甲基-4-(6-硝基吡啶-3-基)-1,4-二氮杂环庚烷338b用氮气吹扫500-ml瓶,并加入338a(0.8g,3.4mmol)、10%钯/碳(50%湿度,100mg)和甲醇(100ml)。对瓶抽真空,充入氢气,并在室温下搅拌16h。然后抽除氢气并将氮气充入瓶中。通过celite垫过滤除去催化剂,然后在减压下浓缩滤液得到338b(0.6g,粗品)。ms:[m+h]+207。实施例338c5-溴-1-甲基-3-(5-(4-甲基-1,4-二氮杂环庚烷-1-基)吡啶-2-基氨基)吡啶-2(1h)-酮338c向配有磁力搅拌器和回流冷凝管的100-ml单颈圆底烧瓶中加入338b(968mg,4.7mmol)、3,5-二溴-1-甲基吡啶-2(1h)-酮(1.24g,4.7mmol)和碳酸铯(3.8g,12mmol)。在持续30分钟使氮气鼓泡经过所得的溶液后,加入xantphos(272mg,0.47mmol)和三(二亚苄基丙酮)二钯(0)(430mg,0.47mmol)。在回流下加热反应混合物3h。此后使反应冷却至室温,在乙酸乙酯(100ml)和水(100ml)之间分配,然后过滤。分离水层,并用乙酸乙酯(2x50ml)萃取。合并有机层,用盐水(50ml)洗涤,然后用硫酸钠干燥。通过过滤除去干燥剂,然后在减压下浓缩滤液。通过快速柱色谱纯化残余物,用石油醚/乙酸乙酯洗脱,得到338c(918mg,50%)。ms:[m+h]+392。实施例338d4-氟-2-(1-甲基-5-(5-(4-甲基-1,4-二氮杂环庚烷-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯338d向密封管中加入338c(274mg,0.7mmol)、210d(337mg,0.7mmol)、pd(dppf)cl2(33mg,0.04mmol)、k3po4.3h2o(372mg,1.4mmol)和naoac(115mg,1.4mmol)在ch3cn(20ml)中的混合物。对系统抽真空而后再充入n2。在微波辐射下在110℃下加热反应混合物3h。将混合物冷却至室温,然后过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用30:1二氯甲烷/甲醇洗脱,得到黄色固体338d(120mg,43%)。ms:[m+h]+668。向338d(120mg,0.18mmol)在丙-2-醇(10ml)、四氢呋喃(10ml)和水(2ml)中的溶液中加入lioh(1.1g,57mmol)。在30℃下搅拌混合物2h。然后蒸发,通过制备型hplc纯化残余物得到白色固体338(60mg,54%)。ms:(m+h)+626。1hnmr(500mhz,meod)δ8.18(s,1h),7.62(s,1h),7.16(s,1h),7.06(m,3h),6.88(d,j=11.5,2h),6.59(s,1h),4.38(m,2h),4.07(m3h),3.87(m,1h),3.57(s,3h),3.42(m,2h),3.31(m,2h),3.20(s,3h),2.60(m,2h),2.50(m,4h),2.42(m,2h),1.75(m,6h)。实施例3395-[5-氟-2-(羟甲基)-3-[1-甲基-5-({5-[4-(氧杂环丁烷-3-基)哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]苯基]-8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3(4)-三烯-6-酮339实施例339a[4-氟-2-(1-甲基-5-{[5-(4-(氧杂环丁烷-3-基)哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3-三烯-5-基}苯基]甲基乙酸酯339a按照实施例210e,将150mg(0.30mmol)的(4-氟-2-{6-氧代-8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3-三烯-5-基}-6-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯341b转化成黄色固体339a(129mg,60%)。ms:[m+h]+712按照实施例148,将120mg的339a(0.17mmol)转化成白色固体339(56mg,50%)。ms:[m+h]+700。1hnmr(500mhz,dmso)δ8.56(d,j=3.0hz,1h),8.48(s,1h),8.41(s,1h),7.88(d,j=3.0hz,1h),7.37(m,4h),7.23(d,j=9.5hz,1h),4.60(t,j=10.0hz,1h),4.56(t,j=13.0hz,2h),4.46(t,j=12.0hz,2h),4.28(s,2h),3.58(s,3h),3.43(m,1h),3.07(t,j=9.0hz,4h)2.93(s,2h),2.85(s,2h),2.38(t,j=9.0hz,4h),1.87(m,4h)。实施例3402-(5-氟-2-(羟甲基)-3-(1-甲基-5-(5-(4-甲基哌嗪-1-基吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢-6,9-桥亚甲基吡嗪并[1,2-a]吲哚-1(2h)-酮340实施例340a{4-氟-2-[1-甲基-5-({5-[4-甲基哌嗪-1-基]吡啶-2-基}氨基)-6-氧代-1,6-二氢吡啶-3-基]-6-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}苯基}甲基乙酸酯340a向配有磁力搅拌器的微波用小瓶中加入(2-溴-4-氟-6-{7-氧代-3,6-二氮杂四环[9.2.1.02,10.03,8]十四-2(10),8-二烯-6-基}苯基)甲基乙酸酯334g(293mg,0.65mmol)、1-甲基-5-(5-(4-甲基哌嗪-1-基)吡啶-2-基氨基)-6-氧代-1,6-二氢吡啶-3-基硼酸197f(450mg,1.3mmol)、pdcl2(dppf)(54mg,0.065mmol)、2.0mna2co3(2.0当量)和1,2-二甲氧基乙烷(18ml)。在真空/氩气吹扫三次循环后,在微波辐射下在130℃下加热混合物0.5h。然后过滤,在真空中蒸发滤液。在快速柱色谱上纯化残余物,用10:1二氯甲烷/甲醇洗脱,得到褐色固体340a(130mg,33%)。lcms:[m+h]+666将340a(130mg,0.20mmol)和lioh(470mg,20.0mmol)在异丙醇/thf(1:1,10ml)和水(3ml)中的混合物在30℃下搅拌2h。在真空中蒸发混合物,然后用乙酸乙酯(30mlx2)萃取残余物。在减压下浓缩合并的乙酸乙酯萃取液,然后用制备型hplc纯化残余物得到340(50mg,41%)。lcms:[m+h]+624。1hnmr(500mhz,meod)δ8.54(s,1h),7.93(s,1h),7.41-7.43(m,1h),7.34(s,1h),7.20-7.22(m,2h),7.02-7.04(d,j=9.0hz,1h),6.67-6.68(d,j=3.0hz,1h),4.46-4.55(m,2h),4.18-4.38(m,3h),3.98-4.06(m,1h),3.71(s,3h),3.46-3.48(m,1h),3.14-3.18(m,4h),2.62-2.64(t,j=4.5hz,4h),2.36(s,3h),1.88-1.95(m,3h),1.67-1.69(m,1h),1.01-1.30(m,2h)。实施例3415-[5-氟-2-(羟甲基)-3-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)苯基]-8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3-三烯-6-酮341实施例341a(2-溴-4-氟-6-{6-氧代-8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3-三烯-5-基}苯基)甲基乙酸酯341a向配有磁力搅拌器的100-ml单颈圆底烧瓶中加入8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3-三烯-6-酮(1g,4.85mmol)、2,6-二溴-4-氟苄基乙酸酯197c(4.8g,14.6mmol)、碘化亚铜(i)(553mg,2.9mmol)、n1,n2-二甲基乙烷-1,2-二胺(512mg,5.82mmol)、cs2co3(3.2g,9.7mmol)和1,4-二噁烷(50ml)。对系统抽真空,然后再充入n2。将回流冷凝管连接到烧瓶,并在100℃下加热反应混合物16h。然后将其冷却至室温,过滤。在减压下浓缩滤液,通过快速色谱纯化所得的残余物,用5:1石油醚/乙酸乙酯洗脱,得到黄色固体341a(437mg,20%)。ms:[m+h]+451。实施例341b(4-氟-2-{6-氧代-8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3-三烯-5-基}-6-(四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)甲基乙酸酯341b按照实施例210d,将341a(400mg0.88mmol)转化成黄色固体341b(353mg,80%)。ms:[m+h]+499实施例341c[4-氟-2-(1-甲基-5-{[5-(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-6-氧代-1,6-二氢吡啶-3-基)-6-{6-氧代-8-硫杂-4,5-二氮杂三环[7.4.0.02,7]十三-1(9),2(7),3-三烯-5-基}苯基]甲基乙酸酯341c按照实施例210a,将180mg(0.36mmol)的341b转化成黄色固体341c(120mg,50%)。ms:[m+h]+670按照实施例148,将120mg的341c(0.18mmol)转化成白色固体341(46mg,41%)。ms:[m+h]+628。1hnmr(500mhz,cdcl3)δ8.58(d,j=2.5,1h),8.26(s,1h),7.95(d,j=3.0,1h),7.77(s,1h),7.45(d,j=2.0,1h),7.31(m,1h),7.25(m,1h),7.11(dd,j=8.0,1h),6.82(d,j=9.0,1h),4.31(s,1h),4.01(s,1h),3.71(s,3h),3.15(t,j=4.5,4h),2.99(t,j=5.0,2h),2.87(t,j=5.5,2h),2.60(t,j=5.0,4h),2.37(s,3h),1.99(s,4h)。实施例3422-(5-氟-2-(羟甲基)-3-(1-甲基-5-(6-(4-甲基哌嗪-1-基)哒嗪-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)苯基)-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-1(2h)-酮342实施例342a6-(4-甲基哌嗪-1-基)哒嗪-3-胺342a向配有磁力搅拌器的密封管中加入6-氯-哒嗪-3-胺(1.3g,10mmol)和1-甲基哌嗪(15ml)。在170℃下加热反应混合物3h。然后将其冷却至室温,在减压下浓缩。用ch3cn(20ml)洗涤所得的残余物得到黄色固体342a(1.5g,78%)。ms:[m+h]+194。1hnmr(500mhz,dmso)δ7.12(d,j=9.0hz,1h),6.74(d,j=9.0hz,1h),5.72(s,2h),3.27(t,j=4.5hz,4h),2.40(t,j=4.5hz,4h),2.20(s,3h)。实施例342b5-溴-1-甲基-3-(6-(4-甲基哌嗪-1-基)哒嗪-3-基氨基)吡啶-2(1h)-酮342b按照实施例188c,将342a(580mg,3.0mmol)转化成黄色固体342b(920mg,80%)。ms:[m+h]+381实施例342c4-氟-2-(1-甲基-5-(6-(4-甲基哌嗪-1-基)哒嗪-3-基氨基)-6-氧代-1,6-二氢吡啶-3-基)-6-(1-氧代-3,4,6,7,8,9-六氢吡嗪并[1,2-a]吲哚-2(1h)-基)苄基乙酸酯342c按照实施例188f,使482mg的342b(1.0mmol)和379mg的5-溴-1-甲基-3-(6-(4-甲基哌嗪-1-基)哒嗪-3-基氨基)吡啶-2(1h)-酮(1.0mmol)反应得到黄色固体342c(261mg,40%)。ms:[m+h]+655。按照实施例188,将342c(150mg0.23mmol)转化成白色固体342(73mg,52%)。lcms:[m+h]+613。1hnmr(500mhz,cdcl3)δ8.68(d,j=2.5hz,1h),7.76(s,1h),7.46(d,j=2.0hz,1h),7.12(dd,j=9.0hz,1h),7.0(m,2h),6.90(dd,j=9.0hz,1h),6.86(s,1h),4.50(dd,j=11.0hz,1h),4.27(m,2h),4.16(m,3h),3.88(m,1h),3.71(s,3h),3.54(m,4h),2.58(m,7h),2.35(s,3h),1.90(m,2h),1.71(m,2h)。实施例901btk生化测定可用来测试式i化合物的btk激酶标准生化测定的一般方法如下。制备无btk酶的含有1x细胞信号转导激酶缓冲液(25mmtris-hcl,ph7.5、5mmβ-甘油磷酸、2mm二硫苏糖醇、0.1mmna3vo4、10mmmgcl2)、0.5μmpromegaptk生物素化的肽底物2和0.01%bsa的预混试剂(mastermix)。制备加btk酶的含有1x细胞信号转导激酶缓冲液、0.5μmptk生物素化的肽底物2、0.01%bsa和100ng/孔(0.06mu/孔)btk酶的预混试剂。btk酶的制备如下:使具有c-末端v5和6xhis标记的全长人野生型btk(登记号nm-000061)亚克隆到pfastbac载体中,用于制备携带该表位标记的btk的杆状病毒。根据invitrogen在其出版的实验方案“bac-tobacbaculovirusexpressionsystems”(cat.nos.10359-016和10608-016)中详述的使用说明制备杆状病毒。传代3病毒用于感染sf9细胞以过量表达重组btk蛋白。然后使用ni-nta柱将btk蛋白纯化至同质。根据敏感的sypro-ruby染色法,最终蛋白制备品的纯度大于95%。在水中制备200μmatp溶液并且用1nnaoh调节至ph7.4。将量为1.25μl的化合物的5%dmso溶液转移至96孔半区costar聚苯乙烯板。逐一地并用11点剂量反应曲线(起始浓度是10μm;1:2稀释度)来测试化合物。将量为18.75μl的无酶预混试剂(作为阴性对照)和加酶预混试剂转移至96孔半区costar聚苯乙烯板中的合适孔。将5μl200μmatp加入96孔半区costar聚苯乙烯板中的混合物中,使最终atp浓度是40μm。使反应物在室温培养1小时。用含有30mmedta、20nmsa-apc和1nmpt66ab的perkinelmer1x检测缓冲液使反应停止。用使用激发滤光片330nm、发射滤光片665nm和第二发射滤光片615nm的perkinelmerenvision,使用时间分辨荧光读板。然后计算ic50值。或者,可以使用lanthascreen测定,通过定量其磷酸化的肽产物来评价btk活性。在肽产物上的荧光素和在检测抗体上的铽之间发生的fret(荧光共振能量跃迁)随着添加降低肽的磷酸化的btk抑制剂而下降。在25ul的最终反应体积中,使btk(h)(0.1ng/25ul反应)与50mmhepesph7.5、10mmmgcl2、2mmmncl2、2mmdtt、0.2mmnavo4、0.01%bsa和0.4um荧光素poly-gat一起温育。通过添加atp至25um(atp的km)引发反应。在室温下温育60分钟后,通过在室温下添加在60mmedta中终浓度为2nmtb-py20的检测抗体,持续30分钟,来终止反应。在perkinelmerenvision上,使用在340nm激发以及在495nm和520nm发射进行检测。示例btk抑制ic50值示于表1、2和3中。实施例902ramos细胞btk测定可用于测试式i化合物的标准细胞btk激酶测定的另一种一般方法如下。以0.5×107细胞/ml的密度在供试化合物存在下在37℃培养ramos细胞1hr。然后通过用10μg/ml抗人igmf(ab)2在37℃培养5分钟来刺激细胞。使细胞成丸(pelleted)、溶解,并且对澄清溶解液进行蛋白测定。对等蛋白量的各样品进行sds-page并且用抗磷酸btk(tyr223)抗体(cellsignalingtechnology#3531;epitomics,cat.#2207-1)或磷酸btk(tyr551)抗体(bdtransductionlabs#558034)进行蛋白质印迹,以评估btk自磷酸化或者用抗btk抗体(bdtransductionlabs#611116)来控制各溶解液中btk的总量。实施例903b细胞增殖测定可用于测试式i化合物的标准细胞b细胞增殖测定的一般方法如下。使用b细胞分离试剂盒(miltenyibiotech,cat#130-090-862)从8-16周龄balb/c小鼠的脾纯化b细胞。将供试化合物稀释在0.25%dmso中,与2.5×105纯化的小鼠脾b细胞培养30分钟,然后加入10μg/ml抗小鼠igm抗体(southernbiotechnologyassociatescat#1022-01),最终体积是100μl。培养24hr后,加入1μci3h-胸苷,将板培养另外36hr,然后使用生产商的关于spa[3h]胸苷吸收测定系统(amershambiosciences#rpnq0130)的实验方案收集。在microbeta计数器(wallacetriplex1450,perkinelmer)中计数基于spa珠的荧光。实施例904t细胞增殖测定可用于测试式i化合物的标准t细胞增殖测定的一般方法如下。使用全t细胞分离试剂盒(miltenyibiotech,cat#130-090-861)从8-16周龄balb/c小鼠的脾纯化t细胞。将供试化合物稀释在0.25%dmso中并且与2.5×105纯化的小鼠脾t细胞以100μl最终体积在透明平底板中一起培养,所述板用各为10μg/ml的抗cd3(bd#553057)和抗cd28(bd#553294)抗体在37℃预涂90min。培养24hr后,加入1μci3h-胸苷,将板培养另外36hr,然后使用生产商的关于spa[3h]胸苷吸收测定系统(amershambiosciences#rpnq0130)的实验方案收集。在microbeta计数器(wallacetriplex1450,perkinelmer)中计数基于spa珠的荧光。实施例905cd86抑制测定可用于测试式i化合物的抑制b细胞活性的标准测定的一般方法如下。通过红细胞裂解(bdpharmingen#555899),从8-16周龄balb/c小鼠的脾纯化总小鼠脾细胞。在透明平底板(falcon353072)中,使供试化合物稀释在0.5%dmso中并且与1.25×106脾细胞在200μl最终体积中于37℃培养60分钟。然后加入15μg/mligm(jacksonimmunoresearch115-006-020)来刺激细胞,并且细胞在37℃、5%co2中培养24hr。培养24hr后,使细胞转移至锥形底透明96孔板并且通过以1200xgx5min离心使细胞成丸。用cd16/cd32(bdpharmingen#553142)将细胞预封闭(preblock),随后用cd19-fitc(bdpharmingen#553785)、cd86-pe(bdpharmingen#553692)和7aad(bdpharmingen#51-68981e)进行三重染色。在bdfacscalibur上将细胞分类并且对cd19+/7aad-群设门(gated)。测量对应于供试化合物的浓度,设门的群上的cd86表面表达的水平。示例性结果示于表4中。实施例906b-all细胞存活测定以下是标准b-all(急性淋巴细胞性白血病)细胞存活研究的方法,其使用xtt读数器来测量活细胞的数量。该测定可以用于测试式i化合物抑制培养物中b-all细胞的存活的能力。可以使用的一种人急性b细胞型淋巴细胞性白血病系是sup-b15,其为一种可从atcc获得的人前b细胞all系。以5×105细胞/ml的浓度将sup-b15前b-all细胞接种在多个96孔微量滴定板的100μliscove培养基+20%fbs中。然后加入供试化合物,使最终浓度是0.4%dmso。细胞在37℃和5%co2下培养至多3天。三天后,将细胞按1:3分到含有供试化合物的新鲜96孔板中并允许生长另外3天。每24h的时间段后,向一个复制96孔板加入50ulxtt溶液,并且按照生产商的指示在2、4和20小时采集吸光度读数。然后采集仅用dmso处理的细胞在本测定的线性范围(0.5-1.5)内的od读数,并且测量化合物处理的孔中的活细胞相对于仅dmso处理的细胞的百分率。实施例907cd69全血测定从具有以下限制的健康志愿者获得人血:1周未药物、不抽烟。通过静脉穿刺入含有肝素钠的(becton,dickinsonandco.)管收集血液(约20ml测试8种化合物)。将式i化合物在dmso中的10mm溶液以1:10在100%dmso中稀释,然后为了10点剂量-反应曲线,在100%dmso中以三倍系列稀释比进行稀释。将化合物以1:10在pbs中进一步稀释,然后将5.5μl等分量的各化合物一式两份地加入到2ml96孔板;加入5.5μl的10%dmso/pbs作为对照和无刺激孔。将人全血–hwb(100μl)加入到各孔。在混合后,将板在37℃、5%co2、100%湿度下培养30分钟。将山羊f(ab’)2抗人igm(10μl500μg/ml溶液,50μg/ml最终)加入到各孔(除了无刺激孔之外)并且混合,将板再培养20小时。在20小时培养结束时,使样品与荧光标记的抗体在37℃、5%co2、100%湿度下一起培养30分钟。包括诱导的对照、用于补偿调节的未染色的和单染色的、以及初始电压设定。然后按照生产商的说明书用pharmlysetm(bdbiosciencespharmingen)溶解样品。而后将样品转移至适合于在lsrii仪上的bdbioscienceshts96孔系统上工作的96孔板。利用bdbiosciencesdiva软件获得采集的数据和平均荧光强度。通过facs分析软件(flowjo)初步分析结果。供试化合物的ic50定义为使经抗-igm刺激也呈cd20阳性的cd69阳性细胞降低50%时的浓度(在减去无刺激背景的8个孔的平均值后,8个对照孔的平均值)。利用非线性回归曲线拟合,通过prism第5版计算ic50值。在cd69全血测定中,选自表1、2和3中的化合物的示例性ic50值包括:化合物编号ic50(微摩尔)1050.0881970.0232100.0353130.0443240.0533250.0243430.0533450.024当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1