一种香豆素类化合物及其制备方法与应用与流程
本发明属于医药技术领域,尤其涉及一种香豆素类化合物及其制备方法与应用。
背景技术:
独活,2015年版《中国药典》一部收载,为伞形科当归属植物重齿毛当归angelicapubescensmaxim.f.biserratashanetyuan的干燥根,性味辛、苦,微温。归肾、膀胱经,具有祛风除湿,通痹止痛之功效,用于风寒湿痹,腰膝疼痛,少阴伏风头痛,风寒挟湿头痛等症。独活始载于《神农本草经》,被列为上品,主要分布于我国湖北、四川、江西等地,用药历史悠久,为常用传统中药材。
独活的主要化学成分为香豆素类化合物,其中包括简单香豆素、呋喃香豆素、吡喃香豆素以及香豆素苷和双香豆素等,除此还有挥发油类以及少量炔烯类、倍半萜类、甾体和生物碱类化合物。现代药理学研究表明,独活浸膏具有镇静、催眠、镇痛等作用,独活寄生汤具有明显抗炎作用;另有研究表明独活具有调节血管紧张素受体、钙通道阻滞剂受体等活性,具有降压和抗心律不齐的作用;同时还具有促进脂肪分解、抗肿瘤等活性。
心脑血管疾病是心脏血管和脑血管疾病的统称,泛指由于高脂血症、血液粘稠、动脉粥样硬化、高血压等导致的心脏、大脑及全身组织发生的缺血性或出血性疾病。心脑血管疾病患病率高、致残率高、死亡率高,已经成为全世界范围内严重威胁人类健康的头号杀手。随着经济发展,人们生活水平逐步提高,生活节奏不断加快,使心脑血管疾病的发病率不断攀升,而预防和治疗心脑血管疾病的药物需求也随之增加。抗氧化剂sod活性和自由基代谢产物mda含量是检测抗氧化活性的重要指标,科学研究表明,人体疾病的发生都与氧自由基有一定的关系,癌症、衰老或其它疾病大都与过量自由基的产生有关联,而抗氧化剂可以有效克服其所带来的危害。
本发明提供一种新的具有较强的抗氧化活性的香豆素类化合物。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种具有较强的抗氧化活性的香豆素类化合物及其制备方法与应用。
本发明提供了一种香豆素类化合物,如式(i)所示:
本发明还提供了一种香豆素类化合物的制备方法,包括以下步骤:
s1)将独活用醇溶剂进行提取,得到浸膏;
s2)将所述浸膏依次通过硅胶柱色谱、反相柱色谱、凝胶柱色谱和制备型高效液相色谱进行分离,得到式(i)所示的化合物;
优选的,所述独活与醇溶剂的质量比为1:(6~10)。
优选的,所述硅胶柱色谱所用的洗脱液为石油醚、乙酸乙酯、二氯甲烷、丙酮与甲醇中的一种或多种。
优选的,所述反相柱色谱所用的仪器为中低压制备色谱、高效液相色谱或动态轴向压缩色谱;所述反相色谱所用的流动相为有机溶剂的水溶液;所述有机溶剂为甲醇或乙腈。
优选的,所述反相柱色谱的洗脱为梯度洗脱;以体积分数计,所述梯度洗脱程度为:0~20min,10%~35%有机溶剂的水溶液;20~60min,35%~65%有机溶剂的水溶液;60~80min,65%~100%有机溶剂的水溶液。
优选的,所述凝胶柱色谱中的凝胶为sephadexlh-20、sephadexg15或sephadexg50。
优选的,制备型高效液相色谱的流动相为甲醇-水溶液或乙腈-水溶液。
本发明还提供了一种上述香豆素类化合物在制备抗氧化类药物中的应用。
本发明还提供了一种药物制剂,包括上述的香豆素类化合物与药学上可接受的载体。
本发明提供了一种香豆素类化合物,如式(i)所示。与现有技术相比,该化合物能够增强sh-sy5y细胞中h2o2导致的细胞活力下降,提高sod活性,并降低mda含量,显示出较强抗氧化和细胞保护活性,可用于开发抗衰老及改善心脑血管疾病相关药物。
附图说明
图1为本发明实施例1得到的式(i)所示的香豆素类化合物的esi-ms谱图;
图2为本发明实施例1得到的式(i)所示的香豆素类化合物的1h-nmr谱图;
图3为本发明实施例1得到的式(i)所示的香豆素类化合物的13c-nmr谱图;
图4为本发明实施例1得到的式(i)所示的香豆素类化合物的dept谱图;
图5为本发明实施例1得到的式(i)所示的香豆素类化合物的hsqc谱图;
图6为本发明实施例1得到的式(i)所示的香豆素类化合物的hmbc谱图;
图7为本发明实施例1得到的式(i)所示的香豆素类化合物的noesy谱图。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种香豆素类化合物,如(i)所示:
该化合物能够增强sh-sy5y细胞中h2o2导致的细胞活力下降,提高sod活性,并降低mda含量,显示出较强抗氧化和细胞保护活性,可用于开发抗衰老及改善心脑血管疾病相关药物。
本发明还提供了一种上述香豆素化合物的制备方法,包括以下步骤:
s1)将独活用醇溶剂进行提取,得到浸膏;
s2)将所述浸膏依次通过硅胶柱色谱、反相柱色谱、凝胶柱色谱和制备型高效液相色谱进行分离,得到式(i)所示的化合物;
按照本发明,首先将独活用醇溶剂进行提取,得到浸膏;优选地,具体为将独活与溶剂混合,进行提取,将提取液浓缩后,得到浸膏;所述醇溶剂优选为乙醇,再优选为体积分数为50%~95%的乙醇;所述独活与醇溶剂的质量比优选为1:(6~10),更优选为1:(8~10);在本发明提供的一些实施例中,所述独活与醇溶剂的质量比优选为1:6;在本发明提供的一些实施例中,所述独活与醇溶剂的质量比优选为1:8;在本发明提供的另一些实施例中,所述独活与醇溶剂的质量比优选为1:10;所述提取的方法为本领域技术人员熟知的方法即可,并无特殊的限制,在本发明中采用回流的方法进行提取;为了提高收率,可进行多次提取;所述提取的次数优选为1~3次,更优选为2~3次;每次的提取时间优选为1~3h;在本发明提供的一些实施例中,所述每次提取的时间优选为1.5h;在本发明提供的一些实施例中,所述每次提取的时间优选为3h;在本发明提供的另一些实施例中,所述每次提取的时间优选为2h。
将所述浸膏进行分离,优选依次通过硅胶柱色谱、反相柱色谱、凝胶柱色谱和制备型高效液相色谱进行分离,得到式(i)所示的化合物。
所述硅胶柱色谱为本领域技术人员熟知的硅胶柱色谱即可,并无特殊的限制;所述柱色谱所用硅胶优选为80~100目;浸膏与硅胶拌样质量比优选为1:(1~2),更优选为1:(1~1.5),再优选为1:1.3;所述硅胶柱色谱所用的洗脱液优选为石油醚、乙酸乙酯、二氯甲烷、丙酮与甲醇中的一种或多种,更优选为二氯甲烷与丙酮的混合溶液;所述洗脱优选为梯度洗脱;所述二氯甲烷与丙酮的体积比优选为(1~50):1,收集二氯甲烷与丙酮体积比为(1~30):1的洗脱部位,得到硅胶柱色谱分离后的粗品。
再将硅胶柱色谱分离后的粗品通过反相柱色谱进行分离;所述反相柱色谱为本领域技术人员熟知的反相柱色谱即可,并无特殊的限制,本发明中其所用的仪器优选为中低压制备色谱、高效液相色谱或动态轴向压缩色谱,更优选为动态轴向压缩色谱;所述反相柱色谱的流动相优选为有机溶剂的水溶剂;所述有机溶剂优选为甲醇或乙腈;为了充分将所需化合物与杂质分离,优选进行梯度洗脱;所述梯度洗脱的程序优选为0~20min,10%~35%有机溶剂的水溶液;20~60min,35%~65%有机溶剂的水溶液;60~80min,65%~100%有机溶剂的水溶液;收集35~60min洗脱部分,得到反相柱色谱分离后的粗品。
然后将反相柱色谱分离后的粗品通过凝胶柱色谱进行分离;所述凝胶柱色谱为本领域技术人员熟知的凝胶柱色谱即可,并无特殊的限制,本发明中所述凝胶柱色谱中的凝胶优选为sephadexlh-20、sephadexg15或sephadexg50,更优选为sephadexlh-20;所述凝胶柱色谱的洗脱液优选为醇溶剂,更优选为甲醇;洗脱后得到凝胶柱色谱分离后的粗品。
最后将所述凝胶柱色谱分离后的粗品通过制备型高效液相色谱进行分离,得到式(i)所示的香豆素类化合物;所述制备型高效液相色谱为本领域技术人员熟知的制备型高效液相色谱即可,并无特殊的限制,本发明中其色谱柱优选为极性苯基柱,更优选为polar-rp;所述色谱柱的规格优选为21.2×250mm,5μm;所述制备型高效液相色谱的流动相优选为甲醇-水溶液或乙腈-水溶液;所述甲醇-水溶液或乙腈-水溶液中有机溶剂的体积分数优选为20%~35%;所述流动相的流速优选为3~100ml/min,更优选为5~80ml/min,再优选为10~60ml/min,最优选为15~30ml/min;所述制备型高效液相色谱的检测波长优选为250nm。
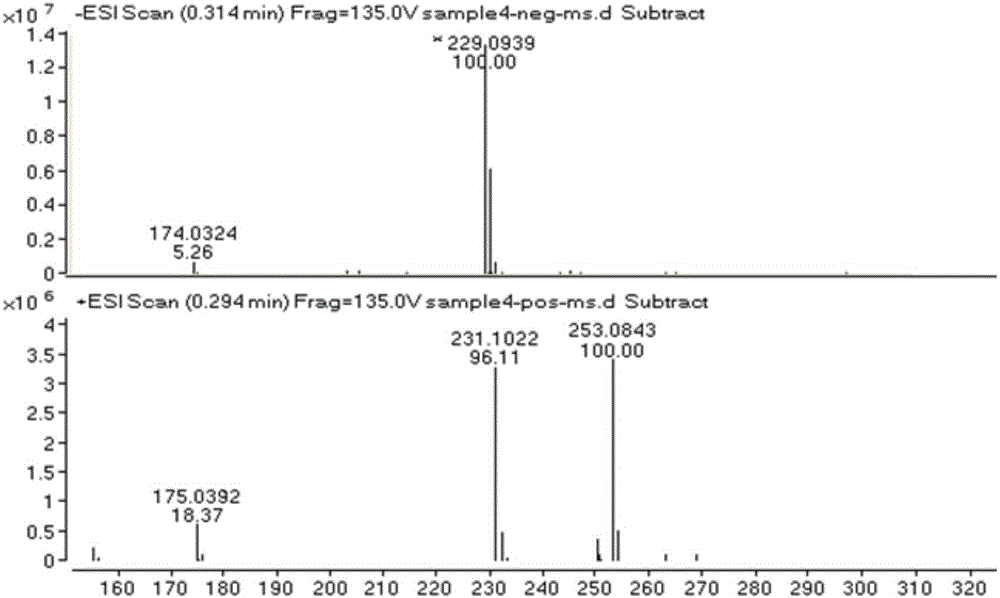
本发明提供的式(i)所示的香豆素类化合物为无色针状结晶,三氯化铁反应呈阳性,异羟肟酸铁反应呈阳性。高分辨质谱hr-esi-ms给出m/z229.0939[m-h]-,m/z253.0843[m+na]+,化合物分子量为230,结合元素分析及13c-nmr谱和dept谱推断该化合物分子式为c14h14o3。
本发明对分离得到的化合物进行结构鉴定,最终确定本发明化合物为(z)-7-hydroxy-8-(2-methylbut-2-enyl)coumarin,结构如式(i)所示,为一个新的香豆素类化合物。所有的碳氢信号归属见表1,表1为式(i)所示的香豆素类化合物的各个碳和氢的归属。
表1式(i)所示的香豆素类化合物的核磁数据(cdcl3,1h-nmr400mhz,13c-nmr100mhz)
本发明还提供了一种上述式(i)所示的香豆素类化合物在制备抗氧化类药物中的应用。
本发明还提供了一种药物制剂,包括式(i)所示的香豆素类化合物与药学上可接受的载体。
所述药学上可接受的载体可根据药剂学领域的常用辅料,根据剂型和实际情况进行恰当选择,例如常用的辅料有淀粉、低取代羟丙基纤维素、微粉硅胶、硬脂酸镁、淀粉浆、蔗糖、糊精、羧甲基淀粉钠、滑石粉、聚山梨酯、聚乙二醇、注射用大豆磷脂和注射用甘油等;利用本发明得到的式(i)所示的香豆素类化合物制备所需药物的各种剂型时,可以按照药剂学领域的常规生产方法制备,如将该提取物与一种或多种载体混合,然后制成相应的剂型。作为优选,所述中药制剂的剂型包括注射剂、片剂、栓剂、软膏剂、凝胶剂、丸剂、片剂、颗粒剂、胶囊剂和合剂。
本发明通过对独活药材进行提取,得到浸膏;然后将得到的浸膏进行分离,选择特定出峰时间的化合物,即得到式(i)所示的香豆素类化合物,且通过细胞实验发现,该化合物能够增强sh-sy5y细胞中h2o2导致的细胞活力下降,提高sod活性,并降低mda含量,显示出较强抗氧化和细胞保护活性。
为了进一步说本发明,以下结合实施例对本发明提供的一种香豆素类化合物及其制备方法与应用进行详细描述。
以下实施例中所用的试剂均为市售。
实施例1
1.1独活药材10kg,加入10倍量的体积分数为50%乙醇水溶液,提取3次,每次1.5h,过滤,将滤液浓缩、回收乙醇得到浸膏。
1.2取步骤1.1中得到的浸膏与80~100目硅胶以质量比1:1.3的比例进行拌样,经硅胶柱色谱分离,采用二氯甲烷-丙酮混合溶液进行梯度洗脱;所述二氯甲烷-丙酮体积比为(1~50):1,收集二氯甲烷-丙酮体积比为(1~30):1洗脱部位,得硅胶柱色谱分离后的粗品。
1.3取步骤1.2中得到的硅胶柱色谱分离后的粗品,经反相动态轴向压缩柱色谱进行分离,以乙腈-水溶液进行梯度洗脱,洗脱程序为0~20min,10%~35%;20~60min,35%~65%;60~80min,65%~100%乙腈-水溶液,收集35~60min洗脱部位,得反相柱色谱分离后的粗品。
1.4取步骤1.3中得到的反相柱色谱分离后的粗品,经sephadexlh-20凝胶柱色谱分离,甲醇洗脱,进行纯化,得到纯化后的样品。
1.5取步骤1.4中得到的纯化后的样品,通过制备型高效液相色谱进行分离,以polar-rp21.2×250mm,5μm为色谱柱;以35%乙腈-水溶液为流动相进行洗脱,流速15ml/min;检测波长为250nm,收集洗脱液减压干燥,得到式(i)所示的香豆素类化合物7mg,纯度为98.5%。
实施例1得到的式(i)所示的香豆素类化合物为无色针状结晶,三氯化铁反应呈阳性,异羟肟酸铁反应呈阳性。高分辨质谱hr-esi-ms给出m/z229.0939[m-h]-,m/z253.0843[m+na]+,化合物分子量为230,结合元素分析及13c-nmr谱和dept谱推断该化合物分子式为c14h14o3。
对实施例1得到的化合物进行结构鉴定,结果见图1~7,图1为本发明实施例1得到的式(i)所示的香豆素类化合物的esi-ms谱图,图2为本发明实施例1得到的式(i)所示的香豆素类化合物的1h-nmr谱图,图3为本发明实施例1得到的式(i)所示的香豆素类化合物的13c-nmr谱图,图4为本发明实施例1得到的式(i)所示的香豆素类化合物的dept谱图,图5为本发明实施例1得到的式(i)所示的香豆素类化合物的hsqc谱图,图6为本发明实施例1得到的式(i)所示的香豆素类化合物的hmbc谱图,图7为本发明实施例1得到的式(i)所示的香豆素类化合物的noesy谱图。
通过对图1~图7进行分析,实施例1中得到的化合物的1h-nmr(cdcl3,400mhz)谱(见图2),给出一组香豆素特征质子信号δ6.25(1h,d,j=9.4hz,h-3),δ7.65(1h,d,j=9.4hz,h-4),δ7.23(1h,d,j=8.4hz,h-5),δ6.86(1h,d,j=8.4hz,h-6);结合5位和6位质子信号的耦合常数,推测该化合物为7,8二取代香豆素。一个亚甲基质子信号δ3.60(2h,d,j=7.2hz,h-1′);一个次甲基质子信号δ5.28(1h,m,h-3′);两个甲基质子信号δ1.85(3h,s,4′-ch3),δ1.73(3h,d,j=0.9hz,5′-ch3),且通过5′-ch3质子耦合常数推断4′-c与5′-c分别与两个不同c相连;13c-nmr(cdcl3,100mhz)谱(见图3),共给出14个碳信号,9个香豆素母核碳信号,其中δ162.2为香豆素母核2位的特征碳信号;dept谱(见图4)显示δ18.0和δ25.8为两个甲基碳信号;δ22.1为一个亚甲基碳信号。结合hmbc谱(见图6),对具有相关关系的碳氢信号进行归属,δ7.65(h-4)与δ162.2(c-2)、δ153.2(c-9)、δ126.6(c-5)相关;δ7.23(h-5)与δ144.5(c-4)、δ158.6(c-7)、δ153.2(c-9)相关;δ6.86(h-6)与δ112.6(c-10)、δ115.1(c-8)相关;δ6.25(h-3)与δ162.2(c-2)、δ112.6(c-10)相关;δ3.60(h-1′)与δ158.6(c-7)、δ153.2(c-9)、120.4(c-3′)和25.8(c-5′)远程相关;δ5.28(h-3′)与25.8(c-5′)、18.0(c-4′)和22.1(c-1′)远程相关;δ1.85(4′-ch3)、δ1.73(5′-ch3)与120.4(c-3′)和135.4(c-2′)远程相关。noesy谱(见图7)显示δ5.28(h-3′)与δ1.73(5′-ch3)具有相关关系,由此确定c-4′和c-5′连接方向为相反。综合以上谱图数据分析,确定该化合物为(z)-7-hydroxy-8-(2-methylbut-2-enyl)coumarin,是一个新的香豆素类化合物。
实施例2
2.1独活药材10kg,加入6倍量的体积分数为95%乙醇水溶液,提取2次,每次3h,过滤,将滤液浓缩、回收乙醇得到浸膏。
2.2取步骤2.1中得到的浸膏与80~100目硅胶以质量比1:1.3比例进行拌样,经硅胶柱色谱分离,采用二氯甲烷-丙酮混合溶液进行梯度洗脱;所述二氯甲烷-丙酮体积比为(1~50):1,收集二氯甲烷-丙酮体积比为(1~30):1洗脱部位,得硅胶柱色谱分离后的粗品。
2.3取步骤2.2中得到的硅胶柱色谱分离后的粗品,经反相动态轴向压缩柱色谱进行分离,以乙腈-水溶液进行梯度洗脱,洗脱程序为0~20min,10~35%;20~60min,35~65%;60~80min,65~100%乙腈-水溶液,收集35~60min洗脱部位,得反相柱色谱分离后的粗品。
2.4取步骤2.3中得到的反相柱色谱分离后的粗品,经sephadexlh-20凝胶柱色谱分离,甲醇洗脱,进行纯化,得到纯化后的样品。
2.5取步骤2.4中得到的纯化后的样品,通过制备型高效液相色谱进行分离,以polar-rp21.2×250mm,5μm为色谱柱;以20%乙腈-水溶液为流动相进行洗脱,流速30ml/min;检测波长为250nm,收集洗脱液减压干燥,得到式(i)所示的香豆素类化合物8mg,纯度为98.6%。
通过对检测结果分析可知,本发明得到的化合物结构如式(i)所示。
实施例3
3.1独活药材10kg,加入8倍量的体积分数为75%乙醇水溶液,提取2次,每次2h,过滤,将滤液浓缩、回收乙醇得到浸膏。
3.2取步骤3.1中得到的浸膏与80~100目硅胶以质量比1:1.3比例进行拌样,经硅胶柱色谱分离,采用二氯甲烷-丙酮混合溶液进行梯度洗脱;所述二氯甲烷-丙酮体积比为(1~50):1,收集二氯甲烷-丙酮体积比为(1~30):1洗脱部位,得硅胶柱色谱分离后的粗品。
3.3取步骤3.2中得到的硅胶柱色谱分离后的粗品,经反相动态轴向压缩柱色谱进行分离,以乙腈-水溶液进行梯度洗脱,洗脱程序为0~20min,10~35%;20~60min,35~65%;60~80min,65~100%乙腈-水溶液,收集35~60min洗脱部位,得反相柱色谱分离后的粗品。
3.4取步骤3.3中得到的反相柱色谱分离后的粗品,经sephadexlh-20凝胶柱色谱分离,甲醇洗脱,进行纯化,得到纯化后的样品。
3.5取步骤3.4中得到的纯化后的样品,通过制备型高效液相色谱进行分离,以polar-rp21.2×250mm,5μm为色谱柱;以30%乙腈-水溶液为流动相进行洗脱,流速20ml/min;检测波长为250nm,收集洗脱液减压干燥,得到式(i)所示的香豆素类化合物8mg,纯度为98.7%。
通过对检测结果分析可知,本发明得到的化合物结构如式(i)所示。
实施例4式(i)所示的香豆素类化合物对h2o2所致sh-sy5y细胞损伤的保护作用研究
1.材料
1.1药物:式(i)所示的香豆素类化合物。
1.2细胞:sh-sy5y人神经母细胞瘤细胞株,中国科学院典型培养物保藏中心上海细胞库。
培养条件:dmem+10%胎牛血清,37℃,5%co2培养箱。
1.3仪器与试剂:超净工作台(苏净安泰);二氧化碳培养箱(thermoscientific);酶标仪(md);离心机(北京众益中和生物技术有限公司);细胞自动计数仪(invitrogen);高压蒸汽灭菌锅(bxm-30r立式压力蒸气灭菌锅);倒置显微镜(olypus),96孔细胞培养板(costar),25cm2细胞培养瓶(costar),移液枪(eppendorf)。dmem培养基(gibco),胎牛血清(hyclone),胰蛋白酶(gibco),lps(sigma),dmso(sigma),总sod活性检测试剂盒(碧云天生物技术研究所)。
2.实验方法与步骤
药液的配制:将药物以dmso溶解,制得1mol/l的储备液。临用时分别稀释成高、中、低浓度为50、25、12.5μmol/l的式(i)所示的香豆素类化合物药液。
实验方法:细胞以1×105个/ml的浓度接种于96孔细胞培养板,每孔100μl,于37℃、5%co2细胞培养箱中培养24小时后,吸弃上清,按照实验要求随机分为空白组、模型组、给药组,每组3个复孔。空白组给予100μl无血清dmem培养基,模型组和给药组分别给予100μl含浓度为200μmol/l的h2o2无血清培养基;h2o2氧化损伤3h后,空白组和模型组分别给予100μl完全培养基,给药组给予100μl浓度分别为50μmol/l、25μmol/l、12.5μmol/l的高、中、低剂量组的式ⅰ所示化合物。pbs清洗3次,3000r·min-1离心5min,吸弃上清液,加入细胞裂解液后,按照试剂盒说明测定sod活性和mda含量。
实验结果:h2o2损伤造模后,sh-sy5y细胞活力下降,sod活性明显降低,mda含量升高。分别加入高、中、低剂量式i化合物后,可见高、中剂量组sod活性均较模型组明显升高,mda含量有所降低,具有显著性差异(p<0.01,p<0.05),低剂量组无显著性差异。数据结果如表2。
表2式(i)所示的香豆素类化合物对h2o2损伤sh-sy5y细胞内sod活性和mda含量影响(x±s,n=6)
与空白组比较,##p<0.01,与模型组比较,**p<0.01,*p<0.05。
4.结论
本发明化合物能够增强sh-sy5y细胞中h2o2导致的细胞活力下降,提高sod活性,并降低mda含量,显示出较强抗氧化和细胞保护活性。
实施例5式(i)所示的香豆素类化合物制备片剂药物
将350g式i所示结构的化合物和50g淀粉、7.5g羧甲基淀粉钠、0.8g滑石粉、50g糊精、0.8g硬脂酸镁及适量10%淀粉浆适混合,按照常规方法制成式i所示结构的化合物片剂1000片。每日3次,每次1片。
实施例6式(i)所示的香豆素类化合物制备丸剂药物
将350g式i所示结构的化合物和12g聚乙二醇-6000、80.5g聚山梨酯-80、适量液状石蜡混合,按照常规方法制成式i所示结构的化合物丸剂1000粒。每日3次,每次1粒。
实施例7式(i)所示的香豆素类化合物制备注射剂药物
将200g式i所示结构的化合物和15g注射用大豆磷脂、25g注射用甘油,注射用水定容至1000ml,按照常规方法制成式i所示结构的化合物注射剂1000支。每日1次,每次1支,至少采用250ml5%葡萄糖注射液稀释后静脉滴注。
- 还没有人留言评论。精彩留言会获得点赞!