人工改造的PCV2Cap蛋白、重组病毒及其应用的制作方法
本发明涉及基因工程技术领域,特别涉及一种人工改造的pcv2cap蛋白,还涉及含有此蛋白编码基因的重组病毒,还涉及人工改造的pcv2cap蛋白及重组病毒的应用。
背景技术:
猪圆环病毒1型和2型(pcv1和pcv2)非常小,直径只有17nm左右,呈球状,不具有囊膜。其基因组为单链环状dna,大约由1760个核苷酸构成,至少编码两个开放阅读框,分别是orf1和orf2。其中orf1编码rep蛋白,与病毒dna复制有关。orf2编码cap蛋白,与病毒粒子的装配相关。猪圆环病毒病(pcvd)在全球范围内广泛流行,给养殖业带来了巨大的经济损失。pcv2是导致该疾病的主要病原因子,对猪体进行pcv2疫苗免疫是较为有效的预防手段。
传统的疫苗种类包括弱毒苗和灭活苗,两者的制备都需要大规模地培养病原微生物,在生产应用上存在一定的风险。重组亚单位疫苗因不含有病原微生物及其遗传物质,所以不存在上述风险。杆状病毒-昆虫细胞表达系统(bevs)是一个高效的表达系统,能够表达具有生物活性的大分子蛋白质,已被广泛地用于生产病原微生物的抗原。近来,已有多种基于该平台的疫苗得到了商品化,比如merck的猪瘟苗porcilis
cap蛋白是pcv2的主要免疫原性蛋白,具有多个表位。最近,研究人员使用了多种表达系统来表达cap蛋白,从而制备pcv2亚单位疫苗,比如大肠杆菌和重组病毒载体疫苗(杆状病毒和伪狂犬病毒)。尽管每种表达系统都具有独特的优势,但是也存在一些不足限制了重组亚单位疫苗的开发利用。比如大肠杆菌表达系统操作简单、产量高,但是表达的蛋白不能够正确的折叠和加工,而这些对抗原天然构象的形成是必不可少的。杆状病毒表达系统能够表达多种病毒的结构蛋白,进而形成病毒样颗粒(vlps)。目前国外已有两种基于杆状病毒表达系统的pcv2亚单位疫苗得到了商品化,应用效果良好。我国也已有采用该表达系统表达pcv2cap蛋白的研究报道,但其表达水平较低,疫苗生产成本较高。
技术实现要素:
为了解决以上现有技术中pcv2cap蛋白表达水平较低,疫苗免疫免疫效果不够理想的问题,本申请公开了一种人工改造的pcv2cap蛋白,还涉及含有此蛋白编码基因的重组病毒,还涉及人工改造的pcv2cap蛋白及重组病毒的应用。
本发明是通过以下步骤得到的:
表达人工改造的pcv2cap蛋白的核苷酸序列,如序列表中序列2或序列3。
人工改造的pcv2cap蛋白,是序列表中序列2或序列3经过表达后得到的。
含有、所述的表达人工改造的pcv2cap蛋白的核苷酸序列的重组病毒。
所述的重组病毒的构建方法,包括以下步骤:
(1)以含有序列表中序列1的核苷酸序列的pcv2orf2基因为模板,以下述的引物对中的一对进行pcr扩展,pcr产物经纯化后酶切克隆入pfastbac载体,转化大肠杆菌dh5α,选取阳性质粒得到重组质粒;
(2)重组质粒转化感受态细胞dh10bac,培养,进行蓝白斑筛选,按bac-to-bac杆状病毒表达系统中的碱裂解法提取重组载体骨架bacmid,转染昆虫细胞,出现病变的昆虫细胞即为重组病毒;
所述引物对的核苷酸序列如下:
kozakandmutations:5’-cgctcgagatcaaaatggcctaccccc-3’,
kozakr:5’-agggtacctcacttggggttcag-3’。
或:kozaks:5’-cgctcgagatcaaaatgacctaccccc-3’,
kozakr:5’-agggtacctcacttggggttcag-3’。
所述的人工改造的pcv2cap蛋白或者所述的重组病毒在pcv2免疫疫苗中的应用。
从重组病毒中获取pcv2cap蛋白,制备成疫苗。
重组病毒细胞中加入pbs溶液得到细胞悬液,吹下细胞,对细胞悬液进行超声波裂解,得到含有pcv2cap蛋白的细胞裂解液,以cp974s水佐剂为基础,配制佐剂,将佐剂与等体积的细胞裂解液混合,制备动物免疫用疫苗。
所述免疫疫苗为重组亚单位疫苗。
本发明的有益效果:
1)其中重组杆状病毒rbcapokm为研制pcv2亚单位疫苗奠定了重要基础。为了提高pcv2cap蛋白表达水平和抗原性,本发明根据昆虫细胞密码子的偏嗜性对cap蛋白的基因进行优化,设计了7种含cap蛋白的基因分子,构建重组病毒,筛选获得两株重组杆状病毒,能有效表达cap蛋白,具有良好的免疫原性,并能够自组装成病毒样粒子,为pcv2亚单位疫苗的研发打下了基础;
2)本发明构建成功的昆虫杆状病毒表达系统制备的pcv2亚单位疫苗,进行动物免疫试验。小鼠免疫试验表明,重组蛋白均可诱导产生高水平的elisa抗体和中和抗体。该重组cap蛋白具有较好的免疫保护效果,具有很好的开发和应用前景。
附图说明
图1为cap基因扩增,
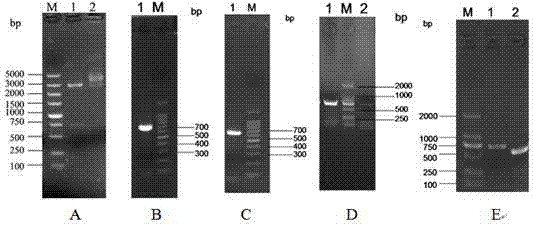
图2为目的基因的扩增结果,
a:m.dl5000dnamarker;1.pvax-cap双酶切产物(bamhi和xhoi);2.pvax双酶切产物(bamhi和xhoi);b:m.100bpdnamarker;1.capompcr产物;c:m.100bpdnamarker;1.capo/bnlspcr产物;d:m.dl2000dnamarker;1.capokpcr产物;2.capokmpcr产物;
e:m.dl2000dnamarker;1.capoempcr产物;2.capo△nlspcr产物,
图3重组载体质粒的鉴定,其中
a:m1.dl2000dnamarker;1.pfastbachtb-capo双酶切产物(bamhi和xhoi);2.pfastbachtb双酶切产物(bamhi和xhoi);m2.dl15000dnamarker.b:m1.dl2000dnamarker;1.pfastbachtb-capom双酶切产物(bamhi和xhoi);2.pfastbachtb双酶切产物(bamhi和xhoi);m2.dl15000dnamarker.c:m1.dl2000dnamarker;1.pfastbacdual-capo/bnls双酶切产物(xhoi和kpni);2.pfastbacdual双酶切产物(xhoi和kpni);m2.dl15000dnamarker.d:m1.dl2000dnamarker;1.pfastbacdual-capok双酶切产物(xhoi和kpni);2.pfastbacdual双酶切产物(xhoi和kpni);m2.dl15000dnamarker.
e:m1.dl2000dnamarker;1.pfastbacdual-capokm双酶切产物(xhoi和kpni);2.pfastbacdual双酶切产物(xhoi和kpni);m2.dl15000dnamarker.f:m1.dl2000dnamarker;1.pfastbacdual-capo△nls双酶切产物(ecori和hindiii);2.pfastbacdual双酶切产物(ecori和hindiii);m2.dl15000dnamarker.g:m1.dl2000dnamarker;1.pfastbacdual-capoem双酶切产物(ecori和hindiii);2.pfastbacdual双酶切产物(ecori和hindiii);m2.dl15000dnamarker.
图4重组bacmid的pcr鉴定,其中
a:1,2:rbacmid-capopcr产物;m:dl5000dnamarker.b:1,2:rbacmid-capompcr产物(m13fandm13r).1,2:recombinantbacmiddnaamplifiedwithm13primers;m:dl5000dnamarker.c:1~4:rbacmid-capo/bnlspcr产物(m13fandm13r);m:1kbdnamarker.d:1~2,5~6:rbacmid-capokpcr产物(m13fandkozaks);3~4,7~8:rbacmid-capokmpcr产物;m:dl5000dnamarker.e:1~3:rbacmid-cap△nlspcr产物;m:dl5000dnamarker.f:1~4:
rbacmid-capoempcr产物;m.dl2000dnamarker.
图5重组杆状病毒感染sf9细胞的cpe
图6重组cap蛋白的sds-page分析,其中a:m,proteinmarker;1,rbcapo;2,rbcapom;3,rbcapok;4,rbcapokm;5,vbac-cap;6,lysatesofcells;b:m,proteinmarker;1,rbcapo/bnls;2,rbcapo△nls;3,rbcapoem;4,vbac-cap;5,lysatesofcells,
图7不同病毒感染的sf9细胞中重组cap蛋白的westernblot鉴定,其中a:1,rbcapo;2,rbcapom;3,rbcapok;4,rbcapokm;5,rbcapo△nls;6,rbcap/bnls;7,cellscontrol.b:1,rbcapoem;2,cellscontrol.
图8不同病毒感染的sf9细胞内重组cap蛋白的ifa鉴定,其中
a:rbcapo;b:rbcapom;c:rbcapok;d:rbcapokm;e:normalcells,
图9vlps的电镜观察,
图10小鼠免疫后elisa抗体检测,
图11小鼠免疫后中和抗体检测,
图12小鼠免疫后淋巴细胞增殖反应的检测,
图13仔猪免疫后elisa抗体检测(s/p),
图14仔猪免疫后中和抗体检测,
图15攻毒后仔猪体温的测定,
图16攻毒后各组猪相对日增重测定。
图17肺脏及淋巴结显微病变(he染色,100×),其中
cph(1),ipcv2(2)andchallengecontrol(3)at28dpc,
图18ihc检测结果(400×),其中
cph(1),ipcv2(2)andchallengecontrol(3)at28dpc。
具体实施方式
下面结合具体实施例对本发明进行进一步说明:
实施例1
1材料与方法
1.1材料
昆虫杆状病毒表达系统(baculovirusexpressionsystem,bevs)由本实验室保存,包括pfastbachtb、pfastbacdual质粒、dh10bac菌株、sf9昆虫细胞。大肠杆菌dh5α由本实验室保存,本实验中所用的限制性内切酶、t4dna连接酶、taq酶均购自takara公司。dna回收试剂盒和质粒提取试剂盒购自鼎国公司。培养昆虫细胞的grace培养基、expressfive无血清培养基和fbs为gibco公司产品。转3染试剂lipofectamine2000购于invitrogen公司。hrp标记的羊抗小鼠igg和fitc标记的spa购自博士德公司。含有经密码子优化的pcv2wg09毒株orf2基因的pvax-cap质粒由本实验室构建和保存,pvax-cap质粒中含有序列表中序列1中的capo基因序列,是经过优化的,针对pcv2cap蛋白的单克隆抗体亦由本实验室制备和保存。
1.2方法
1.2.1pcv2cap基因片段克隆引物设计和合成
1.2.1.1序列优化的完整cap基因的获得(capo)
用质粒pvax-cap转化感受态dh5α。挑取单菌落于含有kna+抗性的液体lb培养基中,37℃振荡培养12h,收集菌体,提取质粒。利用限制性内切酶bamhi和xhoi对提取的pvax-cap质粒进行双酶切,然后进行琼脂糖凝胶电泳,切取目的条带并进行纯化。
1.2.1.2碱基突变的完整cap基因的扩增(capom)
根据质粒pvax-cap的碱基序列,设计如下引物,
pcv2-orf2-s:5’-attggatccacgaccatggcctaccctcgc-3’和
pcv2-orf2-a:5’-cgcgctcgagtcacttggggttcag-3’,扩增得到capom。
1.2.1.3缺失核定位信号并添加分泌信号肽的cap的扩增(capo/bnls)
根据质粒pvax-cap和蜜蜂分泌信号肽(honeybeemelittinsecretionsignalpeptide)的碱基序列,设计如下三个引物,s1:5’-cttgtttttatggtcgtatacatttcttacatctatgccaacggcatcttcaaca-3’,s2:5’-gcctcgagacgaccataaattcttagtcaacgttgcccttgtttttatggtcg-3’和a:5’-atttggtacctcacttggggttcaggg-3’,分两次扩增出capo/bnls。
1.2.1.4添加昆虫kozak序列的完整cap的扩增(capok,见序列表中序列2)
根据质粒pvax-cap和果蝇的kozak序列的碱基,设计如下一对引物,kozaks:5’-cgctcgagatcacaatgacctaccccc-3’和kozakr:5’-agggtacctcacttggggttcag-3’,扩增出capok。
1.2.1.5添加昆虫kozak序列和碱基突变的完整cap的扩增(capokm,见序列表中序列3)
根据质粒pvax-cap和果蝇的kozak序列的碱基,设计如下一对引物,
kozakandmutations:5’-cgctcgagatcacaatggcctaccccc-3’和
kozakr:5’-agggtacctcacttggggttcag-3’,扩增出capokm。
1.2.1.6添加ecori序列的去nls的cap的扩增(capo△nls)
根据质粒pvax-cap和ecori序列的碱基,设计如下一对引物,
s-ecori(nls):5’-gcgaattcatgggcatcttcaacacc-3’
和r-hindiii:5’-cgaagctttcacttggggttca-3’,扩增得到去除nls的cap,命名为cap△nls。
1.2.1.7添加ecori序列的碱基突变的完整cap的扩增
根据质粒pvax-cap和ecori序列的碱基,设计如下一对引物,s-ecori:5’-ggatccgaattcatggcctacccc-3’和r-hindiii:5’-cgaagctttcacttggggttca-3’,扩增得到capem。
1.2.2目的基因片段的扩增
以质粒pvax-cap为模板,利用前文所述的各对引物,通过pcr分别扩增各个对应的cap基因片段。
pcr反应体系为:上、下游引物各1μl,2×mix12.5μl;稀释质粒的模板1.0μl;taqdna聚合酶0.2μl;灭菌双蒸水补至25μl。循环参数:95℃5min;94℃45s,52-58℃45s,72℃45s,30次循环;最后72℃延伸10min。根据各对引物的tm值,确定不同的退火温度,一般计算公式为:tm=4(g+c)+2(a+t),退火温度=tm值-(5~10℃)。1%琼脂糖凝胶电泳鉴定pcr产物,回收pcr产物,-20℃保存备用。
1.2.3pcr产物的克隆
1.2.3.1pcr产物的回收和纯化
pcr产物经琼脂糖凝胶电泳后,在紫外灯下切下含目的条带的琼脂糖胶块,参照dna快速回收纯化试剂盒说明书回收目的片段。
1.2.3.2pcr产物酶切与纯化
酶切反应总体积为20.0μl。10×buffer2.0μl,pcr回收片段10.0μl,酶各0.5μl,用无菌双蒸水补至总体积20.0μl。37℃作用4.0h,然后进行琼脂糖凝胶电泳,用琼脂糖凝胶回收试剂盒对酶切后的产物进行回收,方法同上。
不同cap片段采用对应的限制性内切酶,酶切体系如下:10×buffer2μl,内切酶10.5μl,内切酶20.5μl,pcr产物10μl,ddh2o7μl,总计20μl。
提取pvax-cap质粒,用限制性内切酶bamhi和xhoi对其进行双酶切,得到目的片段capo。再以pvax-cap质粒为模板,利用上文中的引物进行pcr扩增,分别得到对应的pcr产物。经1%琼脂糖凝胶电泳分析,pcr产物均在相应位置处出现特异性条带,与预期大小结果相符,如图2所示。然后切取含有目的片段的凝胶,回收纯化后备用。
1.2.3.3pfastbac载体的酶切与纯化
酶切反应总体积为20.0μl。10×buffer2.0μl,质粒5.0μl,内切酶各0.5μl,用无菌双蒸水补至总体积20.0μl,具体为:pfastbachtb用bamhi和xhoi双酶切,pfastbacdual分别用xhoi、kpni和ecori、hindiii双酶切。37℃作用4.0h,用琼脂糖凝胶回收试剂盒对酶切后的产物进行回收,方法同上。
酶切体系:10×buffer2.0μl,内切酶10.5μl,内切酶20.5μl,质粒5μl,ddh2o12μl,总计:20μl。
1.2.3.4目的基因克隆入pfastbac载体
通过酶切位点,将capo和capom基因分别克隆入供体质粒pfastbactmhtb中,将capo/bnls、capok、capokm、capoem和capo△nls基因分别克隆入供体质粒pfastbacdual中。16℃下过夜连接,将连接产物转化感受态dh5α细胞,再涂布含有氨苄青霉素的lb平板培养,37℃培养12h后挑取单个菌落培养,常规的碱裂解法提取疑似重组质粒。
连接体系:10×t4dnaligasebuffer1.0μl,t4dnaligase0.5μl,酶切目的基因7.5μl,酶切质粒载体1μl,总计10μl。
1.2.3.5连接产物的转化
将全部连接产物加入到dh5α感受态细胞,冰浴30min后42℃水浴中热激90s,然后迅速冰浴5min;加入800μllb液体培养基,37℃250rpm振摇培养50min;12000rpm离心30s后弃去大部分上清,剩余100μl上清重悬细菌沉淀,涂布于含50μg/ml氨苄青霉素的抗性平板上,37℃温箱中培养12h。
1.2.3.6重组质粒的小量提取
挑取连接产物转化后所涂布氨苄青霉素抗性平板上的单个菌落,接种于3ml的含50μg/mlamp的lb培养基中,37℃250rpm振荡培养12h,按axygen公司说明书提取质粒。
1.2.3.7重组质粒的酶切和测序鉴定
对提取的疑似阳性重组质粒进行双酶切鉴定,将鉴定正确的阳性质粒送由invitrogen公司进行测序鉴定。最后将鉴定正确的重组质粒pfastbachtb-capo、pfastbachtb-capom、pfastbacdual-cap/bnls、pfastbacdual-capok、pfastbacdual-capokm、pfastbacdual-capoem和pfastbacdual-cap△nls用于后续试验。双酶切鉴定体系如下:10×buffer2.0μl,内切酶10.5μl,内切酶20.5μl,质粒5μl,ddh2o12μl,总计20μl。
将capo和capom基因分别克隆入供体质粒pfastbactmhtb中,将capo/bnls、capok、capokm、capoem和capo△nls基因分别克隆入供体质粒pfastbacdual中。经pcr鉴定为阳性后,再进行双酶切鉴定,结果都切出与目的基因大小一致的片段(图3)。测序结果进一步表明,各个基因均正确克隆入载体,符合原有的阅读框。
1.2.4重组bacmid的构建与鉴定
1.2.4.1位点特异性转座
取冻存的dh10bac菌液接种于含50μg/ml卡那霉素的3mllb培养基中,37℃200rpm振荡培养12h;第二天取10μl新鲜菌液接种于新的含卡那霉素的lb培养基中,振荡培养。取3ml菌液制备感受态细胞,方法参见1.2.3.5。按照bac-to-bac表达系统说明书进行转化,将阳性质粒转化感受态细胞dh10bac,具体步骤如下:将1ul的重组质粒加入到100uldh10bac感受态细胞中,轻轻混匀后冰浴30min,42℃水浴热激45s,迅速置于冰水混合物中冰浴2min,然后加入800ul的新鲜lb液体培养基,37℃200rpm振荡培养4h,然后取10μl菌液稀释于200μl无抗生素的lb液体培养基中,涂布含10μg/ml四环素、50μg/ml卡那霉素、7μg/ml庆大霉素、100μg/mlx-gal和40μg/mliptg的lb平板。37℃温箱避光培养48h,至出现显著蓝白菌落。
1.2.4.2重组载体骨架bacmid的提取
在培养48h后,将lb平板置于4℃冰箱中2-3h,使菌落充分变蓝,然后挑取平板上较大的散在白色单菌落,重新划线接种于新的蓝白斑筛选平板上,进行第二次蓝白斑筛选,37℃培养过夜,第二天挑取单个白色单菌落接种于含10ug/ml的四环素、50ug/ml的卡那霉素和7ug/ml的庆大霉素的液体lb培养基中,37℃250rpm振荡培养12h以上,按bac-to-bac杆状病毒表达系统说明书中改良的碱裂解法提取重组载体骨架bacmid。
1.2.4.3重组bacmid的pcr鉴定
在用pcr来鉴定重组bacmid时,以提取的bacmid质粒作为模板,m13通用引物和cap基因的上下游引物对各个重组bacmid进行pcr鉴定。pcr反应体系为:上、下游引物各1μl,2×mix12.5μl;稀释质粒的模板1.0μl;taqdna聚合酶0.2μl;灭菌双蒸水补至25μl。pcr循环参数参照bac-to-bac表达系统说明书进行:94℃4min,94℃45s,55℃45s,72℃4min,30次循环;最后72℃延伸10min。反应结束后取5μlpcr产物进行琼脂糖凝胶电泳鉴定。鉴定正确的重组bacmid用于后续转染实验。
用鉴定正确的重组载体质粒转化感受态dh10bac,经2轮蓝白斑筛选后,挑取白色菌落进行培养,提取质粒用通用引物m13以及基因上下游引物进行鉴定,扩增出特定大小的条带,与预期结果一致(图4)。
1.2.5重组杆状病毒的获得与扩增
1.2.5.1重组bacmid转染sf9昆虫细胞
重组bacmid的转染按照lipofectamine2000的使用说明来操作并稍加修改。
①转染前1天将2×105sf9细胞接种于24孔培养板,并加入500μl不含抗生素的完全培养基,使细胞分布均匀,于27℃过夜培养,以保证转染时细胞汇合达90~95%。
②分别将2μllipofectamine2000和6μlbacmid稀释于50μl无血清无抗生素的grace’s培养液中并轻轻浑匀,室温孵育5min,将它们轻轻混合均匀,室温孵育20min。
③吸去24孔板中的培养基,将复合物(总体积100μl)加入培养孔,前后摇动培养板使其分布均匀。
④将细胞放入27℃培养箱孵育6h后,吸去转染混合液,直接加入2ml含10%fbs的grace’s完全培养基,27℃继续培养至sf9细胞出现明显病变。
1.2.5.2重组杆状病毒的获得与扩增
每天观察转染细胞的病变情况,在转染后5天可以看到sf9细胞出现明显病变,收获出现严重病变的sf9细胞和培养上清。500g离心5min收集上清,4℃避光保存,即为f1代重组病毒。细胞沉淀用于鉴定蛋白的表达。
将第一代重组病毒按1:10的体积比感染处于对数生长期的sf9细胞,27℃培养3天至细胞出现明显病变时,500g离心5min,去除细胞和大的细胞碎片,收集上清4℃避光保存,即为第二代病毒,用同样的方法获得第三代病毒。
用鉴定正确的重组bacmid转染sf9细胞,27℃培养4d,可以见到明显的细胞病变,主要表现为细胞变大变圆,与正常的sf9细胞差别明显(图5)。
1.2.6重组cap蛋白在sf9细胞中的表达与westernblot鉴定
用重组杆状病毒感染sf21细胞72h后,收集蛋白样品用于sds-page分析和westernblot鉴定。在图6a中可以看到,rbcapo、rbcapom、rbcapok和rbcapokm四个泳道可以观察到明显的目的蛋白条带,而wb结果表明,7种重组cap蛋白能与pcv2cap蛋白单克隆抗体发生特异性反应,而正常sf21细胞则没有反应(图7)。该结果表明,重组cap蛋白在杆状病毒系统中得到了高效表达,表达产物能被特异性抗体识别(pcv2cap蛋白单克隆抗体5h7)。1.2.7间接免疫荧光鉴定(ifa)
将各个重组毒接种于96孔板中的单层sf9细胞,同时设正常sf9细胞作为阴性对照。27℃培养2天,细胞出现明显病变前,弃培养上清液,pbs洗涤细胞后用预冷的80%丙酮固定,4℃作用10min。pbs洗涤2次,每次5min,加入1:500稀释的pcv2单克隆抗体,37℃孵育1h。pbs洗3次,每次5min,再加入1:200稀释的羊抗鼠igg-fitc,37℃孵育45min,pbs洗3次,于荧光显微镜下观察,记录结果。
重组杆状病毒感染sf9细胞48h后,用pcv2单克隆抗体3e5对其进行间接免疫荧光鉴定,观察结果表明,rbcapo、rbcapom、rbcapok和rbcapokm感染的细胞内可见亮绿色的荧光(图8中a、b、c、d中白色部分),而正常的sf9细胞为阴性,没有特异性荧光(图8中e)。这进一步证明了pcv2cap蛋白在sf9细胞中得到了表达。
1.2.8病毒样颗粒(vlp)的形成
将获得的重组杆状病毒接种于sf9细胞,大量表达重组蛋白。接种后于27℃温箱培养96h,当细胞出现显著病变时,500g离心5min收集细胞。加适量pbs重悬细胞沉淀,于冰上超声裂解10min,4℃12000rpm离心15min收获上清。亲和层析法纯化上清中的cap蛋白。将收获的蛋白经磷钨酸负染后透射电镜观察,检测是否有病毒样颗粒的形成。
之前已有文献报道杆状病毒表达的pcv2cap蛋白能形成病毒样颗粒(vlp),本研究对表达的重组蛋白(rbcapokm)进行亲和层系,然后进行透射电镜观察,可以见到病毒样颗粒的形成,大小约20nm(图9)。
1.2.9双抗体夹心elisa的测定
将获得的重组杆状病毒接种于sf9细胞,接种后于27℃温箱培养96h,当细胞出现显著病变时,500g离心5min收集细胞。加适量200μlpbs重悬细胞沉淀,再反复冻融3次,4℃12000rpm离心15min收获上清,用双抗体夹心elisa分析测定其抗原效价。
由表1中数据可知,重组杆状病毒rbcapokm在昆虫细胞中表达的重组cap蛋白具有较好的抗原性。
表1夹心elisa检测表达的重组cap蛋白
实施例2:不同重组蛋白小鼠免疫特性
2.1主要材料与实验动物
表达cap蛋白的重组杆状病毒rbcapo、rbcapom、rbcapok和rbcapokm均由本实验室构建并保存。highfive细胞(美国atcc)由本实验室保存;pcv2单克隆抗体3e5由本实验室制备并保存。isa15a佐剂为法国seppic佐剂。
5周龄清洁级icr小鼠70只,经间接elisa检测pcv2抗体阴性。
2.2疫苗制备
将相同滴度的重组杆状病毒(105.0tcid50/ml)接种highfive昆虫细胞,在感染后96小时收取发生病变的细胞。首先吸弃细胞培养上清,每瓶细胞(75cm2)加入1ml0.01mol/lph7.2pbs溶液,吹下细胞,再对细胞悬液进行超声波裂解,得到含有pcv2cap蛋白的细胞裂解液。用夹心elisa方法测定其cap蛋白含量,调整目的蛋白浓度为30μg/ml。将目的蛋白抗原和isa15a佐剂按4:1比例混合,以300r/min搅拌,充分混合10分钟,配置4种疫苗capo、capom、capok和capokm,保存于4℃备用。
2.3小鼠免疫试验
将60只清洁级小鼠随机分为7组,第1-4组为capo、capom、capok和capokm疫苗接种组,第5组为pbs对照组。小鼠适应2天后进行首免,免疫方法为背部皮下多点注射,疫苗免疫剂量是200μl。首免后14d进行加强免疫,加强免疫的剂量和方法与之前相同。首免后第28、42d,每组随机取5只小鼠眼球采血,分离血清,分别测定elisa抗体和中和抗体滴度;无菌摘取小鼠脾脏,加灭菌pbs研磨后分离淋巴细胞,测定淋巴细胞增殖反应。
2.4elisa抗体检测
包被抗原为本实验室制备纯化保存的capc,此蛋白由大肠杆菌表达。用ph9.6碳酸盐缓冲液稀释至终浓度为5ug/ml,包被酶标板,100μl/孔,37℃作用2h后4℃包被过夜;洗涤3次,每次3-5min;每孔加200μl的0.15%bsa封闭液封闭板子,37℃作用2h;洗涤;将待检血清用pbs倍比稀释,每个样品一行,每孔加100μl,37℃作用1h;洗涤;然后加入酶标羊抗鼠igg(1:5000倍稀释),100μl/孔,37℃作用1h;洗涤;加底物液tmb显色,最后用2mm的h2so4终止反应。结果判定:待检血清od450值/阴性血清od450值≥2.1为阳性。
结果见图10。capo、capom、capok和capokm疫苗首次免疫14天即可诱导产生pcv2抗体,首免后28天和42天,四个疫苗免疫组elisa抗体水平无明显差异(p>0.05)。同时,阴性对照组则未检测到pcv2特异性抗体。
2.5中和抗体检测
待检血清于56℃水浴30min进行灭活,12000rpm离心10min除菌后,吸出上清到灭菌的ep管中。再将处理好的血清用维持液进行倍比稀释,依次是1∶4、1∶8、1∶16、1∶32,……与此同时,将增殖的pcv2用维持液稀释到200tcid50/0.1ml,然后与不同稀释度的血清等体积混合,37℃水浴作用1h。弃掉长有pk15细胞的96孔板中的营养液,用纯dmem洗涤细胞一遍,再将水浴作用后的血清病毒混合物加到孔中,每个血清稀释度设置3个重复,100μl每孔,37℃培养72h。同时设置阴性血清对照、阴性血清病毒对照和空白对照。72h后用间接免疫荧光法(ifa)测定血清中和抗体效价,以能够抑制50%pcv2感染的血清最大稀释度作为待检血清的中和抗体效价。
结果如图11。首免后28和42天,capok和capokm疫苗免疫组pcv2中和抗体水平明显高于capo和capom疫苗免疫组(p<0.05)。同时,阴性对照组则未检测到pcv2中和抗体。
2.6淋巴细胞增殖试验
将小鼠眼球采血,用颈椎脱臼法处死小鼠。无菌条件下,取出脾脏,并用剪子剪去与其相连的结缔组织和脂肪组织。将分离获得的脾脏放入200目的虑网膜中,加入3mlpbs后无菌研磨,将脾细胞悬液转移到含有淋巴细胞分离液的离心管中,2000rpm离心15min。用吸管吸取中间层的灰白细胞,放入另一只试管中,加红细胞裂解液5ml,混匀脾细胞,静置5min,待红细胞完全破碎,2000rpm离心10min,弃上清去除红细胞。加入5ml纯1640再次洗涤细胞沉淀,2000rpm离心10min,弃掉上清,用10%的1640稀释到5×106个/ml,加入96孔板,100μl每孔。将pcv2作为刺激抗原,cona作为对照,终浓度10μg/ml,37℃下培养72h,每孔加入20μlmtt(5mg/ml),每组3个重复,37℃下继续培养6h。弃掉96孔中的培养液,加入dmso,100μl每孔,振荡融解紫色结晶,测定波长570nm的od值,计算刺激指数(si=刺激孔的od值/未刺激孔的od值)。
结果如图12。首免后28-42天,capo和capom疫苗免疫组均没有检测到pcv2特异性的淋巴细胞增殖;首免后28-42天,capok和capokm疫苗免疫组si值明显高于pbs组(p<0.05),表明capok和capokm疫苗可诱导小鼠产生pcv2特异性的细胞免疫应答反应。
重组杆状病毒rbcapo、rbcapom、rbcapok和rbcapokm表达的cap蛋白亚单位疫苗,四种疫苗均可诱导小鼠产生pcv2elisa抗体和中和抗体,但capok和capokm疫苗中和抗体和细胞免疫水平明显高于capo和capom疫苗,capok和capokm重组蛋白疫苗体液免疫和细胞免疫水平相似,具有重要应用前景。
应用spss软件对实验数据进行统计分析,并比较各组数值的差异,其中p<0.05表示差异显著,p<0.01表示差异极显著。
实施例3仔猪免疫保护试验
筛选21头30日龄断奶仔猪,经检测pcv2和prrsv抗原抗体均为阴性,随机分为4组,每组5~6只,各组隔离饲养。第一组接种pcv2亚单位疫苗(rbcapkm),第二组接种pcv2灭活苗,第三组不接种作为攻毒对照组,第四组不接种作为空白对照组。一免后21天进行加强免疫,免疫后注意观察免疫组仔猪是否有不良反应。二免后14天对免疫组和攻毒组仔猪进行攻毒,每头仔猪滴鼻攻毒3ml(pcv2sh,105tcid50/ml)并刺激,具体方法是,攻毒后第4天和7天注射血蓝蛋白,2ml每头(1mg/ml),同时腹腔注射巯基乙酸培养基,10ml每头,攻毒第14天和21天腹腔注射巯基乙酸培养基,10ml每头。攻毒后每天上午测量所有仔猪的体温,并观察仔猪的临床表现。在一免后21天和35天采血,分离血清用于elisa抗体和中和抗体检测。攻毒后7、14、21、28天采血,分离血清用于病毒血症检测。二免后14天和攻毒后28天分别称量每头猪体重,计算相对日增重(rdwg)。攻毒后28天剖杀所有仔猪,观察每头猪肺脏和淋巴结等脏器病变情况,取淋巴结、肺脏于4%多聚甲醛中固定,用于组织切片制作和免疫组化实验。
2.5.1elisa抗体检测
检测一免和二免猪血清中的pcv2特异性elisa抗体,二抗为spa-hrp,用封闭液稀释10000倍后使用。
根据小鼠免疫试验的结果,确定以cph免疫仔猪,并评价比较其与pcv2灭活苗的免疫保护效果。用间接elisa测定pcv2特异性抗体,结果以血清稀释100倍时的s/p值表示,具体结果见图13。首次免疫3周后,两个免疫组都有不同程度的pcv2抗体产生,其中灭活苗免疫组的抗体水平显著高于cph组;首次免疫5周后,两个免疫组的抗体水平继续升高,差异任然存在。
2.5.2中和抗体检测
为了鉴定疫苗的免疫效果,测定二免后血清中和抗体效价。
此外,还测定了首次免疫5周后的血清中和抗体效价,结果如图14所示,cph组平均血清中和抗体效价达到了1:102,而pcv2灭活苗组也达到了1:90,两者没有显著性差异。上述结果表明两种疫苗都能诱导机体产生一定水平的中和抗体,对机体产生保护作用。
2.5.3攻毒后仔猪临床表现及体温变化
首次免疫5周后,对两个免疫组和攻毒对照组进行攻毒,每天测量体温,连续三周,统计结果见图15。在相同时间点,各个组的体温没有明显的差异,也没有出现发热的现象(大于40℃)。但是从临床表现来看,攻毒组有两头猪出现消瘦、被毛粗乱和精神沉郁的现象,其中一头在攻毒后26天死亡。两个免疫组和空白对照组则表现正常,没有明显的临床症状。
2.5.4攻毒后仔猪体重的变化
攻毒前和剖杀前,称量每一头猪的体重,计算相对日增重,以此评价疫苗的免疫保护效果。具体结果见图16,免疫组的相对日增重分别达到了0.0137和0.0135,而攻毒组只有0.009,说明在攻毒之后两种疫苗都对仔猪产生了免疫保护作用,促进了仔猪的生长。
2.5.5病理变化观察
试验结束后,剖杀所有猪,观察淋巴结和肺脏的病变情况。空白对照组和cph组的肺脏正常,攻毒对照组的肺脏出现间质增宽、出血和实变的现象,ipcv2组也有轻微的症状。除了攻毒组的淋巴结出现水肿外,免疫组和空白组都正常。
完成组织切片后,进行病理学观察,结果如图17所示。与免疫组相比,攻毒组出现了明显的间质性肺炎的症状,主要表现为肺泡壁增厚、间质增宽和肺泡缩小(图17中a3),cph组和ipcv2组则较为正常或者只有轻微的症状。攻毒组淋巴结的淋巴滤泡边界模糊,淋巴细胞缺失(图17中b3),免疫组则基本正常。
上述病理观察结果表明,cph疫苗和灭活苗类似,能够减轻由pcv2感染导致的肺脏和淋巴结病变。
2.2.6免疫组化
采用pcv2单克隆抗体对淋巴结组织进行免疫组化检测,检测结果见图18。攻毒组淋巴组织中存在较多的棕黄色细胞,而免疫组则没有特异性的着色细胞,表明cph和ipcv2能够在很大程度上减轻pcv2在淋巴结中的增殖,从而对免疫猪提供保护作用。
本研究用杆状病毒表达pcv2cap蛋白,经鉴定可以形成vlps,以此制备疫苗并免疫小鼠和仔猪,评价其应用前景。小鼠首免2周后即可检测到pcv2特异的elisa抗体,首免4周后抗体达到了较高水平,首免6周后抗体水平继续攀升。中和抗体的产生规律与elisa抗体类似,在首免4周和6周后,均能检测到高水平的中和抗体的存在。这表明制备的疫苗具有良好的抗原性,能够刺激小鼠产生高水平的体液免疫应答。在细胞免疫应答方面,结果与体液免疫有相同的趋势,与对照组存在差异。
仔猪免疫保护实验进一步验证了该亚单位疫苗的效果。首免3周后即可检测到elisa抗体,2免2周后抗体水平进一步升高,与此同时,中和抗体水平达到了1:102,高于ipcv2组的1:90。攻毒实验结果表明,亚单位疫苗和灭活苗都能为攻毒仔猪提供免疫保护。
综上所述,本研究经过pcv2cap蛋白抗原分子设计,成功构建了高效分泌表达的重组杆状病毒。制备的pcv2cap蛋白亚单位疫苗可以诱导机体产生pcv2特异性的elisa抗体和中和抗体,对pcv2攻毒产生保护作用,比传统的灭活苗更加优异,显示出良好的开发应用前景,从而为国内pcv2新型疫苗的研究奠定了基础。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
<110>江苏南农高科技股份有限公司
<120>人工改造的pcv2cap蛋白、重组病毒及其应用
<160>16
<210>1
<211>723
<212>dna
<213>猪圆环病毒(porcinecircovirus)
<400>1
ggatccacgatgatgacctacccccgccgccgcttccgccgccgccgccaccgcccccgc60
agccacctgggccagatcctgcgccgccgcccctggctggtgcacccccgccaccgctac120
cgctggcgccgcaagaacggcatcttcaacacccgcctgagccgcaccatcggctacacc180
gtgaagaagaccaccgtgcgcacccccagctggaacgtggacatgatgcgcttcaacatc240
aacgacttcctgccccccggcggcggcagcaaccccctgaccgtgcccttcgagtactac300
cgcatccgcaaggtgaaggtggagttctggccctgcagccccatcacccagggcgaccgc360
ggcgtgggcagcaccgccgtgatcctggacgacaacttcgtgaccaaggccaacgccctg420
acctacgacccctacgtgaactacagcagccgccacaccatcacccagcccttcagctac480
cacagccgctacttcacccccaagcccgtgctggaccgcaccatcgactacttgcagccc540
aacaacaagcgcaaccagctgtggctgcgcctgcagaccaccggcaacgtggaccacgtg600
ggcctgggcaccgccttcgagaacagcatctacgaccaggactacaacatccgcatcacc660
atgtacgtgcagttccgcgagttcaacctgaaggacccccccctgaaccccaagtgactc720
gag723
<210>2
<211>723
<212>dna
<213>prt
<400>2
ctcgagatcacaatgacctacccccgccgccgcttccgccgccgccgccaccgcccccgc60
agccacctgggccagatcctgcgccgccgcccctggctggtgcacccccgccaccgctac120
cgctggcgccgcaagaacggcatcttcaacacccgcctgagccgcaccatcggctacacc180
gtgaagaagaccaccgtgcgcacccccagctggaacgtggacatgatgcgcttcaacatc240
aacgacttcctgccccccggcggcggcagcaaccccctgaccgtgcccttcgagtactac300
cgcatccgcaaggtgaaggtggagttctggccctgcagccccatcacccagggcgaccgc360
ggcgtgggcagcaccgccgtgatcctggacgacaacttcgtgaccaaggccaacgccctg420
acctacgacccctacgtgaactacagcagccgccacaccatcacccagcccttcagctac480
cacagccgctacttcacccccaagcccgtgctggaccgcaccatcgactacttgcagccc540
aacaacaagcgcaaccagctgtggctgcgcctgcagaccaccggcaacgtggaccacgtg600
ggcctgggcaccgccttcgagaacagcatctacgaccaggactacaacatccgcatcacc660
atgtacgtgcagttccgcgagttcaacctgaaggacccccccctgaaccccaagtgaggt720
acc723
<210>3
<211>723
<212>dna
<213>prt
<400>3
ctcgagatcacaatggcctacccccgccgccgcttccgccgccgccgccaccgcccccgc60
agccacctgggccagatcctgcgccgccgcccctggctggtgcacccccgccaccgctac120
cgctggcgccgcaagaacggcatcttcaacacccgcctgagccgcaccatcggctacacc180
gtgaagaagaccaccgtgcgcacccccagctggaacgtggacatgatgcgcttcaacatc240
aacgacttcctgccccccggcggcggcagcaaccccctgaccgtgcccttcgagtactac300
cgcatccgcaaggtgaaggtggagttctggccctgcagccccatcacccagggcgaccgc360
ggcgtgggcagcaccgccgtgatcctggacgacaacttcgtgaccaaggccaacgccctg420
acctacgacccctacgtgaactacagcagccgccacaccatcacccagcccttcagctac480
cacagccgctacttcacccccaagcccgtgctggaccgcaccatcgactacttgcagccc540
aacaacaagcgcaaccagctgtggctgcgcctgcagaccaccggcaacgtggaccacgtg600
ggcctgggcaccgccttcgagaacagcatctacgaccaggactacaacatccgcatcacc660
atgtacgtgcagttccgcgagttcaacctgaaggacccccccctgaaccccaagtgaggt720
acc723
<210>4
<211>30
<212>dna
<213>人工合成
<400>4
attggatccacgaccatggcctaccctcgc30
<210>5
<211>17
<212>dna
<213>人工合成
<400>5
cgcgctcgagtcacttg17
<210>6
<211>27
<212>dna
<213>人工合成
<400>6
cgctcgagatcaaaatgacctaccccc27
<210>7
<211>23
<212>dna
<213>人工合成
<400>7
agggtacctcacttggggttcag23
<210>8
<211>27
<212>dna
<213>人工合成
<400>8
cgctcgagatcaaaatggcctaccccc27
<210>9
<211>23
<212>dna
<213>人工合成
<400>9
agggtacctcacttggggttcag23
<210>10
<211>55
<212>dna
<213>人工合成
<400>10
cttgtttttatggtcgtatacatttcttacatctatgccaacggcatcttcaaca55
<210>11
<211>54
<212>dna
<213>人工合成
<400>11
gcctcgagacgaccatgaaattcttagtcaacgttgcccttgtttttatggtcg54
<210>12
<211>27
<212>dna
<213>人工合成
<400>12
atttggtacctcacttggggttcaggg27
<210>13
<211>26
<212>dna
<213>人工合成
<400>13
gcgaattcatgggcatcttcaacacc26
<210>14
<211>22
<212>dna
<213>人工合成
<400>14
cgaagctttcacttggggttca22
<210>15
<211>24
<212>dna
<213>人工合成
<400>15
ggatccgaattcatggcctacccc24
<210>16
<211>22
<212>dna
<213>人工合成
<400>16
cgaagctttcacttggggttca22
- 还没有人留言评论。精彩留言会获得点赞!
- 用于检测EB病毒Rta/IgG抗体的化学发光试剂盒及其应用
- 表达猪传染性胃肠炎病毒s蛋白a位点的重组猪痘病毒载体疫苗的制作方法
- 一种口蹄疫病毒2c3abc重组蛋白及其制备方法和应用
- 抗草鱼出血病病毒工程蛋白tat-vp7-tat及制备方法和应用
- 一种重组猪流行性腹泻病毒n蛋白及其制备方法
- 表达西尼罗热病毒PrM/E蛋白的重组新城疫LaSota疫苗株的制作方法
- 一种抗乙型肝炎病毒x蛋白抗体酶联免疫测定试剂盒及其制备方法
- 蓝舌病病毒ns2蛋白单克隆抗体btv-4d4及其识别的b细胞表位和应用的制作方法
- 一种检测黄热病毒抗体的重组抗原蛋白、试剂盒及其应用的制作方法
- 一种同步检测十二种病原抗体的蛋白悬浮芯片系统的制作方法