一种氯吡脲人工抗原和多克隆抗体的制备方法与应用与流程
本发明涉及一种氯吡脲人工抗原和多克隆抗体的制备方法与应用,属于植物生长调节剂小分子化合物免疫化学和食品安全分析领域。
背景技术:
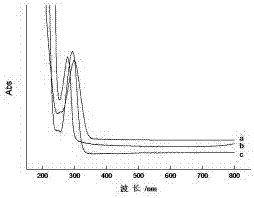
:氯吡脲是一种高活性的植物生长调节剂,具有加速细胞有丝分裂、促进细胞的增大和分化、防止落花落果、促进果实膨大等作用,常用于脐橙、柑桔、猕猴桃、葡萄、西瓜、黄瓜等果蔬的农业生产中。残留于果蔬中的氯吡脲可能会对人类及其他生物造成潜在的威胁,美国环保署在《农药毒性确认和管理》中指出,长期接触氯吡脲会引起体内蛋白质代谢的紊乱,造成肺气肿和体型消瘦。各国制定对食品中氯吡脲的最大残留限量不同,范围为0.01~0.1mg/kg,如澳大利亚规定猕猴桃中氯吡脲的最大残留限量为0.01mg/kg,美国为0.04mg/kg,欧盟为0.05mg/kg,日本为0.1mg/kg。我国食品安全国家标准gb2763-2014(食品中农药最大残留限量)规定食品中氯吡脲最大残留限量为黄瓜、西瓜、甜瓜≤0.1mg/kg,猕猴桃、葡萄、橙、枇杷≤0.05mg/kg。氯吡脲残留检测目前主要采用液相色谱法、气相色谱法或质谱分析方法等技术,存在检测成本高、周期长及操作繁琐复杂等问题,不适合大规模现场筛查,因此迫切要求发展简便、灵敏、特异性强、成本低廉的快速检测技术。技术实现要素:本发明的目的是提供一种氯吡脲人工抗原和多克隆抗体的制备方法,及提供抗氯吡脲多克隆抗体在检测氯吡脲中的应用。一种氯吡脲人工抗原和多克隆抗体的制备方法,是通过以下技术实现的:(1)氯吡脲半抗原的合成:在无水三氯化铝的催化作用下,氯吡脲与丁二酸酐发生傅克反应,在氯吡脲的苯环上引入活性基团羧基和连接臂,得到半抗原,即氯吡脲半抗原;(2)氯吡脲全抗原的合成:采用碳二亚酰法将氯吡脲半抗原与牛血清蛋白进行偶联,得到免疫全抗原;(3)多克隆抗体的制备:用合成的全抗原免疫动物,取血,离心得到抗血清,即为氯吡脲多克隆抗体。所述的动物优选为新西兰大白兔,利用上述方法制备的兔多克隆抗体一种氯吡脲人工抗原和多克隆抗体的制备方法,具体的步骤如下:1、氯吡脲半抗原的合成采用无水二甲基甲酰胺(dmf)做溶剂,氯吡脲(2.48g)、丁二酸酐(1g)、无水三氯化铝(6.68g)按1:1:5的摩尔比进行投料。将dmf(2ml)逐滴加入到装有无水三氯化铝的烧瓶中,不断搅拌使其充分溶解,待瓶口不再有白雾冒出时放入油浴(200℃)中。把氯吡脲和丁二酸酐的混合物加入到烧瓶中,反应2h后,把反应液慢慢倒入90ml冰水中,加6ml浓度为12mol/l的浓盐酸,冷却静置后过滤水洗,得到粗品,再用dmf/甲醇对粗品进行重结晶纯化,得到淡粉色固体物质,即为氯吡脲半抗原(cppu-cooh);2、氯吡脲免疫抗原的合成准确称取cppu-cooh3.48mg溶于200μldmf中,加入n-羟基琥珀酰亚胺(nhs)1.38mg(另溶于200μldmf),再加入2.88mg溶解好的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)(另溶于300μldmf),室温下振荡反应12h,得到溶液1;称取6.8mgbsa溶于2ml1×pbs中,得到溶液2。再将溶液1逐滴加入溶液2中,边加边振荡,冰浴振荡反应12h。反应混合物移入处理好的透析袋中,用超纯水透析3d,每天换3次透析液,即得到氯吡脲免疫抗原(cppu-bsa),-20℃保存备用;3、氯吡脲检测抗原的制备称取cppu-cooh3.48mg溶于200μldmf中,加入nhs3.45mg(溶于200μldmf),再直接加入2.88mgedc(另溶于300μldmf),室温振荡反应12h,得到溶液3;称取4.5mg卵清蛋白(ova)溶于1.8ml1×pbs中,得到溶液4。将溶液3与溶液4混匀后,冰浴振荡反应12h。反应混合物移入处理好的透析袋中,用超纯水透析3d,每天换3次透析液,即得到氯吡脲检测抗原(cppu-ova),-20℃保存备用;4、抗氯吡脲多克隆抗体的制备用得到的氯吡脲免疫抗原对体重为1.5~2.5kg的新西兰大白兔进行免疫,每次免疫剂量均为200-300μg/只,第一次免疫采用弗氏完全佐剂与等体积的免疫抗原混合后乳化,皮下注射8~10个部位,之后每间隔3周加强免疫一次,加强免疫采用弗氏不完全佐剂与等体积抗原乳化后背部皮下免疫5个点外,增加注射两个肌肉位点,从第3次加强免疫开始,在免疫后的第七天耳缘静脉取血,检测抗血清的效价和特异性,当抗体的效价和特异性达到要求后,颈动脉采血,离心后获得抗血清,-20℃保存。本发明所述的抗氯吡脲多克隆抗体在检测氯吡脲中的应用,其使用方法为间接竞争酶联免疫法,它所使用的试剂包括酶联免疫的常规试剂、酶标板和氯吡脲多克隆抗体。所述的酶标板是将氯吡脲半抗原与卵清蛋白通过碳二亚酰法偶联,将此偶联物作为包被原吸附于固相载体中而形成的。然后在酶标板上加入氯吡脲样品溶液和抗氯吡脲多克隆抗体工作液,样品中的氯吡脲就会与固相载体中的包被原竞争吸附有限的抗体。通过洗涤,将结合了样品中游离的氯吡脲的抗氯吡脲多克隆抗体洗去,再使用酶标二抗标记已经与包被原结合的抗体,显色后,测定吸光光度值,该值与样品中氯吡脲的含量呈负相关,与标准曲线比较即可得出氯吡脲的含量,应用本方法可以快速、灵敏、简便地检测样品中的氯吡脲残留,适用于大量样品的快速筛查。因此本发明的间接竞争酶联免疫方法具有使用方便和成本低廉的优点。应用抗氯吡脲多克隆抗体检测脐橙中氯吡脲残留量的间接竞争酶联免疫方法具体如下:1、样品前处理称取10g已匀浆好的脐橙样品于50ml离心管中,再加入1g氯化钠固体,20ml乙腈,涡旋震荡两分钟,将离心管置于冷水浴中冷却,缓慢加入6g无水硫酸镁,用玻璃棒充分混匀搅拌,涡旋震荡,于4000r/min离心5min。移取2ml上清液于15ml离心管中,再加入100mgn-丙基乙二胺(psa),100mgc18,30mg活性炭和100mg无水硫酸镁,涡旋震荡2分钟,于4000r/min离心5min,准确移取1ml上清液于10ml离心管中,氮气吹干。用含10%甲醇1×pbs(ph=6)缓冲溶液定容至1ml,即可进行酶联免疫测定;2、间接竞争酶联免疫法采用方正滴定法优化了检测抗原的最佳包被浓度,同时对elisa条件中的氯吡脲标准溶液中有机溶剂浓度、抗血清稀释液的离子强度和ph值进行了优化,确定了最佳工作条件,具体如下:(1)抗原包被:用1×pbs稀释检测抗原到浓度为2ug/ml,按照100μl/孔加入到96孔酶标板孔中,做好标记,4℃湿盒过夜,(2)封闭:倾去反应液,pbst洗涤液洗涤三次,取封闭液(1×pbs含5%脱脂奶粉)以150μl/孔加入酶标板孔,37℃湿盒孵育1.5小时,(3)一抗反应:倾去封闭液,用pbst洗涤液洗涤三次,在每孔中先加入50μl1×pbs缓冲液,再加入50μl氯吡脲标准溶液或样品溶液,然后加入50μl1:80000稀释的抗氯吡脲多克隆抗体工作液,稀释液为10×pbs缓冲液,ph=6.0,同时设置空白对照为pbs,37℃保湿温育45min;(4)二抗反应:倾去反应液,pbst洗涤液洗涤三次,每孔加入200μl的1:10000的hrp-羊抗兔igg二抗,37℃湿盒孵育1小时,(5)底物显色反应:倾去反应液,pbst洗涤液洗涤三次,每孔加入tmb底物显色液150μl,室温反应20分钟。(6)终止反应:往酶标板孔中加入终止液(2nh2so4),50μl/孔,(7)测定:把酶标板正确放置在酶标仪上,检测每孔在450nm处吸光值od450nm值。本发明的有益效果是:利用本发明的间接竞争酶联免疫方法检测脐橙中的氯吡脲残留,具有灵敏度高、特异性强、操作简单、对仪器设备要求低、成本低、无放射性同位素污染等优点,有效填补水果中氯吡脲残留的快速检测方法的空白,在日常食品安全快速检测领域里能够发挥重要作用。附图说明图1:氯吡脲半抗原的一级和二级质谱图a.esi+;b.esi-;c.esi+-ms2;d.esi--ms2。图2:氯吡脲的核磁共振图谱。图3:氯吡脲半抗原的核磁共振图谱。图4:人工免疫抗原紫外扫描光谱图a.cppu-bsa;b.cppu-cooh;c.bsa。图5:人工包被抗原紫外扫描光谱图a.cppu-ova;b.cppu-cooh;c.ova。图6:载体蛋白和人工抗原的质谱图a.bsa;b.ova;c.cppu-bsa;d.cppu-ova。图7:氯吡脲的间接竞争elisa标准抑制曲线。具体实施方式实施例:一种氯吡脲人工抗原和多克隆抗体的制备方法,具体的步骤如下:(一)氯吡脲半抗原的合成采用无水二甲基甲酰胺(dmf)做溶剂,氯吡脲(2.48g)、丁二酸酐(1g)、无水三氯化铝(6.68g)按1:1:5的摩尔比进行投料。将dmf(2ml)逐滴加入到装有无水三氯化铝的烧瓶中,不断搅拌使其充分溶解,待瓶口不再有白雾冒出时放入油浴(200℃)中。把氯吡脲和丁二酸酐的混合物加入到烧瓶中,反应2h后,把反应液慢慢倒入90ml冰水中,加6ml浓度为12mol/l的浓盐酸,冷却静置后过滤水洗,得到粗品,再用dmf/甲醇对粗品进行重结晶纯化,得到淡粉色固体物质,即为氯吡脲半抗原(cppu-cooh);2、氯吡脲免疫抗原的合成准确称取cppu-cooh3.48mg溶于200μldmf中,加入n-羟基琥珀酰亚胺(nhs)1.38mg(另溶于200μldmf),再加入2.88mg溶解好的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)(另溶于300μldmf),室温下振荡反应12h,得到溶液1;称取6.8mgbsa溶于2ml1×pbs中,得到溶液2。再将溶液1逐滴加入溶液2中,边加边振荡,冰浴振荡反应12h。反应混合物移入处理好的透析袋中,用超纯水透析3d,每天换3次透析液,即得到氯吡脲免疫抗原(cppu-bsa),-20℃保存备用;3、氯吡脲检测抗原的制备称取cppu-cooh3.48mg溶于200μldmf中,加入nhs3.45mg(溶于200μldmf),再直接加入2.88mgedc(另溶于300μldmf),室温振荡反应12h,得到溶液3;称取4.5mg卵清蛋白(ova)溶于1.8ml1×pbs中,得到溶液4。将溶液3与溶液4混匀后,冰浴振荡反应12h。反应混合物移入处理好的透析袋中,用超纯水透析3d,每天换3次透析液,即得到氯吡脲检测抗原(cppu-ova),-20℃保存备用;4、抗氯吡脲多克隆抗体的制备用得到的氯吡脲免疫抗原对体重为2.0kg的新西兰大白兔进行免疫,每次免疫剂量均为250μg/只,第一次免疫采用弗氏完全佐剂与等体积的免疫抗原混合后乳化,皮下注射9个部位,之后每间隔3周加强免疫一次,加强免疫采用弗氏不完全佐剂与等体积抗原乳化后背部皮下免疫5个点外,增加注射两个肌肉位点,从第3次加强免疫开始,在免疫后的第七天耳缘静脉取血,检测抗血清的效价和特异性,当抗体的效价和特异性达到要求后,颈动脉采血,离心后获得抗血清,-20℃保存。(二)应用抗氯吡脲多克隆抗体检测脐橙中氯吡脲残留量的间接竞争酶联免疫方法具体步骤如下:1、样品前处理:称取10g已匀浆好的脐橙样品于50ml离心管中,再加入1g氯化钠固体,20ml乙腈,涡旋震荡两分钟,将离心管置于冷水浴中冷却,缓慢加入6g无水硫酸镁,用玻璃棒充分混匀搅拌,涡旋震荡,于4000r/min离心5min。移取2ml上清液于15ml离心管中,再加入100mgn-丙基乙二胺(psa),100mgc18,30mg活性炭和100mg无水硫酸镁,涡旋震荡2分钟,于4000r/min离心5min,准确移取1ml上清液于10ml离心管中。氮气吹干。用含10%甲醇1×pbs(ph=6)缓冲溶液定容至1ml,进行酶联免疫测定;2、间接竞争酶联免疫法:采用方正滴定法测定了检测抗原的最佳包被浓度(见表1),同时对elisa条件中的氯吡脲标准溶液中有机溶剂用量、抗血清稀释液的离子强度和ph值进行了实验(见表2),确定工作条件,具体如下:(1)取96孔酶标板,每孔加入2.0μg/ml检测抗原cppu-ova(pbs稀释)100μl,4℃湿盒过夜;(2)倾去包被液,pbst洗板三次,取封闭液(1×pbs含5%脱脂奶粉)以150μl/孔加入酶标板孔,37℃湿盒孵育1.5小时;(3)倾去封闭液,pbst洗涤液洗涤三次,在每孔中首先加入50μlpbs缓冲液,再加入50μl1:80000稀释的抗氯吡脲多克隆抗体工作液,稀释液为10×pbs缓冲液,ph=6.0,设置空白对照(pbs),37℃保湿封闭45min;(4)倾去反应液,pbst洗板三次,每孔加入100μl1:1000稀释的羊抗兔igg-hrp,37℃保湿30min。(5)倾去反应液,pbst洗涤液洗涤三次,每孔加入150μl新鲜配制的tmb底物显色液,室温反应20分钟。(6)每孔加入50μl终止液(2mol/lh2so4)终止反应,轻轻摇匀,用酶标仪检测每孔在波长450nm处od450nm值。其中:氯吡脲标准溶液(溶解在含10%甲醇的1×pbs缓冲溶液中)10×pbs(0.1m,ph7.4):nacl80g,kh2po42g,na2hpo4·12h2o29g,kcl2g,蒸馏水定容至1000ml。1×pbs(10×pbs稀释十倍配制)。pbst:1×pbs1l,tween-200.5ml,混匀后使用(现配现用)。终止液(2mol/lh2so4):取20ml浓硫酸(质量分数为98%),加入160ml蒸馏水中。表1方正滴定法确定检测抗原(cppu-ova)最佳工作浓度。表2有机溶剂用量,离子强度和ph对elisa灵敏度的影响。影响因素ic50(ng/ml)线性相关系数(r2)甲醇含量(%)5380.87210530.95820650.96930850.955离子强度(以1×pbs的浓度倍数计)1810.9873760.9796720.9788670.98110560.989ph值41130.8685920.9146480.98917580.95181230.927试验例1:抗氯吡脲间接竞争elisa标准曲线实验:氯吡脲标准溶液的配置:将氯吡脲标准品溶于含10%甲醇的1×pbs缓冲溶液中,配成浓度分别为5000、1000、500、250、100、50、25、10、5、1、0ng/ml的氯吡脲标准溶液,在含有包被原的酶标板的小孔中分别加入上述氯吡脲标准溶液50μl,再分别加入抗氯吡脲多克隆抗体工作液50μl,37℃湿盒孵育45min,用洗涤液洗板,再用吸水纸吸干。在酶标板的小孔中加入酶标二抗溶液100μl,37℃保湿30min,用洗涤液洗涤,拍干。加入tmb底物显色液150μl于酶标板的小孔中,室温反应20min,加入终止液50μl,轻轻震荡摇匀,然后用酶标仪检测每孔在波长450nm下的吸光值(od450nm),每个浓度重复测定3次。检测结果分析过程为:用所获得的每个浓度的标准溶液的吸光平均值(b)除以不含氯吡脲的溶液(0标准)的吸光光度值(b0)再乘以100%,即抗体与抗原的结合率,计算公式为:抗原与抗体的结合率(%)=(b/b0)×100%式中b为氯吡脲标准溶液的平均吸光光度值,b0为氯吡脲浓度为0ng/ml标准溶液的平均吸光光度值。以氯吡脲标准品溶液的浓度值为x轴,结合率为y轴,作标准曲线,如图7所示,其回归方程为y=-10.30in(c)+89.87(r2=0.9891),ic50为48ng/ml,检测范围(ic20–ic80)为2.6-880ng/ml,最低检出限(ic10)为1ng/ml用同样的方法测得样品溶液的结合率,从回归方程中计算出样品中氯吡脲的含量。试验例2:准确度和精密度实验取不同浓度的氯吡脲标准溶液添加到脐橙样品中,对样品进行加标回收实验,每个浓度做6个平行,计算平均回收率和相对标准偏差,结果见表3。表3样本中加标回收率(n=6)由表可见,脐橙样品中的平均回收率在97.7%~110.9%,相对标准偏差均低于5%,说明本方法具有良好的准确度和精密度。实验例3:抗体特异性实验选择与氯吡脲结构相似的敌草隆、利谷隆、绿麦隆、毒莠定、二氯吡啶酸,配制成不同浓度的标准溶液系列,替代氯吡脲标准溶液,测定其标准曲线,并计算ic50抑制浓度,得出交叉反应率(cr(%)),结果见表4。cr(%)=(ic50时氯吡脲的浓度/ic50时类似物的浓度)×100%表4氯吡脲及其类似物的交叉反应结果表明,抗氯吡脲多克隆抗体与其他类似物几乎不会结合,交叉反应率均很小。说明该抗体对氯吡脲具有很高的特异性。利用本发明的间接竞争酶联免疫方法检测脐橙中的氯吡脲残留,具有灵敏度高、特异性强、操作简单、对仪器设备要求低、成本低、无放射性同位素污染等优点,有效填补水果中氯吡脲残留的快速检测方法的空白,在日常食品安全快速检测领域里能够发挥重要作用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1