一种成体人肝源性干细胞系HN及其制备方法和应用与流程
本发明涉及一种成体人肝源性干细胞系,属于医学生物技术领域。
背景技术:
肝脏疾病是人类健康的巨大威胁,特别是肝炎病毒导致的肝炎、肝硬化及肝癌在我国尤为严重,随之而来的肝衰竭是最常见的致死病因。原位肝移植被认为是治疗终末期肝病的唯一有效方法,但是由于肝脏来源缺乏等原因,临床应用受到很大的限制。
肝细胞移植是治疗肝脏相关疾病,如急性肝衰竭、遗传代谢性肝病以及病毒等导致的慢性肝衰竭疾病等的一个很好的替代方案。由于肝细胞异体排异问题,肝细胞体外大量扩培养技术以及冻存的肝细胞复苏后存活率较低等难题尚未得到有效的解决,肝细胞移植的应用受到极大限制。因此,寻找一种新的可替代的手段治疗各种肝脏疾病及其导致的肝功能衰竭,成为一种迫切的需求。
肝干细胞(hepaticstemcells,hscs)是指具有干细胞特点,并能增殖、分化成为肝细胞和胆管细胞的参与肝脏结构和功能重建一类细胞,体外可以大量扩增培养和冷冻并储存于细胞库,移植后肝干细胞在体内可转化为成熟肝细胞以保持肝脏结构和功能正常。肝干细胞根据其起源不同,可分为肝源性hsc和非肝源性hsc。非肝源性肝干细胞起源于肝脏以外组织,需要体外诱导成为有肝细胞功能的细胞,而肝源性干细胞起源于肝脏胆小管树的小胆管和赫令管,在肝脏环境中形成,具有分化为肝实质细胞和胆管上皮细胞的能力,包括肝卵圆细胞和小肝细胞等。基础研究和临床应用已表明,肝干细胞是替代肝细胞治疗的最好细胞。随着研究的深入和扩展,取得了一些突破性的进展。这为医学上治疗多种疾病打开了一扇崭新的大门,为生命开拓了新的契机。
肝源性干细胞的应用前景:肝源性干细胞具有极其诱人的临床应用价值,主要包括:1)体外培养肝源性干细胞为细胞移植和生物人工肝提供了一种新的细胞来源;2)其强大的增殖能力及多源性的生物学特点为解决用于移植肝细胞的增殖困难及供体缺乏提供了新思路;3)利用其可向肝细胞转化的潜力启动肝再生,以治疗各种原因所致的急性、亚急性肝坏死,即临床肝衰竭;4)可以作为终末期肝病与肝移植之间的桥梁;5)肝细胞移植或者以肝细胞移植为载体的基因治疗,有可能持续纠正遗传代谢性肝相关疾病患者的代谢紊乱;6)肝源性干细胞对肝癌发生发展有免疫调节作用,我们的研究表明肝源性干细胞明显抑制hepg2,hep3b和huh7等肝癌细胞株的增殖,具有抗肿瘤作用。7)另外,hn对酒精性脂肪肝具有显著的防治作用。
技术实现要素:
本发明所要解决的第一个技术问题是提供一种特性稳定、成分均一的成体人肝脏干细胞系hn,它能够表达肝脏前体细胞的标志物;并在体外条件下连续传代培养48代且持续表达肝脏前体细胞标志物。
本发明要解决的第二个技术问题是提供一种成体人肝源性干细胞系的制备方法。
本发明要解决的第三个技术问题是提供所述成体人肝源性干细胞系hn在体内外定向诱导肝细胞中的应用,以及在制备生物人工肝中的应用。而且该细胞系还可以用于治疗肝脏遗传代谢性疾病、酒精性脂肪肝和肝纤维化或肝硬化疾病的研究。
为解决上述技术问题,本发明采用以下技术方案:
本发明所述的成体人肝源性干细胞系hn经鉴定确定为人肝脏干细胞,定名为hn,保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是北京市朝阳区北辰西路1号院3号,保藏日期为2017年5月15日,保藏号为cgmccno.13844。该干细胞系hn在体内外可定向诱导分化为肝细胞、肝胆管上皮细胞为其特征。
所述的成体人肝源性干细胞系hn具有以下生物学特性:
(1)细胞呈典型的上皮细胞形态,连续传代培养48代仍保持该形态特点;
(2)细胞具有较强的增殖能力,但生长存在接触抑制和密度抑制现象,连续传代培养48代仍保持该增殖和生长特性;
(3)细胞表达肝脏前体细胞标志物:通过rt-pcr方法证实,细胞表达肝脏前体细胞标志物:白蛋白(alb)、细胞角蛋白19(ck19)、细胞角蛋白7(ck7)、细胞角蛋白8(ck8)。连续传代培养48代仍表达肝脏前体细胞标志物。
(4)细胞具有多向分化潜能。当细胞处于不同培养环境下,具有向相应细胞分化的潜能;同时无致瘤性。
为解决上述第二个技术问题,本发明提供一种成体人肝源性干细胞系的制备方法,该方法包括以下步骤:
(1)取肝血管瘤患者切下来的瘤旁正常肝组织;
(2)在无菌条件下行门静脉插管,并进行原位灌流以去除血细胞;
(3)用0.05%胶原酶溶液循环灌注以离散肝组织;
(4)将步骤(3)灌流后的肝组织置于120目铜网上剪碎组织并研磨以获得单细胞悬液;
(5)收集步骤(4)的单细胞悬液并于4℃条件下1500rpm离心5分钟以得到细胞沉淀;
(6)将步骤(5)的细胞沉淀重悬于蛋白酶e溶液中在37℃条件下孵育60分钟以去除肝细胞;
(7)向步骤(6)去除肝细胞悬液中加入等体积的含10%胎牛血清的dmem培养基,混合均匀后经孔径40μm尼龙膜过滤;
(8)将步骤(7)滤液上样至浓度为1.35g/ml和1.70g/mlpercoll不连续密度梯度介质上,在4℃条件下2000rpm离心20分钟;
(9)收集两层密度梯度介质间的细胞,用含10%胎牛血清的dmem培养基洗3次,于4℃条件下1500rpm离心5分钟,弃去上清液;
(10)将步骤(9)的细胞沉淀重悬于完全培养基中,按2.5×104/cm2接种细胞悬液于胶原包被的组织培养皿中,置于37℃,5%的co2培养箱中培养;
(11)每隔1天更换1/2量的新鲜完全培养基一次;
(12)待细胞形成克隆后,应用克隆环挑取上皮克隆细胞置于新的培养瓶中继续培养,即得成体人肝脏干细胞;
(13)酸化处理:将获得的成体人肝脏干细胞的原代细胞培养至第30天进行酸化,将培养液ph值调到6.3~6.8;培养24小时或36小时后,换完全培养基继续培养;
(14)低血清筛选培养:原代细胞酸化7~10天后,每2天按1%的量减少胎牛血清,将10%胎牛血清培养液减到1%胎牛血清培养液后,继续培养直到镜下见到部分细胞增殖后,换完全培养基进行传代培养;
(15)待细胞长至90%汇合时应用胰蛋白酶溶液消化,常规传代培养。
本发明包含以下有益效果:
本发明联合应用密度梯度离心和克隆环纯化的方法获得了纯度较高的肝脏干细胞,该细胞呈典型上皮细胞形态,具有较强的增殖能力,但生长仍具有接触抑制与密度抑制现象,表达的肝脏前体细胞标志物:白蛋白(alb)和细胞角蛋白19(ck19)、细胞角蛋白7(ck7)、细胞角蛋白8(ck8);细胞连续传代培养12个月已传至48代,仍然保持上述形态特点、生长和增殖特性,标志物表达以及分化潜能,不同于培养的成熟肝细胞既难于体外大量扩增且细胞功能逐渐丧失的特点,因此,该细胞是一种特性稳定、成分均一的成体人肝脏干细胞,是良好的肝脏干细胞研究模型。
附图说明
图1为相差显微镜下人肝脏干细胞的形态图;
a:分离培养的细胞长到12天时出现干细胞克隆;b:单细胞克隆后的第10代人肝脏干细胞;c:第48代人肝脏干细胞;
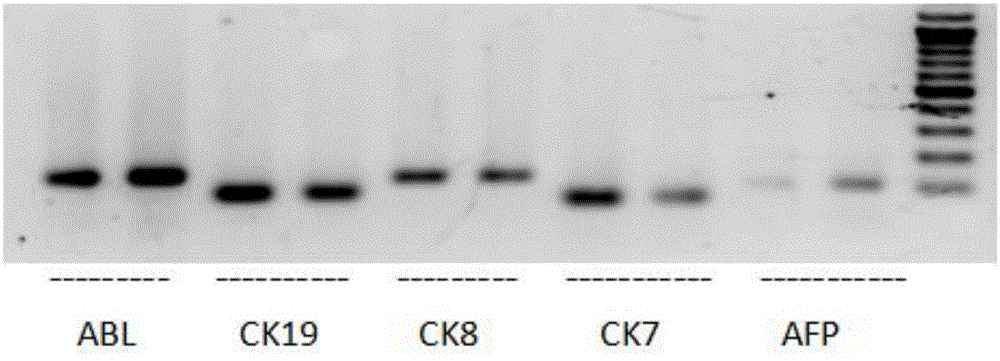
图2为rt-pcr分析人肝脏干细胞标志物的表达图;
图3为诱导分化前成体人肝脏干细胞糖原染色结果图;
图4为诱导分化后成体人肝脏干细胞糖原染色结果图;
图5为诱导分化前成体人肝脏干细胞靛青绿实验结果图;
图6为诱导分化后成体人肝脏干细胞靛青绿实验结果图;
图7为诱导分化后成体人肝脏干细胞白蛋白(alb)和细胞角蛋白19(ck19)的表达图;
图8为人肝脏干细胞移植至肝脏2月后解剖,行肝脏脾脏he染色图;
图9为人肝脏干细胞移植至脾脏2月后解剖,行肝脏脾脏he染色图。
具体实施方式
下面结合附图和实施例对本发明进一步说明。
实施例1:人肝脏干细胞分离、原代培养
一、实验材料和试剂
1.组织来源:取肝血管瘤患者切下来的瘤旁“正常肝组织”。
2.灌流缓冲液:含20mmhepes的d-hank’s平衡盐溶液。
3.循环缓冲液:含0.1%胶原酶(sigma-adlrich)的hank’s平衡盐溶液。
4.酶缓冲液:含0.05%胶原酶(sigma-adlrich)、0.025%胰蛋白酶(sigma-adlrich)、0.02%edta、0.004%dnasei(sigma-adlrich)的pbs溶液。
5.dmem液体培养基、胎牛血清均为gibco公司产品。
6.percoll为pharmacia公司产品。
7.完全培养基:含10%胎牛血清、0.3u/ml胰岛素(sigma-adlrich)、0.3ng/ml表皮细胞生长因子(epithelialgrowthfactor,egf,peprotech)、0.2ng/ml干细胞生长因子(stemcellfactor,scf,peprotech)、100u/ml青霉素和100μg/ml链霉素的dmem培养基。
二、实验方法
1.取肝血管瘤患者切下来的瘤旁“正常肝组织”。
2.无菌条件下经门静脉断端插管,用灌流缓冲液进行灌流(40ml/min),用循环缓冲液循环灌流10-20分钟。
3.将肝组织放入120目铜网中,用剪刀将组织剪成小块,研磨组织并用循环缓冲液冲洗,收集滤液,4℃条件下1500rpm离心5分钟。
4.弃上清液,将细胞重悬于酶缓冲液中,37℃孵育60分钟。
5.加入等体积的含10%胎牛血清的dmem培养基,混合均匀后经孔径40μm尼龙膜过滤。
6.将滤液上样至1.35g/ml和1.70g/mlpercoll不连续密度梯度介质上,4℃条件下2000rpm离心20分钟。
7.收集两层密度梯度介质间的细胞,用含10%胎牛血清的dmem培养基洗3次,每次用5ml含10%胎牛血清的dmem培养基重悬细胞,于4℃条件下1,500rpm离心5分钟,弃去上清液。
8.取0.2ml细胞悬液加入0.4ml台盼蓝染液混匀,分别计数活细胞数和死细胞数,并计算活细胞占总细胞的比例。
9.将细胞重悬于完全培养基中,按2.5×104/cm2接种细胞悬液于胶原包被的组织培养皿中,置于37℃,5%co2培养箱中培养。
10.每隔1天更换1/2新鲜的完全培养基一次。
11.待细胞形成克隆后(约12~18天)(图1-a),应用克隆环挑取细胞克隆分别置于培养板(6孔)中继续培养(即得成体人肝脏干细胞)。经酸化处理和低血清筛选培养,直到镜下见到部分细胞明显增殖后,换完全培养基进行传代培养。常规传代培养每隔3-5天更换1/2新鲜的完全培养基一次,待细胞长至90%汇合时应用胰蛋白酶溶液消化并传代培养。成体人肝脏干细胞增殖迅速到第10代(图1-b)。继续传代到48代(图1-c)。
三、实验结果:
如图1所示相差显微镜下,成体人肝脏干细胞呈铺路石样细胞形态。a:分离培养的细胞长到12-18天时出现干细胞克隆;b:单细胞克隆后的第10代人肝脏干细胞;c:第48代人肝脏干细胞。
实施例2:成体人肝脏干细胞的传代培养与冻存保种
一、试剂
1.胰蛋白酶溶液:含0.25%胰蛋白酶(sigma-adlrich)、0.02%edta的pbs。
2.冻存液:含10%dmso、30%胎牛血清的dmem培养基。
二、实验方法:
1.待细胞生长至90%汇合时,弃去旧培养基,加入2mlpbs轻旋培养瓶浸洗细胞。
2.弃去pbs,再加入2mlpbs洗细胞一次。
3.弃去pbs,加入胰蛋白酶溶液使其刚好覆盖细胞,倒置相差显微镜下观察消化情况,待细胞突起回缩时迅速弃去消化液。
4.加入完全培养基2ml,以终止胰蛋白酶的作用,吸取瓶内培养基反复轻柔吹打细胞。
5.收集吹下的细胞置于15ml离心管中,混匀后取10μl细胞悬液计数。
6.其余细胞悬液于4℃条件下1,000rpm离心5分钟,弃去上清液。
7.将细胞沉淀打散,按计数结果用胚胎肝脏细胞完全培养基制备成1×106/ml细胞悬液,部分细胞按1.0×104/cm2接种于培养瓶中继续培养,部分细胞冻存保种。
8.用于冻存保种细胞于4℃条件下1,000rpm离心5分钟,弃去上清液,应用冻存液重悬细胞制备成2×106/ml细胞悬液,按每管1ml分装至1.8ml冻存管中,于冻存管上注明细胞名称、细胞数和冻存日期。
获得的人肝脏干细胞hn已于年月日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏登记编号为cgmccno.13844,建议分类命名为:成体人肝脏干细胞。
实施例3:成体人肝脏干细胞的鉴定
一、试剂
1.qiagenrneasymini提取试剂盒(德国;qiagen公司;74104)
2.abiappliedbiosytenmsrnatocdnamastermix逆转录试剂盒(美国;abi公司;4472908)
3.pcr扩增反应中各基因特异的引物序列(由上海生物工程有限公司合成)
4.dntpmix:含datp、dctp、dgtp、dttp各2mm
5.taqdna聚合酶
二、实验方法:
1.使用干细胞培养基将成体人肝脏干细胞培养于6孔板中,长至90%汇合后,以0.25%胰酶-edta消化收集细胞,加入10ml无菌pbs,1200rpm/min,室温离心8min。
2.细胞沉淀用qiagenrneasymini提取试剂盒进行总rna的提取。
3.然后取2ug的总rna,用abiappliedbiosytenmsrnatocdnamastermix逆转录试剂盒进行逆转录。
4.rt-pcr
(1)取0.5mlpcr管,依次加入下列试剂:
(2)加入适量的ddh2o,使总体积达50μl。轻轻混匀,离心。
(3)设定pcr程序。在适当的温度参数下扩增28-32个循环。为了保证实验结果的可靠与准确,pcr扩增目的基因时,加入一对内参(gapdh)的特异性引物,同时扩增内参dna,作为对照。
三、实验结果:
结果如图2所示,通过rt-pcr方法证实,细胞表达肝脏前体细胞标志物:甲胎蛋白(afp)、白蛋白(alb)、细胞角蛋白19(ck19)、细胞角蛋白7(ck7)和细胞角蛋白8(ck8)。
实施例4:诱导成体人肝脏干细胞分化为肝细胞
一、试剂:
1.诱导分化培养基:含干细胞生长因子(hgf)、表皮生长因子(egf)和dmso的完全培养基
2.完全培养基:含10%胎牛血清、0.3u/ml胰岛素(sigma-adlrich)、0.3ng/ml表皮细胞生长因子(epithelialgrowthfactor,egf,peprotech)、0.2ng/ml干细胞生长因子(stemcellfactor,scf,peprotech)、100u/ml青霉素和100μg/ml链霉素的dmem培养基。
3.无血清培养基:含100u/ml青霉素、100μg/ml链霉素的dmem培养基。
4.卡诺固定液:酒精:氯仿:冰醋酸=6:3:1。
5.过碘酸溶液:含0.5%过碘酸的h2o。
6.schiff试剂。
7.靛青绿(indocyaninegreen,icg。
8.糖原染色(aps)。
二、实验方法:
1.诱导分化:
(1)取对数生长期的成体人肝脏干细胞制备成单细胞悬液,按2.5×104/cm2接种于直径6cm培养皿中,于37℃,5%co2培养箱中培养过夜。
(2)弃去旧培养基,pbs洗细胞一次,加入诱导分化培养基,继续培养3天,以完全培养基培养细胞为对照。
2.糖原合成能力测定
(1)取诱导分化细胞和对照细胞,弃去旧培养基,pbs洗细胞三次。
(2)用卡诺固定液固定10分钟。
(3)蒸馏水洗三次。
(4)加入过碘酸溶液作用15分钟。
(5)加入schiff试剂30分钟至切片稍微变红。
(6)自来水淋洗小盖片2分钟至切片变红。
(7)用蒸馏水淋洗晾干,显微镜下观察并照相。
3.靛青绿染色。
(1)细胞去除培养基,用pbs洗三次,加入含终浓度1mg/ml靛青绿(indocyaninegreen,icg)的完全培养基。
(2)在37℃的培养箱中培养1h。
(3)弃去培养液,用pbs洗三次,最后一次pbs保留。
(4)在光镜下观察细胞颜色的变化,具有肝细胞功能的应该是胞浆呈绿色。
4.成体人肝脏干细胞白蛋白(alb)和细胞角蛋白19(ck19)的表达。
应用western比较诱导剂组和对照组alb和ck19的蛋白表达。
三、实验结果:
糖原染色结果显示,对照细胞内仅有呈淡粉色,而诱导分化后细胞内可见大量紫红色颗粒。靛青绿染色结果显示,部分细胞包浆呈绿色,靛青绿染色阳性,说明人源性肝干细胞在诱导剂的作用下转化为肝细胞(诱导剂为20ngegf+20nghgf,诱导剂为10ngegf+1%dmso)。成体人肝脏干细胞白蛋白(alb)和细胞角蛋白19(ck19)的表达结果显示,与普通完全培养基相比,成体人肝脏干细胞在诱导剂培养基中蛋白质水平表达肝细胞特异性标志abl增加,而胆管上皮细胞特异性标志ck19未表达,说明成体人肝脏干细胞在2%dmso和hgf的诱导下向肝细胞分化(图5)。
实施例5:成体人肝脏干细胞移植
一、试剂:
1.完全培养基:含10%胎牛血清、0.3u/ml胰岛素(sigma-adlrich)、0.3ng/ml表皮细胞生长因子(epithelialgrowthfactor,egf,peprotech)、0.2ng/ml干细胞生长因子(stemcellfactor,scf,peprotech)、100u/ml青霉素和100μg/ml链霉素的dmem/f12培养基。
2.无菌1×pbs缓冲液。
3.10%水合氯醛。
二、实验方法:
1.使用完全培养基将成体人肝脏干细胞培养于t175培养瓶中,长至90%汇合后,以0.25%胰酶-edta消化收集细胞,加入10ml无菌1×pbs,1200rpm/min,室温离心8min。
2.用无菌pbs重悬细胞,调整细胞浓度为1×107/ml。
3.水合氯醛麻醉小鼠,打开腹腔,暴露肝脏、脾脏,用1ml注射器向肝脏、脾脏各注射200ul干细胞悬液,关闭腹腔。
4.2月后颈椎脱臼处死小鼠,取肝脏、脾脏进行病理学检查。
三、实验结果:
he染色结果示,在肝脏脾脏内未见肿瘤形成。证实成体人肝脏干细胞移植至小鼠肝脏脾脏内,无致瘤率。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无法对所有的实施方式予以穷举。凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
序列表
<110>洪丰
<120>一种成体人肝源性干细胞系hn及其制备方法和应用
<160>12
<210>1
<211>21
<212>dna
<213>人工序列
<220>
<223>gapdh上游引物。
<400>1
ggtgaaggtcggagtcaacgg21
<210>2
<211>23
<212>dna
<213>人工序列
<220>
<223>gapdh下游引物。
<400>2
tgaaggggtcattgatggcaaca23
<210>3
<211>22
<212>dna
<213>人工序列
<220>
<223>afp上游引物。
<400>3
gcaaagctgaaaatgcagttga22
<210>4
<211>20
<212>dna
<213>人工序列
<220>
<223>afp下游引物。
<400>4
ggaaagttcgggtcccaaaa20
<210>5
<211>25
<212>dna
<213>人工序列
<220>
<223>ck7上游引物。
<400>5
tgaatgatgagatcaacttcctcag25
<210>6
<211>20
<212>dna
<213>人工序列
<220>
<223>ck7下游引物。
<400>6
tgtcggagatctgggactgc20
<210>7
<211>21
<212>dna
<213>人工序列
<220>
<223>ck8上游引物。
<400>7
tcatagacaaggtacggttcc21
<210>8
<211>21
<212>dna
<213>人工序列
<220>
<223>ck8下游引物。
<400>8
gcctaaggttgttgatgtagc21
<210>9
<211>17
<212>dna
<213>人工序列
<220>
<223>ck19上游引物。
<400>9
tcgacaacgcccgtctg17
<210>10
<211>16
<212>dna
<213>人工序列
<220>
<223>ck19下游引物。
<400>10
ccacgctcatgcgcag16
<210>11
<211>20
<212>dna
<213>人工序列
<220>
<223>alb上游引物。
<400>11
ctgagcaaaggcaatcaaca20
<210>12
<211>20
<212>dna
<213>人工序列
<220>
<223>alb下游引物。
<400>12
cacagtctgctgaggttgga20
- 还没有人留言评论。精彩留言会获得点赞!