一种原代人肾癌细胞的分离及培养方法与流程
本发明属于现代生物技术之细胞培养技术领域,具体涉及一种原代人肾癌细胞的分离及培养方法。
背景技术:
肾癌是起源于肾实质泌尿小管上皮系统的恶性肿瘤,全称为肾细胞癌,简称为肾癌,是最常见的肾脏实质恶性肿瘤。人肾癌细胞贴壁生长,形态呈短梭形。目前肾癌的研究多采用细胞株,如achn。但长期的体外传代培养会使其细胞特性和蛋白表达发生改变,在肾癌实验研究中可对实验结果产生干扰,影响实验预期结果。通过原代培养获取的肾癌细胞可以避免细胞系长期传代对细胞特性的影响,为各种实验的研究提供可靠的资料。
目前常用的分离原代人肾癌细胞的方法有组织块贴壁法和酶消化法。
组织块贴壁法分离得到的细胞纯度不高,数量少,并且培养时间较长。
本发明在传统酶消化法基础上进行改良,采用一种混合酶消化法和差速贴壁法相结合的方法,旨在提供一种操作简单、高效的获得生长状态好、纯度高的原代人肾癌细胞的分离培养方法,建立一套完善可靠的原代人肾癌细胞体外培养技术。
技术实现要素:
根据上述问题,本发明提供了一种原代人肾癌细胞的分离及培养方法,该方法操作简单,细胞产量和成活率高,是一种较为理想的原代人肾癌细胞培养方法,可以满足多种生理生化实验的要求。
一种原代人肾癌细胞的分离及培养方法步骤包括:(1)无菌条件下切取新鲜肾癌组织,4℃密封运回实验室;(2)组织处理器械消毒;(3)无菌操作台内,pbs清洗肾癌组织3次,剔除表面血管、脂肪、结缔组织;(4)剪碎组织,并用预热的胰蛋白酶和ⅱ型胶原酶分别消化;(5)终止消化,离心,弃上清;(6)取细胞滤液用锥虫蓝染色检测细胞活性;(7)细胞计数后用完全培养基重悬接种到包被后的培养瓶,置于37℃、5%co2环境中培养;(8)差速贴壁法去除成纤维细胞;(9)细胞形态鉴定;(10)细胞存活率测定;(11)免疫学鉴定。
其中,步骤(3)所述的pbs已4℃预冷,pbs浓度为0.01m,ph为7.2~7.4,培养皿置于无菌操作台内的冰上,是为了使组织处于无菌、低温的环境。
其中,步骤(4)所用的胰蛋白酶含0.01%的edta以吸收组织中的ca2+、mg2+,从而进一步促进细胞分离。
其中,步骤(4)所用的胰蛋白酶浓度为0.05%~0.2%,消化时间10~20min,ⅱ型胶原酶浓度为0.1%~0.2%,消化时间30~60min。
其中,步骤(5)所用的离心速度为300~400g,离心时间5~8min。
其中,步骤(7)所述完全培养基为dmem/f12(1:1)培养基,含10%胎牛血清,100u/ml的青霉素、100u/ml的链霉素,5μg/ml的胰岛素。
其中,步骤(7)所述的培养瓶用3~4μg/cm2的多聚赖氨酸包被。
其中,步骤(8)所用差速贴壁法的差速时间为15~30min。
有益效果
本发明建立了一种简单、高效的分离培养原代人肾癌细胞的方法,所得原代细胞经细胞形态学观察与鉴定:数量多、纯度高、活性好,细胞成活率达90%以上,细胞纯度达95%以上。
本发明采用在传统方法上改进而来的混合酶分步消化法结合差速贴壁法,优于组织块贴壁法和单一酶消化法,本发明所得原代人肾癌细胞数量多、纯度高、质量稳定、重复性好,满足体外实验对细胞数量和纯度的要求。
本发明采用多聚赖氨酸包被培养瓶,细胞生长状态好,可满足原代人肾癌细胞实验的要求,多聚赖氨酸包被比apes包被制作更简单,更易保存,本方法经济实用,简便易行,有利于建立体外实验模型细胞,为理想的种子细胞用于衰老和病变引起的组织器官损伤修复研究。
附图说明
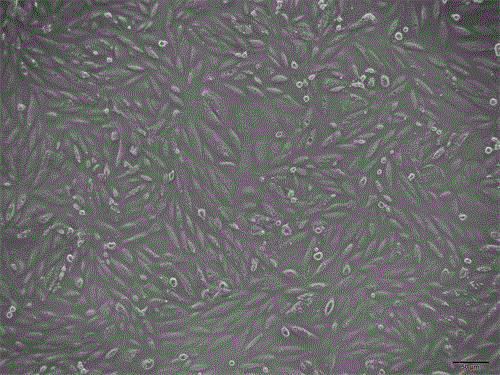
图1培养5d的原代人肾癌细胞图片,100×;
图2培养7d的原代人肾癌细胞图片,100×。
具体实施方式
在本发明中所使用的术语,除非另有说明,一般具有本领域普通技术通常理解的含义。
下面结合附图和实例对本发明进行详细说明,本发明的保护内容不限于下述实施例。
在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
本实验所用的实验仪器与试剂如下:
外科手术器械一套,cck-8细胞计数盒(sigma,美国),倒置显微镜(xds-1a,上海),荧光显微镜(leica,美国),低温离心机(td24b-ws,上海),超低温冰箱(中科美菱),移液枪(eppendorf,美国),电子分析天平(sartorius,美国),超净工作台(hj-cj-1d,上海),co2细胞培养箱(sanyo,日本),elisa试剂盒购于rd公司,青霉素-链霉素双抗于gibco购买,胎牛血清购买于bioind公司,ⅱ型胶原酶和胰蛋白酶购买于德国serva公司,多聚赖氨酸购买于美国gibco公司,pbs自制(8.0gnacl、0.2gkcl、0.2gkh2po4、1.44gna2hpo4溶于1000ml去离子水中,调整ph为7.2~7.4,非特殊指出,本专利所用的pbs皆为此配方),细胞培养瓶、离心管购于美国corning公司,锥虫蓝购买于美国biofer。
本发明提供的技术方案包括如下步骤:
1.将组织处理器械浸泡于体积分数75%乙醇水溶液,再置于无菌操作台紫外灭菌30min,将器械取出,在无菌操作台里晾干。
2.无菌条件下切取新鲜肾癌组织,用pbs(浓度为0.008~0.015m,ph为7.2~7.4)冲洗2~3次,保存在1000u/ml青霉素和1000mg/l链霉素的dmem/f12(1:1)培养基中,4℃密封运回实验室。
3.超净台内用无菌镊取出组织,放入预冷无菌含双抗(100u/ml的青霉素,100u/ml的链霉素)pbs液(浓度为0.008~0.015m,ph为7.2~7.4)中,培养皿置于冰上洗涤除去系膜、血管、脂肪、坏死组织。
4.无菌条件下,在预冷的pbs(浓度为0.008~0.015m,ph为7.2~7.4)中用眼科剪将肾癌组织剪成1mm×1mm×1mm的碎块,置于无菌离心管中。
5.用0.2%的ⅱ型胶原酶37℃恒温摇床(150r/min)消化60min,胶原酶消化过程中每隔15min吹打一次,再用37℃预热的0.1%的胰蛋白酶-edta消化液于37℃,co2培养箱消化10min。
6.加入10ml含10%胎牛血清、双抗(100u/ml的青霉素,100u/ml的链霉素)、5μg/ml胰岛素、ph为7.4的dmem/f12(1:1)混合培养基(简称混合培养基)终止消化,所得滤液350g离心6min,去掉上清液,保留沉淀,重复两次。
7.沉淀用含10%胎牛血清,100u/ml的青霉素、100u/ml的链霉素的双抗,5μg/ml的胰岛素dmem/f12(1:1)完全培养基重悬,细胞计数板计数,在细胞计数板中央放置计数专用的盖玻片,用玻璃虹吸管吸取细胞,让虹吸管在盖玻片上或下侧的计数板凹蹧处流出悬液,至盖玻片被液体充满为止,置显微镜下计数四角大方格内的细胞总数。对于压线的细胞只计数在上线和左线者,对于细胞团按单个细胞计数,细胞数/ml=四大格细胞总数/4×104。
8.计数完成后再加入培养基将细胞密度调至1×105个/ml,接种细胞至铺多聚赖氨酸包被的的培养瓶中,置于37℃、5%co2环境中培养,2h后将未贴壁细胞转移至新的培养瓶中培养,48h后换液去除未贴壁死细胞和其它杂质,此后2~3d换液一次。
9.细胞形态及生长情况观察:倒置显微镜下观察新鲜分离的原代人肾癌呈单个游离态,活细胞形状规则,胞质明亮,细胞膜清晰,死细胞颜色暗淡,培养24~48h后小部分细胞牢固贴壁,48h后大部分细胞贴壁,3d后细胞开始大量增殖,生长良好,贴壁较均匀,原代人肾癌细胞呈梭形,折光性强,散在分布,约7d时,细胞汇合成片,其融合率可达到85%。
10.细胞成活率测定:锥虫蓝排斥实验,吸取0.2ml原代细胞悬液加入0.2ml的0.4%锥虫蓝溶液,吹打均匀,然后吸取少量悬液沿细胞计数板上盖片边缘缓缓滴入,至盖片下刚好充满悬液,在倒置显微镜下观察,若细胞核未被染色则提示细胞存活,如细胞核被染蓝,提示细胞死亡,计数四个大格子细胞数(四大格细胞总数/4×104),计算细胞成活率:活细胞总数/(活细胞总数+死细胞总数)×100%。
11.采用双抗体夹心elisa法底物为opd,检测od492值,白蛋白含量7天时达到高峰;
12.肾癌细胞免疫组织化学鉴定。
高倍显微镜下计数300个细胞,原代人肾癌细胞胞纯度为95%以上。
本发明所得到的细胞数量多,细胞成活率达90%以上,细胞纯度达95%以上,为细胞移植和药物筛选等研究提供高质量的细胞资源。
以上所述,仅为本发明较佳的实施方式,但本发明的保护范围并不局限于此实施实例。任何在本发明的精神和原则之内作出任何修改,等同替换和改进等,均应包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!