一种链霉菌制备天赐霉素-A及其衍生物的发酵工艺的制作方法
本发明涉及一种链霉菌的发酵工艺,特别涉及一种用于制备天赐霉素-a及其衍生物的高产链霉菌的发酵工艺。属于生物医药
技术领域:
。
背景技术:
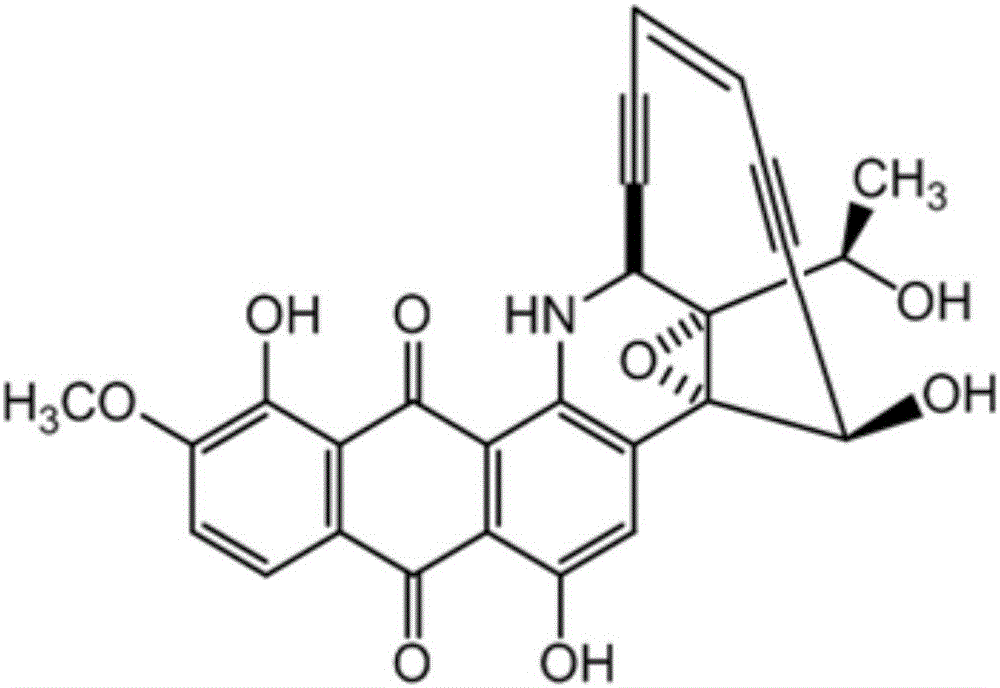
:烯二炔类天然产物具有独特的共轭炔-烯-炔分子结构和超强生物活性,是最具开发前景的一类抗肿瘤抗生素,根据其核心结构可分为包括新制癌菌素(neocarzinotatin,ncs)、力达霉素(c-1027)、kedarcidin和maduropepti等在内的九元环烯二炔,以及包括卡奇霉素(calicheamicin,cal)、esperamicin、dynemicin(dyn)和uncialamycin(ucm)等在内的十元环烯二炔。烯二炔类抗肿瘤抗生素的生物活性主要依赖于其诱导的dna损伤机制,即通过电子重排形成暂时性苯环双自由基,对dna小沟进行亲核攻击后形成以脱氧核糖核酸碳链为中心的自由基,并在分子氧的作用下引起单链或双链dna的断裂。作为迄今为止发现的细胞毒性最强的一类分子,烯二炔类天然产物可作为抗肿瘤抗体偶联药物(adc)的弹头分子,具有极高的成药前景。目前发现的12种烯二炔分子中,ncs、cal和ozogamicin已被开发成为临床药物,其中由日本开发的smancs(聚苯乙烯马来酸共轭ncs)主要用于治疗肝癌,而美国辉瑞公司最近开发的adc药物mylotarg(cd33单克隆抗体偶联cal)和besponsa(cd22抗体inotuzumab偶联ozogamicin)则分别用于治疗急性骨髓性白血病和成人复发或难治性b细胞前体急性淋性白血病。天赐霉素-a(tiancimycin-a,缩略tnm-a)是2016年通过基因组挖掘技术从链霉菌(streptomycessp.cb03234,简称cb03234)的发酵产物中分离发现的一种新型十元环烯二炔抗肿瘤抗生素,其结构如下所示:天赐霉素-a与ucm和dyn结构类似,对多种恶性肿瘤细胞有超高的活性,超过目前临床一线化疗药物丝裂霉素近千倍,并且表现出更快速和更完整的肿瘤细胞杀伤力,将是抗肿瘤adc药物理想的弹头药物分子,该成果已发表在国际微生物权威期刊mbio.上(2016;7(6).pii:e02104-16)。tnm-a在原始菌株(streptomycessp.cb03234)中的产量极低,仅为0.3mg/l左右,而目前达到工业化制备水平的其它烯二炔类天然产物的产量均在20mg/l以上,因此现有tnm-a的来源远远不能满足临床研究和工业化生产的应用需求。同时tnm-a因其复杂独特的分子结构,无法通过传统的化学合成方法来获取,通过微生物发酵是目前制备tnm-a最切实可行的手段。此外,tnm-a从发酵液中的分离纯化仍采用乙酸乙酯萃取发酵上清液,丙酮破碎菌体后再经过乙酸乙酯萃取等传统手段,步骤繁多且过程中需要消耗大量的有机溶剂。因此,构建稳定的tnm-a高产菌株,并对其进行系统的发酵培养优化和建立放大规模的发酵调控工艺,可以大幅提高tnm-a产量,在此基础上通过高效的分离纯化方法获得足量的tnm-a来有效地解决其现阶段的发展瓶颈,加速推动tnm-a后继的抗癌活性分析、作用机理等临床前期研究以及抗肿瘤adc新药的开发。技术实现要素:本发明解决的技术问题是,提高tnm-a的产量,以满足工业化生产的应用需求。本发明通过对活性极强的新型烯二炔类天然产物天赐霉素-a(tnm-a)的原始生产菌株streptomycessp.cb03234进行基于链霉素抗性的核糖体工程菌种诱变,最终筛选获得tnm-a的高产菌株cb03234-s;并建立和优化了tnm-a的微生物发酵制备工艺;以及进一步从发酵液中高效分离和纯化tnm-a的分离纯化工艺。本发明的技术方案是,提供一株链霉菌,所述链霉菌为streptomycessp.cb03234-s(简称cb03234-s),已于2017年9月25日保藏在中国典型培养物保藏中心,保藏编号为cctccm2017538。所述链霉菌可应用在天赐霉素-a及其衍生物的制备,所述天赐霉素-a的结构式为:本发明还提供一种链霉菌的发酵工艺,在发酵过程的前期(即对数生长期,45-55小时左右),控制发酵液中的溶氧为60-80%;在发酵过程的中后期(在上述对数生长期之后,即稳定期和衰亡期),控制发酵液中的溶氧为40-60%,ph为8.0-9.0;所述链霉菌为streptomycessp.cb03234-s,已于2017年9月25日保藏在中国典型培养物保藏中心,保藏编号为cctccm2017538。优选地,发酵工艺使用的培养基中,以可溶性淀粉作为碳源;以酵母浸粉为氮源。优选地,在发酵过程中添加树脂。优选地,每升发酵液中添加树脂5-20g。优选地,发酵工艺使用的培养基中,碳源与氮源的质量比为1:0.8-1.2。优选地,发酵工艺使用的培养基中,氮源的浓度为5-20g/l;碳源的浓度为5-20g/l。优选地,发酵周期为5-7天。优选地,发酵工艺使用的培养基的ph值为6.5-7.5。优选地,在发酵过程的第50小时之后,通过添加酸化的碳源控制发酵液中的ph值。优选地,发酵工艺使用的培养基的组成如下:15g/l可溶性淀粉,15g/l酵母浸粉,0.1g/lcuso4·5h2o,0.005g/lnai和2g/lcaco3,培养基的ph为7.0。本发明还提供一种链霉菌发酵产物的分离纯化工艺,所述链霉菌为streptomycessp.cb03234-s,已于2017年9月25日保藏在中国典型培养物保藏中心,保藏编号为cctccm2017538;所述分离纯化工艺包括以下步骤:(1)在链霉菌的发酵过程中添加树脂,发酵完成后,将链霉菌发酵产物过滤,收集发酵液中的树脂,并用纯水清洗去除附着在树脂上的菌体和其它杂质,再冻藏结冰后通过冷冻干燥去除水分,得到吸附有目标产物的树脂;(2)用甲醇和乙酸乙酯的混合溶剂对吸附有目标产物的树脂进行多次超声洗脱,合并所有洗脱液,浓缩得到粗提浸膏;用水重新溶解粗提浸膏后,再用乙酸乙酯萃取,将萃取得到的萃取液与聚酰胺干粉混合,浓缩至粉末状;再用聚酰胺柱进行纯化,其中,用甲醇水溶液对聚酰胺柱进行洗脱,收集洗脱液,浓缩得到初纯品;(3)再用aq-c18中压制备柱对初纯品进行纯化,得到目标产物纯品。优选地,步骤(2)中,用体积分数55-80%的甲醇水溶液进行梯度洗脱,在洗脱过程中,洗脱液中甲醇的浓度逐渐提高,收集体积分数65-70%的甲醇水溶液洗脱出的溶液,浓缩后用乙酸乙酯萃取直至萃取相无色,萃取相再次浓缩干燥后得到初纯品。优选地,步骤(3)中,aq-c18中压制备柱的纯化条件如下:流速为5.0ml/min,紫外检测器波长为540nm,洗脱液为体积分数50-100%的甲醇水溶液,逐渐提高洗脱液中甲醇的含量进行梯度洗脱,将质量分数为65-70%的甲醇洗脱液收集的组分合并后进行浓缩,得到纯度超过90%的目标产物纯品。优选地,所述步骤(1)中甲醇和乙酸乙酯的混合液中,甲醇和乙酸乙酯的体积比为2:1-1:3。优选地,所步骤(3)中,目标产物纯品的纯度为90%以上。本发明提供的一株tnm-a的高产菌株cb03234-s,该菌株已在中国典型培养物保藏中心保藏,保藏日期是20170925,保藏号为cctccm2017538。该菌株是通过对产生tnm-a的原始菌种streptomycessp.cb03234进行基于链霉素抗性的核糖体工程菌种诱变,最终筛选而得的tnm-a高产菌株。本发明进一步提供一种高效合成tnm-a的微生物发酵制备工艺,具体是通过多组平行摇瓶实验,采取单因素优化和复合优化等方法来确定使cb03234-s高效制备tnm-a的最佳发酵培养基。在此基础上,通过在3l和30l发酵罐中进行的放大实验,对发酵时的溶氧、ph值控制及主要原料的补充等关键因素进行调控,建立放大规模的tnm-a微生物发酵制备工艺,在缩短发酵周期的前提下,进一步提高tnm-a的发酵产率使其可满足现有工业中试化生产的需求。本发明还提供一种tnm-a的高效分离和纯化工艺,通过在发酵过程中添加树脂来富集发酵液中的tnm-a,并先后采用聚酰胺和反相c18填料对其进行分离纯化,简化和减少了分离纯化的步骤,极大地减少了过程中有机溶剂的使用,在降低生产成本的前提下增加了目标产物tnm-a的回收率。本发明制备上述菌株的具体步骤如下:1)链霉菌cb03234的链霉素抗性核糖体工程诱变;2)链霉菌cb03234突变菌株生物活性高通量筛选及tnm-a高产菌株cb03234-s的获得;3)tnm-a高产菌株cb03234-s的遗传稳定性验证。本发明通过核糖体工程诱变及高通量生物活性筛选获得稳定的tnm-a高产菌株cb03234-s,其tnm-a的发酵产率达到7mg/l左右,相对于原始菌株cb03234的tnm-a产量提高10倍以上。tnm-a微生物发酵制备的具体步骤如下:1)cb03234-s发酵过程中接种量、树脂添加和添加量的优化;2)cb03234-s发酵培养基的系统优化;3)cb03234-s在发酵罐上放大规模制备工艺的建立和优化。本发明通过对tnm-a高产菌株cb03234-s的发酵培养基进行系统优化,确定了适合其高效合成目标产物tnm-a的优化培养基,进一步提高了tnm-a的发酵产率;并通过对发酵条件及发酵过程的调控,建立了基于cb03234-s的放大规模tnm-a制备工艺,使得tnm-a的产量突破20mg/l,可以满足工业化制备的需求。tnm-a高效分离纯化的具体步骤如下:1)cb03234-s发酵过程中树脂的添加及其洗脱条件的优化;2)通过聚酰胺填料初步分离纯化含有tnm-a的发酵粗提物;3)通过反相c18填料进行tnm-a的中压制备纯化。本发明通过在发酵过程中添加适量的树脂,不仅提高了tnm-a的产量,更有效地简化了其后续的分离纯化步骤,从中节省了萃取所需的大量有机溶剂,随后通过不同填料的两步纯化,可以获得纯度超过90%的tnm-a,回收率接近40%,上述分离纯化工艺的建立极大地降低了tnm-a的分离纯化成本。本发明的有益效果是,通过核糖体工程诱变及高通量生物活性筛选获得稳定的tnm-a高产菌株cb03234-s,提高了tnm-a的发酵产率,达到7mg/l左右,相对于原始菌株产量提高10倍以上。通过对tnm-a高产菌株cb03234-s的发酵培养基进行系统优化,确定了适合其高效合成目标产物tnm-a的优化培养基,进一步提高了tnm-a的发酵产率,使得tnm-a的产量突破20mg/l。本发明通过在发酵过程中添加适量的树脂,不仅提高了tnm-a的产量,更有效地简化了其后续的分离纯化步骤,从中节省了萃取所需的大量有机溶剂,随后通过不同填料的两步纯化,可以获得纯度超过90%的tnm-a,回收率接近40%,上述分离纯化工艺的建立极大地降低了tnm-a的分离纯化成本。保藏信息菌种名称:链霉菌cb03234;菌种的拉丁文属名:streptomycessp.;保藏编号:cctccno.:m2017538;保藏日期:2017年9月25日;保藏单位:中国典型培养物保藏中心;保藏单位地址:中国武汉,武汉大学。附图说明图1表示发酵产物tnm-a的化学结构式(图1中右侧的十字交叉处没有碳原子)。图2表示tnm-a高产菌株(cb03234-s)的构建及筛选流程图。图3表示cb03234-s在30l发酵罐上的发酵曲线(三个指标分别为:溶氧do、ph值和产量titer)。具体实施方式下面结合实施例进一步解释和说明本发明,如无特别说明,涉及洗脱液、流动相的百分数为体积百分数,其他的百分数为质量百分含量。实施例1:链霉菌cb03234的培养和发酵及tnm-a的生物活性检测将链霉菌cb03234接种至高氏1号(g1)固体培养基(所述g1固体培养基为:10g/l可溶性淀粉、0.5g/lmgso4·7h2o、0.5g/lk2hpo4、1g/lnacl、1g/lkno3、0.01g/lfeso4·7h2o、20g/l琼脂,ph=7.0)斜面上,在30℃恒温条件下培养8-15天左右,用无菌20%甘油溶液收集孢子获得孢子悬浮液后冷藏于-80℃备用。为获得目标产物tnm-a,将50μlcb03234孢子悬浮液接种至50ml胰蛋白胨大豆肉汤(tsb)种子培养基(所述tsb种子培养基为:17g/l胰蛋白胨、3g/l植物蛋白胨、2.5g/lk2hpo4、5g/lnacl、2.5g/l葡萄糖,ph=7.3)中,在30℃和200rpm条件下培养48小时后,将5ml种子转接至含有50ml生产培养基(所述生产培养基为:10g/l可溶性淀粉、5g/l棉籽粉、2g/lcaco3、0.05g/lcuso4、0.005g/lnai)的250ml三角烧瓶中,在30℃和200rpm条件下培养7天。将所得发酵液离心后取上清液,以藤黄微球菌(micrococcusluteus)atcc10240为生物活性指示菌在标准lb培养基平板上进行纸片法测试(20μl发酵上清液/片),通过测量抑菌圈的大小来初步估算发酵液中tnm-a的含量。实施例2:tnm-a的分离纯化及hplc检测将实施例1中所得的50ml发酵液进行离心后分别收集上清液和菌体,上清液用乙酸乙酯(ea)萃取(50ml*3次);菌体用50ml丙酮提取,提取液经过旋转蒸发仪浓缩后再用ea水混合溶剂(1:1,体积比)萃取(50ml*3次),将上述萃取相合并后再次浓缩干燥,最后用甲醇重新溶解进行hplc检测。hplc分析条件及程序如下:流动相a为99.9%去离子水和0.1%甲酸;流动相b为99.9%甲醇和0.1%甲酸,流速为1.0ml/min,紫外检测器波长为540nm,线性梯度分析程序为:0-5分钟,90%a至5%a;5-9分钟,5%a;9-13分钟,5%a至90%a;13-15分钟,90%a。实施例3:链霉菌cb03234发酵过程中不同类型树脂的添加tnm-a具有极强的毒性,在发酵后期随着其浓度的增大会迅速导致其产生菌的菌体死亡和自溶,使发酵液ph值急剧上升;而tnm-a则会在ph超过7.5的条件下开始分解,并随着ph值的进一步升高而加速分解直至消失。因此在发酵过程中添加大孔树脂对tnm-a进行吸附,可有效地消除tnm-a对自身菌种的毒副作用以维持稳定生物量进行tnm-a合成,并通过减少发酵液中tnm-a浓度来进一步诱导其合成。因此,选择包括江苏苏青集团生产的苯乙烯系大孔型强酸阳离子交换树脂sq605、大孔吸附树脂(da201-c、da201-e、da201-h)、苯乙烯系弱碱性阴离子交换树脂d309等5种树脂,以及日本三菱生产的3种大孔吸附树脂(hp20、hp2mgl、sp700),共8种不同类型的树脂对cb03234发酵液中的tnm-a进行了吸附。按1:20(树脂质量:发酵液体积)将树脂与发酵上清液混合,在30℃和200rpm条件下混合60分钟;将树脂与吸附残液分离后用大量纯水清洗树脂至清洗溶液无色;然后加入等体积(初始被吸附发酵液)甲醇在相同条件下洗脱树脂30分钟,最终将甲醇洗脱液和吸附残液分别进行生物活性检测,确定hp20树脂对tnm-a的吸附效果最好,并在随后对生产培养基进行hp20不同添加量的测试确定了其最有效添加量为1%(表1),发酵周期延长至10天左右,因此在后续的tnm-a摇瓶发酵生产中均添加1%的hp20大孔吸附树脂。表1.不同树脂对发酵液中tnm-a的吸附及不同量hp20对tnm-a产量的影响实施例4:链霉菌cb03234的链霉素抗性核糖体工程诱变将链霉菌cb03234接种至g1固体培养基斜面上,在30℃恒温条件下培养8-15天左右,用无菌20%甘油溶液收集孢子,所得孢子混合液经振荡打散后用无菌砂芯漏斗过滤,并通过平板稀疏涂布进行孢子计数,最终制成均一化浓度的孢子悬浮液。同时配制浓度为10mg/ml的链霉素(ss)水溶液并进行过滤除菌,在此基础上配置含有不同浓度ss的g1固体培养基平板;将cb03234的孢子悬浮液稀释50-100倍后取100μl与5ml含有不同浓度ss的g1软琼脂培养基(培养基其它成分与g1相同,琼脂为10g/l)混合均匀后平铺至含对应浓度ss的g1固体培养基平板上(每种ss浓度平行培养3块平板),在30℃培养4-5天后观察菌落存活情况,最终确定ss的最小抑菌浓度(mic)为20mg/l。在上述研究基础上,选取4种不同的ss浓度(3倍mic、4倍mic、6倍3倍mic和7.5倍mic)进行链霉菌cb03234的核糖体工程诱变(表2)。每种浓度按照上述接种流程平行接种10块g1平板,在30℃恒温条件下培养7-8天后挑选存活的单菌落。实施例5:链霉菌cb03234突变菌株生物活性高通量筛选如图2所示,将挑选的cb03234及其相关突变菌株的单菌落分别平行接种至两块96孔板g1固体生长培养基中。将接种的96孔板于30℃恒温培养8-15天后,挑选对应单菌落的琼脂块,放置于打孔的lb平板上,以藤黄微球菌(micrococcusluteus)atcc10240为生物活性测试指示菌,将1mlatcc10240菌液与4mllb软琼脂培养基混合均匀后倾倒在置有待筛选单菌落琼脂块的lb平板上,待其凝固后于37℃恒温培养过夜,以原始菌株为参照,通过测量对应单菌落琼脂块的抑菌圈大小来快速筛选潜在的tnm-a高产菌株,最终从71个突变株中筛选出21株进行进一步的发酵验证(表2)。表2.cb03234菌株的核糖体工程诱变及生物活性高通量筛选结果ss筛选浓度(mg/l)6080120150生长单菌落数1710395抑菌圈大于原始菌株数74100实施例6:tnm-a高产菌株cb03234-s的筛选及验证将抑菌圈大于原始菌株cb03234的突变单菌落,转接至50ml含有对应浓度ss的胰蛋白胨大豆肉汤(tsb)种子培养基(所述tsb种子培养基为:17g/l胰蛋白胨、3g/l植物蛋白胨、2.5g/lk2hpo4、5g/lnacl、2.5g/l葡萄糖,ph=7.3)中,在30℃和200rpm条件下培养48小时,取样冷冻保藏并转接至g1固体培养基斜面(;剩余部分按10%的接种量转接至含有50ml生产培养基(所述生产培养基为:10g/l可溶性淀粉、5g/l棉籽粉、2g/lcaco3、0.1g/lcuso4、0.005g/lnai,并添加0.5g(1%质量体积比,所有实施例中树脂的用量均为质量(g)体积(ml)比)hp20大孔吸附树脂)的250ml三角烧瓶中,在30℃和200rpm条件下培养7-10天。发酵结束后收集大孔树脂,甲醇浸泡并超声洗脱后将洗脱液合并浓缩至2ml,通过hplc分析计算突变株的tnm-a产量,最终从21株潜在高产菌株中筛选出s-60-16t突变菌,其tnm-a产量达到7mg/l左右(表3),相对于原始菌cb03234产量提高10倍以上,并将其命名为cb03234-s。表3.部分潜在tnm-a高产菌株的发酵产量菌株产量(mg/l)菌株产量(mg/l)s-60-15t5.7±1.3s-80-63.3±1.0s-60-16t6.9±0.2s-120-141.1±0.9s-80-32.5±1.4s-120-223.4±0.8cb032340.6±0.1实施例7:tnm-a高产菌株cb03234-s的遗传稳定性验证为保证后续的工业化生产制备,对筛选获得的tnm-a高产菌株cb03234-s进行了遗传稳定性验证:在含有60mg/lss的g1固体斜面上进cb03234-s的连续传代培养,每一代的培养周期为8-15天,同时对每一代培养所收集的孢子进行摇瓶发酵验证,实验流程同实施例1,其中tsb种子培养基中添加ss的最终浓度为60mg/l,种子生长周期为36-40小时左右。发酵和hplc分析检测结果表明,cb03234-s连续四代的tnm-a产量都在7mg/l左右(表4),具有良好的遗传稳定性。表4.cb03234-s的遗传稳定性验证孢子代数第一代第二代第三代第四代产量(mg/l)6.9±0.26.8±0.37.4±0.27.3±1.3实施例8:cb03234-s发酵培养基的系统优化基于原始的cb03234生产培养基(10g/l可溶性淀粉,5g/l棉籽粉,0.1g/lcuso4·5h2o,0.005g/lnai和2g/lcaco3,ph7.0),首先进行碳源的优化,分别选择10g/l的甘油、葡萄糖、甘露醇、果糖、半乳糖、木糖、蔗糖、麦芽糖、乳糖、可溶性淀粉、糊精、玉米粉等12种常用碳源作为考察对象进行摇瓶发酵,当发酵液ph值大于7.5时收取摇瓶中的菌体及树脂来确定tnm-a的产量。第一轮评价结果表明,葡萄糖、木糖、麦芽糖和可溶性淀粉均能较好支持tnm-a的生物合成,对上述这4种碳源的进一步验证最终确定可溶性淀粉为最优碳源,对应产量可达到7.4±0.5mg/l(表5)。表5.不同碳源对tnm-a产量的影响随后采用同样的策略,对包括燕麦粉、胰蛋白胨、大豆粉、大豆蛋白胨、安琪蛋白胨、安琪酵母蛋白胨、酵母浸粉、麦芽提取物、安琪玉米浆干粉、玉米浆、玉米蛋白胨、棉籽粉在内的12种常用氮源进行了比较。结果表明,酵母来源的氮源对tnm-a产量的促进作用较为明显,其中酵母浸粉被确定为最优氮源,对应tnm-a产量可达到9.5±1.2mg/l(表6)。表6.不同氮源对tnm-a产量的影响氮源(10g/l)产量(mg/l)氮源(10g/l)产量(mg/l)燕麦5.7±0.3安琪酵母浸粉9.5±1.2胰蛋白胨0.4±0.1安琪玉米浆干粉0大豆粉2.5±0.3麦芽提取物2.4±0.3大豆蛋白胨0玉米浆4.3±0.3安琪酵母蛋白胨8.2±0.0玉米蛋白胨1.9±0.1安琪蛋白胨0棉籽粉3.7±0.2在上述碳氮源优化的基础上,对酵母浸粉的最佳用量以及碳氮源的等比例复合优化开展了进一步考察。结果表明,选用15g/l的可溶性淀粉和15g/l酵母浸粉作为碳氮源时,tnm-a的发酵周期由10天缩短到5至6天,产量最高可达16.3±1.3mg/l(表7),因此确定优化的tnm-a生产培养基为15g/l可溶性淀粉,15g/l酵母浸粉,0.1g/lcuso4·5h2o,0.005g/lnai和2g/lcaco3(ph7.0)。表7.氮源不同用量及碳氮源复合优化对tnm-a产量的影响酵母浸粉(g/l)产量(mg/l)碳源(g/l)/氮源(g/l)产量(mg/l)58.7±1.15/58.9±1.7109.9±0.910/109.9±0.91514.1±1.415/1516.1±1.32012.1±0.220/204.6±1.130030/300实施例9:cb03234-s在3l发酵罐上的制备工艺建立和优化在上述研究基础上,对cb03234-s在6联3l平行发酵罐中进行了制备工艺的初步建立和优化,将cb03234孢子悬浮液接种至含60mg/lss的tsb种子培养基中,在30℃和200rpm条件下培养24-48小时后,转接至含有2l优化生产培养基的3l发酵罐中进行发酵。首先进行了不同溶氧条件的评估,通过采取溶氧与搅拌速度联动的方式,将3个平行发酵罐的溶氧分别设置在20%-40%、40%-60%、60%-80%的三个区间,设定通气量为6l/min,罐压为0.05mpa,发酵温度30℃。发酵48小时后每隔12小时取样分析检测tnm-a的含量变化。结果表明,高溶氧条件(60%-80%)时,发酵前期tnm-a的产量上升较快;而随着发酵时间的延长,在发酵中后期溶氧控制在40%-60%时,tnm-a的产量上升快且最终产量最高,同时发酵周期明显缩短;而低溶氧条件(20%-40%)时tnm-a在整个发酵周期中的产量都不高(表8)。因此初步确定发酵罐条件下,发酵前期和中前期溶氧控制在较高条件(60%-80%),发酵中后期适当降低溶氧,将其控制在中等条件(40%-60%),有助于tnm-a产量的提升。表8.3l发酵罐上不同溶氧条件对tnm-a产量的影响随后在3l发酵罐上还进行了补料条件的探究,通过将溶氧与搅拌联动的方式,根据发酵周期将溶氧设置在两段不同区间,其它条件不变。当发酵培养至50h左右,发酵液ph值开始上升时,进行不同条件的分批补料,设置的三个条件分别为:不进行补料、添加ph=1(盐酸调节)的15g/l可溶性淀粉溶液、添加ph=3(盐酸调节)的15g/l可溶性淀粉溶液;后两者通过设置ph值与补料联动来维持发酵液ph值稳定在一定范围内不发生剧烈变化(实际发酵过程中ph稳定在8.3-8.6之间),直至发酵结束。同样每隔12h进行取样分析检测tnm-a的含量变化,当tnm-a产量明显降低时下罐。结果表明,未进行补料时发酵周期在100h左右,tnm-a最高产量仅为12mg/l左右;而在发酵过程中进行一定量碳源的补充,不仅可以维持较为稳定的发酵ph值,还能明显延长次代谢产物合成周期,从而进一步提高tnm-a产量;并且ph值较低的补料溶液对发酵液ph值的调控更为灵敏,能较好地维持整个发酵环境,相比之下所得的tnm-a产量最高(表9)。在3l发酵罐条件下,通过对溶氧和补料条件的控制,可将发酵周期延长至120h左右,tnm-a的产量达到19g/l左右。表9.3l发酵罐上不同补料条件对tnm-a产量的影响实施例10:cb03234-s在30l发酵罐上的放大规模制备根据3l发酵罐实验中的发酵制备工艺条件优化,对cb03234-s在30l发酵罐中进行了放大发酵。种子通过逐级放大培养,将200μlcb03234-s孢子悬浮液接种至200ml含60mg/lss的tsb种子培养基中,在30℃和200rpm条件下培养36小时后,转接至含有2.5ltsb种子培养基的10l种子罐中,在通气量为6l/min,罐压为0.05mpa,发酵温度30℃,转速200rpm条件下培养24h,然后将2.5l种子全部转接至含有已灭菌25l优化生产培养基的30l发酵罐中进行发酵,溶氧控制策略与实施例10相同;在发酵60h左右,溶氧和ph值均开始明显上升时开始补充ph=1(盐酸调节)的15g/l可溶性淀粉溶液,通过设置ph值与补料联动来维持发酵液ph值不超过8.5,直至发酵结束。期间每隔12h进行取样分析检测tnm-a的含量变化,当tnm-a产量明显降低时下罐。发酵曲线表明(图3),通过对发酵过程中转速、溶氧(单位采用空气饱和度%表示)、ph值控制及补料控制等重要参数的有效调控,发酵周期稳定在7天左右,tnm-a产量进一步提升最终超过20mg/l(最高约为23mg/l),达到工业化制备水平。实施例11:cb03234-s发酵结束后树脂的处理流程优化虽然在cb03234-s的发酵过程中添加树脂可以有效地提高tnm-a的产量,但在发酵结束后由于树脂和菌体被一起处理,菌体破碎时释放的大量杂质为tnm-a后续的分离纯化带来极大不便。通过检测tnm-a在50ml发酵液中菌体和树脂的分布情况(表10),发现超过90%的tnm-a被吸附在树脂上,因此在后续的分离过程中,通过不锈钢筛过滤收集发酵液中hp20树脂并用纯水清洗去除少量菌体和其它杂质,在-80℃冻藏结冰后通过冷冻干燥机(-55℃)进行冷冻干燥去除水分。表10.tnm-a在树脂和菌体中的分布情况(50ml摇瓶发酵)tnm-a分布菌体树脂树脂+菌体tnm-a含量(mg/l)0.6±0.114.3±1.515.8±1.0在对树脂吸附的tnm-a进行洗脱时,需要用大量甲醇的重复洗脱(参见实施例6),过程较为繁琐且消耗较多溶剂。为寻找合适的洗脱溶剂,参考tnm-a的原始分离纯化流程中所用试剂,选择不同比例的甲醇和乙酸乙酯(ea)对树脂中的tnm-a进行洗脱,处理方式为0.5g树脂/50ml混合溶剂,单次超声洗脱后将洗脱液浓缩至2ml并进行hplc分析确定tnm-a含量。根据分析结果,并设定其中tnm-a含量最高的混合溶剂的洗脱效率为100%,发现甲醇中混入ea能显著提高对tnm-a的洗脱能力,当甲醇与ea比例为1:1时洗脱效率最佳(表11)。表11.不同溶剂对hp20树脂中tnm-a的洗脱效率根据上述对树脂收集和洗脱流程的优化,节省了大量的时间和试剂,并可极大地简化后续的纯化步骤,为大规模分离纯化奠定了基础。实施例12:tnm-a的聚酰胺柱层析纯化从放大规模的30l发酵罐(有效发酵体积为25l)上收集到200g左右冷冻干燥的树脂后,用总体积20l的混合溶剂(甲醇:ea=1:1),按每次5l用量超声洗脱4次,合并所有洗脱液取样分析定量后通过旋转蒸发仪浓缩后获得棕黑色的粗提浸膏。加入50ml纯水重新溶解粗提浸膏后,用每次500ml的ea萃取3次,合并ea萃取相取样分析定量后(本分离步骤回收率在80%左右)加入20g预处理并干燥的聚酰胺干粉,通过旋转蒸发仪浓缩至粉末状。聚酰胺柱的预处理流程如下:称取500g聚酰胺干粉,用90-95%的乙醇搅拌浸泡24小时除去气泡后装柱(有效填柱体积2.2l),用3-4倍柱体积的90-95%乙醇洗脱至洗脱液透明,再依次用2倍柱体积5%的naoh水溶液、1倍柱体积的蒸馏水、2倍柱体积10%的醋酸水溶液洗脱,最后用纯水洗脱至ph中性后再用2倍柱体积的50%甲醇水溶液平衡。将拌有tnm-a的聚酰胺粉末进行干法上样,用4倍柱体积的50%甲醇水溶液初步分离杂质后,依次用2倍柱体积不同浓度的甲醇水溶液(55%、60%、65%、70%、80%)进行洗脱,tnm-a主要集中于65%-70%甲醇水溶液洗脱组分。合并含有tnm-a的组分进行浓缩,所得的水悬浊液用ea萃取直至萃取相无色,将ea萃取相再次浓缩干燥后用20ml甲醇重溶,得到纯度为80%左右的tnm-a初纯品(本分离步骤回收率在65%左右)。实施例13:tnm-a的中压制备纯化将5mltnm-a初纯品的甲醇溶液注射上样至aq-c18样品柱(welchflash,20-40μm,10g)中,再将样品柱与aq-c18分离柱(welchflash,20-40μm,80g)串联后,用中压制备色谱仪进行纯化。纯化条件如下:流动相a为去离子纯水;流动相b为色谱级甲醇,流速为5.0ml/min,紫外检测器波长为540nm,线性梯度洗脱程序为:0-20分钟,50%a/50%b;20-30分钟,45%a/55%b;30-50分钟,40%a/60%b;50-70分钟,35%a/65%b;70-80分钟,30%a/70%b;80-90分钟,20%a/80%b;90-100分钟,0%a/100%b。将含有tnm-a的65-70%甲醇洗脱组分合并后进行浓缩,所得的水悬浊液用ea萃取直至萃取相无色,将ea萃取相再次浓缩干燥后得到纯度超过90%的tnm-a纯品(本分离步骤回收率在88%左右),总回收率超过45%。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1