一种海洋微生物酶法制备AA‑2G的方法与流程
本发明涉及海洋微生物酶领域,特别是涉及一种海洋微生物菌株y112产生的α-环糊精葡萄糖基转移酶转化l-抗坏血酸制备aa-2g的方法。
背景技术:
l-抗坏血酸(l-ascorbicacid,l-aa)又名维生素c(vc),是一种人体不可缺少的营养素,人体自身无法合成vc,必须从食物中获得。vc在多种生理活动中均起到重要作用,如胶原蛋白合成、改善脂肪代谢、提高免疫力等。vc的应用非常广泛,可应用于食品、化妆品、医药领域等。在食品领域,vc常被用作食品添加剂,有利于保持食品良好的感官品质、防止其中的组分被氧化。近年来研究发现vc对人类白血病细胞、恶性黑色素瘤细胞及其他肿瘤细胞有细胞毒性,对于癌症病人可起到辅助治疗的作用且安全无风险。此外vc能够抑制黑色素的形成,与维生素e协同可起到良好的光保护作用,显著减轻因紫外线照射引起的皮肤炎症、色素沉着。然而,vc分子结构中具有特殊的连烯二醇结构,容易被氧化失去生理活性,限制了它在各领域中的应用。
2-氧-α-d-葡萄糖基-l-抗坏血酸(aa-2g)是vc和葡萄糖基利用糖基转移酶的转糖基作用形成的缩合物,葡萄糖基以α-1,4糖苷键接于l-抗坏血酸的c2上,取代了原有的羟基。由于葡萄糖基的掩蔽作用,aa-2g不易氧化降解,在各种水溶液中均有良好的稳定性,是一种良好的vc替代品。
aa-2g的用途广泛,可应用在化妆品、食品、医疗保健等领域。最常见的是在化妆品领域的应用,它的美白效果显著,可以直接排出表皮层中已经形成的黑色素,作为一种附加成分已被投入商业化妆品的生产中。aa-2g能够有效地促进成纤维细胞合成胶原蛋白,缓解细胞氧化及细胞衰老,因而在维持皮肤弹性和延缓皮肤衰老方面起到重要作用。由于aa-2g进入人体后在可被缓慢分解成vc与d-葡萄糖,能持续提供vc,因此可添加到食品及饮品中作为抗氧化剂、vc补充剂等。在医疗保健方面,aa-2g能够促进b细胞分化成浆细胞,延缓其死亡时间,加强b细胞在体液免疫中的作用。
技术实现要素:
本发明要解决的技术问题在于提供一种海洋微生物酶法制备aa-2g的方法。本发明方法利用海洋微生物菌株y112产的环糊精葡萄糖基转移酶(α-cgtase)转化vc合成aa-2g,通过优化反应条件,使aa-2g产量达到较高水平。
本发明是通过如下技术方案来实现的:
一种海洋微生物酶法制备aa-2g的方法,其特征在于包括下列步骤:
⑴在vc和β-cd混合液中加入na2so3作为抗氧化剂,其中混合液中vc和β-cd质量比为1:1,vc和β-cd的浓度均为56.81g/l,抗氧化剂的浓度为10%(g/ml);
⑵取步骤⑴的水溶液调整ph为9后,添加海洋微生物菌株y112产生的α-cgtase于水溶液中,添加量为90u/gβ-cd;
⑶取步骤⑵的水溶液置于振荡器进行反应,温度设定为35℃,反应时间为24小时,既得aa-2g水溶液。
本发明与现有技术相比的有益效果:
本发明通过转化vc制备aa-2g响应面设计优化方法,得到aa-2g产量对酶添加量a、反应体系phb和底物浓度c二次多项回归方程为:y=10.25-0.99a-0.41b+2.06c-0.90ab+0.74ac+1.60bc-2.18a2-2.02b2-3.01c2,利用软件分析得到最大响应值时a、b、c对应的值即为最佳实验条件。利用所述实验条件对α-cgtase转化vc制备aa-2g,获得了较高的aa-2g产量,可以达到10.67g/l,该方法工艺简单,快速效果好,用来转化vc制备aa-2g有效、可靠、经济。
附图说明
图1转化时间对合成aa-2g的影响;
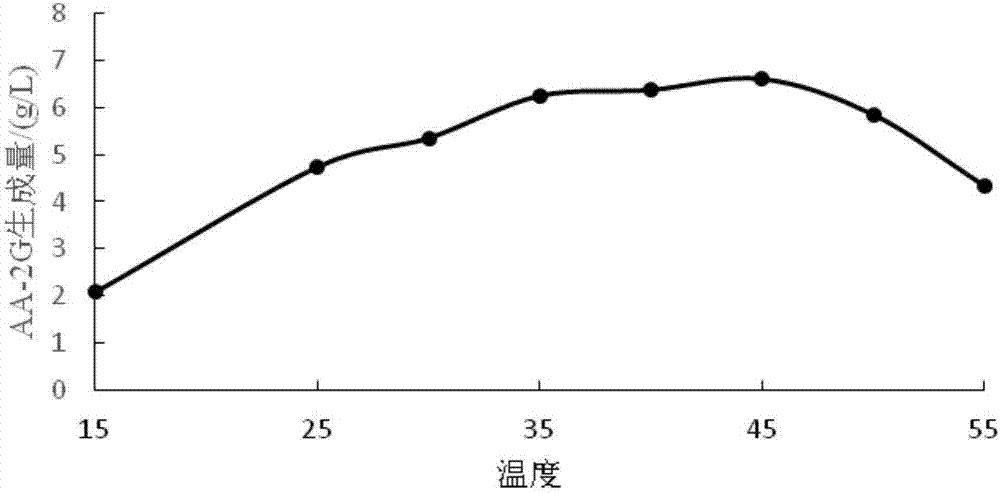
图2温度对合成aa-2g的影响;
图3ph对合成aa-2g的影响;
图4底物浓度对合成aa-2g的影响;
图5底物配比对合成aa-2g的影响;
图6加酶量对合成aa-2g的影响;
具体实施方式
下面通过实施例结合附图来对本发明的技术方案作进一步解释,但本发的保护范围不受实施例任何形式上限制。
实施例
一种筛选影响海洋微生物酶法制备2-氧-α-d-葡萄糖基-l-抗坏血酸的方法,具体方法如下:
⑴转化时间单因素实验:在反应容器中加入终浓度均为50g/l的vc和β-cd各1ml作为底物,以及0.2gna2so3作为抗氧化剂,调节ph至9,按照100u/gβ-cd的比例加入α-cgtase,在35℃,ph9,150r/min的条件下,分别反应6h,12h,18h,24h,36h,42h,48h。
⑵转化温度单因素实验:在反应容器中加入终浓度均为50g/l的vc和β-cd各1ml作为底物,以及0.2gna2so3作为抗氧化剂,调节ph至9,按照100u/gβ-cd的比例加入α-cgtase,在150r/min的条件下反应24h,温度分别设为15℃,25℃,30℃,35℃,40℃,45℃,50℃,55℃。
⑶ph单因素实验:在反应容器中加入终浓度均为50g/l的vc和β-cd各1ml作为底物,以及0.2gna2so3作为抗氧化剂,调节ph分别至4,5,6,7,8,9,10,11,按照100u/gβ-cd的比例加入α-cgtase,在35℃、150r/min的条件下反应24h。
⑷底物浓度单因素实验:在反应容器中加入0.2gna2so3作为抗氧化剂,终浓度相同的vc和β-cd各1ml作为底物,浓度分别设置为10,20,30,40,50g/l,调节ph至9,按照100u/gβ-cd的比例加入α-cgtase,在35℃、150r/min的条件下反应24h。
⑸底物配比单因素实验:反应总体系为2ml,分别按照1:4,2:3,1:1,3:2,4:1的体积比例在反应容器中加入初始浓度均为100g/l的vc和β-cd作为底物,以及0.2gna2so3作为抗氧化剂,调节ph至9,按照100u/gβ-cd的比例加入α-cgtase,在35℃、150r/min的条件下反应24h。
⑹加酶量单因素实验:在反应容器中加入终浓度均为50g/l的vc和β-cd各1ml作为底物,以及0.2gna2so3作为抗氧化剂,调节ph至9,分别按照0,50,100,150,200,250,300u/gβ-cd的比例加入α-cgtase,在35℃、150r/min的条件下反应24h。
⑺响应面实验设计与分析
在单因素实验的基础上,通过plackett-burman实验对转化时间、转化温度、ph、底物浓度、底物配比、加酶量6个因素进行筛选,从中选出对酶法合成aa-2g具有显著影响的因素,采design-expert.8.0.6软件进行实验设计及结果分析。试验设计及结果见表1。对表1中试验结果进行响应面分析,经过二次回归拟合后,得到aa-2g产量对酶添加量a、反应体系phb和底物浓度c的二次多项回归方程为:y=10.25-0.99a-0.41b+2.06c-0.90ab+0.74ac+1.60bc-2.18a2-2.02b2-3.01c2。
表1box-behnken实验设计及结果
用design-expertv8.0.6数据分析软件对数据进行回归分析,分析结果见表2,p值<0.0001,说明该模型是显著的,失拟项p=0.1273>0.05,表明该模型的失拟向不显著。方程的r2=0.9769,说明表明模型拟合度较好,能较好的预测aa-2g产量变化。
表2回归模型系数的显著性
对回归方程进行分析,得到理论上的最优条件组合:加酶量90.78u/gβ-cd,ph9.07,底物浓度为56.81g/l,该条件下aa-2g达到最高产量为10.67g/l。为操作简便,将最终反应条件定为加酶量90u/gβ-cd,ph9,底物浓度60g/l,在此条件下进行验证实验,三次实验的平均aa-2g生成量为9.86g/l,与模型预测值基本吻合,这能够有效说明该实验选用的模型是合理的。
本实施例所用到的α-cgtase酶活力的测定方法:实验组用0.2mol/l的naoh-甘氨酸缓冲液(ph8.5)配制4%(w/v)可溶性淀粉液做为底物,取0.9ml底物于试管中,50℃水浴预热5min,然后加入适当稀释倍数的酶液0.1ml混合均匀,50℃水浴准确反应10min,再加入1ml盐酸溶液(1mol/l)终止反应,最后加入4ml甲基橙溶液(8mg/l)混匀,室温静置20min。对照组取底物0.9ml于试管中,50℃水浴预热5min。随实验组一起50℃水浴反应10min,加入1ml盐酸溶液混合均匀后再加入与实验组相同的酶液,其它处理与实验组相同。最后用紫外分光光度计在507nm下测定实验组与对照组的吸光度。酶活定义为1个单位上述条件下1分钟生成1μgα-环糊精所需要的酶量。
本实施例所用到的aa-2g含量测定方法采用高效液相色谱法测定,其hplc条件如下:检测波长254nm,流动相为20mmol/l稀磷酸,流速0.8ml/min,柱温35℃。用超纯水配制浓度为:250mg/l、500mg/l、1000mg/l、1500mg/l、2000mg/l、3000mg/l的aa-2g标准液,通过hplc分析,以峰面积为横坐标,aa-2g浓度为纵坐标,制作aa-2g的标准曲线。将待测溶液按照上述步骤进行测定,根据标准曲线计算得到aa-2g的浓度,然后得出aa-2g的含量值。
- 还没有人留言评论。精彩留言会获得点赞!