色烯化合物和第二活性剂的组合的制作方法
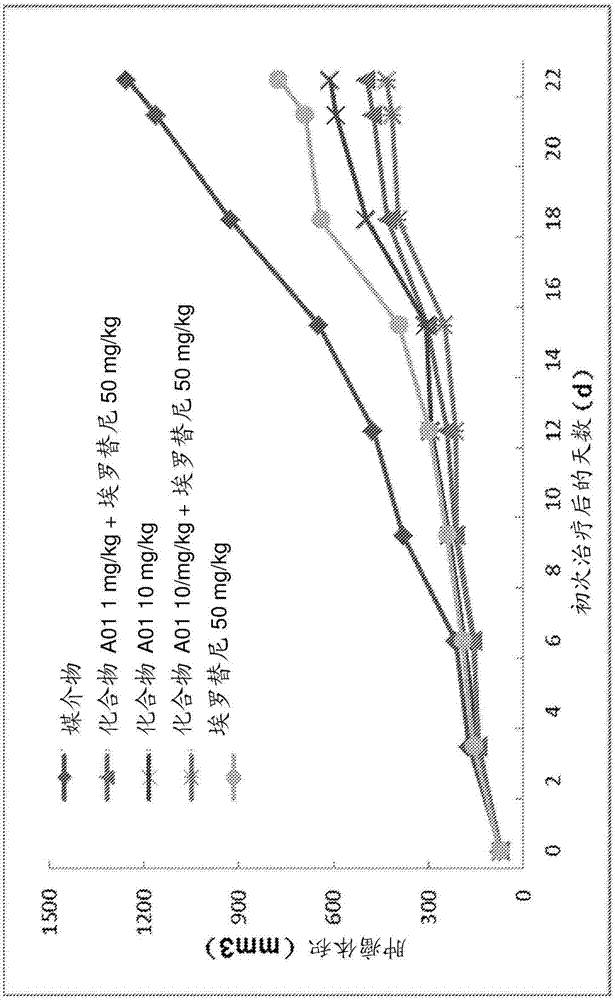
本申请基于35u.s.c.§119(e)要求于2016年1月8日提交的第62/276,713号美国申请和于2016年1月11日提交的第62/277,225号美国申请的权益。第62/276,713号和第62/277,225号申请的内容通过引用以其整体并入本文。领域本公开大体上涉及药用的色烯化合物和第二化合物的组合,包含所述组合的药物组合物,以及通过施用所述组合而适用于治疗个体个体的方法。更具体地,本公开涉及包含一类氘代的和非氘代的色烯化合物和第二活性化合物的组合,以及预防和治疗各种癌症的方法。背景本节提供了与本公开有关的背景信息,其不一定是现有技术。已证实非甾体抗炎药(nsaid)治疗并预防各种癌症。非选择性的nsaid抑制cox-1和cox-2两者。cox-2通过增加前列腺素类的生产、抑制细胞凋亡、促进血管生成、以及调节炎症和免疫功能从而促成致癌作用。cox-2抑制剂可以有效治疗各种癌症。一些选择性cox-2抑制剂包含色烯结构特征。基于色烯的cox-2抑制剂具有与二芳基杂环coxib化合物类似的选择性和镇痛能力。然而,不同于基于二芳基杂环coxib的药物,基于色烯的cox-2抑制剂不损伤肾脏,从而降低高血压的可能性。尿pge-m是pge2的主要尿代谢物,并且可以用作全身性pge2产生的指数。非选择性nsaid和cox-2选择性抑制剂均抑制pge-m水平。考虑到nsaid(例如cox-2抑制剂)的抗肿瘤作用取决于通过靶定cox-2减少pge2产生,尿pge-m用作nsaid在癌症预防和治疗中的药理活性的有价值的中间标记。pge-m是在患有依赖cox-2过表达的癌症的患者中预测cox-2抑制剂效果的有效生物标记(wang等人,cancerprev.res.,2013)。wo03/015608描述了使用可以与cox-2抑制剂结合的蛋白激酶抑制剂来治疗或预防癌症的方法。us2004/0127470描述了使用cox-2抑制剂和egfr拮抗剂的组合来治疗肿瘤形成病症的方法。wo2013/189121报导了具有抗炎和抗肿瘤作用的新型氘代苯并吡喃化合物。zhang等人(acsmed.chem.lett.2015)描述了使用连接至不同的nsaid的埃罗替尼共价连接物来体外治疗肺癌的方法。概述本节提供了本公开的一般概述,并且并非本公开的全部范围或全部特征的全面公开。本文提供了式(i)的化合物或其药物可接受的盐或溶剂化物与第二化合物的组合,其中式(i)为其中m选自h和烷基;z选自cf3、cf2h和c2f5;各个r1、r2、r3和r4独立地选自h、烷基、芳烷基、氘代烷基、氘代芳烷基、氘代烷氧基、氘代环烷基、氘核、氘芳氧基、氘代芳氧基、氘代杂芳氧基、氘代芳基烷氧基、氘代杂芳基烷氧基、氘代卤代烷氧基、氘代卤代烷氧基、氘代氨基、氘代磺酰氨基、磺酰氨基、环烷基、环烯基、卤素、卤代烷基、烷氧基、卤代烷氧基、烷基硫基、卤代烷基硫基、五氟硫烷基、羟基烷基、三烷基甲硅烷基、炔基和烯基;以及其中第二化合物选自pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂、ox-40激动剂、cd137激动剂、lag-3抑制剂、ido抑制剂、双特异性蛋白质、egfr抑制剂、her2抑制剂和免疫刺激治疗剂。在另一个实施方案中,提供了包含治疗有效量的式(ii)的化合物和第二化合物的组合的药物组合物。在另一个实施方案中,提供了治疗癌症的方法,其包括向有需要的个体施用治疗有效量的式(i)的化合物和第二化合物的组合。附图简述图1示出了化合物a01、埃罗替尼、或其组合对于接种了结肠直肠癌细胞的小鼠中肿瘤体积(mm3)的作用。图2示出了化合物a01、抗pd1抗体、或其组合对于接种了结肠癌细胞的小鼠中肿瘤排斥的作用。图3示出了将cd8+t细胞的增长与肿瘤体积的减小相关联的线性回归。图4示出了化合物a01、抗pd1抗体、或其组合对于注射了结肠癌细胞的小鼠中的cd8+t细胞水平的作用。详述a.定义本文使用的术语“氘”意指单个氘原子,其中氘自由基连接至碳以形成氘代氘代化合物。如本文使用的,术语“烷基”和“亚烷基”是指具有指定碳原子数的支链和直链的饱和脂肪族烃基团。例如,“c1-c5烷基”中的“c1-c5”意指包括直链或支链排布中具有1、2、3、4或5个碳原子的基团。例如,“c1-c5烷基”具体地包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、戊基等。术语“环烷基”意指具有指定碳原子数的单环饱和脂肪族烃基团。例如,“环烷基”包括环丙基、甲基-环丙基、2,2-二甲基-环丁基、2-乙基-环戊基和环己基。如本文使用的,术语“烯基”和“亚烯基”是指具有指定碳数和至少一个碳-碳双键的支链和直链的不饱和或部分不饱和烃基团。术语“环烯基”意指具有指定碳原子数和至少一个碳-碳双键的单环不饱和或部分不饱和脂肪族烃基团。如本文使用的,术语“炔基”和“亚炔基”是指具有指定碳数和至少一个碳-碳三键的支链和直链的不饱和或部分不饱和烃基团。本文使用的术语“烷氧基”表示通过氧桥连接的指明碳原子数的环状或非环状烷基。因此,“烷氧基”包含上述烷基和环烷基的定义。本文使用的术语“芳基”意指任何稳定的每个环中至多7个原子的单环或二环碳环,其中至少一个环为芳香族的。此类芳基元素的实例包括苯基、萘基、四氢萘基、茚满基和联苯基。本文使用的术语“杂芳基”表示稳定的每个环中至多7个原子的单环或二环,其中至少一个环为芳香族的并且含有1至4个选自o、n和s的杂原子。本定义范围内的杂芳基包括但不限于:吖啶基、咔唑基、噌啉基、喹喔啉基、吡唑基、吲哚基、苯并三唑基、呋喃基、噻吩基、苯并噻吩基、苯并呋喃基、喹啉基、异喹啉基、噁唑基、异噁唑基、吲哚基、吡嗪基、哒嗪基、吡啶基、嘧啶基、吡咯基和四氢喹啉。本文使用的术语“卤代”或“卤素”包括氯、氟、溴和碘。本公开包括游离形式的式(i)的化合物,以及其药物可接受的盐和立体异构体。本文例示的一些具体化合物是胺化合物的质子化的盐。术语“游离形式”是指非盐形式的色烯化合物。涵盖的药物可接受的盐不仅包括针对本文描述的具体化合物所例示的盐,还包括游离形式的式(i)的化合物的所有典型的药物可接受的盐。可以使用本领域已知的技术来分离所描述的具体盐化合物的游离形式。本公开的药物可接受的盐可以通过常规化学方法由含有碱性或酸性部分的本公开的化合物来合成。当本公开的化合物为酸性的时,适合的“药物可接受的盐”是指由药物可接受的无毒碱制备的盐,所述碱包括无机碱和有机碱。应注意,本公开的化合物可能是内盐或两性离子,因为在生理条件下,化合物中的去质子化的酸性部分(例如羧基)可以是阴离子的,并且这种电子电荷可以在内部与质子化或烷基化的碱性部分(例如季氮原子)的阳离子电荷平衡。本文使用的术语“组合”表示使用式(i)或式(ii)的色烯化合物以及本文描述的第二化合物两者。所述组合包括两种化合物的共同呈现,例如试剂盒或共同包装的产品,以及患者对于分别获得或分别开出处方的两种化合物的使用。组合中的式(i)或式(ii)的色烯化合物可以在第二化合物之前、伴随第二化合物、在第二化合物之后或者与第二化合物交替施用于患者。免疫检查点蛋白是免疫系统的组成部分,其通常可以用于刺激或抑制免疫信号(例如,t细胞活化信号)。刺激性免疫检查点蛋白的非限制性实例包括cd27、cd40、ox40、gitr、cd137、cd28、hvem和icos。抑制性免疫检查点蛋白的非限制性实例包括腺苷a2a受体、b7-h3、b7-h4、btla、ctla-4、ido、kir、lag-3、pd-1、pd-l1、tim-3和vista(c10或f54)。免疫检查点调节化合物是调节免疫检查点蛋白的活动的任何化合物,例如抗体、小分子、生物制剂或多糖。免疫检查点蛋白的调节可以包括化合物作为激动剂、拮抗剂、变构效应剂的活动,或者改变免疫检查点蛋白的常规生物功能的来自与免疫检查点蛋白或蛋白配体的结合的任何作用。很多癌症表达了高水平的抑制性免疫检查点蛋白,以便规避t细胞和其他免疫系统组分的检测。使用拮抗剂抗体阻断抑制性免疫检查点蛋白(例如pd-1)增强了检测和破坏癌细胞的免疫反应。相反地,使用激动剂抗体活化刺激性免疫检查点蛋白(例如ox-40)增强了识别和破坏癌细胞的免疫反应。b.色烯化合物本公开涉及具有式(i)或式(ii)所示结构的色烯化合物。本申请公开的化合物和其药物可接受的盐可以应用于制备抗炎和镇痛药物以及治疗或预防肿瘤的药物。在一个实施方案中,本公开提供了包含式(i)的色烯化合物或其药物可接受的盐或溶剂化物以及第二化合物的组合:其中m选自h和烷基;z选自-cf3、-cf2h和-c2f5;各个r1、r2、r3和r4独立地选自h、烷基、芳烷基、氘代烷基、氘代芳烷基、氘代烷氧基、氘代环烷基、氘核、氘芳氧基、氘代芳氧基、氘代杂芳氧基、氘代芳基烷氧基、氘代杂芳基烷氧基、氘代卤代烷氧基、氘代卤代烷氧基、氘代氨基、氘代磺酰氨基、磺酰氨基、环烷基、环烯基、卤素、卤代烷基、烷氧基、卤代烷氧基、烷基硫基、卤代烷基硫基、五氟硫烷基、羟基烷基、三烷基甲硅烷基、炔基和烯基。当任何变量(例如,r1、z等)在任何组分中出现多于一次时,其在每次出现时的定义独立于每次其他的出现。并且,取代基和变量的组合仅在这些组合得到稳定化合物时被允许。从取代基画入环系统的线表示所示的键可以连接至任何可取代的环原子。如果环系统是多环的,其意指所述键仅连接至邻近的环上的任何适合的碳原子。应理解,本发明的化合物上的取代基和取代模式可以由本领域普通技术人员选择,以提供化学稳定并且可以容易地通过本领域已知的技术以及下文描述的那些方法由容易得到的起始材料来合成的化合物。除了文献中已公开或者在实验程序中充分验证的方法之外,式(i)的色烯化合物可以通过使用以下的反应来制备。因此,下文的合成方案仅是例示性的,并非意在限制化合物或任何具体的取代基。方案中的取代基的数量不需要与权利要求中限定的数量一致。此外,为了清楚起见,显示单个取代的式(i)或式(ii)的化合物可以允许具有多个取代基的化合物。在一个实施方案中,当z=-cf3时,式(i)的色烯可以根据文献(即,第6,034,256号美国专利)中描述的程序通过水杨酸醛(由相应的酚制备;参见wo2013/189121;cn102757417;cn103044477;和cn103012350;其各自通过引用并入本文)与4,4,4-三氟巴豆酸乙酯的反应来制备,或者当z=-cf2cf3时,使用4,4,5,5,5-五氟丁-2-烯酸乙酯(cas#[37759-78-7])来制备。或者,通过水杨酸醛与4,4,4-三氟巴豆醛和手性催化剂的反应,然后根据acsmed.chem.lett.2014,5,1162–1166中描述的程序进行氧化来制备其中z=-cf3的手性色烯酸。通过类似的方法使用4,4,5,5,5-五氟戊-2-烯醛制备其中z=-cf2cf3的手性色烯酸,所述4,4,5,5,5-五氟戊-2-烯醛由4,4,5,5,5-五氟戊-2-烯-1-醇使用下文所述的制备4,4,4-三氟巴豆醛(int-03)的相同程序来制备。在各种实施方案中,式(i)的化合物具有至少一个氘代氘代取代基,例如,氘代烷基、氘代环烷基和氘核。在一个实施方案中,r1、r2、r3和r4中的至少一个为氘代烷基、氘代环烷基或氘核。在一些实施方案中,组合中的色烯化合物具有式(ii)所示的结构,或其药物可接受的盐或立体异构体,或其前药分子:其中x选自o、s和nra;ra选自h、c1-c3烷基、c3-c6环烷基、被一个或两个卤素取代的c1-c3烷基、以及芳基;r选自羧基、酰氨基、烷基磺酰基、c1-c3环羰基、芳基取代的c1-c3环羰基和c1-c3烷氧基羰基、以及烷氧基羰基;r1选自卤代烷基、烷基、芳烷基、苯基和环烷基;r2选自以下基团中的一种或多种:氢、氘、卤素、烷基、氘代烷基、芳烷基、氘代芳烷基、烷氧基、氘代烷氧基、芳氧基、氘代芳氧基、杂芳氧基、氘代杂芳氧基、芳基烷氧基、氘代芳基烷氧基、杂芳基烷氧基、氘代杂芳基烷氧基、卤代烷氧基、氘代卤代烷氧基、卤代烷氧基、氘代卤代烷氧基、氨基、氘代氨基、磺酰氨基、五氟硫烷基和氘代磺酰氨基;以及n为选自1、2和3的整数。r3为氘代烷基。式(i)的色烯化合物的具体实施方案包括:表1:氘代化合物表2:非氘代化合物在另一个实施方案中,式(ii)的色烯化合物:其中x为o,ra选自h、c1-c3烷基、c3-c6环烷基、被一个或两个卤素取代的c1-c3烷基、和芳基;n为选自1、2和3的整数;r选自羧基和烷氧基羰基;r1选自卤代烷基、烷基、芳烷基和环烷基;各个r2独立地选自氘、卤素、烷基、氘代烷基、芳烷基、氘代芳烷基、卤代烷基、氘代卤代烷基、烷氧基、氘代烷氧基、芳氧基、氘代芳氧基、杂芳氧基、氘代杂芳氧基、芳基烷氧基、氘代芳基烷氧基、杂芳基烷氧基、氘代杂芳基烷氧基、卤代烷氧基、氘代卤代烷氧基、氨基、氘代氨基、磺酰氨基、和氘代磺酰氨基;并且r3为氘代烷基。在另一个实施方案中,7位未被取代;r为羧基或c1-c3烷氧基羰基;r1为卤代烷基;以及其组合。在另一个实施方案中,n为1或2;r为羧基或c1-c3烷氧基羰基;r1为卤代烷基、环烷基或苯基;r2为氘、卤素、烷基、氘代烷基、卤代烷基、氘代卤代烷基、烷氧基、氘代烷氧基、烷基氨基、氘代烷基氨基、烷基化磺酰氨基、和烷基化氘代磺酰氨基;或其组合,并且r2取代中的至少一个在6位。c.第二化合物式(i)的色烯化合物与第二化合物组合。第二化合物为小分子、药物、肽、抗体或药物试剂。在一个实施方案中,第二化合物可以为pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂、ox-40激动剂、cd137激动剂、lag-3抑制剂、ido抑制剂、双特异性蛋白质、egfr抑制剂、her2抑制剂或免疫刺激治疗剂。在一个实施方案中,第二化合物为pd-1抑制剂。pd-1抑制剂为免疫检查点调节剂,其作用于免疫检查点蛋白——程序性细胞死亡蛋白1,也被称为分化簇279(cd279)。pd-1存在于免疫细胞上,并且通常用作防止t细胞活化的“关闭开关”。在pd-1结合pd-l1时,这种抑制功能被活化,pd-l1存在于许多肿瘤上。在一些实施方案中,pd-1抑制剂选自纳武单抗(nivolumab)、pidilizumab、帕博利珠单抗(pembrolizumab)、amp-224(cas#1422184-00-6)、amp-514(medi0680,cas#1642374-69-3)、sti-a1110、tsr-043和aunp-12(aur-012,aurigene-012,aurigenenp-12)。在一个实施方案中,第二化合物为pd-l1抑制剂。pd-l1抑制剂为免疫检查点调节剂,其作用于免疫检查点蛋白——程序性死亡配体1,也被称为分化簇274(cd274)或b7同系物1(b7-h1)。pd-l1的高度表达已经显示出与增强的肿瘤侵略性和较低的生存率有关,因为肿瘤中pd-l1的上调可以使肿瘤规避免疫系统。这种现象通过pd-l1与pd-1的结合而发生,pd-l1抑制剂通过与pd-l1结合而防止这种现象发生。在一些实施方案中,pd-l1抑制剂选自rg7446、bms-936559(mdx1105,cas#1422185-22-5)、msb0010718c、sti-a1010、阿维单抗(avelumab)、阿特珠单抗(atezolizumab)和度伐单抗(durvalumab)。在一个实施方案中,第二化合物为ctla-4抑制剂。ctla-4抑制剂为免疫检查点调节剂,其作用于免疫检查点蛋白——细胞毒素t-淋巴细胞相关蛋白4,也被称为分化簇152(cd152)。ctla-4检查点蛋白在活化的t细胞和treg中表达,并且ctla-4与cd80或cd86的结合抑制了免疫功能。ctla-4可以通过竞争胜过cd28来起作用,或者通过阻止cd28与引起免疫刺激性作用的cd80或cd86的结合来起作用。ctla-4可以通过从抗原呈递细胞捕获并去除cd80和cd86来起作用。在一些实施方案中,ctla-4抑制剂选自伊匹单抗(ipilimumab)和tremelimumab。在一个实施方案中,第二化合物为ox-40激动剂。ox-40激动剂为免疫检查点调节剂,其作用于免疫检查点蛋白——肿瘤坏死因子受体超家族成员4(tnfrsf4),也被称为分化簇134(cd134)和ox-40。ox-40是二级共刺激性免疫检查点蛋白,在免疫活化后表达24至72小时。由于ox-40l与t细胞上的ox-40受体结合,阻止t细胞的死亡,并且增加细胞因子的产生,ox-40对维持免疫反应超过起初几天直至记忆反应是至关重要的。在一些实施方案中,ox40激动剂选自抗-ox40、tim3抗体和immutuneimp701。在一个实施方案中,第二化合物为cd137激动剂。cd137激动剂为免疫检查点调节剂,并且包括结合cd137蛋白的任何化合物,包括但不限于抗体和小分子。cd137也被称为肿瘤坏死因子受体超家族成员9(tnfrsf9)、4-1bb,并且由淋巴细胞活化(ila)来引入,其引起免疫系统的刺激。cd137可以通过活化的t细胞来表达,但是在cd8上比在cd4t细胞上有更大程度的表达。另外,在树突细胞、b细胞、滤泡树突细胞、自然杀伤细胞、粒细胞和炎症位点的血管壁细胞上发现cd137表达。在一些实施方案中,cd137激动剂选自urelumab和utomilumab。在一个实施方案中,第二化合物为lag-3抑制剂。lag-3抑制剂为免疫检查点调节剂,并且包括结合lag-3蛋白并阻止其对免疫系统的抑制性作用的任何化合物,包括但不限于抗体和小分子。lag-3的主要配体是mhcii类,其以比cd4更高的亲和力结合该配体。所述蛋白以与ctla-4和pd-1类似的方式将t细胞的细胞增殖、活化和体内平衡下调,并且已报导在treg抑制功能中具有重要作用。lag-3也帮助将cd8+t细胞维持在致耐受性状态,并且,与pd-1作用,在慢性病毒感染过程中帮助维持cd8耗尽。在一些实施方案中,lag-3抑制剂为bms-986016(cas#1683572-29-3)。在一个实施方案中,第二化合物为ido抑制剂。ido抑制剂为免疫检查点调节剂,并且包括与吲哚胺2,3-双加氧酶结合并且防止其向免疫系统发送抑制性信号的任何化合物,包括但不限于抗体和小分子。ido可以通过在细胞的微环境中消耗l-trp来允许肿瘤细胞逃避免疫系统。有大范围的人癌症,例如前列腺癌、结肠直肠癌、胰腺癌、宫颈癌、胃癌、卵巢癌、头癌、肺癌等,过表达人ido(hido)。在一些实施方案中,ido抑制剂选自gdc-0919(cas#1402836-58-1)、indoximod、1-甲基-d-色氨酸(nsc-721782)、nlg919(cas#1402836-58-1)epacadostat和去甲哈尔满。在一个实施方案中,第二化合物为含有至少两个域以结合至少两个靶标以便减小距离或引发生物反应或实现两者的双特异性蛋白质。在另一个实施方案中,双特异性蛋白质的活动通过刺激反应或阻止抑制性作用或两者来引起增强的免疫反应。双特异性蛋白质可以结合免疫细胞以及肿瘤细胞上的表位,所述免疫细胞包括但不限于t细胞或自然杀伤(nk)细胞。双特异性蛋白质的活动可以由于免疫细胞与肿瘤细胞的接近而引起免疫反应的增强。双特异性蛋白质的活动也可以由于抑制性检查点蛋白或其他免疫抑制性信号的抑制而引起免疫反应。双特异性蛋白质的活动也可以由于引发增强的免疫细胞活性的信号的激活而引起免疫反应。在一些实施方案中,双特异性蛋白质选自alt-801(cas#1188450-53-4)和medi-565(amg211,biib-024,cas#1419574-83-6)。在一个实施方案中,第二化合物为egfr抑制剂。egfr抑制剂是防止egfr的活化、上调或过表达(其可以通过多种途径实现)的化合物。对其他蛋白质起作用并且也防止egfr的活化、上调或过表达的化合物也被认为是egfr抑制剂。egfr上调或过表达由产生不受控制的细胞分裂的基因突变引起。egfr上调或过表达与多种癌症有关,包括但不限于肺鳞状细胞癌、肛门癌、胶质母细胞瘤和头颈的上皮肿瘤。在一些实施方案中,egfr抑制剂选自布吉他滨(brigatinib)、吉非替尼(gefitinib)、埃克替尼(icotinib)、来那替尼(neratinib)、阿法替尼(afatinib)、达克替尼(dacomitinib)、西妥昔单抗(cetuximab)、埃罗替尼(erlotinib)、夫拉平度(flavopiridol)、扎鲁目单抗(zalutumumab)、耐昔妥珠单抗(necitumumab)、利多卡因(lidocaine)、马妥珠单抗(matuzumab)、奥希替尼(osimertinib)、帕尼单抗(panitumumab)、pd168393(cas#194423-15-9)、拉帕替尼(lapatinib)、凡德他尼(vandetanib)、rindopepimut、卡奈替尼(canertinib)、humax-egfr和cimavax-egf。在一个实施方案中,第二化合物为her2抑制剂。her2也被称为cd340、erbb2或her2/neu。her2是可以活化多种细胞途径的致癌基因,包括mapk、pi3k/akt、磷脂酶c、pkc和stat途径。通过her2蛋白的信号转导促进细胞增殖并且抑制细胞凋亡。抑制her2将减少增殖并增加细胞凋亡。her2抑制剂包括小分子、her2拮抗剂、抑制性肽和抗her2抗体。在一些实施方案中,her2抑制剂选自ado-曲妥珠单抗emtansine、曲妥珠单抗(trastuzumab)和帕妥珠单抗(pertuzumab)。在一个实施方案中,第二化合物是免疫刺激治疗剂。免疫刺激治疗剂为充当刺激性途径的刺激剂或抑制性途径的抑制剂来调节免疫系统的活动的任何化合物,例如抗体、小分子、生物制剂或多糖,其可以不同于先前描述的分子和分子类别。这些治疗剂的作用机理可以包括作为激动剂、拮抗剂、变构效应剂、酶的活动,或者导致免疫系统对抗癌症增强的功效的任何活动。免疫刺激治疗剂可以抑制b7-h3,抑制nkg2a,连接至磷脂酰丝氨酸,连接至cd27以刺激免疫反应抵抗,拮抗腺苷a2受体,或者通过未知的机理起作用。在一些实施方案中,免疫刺激治疗剂选自vidapenant、varlilumab、monalizumab、kahr-102、bgb324(r-428,cas#1037624-75-1)、enoblituzumab、lirilumab、巴维昔单抗(bavituximab)、pidilizumab、bl-8040(cas#664334-36-5)、gdc-0919(nlg-919,rg607,cas#1402836-58-1)、ign-311(cas#1354846-06-2)、埃洛妥珠单抗(elotuzumab)、博纳吐单抗(blinatumomab)、samalizumab、普乐沙福(plerixafor)、ganitumab、pexodartinib、trabedersen和galunisertib。d.组合本文描述的式(i)的色烯化合物与已知适用于治疗或缓解类似疾病(例如癌症)的第二化合物组合使用。在组合施用中,可以通过施用途径并且以常用的剂量,与式(i)的化合物同时或者与式(i)的化合物相继施用第二化合物。色烯化合物可以在第二化合物之前或之后施用。当式(i)的色烯化合物与第二化合物同时使用时,可以使用包含式(i)的色烯化合物、第二化合物和任选的一种或多种另外的药物的药物组合物。组合疗法也包括式(i)的色烯化合物和第二化合物以重叠的时间安排施用的疗法。式(i)的色烯化合物当与第二化合物组合使用时可以以比式(i)的化合物单独使用时使用更低的剂量。在一个实施方案中,式(i)的色烯化合物与pd-1抑制剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代并且与pd-1的抑制剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与pd-1抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的pd-1抑制剂是纳武单抗、pidilizumab、帕博利珠单抗、amp-224、amp-514、sti-a1110、tsr-043、amp-514或aunp-12。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与pd-1的抑制剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与pd-1抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的pd-1抑制剂是纳武单抗、pidilizumab、帕博利珠单抗、amp-224、amp-514、sti-a1110、tsr-043、amp-514或aunp-12。在一个实施方案中,式(i)的色烯化合物与pd-l1抑制剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代并且与pd-l1的抑制剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与pd-l1抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的pd-l1抑制剂是rg7446、bms-936559、msb0010718c、sti-a1010、阿维单抗、atezolizumab或度伐单抗。在另一个实施方案中,式(i)的色烯化合物是非氘代的并且与pd-l1的抑制剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与pd-l1抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的pd-l1抑制剂是rg7446、bms-936559、msb0010718c、sti-a1010、阿维单抗、atezolizumab或度伐单抗。在一个实施方案中,式(i)的色烯化合物与ctla-4抑制剂组合。在另一个实施方案中,式(i)的色烯化合物是氘代的并且与ctla-4的抑制剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与ctla-4抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的ctla-4抑制剂是伊匹单抗或tremelimumab。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与ctla-4的抑制剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与ctla-4抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的ctla-4抑制剂是伊匹单抗或tremelimumab。在一个实施方案中,式(i)的色烯化合物与ox-40激动剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代并且与ox-40激动剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与ox-40激动剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的ox-40激动剂是抗ox40、tim3抗体或immutuneimp701。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与ox-40激动剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与ox-40激动剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的ox-40激动剂是抗ox40、tim3抗体或immutuneimp701。在一个实施方案中,式(i)的色烯化合物与cd137激动剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代,并且与cd137激动剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与cd137激动剂组合。在另一种实施方案中,与氘代的式(i)的色烯化合物组合的cd137激动剂是urelumab或utomilumab.在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与cd137激动剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与cd137激动剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的cd137激动剂是urelumab或utomilumab。在一个实施方案中,式(i)的色烯化合物与lag-3抑制剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代,并且与lag-3的抑制剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与lag-3抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的lag-3抑制剂是bms-986016。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与lag-3的抑制剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与lag-3抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的lag-3抑制剂是bms-986016。在一个实施方案中,式(i)的色烯化合物与ido抑制剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代,并且与ido的抑制剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与ido抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的ido抑制剂是gdc-0919、indoximod、1-甲基-d-色氨酸、nlg919、epacadostat或去甲哈尔满。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与ido的抑制剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与ido抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的ido抑制剂是gdc-0919、indoximod、1-甲基-d-色氨酸、nlg919、epacadostat或去甲哈尔满。在一个实施方案中,式(i)的色烯化合物与双特异性蛋白质组合。在另一个实施方案中,式(i)的色烯化合物被氘代,并且与双特异性蛋白质组合。在另一个实施方案中,化合物a01-a10中的一种或多种与双特异性蛋白质组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的双特异性蛋白质是alt-801或medi-565。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与双特异性蛋白质组合。在另一个实施方案中,化合物b01-b11中的一种或多种与双特异性蛋白质组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的双特异性蛋白质是alt-801或medi-565。在一个实施方案中,式(i)的色烯化合物与egfr抑制剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代,并且与egfr的抑制剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与egfr抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的egfr抑制剂是布吉他滨、吉非替尼、埃克替尼、来那替尼、阿法替尼、达克替尼、西妥昔单抗、埃罗替尼、夫拉平度、扎鲁目单抗、耐昔妥珠单抗、利多卡因、马妥珠单抗、奥希替尼、帕尼单抗、pd168393、拉帕替尼、凡德他尼、rindopepimut、卡奈替尼、humax-egfr或cimavax-egf。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与egfr的抑制剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与egfr抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的egfr抑制剂是布吉他滨、吉非替尼、埃克替尼、来那替尼、阿法替尼、达克替尼、西妥昔单抗、埃罗替尼、夫拉平度、扎鲁目单抗、耐昔妥珠单抗、利多卡因、马妥珠单抗、奥希替尼、帕尼单抗、pd168393、拉帕替尼、凡德他尼、rindopepimut、卡奈替尼、humax-egfr或cimavax-egf。在一个实施方案中,式(i)的色烯化合物与her2抑制剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代,并且与her2的抑制剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与her2抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的her2抑制剂是ado-曲妥珠单抗emtansine、曲妥珠单抗或帕妥珠单抗。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与her2的抑制剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与her2抑制剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的her2抑制剂是ado-曲妥珠单抗emtansine、曲妥珠单抗或帕妥珠单抗。在一个实施方案中,式(i)的色烯化合物与免疫刺激治疗剂组合。在另一个实施方案中,式(i)的色烯化合物被氘代,并且与免疫刺激治疗剂组合。在另一个实施方案中,化合物a01-a10中的一种或多种与免疫刺激治疗剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的免疫刺激治疗剂是vidapenant、varlilumab、monalizumab、kahr-102、bgb324、enoblituzumab、lirilumab、巴维昔单抗、pidilizumab、bl-8040、gdc-0919、ign-311、埃洛妥珠单抗、博纳吐单抗、samalizumab、普乐沙福、ganitumab、pexodartinib、trabedersen和galunisertib。在另一个实施方案中,式(i)的色烯化合物是非氘代的,并且与免疫刺激治疗剂组合。在另一个实施方案中,化合物b01-b11中的一种或多种与免疫刺激治疗剂组合。在另一个实施方案中,与氘代的式(i)的色烯化合物组合的免疫刺激治疗剂是vidapenant、varlilumab、monalizumab、kahr-102、bgb324、enoblituzumab、lirilumab、巴维昔单抗、pidilizumab、bl-8040、gdc-0919、ign-311、埃洛妥珠单抗、博纳吐单抗、samalizumab、普乐沙福、ganitumab、pexodartinib、trabedersen和galunisertib。在具体的实施方案中,化合物a01与以下之一组合:埃罗替尼、帕博利珠单抗、纳武单抗、atezolizumab、伊匹单抗、阿维单抗、druvalumab、曲妥珠单抗、西妥昔单抗、帕妥珠单抗或帕尼单抗。在具体实施方案中,化合物a01与埃罗替尼组合。本申请中的组合可以与可购得或开发中的其他传统抗炎药一起使用,以便增强抗炎和镇痛作用,所述抗炎药例如,诸如甾体抗炎药、非甾体抗炎药、inos抑制剂、ltb4受体刺激剂和lta4水解酶抑制剂的药物;或者,可以与抗生素、烷基化药物、抗代谢物、激素药物、免疫药物、干扰素药物和一些其他的药物组合一起使用,以便增强对肿瘤的治疗或抑制作用。e.施用和剂量范围基于标准制药技术,本公开的式(i)的化合物、第二化合物和其组合可以单独施用,或者作为与对于哺乳动物(例如人)药物可接受的赋形剂一起的药物组合来施用,例如,通过口服、皮下、腹膜内、静脉内、直肠、局部、眼、肺、鼻和胃肠外施用。在一个实施方案中,本公开的组合中的式(i)的色烯化合物以治疗有效的剂量存在。在一个实施方案中,治疗有效的剂量是足以引起当与健康对照或基线标准比较时至少70%的尿pge-m减少的量。尿pge-m可以通过诸如酶联免疫吸附测定(elisa)或质谱法的常规方式确定。健康对照可以是未患有癌症的个体。可以通过确定患者在开始用式(i)的色烯化合物和第二化合物的组合治疗之前的尿pge-m来得到基线标准。us2012/0016002描述了确定个体的尿pge-m的方法,并且通过引用以其整体并入本文。在一个实施方案中,式(i)的色烯化合物的剂量为约0.1mg/kg/天至约100mg/kg/天。剂量可以以单个的日剂量施用,或者以每天两次、三次、四次或更多次施用,或者以缓释形式施用。在一个实施方案中,第二化合物的量以治疗有效量存在。在另一个实施方案中,第二化合物的治疗有效量为约0.01mg/kg/天至约250mg/kg/天。在另一个实施方案中,当第二化合物与式(i)的化合物组合施用时比单独施用时,第二化合物的治疗有效量更少。第二化合物的具体治疗有效量在表3中公开。表3:第二化合物的治疗有效剂量f.癌症治疗:本公开的组合适用于治疗癌症。在一个实施方案中,治疗癌症的方法包括向有需要的个体施用治疗有效量的本文描述的式(i)的色烯化合物和第二化合物的组合。在具体的实施方案中,癌症选自黑素瘤、非小细胞肺癌、结肠直肠癌、头颈癌、肾细胞癌、淋巴瘤、尿路上皮癌、梅克尔细胞癌、胰腺癌、乳腺癌、胃癌、肠癌、子宫内膜癌、肝胆道癌、尿道癌、脑癌、皮肤癌、胶质母细胞瘤、前列腺癌和卵巢癌。在具体的实施方案中,癌症为结肠直肠癌、胃癌、非小细胞肺癌、乳腺癌、胰腺癌、前列腺癌或头颈鳞状细胞癌。在另一个实施方案中,所述方法还包括确定所述个体的癌症中主要组织相容性复合体(mhc)i型的表达,以及当癌症显示出mhci型的阳性表达时,施用式(i)的色烯化合物和第二化合物的组合。mhci型表达可以被分为高、低或阴性,其中高表达和低表达被认为是“阳性”mhci型表达。mhci型表达可以通过免疫组织化学(ihc)分析或其他临床测定来量化。“高”和“低”的表达可以通过本领域普通技术人员来确定。使用定制多重珠阵列(r&d系统)来测量可溶mhci型多肽相关序列a(smica)、smicb、可溶ul16-结合蛋白(sulbp)-1、sulbp-2、sulbp-3和sulbp-4。使用基于luminex的bio-plex系统(bio-rad)来分析基于珠的测定。关于确定可溶mhci型多肽相关链a(smica)的水平的方法的更多的信息参见koguchi等人cancerres.2015。由本领域技术人员(例如,临床病理学家)通过标准方法确定的mhci型蛋白表达的存在性是对所要求保护的组合治疗的阳性反应的预测指标。参见simpson等人gut2010。在另一个实施方案中,所述方法还包括确定所述个体的癌症中pd-l1的表达,以及当癌症显示出pd-l1的阳性表达时,向所述个体施用式(i)的色烯化合物和第二化合物的组合。pd-l1可以通过本领域常规的方法(例如ihc测定)来确定。在一个实施方案中,如果针对pd-l150%或更多的肿瘤细胞染色,则肿瘤可以被认为是pd-l1表达阳性。在另一个实施方案中,所述方法还包括确定所述个体的癌症中瘤内t细胞的水平,以及当癌症显示出升高的瘤内t细胞水平时,向所述个体施用式(i)的色烯化合物和第二化合物的组合。根据simpson等人,gut2010,在结肠直肠癌中,通过ihc染色的标准方法来评估,大于15个t细胞/mm2被认为是高的或升高的瘤内t细胞水平。根据dieciannalsofoncology2015,在乳腺癌中,根据salgado等人annoncol(2015)中公开的方法,如果有大于或等于50%的瘤内t细胞(it-til)或基质t细胞(str-til),则将情况定义为升高的或含有高的瘤内t细胞,也被称为肿瘤浸润淋巴细胞(til)。在另一个实施方案中,所述方法还包括确定个体的尿pge-m水平,以及当尿pge-m水平升高时,向所述个体施用式(i)的色烯化合物和第二化合物的组合。当尿pge-m水平是正常值上限(uln)的至少1.5倍时,尿pge-m水平被认为是“升高的”。对于男性,升高的尿pge-m水平将会为>15ng/mg肌酸酐(uln为10ng/mg肌酸酐)。对于女性,升高的尿pge-m水平将会为>9ng/mg肌酸酐(uln为6ng/mg肌酸酐)。在另一个实施方案中,测量了患有选自结肠直肠癌、非小细胞肺癌、乳腺癌、胃癌、胰腺癌、前列腺癌或头颈鳞状细胞癌的癌症的个体的尿pge-m水平。在另一个实施方案中,结肠直肠癌、非小细胞肺癌、乳腺癌、胃癌、胰腺癌、前列腺癌或头颈鳞状细胞癌处于阶段iii或阶段iv。在另一个实施方案中,所述方法还包括确定个体的微卫星不稳定性(msi)水平,以及当msi高、低或稳定时,施用式(i)的色烯化合物和第二化合物的组合。msi可以通过本领域常规方式确定,例如通过对于特定dna重复序列的基于pcr的测定或者错配修复(mmr)蛋白的ihc测定(参见例如,vilar等人,nat.rev.clin.oncol,2010;bupathi等人j.gastrointest.oncol,2016;dudley等人,clincancerres.2016;sinicrope等人,clin.gastroenterol.hepatol.,2016;以及kautto等人,oncotarget,2016)。在一个实施方案中,高水平的msi可以定义为两个或更多个基因座的不稳定,或者标记的较大面板(panel)中>30%的基因座的不稳定;低水平的msi可以定义为一个基因座的不稳定,或者较大面板中10-30%的基因座的不稳定;并且微卫星稳定可以被定义为任何基因座均无不稳定,或者较大面板中<10%的基因座的不稳定。在另一个实施方案中,所述方法还包括当癌症为结肠直肠癌、胃癌、子宫内膜癌、卵巢癌、肝胆道癌、尿道癌、脑癌或皮肤癌时,确定微卫星不稳定性。在另一个实施方案中,所述方法还包括根据标准流式细胞计数方法确定cd8+/foxp3表达细胞的比例,以及当cd8+/foxp3比例>1时(据报道其预示着卵巢癌和尿路上皮癌的优秀临床结果,preston等人plosone.2013以及baras等人,oncoimmunology2016),施用式(i)的色烯化合物和第二化合物的组合。在具体的实施方案中,治疗肺癌的方法包括施用化合物a01和埃罗替尼的组合。在具体的实施方案中,治疗结肠直肠癌的方法包括施用化合物a01和帕博利珠单抗的组合。在具体的实施方案中,治疗黑素瘤的方法包括施用化合物a01和帕博利珠单抗的组合。在具体的实施方案中,治疗结肠直肠癌的方法包括施用化合物a01和atezolizumab的组合。在具体的实施方案中,治疗肺癌的方法包括施用化合物a01和atezolizumab的组合。g.药物组合物:含有式(i)的色烯化合物、第二化合物或其组合的药物组合物可以是适于口服施用的形式,例如,片剂、糖锭剂、水性悬浮液或油性悬浮液、可分散粉末或可分散颗粒、乳液、硬胶囊或软胶囊、或者糖浆或酏剂。用于口服施用的组合物可以根据药物组合物制造领域中已知的任何方法来制备,并且此类组合物可以含有一种或多种选自甜味剂、增味剂、着色剂和防腐剂的赋形剂或试剂,以便提供药物上高品质并且可口的制剂。片剂含有与有适于制造片剂的无毒的药物可接受的赋形剂混合的活性成分。这些赋形剂可以为,例如,惰性稀释剂,例如碳酸钙、碳酸钠、乳糖、磷酸钙或磷酸钠;粒化剂和崩解剂,例如,微晶纤维素、交联羧甲基纤维素钠、玉米淀粉或海藻酸;粘合剂,例如淀粉、明胶、聚乙烯基吡咯烷酮或阿拉伯胶;以及润滑剂,例如,硬脂酸镁、硬脂酸或滑石。片剂可以是未包衣的,或者其可以通过已知的技术包衣,以掩蔽药物的令人不快的味道,或者延迟在胃肠道中的崩解和吸收,从而提供经过较长时间的持续作用。例如,可以使用水溶性味道掩蔽材料,例如羟丙基甲基纤维素或羟丙基纤维素,或者可以使用延时材料,例如乙基纤维素或乙酸丁酸纤维素。片剂的剂量可以为0.1mg/tab、0.2mg/tab、0.25mg/tab、0.5mg/tab、1mg/tab、2mg/tab、5mg/tab、10mg/tab、25mg/tab、50mg/tab、100mg/tab和250mg/tab。诸如胶囊的其他形式的剂量可以类似地参考。用于口服使用的制剂也可以表现为其中活性成分与惰性固体稀释剂混合的硬明胶胶囊,所述惰性固体稀释剂例如,碳酸钙、磷酸钙或高岭土;或者表现为其中活性成分与水溶性载体混合的软明胶胶囊,所述水溶性载体例如聚乙二醇或油介质,例如花生油、液体石蜡或橄榄油。水性悬浮液含有与适于水性悬浮液制备的赋形剂混合的活性材料。此类赋形剂包括悬浮剂,例如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、海藻酸钠、聚乙烯基吡咯烷酮、黄芪胶和阿拉伯胶;分散剂或润湿剂可以是天然存在的磷脂,例如卵磷脂,或者氧化烯与脂肪酸的缩合产物,例如聚氧乙烯硬脂酸酯,或者环氧乙烷与长链脂肪族醇的缩合产物,例如十七乙烯氧基鲸蜡醇,或者环氧乙烷与来自脂肪酸和己糖醇的偏酯的缩合产物,例如聚氧乙烯山梨糖醇单油酸酯,或者环氧乙烷与来自脂肪酸和己糖醇酐的偏酯的缩合产物,例如聚乙烯山梨糖醇酐单油酸酯。水性悬浮液还可以包含一种或多种防腐剂,例如对羟基苯甲酸乙酯或对羟基苯甲酸正丙酯,一种或多种着色剂,一种或多种增味剂,以及一种或多种甜味剂,例如蔗糖、糖精或阿斯巴甜。油性悬浮液可以通过将活性成分悬浮于植物油或矿物油中来配制,所述植物油例如花生油、橄榄油、芝麻油或椰子油,所述矿物油例如液体石蜡。油性悬浮液可以含有增稠剂,例如蜂蜡、硬石蜡或鲸蜡醇。甜味剂例如上文描述的那些甜味剂,并且可以添加增味剂以提供可口的口服制剂。这些组合物可以通过添加诸如丁基羟基茴香醚或α-生育酚的抗氧化剂来保藏。适于通过添加水来制备水性悬浮液的可分散粉末和颗粒提供了与分散剂或润湿剂、悬浮剂以及一种或多种防腐剂混合的活性成分。适合的分散剂或润湿剂以及悬浮剂已经通过上文提及的那些试剂例示。也可以存在另外的赋形剂,例如甜味剂、增味剂和着色剂。这些组合物可以通过添加诸如抗坏血酸的抗氧化剂来保藏。本公开的药物组合物还可以为水包油乳液的形式。油相可以为植物油,例如橄榄油或花生油,或者为矿物油,例如液体石蜡,或者为这些油的混合物。适合的乳化剂可以为天然存在的磷脂,例如大豆卵磷脂;以及来源于脂肪酸和己糖醇酐的酯或偏酯,例如失水山梨糖醇单油酸酯;以及所述偏酯与环氧乙烷的缩合产物,例如聚氧乙烯失水山梨糖醇单油酸酯。乳液还可以包含甜味剂、增味剂、防腐剂和抗氧化剂。糖浆和酏剂可以用甜味剂配制,所述甜味剂例如甘油、丙二醇、山梨糖醇或蔗糖。此类制剂也可以含有缓和剂、防腐剂、增味剂、着色剂和抗氧化剂。药物组合物可以为无菌可注射水性溶液的形式。在可接受的载体和溶剂中,可以使用水、林格氏溶液和等渗氯化钠溶液。无菌可注射制剂也可以是其中活性成分溶解于油相的无菌可注射水包油微乳液。例如,活性成分可以首先溶解于豆油和卵磷脂的混合物中。然后将油溶液引入水和甘油的混合物,并且加工以形成微乳液。可注射溶液或微乳液可以通过局部快速浓注来引入患者的血流。或者,以维持本发明化合物的恒定循环浓度的方式施用溶液或微乳液可以是有利的。为了维持这样的恒定浓度,可以使用连续静脉内递送装置。此类装置的一个实施方案是delteccadd-plustm5400型静脉泵。药物组合物可以为用于肌内施用和皮下施用的无菌可注射水性或油性悬浮液的形式。这种悬浮液根据已知技术并使用上文提及的那些适合的分散剂或润湿剂以及悬浮剂来配制。无菌可注射制剂也可以是在无毒胃肠外可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如作为在1,3-丁二醇中的溶液。另外,非挥发性油通常用作溶剂或悬浮介质。为此,可以使用任何温和的非挥发性油,包括合成的甘油单酯或甘油二酯。另外,发现诸如油酸的脂肪酸可用于制备注射剂。式(i)的色烯化合物、第二化合物或其组合也可以以用于直肠施用药物的栓剂形式来施用。这些组合物可以通过将药物与适合的非刺激性赋形剂混合来制备,该赋形剂在常温下为固体,但在直肠温度下为液体,因此将在直肠中熔化以释放药物。此类材料包括可可油、甘油明胶、氢化植物油、各种分子量的聚乙二醇的混合物以及聚乙二醇的脂肪酸酯。为了局部使用,使用了含有式(i)的色烯化合物、第二化合物或其组合的乳膏、软膏、胶冻、溶液或悬浮液等(为了该应用,局部应用应包括漱口药和漱口剂)。本公开的式(i)的色烯化合物、第二化合物和其组合可以通过局部使用适合的鼻内载体和递送装置来以鼻内形式施用,或者通过使用本领域普通技术人员熟知的那些经皮贴片形式来以经皮途径施用。为了以经皮递送系统的形式施用,当然,在整个剂量方案中,剂量施用将是连续的而不是间歇的。本公开的化合物和组合也可以作为使用以下基质的栓剂来递送;例如可可油、甘油明胶、氢化植物油、各种分子量的聚乙二醇的混合物以及聚乙二醇的脂肪酸酯。当本公开的化合物向人个体施用时,日剂量通常将由处方医师来确定,剂量通常根据个体患者的年龄、体重、性别和反应、以及患者症状的严重性而变化。h.代谢物和前药:本公开的组合还包括式(i)的色烯化合物和第二化合物的代谢物和/或前药的组合。在一个实施方案中,该组合包含色烯化合物的代谢物或前药以及第二化合物。在另一个实施方案中,该组合包含色烯化合物以及第二化合物的代谢物或前药。在另一个实施方案中,该组合包含色烯化合物的代谢物或前药以及第二化合物的代谢物或前药。实施例实施例1:组合在结肠细胞癌中的抗肿瘤作用该研究评估了与埃罗替尼组合的(s)-6-溴-8-三氘代甲基-2-(三氟甲基)-2h-色烯-3-甲酸(化合物a01),选择性环加氧酶2(cox-2)抑制剂,对于ht-29异种移植鼠结肠癌模型中的肿瘤生长的作用。将ht-29细胞在培养基中培养一周。在消化后将细胞以800-1500rpm离心3-5分钟。将细胞用pbs洗涤,并且在相同的条件下再次离心。然后将细胞悬浮于pbs中,直至最终浓度为12.5x107个细胞/ml。将200μl的ht-29细胞悬浮液皮下注射至小鼠左前肢腋窝(2.5x106个ht-29细胞/小鼠)。对48只cb17scid雄性小鼠植入2.5x106个ht29细胞。使用卡尺和等式:v=π×ab2/6来对每只动物计算肿瘤的生长。一旦肿瘤达到约75mm3的尺寸,则将小鼠随机分配至6个处理组之一:媒介物,1mg/kg化合物a01,1mg/kg化合物a01+50mg/kg埃罗替尼,10mg/kg化合物a01,10mg/kg化合物a01+50mg/kg埃罗替尼,50mg/kg埃罗替尼。将化合物a01溶解于2%dmso、4%乙醇、4%蓖麻油和90%ddh2o中。将化合物a01和埃罗替尼通过口服灌胃每日施用,在随机分配后立即开始,并且持续22天。小鼠重量和肿瘤体积测量在随机分配后第0、3、6、9、12、15、18、21和22天进行。在第24天从每只动物收集肿瘤组织,以确定化合物a01、埃罗替尼和pge2水平。所有的动物均发展了肿瘤。在研究过程中,处理组之间的体重不存在差异(表6)表6:体重(g)当与媒介物处理的小鼠比较时,1mg/kg化合物a01+50mg/kg埃罗替尼的组合减缓了66%的肿瘤生长。当与媒介物处理的小鼠比较时,10mg/kg化合物a01+50mg/kg埃罗替尼的组合减缓了60%的肿瘤生长。与媒介物相比,10mg/kg化合物a01单独产生了51%的肿瘤生长抑制,而当与媒介物相比时,单独的埃罗替尼产生了38%的肿瘤生长抑制(表7,图1)。表7:处理组的肿瘤体积(mm3)埃罗替尼的口服剂量影响着给药后2小时和6小时的化合物a01的血浆浓度(表8)。表8:化合物a01和埃罗替尼的血浆浓度(平均值±sd,μg/l)当与不存在单独的埃罗替尼时肿瘤内化合物a01的量相比时,埃罗替尼的添加提升了化合物a01的肿瘤内水平1.5倍(表9)。表9:化合物a01和埃罗替尼的肿瘤内浓度(平均值±sd,ug/g)处理组化合物a01埃罗替尼媒介物00化合物a011mg/kg1478.5±652.1化合物a011mg/kg+埃罗替尼-50mg/kg2243.5±887.113225±3017.7化合物a0110mg/kg9720±2758.7化合物a0110mg/kg+埃罗替尼-50mg/kg14745±47587800±3299埃罗替尼-50mg/kg<80单独的或与埃罗替尼组合的化合物a01将肿瘤内的pge2水平抑制66-100%(表10)。表10:pge2的肿瘤内浓度(平均值±sd,ug/g)处理组pge2媒介物246.7±104.3化合物a011mg/kg14.01±30.3化合物a011mg/kg+埃罗替尼-50mg/kg85.3±110.9化合物a0110mg/kg0化合物a0110mg/kg+埃罗替尼-50mg/kg12.8±18.3埃罗替尼-50mg/kg160.6±89.5对于减缓肿瘤生长,单独的化合物a01优于50mg/kg埃罗替尼。然而,当与媒介物相比时,化合物a01+埃罗替尼的组合相比各个单独的治疗显示出了最大的肿瘤生长抑制。当与埃罗替尼组合时,以1mg/kg或10mg/kg给予的化合物a01之间差异小。实施例2:组合在结肠细胞癌中的抗肿瘤作用该实验评估了与埃罗替尼组合的化合物a01对于ct26异种移植鼠结肠癌模型中的肿瘤生长的作用。将ct26.wt细胞在标准条件下培养。将所述细胞用胰蛋白酶收获,并且用pbs洗涤。将105个细胞以100μl的总体积注射至6周龄雌性balb/c小鼠的右胁腹中。将肿瘤尺寸量化为最长直径及其垂直直径的平均值。从第0天起,小鼠每天口服(pero.s.)接受塞来昔布(celecoxib)、化合物a01或媒介物(10%dmso/50%peg400/40%水)。在肿瘤细胞接种后第5天至第9天(当平均肿瘤直径为约5mm时),将抗-pd-1单克隆抗体(克隆rmp1-14,bioxcell)以200μg/小鼠腹膜内施用,然后每3天至4天进行最大六次注射。接受cox-2抑制剂(化合物a01或塞来昔布)和抗pd1抗体的组合治疗的小鼠在接种后长达50天完全排斥了肿瘤。相比之下,单一的治疗(单独的塞来昔布、化合物a01或抗pd1抗体)未阻止肿瘤生长(图2)。没有治疗方案引起体重减轻。与媒介物处理的小鼠相比,组合治疗降低了il-6、ifn-γ、il-1β、tnf-α和pge2的肿瘤内水平。实施例3:组合对于结肠细胞癌的免疫反应的作用如实施例2中,将雌性balb/c小鼠接种105个ct26结肠直肠癌细胞。每天口服施用cox-2抑制剂(塞来昔布或化合物a01)或媒介物。在接种后第9天和第14天腹膜内施用抗pd1抗体(200μg/小鼠)。在第16天(首次抗pd1施用后7天)分析肿瘤。在第16天,各组之间的肿瘤尺寸或重量不存在差异。与媒介物处理的小鼠相比,使用化合物a01单一治疗或组合治疗具有cd45+细胞(白细胞)、cd3+、cd8+、cd8+ifnγ+、cd4+ifnγ+、cd8+tnfα+和cd4+tnfα+细胞渗透进入肿瘤的增加。抗pd1抗体单独或与cox-2抑制剂结合的施用增加了肿瘤内cd4+foxp3+细胞的数量。单独的化合物a01的处理增大了cd8+t细胞与foxp3+t细胞的比例。单独的塞来昔布的处理未增大cd8+t细胞与foxp3+t细胞的比例。对于gr-1+骨髓来源抑制器细胞(mdsc)没有明显的作用。组合治疗增加了脾cd4+ifnγ+细胞的数量。实施例4:色烯和抗pd-l1抗体的组合对于肿瘤生长和免疫反应的作用该实验评估了对于鼠结肠癌模型中单独的和与抗pd-l1抗体结合的化合物a01的治疗的免疫反应的作用。如实施例2中所述制备ct26鼠结肠癌细胞。雌性envigobalb/c(balb/cannhsd)在腋窝高处(就在前肢下面)皮下接种悬浮于pbs(200μl)的5×105个ct26细胞。将小鼠分成七个组:媒介物(组1),抗体对照(大鼠igg2b同种型)(组2),抗-mpd-l1(克隆10f9g2)(组3),化合物a01(组4),化合物a01+抗体对照(组5),化合物a01+抗-mpd1-l1(组6),以及1mg/kg化合物a01+抗-mpd-l1(组7)。在接种后第3、6、9、12和16天通过腹膜内注射施用抗体。每天口服给予化合物a01。将小鼠在第16天的最终给药后2小时进行安乐死,并且制备样品用于检测。与媒介物和同种型对照相比,使用化合物a01的处理减缓了肿瘤生长,或者使用抗-mpd-l1的处理减缓了肿瘤生长(除非指明,所有的剂量为10mg/kg)。表11:化合物a01和抗-mpd-l1对于肿瘤生长的作用(mm3)*:1mg/kg化合物a01在安乐死后,将肿瘤移除并处理以回收活细胞。去除红细胞。对细胞进行表面标记染色,并且在适合时,进行透化以便细胞内染色。将细胞洗涤,并且悬浮于流式细胞计数染色缓冲液中,并且通过流式细胞计数进行分析。表12示出了化合物a01(10mg/kg,除非另外指明)和抗-mpd-l1(10mg/kg)对于免疫反应的作用。单独的和与抗-mpd-l1组合的化合物a01提高了肿瘤内cd4+cd8-t细胞的百分比(对于总cd45+细胞而言)。化合物a01和抗-mpd-l1均提高了肿瘤内cd8+cd4-t细胞的百分比(对于总cd45+细胞而言)。化合物a01降低了ki67+cd8+和pd-1+cd8+t细胞的水平(对于总cd8+cd4-t细胞而言)。处理对于treg(cd25+foxp3+)和mdsc(cd11b+ly6g+)的相对数量(作为总cd45+细胞的百分比)具有最小的作用。组合处理提高了cd8+t细胞与treg的比例。图3将cd8+细胞百分比与肿瘤退化相关联。图4示出了cd8+组之间的统计差异。表12:化合物a01和抗-mpd-l1对于肿瘤内免疫反应的作用*:1mg/kg化合物a01实施例5:化合物a01对于ht-29肿瘤生长和肿瘤内pge2的作用该研究比较了化合物a01和塞来昔布对于ht-29异种移植鼠结肠癌模型中肿瘤pge-2效应的作用。使用与实施例1相同的程序,通过标准方法制备并植入ht-29细胞。对42只cb17scid小鼠植入2.5×106个ht-29细胞。一旦肿瘤达到75mm3的尺寸,则将小鼠随机分配至六个处理组之一:媒介物,10mg/kg塞来昔布,0.1mg/kg化合物a01,0.3mg/kg化合物a01,1mg/kg化合物a01,3mg/kg化合物a01,10mg/kg化合物a01。将化合物a01溶解于2%dmso、4%乙醇、4%蓖麻油和90%ddh2o中。将化合物a01和塞来昔布通过口服灌胃每日施用,在随机分配后立即开始,并且持续22天。小鼠重量和肿瘤体积测量在随机分配后第0、3、6、9、12、15、18、21和22天进行。在22天的给药后,在给药后2小时和6小时从每只动物收集血液。检测化合物a01在血浆中的浓度。在第24天从每只动物收集肿瘤组织以确定化合物a01、塞来昔布和pge2水平。表13示出了10mg/kg塞来昔布或各种剂量的化合物a01对于肿瘤体积的作用。表14示出了用化合物a01或塞来昔布处理后的平均肿瘤内pge-2血浆浓度。表13:处理组的肿瘤体积(mm3)表14:处理组的肿瘤pge-2血浆浓度实施例6:化合物a01对于ct26肿瘤生长和肿瘤内pge2的作用该实验评估了化合物a01与塞来昔布相比的功效,以及它们在具有ct26.wt鼠结肠癌的balc/c雌性小鼠中对于前列腺素e2(pge2)水平和t细胞抑制的作用。另外,进行了化合物a01在血液和肿瘤中的浓度的分析。如实施例2所述制备ct26鼠结肠癌细胞。雌性harlanbalb/c小鼠(balb/cannhsd)在腋窝高处(就在前肢下面)皮下接种悬浮于pbs(200μl)的5×105个ct26细胞。在第8天当所有动物的平均肿瘤负荷为约79mm3时,基于肿瘤负荷的卡尺测量估计将所有的小鼠分类至研究组(组平均值范围,75-83mm3)。将小鼠分成10组:媒介物对照(组1),30mg/kg化合物a01(组2),10mg/kg化合物a01(组3),3mg/kg化合物a01(组4),1mg/kg化合物a01(组5),0.3mg/kg化合物a01(组6),30mg/kg塞来昔布(组7),以及10mg/kg塞来昔布(组8)。表15示出了10mg/kg塞来昔布或各种剂量的化合物a01对于肿瘤体积的作用。表16示出了用化合物a01或塞来昔布处理后的平均肿瘤内pge-2血浆浓度。表15:处理组的ct26肿瘤体积(mm3)表16:处理组的ct26肿瘤pge-2血浆浓度(ng/g)处理组平均pge-2浓度标准偏差媒介物(组1)1180610化合物a0130mg/kg(组2)15060化合物a011mg/kg(组5)278141化合物a010.3mg/kg(组6)670300塞来昔布10mg/kg(组8)1140690实施例7:化合物a01和抗-pd-l1对于ct26肿瘤生长和肿瘤内pge2的作用该实验评估了鼠结肠癌模型中用单独的或与抗-pd-l1抗体组合的化合物a01的处理对于pge-2血浆浓度的作用。如实施例4中所述制备ct26鼠结肠癌细胞。如实施例4中所述,对雌性envigobalb/c(balb/cannhsd)小鼠接种5×105个ct26细胞。然后将小鼠分成对照组和处理组,其中使用单独的或与抗-pd-l1抗体组合的化合物a01来处理。确定肿瘤尺寸和肿瘤pge-2血浆浓度。上文提及的实施方案仅说明本公开的各方面。这些实施方案不应被认为是对本专利的任何限制。应注意,在不偏离本发明概念的情况下,本领域技术人员可以进行各种改变和改进,并且那些改变和改进应落入本发明的保护范围内。因此,本发明的保护范围受限于权利要求。所有提及的文件通过引用并入本文,如同在本文中撰写。当引入本公开的要素或其示例性实施方案时,冠词“一个/种(a)”、“一个/种(an)”、“所述(the)”和“所述(said)”意指存在一个或多个所述要素。术语“包含(comprising)”、“包括(including)”和“具有(having)”意指包括性的,并且意指可以存在不同于所列要素的另外的要素。虽然本发明已就具体实施方案进行了描述,但这些实施方案的详细内容不应被解释为限制。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1