产生生物表面活性剂的重组微生物的制作方法
本发明公开一种涉及使用了微生物的生物表面活性剂的制造的技术。
背景技术:
脂肪酶是切断构成植物油脂等油脂类的甘油三酯的酯键、分解为脂肪酸和甘油的酶。很多生物拥有脂肪酶,脂肪酶不仅用于生物体内的反应,而且用于很多工业用途。
生物表面活性剂是微生物所生产的天然的表面活性剂,生物降解性高,环境负担低,具有各种有益的生理功能。因此,如果在食品工业、化妆品工业、医药品工业、化学工业、环境领域等中使用生物表面活性剂,则在实现环境和谐型的社会方面有意义。
生物表面活性剂被分类为糖脂系、乙酰肽系、磷脂系、脂肪酸系及高分子系5种。它们当中,糖脂系的表面活性剂得到最多的研究。作为此种糖脂系的生物表面活性剂,已知有在将赤藓醇与甘露糖进行糖苷键合而得的甘露糖赤藓糖醇(以下也称作me。)上再酯键合脂肪酸而得的甘露糖赤藓糖醇脂(以下也称作mel。)、以及鼠李糖脂、黑粉菌酸(ユスチラジン酸)、海藻糖脂、以及槐糖脂等。
关于mel,报告过很多以植物油脂等油脂类为原料制造的例子。例如,非专利文献1及2中,报告过能够使用假丝酵母属(candidasp.)b-7株由5质量%的大豆油在5天中生产35g/l(生产速度:0.3g/l/h、原料收率:70质量%)的mel。非专利文献3及4中,报告过能够使用南极假丝酵母(candidaantarctica)t-34株由8质量%的大豆油在8天中生产38g/l(生产速度:0.2g/l/h、原料收率:48质量%)的mel。
非专利文献5中,报告过能够使用南极假丝酵母t-34株利用以6天间隔共计3次的逐次流加在24天后由25质量%的花生油生产110g/l(生产速度:0.2g/l/h、原料收率:44质量%)的mel。非专利文献6中,报告过能够使用假丝酵母(candidasp.)sy-16株由10质量%的植物油脂利用间歇培养法在200小时中生产50g/l(生产速度:0.25g/l/h、原料收率:50质量%)的mel,并且能够利用流加培养法由20质量%的植物油在200小时中生产120g/l(生产速度:0.6g/l/h、原料收率:50质量%)的mel。
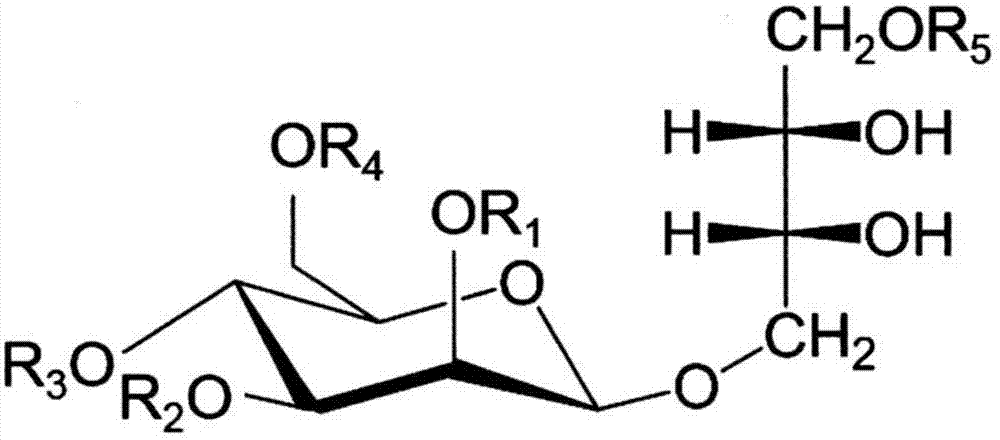
mel中存在有键合的脂肪酸残基以及乙酰基的位置及个数等彼此不同的各种结构。图1中,表示出将氢原子、乙酰基、以及碳原子数3~18的脂肪酸残基以r1~r5表示的mel的结构式。r1及r2为脂肪酸残基且r3及r4为乙酰基的结构物被定义为mel-a,r3为氢原子且r4为乙酰基的结构物被定义为mel-b,r3为乙酰基且r4为氢原子的结构物被定义为mel-c,r3及r4为氢原子的结构物被定义为mel-d。根据与甘露糖键合的赤藓醇的羟甲基是来自于1位的碳、还是来自于4位的碳,所得的me的结构如图2(a)、(b)所示彼此不同。所述南极假丝酵母t-34株生成以图2(a)所示的4-o-β-d-吡喃甘露糖基(mannopyranosyl)-赤藓糖醇(erythritol)作为糖骨架的化合物。也将所得的4-o-β-d-吡喃甘露糖基-赤藓糖醇脂(erythritollipid)称作4-o-β-mel。
很多种类的微生物生成上述的4-o-β-mel,然而筑波类酵母(pseudozymatsukubaensis)以橄榄油为原料,生成以图2(b)所示的1-o-β-d-吡喃甘露糖基-赤藓糖醇作为糖骨架的1-o-β-d-吡喃甘露糖基-赤藓糖醇脂-b(以下也称作1-o-β-mel-b。)。1-o-β-mel-b具有与4-o-β-mel-b相比水合性提高、泡囊(ベシクル)形成能力也高的特征,是有望用作护肤剂等的生物材料。报告过pseudozymatsukubaensis1e5株能够由20质量%的橄榄油在7天中生产70g/l(生产速度:0.4g/l/h、原料收率:35质量%)的1-o-β-mel-b(参照非专利文献7),被作为化妆品材料销售。
现有技术文献
非专利文献
非专利文献1:t.nakahara,h.kawasaki,t.sugisawa,y.takamoriandt.tabuchi:j.ferment.technol.,61,19(1983)
非专利文献2:h.kawasaki,t.nakahara,m.oogakiandt.tabuchi:j.ferment.technol.,61,143(1983)
非专利文献3:d.kitamoto,s.akiba,c.hiokiandt.tabuchi:agric.biol.chem.,54,31(1990).
非专利文献4:d.kitamoto,k.haneishi,t.nakaharaandt.tabuchi:agric.biol.chem.,54,37(1990).
非专利文献5:d.kitamoto,k.fijishiro,h.yanagishita,t.nakaneandt.nakahara:biotechnol.lett.,14,305(1992).
非专利文献6:金,伊炳大,桂树彻,谷吉树:平成10年日本生物工学会大会要旨,p195.
非专利文献7:t.morita,m.takashima,t.fukuoka,m.konishi,t.imura,d.kitamoto:appl.microbiol.biotechnol.,88,679(2010)
技术实现要素:
发明所要解决的问题
为了在食品工业、医药品工业、以及化学工业等中广泛地普及mel,希望提高mel的生产效率,实现生产成本的降低。因而,以提供提高此种mel的生产效率的方法作为一个课题。
用于解决问题的方法
为了解决该问题反复进行了深入研究,结果发现,通过使具有生产生物表面活性剂的能力的微生物表达外源性的脂肪酶,由此,基于该微生物的生物表面活性剂的生产效率飞跃性地提高。另外发现,通过在包含脂肪酸及甘油的培养基中培养具有生产生物表面活性剂的能力的微生物,由此,基于该微生物的生物表面活性剂的产生效率飞跃性地提高。基于这些见解,反复进行了进一步的研究和探讨,结果提供以下述为代表的发明。
第一项
一种重组微生物,其具有编码脂肪酶的外源性核酸、且具有产生甘露糖赤藓糖醇脂的能力。
第二项
根据第一项中记载的重组微生物,其中,上述微生物是属于类酵母(pseudozyma)属的微生物。
第三项
根据第一项或第二项中记载的重组微生物,其中,上述微生物是属于pseudozymatsukubaensis的微生物。
第四项
根据第一项~第三项中任一项记载的重组微生物,其中,脂肪酶与选自序列号1~9、24、以及25中的氨基酸序列具有90%以上的相同性。
第五项
一种方法,该方法使用第一项~第三项中任一项记载的重组微生物制造甘露糖赤藓糖醇脂。
第六项
一种制造第四项中记载的甘露糖赤藓糖醇脂的方法,该方法包括在包含植物油脂的培养基中培养上述微生物。
第七项
一种制造甘露糖赤藓糖醇脂的方法,该方法包括在添加有脂肪酸及甘油的培养基中培养具有产生甘露糖赤藓糖醇脂的能力的微生物。
发明效果
能够高效地制造生物表面活性剂。
附图说明
图1表示mel的结构。
图2表示4-o-β-d-吡喃甘露糖基-赤藓糖醇(a)及1-o-β-d-吡喃甘露糖基-赤藓糖醇(b)的结构。
图3表示通过将纯化脂肪酶添加到培养基中而评价对mel生产效率的影响的结果。
图4表示表达载体puc_neo::lipa及puc_neo::lipb的结构。
图5表示测定转化株的脂肪酶活性而得的结果。
图6表示利用薄层色谱测定利用外源性脂肪酶导入株及对照生产mel的结果。
图7表示利用hplc测定利用外源性脂肪酶导入株及对照生产mel的结果。
图8表示测定外源性脂肪酶导入株及对照的增殖速度的结果。
图9表示通过向培养基中添加橄榄油或油酸和甘油而造成的对mel的生产的影响。
图10表示通过向培养基中添加橄榄油或油酸和甘油而造成的对菌体增殖的影响。
具体实施方式
微生物的重组中使用的脂肪酶只要可以在微生物中表达、发挥脂肪酶活性(即发挥作用),就没有特别限制,可以任意地选择。因此,脂肪酶的来源可以是微生物、植物及动物的任意一种。在一个实施方式中优选的脂肪酶来自于微生物。在一个实施方式中,作为脂肪酶的来源优选的微生物是类酵母属(シュードザイマ属)、黑粉菌属(ウスチラゴ属)、sporisorium属、melanopsichium属、以及kurtzmanomyces属(クルツマノマイセス属)。优选的类酵母属微生物为pseudozymaantarctica、pseudozymaaphidis、pseudozymahubeiensis、以及pseudozymatsukubaensis。优选的黑粉菌属微生物为ustilagohordei及ustilagomaydis。优选的sporisorium属微生物为sporisoriumreilianum及sporisoriumscitamineum。优选的melanopsichium属微生物为melanopsichiumpennsylvanicum。优选的kurtzmanomyces属微生物为kurtzmanomycessp.i-11。
在一个优选的实施方式中,脂肪酶优选具有序列号1~9、24及25的任意一种氨基酸序列、或与之具有80%以上的相同性的氨基酸序列。相同性优选为85%以上、90%以上、95%以上、96%以上、97%以上、98%以上、或99%以上。此种脂肪酶可以利用任意的方法获得。例如,可以使用基因工程的方法及化学合成法(例如液相法及固相法)制造。另外,对于编码脂肪酶的核酸也可以使用任意的方法(例如基因工程的方法及化学方性法)获得。
序列号1为来自于p.antarcticat-34的lip-a的氨基酸序列。序列号2为来自于pseudozymaaphidisdsm70725的脂肪酶所具有的氨基酸序列。序列号3为来自于pseudozymahubeiensissy62的脂肪酶的氨基酸序列。序列号4为来自于ustilagohordei的脂肪酶所具有的氨基酸序列。序列号5为来自于ustilagomaydis521的脂肪酶所具有的氨基酸序列。序列号6为来自于sporisoriumreilianumsrz2的脂肪酶所具有的氨基酸序列。序列号7为来自于sporisoriumscitamineum的脂肪酶所具有的氨基酸序列。序列号8为来自于melanopsichiumpennsylvanicum4的脂肪酶所具有的氨基酸序列。序列号9为来自于kurtzmanomycessp.i-11的脂肪酶所具有的氨基酸序列。序列号24为来自于pseudozymatsukubaensisnbrc1940株的脂肪酶(lipa)所具有的氨基酸序列。序列号25为来自于pseudozymatsukubaensis1e5株的脂肪酶(lipa)所具有的氨基酸序列。在一个实施方式中优选的脂肪酶为来自于p.antarcticat-34的lip-a。需要说明的是,p.antarcticat-34也被称作“moesziomycesantarcticust-34”。p.aphidis也被称作“moesziomycesaphidis”。
氨基酸的相同性可以使用市售的或能够通过互联网利用的分析工具(例如fasta、blast、psi-blast、ssearch等软件)计算。例如,blast检索中一般所用的主要的初始条件如下所示。即,在advancedblast2.1中,程序使用blastp,使expect值为10,使filter全都为off,matrix使用blosum62,使gapexistencecost、perresiduegapcost、以及lambdaratio分别为11、1、0.85(默认值),将其他的各种参数也设定为默认值而进行检索,由此可以算出氨基酸序列的相同性的值(%)。
在另一实施方式中,脂肪酶可以是由序列号1~9、24及25的氨基酸序列中1个或几个氨基酸发生了残基的置换、缺失、插入、添加和/或倒位(以下有时将它们集中称作“突变”。)的氨基酸序列构成、且具有脂肪酶活性的多肽。此处所谓“几个”,只要可以维持脂肪酶活性就没有限制,例如为相当于小于全部氨基酸的约20%的数,优选为相当于小于约15%的数,更优选为相当于小于约10%的数,进一步优选为相当于小于约5%的数,最优选为相当于小于约1%的数。更具体而言,例如为2~100个,优选为2~80个,更优选为2~60个,进一步优选为2~40个,更进一步优选为2~20个,更进一步优选为2~15个,更进一步优选为2~10个,特别优选为2~5个。
氨基酸的置换的种类没有特别限制,从不会对脂肪酶造成明显影响的观点考虑优选保守性氨基酸置换。所谓“保守性氨基酸置换”,是指将某个氨基酸残基置换为具有同样性质的侧链的氨基酸残基。氨基酸残基根据其侧链被分类为像碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、β分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)、芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)那样几个家族。保守性氨基酸置换优选为同一家族内的氨基酸残基间的置换。
一个或几个突变可以利用限制酶处理、借助核酸外切酶、dna连接酶等的处理、位点指定突变导入法(molecularcloning,thirdedition,chapter13,coldspringharborlaboratorypress,newyork)等公知的方法导入。另外,也可以利用紫外线照射等其它方法获得变体。在变体中也包含基于具有脂肪酶的微生物的个体差别、种或属的差异的情况等天然产生的变体(例如单核苷酸多态性)。在一个实施方式中,突变优选存在于对fgdh的活性部位或底物结合部位不造成影响的部位。
将编码序列号1的氨基酸序列的碱基序列表示于序列号10中。将编码序列号2的氨基酸序列的碱基序列表示于序列号11中。将编码序列号3的氨基酸序列的碱基序列表示于序列号12中。将编码序列号4的氨基酸序列的碱基序列表示于序列号13中。将编码序列号5的氨基酸序列的碱基序列表示于序列号14中。将编码序列号6的氨基酸序列的碱基序列表示于序列号15中。将编码序列号7的氨基酸序列的碱基序列表示于序列号16中。将编码序列号8的氨基酸序列的碱基序列表示于序列号17中。将编码序列号9的氨基酸序列的碱基序列表示于序列号18中。将编码序列号24的氨基酸序列的碱基序列表示于序列号26中。将编码序列号25的氨基酸序列的碱基序列表示于序列号27中。
重组微生物例如可以通过向宿主微生物导入上述编码脂肪酶的外源性核酸而获得。此处,宿主微生物只要是具有生产甘露糖赤藓糖醇脂的能力的微生物,就没有特别限制,可以任意地选择使用。作为具有生产甘露糖赤藓糖醇脂的能力的微生物,例如可以举出属于pseudozyma属的微生物。在一个实施方式中,优选的具有生产甘露糖赤藓糖醇脂的能力的微生物为属于pseudozymatsukubaensis、pseudozymaantarctica、pseudozymarugulosa、pseudozymaaphidis、pseudozymaparantarctica、pseudozymahubei-ensis的微生物。作为tsukubaensis种中所含的优选的mel生产株,可以举出nbrc1940株、km-160株、1d9株、1d10株、1d11株、1e5株、以及jcm16987株。pseudozymatsukubaensis所生产的1-o-β-mel-b的水合性高于4-o-β-mel-b,在水系用途中有用。
编码脂肪酶的核酸向宿主细胞中的导入方法是任意的,没有特别限制。例如,可以将核酸重组入适合于宿主的载体,将其利用任意的方法导入宿主细胞。所谓载体,是可以将重组入其中的核酸分子输送到细胞内的核酸性分子(carrier)。载体的种类只要是能够在宿主细胞内复制及表达,其种类、结构就没有特别限定。载体的种类可以根据宿主细胞的种类适当地选择。作为载体的具体例,可以举出质粒载体、粘粒载体、噬菌体载体、病毒载体(腺病毒载体、腺相关病毒载体、逆转录病毒载体、疱疹病毒载体等)等。在一个实施方式中优选的载体为质粒载体。
作为以pseudozyma属为宿主的情况的载体,例如可以例示出puxv1atcc77463、puxv2atcc77464、puxv5atcc77468、puxv6atcc77469、puxv7atcc77470、puxv8atcc77471、puxv3atcc77465、pu2x1atcc77466、pu2x2atcc77467、puxv1-neo、ppax1-neo、ppaa1-neo(applmicrobiolbiotechnol(2016)100:3207-3217)及puc_neo等。在一个实施方式中,优选的载体为puc_neo。
表达载体通常包含被插入的核酸的表达所需要的启动子序列及促进表达的增强子序列等。也可以使用包含选择标记的表达载体。核酸向载体中的插入、选择标记基因的插入(需要的情况下)、启动子的插入(需要的情况下)等可以使用标准的重组dna技术(例如可以参照molecularcloning,thirdedition,1.84,coldspringharborlaboratorypress,newyork,使用了限制酶及dna连接酶的众所周知的方法)来进行。
载体向宿主细胞的导入是任意的,可以根据宿主细胞及载体的种类等适当地选择。载体的导入例如可以利用电穿孔法、磷酸钙共沉降法、脂质体转染法、显微注射法、以及乙酸锂法等来实施。
对于是否可以利用核酸的导入获得重组微生物,可以利用任意的方法来确认。例如,可以通过确认有无因外源性核酸的导入而赋予的脂肪酶活性来确认是否获得所期望的重组微生物。脂肪酶活性的确认可以利用任意的方法实施。例如,可以利用上述的实施例中采用的方法(即利用因月桂酸对硝基苯酯的水解而产生的、波长410nm的吸光度的变化进行测定的方法)来实施。
重组微生物因具备脂肪酶活性和产生甘露糖赤藓糖醇脂的能力,而可以更加高效地产生甘露糖赤藓糖醇脂。重组微生物所产生的甘露糖赤藓糖醇脂的种类没有特别限制,可以根据目的适当地选择。在一个实施方式中,优选的mel为1-o-β-mel-b及4-o-β-mel-b,更优选为1-o-β-mel-b。
使用了重组微生物的mel的生产可以利用任意的方法进行。例如,可以通过在适于mel的生产的培养基中培养重组微生物来实施。在一个实施方式中,在使用了重组微生物的、生产mel的情况下,优选向培养基中添加植物油脂。植物油脂的种类没有特别限制,可以根据作为目标的mel的种类等适当地选择。例如,可以举出大豆油、橄榄油、菜籽油、红花油、芝麻油、棕榈油、葵花籽油、椰子油、可可油、以及蓖麻子油等。在一个实施方式中优选的油脂为橄榄油。
重组微生物的培养条件没有特别限制。例如,在重组微生物为pseudozyma属的情况下,可以在ph5~8、优选在ph6、温度20~35℃、优选在22~28℃的条件下培养3~7天。mel可以依照常规方法从培养液中回收。
在另一实施方式中,提供一种包括在添加有脂肪酸及甘油的培养基中培养具有产生甘露糖赤藓糖醇脂的能力的微生物的、制造甘露糖赤藓糖醇脂的方法。本实施方式中使用的产生mel的微生物可以具有脂肪酶活性,也可以不具有脂肪酶活性,在一个实施方式中优选不具有脂肪酶活性的微生物。
脂肪酸没有特别限制,例如可以举出辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸、花生四烯酸、山嵛酸、以及神经酸等。在一个实施方式中,优选的脂肪酸为油酸。
脂肪酸及甘油的量没有特别限制,例如可以以使各个培养基中的浓度为0.1~20容量%的方式添加。
微生物的培养条件没有特别限制,可以采用与使用上述的重组微生物的情况同样的条件。
[实施例]
以下,利用实施例对本发明进一步详细说明,然而本发明不受它们限制。
1.材料
·使用菌体
pseudozymatsukubaensis1e5株、基因组dna
pseudozymaantarcticat-34株、质粒
表达载体puc_neo
·培养基
添加甘油的ym培养基:向去离子水1l中溶解酵母提取物3g、麦芽提取物3g、蛋白胨5g、葡萄糖10g、甘油50g而制备。
生产mel的培养基:向去离子水1l中溶解酵母提取物5g、硝酸钠3g、磷酸二氢钾0.3g、七水合硫酸镁0.3g、甘油20g而制备。在培养时,根据需要添加g418(抗生物质)。
·纯化脂肪酶:来源于猪胰脏的脂肪酶(东京化成公司制)、固定化脂肪酶a(sigmaaldrich公司制)、固定化脂肪酶b(sigmaaldrich公司制)
2.利用添加纯化脂肪酶的培养基的mel生产能力的评价
将pseudozymatsukubaensis1e5株在添加甘油的ym培养基2ml中在25℃振荡培养3天,得到前培养液。然后,将前培养液0.1ml接种于向mel生产培养基中添加了10%橄榄油以及来源于猪胰脏的脂肪酶、固定化脂肪酶a或固定化脂肪酶b1mg的培养基2ml中,在25℃振荡培养4天。向所得的菌体培养液中添加等量的乙酸乙酯,充分地搅拌后,分离收集乙酸乙酯层。利用薄层色谱确认了乙酸乙酯层中所含的mel。将结果表示于图3中。根据图3的结果表明,任意的脂肪酶的添加都不会对利用1e5株的mel-b的生产率造成影响。
3.使用了脂肪酶表达重组株的mel-b的生产
3-1.基因组dna的提取
将上述pseudozymaantarcticat-34株的菌体培养液中所含的菌体用液氮冷冻,用苯酚及氯仿处理,提取基因组dna。利用分光光度计确认了所得的基因组dna的纯度和量。
3-2.表达载体构建
依照下面的步骤构建出表达序列号10及19所示的基因的表达载体。序列号10是编码pseudozymaantarcticat-34株的脂肪酶a的碱基序列,序列号19是编码pseudozymaantarcticat-34株的脂肪酶b的碱基序列。首先,参照序列号10,制备出向开始密码子的上游导入了kpni位点的上游引物(序列号20)、以及向终止密码子的下游导入了ecori位点的下游引物(序列号21)。使用它们,以上述3-1.中所得的pseudozymaantarcticat-34株的基因组dna为模板进行了基因的扩增。同样地,参照序列号19,制备出向开始密码子的上游导入了kpni位点的上游引物(序列号22)、以及向终止密码子的下游导入了ecori位点的下游引物(序列号23)。使用它们,以上述3-1.中得到的pseudozymaantarcticat-34株的基因组dna为模板进行了基因的扩增。将扩增了的基因与包含来自于丝状菌(ustilagomaydis)的复制起始点(uars)、g418耐性基因、来自于pseudozymaantarcticat-34株的gap启动子的表达载体puc_neo连接,在gap启动子的控制下构建出表达这些基因的基因表达载体puc_neo::lipa及puc_neo::lipb。将表达载体的结构表示于图4中。
fwd:tttggtaccatgcgagtgtccttg(序列号20)
rvs:gcagaattcctaaggcggtgtg(序列号21)
fwd:cgaggtaccatgaagctactctc(序列号22)
rvs:tgagaattctcagggggtgacg(序列号23)
3-3.转化体的制备
使用将上述3-2.中所得的表达载体puc_neo::lipa及puc_neo::lipb利用限制酶处理进行了直线化的材料,利用电穿孔法对pseudozymatsukubaensis1e5株进行了转化。另外,作为对照将不包含插入子的载体puc_neo也同样地利用限制酶处理进行直线化后,利用电穿孔法导入pseudozymatsukubaensis1e5株。在转化体的挑选时,使用了g418。
3-4.酶活性测定
将各转化体在添加甘油的ym培养基2ml中在25℃振荡培养3天,得到前培养液。然后,将前培养液1ml接种于向mel培养基中添加12%橄榄油而得的培养基20ml中,在25℃振荡培养3天。离心所得的菌体培养液,得到培养上清液。
根据因月桂酸对硝基苯酯的水解而产生的、波长410nm的吸光度的变化测定出各转化体的培养上清液中的脂肪酶活性。将1分钟消耗1μmol的底物所需要的酶量设为1unit。将结果表示于图5中。图中,neo表示puc_neo导入株(对照),lipa表示puc_neo::lipa导入株,lipb表示puc_neo::lipb导入株。根据该结果,在lipa导入株及lipb导入株中确认了脂肪酶活性。
3-5.转化体的mel生产能力的评价
将各转化体在添加甘油的ym培养基2ml中在25℃振荡培养3天,得到前培养液。然后,将前培养液1ml接种于向mel培养基中添加12%橄榄油而得的培养基20ml中,在25℃振荡培养15天。向所得的菌体培养液中添加等量的乙酸乙酯,充分地搅拌后,分离收集乙酸乙酯层。利用薄层色谱确认了乙酸乙酯层中所含的mel(图6)。另外,使用高效液相色谱对mel的生产量进行了定量(图7)。继而,向分离收集乙酸乙酯层后残留的水层中加入甲醇,进行离心分离,由此得到菌体。使所得的菌体干燥,进行称量,评价了菌体增殖量(图8)。
如图6及7所示,在任意的菌株中都确认了mel-b的生产,与对照相比确认脂肪酶a导入株中初期的mel-b生产速度显著更快(约1.5倍)。由图8的结果确认,脂肪酶a导入株中,菌体增殖速度也比对照快。
4.由脂肪酸和甘油的添加造成的对mel-b生产的影响
将pseudozymatsukubaensis1e5株在添加甘油的ym培养基2ml中在25℃振荡培养3天,得到前培养液。然后,将前培养液1ml接种于向mel培养基中添加12容量%的橄榄油而得的培养基20ml中、或将橄榄油12容量%替换为油酸10.8容量%及甘油1.2容量%的培养基20ml中,在25℃振荡培养4天。向所得的菌体培养液中添加等量的乙酸乙酯,充分地搅拌后,分离收集乙酸乙酯层。利用高效液相色谱测定出乙酸乙酯层中所含的mel的量(图9)。另外,向分离收集乙酸乙酯层后残留的水层中加入甲醇,进行离心分离,由此得到菌体。使所得的菌体干燥后进行称量,评价了菌体增殖量(图10)。由图9的结果确认,通过代替橄榄油而将油酸及甘油添加到培养基中,由此,mel-b的生产量提高约1.5倍。另一方面,由图10的结果判明,即使将橄榄油替换为油酸及甘油,也不会对菌体的增殖能力产生影响。
- 还没有人留言评论。精彩留言会获得点赞!