新型肽及其用途的制作方法
本发明涉及新型肽,具体地说涉及显示β-淀粉样蛋白流入脑内的抑制效果的新型肽及其用途。
背景技术:
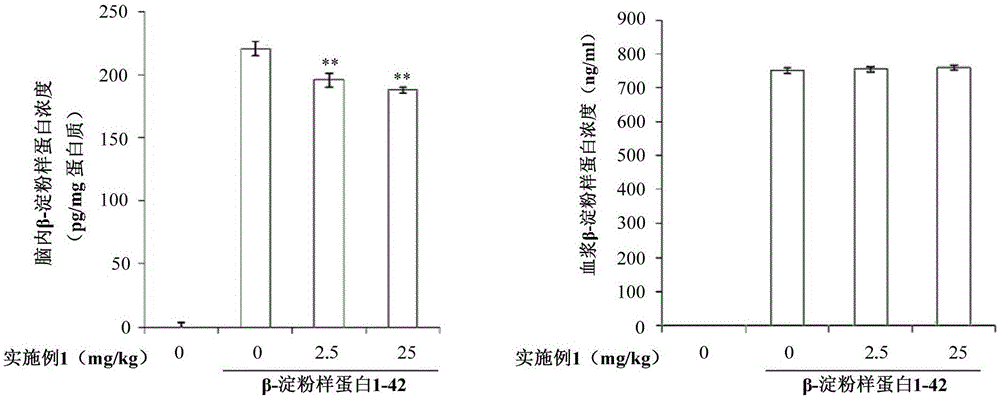
:已知β-淀粉样蛋白(beta-amyloid)作用于脑内,诱发阿尔茨海默氏病(alzheimer’sdisease)、血管性痴呆、酒精性痴呆、路易体痴呆等痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、脑内炎症等疾病(参照irvinegb,ei-agnafom,shankargm,walshdm."proteinaggregationinthebrain:themolecularbasisforalzheimer’sandparkinson’sdiseases"molmed.2008;14(7-8):451-64.等)。其中,阿尔茨海默氏病(alzheimer’sdisease,ad)为引起痴呆的最常见的退行性脑疾病,占有所有痴呆的55~70%。目前与痴呆相关而开发的药物大部分为乙酰胆碱酯酶(acetylcholinesterase)抑制剂,上述乙酰胆碱酯酶抑制剂用于抑制在记忆功能上非常重要的神经递质-乙酰胆碱的分解(参照美国专利第4895841号等)。相比病症治疗,乙酰胆碱酯酶抑制剂为更为注重缓和症状的药物,这些治疗剂的主要副作用为因乙酰胆碱的过度增加而使副交感神经亢进,会产生严重的腹泻、恶心、呕吐、抑郁症、不安、失眠、头痛等消化系统和神经精神系统异常反应。一方面,关于包含特定氨基酸序列(daef)的肽,已知其作为抑制由β-淀粉样蛋白产生的神经细胞毒性的神经保护性肽(参照国际专利公开公报wo2006/03l330a2)。已知上述肽仅仅降低或预防tau蛋白质磷酸化或神经细胞死亡等由β-淀粉样蛋白产生的效果本身。另外,关于上述神经保护性肽,为了显示脑内的效果,需要通过血脑屏障(blood-brainbarrier;bbb),所以不仅需要使用流入脑内的附加手段(例如,通过神经外科手术来插入的导管等),而且存在使用这种手段仍然很难的问题。因此,关于β-淀粉样蛋白的脑内作用的抑制,需要开发出更加容易使用的药物。【现有技术文献】【专利文献】(专利文献1)美国专利第4895841号,1990.1.23,摘要(专利文献2)国际专利公开公报wo2006/031330a2,2006.3.23,权利要求书【非专利文献】(非专利文献1)irvinegb,ei-agnafom,shankargm,walshdm."proteinaggregationinthebrain:themolecularbasisforalzheimer’sandparkinson’sdiseases"molmed.2008;14(7-8):451-64技术实现要素:技术课题本发明需要解决的一个课题是提供使用性优异的新型肽。另外,本发明需要解决的另外课题是提供本发明肽的用途。本发明需要解决的课题并不限定于如上提及的课题,未提及的其他课题本领域人员能够从下面所述的内容明确理解。课题解决手段本发明提供由序列号1的氨基酸序列(dgeff)或序列号2的氨基酸序列(dgef)组成的肽、或药学上可允许的其盐。上述氨基酸序列的d表示天门冬氨酸(asparticacid;asp),g表示甘氨酸(glycine;gly),e表示谷氨酸(glutamicacid;glu),f表示苯丙氨酸(phenylalanine;phe)。构成上述肽的氨基酸以l-型、d-型、dl-型存在,构成本发明肽的氨基酸包括这些全部。另外,上述d很明显可以解释为包括全部的天门冬氨酸盐(酯)(aspartate)或天门冬氨酸(asparticacid)的氨基酸。另外,上述e很明显可以解释为包括全部的谷氨酸盐(酯)(glutamate)或谷氨酸(glutamicacid)的氨基酸。上述肽包括变异体,包括经过自然变异或人工变异,没有改变主要活性,本发明肽结构的一部分产生变异的变异体。上述药学上可允许的盐可举出,例如,盐酸盐、硫酸盐、磷酸盐、醋酸盐、柠檬酸盐、酒石酸盐、琥珀酸盐、乳酸盐、马来酸盐、富马酸盐、草酸盐、甲磺酸盐、或对甲苯磺酸盐等。序列号1的氨基酸序列(dgeff)或序列号2的氨基酸序列(dgef)都共同包括dgef。本发明的发明人通过以下实验确认,具有如上共同序列的本发明肽或药学上可允许的其盐显示β-淀粉样蛋白(beta-amyloid)流入脑内的抑制效果。通过如上效果,本发明更加直接且容易地抑制β-淀粉样蛋白的脑内作用(脑内沉着等)。也就是,根据本发明,不需要使用通过血脑屏障的附加手段(例如,通过神经外科手术来插入的导管等),也可容易地抑制β-淀粉样蛋白作用于脑内。另外,本发明能够抑制β-淀粉样蛋白本身流入脑内,所以更加直接地对β-淀粉样蛋白相关疾病、症状等显示效果。通过抑制β-淀粉样蛋白流入脑内,抑制脑内作用,其结果可治疗、预防、缓和由β-淀粉样蛋白的脑内作用引起的疾病、症状等。上述β-淀粉样蛋白流入脑内的抑制是通过上述肽或药学上可允许的其盐抑制rage(receptorforadvancedglycationendproducts)和β-淀粉样蛋白的结合来实现的。rage是将β-淀粉样蛋白输送到脑内的受体,上述肽或药学上可允许的其盐替代β-淀粉样蛋白与rage结合,从而抑制β-淀粉样蛋白与rage的结合,显示抑制β-淀粉样蛋白流入脑内。因此,本发明另外提供本发明的肽或药学上可允许的其盐的用途,优选提供β-淀粉样蛋白流入脑内的抑制用途、或者对选自阿尔茨海默氏病(alzheimer’sdisease)、痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、或脑内炎症中的一种以上的治疗或预防用途。治疗是指包括症状的改善、减轻等,预防是指包括在疾病之前阶段抑制发展为疾病,痴呆可以为选自阿尔茨海默氏性痴呆、血管性痴呆、酒精性痴呆、或路易体痴呆中的一种以上。上述阿尔茨海默氏病(alzheimer’sdisease)、上述痴呆、上述帕金森(parkinson)病、上述神经性舞蹈(huntington)病、或上述脑内炎症中选择的一种以上可能是因为脑内沉着β-淀粉样蛋白而引起的。上述治疗或预防可以为通过抑制β-淀粉样蛋白流入脑内而实现的。另外,上述治疗或预防可以为通过抑制脑内β-淀粉样蛋白的沉着或抑制脑内炎症中选择的一种以上来实现的。上述抑制沉着可以为通过抑制β-淀粉样蛋白流入脑内而实现的。因此,本发明提供包含本发明的肽或药学上可允许的其盐的β-淀粉样蛋白流入脑内抑制剂。另外,本发明提供包含本发明的肽或药学上可允许的其盐的选自阿尔茨海默氏病(alzheimer’sdisease)、痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、或脑内炎症中的一种以上的治疗或预防用组合物。上述组合物可以为药学组合物。上述抑制剂或上述组合物,其特征在于,作为有效成分包含本发明的肽或药学上可允许的其盐。另外,上述抑制剂或上述组合物进一步包含药剂学上允许的添加剂,可以由本发明的肽或药学上可允许的其盐、以及上述添加剂组成。本发明的肽可以利用肽化学中通常使用的方法来制备。例如,利用schroderandlubke著,【thepeptides】第1卷,acadmeicpress,newyork(1965)等中记载的方法来制备肽,利用液相合成或固相合成等方法来制备肽。形成肽键的方法可举例,酰基叠氮法、酰卤化法、酰基咪唑法、碳化二亚胺法、膦法、酸酐法、混合酸酐法、氧化-还原法、以及使用woodward试剂k的方法等。在进行缩合反应之前,保护与反应无关的羧基、胺基等,而与缩合反应相关的羧基等通过本领域公知的方法进行活性化。羧基的保护基可举例,甲基、叔丁基、芳基、五氟苯基、苄基、对甲氧基苄基、或甲氧基乙氧基甲基等酯基形成基团。胺基的保护基可举例,三苯甲基羰基、芳氧基羰基、环己氧基羰基、三氯乙氧基羰基、苄氧基羰基、叔丁氧基羰基、和/或9-芴甲氧基羰基等。羧基的活性形态可举出例如,混合酸酐、叠氮化合物、酰氯、或活性酯【与醇(例如,五氯苯酚、2,4-二硝基苯酚、氰基甲醇、p-硝基苯酚、n-羟基-5-降冰片烯-2,3-二羧基酰亚胺,n-羟基琥珀酰亚胺、n-羟基邻苯二酰胺、或1-羟基苯并三唑)的酯】等。形成肽键的缩合反应中所用的溶剂可以为苯、甲苯、己烷、丙酮、硝基甲烷、环己烷、乙醚、氯仿、二氯甲烷、乙酸乙酯、n,n-二甲基甲酰胺、二甲基亚砜、吡啶、二氧六环(二恶烷)、四氢呋喃、水、甲醇、或乙醇等的单一溶剂或它们的混合溶剂。反应温度可以为反应中通常所用的约-70℃~100℃的范围,优选为-30℃~30℃的范围。肽保护基的消除反应虽然根据保护基的种类而不同,但是可以利用对肽键不产生任何影响且可脱保护基的酸化合物、碱化合物、或过渡金属等来消除。保护基可以通过酸处理、例如通过氯化氢、溴化氢、氟化氢、乙酸、甲磺酸、三氟甲磺酸、三氟乙酸、三甲基氯硅烷、或者它们的混合物的处理来消除。在进行由上述酸处理来消除保护基的反应时,作为辅助剂添加苯甲醚、苯酚、以及甲基苯基硫醚等,促进反应。保护基可以通过碱处理、例如通过氨、二乙胺、肼、吗啉、n-甲基吡咯烷、哌啶、碳酸钠、或者这些碱的混合物的处理来消除。另外,保护基可以通过过渡金属处理、例如通过锌、汞、钯/氢等来消除。反应结束后,利用常规的肽精制方法、例如提取、层分离、固体沉淀、重结晶、或柱色谱来精制肽。另外,本发明的肽可以利用常规方法来转换为变异体或药学上可允许的其盐。本发明涉及的肽可以利用自动肽合成仪来合成,也可以利用基因操作技术来生产。例如,通过基因操作,制备将由载体蛋白和本发明的肽形成的融合蛋白质进行编码的融合基因,利用该融合基因来转基因宿主微生物后,在宿主微生物上以融合蛋白质形态表达,之后利用蛋白质分解酶或化合物,从融合蛋白质切断、分离本发明的肽,可生成所期待的肽。上述肽、或药学上可允许的其盐的投入量为在非口服时200mg/天~500mg/天、优选267mg/天~400mg/天。口服时的投入量为非口服时的投入量的2~5倍。可以一天一次或分几次投入,这些投入量是以成人(体重60kg)为基准,但是不同的体重、身体状态等而当然不同。本发明的肽或药学上可允许的其盐主要通过非口服方法投入,例如局部注射、静脉或皮下注射、大脑室内或脊椎腔内投入、经皮投入、或者鼻腔投入或直肠内投入。另外,根据情况,可以口服。本发明的肽、或药学上可允许的其盐、抑制剂或组合物是与药学上允许的添加剂一起制剂化,制得注射剂、栓剂、粉末、点鼻剂、颗粒、片剂、经皮投入用贴片等形态。药学上允许的添加剂的使用需要考虑本领域人员周知的多种因素,例如需要考虑被利用的特定生理活性物质、其浓度、稳定性、以及所期望的生物体利用性;需要治疗的病患和疾病或状态;需要治疗的个体、年龄、大小和一般状态;组合物的投入途径,例如鼻腔、口腔、眼部、局部、经皮和肌肉等要素,但是并不限定于此。一般来说,除了口服投入途径之外的生理活性物质投入所用的药剂学上可利用的添加剂包括将d5w(水中5%葡萄糖)、葡萄糖和生理学上的盐以容积的5%以内包含的水溶液等,对病灶局部注射时,为了增进治疗效果且增加持续时间,可使用多种可注射型水凝胶(hydrogel)。另外,药学上可利用的添加剂可包括能够加强活性成分的稳定性的保存剂和抗氧化剂等附加成分。本发明的肽、或药学上可允许的其盐、抑制剂或组合物可以通过本领域的适当方法进行制剂化,例如,参照在remington’spharmaceuticalscience,mackpublishingcompany,eastonpa(最新版)等中公开的方法,根据各疾病或者根据成分,能够有效制剂化。本发明的肽可利用生理食盐水溶液保管,添加甘露醇或山梨醇后,在安瓿瓶(ample)中冻结干燥,使用时可溶解在生理食盐水等中。另外,本发明提供β-淀粉样蛋白流入脑内的抑制方法,该方法包括将本发明的肽或药学上可允许的其盐投入到需要投入的包括人类的哺乳类的步骤。此外,本发明提供选自阿尔茨海默氏病(alzheimer’sdisease)、痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、或脑内炎症中的一种以上的治疗或预防方法,该包括将本发明的肽或药学上可允许的其盐投入到需要投入的包括人类的哺乳类的步骤。另外,本发明提供本发明的肽或药学上可允许的其盐用于制备β-淀粉样蛋白流入脑内的抑制剂的用途。此外,本发明提供本发明的肽或药学上可允许的其盐用于制备选自阿尔茨海默氏病(alzheimer’sdisease)、痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、或脑内炎症中的一种以上的治疗或预防用制剂的用途,上述投入的肽或药学上可允许的其盐可以为有效量的肽或药学上可允许的其盐。如果没有另外提及,本发明的肽或药学上可允许的盐、用途、抑制剂、组合物、方法中提及的事项,在不相矛盾时就会在相同范围内同样适用。发明效果本发明具有β-淀粉样蛋白流入脑内的抑制效果。另外,由于本发明更加容易使用于β-淀粉样蛋白的脑内作用抑制,具有优异的使用性。附图说明图1是表示本发明的一个实施例的血中β-淀粉样蛋白流入脑内的抑制效果的确认结果的图谱。图2是表示本发明的一个实施例的动物的学习和记忆恢复的影响效果的确认结果的图谱。图3是表示本发明的一个实施例的β-淀粉样蛋白1-42的降低效果的确认结果的图谱。图4是表示本发明的一个实施例的tnf-α的降低效果的确认结果的图谱。图5是表示本发明的一个实施例的gfap降低效果的确认结果的图谱。具体实施方式以往没有公开过本发明的肽或药学上可允许的其盐。只是,国际专利公开公报wo2006/031330a2公开了β-淀粉样蛋白相关的多种肽,这些肽都与降低或预防由β-淀粉样蛋白自身作用而产生的效果相关,特别是由β-淀粉样蛋白产生的tau蛋白质磷酸化或神经细胞死亡的抑制效果相关,这些肽只作为神经保护性肽周知。也就是,这些神经保护性肽仅仅抑制神经细胞死亡和tau蛋白质磷酸化等由β-淀粉样蛋白产生的效果。神经保护性肽具有的这些效果与本发明具有的β-淀粉样蛋白流入脑内的抑制效果不同。本发明显示β-淀粉样蛋白流入脑内的抑制效果,所以使用时无需通过血脑屏障(bbb),因此使用性优异;而神经保护性肽为了作用于脑内,需要通过血脑屏障(bbb)。因此,神经保护性肽为了所期待的作用,不得不使用脑内流入的附加手段(例如,通过神经外科手术来插入的导管等),而本发明不需要使用脑内流入的附加手段,在这点上,具有神经保护性肽无法预料的效果。因此,本发明的效果与国际专利公开公报wo2006/031330a2公开的多种肽的效果完全不同,而且从国际专利公开公报wo2006/031330a2无法预料。尤其是,从如下实验结果也再次可确认,神经保护性肽不能显示β-淀粉样蛋白流入脑内的抑制效果,本发明与这些肽完全不同,而且具有从神经保护性肽难以预料的效果。下面通过实施例、对比例、和制备例进一步详细说明本发明。下述实施例和制备例仅仅是为了举例说明本发明,本发明的范围并不限定于这些实施例和制备例。如下,实施例等中使用的试剂可以购买市售品,使用最优品,在没有另外提及的情况下,从sigma-aldrich公司购买使用。下面的实验结果根据需要求出平均和标准偏差,鉴定统计上的显著性。《肽的制备》委托anygen(株)(anygenco.,ltd.,韩国)制备下面表1记载的肽。具体地说,通过利用fmoc(9-fluorenyl-methoxycarbonyl)化学性质的固相方法(solidphasemethod)来合成。更具体地说,利用0.55mmol/g的固相树脂(wangresin;sigma-aldrich公司),将肽的c-末端结合在固相树脂来实施。fmoc-phe-oh氨基酸的偶联(coupling)是与o-苯并三唑-n,n,n',n'-四甲基1-脲六氟磷酸盐【o-benzotriazole-n,n,n',n'-tetramethy1-uronium-hexafluoro-phosphate(hbtu)】一起实施。氨基酸支链由叔丁基(tert-butyl)和叔丁氧基羰基(tert-butyloxycarbonyl)保护。保护基消除(deprotection)和从树脂(resin)的分离是利用三氟乙酸(trifluoroaceticacid)和水以95:5(v/v)比例混合的溶液在室温进行3小时。粗(crude)肽利用乙醚(diethylether)反复洗涤后,真空干燥,使用shimadzu5umshimpakodsc18column(20×250mm),利用反相高效液相色谱{reverse-phasehplc;rp-hplc}来精制。已精制的肽使用shimpak5umodsc18column(4.6×250mm),利用分析用反相高效液相色谱(analyticalrp-hplc)来确认。合成的肽分子量利用基质辅助激光解吸电离-质谱{matrix-assistedlaserdesorptionionization(maldi)-massspectrometer}(aximacfr,kratosanalytical,manchester,uk)来确认。【表1】氨基酸序列序列号实施例1dgeff1实施例2dgef2对比例1daef3对比例2vkmdaefr4表1中,d表示天门冬氨酸(asparticacid;asp),g表示甘氨酸(glycine;gly),e表示谷氨酸(glutamicacid;glu),f表示苯丙氨酸(phenylalanine;phe),a表示丙氨酸(alanine;ala),v表示缬氨酸(valine;val),k表示赖氨酸(lysine;lys),m表示蛋氨酸(methionine;met),r表示精氨酸(arginine;arg)。《β-淀粉样蛋白流入脑内的抑制效果的确认i》通过实验来确认实施例1的肽抑制血中β-淀粉样蛋白流入脑内。具体地说,为了确认实施例1的肽对阿尔茨海默氏病的病因之一的β-淀粉样蛋白1-42流入脑内的阻碍效果,将1mg的β-淀粉样蛋白1-42(americanpeptidecompany,sunnyvale,ca,usa)利用2ml的六氟异丙醇(hexafluoroisopropanol:hfip)处理后,常温放置三天,按100μl分别装入试管(tube)。利用真空仪(speedvacuum)蒸发六氟异丙醇(hfip)后,分装的一个试管(tube)中加入10μl的无水二甲亚砜{anhydrousdmso(dimethylsulfoxide)}充分溶解后,添加400μl的磷酸缓冲生理食盐水(pbs;phosphatebuffersaline),最终获得25μm的β-淀粉样蛋白1-42溶液。已准备的icr老鼠(thejacksonlaboratory,barharbor,me,usa)分为正常组、对比组、两组实验组。实验组中分别以2.5mg/kg、25mg/kg腹腔投入实施例1的肽,对比组中除了替代实施例1的肽使用赋形剂(10%dmsoinsaline,10ml/kg)之外,其他与实验组进行相同处理。经过20分钟后,在对比组和实验组,从尾巴静脉将400μl的25μmβ-淀粉样蛋白1-42静脉注射(i.v)。另外,正常组中除了没有使用β-淀粉样蛋白1-42之外,其他与对比组进行相同处理。尾巴静脉注射投入β-淀粉样蛋白10分钟后,利用肝素钠化处理的肝素钠化毛细管(sodiumheparinizedcapillarytube)从老鼠眼底静脉抽取50μl的血,并立即用二氧化碳(co2)气体安乐死后,摘除老鼠的右半球并保管在液氮中。抽取的所有血样在13000rpm离心分离10分钟。已准备的试管(tube)中收集上层液,以1/4000稀释后,将β-淀粉样蛋白1-42利用酶免疫测定法(elisa;enzyme-linkedimmunosorbentassay,或者enzyme-linkedimmunospecificassay)测定。冷冻的右半球中加入3ml的ripa缓冲液(ripabuffer;radioimmunoprecipitationassaybuffer)进行超声处理(sonication)后,利用离心分离器分离上清液,然后进行bca测定(bcaassay;bicinchoninicacidassay),测定蛋白质(protein)浓度。bca测定是在试剂盒(thermoscientific,waltham,ma,usa,cat.no.23227)内按规程进行。脑内β-淀粉样蛋白1-42浓度是在ripa均质悬浊液(ripa-homogenate)中利用酶免疫测定法(elisa)测定。酶免疫测定法(elisa)是在试剂盒(iblinternational,hamburg,germany,codeno.27711)内按规程进行。其结果如图1所示。图1是表示本发明的一个实施例的血中β-淀粉样蛋白流入脑内的抑制效果的确认结果的图谱,图1的左侧图谱为分别正常组、对比组、两组实验组(肽的2.5mg/kg投入组、肽的25mg/kg投入组)中测定脑内β-淀粉样蛋白浓度的测定结果,右侧图谱为血液(血浆)β-淀粉样蛋白浓度的测定结果。如图所示,实施例1的肽的2.5mg/kg腹腔投入组、25mg/kg腹腔投入组中分别测定的脑内β-淀粉样蛋白1-42浓度为195.5±5.6pg/mg、187.8±2.4pg/mg,与对比组相比,脑内β-淀粉样蛋白浓度就会浓度依赖地减少。另外,可以确认这些结果具有统计上的显著性(p<0.01)。一方面,血浆β-淀粉样蛋白浓度,在对比组和实验组中都没有很大差异。从此结果可以看出,血中β-淀粉样蛋白1-42流入脑内的抑制依赖于实施例1的肽浓度。因此,本发明的肽可以抑制血中β-淀粉样蛋白1-42流入脑内,从而可以治疗和/或预防阿尔茨海默氏病(alzheimer’sdisease)、血管性痴呆、酒精性痴呆、路易体痴呆等痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、和/或脑内炎症等。流入脑内的β-淀粉样蛋白的沉着而诱发的疾病已知有阿尔茨海默氏病(alzheimer’sdisease)、血管性痴呆、酒精性痴呆、路易体痴呆等痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、脑内炎症等(参照irvinegb,ei-agnafom,shankargm,walshdm.proteinaggregationinthebrain:themolecularbasisforalzheimer’sandparkinson’sdiseases.molmed.2008;14(7-8):451-64等),本发明的肽可以抑制血中β-淀粉样蛋白1-42流入脑内,从而可以治疗和/或预防这些疾病。《利用动物模型的学习和记忆恢复效果的确认》通过实施例1的肽的实验来确认肽的学习和记忆恢复效果。具体地说,为了确认实施例1的肽的阿尔茨海默氏病的症状之一的学习能力和记忆力降低的抑制效果,通过基因操作,将具有瑞典突变(swedishmutation)的β-淀粉样蛋白前体蛋白质app(appsw;淀粉样蛋白突变体)的人类基因和γ-分泌酶ps1基因的外显子-9缺损状态的人类基因在脑内过量表达而诱发人类的阿尔茨海默氏病的30周龄的双重转基因老鼠{doubletransgenicmouse(dtg老鼠),jacksonlaboratory,美国}作为模型进行实验。dtg老鼠在出生后1.5个月前后就发现脑内淀粉样蛋白斑块(amyloidplaques),从4~5个月开始出现认知机能障碍(参照oakleyh,colesl,logans,mause,shaop,craftj,guillozet-bongaartsa,ohnom,disterhoftj,vaneldikl,berryr,vassarr."intraneuronalbeta-amyloidaggregates,neurodegeneration,andneuronlossintransgenicmicewithfivefamilialalzheimer’sdiseasemutations:potentialfactorsinamyloidplaqueformation."jneurosci.2006oct4;26(40):10129-40.),因此,可以用作确认实施例1的肽是否具有学习和记忆恢复效果的动物模型。实验动物是根据实验动物的试验手册,得到后在动物室驯化,并根据批准的动物实验计划书进行处理。实验环境保持在温度23±1℃、湿度50±5%,明暗周期为12小时(07:00熄灯~19:00亮灯)。进行实验期间,动物可自由摄取水和饲料。实验动物分为每组10只,分两组,一组为对比组,另外一组为实验组。实验组利用注射器以50mg/kg浓度的肽腹腔投入一天一次,每周5次,共13周。对比组除了替代实施例1的肽使用赋形剂(10%dmsoinsaline,10ml/kg)处理之外,其他与实验组进行相同处理。投入实施例1的肽后经过10周时,实施一次行动实验(y字迷宫试验)。y字迷宫试验是动物对新环境的自发性探究倾向的短期记忆能力的观察实验。实验是将动物放在迷宫的最中央后,让它在迷宫中自由移动8分钟,以视觉上观察、记录动物进入各通路的顺序的方式进行。自发性交叉行动量(%,spontaneousalternation值)由下述数学式计算。%自发性交叉行动量={(实际交叉次数)/(总交叉数-2)}×100实际交叉次数是以将动物没有重复性地连续进入三个不同方向通路时为一次来测定的。试验结果的统计处理利用spss程序(ibmspssstatistics)。利用unpairedt-test,比较对比组与实验组(实施例1的肽的投入组),鉴定统计上的显著性。显著性的认定是由p<0.05,p<0.01确定。其结果示于图2。图2是表示本发明的一个实施例的动物的学习和记忆恢复的影响效果的确认结果的图谱。如图2所示,测得对比组的自发性交叉行动量值为49.44±3.88%,测得实施例1的肽的投入组的自发性交叉行动量值为63.22±2.56%,可确认投入实施例1的肽的实验组中学习和记忆恢复效果恢复明显(p<0.01)。因此,可以确认实施例1的肽具有学习和记忆恢复效果。其结果,本发明的肽可以治疗和/或预防能够通过学习和记忆恢复来治疗和/或预防的阿尔茨海默氏病(alzheimer’sdisease)、血管性痴呆、酒精性痴呆、路易体痴呆等痴呆、帕金森(parkinson)病等。《动物模型中生物标记变化效果的确认》《利用动物模型的学习和记忆恢复效果确认》实验中,利用完成共13周投入期间的动物模型,进行了确认生物标记变化效果的实验。将完成共13周腹腔投入的动物模型利用二氧化碳(co2)安乐死后,立即摘除脑部。摘除脑部时,为了避免出现伤口,将整体脑部取出后,利用生理食盐水轻轻洗涤。利用手术刀,分离半球,左半球装入已准备的eptube(eppendorftube)后,在液氮中迅速冷却,到下次实验为止保管在-80℃的低温冰箱(deepfreezer)中。保管在-80℃的低温冰箱(deepfreezer)的左半球装入ripa缓冲液(ripabuffer;radioimmunoprecipitationassaybuffer)中,进行超声处理(sonication),准备脑细胞粉碎液(脑匀浆)(brainhomogenate)。然后,进行bca测定(bcaassay;bicinchoninicacidassay),确认蛋白质(protein)量。bca测定是在试剂盒(thermoscientific,saltham,ma,usa,cat.no.23227)内按规程进行。生物标记的表达量是利用酶免疫测定法(elisa)测定,酶免疫测定法(elisa)是在试剂盒{amyloid-beta(l-42)elisakit:iblintemational,hamburg,germany(27711),tnf-αelisakit:komabiotech,首尔,韩国(k0331186p),gfapelisakit:milliporecorporantion,billerica,ma,usa(ns830)}内按规程进行。所有反应结束后,利用光谱仪(spectrophotometer),在450nm处吸光度测定样品的od值(opticaldensity),利用定量分析程序,算出浓度。利用elisa测定的生物标记为β-淀粉样蛋白1-42、tnf-α、gfap(glialfibrillaryacidicprotein;胶质纤维酸性蛋白)。由elisa测定的生物标记的表达量是由分别计算对比组和实验组(实施例1的肽的50mg/kg投入组)的平均值和标准偏差来算出的。其结果示于图3至图5。图3是表示本发明的一个实施例的β-淀粉样蛋白1-42的降低效果的确认结果的图谱。如图3所示,测得对比组的β-淀粉样蛋白1-42浓度为76.03±25.63ng/mg蛋白质,测得实验组的β-淀粉样蛋白1-42浓度为57.56±28.47ng/mg蛋白质,确认与对比组相比有些减少。图4是表示本发明的一个实施例的tnf-α的降低效果的确认结果的图谱。如图4所示,测得对比组的tnf-α浓度为1109.91±285.30pg/mg蛋白质,测得实验组的tnf-α浓度为798.99±172.90pg/mg蛋白质,确认与对比组相比统计上显著地(p<0.05)减少。tnf-α为炎症因子,它的降低可以解释为炎症的抑制。特别是,从其结果可知,根据实施例1的肽,可抑制脑内炎症。图5是表示本发明的一个实施例的gfap降低效果的确认结果的图谱。如图5所示,星形胶质细胞(astrocyte)标记gfap(glialfibrillaryacidicprotein)的情况,测得对比组的gfap浓度为70.61±26.82ng/mg蛋白质,测得实验组的gfap浓度为47.63±24.92ng/mg蛋白质,确认与对比组相比有些减少。从这些生物标记实验结果可以看出,将实施例1的肽投入脏器时,脑内β-淀粉样蛋白就会减少,抑制炎症反应。这些生物标记的变化也可以认为支持实施例1的肽增加动物的学习和记忆恢复效果的结果。如上结果可以看出,根据本发明的肽或药学上可允许的其盐,可以治疗和/或预防阿尔茨海默氏病(alzheimer’sdisease)、血管性痴呆、酒精性痴呆、路易体痴呆等痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、和/或脑内炎症等,这些治疗和/或预防是通过抑制β-淀粉样蛋白流入脑内、抑制β-淀粉样蛋白脑内沉着、和/或抑制脑内炎症而实现的。《β-淀粉样蛋白流入脑内的抑制效果的确认ii》以实施例1的上述实验结果为基础,与实施例1一起进行了用于确认实施例2、对比例1至2是否显示β-淀粉样蛋白1-42流入脑内的抑制效果的实验。实施例2的肽是除去实施例1的肽的末端f的由四个氨基酸组成的肽(dgef),对比例1是国际专利公开公报wo2006/031330a2公开的由神经细胞保护肽中典型且核心的氨基酸序列(daef)组成的肽,对比例2是包括相应氨基酸序列的神经细胞保护肽中效果最优异的肽。具体地说,首先将1mg的β-淀粉样蛋白1-42(americanpeptidecompany,sunnyvale,ca,usa)利用2ml的六氟异丙醇(hexafluoroisopropanol:hfip)处理后,常温放置三天,按100μl分别装入试管(tube)。利用真空仪(speedvacuum)蒸发六氟异丙醇(hfip)后,分装的一个试管(tube)中加入10μl的无水二甲亚砜{anhydrousdmso(dimethylsulfoxide)}充分溶解后,添加400μl的磷酸缓冲生理食盐水(pbs;phosphatebuffersaline),最终获得25μm的β-淀粉样蛋白1-42溶液。已准备的icr老鼠(thejacksonlaboratory,barharbor,me,usa)分为正常组、对比组、四组实验组。实验组中分别以25mg/kg腹腔投入实施例1、实施例2、对比例1、对比例2的肽,对比组中除了替代肽使用赋形剂(10%dmsoinsaline,10ml/kg)之外,其他与实验组进行相同处理。经过20分钟后,在对比组和实验组,从尾巴静脉将400μl的25μmβ-淀粉样蛋白1-42静脉注射(i.v)。另外,正常组中除了没有使用β-淀粉样蛋白1-42之外,其他与对比组进行相同处理。尾巴静脉注射投入β-淀粉样蛋白10分钟后,利用肝素钠化处理的肝素钠化毛细管(sodiumheparinizedcapillarytube)从老鼠眼底静脉抽取50μl的血,并立即用二氧化碳(co2)气体安乐死后,摘除老鼠的右半球并保管在液氮中。抽取的所有血样在13000rpm离心分离10分钟。已准备的试管(tube)中收集上层液,以1/4000稀释后,将β-淀粉样蛋白1-42利用酶免疫测定法(elisa;enzyme-linkedimmunosorbentassay,或者enzyme-linkedimmunospecificassay)测定。冷冻的右半球中加入3ml的ripa缓冲液(ripabuffer;radioimmunoprecipitationassaybuffer)进行超声处理(sonication)后,利用离心分离器分离上清液,然后进行bca测定(bcaassay;bicinchoninicacidassay),测定蛋白质(protein)浓度。bca测定是在试剂盒(thermoscientific,waltham,ma,usa,cat.no.23227)内按规程进行。脑内β-淀粉样蛋白1-42浓度是在ripa均质悬浊液(ripa-homogenate)中利用酶免疫测定法(elisa)测定。酶免疫测定法(elisa)是在试剂盒(iblinternational,hamburg,germany,codeno.27711)内按规程进行。其结果示于下面表2。【表2】脑内β-淀粉样蛋白1-42浓度(pg/mg蛋白质)正常组0.0±11.9对比组60.8±14.8实施例1的处理组54.8±8.0实施例2的处理组48.8±14.7对比例1的处理组69.5±6.1对比例2的处理组87.6±14.9如表2所述,实施例2的肽与实施例1的肽相同,有效抑制β-淀粉样蛋白流入脑内。因此,实施例2的肽与实施例1的肽相同,能够抑制β-淀粉样蛋白流入脑内,抑制β-淀粉样蛋白沉着脑内。其结果,实施例2的肽也可以确认治疗和/或预防β-淀粉样蛋白的脑内沉着相关的阿尔茨海默氏病(alzheimer’sdisease)、血管性痴呆、酒精性痴呆、路易体痴呆等痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、和/或脑内炎症等,可以确认这些预防和/或治疗是通过抑制β-淀粉样蛋白流入脑内、抑制β-淀粉样蛋白脑内沉着和/或抑制脑内炎症而实现的。但是,对比例1和对比例2的肽与实施例1的肽不同,不能抑制β-淀粉样蛋白流入脑内。从这些结果可以看出,本发明的肽或药学上可允许的其盐显示与已知的神经保护性肽完全不同的效果。因此,根据本发明,在不需要通过血脑屏障的附加手段也能抑制β-淀粉样蛋白作用于脑内的方面,具有容易使用的优点。另外,本发明从源头抑制β-淀粉样蛋白作用于脑内,因此在β-淀粉样蛋白作用于脑内的抑制方面,使用更直接,具有优异的使用性。《β-淀粉样蛋白流入脑内的抑制效果的确认iii》通过如下方法,确认实施例1和实施例2的肽与rage结合,从而确认抑制β-淀粉样蛋白和rage的结合,抑制β-淀粉样蛋白流入脑内。这是血脑屏障内皮细胞膜上表达的rage(receptorforadvancedglycationendproducts)起到将β-淀粉样蛋白输送到脑部的作用,利用了rage和β-淀粉样蛋白的结合抑制物质有效治疗或预防脑组织中沉着β-淀粉样蛋白蛋白质相关的疾病-阿尔茨海默氏病、认知障碍、或痴呆等(参照neurology.2004jun8;62(11):1984-1989;jclininvest.2012apr;122(4):1377-1392等)。具体地说,利用mst(microscalethermophoresis)技术,测定实施例1或实施例2的肽与rage的结合能力。首先,利用试剂盒{monolithnttmproteinlabelingkitred-nhs(l001,nanotempertechnologies)},将redfluorescentdyent-647-nhs结合在extracellulardomain重组蛋白质rage(l1629-h08h,sinobiologicalinc.)后精制。然后,准备rage溶液,使redfluorescentdyent-647-nhslabeledrage在mstbuffer(50mmtris-hclph7.4,150mmnacl,10mmmgcl2,0.05%tween-20)溶液中的含量为20μm。另外,将实施例1或实施例2的肽利用mstbuffer分别反复稀释,从50μm到1.52μm,准备16个梯度的浓度的肽溶液。然后,将rage溶液和肽溶液分别加入100μl进行混合,注入毛细管中后,在monolithnt.115(g009,nanotempertechnologies)托盘按浓度顺序装入。根据monolithnt.115工作方法启动软件。以相同方法重复三次后,得到kd(dissociationconstant)的平均值。其结果,rage和实施例1的肽之间的kd为76.86nm,rage和实施例2的肽之间的kd为80.89nm。从其结果可以看出,实施例1的肽和实施例2的肽都与rage结合,抑制β-淀粉样蛋白与rage结合,起到抑制流入脑内的作用。因此,本发明的肽抑制rage与β-淀粉样蛋白的结合,从而抑制β-淀粉样蛋白流入脑内,更能从源头抑制β-淀粉样蛋白对脑内作用。其结果,本发明的肽或药学上可允许的其盐可以治疗和/或预防与β-淀粉样蛋白的脑内沉着相关的阿尔茨海默氏病(alzheimer’sdisease)、血管性痴呆、酒精性痴呆、路易体痴呆等痴呆、帕金森(parkinson)病、神经性舞蹈(huntington)病、和/或脑内炎症等。另外,本发明在β-淀粉样蛋白作用于脑内的抑制方面,使用更直接、容易,具有优异的使用性。《制备例》制备注射液剂将500mg的通过与实施例1或实施例2相同方法制备的肽溶解在生理食盐水中,制得10ml的溶液。制得的溶液填充在注射剂用安瓿瓶,制备制备例1或制备例2的注射液剂。工业上利用可能性本发明具有β-淀粉样蛋白流入脑内的抑制效果。另外,本发明在β-淀粉样蛋白作用脑内的抑制方面,更加容易使用,具有使用性优异的效果。因此,本发明具有工业上利用可能性。sequencelisting<110>因首生物科学有限公司(ensolbiosciencesinc.)<120>anovelpeptideandusethereof<130>p55006kro<160>4<170>kopatentin3.0<210>1<211>5<212>prt<213>artificialsequence<220><223>peptide<400>1aspglygluphephe15<210>2<211>4<212>prt<213>artificialsequence<220><223>peptide<400>2aspglygluphe1<210>3<211>4<212>prt<213>artificialsequence<220><223>peptide<400>3aspalagluphe1<210>4<211>8<212>prt<213>artificialsequence<220><223>peptide<400>4vallysmetaspalagluphearg15当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1