建立自外周血单核细胞的神经前体细胞及其构建方法与流程
本发明涉及建立自外周血单核细胞的神经前体细胞及其构建方法。
背景技术:
阿尔茨海默病(alzheimer’sdisease,ad)是一种在老年人群中高发的神经退行性疾病,随着全世界人口老龄化的加剧和平均寿命的延长,ad发病率呈明显的逐年上升趋势,已经成为危害人类,特别是老年人身体健康和生活质量的重大疾病。目前,who已经把ad定为21世纪五大重点疾病之一。据估计,2030年全球对阿尔兹海默病患者提供的治疗、看护的费用及社会成本将超过1万1千亿美元,成为医疗和社区体系的重要负担。ad主要的临床症状是失忆型认知功能障碍、语言功能恶化和视觉空间缺陷,晚期临床病人还表现出各种神经精神症状和行为障碍,日常生活能力进行性减退,最终发展为痴呆,甚至死亡(cummings,2004)。ad患者的典型神经病理特征随着病情的加剧依次表现为:大脑内β淀粉样蛋白肽沉积即aβ斑(amyloid-betaplaques)、磷酸化的tau蛋白组成的神经纤维缠结(neurofibrillarytangles)和神经元细胞的大量丢失(neuronalloss)(hardyandselkoe,2002)。
ad是多因素隐性发病,病程进展缓慢,病因和发病机制复杂,迄今尚未阐明。ad的潜伏期长达10-25年,病人就诊时,病情基本上已经发展到了中期、甚至晚期,错失了在病人身上研究ad发病以及进行药物预防和干预的最佳时机。这从根本上阻碍了人们对这类疾病治疗策略的研究,因此,ad的治疗在世界临床范围内都是个难题。一直以来,ad的治疗主要是通过有限的几种药物来调节和改善病人的基底前脑胆碱能系统的功能,以期减缓病人认知功能的衰退,但是这几种药的治疗效果普遍不佳(fisher,2008;kukaretal.,2008)。因为没有能够有效干预和治愈ad的药物,所以近年来ad治疗策略的研究主要集中在药物研发上面。在2012年,三大制药公司pfizer、johnson&johnson和elililly先后声明停止其aβ抗体药物的临床实验,宣布ad新药研发的失败,标志着以药物为主的ad治疗策略进入瓶颈时期。因此,当前迫切需要探索和建立新的可以有效干预和治疗ad的策略。一般认为,在ad发病早期,aβ引起大脑神经环路的稳定性和完整性的受损以及神经可塑性下降;ad发病晚期,aβ和tau神经缠结引起大量神经元死亡,这些因素直接导致了病人的认知功能障碍(palopandmucke,2010;selkoe,2002)。因此,通过补充丢失的神经元修复受损的神经环路从而达到改善ad病人认知能力,被认为是治疗ad策略的新方向(canteretal.,2016)。近年来,随着胚胎干细胞(embryonicstemcell,esc)向神经元,特别是亚型特异性的功能神经元定向分化的成功,基于干细胞的细胞替代治疗在神经退行性疾病上的应用研究取得了一系列突破性进展,为ad治疗带来新的希望(lindvallandkokaia,2006;lindvalletal.,2004)。
随着重编程技术的发展,近几年来已有许多研究工作通过过表达特定转录因子或结合小分子化合物,成功地将人的成纤维细胞转分化为神经干细胞/前体细胞(nsc/npc)(kumaretal.,2012;luetal.,2013;ringetal.,2012;yuetal.,2015;zhuetal.,2014)。运用类似的策略,也有工作从人的尿液细胞(chengetal.,2014)、星形胶质细胞(cortietal.,2012)或脐带血细胞(castanoetal.,2014;liaoetal.,2015;tangetal.,2016)转分化得到神经前体细胞。相比重编程普遍使用的皮肤真皮组织来源的成纤维细胞,外周血单核细胞(pbmncs)尤其是其中的成红血球细胞,非常容易获得;其生命周期较短,受环境影响较弱,从而避免了因外界环境因素而引发的基因突变,是一类非常理想的重编程起始细胞。2016年报道的一项研究就是以外周血单核细胞为起始细胞,以episomal质粒为载体,通过表达六个转录因子〔包括ips四因子(sox2,oct4,c-myc,klf4)、nanog和lin28〕,并结合两个化合物,得到了神经干细胞并在体外实验中验证其功能(tangetal.,2016)。然而,关于从外周血单核细胞转分化得到的神经干细胞是否能在宿主动物脑内存活并与宿主的神经环路整合,目前还没有相关研究。
技术实现要素:
本文第一方面提供一种从人外周血单核细胞经重编程建立诱导的神经前体细胞的方法,该方法包括使用表达sox2、oct4、c-myc和klf4的非整合型附加体质粒转染人外周血单核细胞,和将转染的人外周血单核细胞在含有tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂的培养基中培养的步骤。
在一个或多个实施方案中,所述非整合型附加体质粒是orip/ebna1基附加体质粒(episomalvector,ev);优选地,该质粒中的启动子是脾脏病灶形成病毒(spleenfocusformingvirus,sffv)长末端重复序列(ltr)启动子。
在一个或多个实施方案中,所述方法还包括使用表达bcl-xl的非整合型附加体质粒转染所述人外周血单核细胞的步骤。
在一个或多个实施方案中,使用pev-sffv-oct4-2a-sox2-wpre、pev-sffv-myc-2a-klf4-wpre和任选的pev-sffv-bcl-xl-wpre转染所述人外周血单核细胞。
在一个或多个实施方案中,该方法包括电转后复苏步骤,即在人外周血单核细胞培养基中培养转染的人外周血单核细胞18-60小时。
在一个或多个实施方案中,所述方法包括滋养层培养步骤,即将转染复苏后的细胞转移到滋养层中,在滋养层细胞的培养液中培养12-36小时。
在一个或多个实施方案中,所述滋养层细胞为小鼠胚胎成纤维细胞。
在一个或多个实施方案中,所述方法包括在重编程中间过程中用ksr培养液培养转染后的人外周血单核细胞,包括将滋养层细胞的培养液替换成ksr培养液,培养3-7天。
在一个或多个实施方案中,所述ksr培养液以dmem/f12为基础培养基,添加有15-25%的knockout血清替代物(ksr),1×l-谷氨酰胺,1×非必需氨基酸(neaa)溶液,0.05-0.2mm2-巯基乙醇,5-20ng/mlbfgf和0.15-0.40mmnab。
在一个或多个实施方案中,所述方法包括重编程诱导细胞命运转变的步骤,包括在神经前体细胞培养基中培养处于重编程中间状态的细胞,其中该神经前体细胞培养基中添加有tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和camp激活剂。
在一个或多个实施方案中,所述神经前体细胞培养基中tgf-β抑制剂的浓度为1-50μm,gsk3β抑制剂的浓度为1-15μm,组蛋白去乙酰化酶抑制剂的浓度为1nm到-1mm,腺苷酸环化酶激活剂的浓度为5-50μm。
在一个或多个实施方案中,诱导培养步骤中,每12-60小时更换一次培养基。
在一个或多个实施方案中,所述方法包括,对于前两代神经前体细胞,使用添加了5-20ng/mlhlif、1-10μmsb431542和1-10μmchir99021的神经前体细胞培养基培养。
在一个或多个实施方案中,对于第三代及之后的神经前体细胞,使用添加了10-50ng/ml的bfgf和10-50ng/ml的egf的神经前体细胞培养基培养。
在一个或多个实施方案中,所述神经前体细胞培养基的基础培液为n2b27培养液。
在一个或多个实施方案中,所述n2b27培养液以体积比为1:1的dmem/f12和neurobasal为基础培养基,添加有1×n2、1×b27、1×l-谷氨酰胺、1×非必需氨基酸和0.05-0.20mm2-巯基乙醇。
本文还提供一种诱导性神经前体细胞,该细胞衍生自人外周血单核细胞,并表达神经前体细胞标记基因和增殖性标记基因。
在一个或多个实施方案中,所述神经前体细胞标记基因包括nestin、pax6、sox1、sox2和fabp7。
在一个或多个实施方案中,所述增殖性标记基因为ki67。
在一个或多个实施方案中,所述诱导性神经前体细胞与hesc体外分化得到的皮层神经前体细胞相似,和/或与胚胎发育8-9周的皮层和前脑组织中的细胞相似。
在一个或多个实施方案中,所述诱导性神经前体细胞具有向神经元、星形胶质细胞和少突胶质细胞的分化潜能。
在一个或多个实施方案中,所述诱导性神经前体细胞能分化为皮层谷氨酸能神经元。
本文还提供一种试剂盒,所述试剂盒含有tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂。在一个或多个实施方案中,所述试剂盒还含有knockout血清替代物、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf、nab、n2、b27、hlif、sb431542、chir99021和egf中的任意一种或任意多种或全部。
在一个或多个实施方案中,所述试剂盒还含有dmem/f12培养基,以及knockout血清替代物、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf和nab;其中,所述knockout血清替代物、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf和nab各自独立包装;其中,独立包装的knockout血清替代物、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf和nab其各自的含量使得以dmem/f12培养基为基础培养基配制得到的ksr培养基含有15-25%的knockout血清替代物,1×l-谷氨酰胺,1×非必需氨基酸(neaa)溶液,0.05-0.2mm2-巯基乙醇,5-20ng/mlbfgf和0.15-0.40mmnab。
在一个或多个实施方案中,所述试剂盒含有神经前体细胞培养基,该神经前体细胞培养基以体积比为1:1的dmem/f12和neurobasal为基础培养基,添加有1×n2、1×b27、1×l-谷氨酰胺、1×非必需氨基酸和0.05-0.20mm2-巯基乙醇;优选地,该神经前体细胞培养基中还添加有所述tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂,其中tgf-β信号抑制剂的浓度为1-50μm,gsk3β抑制剂的浓度为1-10μm,组蛋白去乙酰化酶抑制剂的浓度为0.2-0.8mm,腺苷酸环化酶激活剂的浓度为5-15μm。
在一个或多个实施方案中,所述试剂盒还含有添加了5-20ng/mlhlif、1-10μmsb431542和1-10μmchir99021的神经前体细胞培养基培养;和/或添加了10-50ng/ml的bfgf和10-50ng/ml的egf的神经前体细胞培养基培养;优选地,所述神经前体细胞培养基为n2b27培养液。
本文还提供本文所述的诱导性神经前体细胞在制备用于改善对象学习记忆能力的药物中的应用,在制备治疗对象的ad或缓解其ad症状用的药物中的应用。
本文还提供以下(1)和/或(2)所述的物质在制备诱导性神经前体细胞中的应用:
(1)转录因子sox2、oct4、c-myc和klf4,其编码序列或表达转录因子sox2、oct4、c-myc和klf4的非整合型附加体质粒;
(2)tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂,或含有tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂的培养基。
附图说明
图1:成人外周血单核细胞来源的inpc细胞系的建立。a、pbmnc重编程得到inpc细胞系的方法示意图。b、稳定传代第15代的inpc表达高水平的npc标记基因和增殖性标记基因ki67。c、各标记基因阳性细胞所占百分比统计。标尺:25μm。
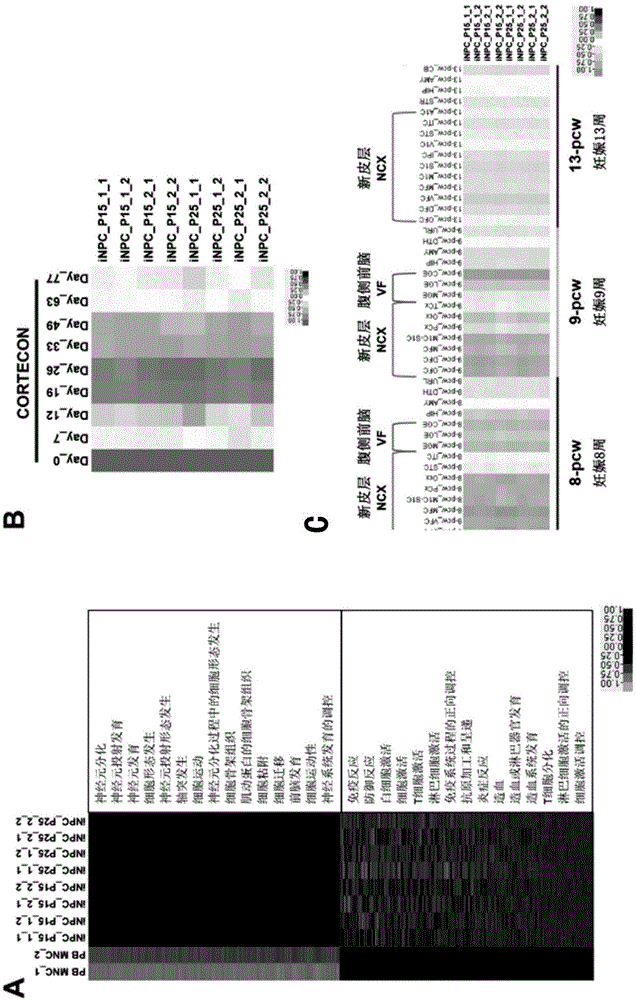
图2:人inpc细胞系的转录组测序分析。a、pbmnc和inpc细胞系前2000个差异表达基因及其go分析。b、inpc细胞系的转录组测序数据和已发表的hesc神经分化过程中的测序数据(cortecon)的比对分析。c、inpc细胞系的测序数据与brainspan数据库中妊娠8周、9周和13周胎儿各脑区组织的rna测序数据。
图3:人inpc的分化潜能。a、人inpc具有向神经元、星形胶质细胞和少突胶质细胞的分化潜能,但更倾向于分化成神经元。b、人inpc主要分化为皮层谷氨酸能神经元,与转录组测序数据预测的一致。标尺:25μm。
图4:人inpc在小鼠脑内的存活和迁移和分化。a、人inpc移植入小鼠脑内2、4和6个月的细胞存活率维持在70%以上。b和c、人inpc在移植后2、4和6个月的分布随时间推移逐渐向四周迁移,c为b图中方框内区域细胞的免疫荧光染色结果,ku80能特异性识别人的细胞核。标尺:b,1mm;6m图中虚线框内标尺为200μm。c,25μm。
图5:人inpc在小鼠脑内的分化。a、人inpc在小鼠脑内主要分化为神经元和一部分星形胶质细胞。b和c、inpc在小鼠脑内主要分化为谷氨酸能神经元和少量胆碱能神经元。标尺:25μm。
图6:人inpc分化的神经元在小鼠脑内逐渐成熟。a、收集移植人inpc后2、4、6个月不同时间的小鼠脑片,运用膜片钳技术对植入的细胞进行膜特性的记录。b、植入的细胞一部分可以产生自发的动作电位,显示其具有电生理活性。c、细胞静息膜电位和输入膜电阻的测定结果。d和e、对植入细胞进行不同强度的电流刺激,可以观察到,与2个月的神经元相比,4个月和6个月的神经元即使是在较高强度的电流刺激下,仍能发放连续的动作电位(d),且发放连续动作电位的比例明显提高(e)。f、f-i曲线也显示,4个月和6个月的神经元可以保持更大范围的f-i线性关系。
图7:人inpc分化的神经元整合入宿主小鼠的神经环路。a、植入的inpc分化的神经元可以表达自发的抑制性和兴奋性的突触后电流(ipsc和epsc)。b、植入神经元的ipsc和epsc的risetime和decaytime随时间推移降低。c、植入神经元中能检测到突触后电流的细胞所占比例随时间推移增加。d、左,光遗传实验示意图;右,植入的表达chr2-mcherry的神经元可被蓝光激活,产生内向电流,并发放连续的动作电位。e、宿主小鼠海马dg区的颗粒细胞不能被蓝光激活,但可以产生对蓝光刺激响应的突触后电流。
图8:小鼠的y迷宫行为学检测和海马长时程增强检测(ltp)。a、对野生型c57小鼠、ad模型小鼠5xfad、免疫缺陷ad模型小鼠rag2-/-/5xfad和移植了inpc的rag2-/-/5xfad小鼠共四组小鼠进行y迷宫的行为学检测结果。b、对四组小鼠的ltp检测结果表明,与野生型小鼠相比,5xfad和rag2-/-/5xfad均呈现出减弱的ltp,而移植了inpc的ad鼠的ltp可以回复到接近正常小鼠的水平。
具体实施方式
应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。此外,应理解的是,除非另有说明,否则本文所述的各浓度,尤其是培养基或培养液中各成分的浓度均为以体积计的终浓度。
本文从人外周血中分离出单核细胞,利用非整合的附加体质粒电转方式,结合小分子化合物的处理,建立可以稳定传代的神经干细胞系。本文获得的神经前体细胞在小鼠脑内可以很好的存活、分化和迁移,其分化得到的神经元在脑内逐渐成熟,并功能性地整合入宿主的神经环路中,参与修复ad小鼠的学习和记忆能力,提高ad小鼠的神经可塑性,具有用于ad细胞替代治疗的潜能。
因此,本文提供一种从人外周血单核细胞经重编程建立诱导的神经前体细胞的方法,该方法包括使用表达sox2、oct4、c-myc和klf4的非整合型附加体质粒转染人外周血单核细胞,和将转染的人外周血单核细胞在含有tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂的培养基中培养的步骤。
可采用本领域周知的非整合型附加体质粒来实施本文的方法。例如,在某些实施方案中,非整合型附加体质粒是orip/ebna1基附加体质粒(episomalvector,ev)。优选的是,用于本文的非整合型附加体质粒中的启动子是脾脏病灶形成病毒(spleenfocusformingvirus,sffv)长末端重复序列(ltr)启动子。
应理解的是,可使用一种或多种非整合型附加体质粒表达sox2、oct4、c-myc和klf4。例如,可使用四种非整合型附加体质粒,其分别表达sox2、oct4、c-myc和klf4;或者,可使用两种非整合型附加体质粒,其可表达两两组合的sox2、oct4、c-myc和klf4,或者一质粒表达sox2、oct4、c-myc和klf4中的一种转录因子,而另一质粒表达余下3种转录因子;或者可使用三种非整合型附加体质粒,其中一种质粒表达sox2、oct4、c-myc和klf4中的一种转录因子,一种质粒表达sox2、oct4、c-myc和klf4中的另一种转录因子,余下的一种质粒表达余下的转录因子。这可由本领域技术人员根据实际情况容易确定。此外,使用多种非整合型附加体质粒时,可使用相同或不同的非整合型附加体质粒。
在本文的某些实施方案中,使用两种非整合型附加体质粒,其分别表达oct4+sox2和myc+klf4;其中,两种非整合型附加体质粒是相同的,即均为orip/ebna1基附加体质粒。优选的,质粒中的动子是脾脏病灶形成病毒(spleenfocusformingvirus,sffv)长末端重复序列(ltr)启动子。当用一种质粒同时表达两种或多种转录因子时,转录因子之间可使用常用的接头序列如2a连接。
在本文的某些实施方案中,所述方法还包括使用表达抗凋亡基因的非整合型附加体质粒转染所述人外周血单核细胞的步骤。适用于本发明的抗凋亡基因可以是本领域周知的用于细胞重编程的抗凋亡基因,包括但不限于bcl-xl。在某些实施方案中,该非整合型附加体质粒也是orip/ebna1基附加体质粒;优选的,质粒中的动子是脾脏病灶形成病毒(spleenfocusformingvirus,sffv)长末端重复序列(ltr)启动子。
转染可以是本领域周知的转染方式,如电转。可采用常规的转染试剂实施转染。例如,在某些实施方案中,进行电转时,使用amaxa4d-nucleofector核转仪和p3primarycell4d-nucleofectorxkit转染试剂(lonza),按照protocolsforunstimulatedhumancd34+cells说明书步骤实施。转染时,与细胞共混的非整合型附加体质粒的量为常规用量,可由本领域技术人员根据实际情况确定。例如,对于2×106个待转染细胞,可使用大约4μg的表达oct4+sox2的非整合型附加体质粒和大约4μg的表达myc+klf4的非整合型附加体质粒。如果同时使用表达抗凋亡因子的非整合型附加体质粒,其用量大约为2μg。
转染后进行复苏。复苏步骤包括在人外周血单核细胞培养基中培养转染的人外周血单核细胞,复苏时间可为10-80小时,如18-60小时或40-50小时。可使用本领域常规的人外周血单核细胞培养基(如本文所述的mnc培液)来实施该复苏步骤。
复苏后,可将复苏的细胞转移到滋养层中,在滋养层细胞的培养液中培养12-36小时。通常,滋养层细胞为本领域常用于细胞培养的滋养层细胞,如小鼠成纤维细胞。之后,将该培养液替换成ksr培液,培养3-7天。此培养使所述细胞处于重编程中间状态。
ksr培液为本领域周知的培养液。在某些实施方案中,本发明使用的ksr培液为含有15-25%的knockout血清替代物(ksr)的dmem/f12溶液,其添加有1×glutamax、1×neaa、0.05-0.20mm的β-me(2-巯基乙醇)、5-20ng/ml的bfgf和0.15-0.40mm的nab。可根据实际培养情况对ksr培养中的成分作出适当调整。
使用ksr培液培养3-7天后,优选培养大约5天后,将ksr培液替换成添加了tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂的n2b27培液(本文也称为“诱导培养液”或“诱导培养基”)。此培养将诱导细胞命运转变,使处于重编程中间状态的细胞转变成诱导的神经前体细胞。
本文中,n2b27培液为添加了1×n2、1×b27、1×glutamax、1×neaa和0.05-0.15mm的β-me的体积比为1:1的dmem/f12:neurobasal培液。
可使用本领域周知的tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂,试剂的浓度可以是其有效起作用的浓度。合适的tgf-β抑制剂包括但不限于sb431542、repsox和a83-01等。通常,tgf-β抑制剂的浓度在1-50μm的范围内。合适的gsk3β抑制剂尤其包括可促进wnt信号的试剂,包括但不限于chir99021和kenpaullone等。通常,gsk3β抑制剂的浓度可在1-15μm的范围内。合适的组蛋白去乙酰化酶抑制剂可以是表观遗传调控因子,包括但不限于vpa、tsa、saha和丁酸钠等,组蛋白去乙酰化酶抑制剂的浓度可在1nm到1mm的范围内。合适的腺苷酸环化酶激活剂包括但不限于forskolin;腺苷酸环化酶激活剂的浓度可在5-50μm的范围内。应理解的是,不同试剂,其起到有效作用的浓度可能是不同的,但这是本领域技术人员可容易确定的。例如,sb431542的有效浓度范围可在5-15μm的范围内,repsox的有效浓度通常在1-10μm的范围内,a83-01的有效浓度通常在0.2-5μm的范围内,chir99021的有效浓度通常在1-5μm的范围内,kenpaullone的有效浓度通常在2-10μm的范围内,vpa的有效浓度通常在0.3-0.8mm的范围内,tsa的有效浓度通常在5-20nm的范围内,saha的有效浓度通常在2-10μm的范围内,丁酸钠的有效浓度通常在0.2-1mm的范围内,forskolin的有效浓度通常在5-15μm的范围内。
在该n2b27培液中培养时,每12-60小时(如大约1天半)更换一次培养基,直至克隆出现。可挑取具有npc形态的克隆,进行扩增和鉴定后可获得神经前体细胞。
通常,在前两代的神经前体细胞的培养中,其培养液为添加了5-20ng/mlhlif、1-10μmsb431542和1-10μmchir99021的神经前体细胞培养基(如n2b27培液)。通常,在添加了10-50ng/ml的bfgf和10-50ng/ml的egf的神经前体细胞培养基(如n2b27培液)中培养第三代及之后的神经前体细胞。可使用accutase进行持续传代。
因此,在某些实施方案中,本文所述的人外周血单核细胞经重编程建立诱导的神经前体细胞的方法包括前文所述的转染、复苏、滋养层培养、ksr培液培养和诱导处于重编程中间状态的细胞转变成诱导的神经前体细胞的步骤。
本文也包括一种诱导性神经前体细胞,该细胞衍生自人外周血单核细胞,并表达神经前体细胞标记基因和增殖性标记基因。在某些实施方案中,所述神经前体细胞标记基因包括nestin、pax6、sox1、sox2和fabp7。在某些实施方案中,所述增殖性标记基因为ki67。在某些实施方案中,本文所述的诱导性神经前体细胞与hesc体外分化得到的皮层神经前体细胞相似,如该诱导性神经前体细胞的转录组测序数据与hesc体外分化得到的皮层神经前体细胞的测序数据(cortecon)有强相关性(相关系数大于或等于0.5);和/或与胚胎发育8-9周的皮层和前脑组织中的细胞相似,如该诱导性神经前体细胞的测序数据与brainspan数据库中胚胎发育8-9周的皮层和前脑组织中细胞有强相关性(相关系数大于或等于0.5)。本文的诱导性神经前体细胞还具有向神经元、星形胶质细胞和少突胶质细胞的分化潜能。在某些实施方案中,本文的诱导性神经前体细胞能分化为皮层谷氨酸能神经元。在某些实施方案中,本文所述的诱导性神经前体细胞为采用前文所述的方法重编程建立得到。
本文也包括本文所述诱导性神经前体细胞的后代,例如对其进行诱导分化后获得的后代细胞,包括但不限于谷氨酸能神经元、星形胶质细胞和少突胶质细胞等。
本文还提供一种试剂盒,所述试剂盒含有tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂。在某些实施方案中,所述试剂盒还含有人外周血单核细胞培养基、滋养层细胞的培养液、dmem/f12培养基、neurobasal、knockout血清替代物(ksr)、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf、nab、n2、b27、hlif、sb431542、chir99021和egf中的任意一种或任意多种或全部。在使用时,可根据实际情况,使用试剂盒所含有的上述成分配置成所需的培养基或培养液,用于实施本发明的各项实施方案所述的方法。
试剂盒中的各成分可独立包装。因此,在某些实施方案中,所述试剂盒含有dmem/f12培养基,以及knockout血清替代物、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf和nab;其中,所述knockout血清替代物、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf和nab各自独立包装;其中,独立包装的knockout血清替代物、l-谷氨酰胺、非必需氨基酸(neaa)溶液、2-巯基乙醇、bfgf和nab其各自的含量使得以dmem/f12培养基为基础培养基配制得到的ksr培养基含有15-25%的knockout血清替代物,1×l-谷氨酰胺,1×非必需氨基酸(neaa)溶液,0.05-0.2mm2-巯基乙醇,5-20ng/mlbfgf和0.15-0.40mmnab。
或者,也可如本申请所述预先配制成适用于本文所述各步骤的培养液,如ksr培养液、诱导培养基、培养前两代神经前体细胞的培养液以及培养第三代及之后的神经前体细胞的培养液等。因此,在某些实施方案中,所述试剂盒含有诱导培养基,该诱导培养基以体积比为1:1的dmem/f12和neurobasal为基础培养基,添加有1×n2、1×b27、1×l-谷氨酰胺、1×非必需氨基酸和0.05-0.20mm2-巯基乙醇,以及所述tgf-β抑制剂、gsk3β抑制剂、组蛋白去乙酰化酶抑制剂和腺苷酸环化酶激活剂,其中tgf-β信号抑制剂的浓度为1-50μm,gsk3β抑制剂的浓度为1-10μm,组蛋白去乙酰化酶抑制剂的浓度为0.2-0.8mm,腺苷酸环化酶激活剂的浓度为5-15μm。
在某些实施方案中,所述试剂盒还含有添加了5-20ng/mlhlif、1-10μmsb431542和1-10μmchir99021的神经前体细胞培养基培养;和/或添加了10-50ng/ml的bfgf和10-50ng/ml的egf的神经前体细胞培养基培养;优选地,所述神经前体细胞培养基为n2b27培养液。
进一步地,在某些实施方案中,所述试剂盒还含有神经分化培液,如以b27培液为基础培养基,添加有0.5-5μg/ml的层粘连蛋白、0.5-5μg/ml的fn、5-20ng/ml的bdnf、5-20ng/ml的nt3、5-20ng/ml的igf-1、5-20ng/ml的cntf和0.5-2μm的camp,用于进行自发的神经分化。
在某些实施方案中,本文的试剂盒含有本文所述的诱导培养基,以及任选的人外周血单核细胞培养基、滋养层细胞的培养液、ksr培养液、培养前两代神经前体细胞的培养液、培养第三代及之后的神经前体细胞的培养液和神经分化培液中的任意一种或多种。
本文还提供本文所述的诱导性神经前体细胞在制备用于改善对象学习记忆能力的药物中的应用,在制备治疗对象的ad或缓解其ad症状用的药物中的应用。
下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并非意图限制本发明的范围。实施例中所用到的方法和试剂,除非另有说明,否则为本领域所常用方法和试剂。
一、方法和材料
1、人外周血单核细胞的分离和培养
共有两位健康志愿者的外周血样本被用于建立神经前体细胞系。外周血单核细胞的分离和培养方法参照已发表文献(doweyetal.,2012)。收集外周血3-8ml通过ficoll-paquepremium(sigma)进行密度梯度离心分离得到单核细胞(mnc),在mnc培液中培养8-12天,隔天计数并换液,直至细胞数连续增长两次,则可开始进行转分化的操作。
mnc培液:imdm:ham’sf12(1:1),添加1%its-x、1%化学成分确定的脂质浓缩物、1×glutamax、50μg/mll-抗坏血酸(sigma)、5mg/mlbsa(sigma)、200μm1-硫代甘油(sigma)、100ng/mlscf(peprotech)、10ng/mlil-3(peprotech)、2u/mlepo、40ng/mligf-1(peprotech)、1μm地塞米松(mpbiomedicals)、100μg/ml全铁转铁蛋白(sigma)(未注明的试剂均购自lifetechnology)。
2.通过附加体转染方式从外周血单核细胞转分化得到神经前体细胞
体细胞重编程所用episomal质粒组合pev-sffv-oct4-2a-sox2-wpre、pev-sffv-myc-2a-klf4-wpre和pev-sffv-bcl-xl-wpre为美国罗马琳达大学张孝兵实验室建立(su,r.j.等,2013,efficientgenerationofintegration-freeipscellsfromhumanadultperipheralbloodusingbcl-xltogetherwithyamanakafactors,plosone8,e64496),通过美国约翰霍普金斯大学程临钊教授惠赠。使用amaxa4d-nucleofector核转仪和p3primarycell4d-nucleofectorxkit转染试剂(lonza),按照protocolsforunstimulatedhumancd34+cells说明书步骤,对2×106的外周血单核细胞进行附加体质粒的电转(4μg的pev-sffv-oct4-2a-sox2-wpre、4μg的pev-sffv-myc-2a-klf4-wpre和2μg的pev-sffv-bcl-xl-wpre)。电转后,将pbmnc在mnc培液中复苏两天,再以每孔2×105将其转移到经辐照处理过的小鼠成纤维细胞上(mef)。在mef培液中培养一天后,将培液换成ksr培液(20%ksr的dmem/f12溶液,1×glutamax,1×neaa,0.1mmβ-me,10ng/mlbfgf(普飞)和0.25mmnab(sigma))。5天后,将培液换成添加了10μmsb431542(tgf-beta抑制剂),3μmchir99021(gsk3beta抑制剂,促进wnt信号),0.5mmvpa(表观遗传调控因子)和10μmforskolin(腺苷酸环化酶激活剂)(selleck)化合物的n2b27培液(dmem/f12:neurobasal(1:1)添加1×n2,1×b27,1×glutamax,1×neaa和0.1mmβ-me)。隔天半换液,直至克隆出现。电转后20天左右,显微镜下挑取具有npc形态的克隆并吹打成小块,在matrigel包被的孔板中进行进一步的扩增和鉴定。对于前两代人神经前体细胞,培液为添加了10ng/mlhlif(r&dsystem),3μmsb431542和3μmchir99021的n2b27培液。之后,细胞转移至nsc培液(即添加了20ng/mlbfgf和20ng/mlegf(peprotech)的n2b27培液)中培养并用accutase进行持续传代。
3.人诱导性神经前体细胞(inpc)的体外分化
人inpc的自发分化步骤如下:将人inpc用细胞消化液accutase消化成单细胞,以每盘2x105细胞的密度种于pdl-层粘连蛋白包被的35mm培养盘中,在神经分化培液(b27培液添加1μg/ml层粘连蛋白(sigma),1μg/mlfn(sigma),10ng/mlbdnf(peprotech),10ng/mlnt3(peprotech),10ng/mligf-1(peprotech),10ng/mlcntf(peprotech)和1μmcamp(sigma))中进行自发的神经分化。分化第7天,再次用accutase消化成单细胞,重新种于pdl-层粘连蛋白包被的培养盘中,并在分化第9天到19天期间向培液中加入0.2μm化合物e(millipore)。
人inpc向少突胶质细胞的分化步骤如下:首先用300nmsag(millipore)处理inpc10天,然后以每盘1×105细胞密度种于pdl-层粘连蛋白包被的培养盘中,在少突胶质细胞分化培液(dmem/f12添加1×n2,1×glutamax,0.1mmβ-me,30ng/mlt3(sigma),100ng/ml生物素(sigma),10ng/mlpdgf-aa(r&dsystem),1μmcamp,10ng/mligf-1,10ng/mlnt3和10ng/mlcntf)中进行分化。
4.免疫荧光染色
小鼠麻醉后用pbs和4%pfa灌流,取脑后继续在pfa中固定过夜,蔗糖脱水后进行冰冻切片得到15μm厚度的脑片。体外培养或分化的细胞则在4%pfa中固定半小时后用pbs洗两遍。进行免疫荧光染色时,脑片或细胞用0.3%triton-pbs-5%bsa进行室温穿孔和封闭一小时,之后加入一抗,4度孵育过夜;pbs洗三次,加入二抗,室温孵育1.5小时;pbs洗三次,dapi染色,用pbs再洗一次,fluoromount-g(southernbiotech)封片。所用一抗列表如下,二抗包括驴抗鼠、驴抗兔、驴抗山羊的alexafluro488、546或633荧光二抗,均购自lifetechnologies。照片由olympusbx50显微镜和leicatcssp8共聚焦激光扫描显微镜拍摄。
5.建立表达gfp或chr2-mcherry的人inpc细胞系
用于表达gfp的fugw质粒购自addgene(plasmid#14883)(loisetal.,2002)。用于表达chr2-mcherry的质粒如下构建:从市售的含chr2-mcherry的载体中扩增得到chr2-mcherry片段,将其亚克隆到慢病毒载体fuw(购自addgene,plasmid#14882),得到pfuw-chr2-mcherry质粒。将fugw或pfuw-chr2-mcherry质粒按照已发表方法包装成慢病毒转染inpc(tiscornia,2006)。通过细胞分选(facsarialcellsorter(bdbiosciences))将gfp或mcherry阳性的inpc细胞分选出来,并在nsc培液中增殖至少5代。之后,这些inpc细胞被移植入小鼠脑内并在特定时间后进行分析。
6、小鼠
出生6-8周的裸鼠购于上海斯莱克实验动物有限公司,ad转基因模型小鼠5xfad购自jacksonlab(jacksonno.006554)。免疫缺陷鼠rag2-/-由上海生化细胞所惠利健教授惠赠,以上两种小鼠杂交获得免疫缺陷的ad模型小鼠rag2-/-/5xfad。
7、细胞移植
将gfp或chr2-mcherry阳性的人inpcs悬于添加了10%matrigel的神经分化培液中,向免疫缺陷小鼠的海马dg区进行双侧移植,每侧注射包含了1×105细胞、体积为2μl的悬液。注射位点参照bregma:-1.06,侧边1mm,深度2.6mm。用avertin对小鼠进行麻醉(0.6ml/25g体重),用脑定位仪(rwdlifescience)对小鼠进行移植手术。
8.膜片钳全细胞记录
采用膜片钳全细胞记录技术对人inpc体外分化42-56天的神经元或移植入小鼠脑内的人inpc分化的细胞的脑片(300μm厚度)进行电生理特性的考察,方法参考已发表文献(yueetal.,2015),使用的膜片钳放大器为multiclamp700b(moleculardevices)。突触后电流psc的动力学数据由minianalysis6.03(synaptosoftinc.,nj,usa)分析完成。
9.光遗传学电生理技术
采用光遗传学电生理技术来考察移植入小鼠脑内的表达chr2-mcheery的人inpc细胞能否整合入宿主的神经环路,其分化的神经元与宿主的神经元之间是否建立了突触联系。具体步骤参照已发表的实验方法(avalianietal.,2014)。激光光束由配备473nm的蓝光(50mw;coboltinc.,sweden)的激光快速发射系统发出,通过olympus正置显微镜的40倍水浸物镜投射到脑片上激活移植的人inpc分化的神经元细胞群体,应用膜片钳技术检测宿主细胞的突触后电流在激活前和激活后是否有变化,以此来考察移植入的神经元是否与宿主神经元之间存在突触联系。
10.y迷宫行为学
y迷宫行为学实验通过比较小鼠在y迷宫中的自发变换行为来考察小鼠的空间记忆能力,具体实验步骤参考ohno等(2006,temporalmemorydeficitsinalzheimer'smousemodels:rescuebygeneticdeletionofbace1,theeuropeanjournalofneuroscience23,251-260)。将测试小鼠放置于对称的y迷宫的中心,让其在三个臂的迷宫中自由探索8分钟。记录小鼠探索各臂的顺序和总次数,按以下公式计算出变换百分比(percentagealternation):连续探索三个不同臂的次数/进臂总次数-2×100。变换百分比的高低反映小鼠的空间记忆能力的高低。
11.场电位记录(ltprecording)
海马场电位的记录流程参照已发表的方法(caoetal.,2007;tangetal.,1999;wangetal.,2008)。
二.实验结果
1、成人外周血单核细胞来源的inpc细胞系的建立
图1(a)显示pbmnc重编程得到inpc细胞系的方法示意图。本文从两位志愿者的外周血中分别建立了两株inpc细胞系。采用不导致dna片段插入的附加体质粒作为载体,通过电转的方式向pbmnc中导入yamanaka因子以及抗凋亡基因bcl-xl,并结合4个小分子化合物(scvf)即sb431542、chir99021、vpa和forskolin,成功的得到了与npc克隆形态类似的inpc克隆。稳定传代第15代的inpc表达高水平的npc标记基因和增殖性标记基因ki67(图1,b和c)。而且,inpc可以稳定传代25代以上,并表达高水平的npc标记基因(图2)。
2、人inpc细胞系在转录组水平类似于胚胎发育早期的皮层神经前体细胞
收取所建立的不同代数(p15和p25)的inpc的rna样品,进行转录组测序。
pbmnc和inpc细胞系的前2000个差异表达基因及其go分析的结果如图2(a)所示:所建立的人inpc细胞系在转录组水平与其起始细胞pbmnc有很大差异,主要体现在神经分化和发育方面基因的表达上调。inpc细胞系的转录组测序数据和已发表的hesc神经分化过程中的测序数据(cortecon)的比对分析发现,inpc与hesc体外分化得到的皮层神经前体细胞相似(图2,b)。另外,inpc细胞系的测序数据与brainspan数据库中妊娠8周、9周和13周胎儿各脑区组织的rna测序数据进行的比对分析发现,inpc与胚胎发育8-9周的皮层和前脑组织中细胞相似(图2,c)。
3、人inpc的体外神经分化潜能
采用“方法与材料”部分第3点所述的方法体外分化本文获得的第15代人inpc,结果如图3所示。图3(a)显示,该人inpc具有向神经元、星形胶质细胞和少突胶质细胞的分化潜能,但更倾向于分化成神经元。图3(b)显示,该人inpc主要分化为皮层谷氨酸能神经元,与转录组测序数据预测的一致。
4、人inpc在小鼠脑内能够很好地存活和迁移
用gfp标记采用前述方法获得的第15代人inpc,将其移植入免疫缺陷的裸鼠大脑的海马部位,分别在2、4和6个月后考察移植细胞的存活和迁移情况,结果如图4所示:该人inpc移植入小鼠脑内2、4和6个月的细胞存活率维持在70%以上(图4,a);该人inpc在移植后2、4和6个月的分布随时间推移逐渐向四周迁移(图4,b和c)。
5、人inpc在小鼠脑内主要分化为谷氨酸能神经元
采用前述方法获得的第15代人inpc在小鼠脑内的分化结果如图5所示:该人inpc在小鼠脑内主要分化为神经元和一部分星形胶质细胞(图5,a),尤其是谷氨酸能神经元和少量胆碱能神经元(图5,b和c)。
6、采用前述方法获得的第15代人inpc分化的神经元在小鼠脑内逐渐成熟
收集移植人inpc后2、4、6个月不同时间的小鼠脑片,运用膜片钳技术对植入的细胞进行膜特性的记录。结果如图6所示。图6(b)显示,植入的细胞一部分可以产生自发的动作电位,显示其具有电生理活性。细胞静息膜电位和输入膜电阻的测定结果显示,随着时间的推移,植入的inpc分化得到的神经元逐渐成熟(图6,c)。对植入细胞进行不同强度的电流刺激,可以观察到,与2个月的神经元相比,4个月和6个月的神经元即使是在较高强度的电流刺激下,仍能发放连续的动作电位(图6,d),且发放连续动作电位(tonicap)的比例明显提高(图6,e)。发放动作电位频率-电流曲线(f-i曲线)也显示,4个月和6个月的神经元可以保持更大范围的f-i线性关系(图6,f)。
以上结果都表明,人inpc分化的神经元在小鼠脑内随时间推移逐渐成熟。
7、采用前述方法获得的第15代人inpc分化的神经元在小鼠脑内整合入宿主的神经环路
植入的inpc分化的神经元可以表达自发的抑制性和兴奋性的突触后电流(ipsc和epsc),说明其与周围的细胞建立了突触联系(图7,a)。植入神经元的ipsc和epsc的上升时间(risetime)和衰减时间(decaytime)随时间推移降低(图7,b)。植入神经元中能检测到突触后电流的细胞所占比例随时间推移增加(图7,c)。这些都显示植入的神经元在脑内逐渐成熟并建立了突触联系。
植入的表达chr2-mcherry的神经元可被蓝光激活,产生内向电流,并发放连续的动作电位(图7,d)。宿主小鼠海马dg区的颗粒细胞不能被蓝光激活,但可以产生对蓝光刺激响应的突触后电流,表明植入的人inpc分化的神经元已整合入宿主的神经环路,与宿主细胞建立了突触联系(图7,e)。
上述结果表明,人inpc分化的神经元在小鼠脑内整合入宿主的神经环路。
8、移植采用前述方法获得的第15代人inpc显著改善免疫缺陷ad模型小鼠的认知能力,并增强其突触可塑性。
对野生型c57小鼠(wt)、ad模型小鼠5xfad、免疫缺陷ad模型小鼠rag2-/-/5xfad和移植了inpc的rag2-/-/5xfad小鼠共四组小鼠进行y迷宫的行为学检测以考察其海马依赖性的空间学习记忆能力。结果显示,移植了人inpc的ad鼠的认知功能得到显著改善(图8,a)。对四组小鼠的海马长时程增强检测(ltp)结果表明,与野生型小鼠相比,5xfad和rag2-/-/5xfad均呈现出减弱的ltp,而移植了inpc的ad鼠的ltp可以回复到接近正常小鼠的水平(图8,b)。该结果表明,inpc的植入增强了ad鼠脑内的神经可塑性,这可能是导致ad鼠认知功能改善的重要原因。
三、结论
本文从3-8ml人的外周血中分离出单核细胞,采用不导致dna片段插入的附加体质粒(episomalvector)作为转录因子表达载体,结合小分子化合物,成功地建立了将人的外周血单核细胞转分化成神经前体细胞(inpc)的方法以及可以稳定传代的神经干细胞系(inpc)。采用本文方法构建的inpc可以稳定传代25代以上,并表达高水平的npc标记基因。对该inpc的全基因转录组测序分析显示,该inpc在转录组水平上与人胚胎干细胞(hesc)分化得到的皮层神经干细胞和人胚胎发育时期8-9周的大脑皮层组织呈现出较高的相似度。在体外分化中,采用本文所示方法获得的inpc具有向神经元、星形胶质细胞和少突胶质细胞三种神经细胞分化的潜能,并主要分化为皮层谷氨酸能神经元。将采用本文所示方法获得的inpc移植到免疫缺陷小鼠的海马部位后,发现inpc的存活率高达70%以上,并可以很好地向四周迁移,其在脑内主要分化成谷氨酸能神经元,和转录组测序预测的一致。脑片电生理实验结果表明,采用本文所示方法获得的inpc分化的神经元随时间的推移逐渐成熟,并整合入宿主的神经环路中。y迷宫行为学实验发现,接受采用本文所示方法获得的inpc移植的免疫缺陷ad模型小鼠的空间学习和记忆能力得到显著的恢复。海马长时程增强(ltp)检测实验显示,移植了inpc的ad小鼠的ltp水平较未移植细胞的ad鼠有显著提高。这些结果证明,人外周血单核细胞转分化得到的inpc在小鼠脑内可以发挥其正常的功能并整合入宿主的神经环路中,参与修复ad小鼠的学习和记忆能力,提高ad小鼠的神经可塑性,具有用于ad细胞替代治疗的潜能。
- 还没有人留言评论。精彩留言会获得点赞!