一种靶向RunX2基因的小鼠成骨样细胞慢病毒载体及其构建方法与流程
本发明属于生物医药
技术领域:
,更具体地,涉及一种靶向runx2基因的小鼠成骨样细胞慢病毒载体及其构建方法。
背景技术:
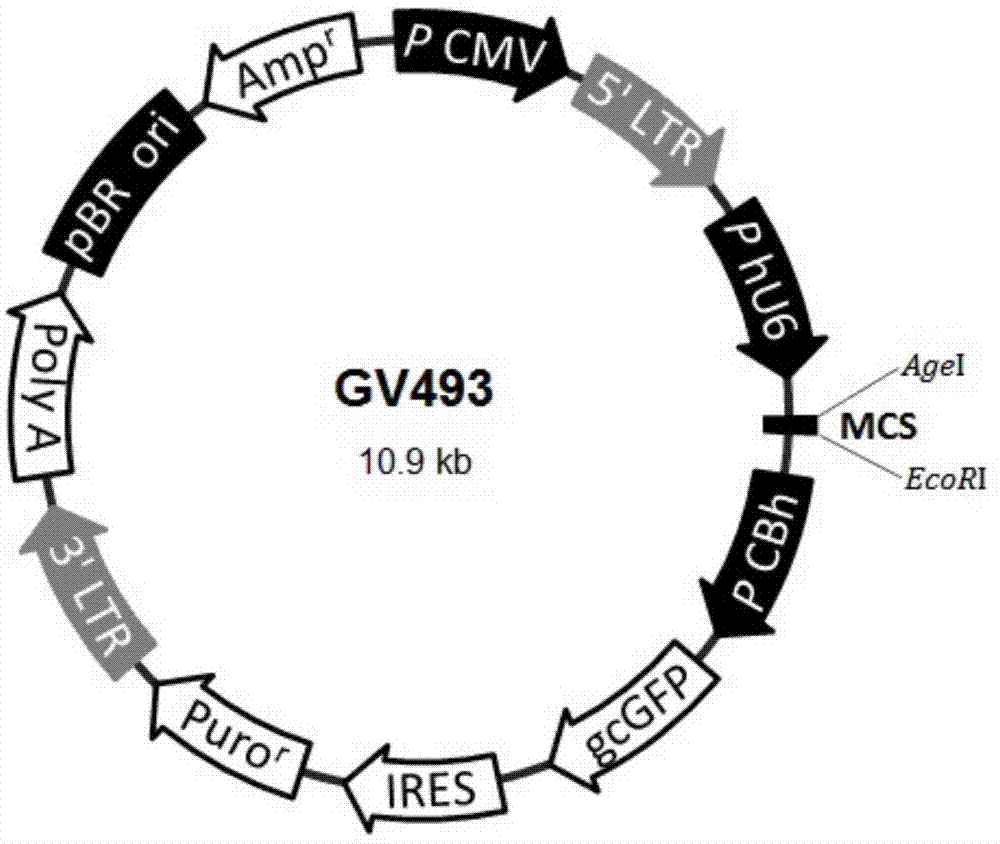
骨骼的形成和重建主要是骨祖细胞和软骨组细胞的分化、增殖和细胞外基质的形成,这些过程离不开一系列相关基因的激活和抑制,转录因子对这些基因起着重要调控作用。成骨细胞和破骨细胞间的动态平衡是保证牙齿正常萌出的基础,若平衡失调则导致牙齿萌出障碍,颅骨锁骨发育不良(cleidocranialdysplasia,ccd)是一种典型牙齿萌出障碍性疾病,研究表明成骨细胞特异性转录因子(runx2)的基因突变是ccd的重要原因。runx2属于runxx相关因子(runt-relatedgene)家族,runxx相关因子是一类转录因子蛋白的统称,它们都是由α和β亚单位构成的异二聚体,其特点是在分子结构中均含有一个由128个氨基酸组成的dna结合区,该结合区与果蝇属的分节基因runt同源,因此被称为runt结构域。runxx家族主要有runx1、runx2和runx3,runx2又称为核心结核因子α1(corebindingfactor,cbfa1),多瘤病毒增强子结合蛋白(polymavimsenchancerbindingprotein,pebp)或急性髓系白血病因子(acutemyeloidleukemia,aml)。runx2基因位于人类常染色体的6p21,长约220kb,包括8个外显子,并具有和其他家族成员相似的runt结构域,是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子,runx2的表达是成骨细胞开始分化的标志,因此它是骨形成过程中最早和最特异性的标志基因,此基因的缺失将导致骨发育不良或终止。runx2包括n端的多谷氨酰胺/丙氨酸重复序列结构域(q/a)、中部的runt结构域以及c端的富含脯氨酸、丝氨酸及苏氨酸的pst结构域。runx2能特异性地识别并结合许多靶基因上pygpyggtpy序列,产生不同的生物效应。runx2基因的变化与很多疾病相关,特别是骨相关疾病,对其研究有利于为疾病的早期发现提供新思路及早期治疗提供新靶点。技术实现要素:本发明的目的是提供一种靶向runx2基因的小鼠成骨样细胞慢病毒载体及其构建方法。为了实现上述目的,本发明提供一种靶向runx2基因的小鼠成骨样细胞慢病毒载体的构建方法,该构建方法包括以下步骤:步骤1:根据runx2基因序列,设计合成双链dna片段;步骤2:将合成的双链dna片段连接到gv493载体的多克隆位点中构建runx2-rna重组载体;步骤3:将构建的runx2-rna重组载体与shrna慢病毒共转染到小鼠成骨样细胞培养,得到靶向runx2基因的小鼠成骨样细胞慢病毒载体;其中,所述双链dna片段的正义链具有seqidno:1所示序列(5’-ccgggtgcccaggcgtatttcagatctcgagatctgaaatacgcctgggcactttttg-3’),反义链具有seqidno:2所示序列(5’-aattcaaaaagtgcccaggcgtatttcagatctcgagatctgaaatacgcctgggcac-3’)。本发明中上述各步均可采用常规的分子生物学操作步骤。根据本发明一种优选实施方式,所述gv493载体的多克隆位点连接双链dna片段的酶切位点为agei和ecori。根据本发明,优选地,所述小鼠成骨样细胞为mc3t3-e1细胞。根据本发明,优选地,所述共转染在含4-6μg/ml聚凝胺(polybrene)的eni.s感染培养基中进行,按moi=40感染mc3t3-e1细胞。本发明还提供由上述构建方法得到的靶向runx2基因的小鼠成骨样细胞慢病毒载体。本发明成功构建特异性抑制成骨细胞runx2基因的慢病毒载体,并确定了其作用的时间、相应的剂量。通过慢病毒转染,沉默成骨细胞runx2基因,模拟ccd牙齿萌出过程中成骨细胞的变化情况,而后检测自噬相关蛋白表达,为译解成骨细胞在ccd疾病发生过程中分子信号转导的相关机制打开新的思路,进而为牙齿萌出异常的防护和治疗提供新的理论和实验依据。本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。附图说明通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显。图1为gv493载体图谱。图2为各组病毒的被检基因表达情况图。图3示出了runx2基因的real-timepcr扩增曲线。图4示出了gapdh基因和runx2基因的real-timepcr熔解曲线。图5示出了各组病毒的相对mrna水平。具体实施方式下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。以下实施例中,所用材料及来源如下:胎牛血清(ausbian)、dmem(corning)、胰酶(上海生工)、puromycin(clontech)、d-hanks(上海吉凯)、trizol(上海普飞)、m-mlv(promega)、dntps(promega)、oligodt(上海生工)、bulge-looptmmirnaqpcrprimerset(广州锐博)、rnaseinhibitor(promega)、primer(r&f)(上海吉凯)、sybrmastermixture(takara)、bcaproteinassaykit(碧云天)、ripa裂解液(强)(碧云天)、ripa裂解液(上海鼎国)、np-40裂解液(上海鼎国)、prestainedproteinmarker(thermo)、ecl-plus/kit(thermo)、医用x射线光片(carestream)、x射线胶片显影粉(上海冠龙)、x射线胶片定影粉(上海冠龙)、nanodrop分光光度计(thermo)、稳压电泳仪(上海天能)、超细匀浆机(fluko公司)、realtimepcr仪器(roche)、反转录耗材(axygen)、celigo(nexcelom)、pvdf膜(millipore)、sds-page蛋白电泳仪(上海天能)、蛋白转膜仪(上海天能)、冷冻高速离心机(thermo)、离心机(赛默飞世尔)、倒置显微镜(上海蔡康)、荧光显微镜(奥林帕斯)、生物安全柜(上海振样创)、稳压电源(上海天能)、co2培养箱(日本三洋)。gv493载体购自上海吉凯基因化学技术有限公司。shrna慢病毒购自上海吉凯基因化学技术有限公司。实施例中未注明具体条件者,皆按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。预实验1、感染条件优化由于细胞的种属、代数及活性的不同,病毒对细胞的亲嗜性也会不同,在预实验中按转染条件分为4组:normalmedium组:在目的细胞正常培养基,即完全培养基中感染病毒;polybrene组:在含5μg/mlpolybrene的正常培养基中感染病毒;eni.s组:在enhancedinfectionsolution(eni.s.)中感染病毒;eni.s+polybrene组:在含5μg/mlpolybrene的eni.s中感染病毒,而后按感染moi分四组:moi1病毒按moi=1进行感染;moi10病毒按moi=10进行感染;moi40病毒按moi=40进行感染;moi100病毒按moi=100进行感染,预实验结果显示对于小鼠成骨样细胞mc3t3-e1而言,在含5μg/mlpolybrene的eni.s培养基中,病毒按moi=40更容易被转染。2、慢病毒制备根据预实验将mc3t3-e1细胞进行慢病毒感染,按病毒序号分4组:nc组:pfu-gw-016psc53349-1(未插入双链dna的空白对照);kd1组:lvpfu-gw-016psc60107-1;kd2组:lvpfu-gw-016psc60108-1;kd3组:lvpfu-gw-016psc60109-1。其中,lvpfu-gw-016psc60109-1、lvpfu-gw-016psc60107-1、lvpfu-gw-016psc60108-1通过以下方法构建:步骤1:设计合成双链dna片段;easy-sirna设计如表1所示:表1合成oligo信息如表2所示。表2步骤2:将合成的各双链dna的正义链和反义链进行退火,将得到的双链dna片段连接到gv493载体多克隆位点的agei和ecori之间,构建重组载体;gv493载体基本信息如下:载体名称:gv493元件顺序:hu6-mcs-cbh-gcgfp-ires-puromycin载体图谱:http://www.genechem.com.cn/service/index.php?ac=gene&at=vector_search&keyword=gv步骤3:将构建的重组载体与shrna慢病毒共转染到小鼠成骨样细胞培养,得到慢病毒载体。3、慢病毒包装及滴定测定根据试剂盒说明书进行转染,按照梯度稀释法进行滴度测定。滴度测定结果如表3所示。表3病毒名称滴度(tu/ml)lv-runx2-rnai(60107-1)1e+9lv-runx2-rnai(60108-1)8e+8lv-runx2-rnai(60109-1)8e+8实施例11、准备目的细胞从液氮罐中取出小鼠成骨细胞mc3t3-e1冻存管,迅速放入37℃水浴中,并不时摇动使其尽快解冻。完全解冻后,1300rpm,离心3min,75%酒精擦拭冻存管消毒后,移至生物安全柜。吸去冻存液上清,加入1ml新鲜的完全培养基重悬细胞,将细胞悬液接种至含有3ml完全培养基的6cmdish中,轻轻晃匀后置于37℃、5%co2培养箱。24h后更换一次培养液继续培养,待细胞汇合度达80%左右传代培养,保持细胞良好的生长状态。2、目的细胞慢病毒感染处于对数生长期的细胞胰酶消化,用完全培养基制成3-5×104个/ml细胞悬液,接种相应的细胞数到培养板中,继续培养保证感染时铺板量达到15-30%。按照预实验结果,更换含5μg/mlpolybrene的eni.s感染培养基,将上述4组病毒按moi=40进行感染,感染后16h更换为常规培养基继续培养。观察感染后细胞状态良好,未出现大量死亡现象。感染后72h左右,celigo全视野细胞扫描分析仪观察被检基因的表达情况,荧光率即为阳性感染率。3、荧光实时定量(qpcr)检测runx2mrna水平表达情况收集细胞,2000rpm离心5min,去上清,细胞沉淀中加入1mltrizol,充分混匀后室温静置5min,然后转移至新的1.5mlep管中。反转录获得cdna(使用promegam-mlv试剂盒),将1μloligodt(0.5μg/μl)和2.0μgtotalrna加入到pcr小管中,补充rnase-freeh2o至10μl;混匀后离心,70℃温浴10min;之后立即置于冰水混合物中冰浴,使oligodt和模板退火。在上述混合物中,按比例配制反应体系(冰上进行),混匀,短暂离心,上述体系在42℃水浴反应1h,然后在70℃水浴10min使rt酶失活,将得到的rt产物-cdna置于-20℃保存备用。两步法进行real-timepcr,并制作熔解曲线,进行数据分析。内参基因和目的基因引物由吉凯基因设计与合成,引物信息如下表4所示:表44、数据处理应用spss13.0统计软件分别对实验组和对照组数据进行t检验,p<0.05为有统计学意义。5、实验结果5.1、慢病毒转染mc3t3-e1细胞病毒转染后72h,全视野细胞扫描分析仪观察被检基因表达情况,结果显示各组细胞状态良好,未出现大量死亡现象,如图2所示,荧光率即为阳性感染率,nc组:未见荧光表达;kd1组:可见少量荧光表达;kd2组:荧光表达增强;kd3组:可见强绿色荧光。5.2、real-timepcr扩增曲线如图3所示,目的基因扩增曲线光滑,曲线拐点清楚,且各管的曲线平行性好,表明扩增效应相近。5.3、real-timepcr熔解曲线如图4所示,gapdh基因和runx2基因熔解曲线均为单一的峰型,基底窄而峰高,说明无引物二聚体及非特异性扩增产生,表明引物设计良好,特异性强。5.4、数据分析:采用2-δδct法数据分析,其中δct=目的基因ct值-内参基因ct值;-δδct=nc组δct平均值-各样品δct值;2-δδct反映各样品相对nc组样品目的基因的相对表达水平。从定量pcr结果可以看出,在mc3t3-e1细胞中,相对于nc组,kd3组runx2基因沉默效率较高(表5,图5)。表5各组runx2real-timepcr结果分析通过以上实施例可知,本发明成功构建特异性抑制成骨细胞runx2基因的慢病毒载体,并确定了其作用的时间、相应的剂量。以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本
技术领域:
的普通技术人员来说许多修改和变更都是显而易见的。序列表<110>连云港市第一人民医院<120>一种靶向runx2基因的小鼠成骨样细胞慢病毒载体及其构建方法<130>bji1800984lyg<160>13<170>siposequencelisting1.0<210>1<211>58<212>dna<213>人工序列(artificialsequence)<400>1ccgggtgcccaggcgtatttcagatctcgagatctgaaatacgcctgggcactttttg58<210>2<211>58<212>dna<213>人工序列(artificialsequence)<400>2aattcaaaaagtgcccaggcgtatttcagatctcgagatctgaaatacgcctgggcac58<210>3<211>21<212>dna<213>人工序列(artificialsequence)<400>3tccgaaatgcctccgctgtta21<210>4<211>21<212>dna<213>人工序列(artificialsequence)<400>4cagcacgctattaaatccaaa21<210>5<211>21<212>dna<213>人工序列(artificialsequence)<400>5gtgcccaggcgtatttcagat21<210>6<211>58<212>dna<213>人工序列(artificialsequence)<400>6ccggtccgaaatgcctccgctgttactcgagtaacagcggaggcatttcggatttttg58<210>7<211>58<212>dna<213>人工序列(artificialsequence)<400>7aattcaaaaatccgaaatgcctccgctgttactcgagtaacagcggaggcatttcgga58<210>8<211>58<212>dna<213>人工序列(artificialsequence)<400>8ccggcagcacgctattaaatccaaactcgagtttggatttaatagcgtgctgtttttg58<210>9<211>58<212>dna<213>人工序列(artificialsequence)<400>9aattcaaaaacagcacgctattaaatccaaactcgagtttggatttaatagcgtgctg58<210>10<211>21<212>dna<213>人工序列(artificialsequence)<400>10tgacttcaacagcgacaccca21<210>11<211>21<212>dna<213>人工序列(artificialsequence)<400>11caccctgttgctgtagccaaa21<210>12<211>23<212>dna<213>人工序列(artificialsequence)<400>12ttcaacgatctgagatttgtggg23<210>13<211>19<212>dna<213>人工序列(artificialsequence)<400>13ggatgaggaatgcgcccta19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1