基于静电亲和纳米转运载体及细胞成像的胞内microRNA非酶扩增检测方法与流程
本发明属于核酸检测技术领域,特别涉及一种基于静电亲和纳米转运载体的胞内microrna非酶扩增检测方法及其在细胞成像中的应用。
背景技术:
microrna(mirna)是高度保守的、长度为18-25nt的、由非编码内源性基因编码的微小单链rna。迄今为止,mirna在基因表达调控中的功能机制受到极大的关注,研究表明,mirna参与众多重要的细胞活动,包括早期发育、病毒防御、器官发育与形成、细胞增殖和凋亡等。另外,它们的表达水平与多种癌症直接相关,可以反映癌基因或抑癌基因的表达情况。因此,mirna可以作为细胞水平研究和相关疾病的有价值的生物标志物,其中为阐明细胞过程中的复杂功能而对活细胞中天然mirna信息的揭示已成为mirna生物学功能研究的热门话题。因此,可视化活细胞中天然mirna的创新策略可以显著影响mirna生物学的研究。
然而,由于细胞中mirna的低表达水平和体内复杂的环境,在活细胞中mirna的原位监测和示踪仍面临着巨大的挑战。作为第一代活细胞成像技术,荧光原位杂交(fish)测定法监测细胞、组织和模型动物中的核酸已成为细胞生物学中的常用方法,并已被应用于mrna的成像。尽管基于fish的技术在广泛的研究领域中是有效的,但探针的单个荧光发光体不能满足低浓度靶标的要求。迄今为止,已经开发了一些基于探针的改进的体内杂交技术,这些技术开拓了细胞成像领域的新策略。特别地,基于分子信标(mb)的方法构建了高信噪比策略,其已应用于mrna分析和分子感测。mb的引入通过茎环结构实现特定的dna或rna监测和跟踪,实现了高效率和高信噪比。但是,灵敏度仍受单荧光发光体的限制。
因此,发明人通过提高核酸进入细胞的荧光产量、探针稳定性和转移效率来改善这些局限性。通过优化的反应条件,核酸探针可以显著提高荧光产量,并获得更高的荧光强度。发明人前期专利(中国专利:201410768156.4)公开了一种目标触发的指数级非酶扩增平台,它通过两个发夹探针的循环相互作用实现,采用这种策略对荧光信号进行放大可显著提高灵敏度。因此,发明人有将其应用于活细胞中mirna的细胞内成像的想法。重要的是,将两个发夹探针递送到活细胞中的效率也是细胞成像过程中的重要因素。此前,随着纳米技术的发展与普及,纳米金颗粒(aunps)作为载体用于药物、基因转运越来越备受关注,并大大提高了转运效率。因此,我们构建了电荷负载的aunps载体以进行靶标触发的非酶扩增的细胞内转运,其通过dna探针的自组装实现信号放大,并可应用于活细胞成像。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供一种基于静电亲和纳米转运载体和细胞成像的胞内microrna非酶扩增检测方法,并将其应用于活细胞成像。该方法是通过荧光信号增强非酶扩增平台并结合纳米转运载体用于细胞胞内microrna痕量检测。该方法灵敏度高、特异性好、准确、快速、操作简单,且整个扩增过程不需要酶的参与。因此,本发明在降低了检测成本的基础上,为microrna检测技术体系提供了一种全新的microrna检测方法。
本发明的基本原理如图1所示:本发明的扩增过程由非酶扩增反应构成,“信号给出”步骤采用荧光信号模式。首先,针对检测目标microrna序列设计特异性的dna发卡探针h1、h2序列,其中h1的5′端和3′端分别标记荧光基团fam、淬灭基团bhq-1,h2的3′端标记荧光基团fam,从5′端起第8个碱基t标记淬灭基团bhq-1;当扩增体系不存在待测microrna时,扩增反应不会被激活,发卡探针之间不能发生反应,因此,发卡探针不会被打开仍是发卡结构,荧光基团fam与淬灭基团bhq-1相互作用,荧光处于淬灭状态;当扩增体系中含有待测microrna,待测microrna可与发卡探针h1结合,导致h1茎部打开,由此产生的部分单链结构与h2相作用,导致发卡探针h2茎部打开,并与h1形成h1+h2双链复合结构,由此荧光基团fam与淬灭基团bhq-1距离增大,荧光强度增加。再者,将发卡探针h1、h2与纳米金颗粒组装成复合体,并转运至细胞内,因肿瘤细胞高表达microrna,因此触发非酶扩增,发卡探针h1、h2打开,荧光强度增加。最后用荧光分光光度计检测胞外非酶扩增荧光强度,并用激光扫描共聚焦显微镜记录细胞胞内成像情况。
本发明的目的通过下述技术方案实现:一种基于静电亲和纳米转运载体和细胞成像的胞内microrna非酶扩增检测方法,包括以下步骤:
(1)纳米金颗粒(aunps)的合成
纳米金颗粒(aunps)的合成包括以下步骤:
a、纳米金颗粒合成体系有pbs缓冲液、聚-l-赖氨酸pll溶液、氯金酸溶液,最后加入无核酸酶水将体积补至体系所需体积,充分振荡混匀,全程避光;
b、将步骤a所得溶液瞬时离心,使管盖沾粘的溶液落于管中,全程避光;
c、将步骤b所得溶液放于恒温混匀仪中,恒温避光孵育;
d、待步骤c溶液由黄色变为红色,指示纳米金颗粒的形成,放入4℃冰箱保存;
(2)用于非酶扩增体系发卡探针的设计
根据非酶扩增原理及待测microrna序列设计非酶扩增体系所需的发卡探针h1及发卡探针h2序列:发卡探针h1采用双头标记策略,其5′端和3′端分别标记荧光基团fam、淬灭基团bhq-1;h2的3′端标记荧光基团fam,从5′端起第8个碱基t标记淬灭基团bhq-1;发卡探针h1、h2用te缓冲液溶解即可,终浓度均为100μm,保存于-20℃冰箱;
(3)发卡探针预处理
为了使发卡探针h1、h2充分形成发卡结构,向发卡探针h1、h2溶液中分别加入磷酸盐缓冲液pbs,并将pbs终浓度设置为1×;随后,加热至95℃之后,使其充分变性;最后,梯度降温,降至常温为止,分别得到发卡探针h1、h2的预处理产物,产物保存于4℃或-20℃环境中备用;h1、h2形成充分的发卡结构后,荧光基团fam与淬灭基团bhq-1相互作用,荧光淬灭;
(4)胞外非酶扩增检测体系的构建
取一定量步骤(3)中得到的发卡探针h1、h2的预处理产物,并加入pbs缓冲液,再加入rna酶抑制剂,最后加depc水至检测体系所需体积,充分混匀;
(5)胞外非酶扩增检测体系的验证及其灵敏度、特异性检测
分别在步骤(4)非酶扩增检测体系中加入不同浓度的待测microrna,温浴,用荧光分光光度计检测所得溶液的荧光强度,并确定非酶扩增体系的灵敏度;
设置control组,然后分别在步骤(4)非酶扩增检测体系中加入相同浓度的待测microrna,以及与其碱基序列类似的microrna210、microrna214,温浴,用荧光分光光度计检测所得溶液的荧光强度,并确定非酶扩增体系的特异性;
(6)非酶扩增纳米金颗粒转运体系的构建
取一定量步骤(3)中得到的发卡探针h1、h2的预处理产物,加入到步骤(1)所得的aunps溶液中,充分混匀后,温浴;
(7)肿瘤细胞非酶扩增纳米金复合体的转运
取一定量步骤(6)所得溶液,加入到肿瘤细胞中,随后放到37℃二氧化碳培养箱中孵育,至少1小时;
(8)细胞核与骨架的染色
将步骤(7)中孵育过后的产物从二氧化碳培养箱中取出,然后进行细胞核与骨架的染色,再进行显微镜观察,或放入4℃冰箱避光保存;
(9)细胞荧光强度的检测与胞内成像
将步骤(8)中所得最终产物,用激光扫描共聚焦显微镜观察细胞胞内成像情况,并记录数据。
进一步地,所述纳米金颗粒合成的详细步骤如下:
a、取30mgpll溶于3ml水中,充分振荡混匀5min使其全部溶解,配制成浓度为10mg/ml的pll溶液,放入-20℃低温冰箱保存;
b、取10ul原浓度为1.52mol/l的氯金酸溶液,加入142ul水中,充分混匀,避光配制成浓度为0.1mol/l的氯金酸溶液,放入4℃冰箱避光保存;
c、取20×pbs50ul,同时取步骤a所得溶液60ul,步骤b所得溶液10ul,加入880ul无核酸酶水补至1ml,充分振荡混匀,全程避光;
d、将步骤c所得溶液瞬时离心,使管盖沾粘的溶液落于管中,全程避光;
e、将步骤d所得溶液放于恒温混匀仪中,300rpm、66℃恒温孵育3小时,全程避光;
f、待步骤e溶液由黄色变为红色,指示纳米金颗粒的形成,放入4℃冰箱保存。
进一步地,所述步骤(3)中把发卡探针h1、h2分别溶解于1×磷酸盐缓冲液pbs中,终浓度均为500nm。
进一步地,步骤(3)中梯度降温从95℃开始,保持5min再以5℃/min的速率历经1min降温至下一个温度点,如此循环下去,直至常温25℃。
进一步地,所述步骤(4)中检测体系是100μl,h1、h2预处理产物终浓度皆为50nm,pbs缓冲液终浓度为1×,rna酶抑制剂终浓度为1u/μl。
进一步地,所述步骤(5)中加入不同浓度的待测microrna后,37℃温浴1小时,之后用荧光分光光度计检测所得溶液的荧光强度,确定非酶扩增体系的灵敏度;
加入相同浓度的待测microrna、microrna210、microrna214后,37℃温浴1小时,之后用荧光分光光度计检测所得溶液的荧光强度,确定非酶扩增体系的特异性;
所述的荧光分光光度计为日立f-7000荧光分光光度计。
进一步地,所述步骤(6)中,取发卡探针h1、h2预处理物,加入到步骤(1)所得的aunps溶液中,发卡探针h1、h2预处理物终浓度皆为500nm,充分混匀后,37℃温浴2小时。
进一步地,所述步骤(8)中细胞核与骨架染色的具体步骤是:
a、弃掉细胞的培养液;
b、加入1×pbs,轻轻晃动,然后弃掉pbs,重复此步骤一遍;
c、加入适量4%多聚甲醛,刚好全部覆盖底部细胞即可,室温避光固定10分钟;
d、弃掉步骤c的4%多聚甲醛,用1×pbs将细胞清洗两遍,每次5分钟;
e、取5ul的20umtritcphalloidin罗丹明标记鬼笔环肽染液溶于1ml1×pbs中,充分混匀;
f、将步骤e所得染液加入到步骤d所得细胞中,室温避光染色30分钟;
g、弃掉步骤f的染液,用1×pbs将细胞清洗两遍,每次5分钟;
h、取1ul的dapi染液(5mg/ml)溶于1ml1×pbs中,充分混匀;
i、将步骤h所得染液加入到步骤g所得细胞中,室温避光染色5分钟;
j、弃掉步骤i的染液,用1×pbs将细胞清洗两遍,每次5分钟;
k、取适量fluoromount-gtm水溶性封片剂加入到步骤j所得细胞中,室温下避光静置5分钟,使得封片剂晾干后再进行显微镜观察,或放入4℃冰箱避光保存。
进一步地,所述待测microrna为microrna21,其序列为:
uagcuuaucagacugauguuga;
所述microrna210的序列为:cugugcgugugacagcggcuga;
microrna214的序列为:acagcaggcacagacaggcagu;
所述的发卡探针h1的序列为:
tcaacatcagtctgataagctaccatgtgtagatagcttatcagactcctaatggtgtggc;
其5′端和3′端分别标记荧光基团fam、淬灭基团bhq-1;
所述的发卡探针h2的序列为:
ataagctatctacacatggtagcttatcagactccatgtgtaga;
其3′端标记荧光基团fam,从5′端起第8个碱基t标记淬灭基团bhq-1。
在本发明中,所涉及的dna产品均由华大基因科技有限公司合成。37℃恒温环境可由pcr仪、水浴锅或恒温混匀仪维持。
步骤(1)中所述的聚-l-赖氨酸(pll)是指聚-l-赖氨酸氢溴酸盐,其摩尔重量为15-30kda,由sigma-aldrich公司提供;
步骤(1)中所述的氯金酸由生工生物工程有限公司提供,浓度为1.52mol/l;
步骤(1)中所述的磷酸盐缓冲液pbs由生工生物工程有限公司提供,浓度为20×;该缓冲液经过depc处理;
步骤(1)中所述的无核酸酶水由英潍捷基(上海)贸易有限公司提供;
所述的depc水为经过高温高压灭菌的0.1%(v/v)depc水;depc是焦磷酸二乙酯;
步骤(4)中所述的rna酶抑制剂由宝生物工程有限公司提供;
步骤(8)中所述的多聚甲醛由上海翊圣生物科技有限公司提供;
步骤(8)中所述的tritcphalloidin罗丹明标记鬼笔环肽染液由上海翊圣生物科技有限公司提供;
步骤(8)中所述的dapi染液由上海翊圣生物科技有限公司提供;
步骤(8)中所述的fluoromount-gtm水溶性封片剂由上海翊圣生物科技有限公司提供;
步骤(9)中所述的激光扫描共聚焦显微镜优选为zeiss激光扫描共聚焦显微镜lsm780。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明采用非酶扩增反应体系:全过程不需要酶的参与,原理简单且检测成本低。
(2)恒温扩增:在恒温条件下进行,只需37℃反应1h就能得到理想的实验结果。反应装置简单,用水浴锅加热亦可。
(3)高灵敏度:胞外非酶扩增实验的灵敏度已达到了100fmol。实现了microrna痕量检测的目的。
(4)通过静电亲和作用,用纳米金颗粒载体转运发卡探针,将非酶扩增应用于胞内。
(5)实现胞内mirna检测,并应用于细胞胞内成像,也可进行其他多样化应用。
(6)操作简单、易于普及。
(7)适用于核酸检测,也可以结合蛋白适配体相关技术用于蛋白检测:该实验原理可用于dna及rna的检测,只要根据目标序列合理设计发卡探针序列即可。
附图说明
图1是基于静电亲和纳米转运载体的胞内microrna非酶扩增检测方法的原理图;
图2是纳米金颗粒(aunps)结合发夹探针前后的表征图;
图3是胞外非酶扩增检测平台灵敏度的结果图;
图4是胞外非酶扩增检测平台特异度的结果图;
图5是人肿瘤细胞胞内成像的结果图;
图6是人正常细胞胞内成像的结果图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1纳米金颗粒(aunps)的合成
合成aunps时,使用带正电荷的聚-l-赖氨酸(pll)用作封端剂、还原剂,pll还原金盐离子(aucl4-1)的氨基,金属离子诱导胺氧化成亚硝酸盐,发生直接氧化还原反应,自发形成aunps,pll被封装在aunps表面,稳定纳米颗粒的形成。所得aunps的稳定化是通过带电多肽的空间和静电相互作用的组合来保证的。首先取30mgpll溶于3ml水中,充分振荡混匀5min使其全部溶解,配制成浓度为10mg/ml的pll溶液;取10ul原浓度为1.52mol/l的氯金酸溶液,加入142ul水中,充分混匀,避光配制成浓度为0.1mol/l的氯金酸溶液;最后加入无核酸酶水将体积补至1ml,充分振荡混匀,全程避光;构成1ml体系,其中pbs缓冲液终浓度1×、聚-l-赖氨酸(pll)终浓度0.6mg/ml、氯金酸溶液终浓度0.1m,将该体系溶液瞬时离心,使管盖沾粘的溶液落于管中,全程避光;于恒温混匀仪中300rpm、66℃避光温育3小时;溶液由黄色变为红色,指示纳米金颗粒的形成,可放入4℃冰箱保存。
实施例2基于静电亲和纳米转运载体的microrna非酶扩增平台的建立及其灵敏度实验
根据基于静电亲和纳米转运载体的microrna非酶扩增平台原理、针对microrna21序列设计非酶扩增体系所需的发卡探针h1、h2,其序列如表1所示。发卡探针h1采用双头标记策略,其5′端和3′端分别标记荧光基团fam、淬灭基团bhq-1;h2的3′端标记荧光基团fam,从5′端起第8个碱基t标记bhq-1。发卡探针均由华大基因科技有限公司合成,h1、h2用te缓冲液溶解即可(终浓度100μm,保存于-20冰箱)。
表1实施例中所用到的序列
为了使发卡探针h1、h2充分形成发卡结构,向发卡探针h1、h2溶液中分别加入磷酸盐缓冲液pbs,并将pbs终浓度设置为1×,随后加热至95℃之后,使其充分变性,而后梯度降温,从95℃开始,保持5min再以5℃/min的速率历经1min降温至下一个温度点,如此循环下去,直至常温25℃,具体的温度点及保温时间分别为95℃5min、90℃5min、85℃5min、80℃5min、75℃5min、70℃5min、65℃5min、60℃5min、55℃5min、50℃5min、45℃5min、40℃5min、35℃5min、30℃5min、25℃5min。分别得到发卡探针h1、h2的预处理产物,产物保存于4℃或-20℃环境中备用。h1、h2形成充分的发卡结构后,荧光基团fam与淬灭基团bhq-1相互作用,荧光淬灭。
整个胞外非酶扩增检测扩增体系设置为100μl,取发卡探针h1、h2的预处理产物,加入4μl20×pbs,加入rna酶抑制剂,加入待测microrna21,最后加depc处理水补至100μl。充分混匀。使pbs终浓度为0.8×,rna酶抑制剂终浓度为1u/μl,发卡探针h1、h2的预处理产物终浓度均为50nm,37℃温育1小时后,扩增产物放入荧光分光光度计日立f-7000中检测荧光信号。
为了验证非酶扩增荧光检测平台的灵敏度,分别设置microrna21加入的量为100pmol、10pmol、1pmol、100fmol、10fmol、1fmol、100amol、10amol、0mol,检测荧光信号,实验结果如图3所示。由图3可知,该检测平台的灵敏度能达到100fmol。经过线性分析,该方案得到了较好的线性(r2=0.9771)。
实施例3基于静电亲和纳米转运载体的胞内microrna非酶扩增平台的特异性验证
为验证基于静电亲和纳米转运载体的胞内microrna非酶扩增平台的特异性,分别向该平台加入碱基序列与microrna21类似的microrna210及microrna214,加入的量分别是10pmol,并检测荧光信号,实验结果如图4所示,control组是空白对照,microrna210、microrna214和control对照组在发射波长518nm处的荧光强度值分别为801.775a.u.、788.7a.u.、739.5a.u.,这三组荧光强度基本持平;而microrna21实验组在发射波长518nm处的荧光强度值为3763a.u.,得到了较强的荧光信号。因此,该平台特异性较好。
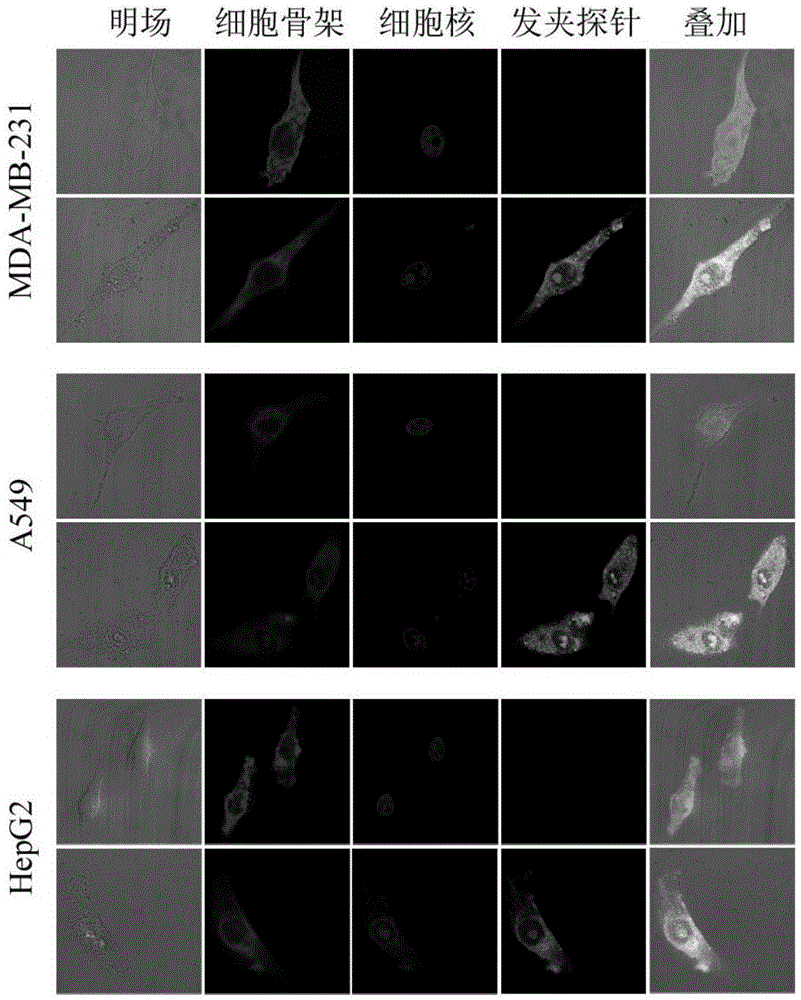
实施例4人肿瘤细胞与正常细胞胞内成像
为了验证该平台应用于细胞检测的可行性,我们设计了细胞胞内成像实验。在本实验中,我们选取了三种肿瘤细胞系:肝癌细胞系(hepg2细胞系),肺癌细胞系(a549细胞系),乳腺癌细胞系(mda-mb-231细胞系),microrna21已被证明在这三种细胞系中存在高表达的现象;以及选取了三种人正常细胞系:人胃粘膜细胞系(ges-1细胞系)、人脐静脉内皮细胞系(huvec细胞系)、人永生化表皮细胞系(hacat细胞系)。
在本方案中,参照上述实验方法,我们首先取一定量经过梯度降温的发卡探针h1、h2的预处理产物,加入到合成的aunps溶液中,充分混匀后,发卡探针h1、h2预处理产物终浓度皆为500nm,37℃温浴2小时,使aunps与发卡探针h1、h2通过静电亲和作用组装成复合物;然后将此复合物加入到三种肿瘤细胞与三种正常细胞中,随后放到37℃二氧化碳培养箱中孵育,至少1小时。
最后将孵育过后的产物从二氧化碳培养箱中取出,进行细胞核与骨架的染色,首先弃掉细胞的培养液,加入1×pbs清洗两遍;然后加入适量4%多聚甲醛,刚好全部覆盖底部细胞即可,室温避光固定10分钟;弃掉4%多聚甲醛,用1×pbs将细胞清洗两遍,每次5分钟;取终浓度为100nm的tritcphalloidin罗丹明标记鬼笔环肽染液加入到固定过后的细胞中,室温避光染色30分钟;弃掉染液,用1×pbs将细胞清洗两遍,每次5分钟;取终浓度为5ug/ml的dapi染液室温避光染色5分钟;弃掉dapi染液,用1×pbs将细胞清洗两遍,每次5分钟;最后取适量fluoromount-gtm水溶性封片剂加入到染色过后的细胞中,室温下避光静置5分钟,使得封片剂晾干后再进行显微镜观察,或放入4℃冰箱避光保存。
用激光扫描共聚焦显微镜lsm780观察细胞胞内成像情况,检测胞内非酶扩增荧光信号。如图5所示,在hepg2细胞系、a549细胞系、mda-mb-231细胞系中fam绿色荧光信号与tritcphalloidin罗丹明标记鬼笔环肽红色荧光信号、dapi蓝色荧光信号共定位,说明这三种细胞系都出现了microrna21高表达的现象,且纳米金颗粒与发卡探针h1、h2成功装载成复合体,此复合体能够跨磷脂双分子层进入细胞质,并能够进入细胞核。至于三种人正常细胞的实验情况,如图6所示,并没有发卡探针发光信号。
所述的hepg2细胞系、a549细胞系、mda-mb-231细胞系均购自上海汉博生物科技有限公司。
所述的ges-1细胞系、huvec细胞系、hacat细胞系购自广州展晨生物科技有限公司。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110>中山大学附属第五医院
<120>基于静电亲和纳米转运载体及细胞成像的胞内microrna非酶扩增检测方法
<130>2018
<160>5
<170>siposequencelisting1.0
<210>1
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>1
uagcuuaucagacugauguuga22
<210>2
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>2
cugugcgugugacagcggcuga22
<210>3
<211>22
<212>rna
<213>人工序列(artificialsequence)
<400>3
acagcaggcacagacaggcagu22
<210>4
<211>61
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>荧光基团fam修饰
<222>((1))..(.(1))
<220>
<221>淬灭基团bhq-1修饰
<222>((25))..(.(25))
<400>4
tcaacatcagtctgataagctaccatgtgtagatagcttatcagactcctaatggtgtgg60
c61
<210>5
<211>44
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>荧光基团fam修饰
<222>((44))..(.(44))
<400>5
ataagctatctacacatggtagcttatcagactccatgtgtaga44
- 还没有人留言评论。精彩留言会获得点赞!