一种嘌呤类衍生物自由基前体分子及其制备方法与流程
本发明涉及一种嘌呤类衍生物自由基前体分子的结构和制备方法。
背景技术:
近几十年来,由于有机导电或半导体材料具有柔性、多样性、成本低廉等等优点,一直受到科学界和产业界的普遍关注,这类材料的研发成为了全球研究热点。目前,有机导电或半导体材料被广泛应用于各种光电或电-机械器件,如场效应晶体管、柔性显示、太阳能电池、发光电化学电池、人造皮肤以及电活性驱动器或探测器等。要实现这些低成本柔性器件的产业化,最基础的前提就是研发出性能优异的有机导电或半导体材料。
除了设计合成新的高性能有机导电或半导体材料外,掺杂也是提升材料和器件性能的重要手段。掺杂剂中能提高“空穴”载流子浓度的称为p型,提高电子载流子浓度的则为n型。有机n型掺杂剂的掺杂特性源自于其分子具有很强的电离能力,容易离去电子,电子转移至主体材料的导电能级上,即可有效增加主体材料中的电子载流子浓度,提高电导率,调整态密度,改变费米能级,最终提高有机光电器件的性能。
综合文献来看,自由基前体分子是应用较多的一类有机n型掺杂剂。其中,以苯并咪唑烷衍生物为例,其2位碳是三级碳原子,该叔碳上的电子可离域到与其相连的烷基和苯环的碳上,易生成较稳定的自由基。因此苯并咪唑烷的2位碳在光照、加热等简单条件下就能离去氢原子,形成易给出电子的碳自由基分子(如下所示),即具有较低的电离能,从而具有良好的n型掺杂性能。由此可见,芳基叔碳(如苯基甲烷)结构是易形成稳定自由基的框架结构。因此,可以在芳基叔碳的基础上,通过分子结构设计合成芳基自由基前体分子。
嘌呤类衍生物是动植物体内必须的有机物,在能量供应、代谢调节及组成辅酶等方面起着非常重要的作用,被广泛应用于生物医药领域。嘌呤其本身是大π共轭体系,具备有机半导体性质。嘌呤环上的2、6、8位上均可以引入特定的取代基团,从而可有效调节其半导体特性。因此,可以通过分子结构设计合成功能性嘌呤类衍生物,研发出高性能的新型有机光电半导体,应用于有机光电材料领域。
技术实现要素:
本发明的目的是提供一种嘌呤类衍生物自由基前体分子的结构和制备方法。本发明通过如下技术方案实现:
1、一种嘌呤类衍生物自由基前体分子,其结构如式i所示。该分子在8位碳-r4位置保留了已被文献证实的苯甲基型自由基前体结构,这类结构的叔碳在光照、加热等简单条件下就能离去氢原子,形成易给出电子的碳自由基分子;其次,由于嘌呤环上氮原子较多,而氮原子的电子比碳多,使得嘌呤环上的给电子能力和反应位点活性都比苯并咪唑环更强,更容易进行结构修饰,形成的自由基更容易给出电子;最终,创新性的将生物医药领域中的重要有机物嘌呤,应用于有机光电掺杂剂材料,该分子结构目前尚无文献报道。
所述嘌呤类衍生物分子r1和r2为氢、烷基、给/吸电子基团或苯、萘、噻吩等芳香环,r3和r5为烷基,而r4则为芳香环,这将增大共轭体系长度,并调整分子前线轨道能级,优化掺杂剂性能。在r4芳香环上相应位置,例如苯环的o、m、p位,引入给(或吸)电子基团或者各种官能团,在保证分子稳定性的前提下调节能级,优化分子电离能,增强分子溶解性。
所述烷基选自甲基、乙基、长链烷基等;所述给电子基团选自烷氧基、胺基、烷巯基、卤素、磷烷基、噻吩环等富电子芳香环;所述吸电子基团选自硝基、氰基、羰基、炔基、酰亚氨等缺电子芳香环;所述芳香环选自苯、萘、噻吩等富电子芳香环,其上可以连接氢、烷基、给/吸电子基团或芳香环。
2、本发明还提供如上所述本发明式(i)化合物的制备方法,包括以下两条路线:
(1)2,6-二氯嘌呤为原料,将其充分溶解于干燥无水的dmf溶液中,再加入碳酸钾作催化剂,分多次加入碘甲烷反应制得产物化合物2;
所述步骤(1)的反应如下所示:
路线一:(2)将步骤(1)中制得化合物2与碘代芳香环(r4-i)反应,惰性氛围下,以dmf为溶剂,醋酸钯、碳酸铯和碘化亚铜为催化剂体系反应制得产物化合物3;
根据本发明,所述步骤(2)的反应以r4为对甲氧基苯基为例如下所示:
(3)以r1和r2为苯基为例,利用嘌呤的6位反应性能比2位活泼的特点,将步骤(2)中制得化合物3分别与r1芳基硼酸、r2芳基硼酸,通过两次suzuki-miyaura偶联反应,先在嘌呤环6位连接r2,再在2位连接r1制得产物化合物4;
根据本发明,所述步骤(3)的反应如下所示:
(4)将步骤(3)中制得化合物4先在甲苯溶剂中,乙醇钠催化下,与碘甲烷反应得到季铵盐,重结晶后,在乙醇溶液中用硼氢化钠还原制得目标产物5;
根据本发明,所述步骤(4)的反应如下所示:
路线二:(ⅱ)利用嘌呤的6位反应性能比2位活泼的特点,将步骤(1)中制得的化合物2分别与r1芳基硼酸、r2芳基硼酸,通过两次suzuki-miyaura偶联反应,先在嘌呤环6位连接r2,再在2位连接r1制得产物化合物6;
所述步骤(ⅱ)的反应如下所示:
(ⅲ)将步骤(ⅱ)中制得的化合物6与对碘苯甲醚反应反应,惰性氛围下,以dmf为溶剂,醋酸钯为催化剂、混合碳酸铯、碘化亚铜反应制得产物化合物4;
(ⅳ)与路线一的步骤(4)相同将制得化合物4先在甲苯溶剂中,醇钠催化下,与碘甲烷反应得到季铵盐,重结晶后,在乙醇溶液中用硼氢化钠还原制得目标产物5。
根据本发明,所述步骤(1)中,所述原料(化合物1)、碳酸钾的用量比为1mmol:0.8-1.2mmol,优选1mmol:1-1.2mmol;其中生成化合物2的反应温度为常温,优选为25℃。
根据本发明,在步骤(1)反应后,优选所述纯化处理如下所示:将反应体系倒入60-80ml(优选60-70ml)蒸馏水中,搅拌10min后,用120-160ml(优选130-150ml)二氯甲烷分三次萃取,合并有机相,无水硫酸镁干燥,过滤,旋干二氯甲烷,减压蒸除去溶剂,柱色谱提纯得到白色固体产物化合物2。
根据本发明,所述方案一的步骤(2)中,化合物2、碘化亚铜、醋酸钯、对碘苯甲醚、碳酸铯的用量比为1mmol:2-4mmol:0.05-0.1mmol:1-3mmol:2-4mmol,优选1mmol:3-4mmol:0.05-0.1mmol:1-2mmol:3-4mmol;反应温度为140-180℃,优选155-165℃;反应时间为50-70h,优选55-65h。
根据本发明,在步骤(2)反应后,对反应体系进行后处理,优选所述纯化处理如下所示:将反应体系倒入80-150ml(优选100-120ml)二氯甲烷中,搅拌5min后,用80-120ml(优选90-100ml)水分三次洗涤,有机相用饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,旋干二氯甲烷,减压蒸除去溶剂,柱色谱提纯得到棕黄色晶状化合物3。
根据本发明,所述步骤(3)中,化合物3、苯硼酸、四三苯基膦钯、碳酸钾的用量比为1mmol:3-4mmol:0.05-0.1mmol:2-5mmol,优选1mmol:3-4mmol:0.05-0.1mmol:3-4mmol;反应温度为80-100℃,优选90-95℃;反应时间为8-12h,优选10h。
根据本发明,在步骤(3)反应后,对反应体系进行纯化处理,优选所述纯化处理如下所示:减压蒸除去多余的溶剂,产物溶于130-180ml(优选140-160ml)二氯甲烷,用80-120ml(优选90-100ml)蒸馏水分三次洗涤有机相,再用饱和食盐水洗涤一次,有机相用无水硫酸镁干燥,过滤后旋干有机溶剂,柱色谱提纯得到棕黄色固体化合物4。
根据本发明,所述步骤(4)中,化合物4、无水乙醇、钠、碘甲烷、硼氢化钠的用量比为1mmol:20-30mmol:2-5mmol:8-10mmol:2-4mmol,优选1mmol:25-30mmol:3-4mmol:9-10mmol:3-4mmol;反应温度为80-100℃,优选90-95℃;反应时间为8-12h,优选8h。
根据本发明,在步骤(4)反应后,对反应体系进行纯化处理,优选所述纯化处理如下所示:将反应体系倒入200ml烧杯中,缓慢滴加20mol/l的稀盐酸,不停搅拌至溶液呈中性,旋干溶剂,产物溶于100-150ml(优选130-140ml)二氯甲烷,用50-80ml(优选60-70ml)蒸馏水分三次洗涤有机相,再用饱和食盐水洗涤一次,有机相用无水硫酸镁干燥,过滤后旋干有机溶剂,柱色谱提纯得到黄色化合物5。
根据本发明,所述方案二的步骤(ⅱ)中,化合物2、苯硼酸、四三苯基膦钯、碳酸钾的用量比为1mmol:3-4mmol:0.05-0.1mmol:2-5mmol,优选1mmol:3-4mmol:0.05-0.1mmol:3-4mmol;反应温度为80-100℃,优选90-95℃;反应时间为8-12h,优选10h。
根据本发明,在步骤(ⅱ)反应后,对反应体系进行纯化处理,优选所述纯化处理如下所示:减压蒸除去多余的溶剂,产物溶于100-150ml(优选120-140ml)二氯甲烷,用50-80ml(优选60-80ml)蒸馏水分三次洗涤有机相,再用饱和食盐水洗涤一次,有机相用无水硫酸镁干燥,过滤后旋干有机溶剂,柱色谱提纯得到棕黄色固体化合物6。
根据本发明,所述步骤(ⅲ)中,化合物6、碘化亚铜、醋酸钯、对碘苯甲醚、碳酸铯的用量比为1mmol:2-4mmol:0.05-0.1mmol:1-3mmol:2-4mmol,优选1mmol:3-4mmol:0.05-0.1mmol:1-2mmol:3-4mmol;反应温度为140-180℃,优选155-165℃;反应时间为50-70h,优选55-65h。
根据本发明,在步骤(ⅲ)反应后,对反应体系进行后处理,优选所述纯化处理如下所示:将反应体系倒入80-150ml(优选100-120ml)二氯甲烷中,搅拌5min后,用80-120ml(优选90-100ml)水分三次洗涤,有机相用饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,旋干二氯甲烷,减压蒸除去溶剂,柱色谱提纯得到棕黄色固体化合物4。
根据本发明,所述步骤(ⅳ)与上述步骤(4)完全相同。
附图说明
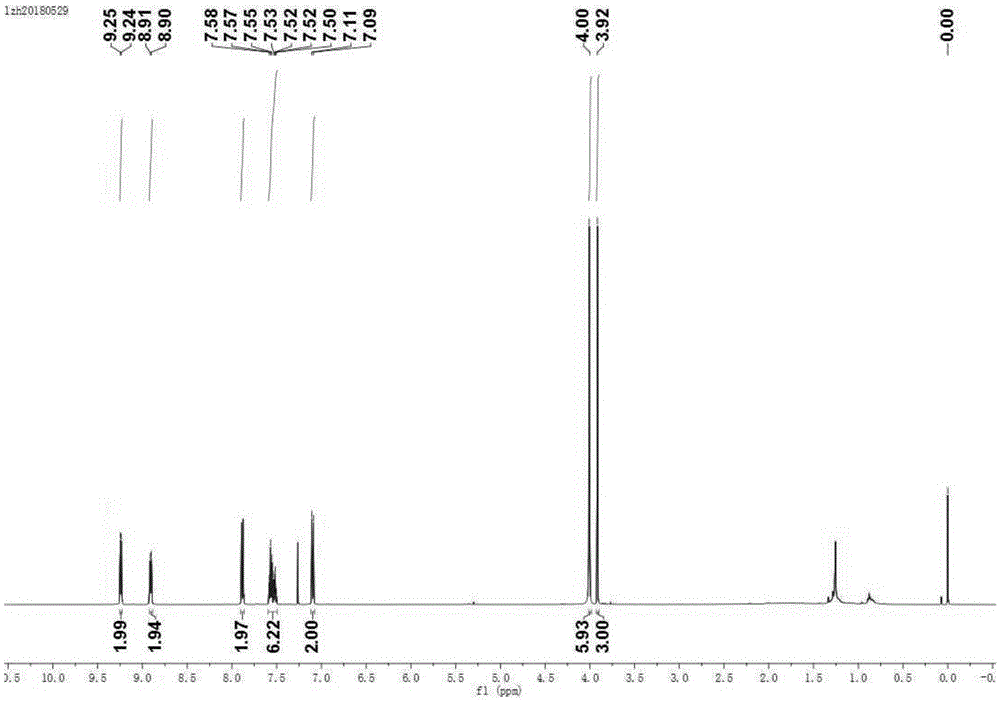
图1为实施例6制备所得目标产物(化合物5)的核磁氢谱。
具体实施方式
下面结合具体实施例对本发明作进一步说明,但本发明并不限于以下实施例。下述方法中如无特别说明,所述方法均为常规方法,以r1和r2为苯基、r3和r5为甲基、r4为对甲氧基苯基为例。
实施例1、制备9-甲基-2,6-二氯嘌呤(化合物2)
将2,6-二氯嘌呤(0.453g,2.41mmol)溶于10mldmf,室温下加入碳酸钾(0.375g,2.71mmol),再分3次加入3ml的碘甲烷,室温下搅拌10h。将反应体系倒入60ml蒸馏水中,搅拌10min后,用150ml二氯甲烷分三次萃取,合并有机相,无水硫酸镁干燥,过滤,旋干二氯甲烷,减压蒸除去溶剂,柱色谱提纯得到白色固体产物化合物2。
实施例2、制备9-甲基-8-对甲氧基苯基-2,6-二氯嘌呤(化合物3)
将化合物2(0.404g,2mmol)、pd(oac)2(0.022g,0.1mmol)、cui(1.142g,6mmol)、对碘苯甲醚(0.936g,4mmol)和cs2co3(1.630g,5mmol)加至100ml双口瓶中,氮气氛围下加入dmf20ml,160℃下反应60小时。反应结束后,将反应体系冷却至室温后,分3次加入150ml二氯甲烷进行萃取,合并有机相,分别用水、饱和nacl溶液对有机相进行洗涤。有机相用无水硫酸镁干燥,过滤,旋干二氯甲烷,减压蒸除去溶剂,柱色谱提纯得到棕黄色晶状化合物3。
实施例3、制备9-甲基-2,6-二苯基-8-对甲氧基苯基嘌呤(化合物4)
将化合物3(0.308g,1mmol)、苯硼酸(0.128g,1.05mmol)、四三苯基膦钯、(0..128g,1.05mmol)、碳酸钾(0.415g,3mmol)加入到充满氩气的100ml小瓶中,加入20ml甲苯作溶剂,95℃下反应8h。再将苯硼酸(0..128g,1.05mmol)溶于5ml的干燥的thf中,氩气保护下加入到反应液中继续反应10h。反应结束后,旋干溶剂,加入100ml二氯甲烷溶解底物,用60ml蒸馏水分三次洗涤有机相,再用饱和nacl溶液对有机相进行洗涤。有机相用无水硫酸镁干燥,过滤,旋干二氯甲烷,减压蒸除去溶剂,柱色谱提纯得到黄色固体产物。将该黄色固体产物作为原料,再次重复上述操作(在这步可以更换其他芳基硼酸),即可制备得到棕黄色晶状化合物4。
实施例4、制备9-甲基-2,6-二苯基嘌呤(化合物6)
将化合物2(0.202g,1mmol)、苯硼酸(0.128g,1.05mmol)、四三苯基膦钯、(0..128g,1.05mmol)、碳酸钾(0.415g,3mmol)加入到充满氩气的100ml小瓶中,加入20ml甲苯作溶剂,95℃下反应8h。再将苯硼酸(0..128g,1.05mmol)溶于5ml的干燥的thf中,氩气保护下加入到反应液中继续反应8h。反应结束后,减压蒸除去多余的溶剂,产物溶于150ml二氯甲烷,用90ml蒸馏水分三次洗涤有机相,再用饱和食盐水洗涤一次,有机相用无水硫酸镁干燥,过滤后旋干有机溶剂,柱色谱提纯得到淡黄色固体产物。将该淡黄色固体产物作为原料,再次重复上述操作(在这步可以更换其他芳基硼酸),即可制备得到化合物6。
实施例5、制备6-苯-8-对甲氧基苯-9-甲基嘌呤(化合物5)
将化合物6(0.572g,2mmol)、pd(oac)2(0.022g,0.1mmol)、cui(1.142g,6mmol)、对碘苯甲醚(0.936g,4mmol)和cs2co3(1.630g,5mmol)加至100ml双口瓶中,氮气氛围下加入dmf20ml,160℃下反应60小时。反应结束后,将反应体系冷却至室温后,分3次加入150ml二氯甲烷进行萃取,合并有机相,分别用水、饱和nacl溶液对有机相进行洗涤。有机相用无水硫酸镁干燥,过滤,旋干二氯甲烷,减压蒸除去溶剂,柱色谱提纯得到棕黄色晶状化合物4。
实施例6、制备目标产物嘌呤衍生物分子(化合物5)
在250ml反应瓶中加入25ml无水乙醇,冰浴冷却下搅拌,缓慢加入除去氧化层的新切金属钠丝(2.8g,20mmol),反应完全后冷却至室温,加入60ml苯,将化合物4(0.392g,1mmol)加入到反应瓶中,分3次加入碘甲烷4ml,加热回流10h,反应结束后蒸除溶剂,将反应物溶于20ml无水乙醇,氩气氛围下加入硼氢化钠(0.13g,4mmol),室温下搅拌2小时,将反应体系倒入200ml烧杯中,缓慢滴加20mol/l的稀盐酸,不停搅拌至溶液呈中性,旋干溶剂,产物溶于100ml二氯甲烷,用50ml蒸馏水分三次洗涤有机相,再用饱和食盐水洗涤一次,有机相用无水硫酸镁干燥,过滤后旋干有机溶剂,柱色谱提纯得到化合物5。
该产物的结构表征数据如下:
1hnmr(500mhz,cdcl3),9.24(d,2h),8.90(d,2h),7.88(d,2h),7.58–7.50(m,6h),7.10(d,2h),4.00(s,6h),3.92(s,3h).
该产物的核磁氢谱如图1所示。由上可知,该化合物结构正确。
- 还没有人留言评论。精彩留言会获得点赞!