一种促进干细胞成脂分化的方法及其所用试剂或试剂盒与流程
本发明涉及生物医药领域中一种促进干细胞成脂分化的方法及其所用试剂或试剂盒。
背景技术:
脂肪细胞是脂肪组织的主要成员,长期以来人们认为脂肪组织在动物体内主要起到贮存甘油三酯和调节能量平衡的作用,而脂肪沉积主要由体内生长激素(gh)、胰岛素(ins)、胰岛素样生长因子(igf-1)等激素所调控。最近研究表明,脂肪组织不仅仅是储存脂肪的场所,也是动物体内重要的内分泌组织,它能够分泌肿瘤坏死因子、脂联素、瘦素等多种生物活性物质、脂肪细胞因子,且这些细胞因子作用于中枢神经系统、免疫系统及内分泌器官如垂体、甲状腺和内分泌腺,并参与神经、内分泌、免疫网络和组织损伤修复,对动物机体的物质代谢、能量代谢、胰岛素敏感性都有着重要的生理作用。最新研究表明,脂肪细胞还可以分化成免疫细胞,如果脂肪细胞真的具有分化成免疫细胞的潜力,人类肥胖相关疾病的治疗将迎来新的曙光,也将有助于新药的研制。
脂肪细胞起源于脂肪组织中存在的间充质干细胞,与骨髓基质中存在的干细胞一样,该细胞可以自我更新、且具有多项分化潜能。20世纪80年代脂肪抽吸术的发展和完善,使得大量自体脂肪的获得十分方便,但此抽吸技术对脂肪细胞造成一定的损伤;目前大多数采用脂肪源性干细胞诱导成脂分化的方法获得脂肪细胞,此方法为在培养体系中加入嘌呤霉素、地塞米松、胰岛素和吲哚美辛长时间诱导分化,分化周期较长,因此目前急需寻找一种快速、高效地制备脂肪细胞的方法。
技术实现要素:
本发明所要解决的技术问题是如何快速、高效地制备脂肪细胞。
为了解决上述技术问题,本发明提供了用于制备脂肪细胞的试剂或试剂盒。
本发明所提供的用于制备脂肪细胞的试剂或试剂盒中,所述试剂或试剂盒包括离体的神经干细胞和离体的棕色脂肪干细胞。
上述用于制备脂肪细胞的试剂或试剂盒中,所述试剂或试剂盒还可含有哺乳动物细胞培养基和/或甲基纤维素。
上述用于制备脂肪细胞的试剂或试剂盒中,所述离体的神经干细胞和所述离体的棕色脂肪干细胞、哺乳动物细胞培养基和甲基纤维素均可独立包装。
上述用于制备脂肪细胞的试剂或试剂盒中,所述离体的神经干细胞与所述哺乳动物细胞培养基的配比可为104个所述离体的神经干细胞:1ml所述哺乳动物细胞培养基。
上述用于制备脂肪细胞的试剂或试剂盒中,所述甲基纤维素与所述哺乳动物细胞培养基的配比可为10-30mg所述甲基纤维素:1ml所述哺乳动物细胞培养基。
为了解决上述技术问题,本发明还提供了离体的神经干细胞和离体的棕色脂肪干细胞在制备生产脂肪细胞的试剂或试剂盒中的应用。
上述应用中,所述试剂或试剂盒包括离体的神经干细胞和离体的棕色脂肪干细胞。
上述应用中,所述试剂或试剂盒可含有哺乳动物细胞培养基和/或甲基纤维素。
上述应用中,所述离体的神经干细胞和所述离体的棕色脂肪干细胞、哺乳动物细胞培养基和甲基纤维素均可独立包装。
上述应用中,所述离体的神经干细胞与所述哺乳动物细胞培养基的配比可为104个所述离体的神经干细胞:1ml所述哺乳动物细胞培养基。
上述应用中,所述甲基纤维素与所述哺乳动物细胞培养基的配比可为10-30mg所述甲基纤维素:1ml所述哺乳动物细胞培养基。
为了解决上述技术问题,本发明还提供了离体的神经干细胞在制备将离体的棕色脂肪干细胞诱导为脂肪细胞的试剂或试剂盒中的应用。
上述应用中,所述试剂或试剂盒包括离体的神经干细胞和离体的棕色脂肪干细胞。
上述应用中,所述试剂或试剂盒可含有哺乳动物细胞培养基和/或甲基纤维素。
上述应用中,所述离体的神经干细胞和所述离体的棕色脂肪干细胞、哺乳动物细胞培养基和甲基纤维素均可独立包装。
上述应用中,所述离体的神经干细胞与所述哺乳动物细胞培养基的配比可为104个所述离体的神经干细胞:1ml所述哺乳动物细胞培养基。
上述应用中,所述甲基纤维素与所述哺乳动物细胞培养基的配比可为10-30mg所述甲基纤维素:1ml所述哺乳动物细胞培养基。
为了解决上述技术问题,本发明还提供了将离体的棕色脂肪干细胞诱导为脂肪细胞的试剂或试剂盒。
本发明所提供的将离体的棕色脂肪干细胞诱导为脂肪细胞的试剂或试剂盒,含有离体的神经干细胞和哺乳动物细胞培养基。
上述将离体的棕色脂肪干细胞诱导为脂肪细胞的试剂或试剂盒中,所述离体的神经干细胞与所述哺乳动物细胞培养基的配比可为104个所述离体的神经干细胞:1ml所述哺乳动物细胞培养基。
上述将离体的棕色脂肪干细胞诱导为脂肪细胞的试剂或试剂盒中,所述离体的神经干细胞与所述哺乳动物细胞培养基可以混合在一起,也可以各自独立包装,使用时再混合在一起。
上述将离体的棕色脂肪干细胞诱导为脂肪细胞的试剂或试剂盒中,所述试剂或试剂盒还可含有甲基纤维素。
上述将离体的棕色脂肪干细胞诱导为脂肪细胞的试剂或试剂盒中,所述甲基纤维素与所述哺乳动物细胞培养基的配比可为10-30mg所述甲基纤维素:1ml所述哺乳动物细胞培养基。
为了解决上述技术问题,本发明还提供了一种制备脂肪细胞的方法。
本发明所提供的制备脂肪细胞的方法包括用离体的神经干细胞将离体的棕色脂肪干细胞诱导为脂肪细胞的步骤。
上述方法包括在哺乳动物细胞培养基中将所述离体的棕色脂肪干细胞和所述离体的神经干细胞进行共培养的步骤。
上文中,所述甲基纤维素的粘度可为4000cps。
上文中,所述哺乳动物细胞培养基可由α-mem培养基、胎牛血清、l-谷氨酰胺和β-巯基乙醇组成,所述哺乳动物细胞培养基中胎牛血清的体积含量为30%,l-谷氨酰胺的含量为0.2mg/ml,β-巯基乙醇的含量为0.1mmol/l。
上述棕色脂肪干细胞和神经干细胞均可来源于哺乳动物。
本文中,所述棕色脂肪干细胞为棕色脂肪组织来源的干细胞。
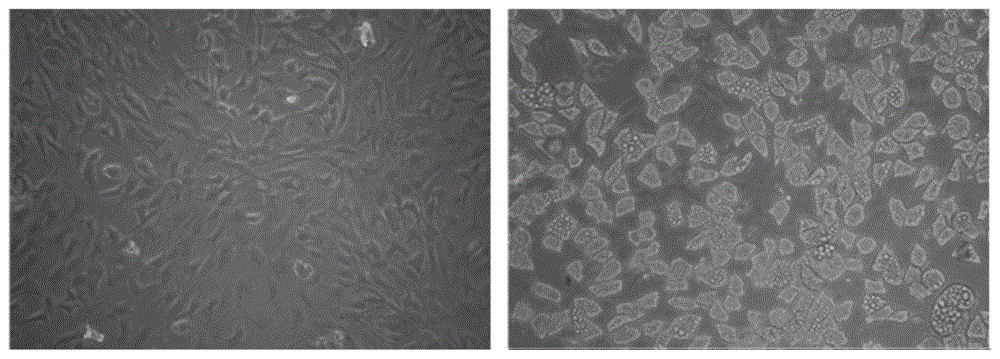
实验证明,用神经干细胞诱导棕色脂肪干细胞,在加入神经干细胞后第二天,85-90%的棕色脂肪干细胞分化为脂肪细胞(图1),7天后全部棕色脂肪干细胞分化为脂肪细胞。本发明可快速、高效地制备脂肪细胞。
附图说明
图1为棕色脂肪干细胞用本发明的方法诱导,加上神经干细胞第2天的光镜照片。图中,左侧图片为对照组,右侧图片为实验组。
图2为棕色脂肪干细胞用本发明的方法诱导,加上神经干细胞后第7天后进行油红o染色的照片。图中,左侧图片为对照组,右侧图片为实验组。
图3为棕色脂肪干细胞用本发明的方法诱导,加上神经干细胞后第7天后的实验组细胞和对照组细胞的脂肪特异性标记pparγ表达情况。
图4为棕色脂肪干细胞用传统方法诱导3天、7天后进行油红o染色的照片。图中,左侧图片为诱导7天的对照组,中间图片为诱导3天的实验组,右侧图片为诱导7天的实验组。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
①实验动物:健康的sd大鼠3周龄(用于分离棕色脂肪干细胞),sd孕鼠,孕龄14-16天(用于分离神经干细胞),均购于军事医学研究院动物中心。
②主要试剂:dmem/f12(gibco,usa),α-mem培养基(gibco,usa),hg-dmem(gibco,usa),胎牛血清(fbs)(gibco,usa),胰蛋白酶(sigma,usa),胶原酶iv(collagenaseiv)(sigma,usa),分散酶ii(dispaseii酶)(sigma,usa)0.05%胰酶(gibco,usa),神经干细胞培养专用小分子及因子:b27(gibco,usa)、n2(gibco,usa)、bfgf(peprotech,usa)、egf(peprotech,usa),β-巯基乙醇(gibco,usa)、l-谷氨酰胺(l-glu)(gibco,usa),油红o染料(sigma公司),甲基纤维素4000cps(no.m-0512sigma),imdm(hyclone850g/50liters)。
③主要仪器:co2孵箱(thermoforma,usa)、超净工作台(bcv-1360,哈东联,中国)、手术器械(上海手术器械厂)、倒置相差显微镜(olympus,japan)、real-timequantitativethermalcycler(ftc-3000p)。
下述实施例中的完全培养基均由α-mem培养基、胎牛血清、l-谷氨酰胺和β-巯基乙醇组成,该完全培养基中胎牛血清的体积含量为30%,l-谷氨酰胺的含量为0.2mg/ml,β-巯基乙醇的含量为0.1mmol/l。
实施例1、将棕色脂肪干细胞诱导为脂肪细胞
1.大鼠棕色脂肪干细胞(badscs)的分离培养
分离方法:以0.25%胰酶:胶原酶iv:分散酶ii:α-mem培养基=4:1:1:4配制badscs混合消化酶(胶原酶iv终浓度为1mg/ml,分散酶ii终浓度为1mg/ml),并于37℃水浴锅中孵育。sd大鼠颈椎脱臼处死,并用75%乙醇浸泡后移至超净工作台,用无菌剪刀及弯捏剪开背部皮肤,轻轻剪取肩胛骨棕色脂肪组织,用冰冷的pbs缓冲液冲洗两遍。充分剪碎后,每克棕色脂肪组织中加入10ml37℃预热的混合消化酶,在37℃,5%co2条件下搅拌20-35min,消化结束后向消化液中加入等体积α-mem培养基(含10%胎牛血清)终止消化,100目和200目筛网过滤消化液,1000rpm离心5min,α-mem培养基(含10%胎牛血清)重悬细胞,以终浓度为1×106个/100ml密度接种细胞。置于恒温孵箱中培养(5%co2,37℃),隔日更换一次培养基,得到大鼠棕色脂肪干细胞(badscs)。
2.胎鼠神经干细胞(nsc)的分离培养
sd孕鼠颈椎脱臼处死,并用75%乙醇溶液浸泡后移至超净工作台,用无菌剪刀及弯捏剪开肚子皮肤,轻轻取出胎鼠,放入冰冷的pbs缓冲液中,用剪刀剪下胎鼠头部,取出大脑,在显微镜下剥除脑膜及多余组织,只剩脑皮层,将脑皮层组织块在pbs中洗两次,用剪刀剪碎并加入0.05%胰酶37℃消化5-25min(依据胎鼠的大小决定消化时间),消化后加入与消化酶等量的胰酶抑制剂终止消化,移入离心管中1000rpm离心5min,弃上清,向沉淀中加入神经干细胞完全培养基,并轻轻吹打,100目和200目筛网过滤细胞悬液,除去粘连的纤维组织,收集细胞计数,以2×105个/ml接种到t25培养瓶中,置于恒温孵箱中培养(5%co2,37℃),得到胎鼠神经干细胞(nsc)。
上述神经干细胞完全培养基由dmem/f12培养基、b27、n2、bfgf和egf组成。该神经干细胞完全培养基中,b27的含量为2%,n2的含量为1%,bfgf的含量为20ng/ml,egf的含量为20ng/ml。
3.按照本发明的方法和传统方法同时进行平行实验将棕色脂肪干细胞诱导为脂肪细胞。
3.1本发明的方法是用神经干细胞将棕色脂肪干细胞诱导为脂肪细胞
同时设置实验组和对照组进行平行实验,实验重复三次,每次实验方法如下:
实验组(棕色脂肪干细胞+神经干细胞):原代badsc增殖到传代时,消化细胞,计数,以1×104个细胞悬到1000μl完全培养基中,与1000μl23mg/ml甲基纤维素溶液混匀,接种到6孔细胞培养板中,置于37℃、5%co2、饱和湿度的培养箱中培养;3天后在badsc上层接种nsc进行诱导:将2×104个nsc细胞悬到1000μl完全培养基中,与1000μl23mg/ml甲基纤维素溶液混匀,得到2000μlnsc细胞悬液,将该2000μlnsc细胞悬液加入到badsc层上。继续置于37℃、5%co2、饱和湿度的培养箱中培养;每天观察拍照。诱导7天后进行油红o染色。油红o染色的具体步骤为:加pbs溶解甲基纤维素,弃掉上清液→4%多聚甲醛固定30分钟→取油红o储存液与去离子水按3:2混合,滤纸过滤→去除固定液,加入油红o染液→室温染色30分钟→去除染液,去离子水清洗2次→显微镜拍照。其中,23mg/ml甲基纤维素溶液按照如下方法配制:
1)称甲基纤维素5.75g,放入500ml的玻璃瓶中;沿瓶壁倒入煮沸(在微波炉煮沸)的双蒸水125ml盖紧瓶盖;
2)在震荡器上充分搅拌,待冷却后置4℃冰箱过夜;
3)高压消毒,115℃,30min(消毒前用纸和纱布包瓶口并用绳子扎紧,再插上一个1ml注射器上的小针头);
4)待冷却后加入无菌2×hg-dmem125ml,在摇床上充分摇匀;
5)置-20℃过夜,次日再置4℃,待融后用力震摇,使瓶内凝块减少,置-20℃过夜,次日再置4℃,待融后用力震摇。反复上述过程数次,使液体透明无凝块。
6)分装后-20℃保存;
7)取2ml37℃培养3天无污染,则可以使用。
其中,2×hg-dmem培养基按照如下方法配制:取hg-dmem粉剂(高糖型dmem粉剂)13.5g/袋一袋,2.4ghepes(amresco)、3.7gnahco3(北京化学试剂公司),用双蒸水定容至500ml,过滤除菌,得到2×hg-dmem。
对照组:原代badsc增殖到传代时,消化细胞,计数,以1×104个细胞悬到1000μl完全培养基中,与1000μl23mg/ml甲基纤维素溶液混匀,接种到6孔细胞培养板中,置于37℃、5%co2、饱和湿度的培养箱中培养;3天后在badsc上层接种2000μl下述液体:将1000μl完全培养基与1000μl23mg/ml甲基纤维素溶液混匀,得到2000μl液体。继续置于37℃、5%co2、饱和湿度的培养箱中培养;每天观察拍照。接种上述液体7天后按照上述方法进行油红o染色。
诱导7天后,取对照组与实验组细胞按照如下方法进行rt-pcr检测,加trireagent裂解,提取细胞中的总rna,并反转录成cdna,pcr引物由上海生工公司合成,以β-actin为内参,扩增目的基因pparr的上游引物序列:taagggactcgaggaggtca(seqidno.1),下游引物序列:cgaagttggtgggccagaat(seqidno.2)。
内参β-actin的上游引物序列:cgtaaagacctctatgccaaca,
下游引物序列:taggagccagggcagtaatc。
经ftc-3000v1.0.2.20.进行图像分析和数据处理,以β-actin校正作相对量分析。
结果表明,棕色脂肪干细胞用本发明的方法诱导,加上神经干细胞后第二天,实验组中85-90%的细胞为脂肪细胞,对照组的棕色脂肪干细胞没有分化为脂肪细胞(图1);7天后进行油红o染色,实验组的细胞染色阳性,全部棕色脂肪干细胞分化为脂肪细胞,对照组的棕色脂肪干细胞没有分化为脂肪细胞(图2)。荧光定量pcr结果显示,本发明的方法三维培养的棕色脂肪干细胞+神经干细胞(实验组)脂肪特异性标记pparγ表达明显高于三维培养的棕色脂肪干细胞(对照组)(图3)。
3.2用传统方法将棕色脂肪干细胞诱导为脂肪细胞
同时设置实验组和对照组进行平行实验,实验重复三次,每次实验方法如下:
原代badsc增殖到传代时,消化细胞,计数,以1×104个/孔细胞的密度接种至24孔板中,加入1000μl完全培养基中,每组都设3复孔,置于37℃、5%co2、饱和湿度的培养箱中培养。细胞过夜贴壁后,吸去原培养液,实验组加入1ml/孔的成脂诱导分化完全培养液进行诱导。对照组加入1ml/孔的对照分化完全培养液。每2天换液。分别于诱导3天和7天后进行油红o染色。结果显示,在诱导后第3天只有1-2%的细胞油红o染色阳性,为脂肪细胞;在诱导后第7天只有2-5%的细胞油红o染色阳性,为脂肪细胞(图4)。
其中,成脂诱导分化完全培养液由hg-dmem培养基、胎牛血清、地塞米松(sigma)、ibmx(sigma)、胰岛素(sigma)和吲哚美辛(sigma)组成;该成脂诱导分化完全培养液中,胎牛血清的含量为10%、地塞米松的含量为1μm、ibmx的含量为0.5μm、胰岛素的含量为10μg/ml和吲哚美辛的含量为0.2mm。
对照分化完全培养液由hg-dmem培养基和胎牛血清组成,该对照分化完全培养液中胎牛血清的含量为10%。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
<110>北京健坤禾润科技有限公司
<120>一种促进干细胞成脂分化的方法及其所用试剂或试剂盒
<130>gncfh190059
<160>2
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
taagggactcgaggaggtca20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgaagttggtgggccagaat20
- 还没有人留言评论。精彩留言会获得点赞!