拟南芥FIPV启动子融合GUS基因的表达载体构建方法与流程
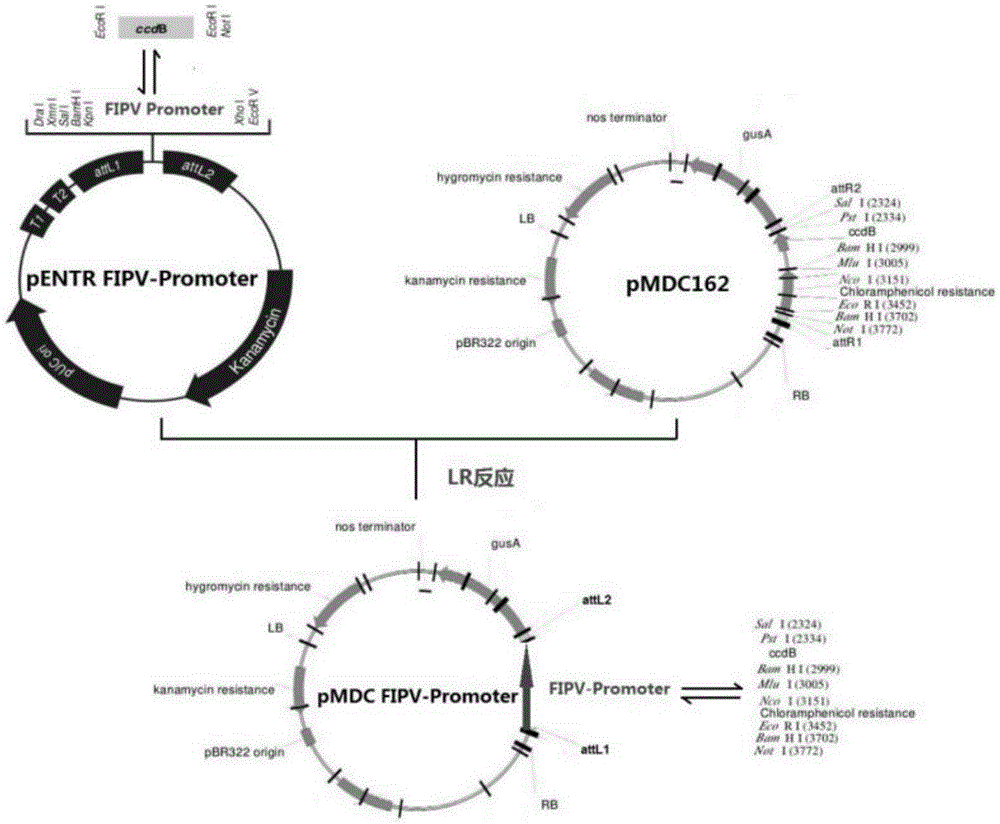
本发明属于分子生物学和生物
技术领域:
,具体涉及一种拟南芥fipv启动子融合gus基因的表达载体构建方法。
背景技术:
:植物能够吸收土壤中的no3-、nh4+和有机氮,绝大多数的陆生植物吸收氮素以no3-形式为主。大量的研究表明,no3-不但是一种营养元素,而且还是一种信号分子,在植物短期和长期生长与发育过程中起重要作用。短期效应主要体现在硝态氮初级响应,即施加no3-时植物体内有超过1000多个基因的表达迅速发生变化,比如nrts,nias和nir在no3-处理几分钟内被诱导表达。长期效应表现在no3-影响植物根系形态建成、种子休眠、开花、生物钟和不依赖于aba的气孔关闭和生长素运输等过程。近十年来,一些重要的参与no3-初级响应过程并影响no3-代谢过程的调控基因被鉴定。这些调控基因包括转运蛋白类,如nrt1.1;蛋白激酶类,如cipk8和cipk23;转录因子类,如nlp7、tga1、tga4、tcp20、nrg2等;microrna类,如micr167。最近的研究表明,参与真核生物mrna前体3’末端加工的多聚腺苷酸化复合体(cpsf)在调控硝态氮信号途径中起重要作用。fipv是cpsf的关键成员,极有可能调控植物的硝态氮感知、吸收、转运和同化等过程。因此鉴定该基因的功能对于研究植物硝态氮代谢过程,进而提高植物氮素利用率非常重要。真核生物的启动子是调控基因表达的关键顺式作用元件,一般位于结构基因的5’端上游。一个典型的启动子包含caat-box和tata-box,为rna聚合酶ii提供识别和结合位点。由于植物结构基因在基因组中的位置不同,上游很可能存在其他基因的外显子或某些特殊序列,因此植物基因的启动子长度一般差异很大。对植物基因启动子的研究是解析基因转录调控和基因表达模式的关键环节,也是对基因进行功能鉴定的首要步骤。在研究工作中,常需要将基因启动子与gus(β-葡萄糖苷酸酶)报告基因融合构建表达载体。该表达载体转化植物后,如加入gus的底物5-溴-4-氯-3-吲哚-β-葡萄糖苷酸(x-gluc)后,则转基因植物会在该启动子驱动的gus表达部位与底物发生反应从而生成蓝色产物。根据蓝色产物的多少和产生位置,可以鉴定启动子转录效率和表达模式。因此,要研究fipvpromoter的转录活性和表达模式,必须建构含有fipvpromoter融合gus报告基因的表达载体。技术实现要素:本发明的目的是提供一种拟南芥fipv启动子融合gus基因的表达载体构建方法。为了实现上述目的,本发明采用的技术方案为:本发明是一种拟南芥fipv启动子融合gus基因的表达载体构建方法,包括拟南芥fipv基因启动子的dna序列如序列表中拟南芥col-0fipv基因启动子序列,拟南芥fipv基因启动子的克隆方法如下:1)以拟南芥col-01周大的植株为材料,采用ctab法提取其gdna,设计特异性引物(f和r)扩增fipv基因启动子:f(正向引物):5’-cggggtaccattcttcggttttccggt-3’;r(反向引物):5’-ccgctcgagaccggaaaaccgaagaat-3’;2)以提取的gdna为模板,设计的f和r为引物,进行pcr反应,产物凝胶回收后通过酶切连接入gateway兼容的载体pentr3c,构建克隆载体pentrfipv-promoter,然后将pentrfipv-promoter与包含gus报告基因的载体pmdc162进行lr反应,得到包含fipv-promoter融合gus的表达载体pmdcfipv-promoter-gus,转化感受态大肠杆菌dh5α,对pmdcfipv-promoter-gus序列测定后得到拟南芥fipv基因启动子序列所示:用限制性内切酶kpni和xhoi分别对pcr产物和gateway兼容的载体pentr3c进行双酶切,将得到的含有黏性末端的fipvpromoter连接入酶切开的pentr3c构建克隆载体pentrfipv-promoter,然后将pentrfipv-promoter与包含gus报告基因的载体pmdc162进行lr反应,得到包含fipv-promoter融合gus的表达载体pmdcfipv-promoter-gus。所用的拟南芥为col-0。首次克隆到了拟南芥fipv基因的启动子序列,具体序列如下:attcttcggttttccggtgagaacgagcttcccagaaccagaaccctaaacacagaacctttcttagttttccggtgaaagaatctgaagatgcttttgtttattgcaacctggtttgtcttttggttcgatgaaagtacaaaaaaagagtttatttacatttttgttaatattaatttttactttttcactaatcctaattggggtagaaaaaaaaaggggtaaataagtgtataaataagaccctagcgatgataaaaagaagccgagacttgttgagaagaagcccttaaagcttcaccgtctctctctctctctttctcgtgagcttcaattcgaatcggccgttcttcttcttcttcctccaatctctttactcca。含拟南芥fipv启动子融合gus报告基因的植物表达载体的构建,方法如下:提取拟南芥中的gdna;以gdna为模板,使用设计的引物f和r,pcr扩增得到上游和下游分别引入kpni和xhoi酶切位点的fipv基因启动子;其中,所述的特定引物f和r是:f(正向引物):5’-cggggtaccattcttcggttttccggt-3’;r(反向引物):5’-ccgctcgagaccggaaaaccgaagaat-3’;将带有酶切位点的fipv基因启动子,连接到gateway兼容的载体pentr3c,构建克隆载体pentrfipv-promoter,转化感受态大肠杆菌dh5α,提取重组质粒。然后将pentrfipv-promoter与包含gus报告基因的载体pmdc162进行lr反应,得到包含fipv-promoter融合gus的表达载体pmdcfipv-promoter-gus,转化感受态大肠杆菌dh5α,提取阳性质粒。本发明的有益效果为:1.本发明构建的拟南芥fipv基因启动子融合gus报告基因的植物表达载体为首次报道,可以直接用农杆菌介导的遗传转化,获得fipv基因启动子过表达的新种质,为该启动子的功能鉴定提供基础。2.fipv基因启动子驱动fipv基因的表达,利用转pmdcfipv-promoter-gus表达载体构建的转基因株系,通过gus染色技术,可以直观地观察fipv基因的表达部位和表达强度。同时,利用不同的营养条件对转基因植株进行处理时,可以确定fipv基因启动子对于不同营养条件的响应情况和转录活性,为解析fipv基因调控植物硝态氮代谢的功能提供了有利的条件和充分的理论依据。附图说明图1为植物表达载体pmdcfip1-promoter-gus构建方法示意图;图2为以拟南芥col-0植株gdna为模板克隆fipv基因启动子的电泳图,其中,1—6泳道381bp处条带为fipv基因启动子;图3为以克隆载体pentrfipv-promoter(重组质粒)为模板的fipv基因启动子克隆后的电泳图,其中,1—6泳道381bp处条带为fipv基因启动子;图4为以表达载体pmdcfipv-promoter-gus(重组质粒)为模板的fipv基因启动子克隆后的电泳图,其中,1—6泳道381bp处条带为fipv基因启动子;图5为用生物信息学软件bdgp对克隆的fipv基因启动子序列中的核心作用元件进行分析的结果。具体实施方式下面结合实例对本发明做进一步说明。实施例1拟南芥fipv基因启动子序列的克隆,植物材料为拟南芥col-0。1.拟南芥gdna的提取(1)将ctab提取液先在65℃的水浴锅中预热;(2)在液氮中研磨拟南芥的幼嫩叶,在离心管中加入800μl粉末,然后加入800μlctab提取液,在65℃的条件下保温30min以上;(3)加入酚:氯仿:异戊醇的比例为400:384:16,混匀,室温静置1分钟;(4)在4℃,12000rpm离心机中离心2min,取上清液,加入氯仿:异戊醇=768:32,混匀,室温静置1min;(5)4℃条件下,12000rpm离心机中离心2min,取上清液,加入氯仿800μl异丙醇,混匀,室温静置10min;(6)4℃,12000rpm离心机中离心15min,取上清液;(7)在上清液中加入800μl的70%乙醇洗涤沉淀,12000rpm离心机中离心2min,丢弃上清液;(8)加入30μl重蒸水(ddh2o),放入-20℃的冰箱中备用。2.利用integrateddnatechnologies(idt)软件设计扩增fipv基因启动子的特异性引物f和r。f(正向引物):5’-cggggtaccattcttcggttttccggt-3’;r(反向引物):5’-ccgctcgagaccggaaaaccgaagaat-3’。3.以提取的拟南芥gdna为模板,进行pcr反应:(1)取0.2mlpcr专用管,依次加入以下成分:(2)封闭pcr管,放入pcr仪中。反应条件为:98℃预变性2分钟,98℃变性3秒,根据引物的退火温度退火20秒,72℃延伸30秒/kb,循环30次,72℃后延伸10分钟。pcr产物琼脂糖凝胶电泳检测结果如图2所示,在381bp处可以观察到清晰的目的条带。实施例2克隆载体pentrfip1-promoter的构建;植物材料为拟南芥col-01.拟南芥gdna的提取:方法同实施例1的步骤12.pcr扩增fipv基因启动子并与pentr3c连接f(正向引物):5’-cggggtaccattcttcggttttccggt-3’;r(反向引物):5’-ccgctcgagaccggaaaaccgaagaat-3’;以提取的gdna为模板,通过特异性引物f和r进行pcr扩增,并在目的基因上游和下游分别引入kpni和xhoi酶切位点。用天根(北京)胶回收试剂盒回收pcr产物,pcr产物与gateway兼容的pentr3c进行酶切连接,操作步骤按下表进行。成分用量目的片段回首产物0.5-10ngpent3c0.5μlsaltsolution0.5μlh2oupto3μl混匀后,室温(25℃)下反应30分钟,然后冰浴1分钟,用于转化大肠杆菌dh5α,表面涂含有卡那霉素的lb培养平板,37℃培养12小时。然后,挑取单个白色克隆涂布新的含有卡那霉素的lb培养平板,37℃培养12小时,进行菌落pcr扩增,如图3所示。同时,将筛菌正确的菌株送上海生工公司进行dna测序。得到的序列如序列表中fipv基因启动子序列所示,用dnaman软件将测序序列与拟南芥fipv基因启动子序列进行比对,比对正确后说明克隆载体pentrfipv-promoter构建成功,提取阳性质粒备用。质粒的提取使用北京康维公司试剂盒,按说明书步骤进行。(1)取1-5ml过夜培养的菌液,加入离心管中,12000rpm离心1min,尽量吸弃上清。(2)向留有菌体沉淀的离心管中加入250μlbufferp1,使用移液器或涡旋振荡器彻底悬浮细菌沉淀。注意:如果菌块未彻底混匀,将会影响裂解效果,使提取量和纯度偏低。(3)向离心管中加入250μlbufferp2,温和地上下颠倒混匀4-6次,使菌体充分裂解,此时菌液应变得清亮粘稠。所用时间不应超过5min,以免质粒受到破坏。(4)向离心管中加入350μlbuffern3,立即温和地上下颠倒混匀4-6次,此时将出现白色絮状沉淀,12000rpm离心10min,此时在离心管底部形成沉淀。(5)柱平衡:向已装入吸附柱(spincolumn)的收集管中加入200μlbufferps,12000rpm离心2min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(6)将步骤4中所得上清加入到已装入吸附柱的收集管中,注意不要吸出沉淀,12000rpm离心1min,倒掉收集管中的废液,将吸附柱放回收集管中。(7)向收集管中加入600μlbufferpw,12000rpm离心1min,倒掉收集管中的废液。(8)重复步骤7。(9)将吸附柱重新放回收集管中,12000rpm离心1min,倒掉收集管中的废液。将吸附柱置于室温数分钟,以彻底晾干。(10)将吸附柱置于一个新的离心管中,向吸附膜的中间部位悬空滴加50-100μlbuffereb,室温放置数分钟,12000rpm离心1min,将质粒溶液收集到离心管中。-20℃保存质粒。实施例3拟南芥fipv基因启动子融合gus报告基因的表达载体构建将测序正确的克隆载体与含有gus报告基因的pmdc162进行lr进行反应,得到包含fipv基因启动子融合gus报告基因的表达载体。lr反应体系如下:克隆载体1μl(约100ng)载体,pmdc162载体1μl(约100ng),lr克隆酶0.5μl。将上述物质混匀后置于室温(25℃)反应1-2小时,转化大肠杆菌dh5α。转化的菌株表面涂含有卡那霉素的lb培养平板,37℃培养12小时。然后,挑取单个白色克隆涂布新的含有卡那霉素的lb培养平板,37℃培养12小时,进行菌落pcr扩增,如图4所示。说明表达载体pentrfipv-promoter-gus构建成功,提取阳性质粒备用,提取方法如实施例2所述。分析该启动子的核心作用元件,如图5所示,ctaat表示启动子的caatbox,tataaa表示启动子的tatabox,下方加黑点的a表示转录起始位点。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1