一种手性2,3-二氢苯并呋喃衍生物及其制备方法与流程
本发明属于化工技术领域,具体涉及一种手性2,3-二氢苯并呋喃衍生物及其制备方法。
背景技术:
2,3-二氢苯并呋喃衍生物(2,3-dihydrobenzofuranderivatives)是一类非常重要的药物分子片段,广泛存在于天然产物和生物活性药物分子中,例如(+)-conocarpan被广泛应用于杀虫剂和抗真菌剂;obtusafuran是一种醌还原酶,具有抗多药耐药性;stachybotrylactam可作为一种hiv-1酶抑制剂被广泛使用,2,3-二氢苯并呋喃骨架也是在dna拓扑异构酶ii的重要骨架组成部分。其众多的重要手性药物分子都含有2,3-二氢苯并呋喃骨架,因此发展高效构建手性手性2,3-二氢苯并呋喃结构的方法成为了合成化学研究领域的一个重要热点和难点。
近年来,对位醌(p-quinonemethides)参与的[4+1]环化反应实现苯并呋喃化合物的一步构建受到了人们的广泛关注。有研究报道邻羟基取代对位醌和活性较高的硫叶立德,在不需要添加任何催化剂的条件下合成了2,3-二氢苯并呋喃衍生物,取得了很好的结果;还有研究报道邻羟基对位醌和硫盐在碱的作用下合成2,3二氢苯并呋喃酮衍生物的方法。然而这些反应都是构建消旋体,关于手性2,3-二氢苯并呋喃衍生物的一步不对称合成还没有任何报道。
技术实现要素:
针对现有技术中存在的上述问题,本发明提供一种手性2,3-二氢苯并呋喃衍生物及其制备方法,通过对位醌的[4+1]反应,一步构建了一种手性2,3-二氢苯并呋喃衍生物,其合成方法简单,合成的手性2,3-二氢苯并呋喃衍生物具有高反应收率(yield),高对映选择性(ee)和高非对映选择性(dr)。
为实现上述目的,本发明解决其技术问题所采用的技术方案是:
一种手性2,3-二氢苯并呋喃衍生物,包括结构通式i及其相应的消旋体、对映异构体和非对映异构体:
其中,r1为c1-20烷基,氢,酯基,芳基,杂芳环基;r2为杂原子,卤素,c1-20烷基,氢,芳基或取代芳基;r3为c1-20烷基,烷氧基或取代烷氧基,氨基或取代氨基,芳基或取代芳基,五元杂环基或者取代五元杂环基,六元杂环基或者取代六元杂环基;r4为氢,c1-20烷基,硅基,碳酸酯基,磺酸酯基,mom,ac,苄基或取代苄基;x为碳原子或杂原子n,o,s;n为1,2,3,4,5,6,7,8。
进一步地,手性2,3-二氢苯并呋喃衍生物,其结构式为如下但不限于如下结构:
上述手性2,3-二氢苯并呋喃衍生物的制备方法,包括以下步骤:
在手性季鏻盐催化剂的作用下,将化合物ⅱ和化合物ⅲ溶于有机溶剂中,再加入碱,经过环加成反应制得手性的2,3-二氢苯丙呋喃衍生物ⅰ;该反应为[4+1]环加成反应,其合成路线如下:
其中,r3为c1-20烷基,烷氧基或取代的烷氧基,氨基或取代的氨基,芳基,杂芳环基,五元杂环基或者取代的五元杂环基,六元杂环基或者取代的六元杂环基;lg为卤素(f,cl,br,i),磺酸酯类(ots,oms,oes),碳酸酯类(oboc),硫醚或取代的硫醚,硫鎓盐,亚砜,砜,季铵盐,胺叶立德,季鏻盐或磷叶立德。
进一步地,有机溶剂为二氯甲烷,氯仿,1,2-二氯乙烷,正己烷,环己烷,石油醚,四氢呋喃,乙醚,甲基叔丁基醚,乙酸乙酯,甲醇,乙醇,乙腈,甲苯或二甲苯。
进一步地,碱为三乙胺,二异丙基乙基胺,dabco,碳酸氢钾,碳酸钾,碳酸钠,碳酸铯,磷酸钾,七水磷酸钾,磷酸钠,十水磷酸钠,氢氧化钠,氢氧化钾或氢氧化锂。
进一步地,反应温度为-78~40℃,反应时间为3-72h。
进一步地,手性季鏻盐催化剂为:
其中,化合物ⅳ中,r1为氢,c1-20烷基,苯基或者取代的苯基,苄基或取代的苄基,杂环或取代的杂环;r5为boc,ts,酰基,脲,硫脲或取代的硫脲,羰基或取代的羰基;r6为c1-20烷基,苯基或者取代的苯基,苄基或取代的苄基,萘基或取代的萘基;x为卤素,bf4,otf,oac或oboc;
所述化合物ⅴ中r4为氢,c1-20烷基,硅基,boc,ts,苄基或取代的苄基;r5为boc,ts,酰基,脲,硫脲或取代的硫脲,羰基或取代的羰基;r6为c1-20烷基,苯基或者取代的苯基,苄基或取代的苄基,萘基或取代的萘基;x为卤素,bf4,otf,oac或oboc。
进一步地,手性季鏻盐催化剂为:
进一步地,手性季鏻盐催化剂ⅳ的制备方法包括以下步骤:
将手性的三价膦通过wittig反应,一步制得季鏻盐催化剂,合成路线如下:
将三价膦溶于dcm中,加入碘甲烷,室温搅拌3小时,直接浓缩得到产物;或者加入苄溴,甲苯回流2小时,冷却旋干再重结晶得到产物;
其中,r1为氢,c1-20烷基,苯基或者取代的苯基,苄基或取代的苄基,杂环或取代的杂环,r5为取代的酰基;r6为c1-20烷基,苄基或取代苄基,苯基或取代苯基,萘基或取代的萘基,杂环;x为卤素,bf4,bf6或oac。
手性季鏻盐催化剂v的制备方法包括以下步骤:
将手性的三价膦通过wittig反应,一步制得季鏻盐催化剂,合成路线如下:
将三价膦溶于dcm中,加入碘甲烷,室温搅拌3小时,直接浓缩得到产物;或者加入苄溴,甲苯回流2小时,冷却旋干再重结晶得到产物;
其中,r4为氢,硅基(优选为tbdps,tbs,tes,tms,tips,tps);r5为取代的酰基;r6为c1-20烷基,苄基或取代苄基,苯基或取代苯基,萘基或取代的萘基,杂环;x为卤素(f,cl,br,i),bf4,bf6或oac。
上述三价膦的制备过程是采用现有技术进行制备。
本发明的反应原理为:
a)对位醌甲基(ii)在碱的作用下,酚羟基被拔氢,同时与催化剂通过氢键和离子对作用,形成中间体a;
b)中间体a再与溴代酮(iii)发生亲核取代得到b;
c)b再被碱拔氢,发生1,6加成关环反应,得到最终的产物1a,同时解离催化剂进入下一个催化循环。
本发明具有以下有益效果:
(1)本发明通过对位醌的[4+1]反应,一步构建了手性2,3-二氢苯并呋喃衍生物,其合成方法简单,操作方便,不需要无水无氧条件,反应不涉及到过渡金属,没有金属残留问题,绿色环保。
(2)本发明在合成过程中所用的催化剂是手性季鏻盐催化剂,该类催化剂对空气和水十分稳定,且具有良好的水溶性,对环境友好。
(3)本发明提供的手性2,3-二氢苯并呋喃衍生物具有反应收率(yield),高对映选择性(ee)和高非对映选择性(dr)。
附图说明
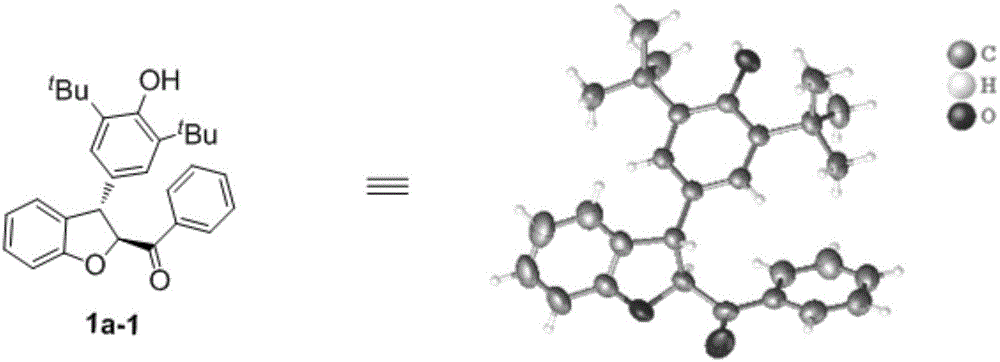
图1为实施例1中化合物1a-1的单晶结构图。
图2为实施例1中化合物1a-1的消旋体hplc谱图。
图3为实施例1中化合物1a-1的手性产物hplc谱图。
图4为实施例1中化合物1a-1的1hnmr谱图。
图5为实施例1中化合物1a-1的13cnmr谱图。
具体实施方式
实施例1
((2s,3s)-3-(3,5-二叔丁基-4-羟基苯基)-2,3-二氢苯并呋喃-2-基)(苯基)甲酮(1a-1)的制备:
将31.0mg化合物2a(0.1mmol)和24mg化合物3a(0.12mmol),三乙胺15.2mg(0.15mmol),催化剂4d(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀后在30℃下发生反应。该反应催化剂载量为5mol%,反应6h,tlc显示原料2a消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=40/1),得到46.8mg产品1a-1,其单晶结构见图1;收率96%,97%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.93(d,j=7.2hz,2h),7.59(dd,j=7.6,7.2hz,1h),7.44(dd,j=8.0,7.6hz,2h),7.20(dd,j=8.0,7.6hz,1h),7.04(d,j=7.2hz,1h),6.98(d,j=8.0hz,1h),6.94(s,2h),6.90(dd,j=7.6,7.2hz,1h),5.77(d,j=6.4hz,1h),5.17(s,1h),4.85(d,j=6.4hz,1h),1.38(s,18h);13cnmr(101mhz,cdcl3)δ195.35,159.33,153.17,136.39,134.74,133.78,132.72,129.47,128.80,128.71,125.60,124.90,121.57,109.95,90.92,51.40,34.49,30.39;hrms(esi)m/zcalcdforc29h32o3[m+na]+=451.2249,found=451.2249;由上述核磁和质谱数据可知,所得产物结构正确。
实施例2
((2s,3s)-3-(3,5-二叔丁基-4-羟基苯基)-6-甲基-2,3-二氢苯并呋喃-2-基)(苯基)甲酮(1a-2)的制备:
将32.4mg化合物2b(0.1mmol)和24mg化合物3a(0.12mmol),三乙胺15.2mg(0.15mmol),催化剂4e(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与30℃下发生[4+1]环加成反应。该反应催化剂载量为5mol%,反应4h,tlc显示原料2b消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=30/1),得到45.0mg产品1a-2,收率93%,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.91(d,j=7.2hz,2h),7.58(dd,j=7.6,7.2hz,1h),7.43(dd,j=8.0,7.6hz,2h),6.99(d,j=7.6hz,1h),6.95(s,2h),6.86(d,j=8.4hz,2h),5.75(d,j=6.8hz,1h),5.17(s,1h),4.79(d,j=6.8hz,1h),2.24(s,3h),1.39(s,18h);13cnmr(101mhz,cdcl3)δ195.50,157.29,153.17,136.38,134.77,133.74,132.90,130.90,129.45,129.43,129.37,128.70,126.00,124.92,109.45,91.08,51.57,34.52,30.42,20.95;hrms(esi)m/zcalcdforc30h34o3[m+na]+=465.2406,found=465.2407;由上述核磁和质谱数据可知,所得产物结构正确。
实施例3
((2s3s)-3-(3,5-二叔丁基-4-羟基苯基)-7氟-2,3-二氢苯并呋喃-2-基)(苯基)甲酮(1a-3)的制备:
将32.8mg化合物2c(0.1mmol)和24mg化合物3a(0.12mmol),三乙胺15.2mg(0.15mmol),催化剂4e(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与20℃下发生[4+1]环加成反应。该反应催化剂载量为5mol%,反应6h,tlc示原料2c消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=20/1),得到42.0mg产品1a-3,收率94%,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.96(d,j=7.2,hz,2h),7.61(dd,j=7.6,7.2hz,1h),7.46(dd,j=8.0,7.6hz,2h),7.03-6.97(m,1h),6.95(s,2h),6.88-6.80(m,2h),5.86(d,j=6.8hz,1h),5.20(s,1h),4.95(d,j=6.8hz,1h),1.39(s,18h);13cnmr(101mhz,cdcl3)δ194.43,153.34,148.83,146.38,145.96(d,jcf=10.7hz),136.54,134.57,133.98,133.23(d,jcf=2.7hz),132.00,129.17(d,jcf=73.5hz),124.87,122.16(d,jcf=5.6hz),120.91(d,jcf=3.4hz),115.90(d,jcf=16.8hz),91.89,51.49(d,jcf=1.9hz),34.51,30.37;hrms(esi)m/zc29h31fo3calcdfor[m+na]+=469.2155,found=469.2150;由上述核磁和质谱数据可知,所得产物结构正确。
实施例4
((1s,2s)-1-(3,5-二叔丁基-4-羟基苯基)-1,2二氢杂酚[2,1-b]呋喃-2-基)(苯基)甲烷酮(1a-4)的制备:
将36.0mg化合物2d(0.1mmol)和24mg化合物3a(0.12mmol),dabco16.8mg(0.15mmol),催化剂4h(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与20℃下发生[4+1]环加成反应。该反应催化剂载量为5mol%,反应10h,tlc示原料2d消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯=40/1,v/v),得到46.3mg产品1a-4,收率97%,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.90(d,j=7.2hz,2h),7.71(dd,j=8.8,6.8hz,2h),7.54(dd,j=7.6,7.2hz,1h),7.40(dd,j=8.0,7.6hz,2h),7.27-7.21(m,2h),7.20-7.14(m,2h),6.92(s,2h),5.85(d,j=5.2hz,1h),5.07(d,j=5.2hz,1h),5.01(s,1h),1.27(s,18h);13cnmr(101mhz,cdcl3)δ195.27,157.26,153.12,136.45,134.51,133.84,132.85,130.68,130.40,130.18,129.53,128.81,126.64,124.60,123.18,120.21,112.24,91.93,51.21,34.47,30.41;hrms(esi)m/zc33h34o3calcdfor[m+na]+=501.2406,found=501.2399;由上述核磁和质谱数据可知,所得产物结构正确。
实施例5
((2s3s)-3-(3,5-二叔丁基-4-羟基苯基)-2,3-二氢苯并呋喃-2-基)(4-甲氧基苯基)甲酮(1a-5)的制备:
将31.0mg化合物2a(0.1mmol)和27.2mg化合物3b(0.12mmol),dabco16.8mg(0.15mmol),催化剂4h(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与20℃下发生环加成反应。该反应催化剂载量为5mol%,反应8h,tlc示原料2a消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=20/1),得到42.1mg产品1a-5,收率92%,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.91(d,j=8.8hz,2h),7.20(dd,j=8.0,7.6hz,1h),7.04(d,j=7.6hz,1h),6.97(d,j=7.6hz,1h),6.96(s,2h),6.97(d,j=7.6hz,1h),6.96(s,2h),5.73(d,j=6.8hz,1h),5.17(s,1h),4.86(d,j=6.8hz,1h),3.87(s,3h),1.38(s,18h);13cnmr(101mhz,cdcl3)δ193.81,164.06,159.38,153.13,136.35,132.77,131.82,129.61,128.73,127.79,125.58,124.97,121.49,113.93,109.91,90.80,55.64,51.49,34.50,30.40;hrms(esi)m/zc30h34o4calcdfor[m+na]+=481.2355,found=481.2361;由上述核磁和质谱数据可知,所得产物结构正确。
实施例6
((2s3s)-3-(3,5-二叔丁基-4-羟基苯基)-2,3-二氢苯并呋喃-2-基)(2-甲氧基苯基)甲酮(1a-6)的制备:
将31.0mg化合物2a(0.1mmol)和27.2mg化合物3c(0.12mmol)dabco16.8mg(0.15mmol),催化剂4e(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与30℃下发生环加成反应。该反应催化剂载量为10mol%,反应5h,tlc示原料2a消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=30/1),得到44.0mg产品1a-6,收率96%,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.73(dd,j=7.6,1.6hz,1h),7.54-7.40(m,1h),7.16(dd,j=8.0,7.6hz,1h),7.03(dd,j=7.6,7.2hz,1h),6.97(dd,j=7.6,6.4hz,2h),6.86(s,2h),6.84(d,j=8.0hz,1h),6.81(d,j=8.0hz,1h),6.04(d,j=6.8hz,1h),5.10(s,1h),4.53(d,j=6.8hz,1h),3.32(s,3h),1.36(s,18h);13cnmr(101mhz,cdcl3)δ198.44,159.55,158.49,152.65,135.95,134.07,131.17,129.75,128.52,125.73,125.22,124.18,120.94,111.20,109.75,93.32,54.91,52.32,34.29,30.28;hrms(esi)m/zc30h34o4calcdfor[m+na]+=481.2355,found=481.2352;由上述核磁和质谱数据可知,所得产物结构正确。
实施例7
((2s3s)-3-(3,5-二叔丁基-4-羟基苯基)-2,3-二氢苯并呋喃-2-基)(3,4-二氯苯基)甲酮(1a-7)的制备:
将31.0mg化合物2a(0.1mmol)和26.5mg化合物3d(0.12mmol),dabco16.8mg(0.15mmol),催化剂4e(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与30℃下发生环加成反应。该反应催化剂载量为10mol%,反应6h,tlc示原料2a消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=30/1),得到47.1mg产品1a-7,95%收率,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.95(d,j=2.0hz,1h),7.79(dd,j=8.4,2.0hz,1h),7.52(d,j=8.4hz,1h),7.21(dd,j=8.0,7.6hz,1h),7.05(d,j=7.6hz,1h),6.97(d,j=7.6hz,1h),6.96(s,2h),6.92(dd,j=7.6,7.2hz,1h),5.66(d,j=7.2hz,1h),5.19(s,1h),4.87(d,j=7.2hz,1h),1.39(s,18h);13cnmr(101mhz,cdcl3)δ193.46,158.95,153.37,138.45,136.62,134.43,133.42,132.17,131.47,130.84,129.33,128.93,128.49,125.62,124.89,121.87,110.03,91.06,51.27,34.52,30.39;hrms(esi)m/zc29h30cl2o3calcdfor[m+na]+=519.1470,found=519.1477;由上述核磁和质谱数据可知,所得产物结构正确。
实施例8
((2s3s)-3-(3,5-二叔丁基-4-羟基苯基)-2,3-二氢苯并呋喃-2-基)(3,4-二氧基苯基)(1a-8)的制备:
将31.0mg化合物2a(0.1mmol)和26.0mg化合物3e(0.12mmol),dabco16.8mg(0.15mmol),催化剂4h(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与30℃下发生环加成反应。该反应催化剂载量为10mol%,反应5h,tlc示原料2a消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=30/1),得到45.4mg产品1a-8,93%收率,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.54(dd,j=8.4,1.6hz,1h),7.41(d,j=2.0hz,1h),7.20(dd,j=8.0,7.6hz,1h),7.03(d,j=7.6hz,1h),6.98(d,j=7.6hz,1h),6.96(s,2h),6.89(dd,j=7.6,7.2hz,1h),6.85(d,j=8.4hz,1h),5.77(d,j=7.2hz,1h),5.17(s,1h),4.83(d,j=7.2hz,1h),3.94(s,3h),3.78(s,3h),1.37(s,18h);13cnmr(101mhz,cdcl3)δ193.83,159.25,153.74,153.05,148.95,136.30,132.53,129.44,128.63,127.75,125.41,124.86,124.13,121.37,111.26,110.09,109.83,90.63,56.10,55.79,51.86,34.37,30.26;hrms(esi)m/zc31h36o5calcdfor[m+na]+=511.2460,found=511.2453;由上述核磁和质谱数据可知,所得产物结构正确。
实施例9
((2s3,s)-3-(3,5-二叔丁基-4-羟基苯基)-2,3-二氢苯并呋喃-2-基)(噻吩-2-基)甲酮(1a-9)的制备:
将31.0mg化合物2a(0.1mmol)和20.4mg化合物3f(0.12mmol),dabco16.8mg(0.15mmol),催化剂4h(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与30℃下发生环加成反应。该反应催化剂载量为10mol%,反应8h,tlc示原料2a消耗完全,直接浓缩柱层析(石油醚/乙酸乙酯,v/v=40/1),得到38.7.4mg产品1a-9,89%收率,98%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.74(dd,j=3.6,0.8hz,1h),7.70(dd,j=4.8,0.8hz,1h),7.21(dd,j=7.6,7.6hz,1h),7.11(dd,j=4.8,4.8hz,1h),7.07(d,j=7.2hz,1h),6.99(d,j=8.4hz,1h),6.97(s,2h),6.92(dd,j=7.6,7.2hz,1h),5.51(d,j=6.8hz,1h),5.17(s,1h),4.91(d,j=6.8hz,1h),1.39(s,18h);13cnmr(101mhz,cdcl3)δ189.40,159.10,153.07,141.12,136.27,134.97,134.12,132.44,129.19,128.70,128.13,125.57,124.74,121.62,109.87,92.00,52.08,34.38,30.27;hrms(esi)m/zc27h30o3scalcdfor[m+na]+=457.1813,found=457.1802;由上述核磁和质谱数据可知,所得产物结构正确。
实施例10
1-((2s3s)-3-(3,5-二叔丁基-4-羟基苯基)-2,3-二氢苯并呋喃-2-基)-2,2-二甲基-酮(1a-10)的制备:
将31.0mg化合物2a(0.1mmol)和21.4mg化合物3g(0.12mmol),dabco16.8mg(0.15mmol),催化剂4k(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与30℃下发生[4+1]环加成反应。该反应催化剂载量为10mol%,反应7h,tlc示原料2a消耗完全,浓缩柱层析(石油醚/乙酸乙酯=30/1,v/v),得到38.1mg产品1a-10,收率94%,98%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.21-7.14(m,1h),7.07-7.01(m,1h),6.95(s,2h),6.92-6.85(m,2h),5.23(d,j=6.4hz,1h),5.14(s,1h),4.78(d,j=6.4hz,1h),1.39(s,18h),1.20(s,9h);13cnmr(101mhz,cdcl3)δ211.82,159.13,153.02,136.29,132.82,129.79,128.62,125.57,124.67,121.41,109.59,89.90,51.50,44.06,34.50,30.42,26.20;hrms(esi)m/zc27h36o3calcdfor[m+na]+=431.2562,found=431.2560;由上述核磁和质谱数据可知,所得产物结构正确。
实施例11
(2s,3’s)-3-(3,5-二叔丁基-4-羟基苯基)-3氢,3’氢3-2,2’-螺[苯并呋喃]-3-酮(1c-1)的制备:
将31.0mg化合物2a(0.1mmol)和25.4mg化合物3h(0.12mmol),dabco16.8mg(0.15mmol),催化剂4h(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与0℃下发生[4+1]环加成反应。该反应催化剂载量为10mol%,反应12h,tlc示原料2a消耗完全,浓缩柱层析(石油醚/乙酸乙酯,v/v=50/1),得到41.5mg产品1c-1,收率95%,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.67(d,j=7.6hz,1h),7.48(dd,j=8.4,8.4hz,1h),7.30(dd,j=7.6,7.2hz,1h),7.22(d,j=6.8hz,1h),7.12-6.98(m,3h),6.90(s,2h),6.62(d,j=8.4hz,1h),5.09(s,1h),5.04(s,1h),1.28(s,18h);13cnmr(101mhz,cdcl3)δ196.64,170.25,158.29,153.33,139.13,135.64,128.92,127.42,125.79,125.34,124.45,123.46,122.67,122.35,120.23,112.72,112.10,110.63,55.99,34.20,30.21;hrms(esi)m/zc29h30o4calcdfor[m+na]+=465.2042,found=465.2049;由上述核磁和质谱数据可知,所得产物结构正确。
实施例12
(2s,3’s)-3-(3,5-二叔丁基-4-羟基苯基)-3氢,3’氢3-2,2’-螺[苯并呋喃]-3-酮(1c-2)的制备:
将31.0mg化合物2a(0.1mmol)和22.3mg化合物3i(0.12mmol),dabco16.8mg(0.15mmol),催化剂4e(0.01mmol)和1ml乙腈加入到反应瓶中,搅拌混匀与0℃下发生[4+1]环加成反应。该反应催化剂载量为10mol%,反应12h,tlc示原料2a消耗完全,浓缩柱层析(石油醚/乙酸乙酯,v/v=20/1),得到42.2mg产品1c-2,收率93%,99%ee,>99:1dr。
核磁和质谱数据:1hnmr(400mhz,cdcl3)δ7.67(d,j=7.6hz,1h),7.48(dd,j=8.4,8.4hz,1h),7.30(dd,j=7.6,7.2hz,1h),7.22(d,j=6.8hz,1h),7.12-6.98(m,3h),6.90(s,2h),6.62(d,j=8.4hz,1h),5.09(s,1h),5.04(s,1h),1.28(s,18h);13cnmr(101mhz,cdcl3)δ196.64,170.25,158.29,153.33,139.13,135.64,128.92,127.42,125.79,125.34,124.45,123.46,122.67,122.35,120.23,112.72,112.10,110.63,55.99,34.20,30.21;hrms(esi)m/zc29h30o4calcdfor[m+na]+=465.2042,found=465.2049;由上述核磁和质谱数据可知,所得产物结构正确。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种具有抗氧化活性的芳基苯并呋喃类化合物及其制备方法和应用与流程
- 一种含苯并双环酮与乙氧磺隆的除草组合物及其应用的制造方法与工艺
- 一种6‑氯呋喃[3,2‑B]吡啶的合成方法与流程
- 一类苯并吡喃类化合物及其应用的制造方法与工艺
- 一种以二苯并环庚烯为核心的化合物及其在有机电致发光器件上的应用的制造方法与工艺
- 一种含苯并双环酮与乙草胺的除草组合物及其应用的制造方法与工艺
- 一种含苯并双环酮与噁草酮的除草组合物及其应用的制造方法与工艺
- 分解二噁英前体的催化剂筛选系统及其使用方法与流程
- 一种无卤热固性树脂组合物以及含有它的预浸料、层压板和印制电路板的制造方法与工艺
- 一种以二联二苯并五元杂环为骨架的有机化合物及其在OLED上的应用的制造方法与工艺