一种选择性捕获和纯化microRNA的纳米磁性颗粒及其制备方法和应用与流程
本发明属于生物检测
技术领域:
,涉及一种选择性捕获和纯化microrna的纳米磁性颗粒及其制备方法和应用。
背景技术:
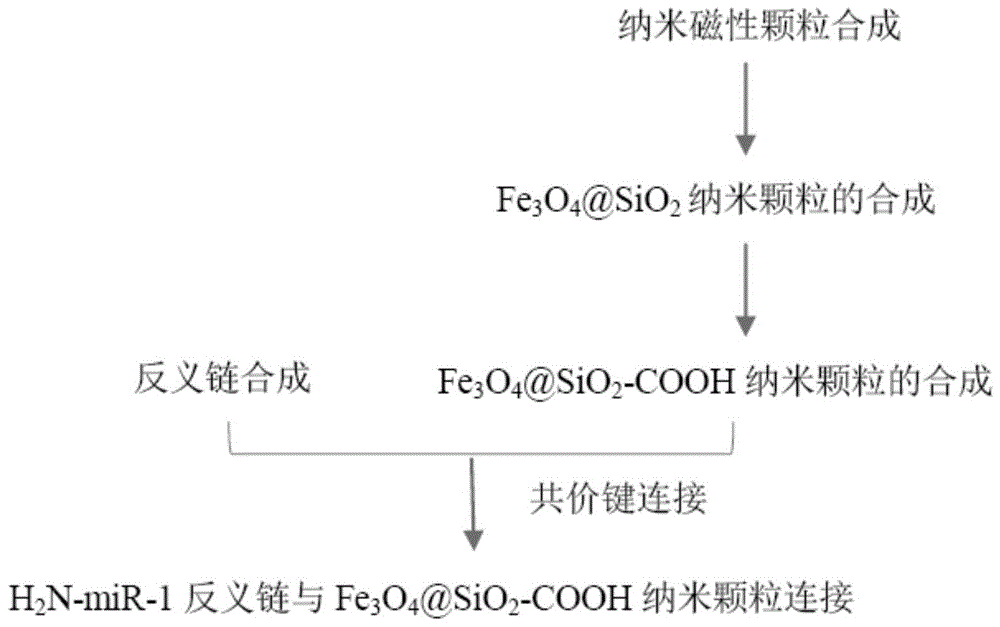
:microrna(mirna),是一种小的内源性非编码rna,在转录后调控中起着重要作用,因此是定制治疗靶向的候选分子。大量的人类基因都是由mirna基于其互补序列进行调控的,mirna调控将抑制蛋白质翻译。尽管越来越多的mirna已被探索发现,但是mirna检测在技术层面上由于其片段太小始终面临着诸多问题。mirna表达量分析是现有的直接用来评估特定mirna生物学功能最主要的方法。这其中主要用到几项专业的技术,包括实时荧光定量pcr法,微阵列芯片检测法以及聚丙烯酰胺凝胶电泳法。这几项技术各有其对应的优势和劣势。实时荧光定量pcr法利用目标mirna与pcr产物各自对应的产量之间的关系,从而计算得到mirna的表达量,仅需初始少量的样本即得到准确的结果,但是在设计引物时需要非常特殊的设备和丰富的经验;高通量测序技术可以捕捉更多更复杂的检测信息。在进行高通量测序检测时,由于mirna片段小,一条测序read就可以完全覆盖对应的mirna信息。其测序深度可以应需求调整,高通量测序技术可以检测到杂交印迹法无法满足的表达量检测下限,从而发现新mirna的表达情况。由此可见高通量测序技术在应用过程中既能满足对新mirna发现,又能满足对mirna低表达情况的检测。但是,在测序前需要将mirna进行分离,常常使用聚丙烯酰胺凝胶电泳的方法,此方法流程较为繁琐,通过单体丙烯酰胺在过硫酸铵与temed(四甲基乙二胺)的催化和诱导下聚合成长链分子,当有亚甲基双丙烯酰胺参与聚合反应时,长链分子之间就交联成凝胶,每次实验流程较长;电泳过程中所用的丙烯酰胺和亚甲基双丙烯酰胺单体都具有生物学毒性,因此增加了在检测mirna时的难度;该技术同样需要特殊的工具和丰富的经验来设计芯片;最常用的聚丙烯酰胺凝胶电泳不需要以上方法中对于特殊工具和经验的要求,可以检测mirna的表达量以及分析rna的大小,但是常规使用的仍然是dna探针去捕获目标mirna分子,灵敏度较低,尤其是在检测丰度较低的mirna样品时,需要加入大量已纯化的rna样本。在样本稀缺时,这样的要求往往是无法实现的。由于mirna通常是18-24bp的核苷酸短片段,在使用传统pcr扩增分析mirna时,常常设计短的引物,这容易引起pcr的扩增效率降低,同时将会增加非特异性的扩增。尽管芯片法在检测mirna时具有高通量的特性,但是微阵列芯片在捕获mirna同样面临交叉杂交和低灵敏度的问题。即便是用rna印迹法这样的金标准去检测细胞中或者是血液中的mirna,也无法灵敏地检出。技术实现要素:本发明的目的是针对现有技术的上述不足,提供一种选择性捕获和纯化microrna的纳米磁性颗粒。本发明的另一目的是提供该纳米磁性颗粒制备方法。本发明的又一目的是提供该纳米磁性颗粒的应用。本发明的目的可通过以下技术方案实现:一种选择性捕获和纯化microrna的纳米磁性颗粒,所述的纳米磁性颗粒为表面共价键偶联mirna反义链探针的fe3o4@sio2-cooh纳米颗粒,所述的mirna反义链含有一个或多个lna核苷酸。作为本发明所述的纳米磁性颗粒的优选,整条mirna反义链均由lna合成。作为本发明所述的纳米磁性颗粒的优选,所述的mirna反义链3’端通过c6连接臂与nh2基团相连。本发明所述的纳米磁性颗粒的制备方法,包含以下步骤:(1)设计并合成mirna反义链寡聚核苷酸探针,其中mirna3’端通过c6连接臂与nh2基团相连;(2)制备fe3o4@sio2-cooh纳米颗粒;(3)共价键连接mirna反义链寡聚核苷酸探针与fe3o4@sio2-cooh纳米颗粒。作为本发明所述的纳米磁性颗粒的制备方法的优选,整条mirna反义链均由lna合成。作为本发明所述的纳米磁性颗粒的制备方法的优选,所述的fe3o4@sio2-cooh纳米颗粒制备方法如下:1)将fe3o4@sio2纳米颗粒与1:1乙醇和水的混合液混合,超声30-35min;2)将citricacidmonohydrate溶解在1:1-2乙醇和水的混合液中;3)将1)中的纳米颗粒混合液加热到82-86℃,随即加入2)中的混合液;4)82-86℃反应1-1.5h,随后冷却到室温;5)置于磁力架上吸附磁性颗粒进行分离,并用pbs缓冲液清洗;6)在真空环境下干燥fe3o4@sio2-cooh磁性颗粒。作为本发明所述的纳米磁性颗粒的制备方法的优选,所述的共价键连接mirna反义链寡聚核苷酸探针与fe3o4@sio2-cooh纳米颗粒方法如下:1)使用蒸馏水配制31mm的edchydrochloride溶液和0.35m的nhs溶液;2)将fe3o4@sio2-cooh磁性颗粒置于无菌水中;3)将磁性颗粒悬液与配制好的edc溶液混合;4)加入nhs溶液和蒸馏水至3)中的溶液,搅拌1-1.5h;5)加入mirna反义链寡聚核苷酸探针,过夜搅拌;6)置于磁力架上吸附磁性颗粒进行分离,并用无菌水清洗。本发明所述的纳米磁性颗粒在mirna检测中的应用。本发明所述的应用,优选所述的纳米磁性颗粒在mirna高通量检测中的应用。一种mirna检测方法,包括利用本发明所述的纳米磁性颗粒选择性捕获和纯化待检测mirna;利用高通量测序技术检测纯化后的mirna。作为本发明mirna检测方法,包括利用本发明所述的纳米磁性颗粒选择性捕获和纯化待检测mirna;利用高通量测序技术检测经过多重所述的纳米磁性颗粒纯化后的mirna。有益效果:lna单体是双环状核苷酸衍生物,是一类与rna具有高亲和性的核苷酸类似物。结构中含有一个或多个2’-o-4’-c-亚甲基-β-d-呋喃核糖核酸单体。对比传统方法,通过在寡聚核苷酸链中引入lna的结构,在检测mirna时将显著提升其灵敏度,精确到单一核苷酸的区别。不仅如此,lna有着非常稳定的化学结构且易于在实验室中实现设计和订购。新设计的lna修饰的反义链探针可以实现低样本量的检测,同时不要求昂贵的设备或是专业的经验。本发明使用lna合成mirna反义链用于捕获检测mirna,通过二代测序的手段,即提高了实验的准确度和精确度,也准确反映了mirna的表达情况。本发明中,生物连接修饰的氧化铁纳米颗粒用于mirna的捕获检测。由于氧化铁纳米颗粒具有磁性,可以实现与细胞、蛋白和核酸等生物分子分离,避免了聚丙烯酰胺凝胶电泳纯化的步骤,简化了后期的检测实验。由于mirna相对较小的结构以及组成上的相似性,使用氧化铁纳米颗粒准确识别生理环境下的mirna仍然为一大挑战。为提升mirna特异性识别与捕获的准确性,本发明使用经表面修饰添加了mirna反义链的氧化铁纳米颗粒,提高了癌症早期诊断和治疗监控中针对mirna的检测能力。使用传统的mirna反义链介导的纳米磁性颗粒与lna修饰过后的mir-31反义链介导的纳米磁性颗粒去捕获不同浓度的目标mirna时,lna在目标单位低浓度的情况下,依然具有良好的捕获检测效果,具有更显著的特异性。附图说明图1纳米磁性颗粒合成流程图图2透射电镜下fe3o4@sio2纳米磁性颗粒视图图3传统反义链探针与lna修饰的反义链探针在检测灵敏度上的区别“1”表示20pmol的mir-31模板,“2”表示1pmol的mir-31模板,“3”表示阴性样本图4lna合成的mir-31反义链介导的纳米磁性颗粒与对照磁性颗粒相对检测量比较具体实施方式实施例11.反义链寡聚核苷酸链的合成传统的dna寡聚核苷酸探针的灵敏度不如lna修饰的反义链寡聚核苷酸探针。为了提高其杂交捕获时的灵敏度,在线设计完成目标mirna的反义链(http://www.exiqon.comandhttp://lnatools.com)。本发明中只选取mir-31和mir-100作为示例设计反义链探针,其中mir-100作为对照,反义链探针见下表。实际捕获检测时,可根据需求设计特定探针。反义链序列的每个碱基均采用lna核苷酸去合成,lna反义链的合成委托罗氏诊断产品(上海)有限公司。表1反义链序列目标序列mir-313’ammc6–tccgttctacgaccgtatcgaa-5’(seqidno.1)mir-100(对照)3’ammc6–ttgggcatctaggcttgaacac-5’(seqidno.2)备注:ammc6表示nh2基团通过c6连接臂与反义链相连,c6又称为aminolinkerc6,是在合成循环的最后一步以亚磷酸胺的形式通过b-氰乙基化学反应添加到引物5’糖环上的。2.纳米磁性颗粒合成磁性颗粒合成所购买的化学试剂见下表,pbs缓冲液为实验室自配试剂。化学试剂名称及对应品牌试剂名称品牌fecl3·6h2omerk油酸钠(sodiumoleate)sigmaaldrichigepalc250sigmaaldrichtetraethylorthosilicatesigmaaldrich1-ethyl-3-(3-dimethylaminopropyl)carbodiimide(edc)hydrochloridesigmaaldrichn-hydroxysuccinimide(nhs)sigmaaldrichammoniumhydroxidesigmaaldrichcitricacidmonohydratesigmaaldrich2.1合成反义链纳米磁性颗粒流程见图12.1.1纳米磁性颗粒的合成1)取11.8gfecl3·6h2o和37.5g油酸钠(sodiumoleate)溶解在150ml的环己烷(cyclohexane)中,加入80ml乙醇和60ml蒸馏水;2)溶液置于70℃搅拌4.5h;3)冷却至室温,有机层使用分液漏斗分离并使用蒸馏水清洗3次;4)抽真空去除溶剂得到产物。2.1.2fe3o4@sio2纳米颗粒的合成1)将25mg第一项中制备的氧化铁纳米磁性颗粒通过超声分散到160ml环己烷中;2)一边搅拌,一边加入8mligepal溶液和25ml环己烷;3)加入125μl的ammoniumhydroxide到以上溶液中,超声35min;4)缓慢加入共计1ml的正硅酸乙酯(tetraethylorthosilicate),每次100μl,持续24小时;5)离心11000rpm,30min得到fe3o4@sio2纳米颗粒;6)使用乙醇清洗3次,并在真空下干燥。2.1.3fe3o4@sio2-cooh纳米颗粒的合成1)将25mgfe3o4@sio2纳米颗粒与6ml1:1乙醇和水的混合液混合,超声35min;2)将11mgcitricacidmonohydrate溶解在4ml1:1乙醇和水的混合液中;3)将1)中的纳米颗粒混合液加热到84℃,随即加入2)中的混合液;4)84℃反应1h,随后冷却到室温;5)置于磁力架上吸附磁性颗粒进行分离,并用pbs缓冲液清洗;6)在真空环境下干燥fe3o4@sio2-cooh磁性颗粒。2.1.4共价键连接mirna反义链寡聚核苷酸探针与fe3o4@sio2-cooh纳米颗粒1)使用蒸馏水配置100μl,31mm的edchydrochloride溶液和100μl,0.35m的nhs溶液;2)将2.0mg的fe3o4@sio2-cooh磁性颗粒置于1ml无菌水中;3)将200μl的磁性颗粒悬液与配置好的edc溶液混合;4)加入nhs溶液和280μl蒸馏水至3)中的溶液,搅拌1.5h;5)加入120μl10μm的mirna反义链寡聚核苷酸探针,过夜搅拌;6)置于磁力架上吸附磁性颗粒进行分离,并用无菌水清洗。制备的纳米磁性颗粒大小为14.8±1.2nm(透射电镜下视图见图2)。磁性颗粒为小立方体。由于其表面的亲水结构,fe3o4@sio2核心颗粒能够在水环境下保持一个稳定的结构。实施例2使用传统的mir-31反义链介导的纳米磁性颗粒与lna修饰过后的mir-31反义链介导的纳米磁性颗粒去捕获不同浓度的目标mir-31,结果见图3,由图可见lna修饰的反义链探针在检测的灵敏度上优于传统反义链探针,lna在目标单位低浓度的情况下,依然具有良好的捕获检测效果。实施例3lna修饰的反义链探针特异性实验为验证是否已特异地捕获了目标mirna,使用经过修饰的mir-100和mir-31共同捕获检测仅含有mirna-31的rna模板。1.在离心管中加入50μl的rna模板2.在不同的离心管中分别加入100μl的mir-100纳米磁性颗粒和100μl的mir-31纳米磁性颗粒,在室温下温浴5min3.在磁力架上放置2min,使用移液器取出并丢弃每个离心管中的上层清液4.从磁力架上取下离心管,加入磁珠重悬液150μl(0.01mtris)重悬磁性纳米颗粒,并使用移液器上下吸打以混匀液体5.重复3-4步骤,在磁力架上保持5min,弃上清液6.向离心管中加入50μl去离子水,充分重悬磁性纳米颗粒7.短暂离心1min后,将上一步离心管置于磁力架上静置2min,使磁珠完全吸附在侧壁后使用移液器将洗脱液转移至新的离心管中用于后续的测序分析实验测序完成后,实验数据表明,与对照纳米磁性颗粒相比,反义链介导的纳米颗粒捕获目标区域的产量比对照组高出约15倍(图4)。说明,不同反义链介导的纳米磁性颗粒对于目标mirna的捕获具有显著的特异性。序列表<110>南京求臻基因科技有限公司<120>一种选择性捕获和纯化microrna的纳米磁性颗粒及其制备方法和应用<160>2<170>siposequencelisting1.0<210>1<211>22<212>dna<213>人类(homo sapiens )<400>1tccgttctacgaccgtatcgaa22<210>2<211>22<212>dna<213>人类(homo sapiens )<400>2ttgggcatctaggcttgaacac22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 壳聚糖修饰的磁性异质结构及其在抑菌方面的应用的制造方法与工艺
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺