一种膜表面工程化NK细胞的制备方法及药物组合物与应用与流程
本发明涉及一种用于肿瘤免疫治疗的靶向性nk细胞构建,具体涉及一种膜表面工程化nk细胞的制备方法及药物组合物与应用。
背景技术:
pd-1/pd-l1免疫检查点抑制剂能够激活显著的、持久的抗肿瘤免疫反应,已经被批准用于包括晚期非小细胞肺癌、头颈部鳞状细胞癌和三阴性乳腺癌等多种肿瘤的治疗,是目前最具有前景的肿瘤治疗手段。但遗憾的是,约70%的晚期肿瘤患者对pd-1/pd-l1免疫检查点抑制剂治疗不反应,因此,探寻如何提高阻断pd-1/pd-l1通路治疗效果具有重要的研究意义,也是目前研究的热点。
nk细胞作为天然免疫的重要组成部分,对肿瘤细胞具有直接的杀伤作用,并通过分泌细胞因子和趋化因子发挥免疫调节功能。与t细胞不同,nk细胞发挥杀伤活性不需要肿瘤细胞表达肿瘤抗原,并且对低表达或不表达mhc分子的肿瘤细胞杀伤活性更强;目前普遍认为pd-1/pd-l1免疫检查点诱导cd8+t细胞功能耗竭,免疫检查点抑制剂通过激活cd8+t细胞发挥抗肿瘤活性。而最近研究表明,pd-1/pd-l1通路能显著地抑制nk细胞的功能,在免疫检查点抑制剂激活的抗肿瘤免疫反应中,nk细胞同t细胞一样,发挥必不可少的作用(jclininvest2018,128(10):4654-4668.)。
过继性回输同种异体nk细胞已经在临床试验中用于血液类肿瘤(淋巴瘤、急性白血病等)和多种实体瘤(晚期胃癌和结直肠癌、胃肠部肿瘤的肝转移和儿童复发、难治性神经母细胞瘤等)的治疗,具有很好的安全性,不会引起移植物抗宿主病(graft-versus-hostdisease,gvhd),但是仅具中等的治疗效果。可能的原因是nk细胞缺乏靶向性以及肿瘤浸润不足(natimmunol2016,17(9):1025-1036.);为了提高nk细胞的靶向杀伤活性,目前的研究主要通过病毒载体构建靶向肿瘤抗原的car-nk细胞,但是即使采用慢病毒感染的方法,原代nk细胞的car载体转染效率依然低下(humgenether2012,23(10):1090-1100.)。并且病毒载体具有一定的安全隐患(natmed2018,24(10):1499-1503.),car-nk制备周期较长,费用高昂;因此,开发一种非转染的方式提供nk细胞的靶向性的方法是目前的研究热点。
因此,本领域迫切需要增强靶向pd-1/pd-l1通路治疗的敏感性及nk细胞靶向性,本发明解决了该需求。
技术实现要素:
为了解决目前临床晚期肿瘤患者对阻断pd-1/pd-l1通路治疗不反应的问题,本发明建立靶向pd-l1的膜表面工程化nk细胞的制备体系,一方面增强nk细胞靶向肿瘤迁移能力和杀伤活性,另一方面阻断pd-1/pd-l1通路介导的免疫逃逸;针对外周血来源nk细胞病毒载体转染效率低下的问题,本发明采用非病毒载体的方式,利用代谢糖生物工程和无铜点击化学的方式构建将靶向pd-l1的多肽修饰到nk细胞表面,增强nk细胞的靶向性。
本发明是通过以下技术方案实现的:一种膜表面工程化nk细胞的制备方法,包括以下步骤:
(1)所述nk细胞源自于外周血的单个核细胞;
(2)用nk细胞配制细胞浓度为1×106-3×106个/ml的nk细胞悬液,加入浓度为5-100μm的靶向载体溶液后孵育12-72小时,所述靶向载体为ac4mannaz或ac4mann-dbco;
(3)孵育完成后,以离心力400×g室温离心5分钟,弃上清,得到孵育细胞,使用培养基重悬孵育细胞,然后加入浓度为5-100μm的靶向pd-l1的多肽溶液进行二次孵育,靶向pd-l1的多肽为n3-p13或dbco-p13,二次孵育时间为0.5-4小时;所述孵育细胞为nk-ac4mannaz或nk-ac4mann-dbco细胞;
所述多肽n3-p13的氨基酸序列为dbco-mal-cys-peg4-nyskptdrqyhfk;多肽dbco-p13的氨基酸序列为n3-mal-cys-peg4-nyskptdrqyhfk;
(4)二次孵育结束后,以离心力400×g室温离心5分钟,弃上清,生理盐水洗两遍后得到膜表面工程化nk细胞,即nk-ac4mann-p13细胞,使用生理盐水重悬nk-ac4mann-p13细胞,使其细胞浓度为2×106-80×106个/ml。
其中,所述nk细胞由外周血的单个核细胞经体外扩增培养得到;
所述步骤(2)中靶向载体溶液的浓度优选为26-60μm,孵育时间优选为12-48小时;
所述步骤(3)中靶向pd-l1的多肽溶液的浓度优化为10-40μm,二次孵育时间优化为0.5-2小时;
一种药物组合物,所述药物组合物包含权利要求1-4所述膜表面工程化nk细胞以及任选的药学上可接受的辅料。
一种膜表面工程化nk细胞的应用,用于治疗或辅助治疗pd-l1阳性肿瘤;所述pd-l1阳性肿瘤为头颈部鳞状细胞癌、非小细胞肺癌或三阴性乳腺癌。
本发明相比现有技术具有以下优点:首先,通过非病毒载体即靶向载体,增强nk细胞的靶向性,消除采用病毒载体转染引发的潜在危险;其次,同种异体nk-ac4mann-p13细胞不会引起gvhd,解决目前car-t细胞个体化和制作过程繁琐的问题;针对于目前阻断pd-1/pd-l1通路治疗不反应的pd-l1阳性肿瘤,nk-ac4mann-p13细胞通过结合肿瘤细胞表面的pd-l1蛋白,在增强nk细胞的肿瘤浸润能力和靶向杀伤活性的同时,能有效阻断pd-1/pd-l1通路介导的免疫逃逸;nk-ac4mann-p13细胞将显著增强阻断pd-1/pd-l1通路的治疗效果,具有潜在的临床应用前景。
附图说明
图1是体外扩增nk细胞(cd3-cd56+)纯度检测图。
图2是nk-ac4mann-p13-fitc细胞比例检测图。
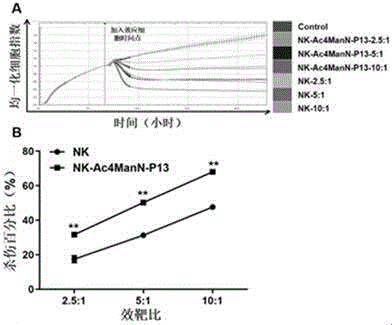
图3是体外杀伤头颈部鳞状细胞癌细胞系fadu活性检测图。
图4是体内杀伤头颈部鳞状细胞癌细胞系fadu移植瘤活性检测。
具体实施方式
为了使本发明的目的、技术方案及优点更加更加清楚、明白,对本发明进一步说明。下述实施例仅用于例示本发明,并不用于限定本发明。如无特殊说明,实施例中所述方法均为常规方法,如无特殊说明所述仪器、材料和试剂等,均2可通过商业途径获得。
实施例1制备nk-ac4mann-p13细胞包括以下步骤
1.1由外周血的单个核细胞经体外扩增培养得到nk细胞,如图1中所示,所述nk细胞(cd3-cd56+)纯度可达95%;
1.2使用l500培养基调整nk细胞浓度至1×106-3×106个/ml;
1.3加入终浓度为26-60μm的靶向载体ac4mannaz或ac4mann-dbco,在设定条件为温度37℃含5%co2的培养箱中孵育12-48小时;
1.4孵育结束后,以离心力400×g室温离心5分钟,弃上清,使用l500培养基重悬细胞,加入终浓度为10-40μm的靶向pd-l1的多肽n3-p13或dbco-p13多肽,在设定条件为温度37℃含5%co2的培养箱中二次孵育0.5-2小时;
1.5二次孵育结束后,以离心力400×g室温离心5分钟,弃上清,用生理盐水洗两遍后,使用生理盐水重悬nk-ac4mann-p13细胞,待用。
实施例2nk-ac4mann-p13细胞阳性检测
2.1按照实施例1制备方法制备nk-ac4mann-p13细胞,将步骤1.4中靶向pd-l1的多肽n3-p13或dbco-p13多肽替换为n3-p13-fitc或dbco-p13-fitc多肽,制备nk-ac4mann-p13-fitc细胞;
2.2通过共聚焦荧光显微镜检测nk-ac4mann-p13-fitc细胞比例的结果如图2-a中所示,通过流式细胞仪检测nk-ac4mann-p13-fitc细胞比例的结果如图2-b中所示,nk-ac4mann-p13-fitc细胞比例达到100%。
实施例3nk-ac4mann-p13细胞体外杀伤活性检测
对实施例1中制备的nk-ac4mann-p13细胞的杀伤活性进行检测
使用艾森生物的实时无标记细胞功能分析仪检测不同效靶比的nk-ac4mann-p13细胞及对照细胞对头颈部鳞状细胞癌fadu细胞的杀伤活性。
具体操作步骤如下:
3.1取对数生长期的fadu细胞,常规消化成浓度至2.67×105个/ml的细胞悬液;
3.2将步骤3.1所得细胞悬液加至实时无标记细胞功能分析仪e-plate8检测板上,每孔加入300μl,置入37℃含5%co2培养箱中静置培养18-24小时;
3.3将100μl的nk-ac4mann-p13细胞及对照组nk细胞悬液以不同的效靶比(e:t=0:1,2.5:1,5:1,10:1)加入e-plate8检测板内;
3.4将上述e-plate8检测板置于实时无标记细胞功能分析仪检测台上实时监测,观察nk-ac4mann-p13细胞及对照组nk细胞对fadu细胞的影响;
3.5图3为体外杀伤头颈部鳞状细胞癌细胞系fadu活性检测图,分析实验结果,在加入nk-ac4mann-p13细胞及对照组nk细胞的时间点,如图3-a中所示,均一化细胞指数值,获得均一化细胞指数(nci),统计加入nk-ac4mann-p13细胞及对照组nk细胞4小时后的nci值,计算不同效靶比nk-ac4mann-p13细胞及对照细胞对fadu细胞杀伤活性,得到在不同效靶比的杀伤百分比如图3-b所示,与nk细胞相比,nk-ac4mann-p13细胞的杀伤活性显著提高。
实施例4nk-ac4mann-p13细胞体内抗肿瘤活性检测
balb/c裸鼠接种fadu细胞构建荷瘤小鼠模型,待肿瘤体积长至50mm3时,通过尾静脉分别回输nk-ac4mann-p13细胞、nk-ac4mann细胞、nk+p13细胞和nk细胞,每周回输两次,每次回输2×107个细胞/ml,观测肿瘤生长情况,其结果如图4所示,图4-a为各组的肿瘤体积变化情况,图4-b中为各组肿瘤照片,可以明显的看出nk-ac4mann-p13细胞组的肿瘤体积最小,说明与其他对照组相比对体内杀伤头颈部鳞状细胞癌细胞系fadu移植瘤活性显著提高。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!