磷酸化肽段富集的方法、检测和定量的方法与流程
本发明涉及分析化学和蛋白质组学领域,具体而言,涉及一种磷酸化肽段富集的方法、检测和定量的方法。
背景技术:
蛋白翻译后修饰是重要的生命活动调控方式,近年来磷酸化修饰是主要的蛋白修饰研究领域。蛋白磷酸化修饰作用广泛,约有1/3的人体蛋白具有磷酸化修饰。磷酸化修饰也参与人体代谢、发育和应对刺激等生理过程。同时,多种代谢疾病和恶性肿瘤中存在磷酸化修饰的调控异常,因此蛋白磷酸化修饰的研究为这些疾病的诊断和治疗提供帮助。
基于二氧化钛的磷酸化肽段富集技术是磷酸化蛋白质组研究中最常用的技术。其具有操作简便,富集效率高的优势,其磷酸化肽段富集比例可达95%。但该方法也存在一些缺陷,比如初始肽段用量大,重复性差等,这限制了该方法分推广应用。
近年来,质谱技术飞速发展。以赛默飞世尔公司为代表的质谱公司推出了具有超高分辨率的质谱仪,并具有多个检测器。这种质谱仪配合高压液相使用,极大提高了基于质谱的蛋白质组学检测效率,使得大规模临床样本蛋白质组数据集构建成为可能。
因此,目前亟需开发微量磷酸化肽段样品富集和定量磷酸化肽段等方法,从而推动临床疾病分型,分子标志物筛选和疾病治疗靶点的发现。
技术实现要素:
本发明旨在提供一种磷酸化肽段富集的方法、检测和定量的方法,以解决现有技术中磷酸化肽段富集初始肽段用量大的技术问题。
为了实现上述目的,根据本发明的一个方面,提供了一种磷酸化肽段富集的方法。该方法包括蛋白质组样本的裂解、酶解和基于二氧化钛的磷酸化肽段富集的步骤,其中,蛋白质组样本的裂解、酶解后得到的溶液中包含磷酸化肽段和非磷酸化肽段,磷酸化肽段和非磷酸化肽段之和为总肽段,在基于二氧化钛的磷酸化肽段富集的步骤中二氧化钛与总肽段的质量比例为10~100:1。
进一步地,在基于二氧化钛的磷酸化肽段富集的步骤中二氧化钛与肽段的比例为20~100:1。
进一步地,蛋白质组样本中磷酸化肽段的含量为10微克~1000微克。
进一步地,基于二氧化钛的磷酸化肽段富集的步骤包括:取二氧化钛,加入富集溶液,涡旋后得到二氧化钛悬浊液;采用富集溶液将酶解后得到的肽段样品溶解,离心去除沉淀,得到肽段溶液;将二氧化钛悬浊液离心去除液体后加入肽段溶液,室温下垂直混匀进行富集,然后离心,上清再次采用二氧化钛进行富集,重复本步骤,得到吸附了磷酸化肽段的二氧化钛;以及对吸附了磷酸化肽段的二氧化钛进行清洗、洗脱、干燥后得到磷酸化肽段;优选的,富集溶液包含体积百分含量为70~80%乙腈,4~6%三氟乙酸,6~10%乳酸溶液以及余量的水;更优选的,富集溶液包含体积百分含量为70%乙腈,5%三氟乙酸,8.3%乳酸溶液以及余量的水;优选的,用含有60%~80%乙腈和4%~6%三氟乙酸的溶液对吸附了磷酸化肽段的二氧化钛进行清洗n次;然后用含有30%~50%乙腈和10%~20%%氨水的溶液洗脱吸附了磷酸化肽段的二氧化钛m次,合并洗脱液并真空干燥,即得磷酸化肽段,其中,n和m分别独立的取值自1~4的自然数。
进一步地,蛋白质组样本的裂解采用的裂解液包含摩尔浓度为10mm三(2-羰基乙基)磷盐酸盐、摩尔浓度为40mm2,2-二氯乙酰胺、质量体积比0.5%~1.5%的脱氧胆酸钠以及缓冲液。
进一步地,缓冲液为tris-hclph=8~10;优选的,ph=8.8;优选的,酶解为采用胰酶进行消化蛋白质组样本裂解后得到的全蛋白裂解液。
进一步地,裂解包括:将蛋白质组样本加入裂解液后加热变性,然后进行超声裂解,得到裂解液;将裂解液离心吸取上清,即得到全蛋白裂解液;优选的,加热变性的温度为95℃,时间为5~10min;优选的,超声裂解的时间为3分钟,其中3秒钟超声,3秒钟间歇,振幅25%,超声裂解之后置于冰上静置裂解15分钟;优选的,酶解包括采用胰酶进行消化全蛋白裂解液,得到肽段样品。
根据本发明的另一方面,提供了一种磷酸化肽段检测和定量的方法,该方法包括采用上述任一种磷酸化肽段富集的方法进行磷酸化肽段富集,然后采用液质联用检测系统对磷酸化肽段进行单组分深度覆盖检测。
进一步地,单组分深度覆盖检测中一级质谱采用高分辨轨道离子阱orbitrap方式进行检测,二级质谱采用普通离子阱iontrap模式扫描。
进一步地,液质联用检测系统中采用15~30cm长的分析柱进行肽段分离。
应用本发明的技术方案,微量样本的应用使得初始肽段需求降至微克级别,扩展了可以检测的样本范围。进一步的,本发明的从生物样本中提取磷酸化肽段并检测定量的方法中应用脱氧胆酸钠裂解液高效裂解组织或者细胞,结合二氧化钛对磷酸化肽段进行富集,最后应用高效液质联用系统进行单组分检测和定量,可以高效快速的在微量样本中富集和定量磷酸化肽段。该方法极大提高了检测效率,可以在数小时内完成样本中磷酸化肽段富集和检测定量过程。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
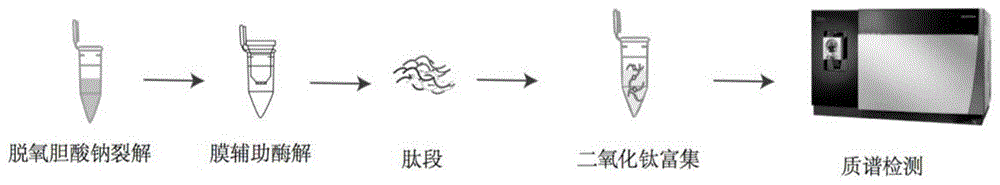
图1示出了本发明一实施方式中磷酸化肽段富集、检测和定量的流程示意图;以及
图2示出了实施例1中富集的293t细胞磷酸化检测的三次实验的重复性评估。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本发明。
针对背景技术中记载的技术问题,本发明的发明人探索了生物样本裂解和酶解的高效方法,改进了二氧化钛对磷酸化肽段的富集参数,优化了单针检测蛋白质组的液质联用系统配置和条件设置,提供一种磷酸化肽段富集、检测和定量的方法。
根据本发明一种典型的实施方式,提供一种磷酸化肽段富集的方法。该方法包括蛋白质组样本的裂解、酶解和基于二氧化钛的磷酸化肽段富集的步骤,其中,蛋白质组样本的裂解、酶解后得到的溶液中包含磷酸化肽段和非磷酸化肽段,磷酸化肽段和非磷酸化肽段之和为总肽段,在基于二氧化钛的磷酸化肽段富集的步骤中二氧化钛与总肽段的质量比例为10~100:1。这样可以降低磷酸化肽段富集初始肽段用量,提高富集率。若初始生物样本中蛋白量很少,可以进一步提高该比例,例如,二氧化钛与肽段的比例为15~100:1,20~100:1,25~100:1,30~100:1,35~100:1,40~100:1,45~100:1,50~100:1,60~100:1,70~100:1,80~100:1或90~100:1。
在本发明中,蛋白质组样本中磷酸化肽段的含量可以低至10微克~1毫克。微量样本的应用使得初始肽段需求降至微克级别,扩展了可以检测的样本范围。
优选的,本发明中基于二氧化钛的磷酸化肽段富集的步骤包括:取二氧化钛,加入富集溶液,涡旋后得到二氧化钛悬浊液;采用富集溶液将酶解后得到的肽段样品溶解,离心去除沉淀,得到肽段溶液;将二氧化钛悬浊液离心去除液体后加入肽段溶液,室温下垂直混匀进行富集,然后离心,上清再次采用二氧化钛进行富集,重复本步骤,得到吸附了磷酸化肽段的二氧化钛;以及对吸附了磷酸化肽段的二氧化钛进行清洗、洗脱、干燥后得到磷酸化肽段。其中,富集溶液包含体积百分含量为70~80%乙腈,4~6%三氟乙酸,6~10%乳酸以及余量的水;优选的,富集溶液包含70%乙腈,5%三氟乙酸,8.3%乳酸溶液以及余量的水。在这种酸性环境中利用二氧化钛对磷酸化修饰的结合作用进行磷酸化肽段富集,可以进一步提高磷酸化肽段富集效率。
优选的,用含有60%~80%乙腈和4%~6%三氟乙酸(优选为80%乙腈和5%三氟乙酸)的溶液对吸附了磷酸化肽段的二氧化钛进行清洗n次;然后用含有30%~50%乙腈和10%~20%%氨水(优选为40%乙腈和18%氨水)的溶液洗脱吸附了磷酸化肽段的二氧化钛m次,合并洗脱液并真空干燥,即得磷酸化肽段,其中,n和m分别独立的取值自1~4的自然数。采用上述溶液进行清洗,采用本发明的洗脱液进行洗脱,可以最大限度的去除非特异性肽段的结合,提高磷酸化肽段的富集效率。
在本发明一种典型的实施方式中,蛋白质组样本的裂解采用的裂解液包含摩尔浓度为10mm三(2-羰基乙基)磷盐酸盐、摩尔浓度为40mm2,2-二氯乙酰胺、质量体积比0.5%~1.5%(g/ml)的脱氧胆酸钠(优选为1%的脱氧胆酸钠)以及缓冲液。其中,通过脱氧胆酸钠来对细胞/组织样本进行裂解和细胞内全蛋白变性,三(2-羰基乙基)磷盐酸盐作为还原剂,2,2-二氯乙酰胺作为烷基化试剂,蛋白质组样本在处理液中数分钟即可完成裂解与还原烷基化。也就是说,在本发明中裂解与还原、烷基化一步完成,这样使得蛋白质组样本处理流程简单,而且节约了时间。当然,本发明的技术方案中也可以使用尿素、碳酸氢铵等其他成分的裂解溶液。
缓冲液能够起到ph调节作用,为了使处理后的蛋白质组样品能够更快更好的进行酶解,优选的,缓冲液为tris-hclph=8~10,更优选ph=8.8,以保证处理后的蛋白质组样品ph>8.0;由于本发明中三(2-羰基乙基)磷盐酸盐不影响胰酶的功能,所以,采用本发明试剂盒处理后的蛋白质组样品能采用胰酶进行溶液内酶解,可以进一步提高蛋白质组样品处理的效率,缩短时间,推进临床应用的推广。
优选的,加热变性的温度为95℃,时间为5min,使蛋白进行充分变性。超声裂解的时间为3分钟,其中3秒钟超声,3秒钟间歇,振幅25%,超声裂解之后置于冰上静置裂解15分钟。
在本发明的整体发明构思下,根据本发明另一典型的实施方式,提供了一种磷酸化肽段检测和定量的方法。该方法包括采用上述磷酸化肽段富集的方法进行磷酸化肽段富集,然后采用液质联用检测系统对磷酸化肽段进行单组分深度覆盖检测。
本发明的从生物样本中提取磷酸化肽段并检测定量的方法中应用脱氧胆酸钠裂解液高效裂解组织或者细胞,结合二氧化钛对磷酸化肽段进行富集,最后应用高效液质联用系统进行单组分检测和定量,可以高效快速的在微量样本中富集和定量磷酸化肽段。该方法极大提高了检测效率,可以在数小时内完成样本中磷酸化肽段富集和检测定量过程。微量样本的应用使得初始肽段需求降至微克级别,扩展了可以检测的样本范围。该方法非常适合于磷酸化蛋白质组学领域的研究,特别是大规模临床样本的检测。
优选的,单组分深度覆盖检测中一级质谱采用高分辨轨道离子阱(orbitrap)方式进行检测,二级质谱采用普通离子阱(iontrap)模式扫描。这样使得一级质谱检测的更准确,二级质谱检测的更快,最终磷酸化肽段检测的更多更准。更优选,液质联用检测系统中采用15~30cm长的分析柱进行肽段分离,检测的重复性好。
在本发明一典型的实施方式或实施例中,磷酸化肽段富集和定量的流程如图1所示,具体操作如下:
1.蛋白质组样本的裂解和酶解:组织和细胞的裂解和酶解。
将组织或者细胞首先用4℃pbs溶液清洗,随后用脱氧胆酸钠裂解液裂解,95℃加热5分钟。冷却后超声,超声破碎仪功率35%,工作-间歇时间为3秒-3秒循环。超声时间5分钟。通过4℃16000g离心10分钟去除沉淀,上清液测定蛋白浓度后取适量体积加入商品化超滤管中(膜辅助酶解),14000g离心10分钟,将溶液中蛋白富集在超滤管膜上。利用50mm碳酸氢铵水溶液清洗超滤管膜,随后加入100μl50mm碳酸氢铵水溶液,并加入胰酶酶解。酶解2小时后,加入200μl水,14000g离心10min,即可得到酶解后肽段溶液。真空干燥后,即可获得酶解后肽段干粉。
2.磷酸化肽段富集
利用二氧化钛富集磷酸化肽段,二氧化钛和蛋白比例为20:1。若蛋白量很少,可以进一步提高该比例。取6mg二氧化钛,加入150μl富集溶液(70%乙腈,5%三氟乙酸,8.3%乳酸以及余量的水),涡旋后均分3管。在步骤1中获得的肽段,用300μl富集溶液溶解,14000g离心10分钟,去除沉淀。测定肽段浓度并取用适量体积。该方法可以将肽段使用量降低至100μg。通过1000g离心1分钟,去除二氧化钛悬浊液中的富集溶液,加入肽段溶液。室温下垂直混匀30分钟。2000g离心2分钟,上清为富集一次后的肽段溶液,将该溶液转移至第二份二氧化钛中继续富集30分钟。重复一次该操作,共富集3次。合并3次富集后的二氧化钛,此时二氧化钛上结合有磷酸化肽段。用含有80%乙腈和5%三氟乙酸的溶液对二氧化钛进行清洗,每次400μl,清洗5次。每次清洗后,2000g离心2分钟,去除清洗溶液。用100μl含有40%乙腈和18%氨水的溶液洗脱二氧化钛上的磷酸化肽段,2000g离心2分钟收集洗脱液。重复4次洗脱过程,合并洗脱液并真空干燥,即可获得富集后的磷酸化肽段。
3.磷酸化肽段检测和定量
将磷酸化肽段使用10%甲酸水溶液溶解,取5μl进行液质联用系统检测。色谱条件:预柱2cm,填料为3μ粒径c18粉末,分析柱30cm,填料为1.9μm粒径c18粉末,流动相a为0.1%甲酸水溶液,流动相b为含有0.1%甲酸的乙腈溶液。b相梯度5%-40%,液相梯度150分钟。流动相流速为600nl/min。质谱条件:正离子扫描模式,电喷雾电压2kv,一级质谱分辨率120000,agc为5e5,最大离子注入时间50ms,全扫描质核比300-1400;二级质谱母离子采用数据依赖模式,hcd碰撞能量设定为35%,agc为5e3,最大离子注入时间35ms,动态排除18s,质谱采集时间150分钟。搜库:以mascot搜索引擎对数据进行检索。蛋白酶选择trypsin,最大漏切2个位点,一级搜索质量偏差不大于20ppm,二级搜索质量偏差不大于0.5da。固定修饰为carbamidomethyl(c),可变修饰为phospho(st)、phospho(y)、acetyl(proteinn-term)与oxidation(m),使用正反库交叉搜索,蛋白水平设定1%错误发现率。
注:对上述步骤中技术特征进一步解释如下:
(1)步骤1中采用脱氧胆酸钠裂解液对细胞或者组织样品进行裂解并提取蛋白,裂解液配置为1%w/v(g/ml)脱氧胆酸钠,40mm2,2-二氯乙酰胺(caa)和10mm磷酸三氯乙酯(tcep)的溶液,tris-hclph=8.8。
(2)步骤1中采用裂解液可以加入磷酸酶抑制剂以保护磷酸化位点不被降解。
(3)步骤1中采用裂解液对细胞或者组织样品进行裂解并提取蛋白,加热时间为5分钟,即可完成裂解和还原烷基化过程。
(4)步骤1中胰酶和蛋白比例为25:1。
(5)步骤1中酶解条件为37℃酶解2h以上。
(6)步骤1种酶解环境为超滤管膜辅助酶解,也可以是裂解液中直接加胰酶进行溶液内酶解。
(7)步骤2中,二氧化钛和蛋白比例为20:1。
(8)步骤2中富集溶液为70%乙腈,5%三氟乙酸,8.3%乳酸以及余量的水。
(9)步骤2中富集过程可以采用垂直混匀,富集过程每次30分钟,重复3次。
(10)步骤2中清洗过程溶液配置为终浓度体积比为80%乙腈和5%三氟乙酸的溶液。
(11)步骤2中清洗过程可以采用垂直混匀方法,每次5分钟,重复5次。
(12)步骤2中洗脱过程洗脱液配置为含有终浓度体积比为40%乙腈和18%氨水的溶液。
(13)步骤2中洗脱过程可以采用垂直混匀的方法,每次5分钟。
(14)步骤3中液质联用系统检测,可以采用双高分辨检测器质谱,也可以采用单高分辨检测器质谱。
(15)步骤3中液质联用系统检测,采用150分钟梯度检测,可以对单组分样品进行深度覆盖,不需要额外进行组分分离,减少操作复杂性。
(16)步骤3中,多种搜库平台均可采用,如proteinomediscovery,maxquant,firmana等。
下面将结合实施例进一步说明本发明的有益效果。
实施例1
对293t细胞来源的肽段进行磷酸化肽段富集和定量,步骤如下:
(1)在含有10%胎牛血清的dmem培养基中培养293t细胞。收集细胞,用4℃pbs溶液清洗,4℃800g离心3分钟收集细胞,取用100μl细胞。
(2)加入裂解液400μl(1%w/v,g/ml,脱氧胆酸钠,40mm2,2-二氯乙酰胺(caa)和10mm磷酸三氯乙酯(tcep)的溶液,tris-hclph=8.8),涡旋混匀,95℃加热5分钟。
(3)冷却后超声5分钟,超声破碎仪功率35%,工作-间歇时间为3秒-3秒循环。
(4)4℃16000g离心10分钟,去除沉淀,上清液置于新的干净ep管中。
(5)利用nanodrop测定蛋白浓度,将含有300μg蛋白的溶液加入10k超滤管中。
(6)14000g离心10分钟,弃去下层溶液。
(7)加入100μl50mm碳酸氢铵水溶液,14000g离心10分钟,弃去下层溶液。并重复一次。
(8)加入100μl50mm碳酸氢铵水溶液,加入12μg胰酶,涡旋后37℃酶解2小时。
(9)加入200μl水,14000g离心10min,得到酶解后肽段溶液。重复一次,合并溶液并真空干燥。
(10)取6mg二氧化钛,加入150μl富集溶液(富集溶液包含体积百分含量为70%乙腈,5%三氟乙酸,8.3%乳酸以及余量的水),涡旋后均分3管,得到二氧化钛悬浊液。
(11)在步骤(9)中获得的肽段,用300μl富集溶液溶解,14000g离心10分钟,去除沉淀。
(12)二氧化钛悬浊液1000g离心1分钟,去除液体,加入(11)中的肽段溶液。室温下垂直混匀30分钟。
(13)2000g离心2分钟,上清转移至第二份二氧化钛中继续富集30分钟。二氧化钛沉淀加入50μl富集溶液保持湿润。
(14)重复步骤(13)进行第3次富集。
(15)合并3次富集后的二氧化钛。
(16)用400μl含有80%乙腈和5%三氟乙酸的溶液对二氧化钛进行清洗,垂直混匀5分钟,2000g离心2分钟,去除清洗溶液。
(17)重复(16)步骤4次。
(18)用100μl含有40%乙腈和18%氨水的溶液洗脱,垂直混匀5分钟后,2000g离心2分钟收集洗脱液。
(19)重复步骤(19)共4次,合并洗脱液并真空干燥,即得磷酸化肽段。
(20)质谱检测:将磷酸化肽段使用10%甲酸水溶液溶解,取5μl进行液质联用系统检测。采用赛默飞世尔fusion质谱和nlc1000液相系统,30cm分析柱,150分钟检测梯度。
(21)搜库:基于proteomediscovery平台搜库,以mascot搜索引擎对数据进行检索。固定修饰为carbamidomethyl(c),可变修饰为phospho(st)、phospho(y)、acetyl(proteinn-term)与oxidation(m),蛋白水平1%错误发现率。
(22)将本实施例得到的富集产物和293t细胞酶解肽段样本进行质谱检测,鉴定结果如下表1。
表1
图2为采用本实施例方法富集的293t细胞磷酸化肽段检测的三次实验的重复性评估,在三次生物重复实验中,磷酸化肽段的定量结果的相关性均在0.87以上,说明本发明的方法可以高效的从微量样本中富集并定量磷酸化肽段,并具有良好的可重复性。
实施例2
与实施例1的实验材料及步骤相同,不同之处如下:
总肽段与二氧化钛的质量不同,对应的结果如下表2所示:
表2
在本申请中,理论上应用更高比例的二氧化钛对目标样本进行磷酸化富集,能够更好的提高磷酸化肽段的富集效果,但主要是针对更微量的样本,比如微克级别;考虑到成本和后续的操作二氧化钛的去除,本发明的方法主要应用于微量的样本。
实施例3
临床微量样本的磷酸化蛋白的检测
对于临床的尿液以及石蜡切片的样本,蛋白提取量在10微克以内的样本,也可以通过本专利的磷酸化肽段的富集方法进行富集。质谱鉴定结果如下表3:
表3
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:
1)高效:采用以脱氧胆酸钠为主的裂解液,裂解和还原烷基化过程合并为5分钟;采用单组分单针深度覆盖的检测方法,2~4个小时即可完成从样品制备的过程;
2)所需样品量少:本方法可以对微量样品中磷酸化肽段进行富集,初始肽段用量可低至μg级别,极大扩展了可以检测的样本范围,提高检测通量;
3)可扩展性强:该方法各种步骤可以自由组合以满足不同需求,同时该方法可以扩展至柱装填料和管装填料形式的磷酸化肽段富集工具,进一步提高磷酸化肽段富集的简便性和高效性;
4)高通量:该方法可以满足高通量样本需求,普通离心机可同时进行24个样本的富集实验,利用工业机械臂,该方法可以应用于更多样本的同时富集。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!