一种基于Tubespin生物反应器的缩小模型的细胞灌流培养方法与流程
本发明涉及生物工程的细胞工程技术领域,尤其是涉及一种基于tubespin生物反应器的缩小模型的细胞灌流培养方法。
背景技术:
动物细胞培养是一种始于20世纪初,目前被生物和医学等领域广泛采用的方法。常用的动物细胞培养分为批次培养、补料批次培养、灌流培养等。其中灌流培养能使培养过程中的培养基不断被更新,及时满足细胞对营养的需求,同时能移除乳酸、铵离子等有害代谢产物。因此,该种方法有效地提高了动物细胞密度和活率,延长了细胞的培养时间,使蛋白的产量得到大幅提升。灌流培养的显著优势在于蛋白可以随时随着培养基的排出而被及时分离,蛋白在反应器中停留的时间短,受到培养体系中各类水解酶的降解作用较少,有利于蛋白质量的提高,所以该方法早期被用来生产化学性质不稳定的蛋白,如酶、凝血因子等。近年来,灌流培养的高产量、高质量以及生产设备小型化等优势越来越引起工业界和学术界的青睐,同时,fda也对其发展做出了鼓舞性的引导。
在细胞灌流培养技术极具发展潜力的同时,该方法对灌流操作、设备要求和培养工艺也提出了更高的要求。一般来说,设计和优化一个灌流工艺需要对多种条件进行优化,只有在较小的规模下才可以完成高通量的筛选。为此,一个能够模拟大规模灌流培养反应器细胞截留,培养基连续交换,多余细胞移除合适的缩小模型迫在眉睫。目前商业化的灌流缩小模型是基于amber15tm的自动化微型反应器,它可以实现最大2rv/day的培养基交换体积和95%以上的细胞分离效率,与大规模灌流反应器相比,工艺具有可比性,但是其存在着成本较高,平行性不够等问题。因此,开发经济可行,能够模拟大规模灌流反应器的缩小模型具有重要意义。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种基于tubespin生物反应器的缩小模型的细胞灌流培养方法,该方法采用基于tubespin生物反应器的灌流培养缩小模型的培养方法,可以模拟灌流培养反应器的高密度培养,营养物质消耗情况,培养基交换速率评价和蛋白产量预估,能够降低工艺开发成本,提高工艺优化效率。
为了实现本发明的上述目的,特采用以下技术方案:
一种基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
将细胞接种于tubespin生物反应器中,细胞装液体积占tubespin生物反应器体积的20-30%,tubespin生物反应器倾斜角度为60°-90°,摇晃条件下,灌流培养。
具体的,tubespin生物反应器置于二氧化碳摇床中,倾斜角度为60°-90°,悬浮培养。
本发明的细胞灌流培养方法,对tubespin生物反应器培养参数进行调控,增强其通气量,减少剪切,为高密度培养提供有利条件;同时能够模拟连续灌流培养过程,每天除去多余细胞,离心换液,监测细胞生长和产量,使培养过程进入多个稳态。
tubespin生物反应器是一种以50ml离心管为原型开发的具有生物反应器特性的一次性缩小反应装置。在一定转速范围内,其具有突出的氧传递效率、低剪切力和良好的气液交换界面等。体积溶氧系数kla对于评价微生物或动物细胞大规模培养生物反应器的氧传递具有重要意义。优化的培养条件的kla数值理论上可以满足10×107cells/ml以上的高密度细胞培养。
优选的,tubespin生物反应器于摇床中进行摇晃。更优选的,摇床的参数包括:旋转半径为40-50mm,转速为150-200rpm。进一步优选的,湿度为80%,5%co2。在本发明一些具体实施方式中,摇床可以为infors二氧化碳摇床,可将tubespin生物反应器置于二氧化碳摇床中的tubespin管架上。
优选的,细胞装液体积为10-15ml。更优选的,细胞装液体积为10-14ml。进一步优选为10ml。
优选的,tubespin生物反应器倾斜角度为60°-75°。更优选的,tubespin生物反应器倾斜角度为75°。
优选的,灌流培养的方法包括:接种3天后,每天进行如下操作:tubespin生物反应器以800-1000rpm转速离心5-7min,移除上清,用补料培养基重悬细胞,摇晃条件下培养。更优选的,灌流培养的时间可以为26-30天。进一步优选的,灌流速率为1rv/day。
优选的,所述细胞由以下各者所构成的群组中选出:
cho、dxb-11、dg-44、cho/-dhfr、cho-s等细胞系。
优选的,缩小模型的细胞灌流培养方法中,稳定表达的单克隆抗体的cho最高细胞密度为(100-120)×106/ml。
优选的,灌流培养的基础培养基为actipro,补料培养基包括cellboost7a和cellboost7b。
在本发明一些具体实施方式中,补料培养基中,cellboost7a和cellboost7b的体积比为10﹕1。在本发明的具体实施方式中,补料培养基可以为在actipro培养基中加入5%体积分数的cellboost7a和0.5%体积分数的cellboost7b。
优选的,所述细胞的接种密度为(0.1-1)×106cells/ml,优选为(0.3-0.7)×106cells/ml,更优选为0.5×106cells/ml。
优选的,经灌流培养后,进入稳态维持的细胞密度为(60-80)×106cells/ml。
优选的,在灌流培养过程中,通过降温的方式调控细胞密度。更优选的,降温的方式包括:当细胞密度达到峰值后,培养温度从37℃降温至33℃,以维持细胞密度。在本发明一些具体实施方式中,峰值为(60-80)×106cells/ml。
与现有技术相比,本发明的有益效果为:
(1)对灌流培养哺乳动物细胞的缩小模型进行参数优化,在tubespin生物反应器中实现最高细胞密度(100-120)×106/ml,利用该模型筛选出来的灌流工艺培养周期在26天,培养周期内细胞进入多个稳态,稳定期细胞密度控制在(45-60)×106/ml,细胞活率维持在90%以上,每天igg浓度为1.5-2.0g/l,tubespin生物反应器之间的平行性较好;
(2)通过本发明的缩小模型得到的工艺参数,在灌流培养3l反应器上得到了较好的重复,在反应器中,细胞密度最高为60×106cells/ml,每天细胞密度与tubespin生物反应器的偏差在0%-15%,在第19天前细胞活率与tubespin生物反应器相差不大;反应器中igg在快速增长阶段,与tubespin生物反应器中的浓度几乎一致;在稳定期内,两者的偏差仅在10%以内;
(3)本发明的缩小模型灌流培养方法成本低,易于操作,过程简单,并且能较好地预测生物反应器灌流培养生长和产量情况,为实现高密度、高产量的细胞培养优化工艺提供了广阔的应用前景。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例的培养方法中tubespin生物反应器中细胞装液体积对细胞密度和细胞活率的影响;
图2为本发明实施例的培养方法中tubespin生物反应器中细胞装液体积对igg产量的影响;
图3为本发明实施例的培养方法中tubespin生物反应器倾斜角度和抗剪切剂对细胞密度和细胞活率的影响;
图4为本发明实施例的培养方法中tubespin生物反应器倾斜角度和抗剪切剂对乳酸脱氢酶释放的影响;
图5为本发明实施例的培养方法中tubespin生物反应器倾斜角度和抗剪切剂对igg产量的影响;
图6为采用本发明实施例的缩小模型的培养工艺与3l反应器细胞密度和细胞活率的对比图;
图7为采用本发明实施例的缩小模型的培养工艺与3l反应器产量的对比图。
具体实施方式
下面将结合附图和具体实施方式对本发明的技术方案进行清楚、完整地描述,但是本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明的实施例中采用的部分实验材料信息如下:
actipro培养基:ge公司;
cellboost7a:ge公司;
cellboost7b:ge公司;
谷氨酰胺:默克公司;
泊洛沙姆:默克公司;
tubespin生物反应器:
3l反应器:finesse公司;
反应器控制器:finesse公司;
二氧化碳摇床培养箱:infors公司;
tubespin生物反应器摇床架:infors公司。
实施例1
本实施例的基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径25mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为10ml,调整tubespin生物反应器角度至90°(tubespin生物反应器垂直于摇床水平面),不加入抗剪切剂;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用添加5%cellboost7a和0.5%cellboost7b补料的actipro培养基重悬细胞,补充至10ml的工作体积;然后将tubespin生物反应器放置于摇床中于37℃培养;24h后,重复以上操作,此后直至第12天结束培养。
实施例2
本实施例的基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径25mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为15ml,调整tubespin生物反应器管架角度至90°(tubespin生物反应器垂直于摇床水平面),不加入抗剪切剂;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用加5%cellboost7a和0.5%cellboost7b补料的actipro培养基重悬细胞,补充至15ml的工作体积;然后将tubespin生物反应器放置摇床中37℃培养;24h后,重复以上操作,此后直至第10天结束培养。
实施例3
本实施例的基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径25mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为10ml,调整tubespin生物反应器角度至60°(tubespin生物反应器与摇床水平面之间成60°),不加入抗剪切剂;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用补料培养基cellboost7a和cellboost7b重悬细胞,补充至10ml的工作体积;然后将tubespin生物反应器放置摇床中37℃培养;24h后,重复以上操作,此后直至第10天结束培养。
实施例4
本实施例的基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径25mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为10ml,调整tubespin生物反应器角度至75°(tubespin生物反应器与摇床水平面之间成75°),不加入抗剪切剂;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用补料培养基cellboost7a和cellboost7b重悬细胞,补充至10ml的工作体积;然后将tubespin生物反应器放置摇床中37℃培养;24h后,重复以上操作,此后直至第10天结束培养。
实施例5
本实施例的基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径25mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为10ml,调整tubespin生物反应器角度至90°(tubespin生物反应器垂直于摇床水平面),加入4g/l的p188抗剪切剂;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用补料培养基cellboost7a和cellboost7b重悬细胞,补充至10ml的工作体积;然后将tubespin生物反应器放置摇床中37℃培养;24h后,重复以上操作,此后直至第10天结束培养。
实施例6
本实施例的基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径25mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为10ml,调整tubespin生物反应器角度至75°(tubespin生物反应器与摇床水平面之间成75°),加入4g/l的p188抗剪切剂;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用补料培养基cellboost7a和cellboost7b重悬细胞,补充至10ml的工作体积;然后将tubespin生物反应器放置摇床中37℃培养;24h后,重复以上操作,此后直至第10天结束培养。
实施例7
本实施例的基于tubespin生物反应器的缩小模型的细胞灌流培养方法,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径50mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为10ml,调整tubespin生物反应器角度至60°(tubespin生物反应器与摇床水平面之间成60°),加入4g/l的p188抗剪切剂;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用补料培养基cellboost7a和cellboost7b重悬细胞,补充至10ml的工作体积;然后将tubespin生物反应器放置摇床中37℃培养;24h后,重复以上操作,此后直至第10天结束培养。
实施例8
采用前述实施例得到的优化的缩小模型参数进行灌流培养工艺优化,包括如下步骤:
(1)种子细胞的扩增:稳定表达单克隆抗体mab的cho细胞复苏后在含有4mmgln的actipro中扩增,每三天传一次,培养扩增用125-250ml的锥形摇瓶置于37℃,旋转半径25mm,转速110rpm,湿度80%,5%co2的infors摇床中进行,待细胞生长到(3.0-4.0)×106cells/ml进行下一步接种;
(2)将步骤(1)中得到的细胞按照0.5×106cells/ml接种到50ml的tubespin生物反应器中,细胞装液体积为10ml,调整tubespin生物反应器角度至75°;tubespin生物反应器培养在37℃,旋转半径50mm,转速190rpm,湿度80%,5%co2的infors摇床中进行,接种培养3d;
(3)接种培养3d后,取样测细胞密度、细胞活率、生化参数和igg含量;然后将tubespin生物反应器以800-1000rpm转速常温离心5-7min,移除上清,根据1rv/day的灌流速率用补料培养基cellboost7a和cellboost7b重悬细胞,补充至10ml的工作体积;然后将tubespin生物反应器放置摇床中37℃培养(当细胞密度达到(60-70)×106cells/ml时降温至33℃);24h后,重复以上操作,此后直至第26天结束培养。
实施例9
采用前述实施例8得到的优化的缩小模型灌流培养工艺,利用3l反应器灌流培养进行放大验证,包括如下步骤:
(1)3lfinesse生物反应器,工作体积2.0l,罐体与repligen中空纤维柱(孔径0.65μm,表面积0.1076m2)用硅胶管相连,采用切向流(tangentialflowfiltration,tff)灌流培养;
(2)接种细胞
接种前将反应器在125℃条件下高压灭菌40min,打入新鲜培养基,将温度、搅拌速度、ph、溶氧等参数按照要求设置好,将中空纤维柱与反应器相连,tff系统开启运转过夜,观察无异常时再接种细胞。接种密度为0.5×106cells/ml;
(3)各种参数的设定与监控
反应器培养温度为37→33℃,ph为6.6-7.2,溶氧为40-50%,搅拌转速190-260rpm,气体(氧气,空气,二氧化碳)由生物反应器自动化控制;
(4)连续灌流培养
第0天按照0.5×106cells/ml接种细胞后,每天取样检测细胞密度、细胞活率、ph、pco2、po2、葡萄糖、乳酸、谷氨酸、谷氨酰胺、铵离子,渗透压和igg的变化,根据测定的参数变化调整培养基配比、灌流速率、搅拌速度、温度等参数。
第三天时,开始灌流培养基,流速为1rv/day,连续灌流培养。
实验例1
为了对比说明本发明各实施例的培养工艺参数对培养效果的影响,对不同培养条件下的细胞密度、成活率、igg产量、乳酸脱氢酶释放等进行测试比较。
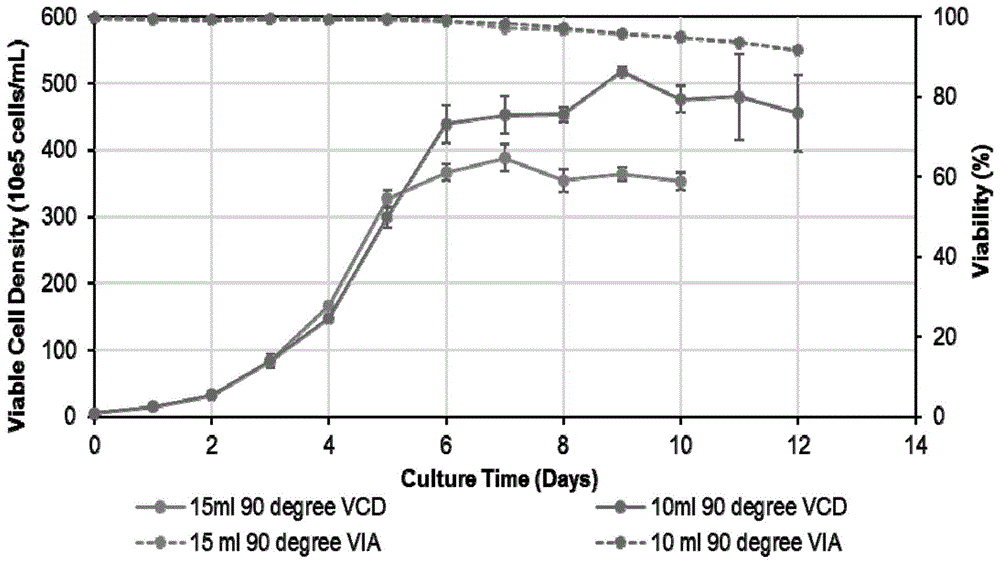
如图1和2所示,其分别是本发明实施例1和2的培养方法中,tubespin生物反应器中细胞装液体积对细胞密度和活率以及igg产量的影响(其中图1的图示中的10ml90degreevcd和15ml90degreevcd分别代表实施例1和实施例2中的细胞密度,10ml90degreevia和15ml90degreevia分别代表实施例1和实施例2中的活率;图2的图示中,10ml,90degree和15ml,90degree分别代表实施例1和实施例2中的igg产量)。从图1和图2中可知,在细胞装液体积为10ml时,细胞密度较高,且活率较高。在细胞装液体积为10ml时,达到细胞密度的峰值为(45-50)×106cells/ml,igg浓度为0.32-0.37g/l/day,均优于培养体积为15ml的条件组。
如图3-5所示,其分别是本发明实施例1-8的培养方法中,tubespin生物反应器倾斜角度和抗剪切剂对细胞密度和活率以及乳酸脱氢酶释放的影响。图3-5中图示所涉及的90degree-control、60degree-control、75degreewith4g/lp188、75degree-control、90degreewith4g/lp188、60degreewith4g/lp188和90degreein1ststexperiment分别代表实施例1、实施例3、实施例6、实施例4、实施例5、实施例7以及重复实施例1(将实施例1重复一次)。从图3-5中可知,tubespin生物反应器倾斜75°和60°的条件组细胞密度峰值为(100-120)×106cells/ml,igg产量在0.6-0.7g/l/day,比90°培养的细胞密度和igg产量分别高60-80%和17-50%。乳酸脱氢酶的释放可以表征细胞的损伤程度,如图4所示,tubespin生物反应器倾斜后可以通过增加通气面积来增强体积氧传质系数,但是会增大剪切力,加快对细胞的损伤,本实验中p188的加入未减轻对倾斜角度对细胞的损伤。
根据上述条件,优选的基于tubespin生物反应器的缩小模型的灌流培养参数为:培养体积10ml,倾斜角度75°,摇床旋转半径50mm,转速190rpm。
如图6-7分别是采用本发明实施例的缩小模型的培养工艺与3l反应器细胞密度和细胞活率以及产量的对比图,其中3l反应器、tubespin、tubespin重复分别代表实施例9培养26天、实施例8培养26天,重复实施例8培养26天(将实施例8重复一次)。从图中可知,在tubespin生物反应器中,细胞密度最高为(65-75)×106cells/ml,培养周期为26天,细胞活率一直维持在90%以上,细胞进入多个稳态,每天igg浓度为1.5-2.0g/l,tubespin生物反应器之间的平行性较好。在反应器中,细胞密度最高为60×106cells/ml,每天细胞密度与tubespin生物反应器的偏差在0%-15%,在第19天前细胞活率与tubespin生物反应器相差不大。在反应器中,前14天igg每天产量快速增加,第14天时igg浓度为1.8g/l,之后逐渐进入稳定期,在15-21天,igg浓度在1.8-2.0g/l,之后进入培养后期,igg浓度下降至1.0g/l结束培养。与tubespin生物反应器igg相比,在igg快速增长阶段,培养的前15天,反应器中igg的浓度几乎一致;在稳定期内,两者的偏差仅在10%以内。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!